第六章 还原反应.
第六章还原反应及其工艺

C
C6 H5 CO 2C 2H 5
+ H2NCNH2
Zn/HCl
C 2H 5
选择性还原C=O成亚甲基,而不影响其它羰基。 选择性还原C=O成亚甲基,而不影响其它羰基。 C=O成亚甲基
搅拌的影响: 搅拌的影响:
铁粉比较重,需要良好的搅拌,否则容易沉到反应器底部。 铁粉比较重,需要良好的搅拌,否则容易沉到反应器底部。 衬有耐酸砖的平底钢槽和铸铁慢速耙式搅拌器。 衬有耐酸砖的平底钢槽和铸铁慢速耙式搅拌器。 耙式搅拌器 新式反应器:衬耐酸砖的球底钢槽和不锈钢快速螺旋桨式搅拌器。 新式反应器:衬耐酸砖的球底钢槽和不锈钢快速螺旋桨式搅拌器。 螺旋桨式搅拌器
铁粉的影响: 铁粉的影响:
洁净、粒细和质软的灰铸铁屑,优于组成比较纯净的钢屑。 洁净、粒细和质软的灰铸铁屑,优于组成比较纯净的钢屑。 通常使用60-100目铁粉。太粗的铁粉表面积小,反应慢; 通常使用60-100目铁粉。太粗的铁粉表面积小,反应慢;太细的 60 目铁粉 铁粉,后处理困难。 铁粉,后处理困难。 用量:每摩尔硝基物理论上需要2.25摩尔铁屑,实际为3 摩尔。 用量:每摩尔硝基物理论上需要2.25摩尔铁屑,实际为3-4摩尔。 2.25摩尔铁屑 思考:1mole间二硝基苯还原为间二氨基苯理论上需要多少摩尔 思考:1mole间二硝基苯还原为间二氨基苯理论上需要多少摩尔 铁屑? 铁屑?
2、锌粉还原
锌粉的还原能力
还原能力比铁粉强。 还原能力比铁粉强。 还原性与反应介质有关:可在碱性、酸性条件下进行。 还原性与反应介质有关:可在碱性、酸性条件下进行。 碱性 条件下进行 可用于还原硝基、亚硝基、氰基、羰基等多种官能团。 可用于还原硝基、亚硝基、氰基、羰基等多种官能团。 缺点:价格比铁粉贵得多。 缺点:价格比铁粉贵得多。
无机化学第六章-氧化还原与电化学

Zn - 2e → Zn2+ Cu2+ + 2e → Cu
3)电池反应: 两半电池反应之和。 Zn + Cu2+ → Zn2+ + Cu
4) 原电池的符号表示:
(-)Zn︱Zn2+(aq)‖Cu2+(aq)︱Cu(+)
• 负极在左,正极在右。用符号(-)(+)表示。 • “︱”表示两相之间的界面。 • “‖”表示盐桥。 • 溶液的浓度、气体的压力也应标明。
C 4HNO 3 4NO 2 CO 2 2H2O
二、离子-电子法
MnO4 SO32 Mn 2 SO42
2 MnO4 8H 5e Mn2 4H2O(还原) 5 SO32 H2O 2e SO42 2H (氧化)
2MnO4 5SO32 6H 2Mn2 5SO42 3H 2O
Zn+CuSO4
ZnSO4+Cu
Zn
CuSO4
Cu-Zn原电池装置
原电池:将氧化还原反应的化学能转变 成为电能的装置。
2. 原电池的组成与表示方法
1)半电池(电极): 组成原电池的每个部分叫半电池。
Zn-ZnSO4 锌电极 失电子-负极
Cu-CuSO4 铜电极 得电子+正极
2)半电池反应:半电池中发生的反应。
2KMnO 4 5K 2SO3 3H 2SO 4 2MnSO 4 6K 2SO 4 3H 2O
配平下列反应:
K2Cr2O7+KI+H2SO4 K2SO4+Cr2(SO4)3+I2+H2O
Cl2+NaOH NaCl+NaClO3+H2O
6.2 原电池与电极电势 原电池的组成与表示方法
第六章 还原反应

硼烷可以选择性的把酰胺还原成相应的氨基,通常以四氢呋 喃为溶剂。
O2N O B H /THF C-N(CH3)2 2 6 O2N CH2-N(CH3)2
此外,乙硼烷可以选择性的把肟还原成相应的氨基。
B2H6,(CH3OCH2CH2 )2O 105 C~110 C
o o
O2N
C=NOH
O2N
CH2NH2
C H COCH3
Hg-Zn HCl Hg-Zn HCl
H3CH2 CH2CH2C
α,β-不 饱 和 醛 酮 同 时 被 还 原
PhHC
C H
CH2CH3
※ 可还原双键,包括非羰基双键;炔键还原为烯键
2、碱性条件下还原,锌可以把羰基还原成羟基。如:马尼地 平中间体的合成
Ph O Ph
Zn/NaOH C2H5 OH,70o C~74oC,2h
CH3
LiAlH4
CH3 CH 2NH 2
CH=NAlH2
H+
氢化锂铝可以使化合物活泼位置的卤素发生氢解,特别是苄 基位和烯丙位的卤原子更容易氢解。
CF3 NH2
LiAlH4 Et2O
CH3 NH2
(二) 氢化硼钠 氢化硼钠(NaBH4)的还原能力比LiAlH4弱,但是选择性较好。 使用条件水醇中进行,与LiAlH4正相反。
PhCH2CH2COOH
第二节
催化氢化反应
一、非均相催化氢化 催化反应发生在催化剂表面的反应。 (一)机理还没有完全研究清楚,通常认为氢吸附在金属的表 面,烯烃也通过p-轨道与金属络合,然后烯烃与氢加成。 (二)影响催化剂的反应因素 1、比表面积:一般催比表面积在数十到数百平方米每克。 2、载体:某些纯金属的催化剂往往吸附在活性炭、硅胶上。 3、助催化剂:反应中加入少量提高催化剂活性的物质。 4、毒剂和抑制剂:能是催化剂活性大大降低或完全丧失,并 难易恢复原有的活性。
第六章氧化-还原反应电化学

第六章 氧化─还原反应和电化学Chapter 6 Oxidation-Reduction Reactions & Electrochemistry本章研究另一类化学反应──氧化─ 还原反应(有电子转移的反应)§1 氧化─ 还原反应(Oxidation —Reduction Reactions )一、氧化数(Oxidation Number )1.氧化数是一个经验值,是一个人为的概念。
2.引入此概念,有以下几方面的应用:(1) 判断是否发生氧化──还原反应:氧化数升高、氧化反应、还原剂 reducing agent (reductant),氧化数降低、还原反应、氧化剂 oxidizing agent (oxidant). (2) 计算氧化──还原当量 (3) 配平氧化──还原反应方程式(4) 分类化合物,如Fe ( Ⅲ )、Fe (Ⅱ);Cu (Ⅰ)、Cu (Ⅱ)。
引入氧化数,可以在不用详细研究化合物的结构和反应机理的情况下,实现上述四点。
3.怎样确定氧化数(1) 在离子化合物中,元素的氧化数等于离子的正、负电荷数。
(2) 在共价化合物中,元素的氧化数为两个原子之间共用电子对的偏移数。
a .在非极性键共价分子(单质)中,元素的氧化数为零,如P 4、S 8、Cl 2中P 、S 、Cl 的氧化数都为零;b .在极性键共价分子中,元素的氧化数等于原子间共用电子对的偏移数,例如:11H :F +-,1111(-2)H :O :H +--+,1100111H :O :O :H +--+-,11+11(0)H :O :F +--。
(3) 具体规定:a .单质的氧化数为零,例如P 4、S 8中P 、S 的氧化数都为零,因为P -P 和S -S键中共用电子对没有偏移;b .除了在NaH 、CaH 2、NaBH 4、LiAlH 4中氢的氧化数为-1以外,氢的氧化数为+1;c .所有氟化物中,氟的氧化数为-1;d .氧的氧化数一般为-2,但有许多例外,例如2O (1/2)--、22O (1)--、3O (1/3)--、21/2O ()++、2OF 2)(+等;目前元素的最高氧化数达到+8,在OsO 4、RuO 4中,Os 和Ru 的氧化数均为+8,其它元素的最高氧化数至多达到其主、副族数。
第六章-还原反应

硝基 R-NO2 伯胺 R-NH2
炔 R- C
C- R'
烯 R-HC
CH-R'
醛 R-CHO
伯醇 R-CH2OH
烯 RCH=CHR 烷 RCH2CH2R
酮 RCOR
仲醇 RCH(OH)R
5
还原基团
X =O, N X =Br,Cl
腈 RC N 含氮芳杂环
N
还原产物
CH3 CH3
2017年7月14日星期五 条件选择及活性比较
7
4. 催化转移氢化反应
催化转移氢化反应属于非均相催化氢化。特点是在金属催化剂存在下,用有
机化合物作为供氢体以代替气态氢作为反应氢源。
COOH
+
Pd/C, 甲苯 回流
COOH
+
常用的供氢体:不饱和脂环烃、不饱和帖及醇类 常用的催化剂:钯-碳
该反应特点:设备与操作简单、反应条件温和、基团还原选择性好
(5) 后处理方便,反应完毕,滤除催化剂蒸出溶剂即可,且干净无污染
(1). 常用催化剂
镍催化剂:Raney 镍、载体镍、还原镍、硼化镍
Raney 镍:为最常用氢化催化剂。具有多孔海绵状结构的金属镍微粒, 又称活性镍。它的制备是由铝镍合金粉末与氢氧化钠溶液反应。 钯和铂催化剂:载体钯和载体铂,用活性碳为载体的称为钯碳(Pd-C)和铂碳 (Pt-C); 用硫酸钡为载体,称为Lindlar催化剂;二氧化铂称为Adams催化剂
按机理分为
电子转移还原反应(Na, K, Li, ...)
1
生物还原反应:使用微生物发孝或活性酶进行底物特定结构底还原反应.
按还原方法分为
微生物发酵(jiao)法 酶催化法
2)按还原反应相的分为:
第六章 氧化还原

4、根据氧化剂和还原剂得失电子数相等的原则, 找出最小公倍数,合并成一个配平的离子方程式。
①×2 ② ×5 2MnO4-+16H++10e10Cl- - 10e5Cl2 2Mn2++ 5Cl2 + 8H2O
14
2Mn2++8H2O
两式相加 2MnO4-+16H++10Cl-
5、将配平的离子方程式写为分子方程式。注意反 应前后氧化值没有变化的离子的配平。
21
常用电极类型: 常用的电极(半电池),通常有四种类型: 1. 金属-金属离子电极:将金属插入到其盐溶液中构 成的电极。如:银电极( Ag+ / Ag ) 。 电极组成式:Ag|Ag+ (c) 电极反应: Ag++eAg
2. 金属-难溶盐-阴离子电极: 将金属表面涂有其金属 难溶盐的固体,浸入与该盐具有相同阴离子的溶液 中所构成的电极。 如: Ag-AgCl电极。 电极组成式:Ag | AgCl(s) | Cl- (c) 电极反应: AgCl + eAg + Cl22
8
又如: Zn + 2HCl
ZnCl2 + H2
锌失去电子,氧化值升高,被氧化,称为还原
剂(reducing agent),又称电子的供体(electron donor)。 HCl中的H+得到电子,氧化值降低,被还原, HCl称为氧化剂(oxidizing agent),又称电子的受体 (electron acceptor)。 氧化还原反应的本质是反应过程中有电子转移 (电子的得失或电子云的偏移),从而导致元素的 氧化值发生变化。
式中:n=5,氧化态为MnO4-和8H+,还原态为Mn2+ (H2O是溶剂,不包括在内)。
第六章 还原反应及其工艺

• 锌粉表面易被空气氧化而降低活性,应选用新制 的锌粉。
2019/9/12
26
6.3.1 芳磺酰氯还原成芳亚磺酸 6.3.2 芳磺酸氯还原成硫酚 6.3.3 碳硫双键还原脱硫成亚甲基 6.3.4 羰基还原成羟基 6.3.5羰基还原成亚甲基 6.3.6 硝基化合物还原成氧化偶氮、偶氮和氢
• 只有个别实例,也可用锌粉还原法或氢气还原法。 6.2.2.6 还原脱溴 • 例如 3,6-二溴 -2- 甲氧基萘还原脱溴制 6- 溴 -2- 甲
氧基萘(水-乙酸介质)。 • 只有少数实例 ,主要用催化氢化法。
2019/9/12
24
6.2.3 铁粉还原的主要影晌因素
• (1) 铁粉的质量:一般用干净质软的灰色铸铁。
R2C-OH R2C-OH
2019/9/12
15
2019/9/12
16
Clemmensen还原(酸性条件下反应)
O Zn-Hg/Zn
C
HCl
CH2
Zn-Hg 活性>Zn HgCl2+HCl+Zn
Zn-Hg
H3COCHC PhC C
C H COCH3
Hg-Zn H3CH2CH2CH2C HCl
Hg-Zn HCl
第六章 还原反应及其 工艺
Reduction and Technique
主要内容
• 还原反应的定义、方法、分类 • 不同官能团还原难易比较 • 活泼金属及其合金( Fe、Zn、Na、Zn-Hg )
反应机理、应用及主要影晌因素
• 硫化碱还原反应机理、应用 • 亚硫酸盐还原反应机理、应用 • 金属复氢化合物还原反应机理、应用 • 醇铝还原剂反应机理、应用 • 催化氢化
第六章 还原反应

CH3
6.3
金属还原剂
3 .以锂(钠)金属将苯还原成双烯类( diene ),称为 Brich 还原反应。此反应需在含质子溶剂中进行。
OCH3 Li,NH3 t BuOH OCH3 H3+O O
6. 2 金属氢化物还原
3. 硼烷(BH3)
硼烷(borane)是由硼氢化钠与三氟化硼制备,以
二硼烷 B2H6(diborane)的形式存在。
3 NaBH4 + 4 BF3
H B H H H B H H
2 B2H6 + 3 NaBF4
硼烷和二硼烷具有 Lewis Acid 的 特性,因此反应性与 NaBH4 或 LiAlH4 不同。 它容易与羧酸及烯烃反应,却 不与酰卤,卤代烷,砜或硝基化合物 等作用。
O H2,(Ph3P)3RhCl PhH, 25 ¡ æ ,1 atm O
6.1 催化氢化(加氢反应)
一般官能团化合物的加氢反应
反应性 最高 反应物 RCOCl RCH2NO2 RC≡CR′ RCHO RCH=CHR′ RCOR′ ArCH2X RC≡N RCO2R′ RCONHR′ 氢化产物 RCHO RCH2NH2 RCH=CHR′(Z,Cis) RCH2OH RCH2CH2R′ RCH(OH)R′ ArCH3 RCH2NH2 RCH2OH + R′OH RCH2NHR
6. 2 金属氢化物还原
1. 氢化锂铝
一般官能团化合物与氢化锂铝 LiAlH4 作用 反应性 最高 C=O COOR 递 减 CN CONR2 C-NO2 CHBr 最低 CH2OSO2Ar 反应物 CHOH CH2OH CH2NH2 CH2NR2 CNH2 CH2 CH3 氢化产物
无机及分析化学第三版第章

Zn-2e→Zn2+ Cu 2++2e →Cu
Zn+ Cu 2+ →Cu +Zn2+
化学能转化为热能
实验二: Zn-Cu原电池反应
装置
Zn
e-
A
KCl
Zn SO4
现象
1、电流表指针发生偏移 2、Zn棒逐渐溶解,铜棒上有铜沉积 3、取出盐桥,指针回零;放入盐桥,指针偏转 Cu
原理
CuSO4 Zn - 2e →Zn2+ Cu 2++2e →Cu
RT [氧化态]a nFln[还原态]b
298.15K 下:
注意!
0.0n59lg[[氧 还化 原态 态]]ab
1) 如果电对中的某一物质是固体或液体,则它们的 浓度均为常数,常认为是1。
2) 如果电对中的某一物质是气体,其浓度用分压来 表示,分压的单位为:大气压(atm)
例如
碳的氧化数 CO CO2 CH4 C2H5OH +2 +4 -4 -2
硫或铁的氧化数 S2O32- S2O82- Fe3O4 +2 +7 +8/3
example
试计算Cr2O72-中Cr的氧化值和Fe3O4中Fe的氧化值
解: 设Cr的氧化值为x,已知O的氧化值为-2 ,则:
2x + 7×(-2) = -2 x = +6
3. 两个半反应相加,消去电子
2 × ( M n 0 4 - + 8 H + + 5 e = M n 2 + + 4 H 2 O )
+
5 × ( 2 C l- = C l2 + 2 e )
第六章 还原反应

影响催化氢化反应的主要因素
• 催化剂 • 被氢化物的结构与性能 • 温度和压力 • 溶剂的极性与酸碱度 • 搅拌
影响催化氢化反应的主要因素
• 催化剂的影响
H2,Raney镍
COOC2H5
COOC2H5
50oC,10.13MPa H2,CuCr2O4 160oC,27.56MPa
CH2OH
催化剂应根据被氢化物结构和目的产物而定 在催化氢化中不允许任意加大催化剂用量,以避 免氢化反应难以控制
第六章 还原反应
§6.1概述 §6.2催化氢化 §6.3化学还原
6.1概述 • 定义 • 反应的重要性 • 还原剂 • 还原方法
定义
广义地讲,在还原剂的参与下,能使某 原子得到电子或电子云密度增加的反应称为 还原反应。 狭义地讲,在有机分子中增加氢或减少 氧的反应,或者兼而有之的反应称为还原反 应。
OH
OH
260oC
4
9.81×10 Pa
R C H
多
R‘ C H
少
R—C C—R‘
Lindlar催化剂 H2
室温 >0.29MPa 室温
RCH2CH2R’ + RCH=CHR’
•溶剂的极性的影响
甲醇或乙醇
苯或环己烷
•搅拌效率的影响
(1)影响催化剂在反应介质中的分布情况、 面积和催化效果; (2)有利于传热,防止局部过热。
RCH2OH + R'OH
RCONH2
RCH2NH2
R
R
RCOOH
RCH2OH
RCOONa
分子结构不同,催化氢化的难易程度不同: 炔>烯>ArH 醛>酮>腈>酸 空间效应越大,越不易靠近催化剂,需要强化反 应条件,如升高温度、增加压力、提高催化剂活 性等。
第六章 氧化还原反应和电极电势

第六章氧化还原反应和电极电势
氧化数:有整数、分数、正负数、零。
任何氧化还原反应保括两个半反应,即氧化半反应、还原半反应。
氧化态:氧化数较高的物质;还原态:氧化数较低的物质。
两者合称氧化还原点对,书写(I2/I-)。
氧化还原点对,就是一个半电池,一个电极。
氧化还原反应方程式配平:
1氧化数法:①氧化数值不变②原子守恒
2离子-电子法(半反应法)原则①原子守恒②电荷平衡
步骤1写成离子方程式
2再写成两个半反应
3配平半反应(原子配平、电荷配平。
不够酸性介质加H、
H2O;碱性介质加OH、H2O;中性介质左加H2O右加H+或OH-)
4合并半反应(氧得=还失。
找最小公倍数)
5离子方程式变化学方程式
6核查总反应
氢氧配平规律:
原电池:负氧正还。
盐桥:提供离子通道维持电荷平衡。
电极的种类:1金属离子电极:点对、电极符号Zn|Zn2+(c)、电极反应(氧化态的电子变还原态)|表示相界面;c注明离子浓度。
2金属难溶盐:电对AgCl/Ag;电极符号Ag|AgCl|Cl-(c)
Hg2Cl2/Hg Pt|Hg(l)|Hg2Cl2|(c)⚠️惰性电极Pt、液态(l)3氧化-还原电极:电对:Fe3+/Fe2+Pt|Fe3+(c1),Fe2+(c2)
⚠️同一相用“,”号隔开;惰性电极Pt
4气体-离子电极:电对:H+/H2 Pt|H2(p)|H+(c)
原电池符号:负极在前,正极在后。
(-)Zn|Zn2+(c1)||Cu2+(c2)|Cu(+)||表示盐桥。
第六章 氧化还原反应及电化学基础_6

如:标准锌电极与标准氢电极组成原电池,锌为负极, 标准锌电极与标准氢电极组成原电池,锌为负极, 氢为正极, 氢为正极,测得 εθ = 0.7618 (V) , 则 Eθ(Zn2+/Zn) = 0.0000 – 0.7618 = -0.7618(V)
标准电极电势表
标准电极电势表
Eθ(Li+/Li)值最小的原因:(严宣申,王长富《普通无机化学》(第二版)p10) (Li+/Li)值最小的原因 值最小的原因: 严宣申,王长富《普通无机化学》 第二版) 热 sGmθ(Μ) hGmθ(Μ+) 化 学 M(s) + H+(aq) M+(aq) + 1 H2(g) 2 循 1 G θ(Η ) hGmθ(Η+) 2 2 d m 环 iGmθ(Η) H(g) H+(g)
“形式电荷” +1 -2 形式电荷” 形式电荷 称为“氧化数” 称为“氧化数”
经验规则: 各元素氧化数的代数和为零。 经验规则: 各元素氧化数的代数和为零。 1)单质中,元素的氧化数等于零。(N2 、H2 、O2 等) 单质中,元素的氧化数等于零。(N 。( 2)二元离子化合物中,与元素的电荷数相一致。 NaCl 二元离子化合物中,与元素的电荷数相一致。 CaF2 +1,- +2,+1,-1 +2,-1 共价化合物中,成键电子对偏向电负性大的元素。 3) 共价化合物中,成键电子对偏向电负性大的元素。 超氧化钾) O: -2 (H2O 等); -1 (H2O2); -0.5 (KO2 超氧化钾) 一般情况; H: +1, 一般情况; -1, CaH2 、NaH
思考题: 确定氧化数 思考题:
Na2S4O6 (1)Na2S2O3 ) +2 +2.5 (2)K2Cr2O7 ) CrO5 +6 +10 KO3 (3)KO2 ) -0.5 -1/3 注意:1) 同种元素可有不同的氧化数; 注意: 同种元素可有不同的氧化数; 氧化数可为正、负和分数等; 2) 氧化数可为正、负和分数等;
轻化工合成原理第6章-讲义
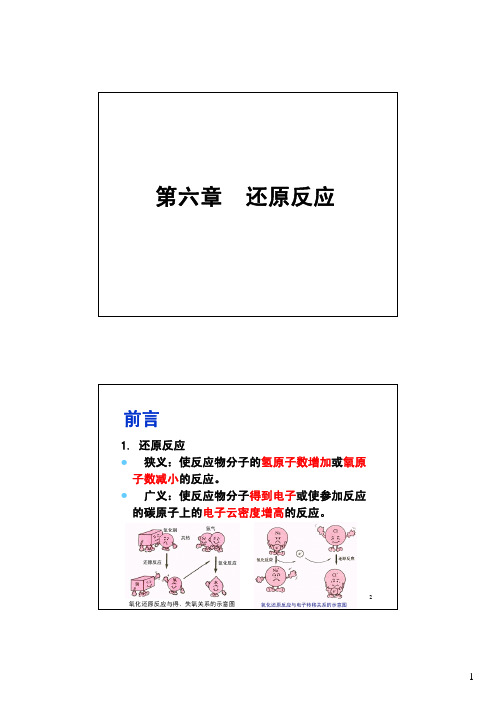
前言1. 还原反应z狭义:使反应物分子的氢原子数增加或氧原子数减小的反应。
z广义:使反应物分子得到电子或使参加反应的碳原子上的电子云密度增高的反应。
232. 还原方法z 化学还原:除氢以外的化学物质作还原剂的方法z 催化加氢:用氢在催化剂作用下进行还原的方法均相催化氢化:催化剂溶于反应介质非均相催化氢化液相催化氢化气固相催化氢化z 电解还原:在电解槽阴极室进行还原的方法4z 还原反应的分类:¾碳-碳不饱和键的还原¾碳-氧键的还原:如醛羰基还原成醇羟基或甲基;酮羰基还原为醇羟基或次甲基;羧基还原成醇羟基;羧酰氯还原成醛基或羟基等。
¾含氮基的还原:硝基和亚硝基还原为羟氨基和氨基等;硝基还原成氧化偶氮基、偶氮基或加氢偶氮基等。
56.1 化学还原有机还原剂:乙醇、甲醛、甲酸、烷氧基铝等。
金属:NaHS 、Na 2S 、Na 2S x 、Na 2SO 3、NaHSO 3、Na 2S 2O 4、SnCl 2、FeCl 2、TiCl 3非金属:SO 2、NH 2OH 和H 2NNH 2等活泼金属及其合金:Fe 、Zn 、Na 、Zn-Hg 、Na-Hg 低价元素化合物金属复氢化合物:NaBH 4、KBH 4、LiBH 4、LiAlH 4等无机还原剂66.1.1 铁粉还原z 以金属铁为还原剂,反应在电解质溶液中进行z 选择性还原剂(硝基或其它含氮的基团)z 工艺成熟、简单,适用范围广z 副反应少z 对设备要求低z 产生大量的含胺铁泥和废水11NH 4Cl >FeCl 2>(NH 4)2SO 4>BaCl 2>CaCl 2>NaCl 最常用的电解质是FeCl 2,可在还原前先加入少量盐酸及铁屑制成,工业上称为“铁的预蚀”。
3) 电解质-电解质可提高溶液的导电能力,加速铁的腐蚀过程,还原速度取决于电解质的性质和浓度。
4) 温度-一般为95-105℃。
铁粉还原为强烈放热反应,若加料太快,反应过于激烈,会导致暴沸溢料。
无机化学 氧化还原反应

E 与反应计量系数无关,无加和性 与反应式的书写方向无关
Fe3+ + e-=Fe2+ E = 0.771 V 2Fe3++ 2e-=2Fe2+ E = 0.771 V, 而非0.771×2 Fe2+ - e- =Fe3+ E = 0.771V, Fe2+ =Fe3+ + e- 而非 - 0.771 V
第六章 氧化还原
PLEASE ENTER YOUR TITLE HERE
第一节 氧化还原反应 第二节 电池的电动势和电极电势 第三节 氧化还原平衡 第四节 影响电极电势的因素 第五节 元素电势图
电负性:元素的原子在分子中吸引电子能力的相对大小
元素电负性的周期性变化与金属性、非金属性的一致
金属-金属离子电极
金属-金属难溶盐-阴离子电极
氧化还原电极
气体-离子电极
三、常用电极类型氧Leabharlann 还原电对: Ag+ / Ag
电极组成式: Ag+(c) | Ag(s)
电极反应:
由金属板插入到该金属的盐溶液中构成
01
03
02
04
例:银电极
1.金属-金属离子电极
将金属表面涂渍上其金属难溶盐的固体,然后浸入到与该电解质具有相同阴离子的溶液中构成的电极
(1) 两个半电池反应分别为: 正极 MnO4-+ 8H+ + 5e-=Mn2+ + 4H2O 负极 H2O2=2H+ + O2 + 2e- (2)电极组成为: 正极 MnO4- (c1), Mn2+ (c2), H+ (c3) | Pt (s) 负极 H+ (c4), H2O2 (c5) | O2 (p) | Pt (s) (3)电池组成式为: (-) Pt |O2 (p) | H2O2 (c5), H+ (c4)‖MnO4- (c1), Mn2+(c2), H+(c3) | Pt (+)
第六章 还原反应jxau

Nitriles to aldehydes
Vinyl esters to allylic alcohols
Reduction Reactions
6.2 Metal hydride
环氧乙烷类及羰基化合物被氢化锂铝或二异丁基氢化铝还原成醇类,反 应的进行可能受动力学控制,也可能受热力学控制(溶剂对反应的影响)。
H
H2,Pd C EtOAc,r.t; 97%
Lindlar(林德拉)催化剂 Pd/BaSO4/喹啉
炔
Lindlar
烯
Reduction Reactions
6.1 Hydrogenation
Rosenmund Reduction(罗森蒙德反应)
催化氢化选择性还原醛的反应
酰氯用受过硫-喹啉毒化的钯催化剂进行催化还原,生成相应的醛
反应性
最高
反应物
RCOCl RCH2NO2 RC≡CR′ RCHO RCH=CHR′ RCOR′ ArCH2X RC≡N RCO2R′ RCONHR′
氢化产物
RCHO RCH2NH2 RCH=CHR′(Z,Cis) RCH2OH RCH2CH2R′ RCH(OH)R′ ArCH3 RCH2NH2 RCH2OH + R′OH RCH2NHR
O R C H + (Ph3P)RhCl R H + (Ph3P)2RhCl(CO) + Ph3P
H2
Reduction Reactions
6.1 Hydrogenation
3)加氢反应受催化剂,取代物及溶剂等诸方面的影响, 可能产生不同的异构产物,但真正的反应机理则尚待 研究中。
H H2 OH O PtO2 Pd C cat cat OH
第六章还原反应

(R3P)3RhCl
1.机理
H-H H H
C
C H H C C
catalyst surface C H H C C H C H
多相催化 :在不溶于反应体系中的固体催化剂 的作用下,氢气还原在液相中的底物的反应。
2. 类型
催化氢化 Hydrogenation
催化氢解
Hydrogenolysis
均相催化 Heterogenous 多相催化 Homogenous
b.脱硫
(2)铂催化剂 活性很强
可以还原除了酯、羧酸和酰胺外,各种不饱和基 团均可被还原。如:醛酮、腈、硝基化合物,还 原氨化反应等。反应通常可在较低温度和较低氢 气压力下反应。 铂黑、铂炭、二氧化铂等。
比较最常用的是二氧化铂(PtO2),(Adams catalyst), 在使用时被还原成铂。
还原活性从高到低:
C=O > COOR> CN> CONR2> C-NO2> CHBr > CH2OSO2Ar
制备:
4LiH + AlCl3 Et2O 3LiCl3 + LiAlH4
遇水分解:
(1)用1M氢化铝锂溶液进行还原时很方便. (2)用较少量溶剂和粉状铝氢化锂混合成稀糊状直 接应用. 此时要注意氢化铝锂用量,至少要过量10%,以保证 有足够的纯LiAlH4进行反应.在特殊的情况下有时甚 至过量2—4倍,才能使反应进行完全。
PhNHOH
PhCH2OH NH2
NH2
特点:较氧化反应易于控制。 类型: (1)活泼金属Fe/HCl, Zn/HOAc,Na/ROH, ZnHg/HCl,Na-Hg/EtOH等 (2)低价元素的化合物 Na2S2O4, NaS, FeCl2, SnCl2, TiCl3, TiCl2等 (3)金属氢化物 NaBH4, LiAlH4, (4)催化加氢 Pd, Pt, Ni, /H2. (5) 有机金属还原剂: 异丙醇铝,叔丁醇铝,甲醛,葡 萄糖。 (6)非金属:Me2S, Ph3P
第六章 氧化还原反应

电极类型:
(1)金属及其离子电极
如:Ag︱Ag+(c)
Ag e
Ag
(2)气体电极
如:Pt︱H 2(p) ︱H+(c) (3)氧化还原电极
2H 2e
H2
如:C(石墨)︱Fe2+(c1) ,Fe3+(c2) Fe3 e
Fe2
(4)金属及其难溶盐-阴离子电极
如:Ag︱AgCl︱Cl-(c)
AgCl e
(5)2 KMnO4+K2SO3+2KOH
2K2MnO4+K2SO4+H2O
2、氧化值法 遵循原则: 氧化剂中元素氧化值降低的总数与还原剂 中氧化值升高的总数必须相等。 配平步骤: 以KMnO4和K2SO3在稀H2SO4中反应为例 (1) 写化学式,标氧化值,计算氧化值变化
氧化值降5价
+7
+4
Cr元素的氧化值:+5
O OO
Cr OO
6、半反应 氧化还原反应根据电子转移的方向可拆成两个半反应。
如: Zn Cu2 Zn 2 Cu
氧化半反应: Zn Zn 2 2e
还原半反应: Cu2 2e Cu
半反应通式:氧化剂+n e
还原剂
或 Ox ne
Red
注意: 氧化还原反应中,电子有得有失,因此半反应不能单独存在,
组成如下图的原电池,从电流方向可得Zn电极为负极
(-)Zn∣Zn2+(1mol/L)‖H+(1mol/L)∣H2(100kPa)∣Pt(+)
Eθ
θ 正极
θ 负极
θ H/H2
θ Zn 2/Zn
0.0000
θ Zn
2
/Zn
0.7618V
∴
θ Zn 2/Zn
0.7618V
第六章氧化物还原熔炼反应的热力学

●直接还原反应与间接还原反应的关系
当固体碳存在并过剩时,体系中C+CO2=2CO反应的平衡成分
控制气相组成。即C+CO2=2CO是气相平衡成分的控制者。间
接还原反应加上碳的气化反应就是直接还原反应。
10
3.2 固体碳直接还原铁的各级氧化物
3.2.1 逐级还原反应方程式
t 570 C
●在CO的氧势线以上的氧化物均能为固体C还原, 但不一定能为CO(或H2)所还原,是中等还原 性的氧化物,如:Cr、V、Ni、Si的氧化物。
●仅能在高温下为固体碳还原的氧化物,是难还原 的氧化物,如CaO、MgO、Al2O3。
3
2 氧化物的间接还原反应热力学
4
2.1 CO还原铁的各级氧化物的特点
%S %S
K
' S
O2 xO2
%O
f S
S2
23
●温度: H 0,T ,K 。
●熔渣组成:
MnO、MgO、CaO ,R 、(O 2 ) ,LS
SiO2、Al2O3 ,(O 2 ) ,LS
FeO
FeO
(O2 ) [O]
LS LS
●金属熔体中元素的影响:
eeSSjj
对于曲线(2):Fe3O4+CO=3FeO+CO2
G RT ln %CO2 %CO a''
RT ln %CO2 %CO a
%CO2 %CO2 %CO a %CO a''
%COa'' %COa;%CO2 a'' %CO2 a
G RT ln %CO2 RT ln %CO2 0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4)炔烃顺式加氢
(5)不发生双键迁移的氢化,前者不发 生双键的迁移。
第二节 化学还原
如果分子中有多个可被还原的基团,需 要氢化还原的是列于表6-2前列的较易还 原的基团,而保留的是该列表后列较难 还原的基团,则选用催化氢化法为佳; 反之,若需还原后列基团而保留前列基 团,通常选用具有反应选择性的化学还 原为好。
有的化学还原剂还是具有立体选择性, 即同一个被还原物,若采用不同的化学 还原剂,结果可得不同的空间构型的产 物。
常用的化学还原剂有:金属、金属复氢 化物、肼及其衍生物、硫化物、硼烷等。
一、活泼金属与供质子剂
金属与供质子剂的还原作用应看成是 “内部的”电解还原,即一个电子从金 属表面转移到待还原的有机分子上,形 成“负离子自由基”,然后随即与供质 子剂提供的质子结合成自由基,接着再 从金属表面取得一个电子,形成负离子, 再从供质子剂取得质子而完成还原反应 的全过程。 如下式所示:
非均相催化氢化反应具有工艺简便、原料低廉, 对许多基团的加氢、氢解均有较高的催化活性, 而且容易分离回收等优点, 均相催化剂的缺点是原料成本高,目对氧敏感, 常用惰性气体回流除氧,以保让氢化反应的顺 利进行。但尽管如此,其优点仍然引起人们极 大的兴趣和重视,无论在催化理论的研究上, 还是在有机合成的应用方面,都具有深远的意 义。
催化加氢
催化加氢是指具有不饱和键的有机物分 子,在催化剂存在下,与氢分子作用, 结果不饱和键全部或部分加氢的反应。 该反应应用范围很广,烯烃、炔烃、硝 基化合物、醛、酮、腈、芳环、芳杂环, 羧酸衍生物等均可采用此法还原成相应 的饱和结构。如下例:
催化氢解
通常指在催化剂存在下,含有碳—杂键的有机 物分子在氢化时发生碳—杂键断裂,结果分解 成两部分氢化产物。可用下列通式表示:
选择性还原未端烯键 由于均相催化剂含有立体位阻较大的三 苯基膦结构,而多取代烯烃的立体位阻 也大,两者不易形成络合物,因此可以 选择性地还原未端烯键,而保留分子中 的多取代烯键。
选择性还原α,β—不饱和醛、酮、硝基、 氰基等化合物的烯键,而不影响羰基、 硝基、氰基的存在。
(3) 选择性还原含氯或醚键等敏感 基团的烯键
反应温度增高,氢压加大反应速度也相 应加快,但也容易引起副反应增多,反 应选择性下降。例如:
4. 溶剂的极性与酸碱度的影响
同一催化剂在这些溶剂中所的影响
该反应为多相反应,且有放热效应,所 以需采用强有力和高效率的搅拌,以免 局部过热,减少副反应的发生。
五、均相催化氢化反应
若反应过程中无供质子剂存在,负离子 自由基可以二聚,形成双负离子,反应 后再经供质子剂处理,即可得双分子还 原产物。
1.钠或钠汞齐
以醇为供质子剂,钠或钠汞齐可将羧酸 酯还原成相应的伯醇,酮还原成仲醇, 即所谓Bouveault—Blanc还原反应。主 要用于高级脂肪酸酯的还原。
在没有供质子剂存在下,酯发生双分子 还 原 得 α— 羟 基 酮 , 称 为 醇 酮 缩 合 (Acylion Condensation)
四、影响催化氢化反应的主要 因素
1.催化剂的影响 从表6—1可知,不同的催化剂,其适用 范围和所要求的反应条件,以及生成的 还原产物有可能不同。
如苯甲酸乙酯分别Raney镍和亚铬酸铜 进行催化氢化,其结果如下 :
2.被还原物结构的影响
各种官能团催化氢化的活性顺序大致如 表6—2。
3.应温度和压力的影响
首先,TTC在溶剂(S)中离解,生成复合物, 然后活化氢分子,使它均裂,生成二氢络合物, 氢原子直接连接在过渡金属上。加氢时,反应 物分子转换二氢络合物中的溶剂分子,继而两 个氢原子立体专一地进行顺式加成,最后离解 为还原产物和复合物。
继续进行氢化还原反应,烯烃的均相催 化加氢过程可以下图表示:
2.均相催化氢化的适用范围
第六章 还原反应
从广义上讲,凡使反应物分子得到 电子或使参加反应的碳原上的电子 云密度增高的反应称为还原反应; 从狭义上讲,凡使反应物分子的氢 原子数增加或氧原子数减少的反应 即为还原反应。
第一节 催化还原
在催化剂存在下,有机化合物与氢的反 应称为催化氢化。其中催化剂以固体状 态存在于反应体系中的反应体系中的称 为非均相催化氢化,而催化剂溶解于反 应介质的称为均相催化氢化。 从反应结果来看,催化氢化又分为两大 类,即催化加氢和催化氢解。
1.反应历程
均相催化剂是以过渡金属(例如钌、铑、 铱、锇、钴等)的原子或离子为中心, 周围按一定几何构型环绕着配位基而形 成的络合物,由于过渡金属具有空的d电 子轨道,容易吸附大量的氢并使其活化, 因此这类催化剂有很强的催化氢化活性。
以三(三苯基膦)氯化铑(简称TTC)为例, 其均相催化氢化反应历程简述如下:
这类反应常见的有:脱卤氢解、脱苄氢解、脱 硫氢解和开环氢解。
一、非均相催化氢化反应历程
非均相催化氢化反应是在催化剂表面进行的, 反应过程如下:
(1)、在一定的反应条件下,催化剂的活性中心 对氢分子进行化学吸附,生成活泼的氢原子吸 附化合物。
(2)、同时,催化剂对不饱和有机物空间阻碍较 小的一面进行化学吸附,使其π键打开,形成 两点吸附的活性中间体(即σ—π络合物) (3)、活泼的氢原子对活性中间体分步加成,生 成加氢产物,然后加氢产物脱离催化剂表面, 并向介质中扩散。
反应过程示意:
某些烯烃在催化氢化过程中有双键异构 化伴随发生,致使产物以反式加成物为 主。
二、常用氢化催化剂及制备方法
氢化还原常用的催化剂主要是过渡金属 元素,如:镍、铂、钯、钌、等高度分 散的活化态金属。近几年来,由金属氧 化物的混合物所组成的新型加氢催化剂, 如亚铬酸铜等,因其价格便宜,使用方 便,也已广泛应用于工业生产。它们各 自的适用范围见表6一1。
表6—1常用非均相氢化催化剂的适用范围
镍、钯、铂、亚铬酸同氢化催 化剂的制备方法如下:
Raney镍催化剂 P—2型硼化镍(NiB) 钯/炭催化剂(含5%Pd) 钯/炭催化剂(含10%Pd) Lindlar催化剂 钯黑 铂催化剂
三、催化氢化反应装置及操作 方法
常压催化氢化装置 高压催化氢化装置高压催化氢化装置
