稳定性考察
稳定性考察方案
文件名称稳定性考察方案文件编码颁发部门质量保证部版本01 执行日期起草:日期:审核:日期:批准:日期:分发部门质量保证部质量控制中心生产管理部设备动力部供应部市场部综合部财务部生产车间份数文件内容1.目的2.责任人3.适用范围4. 内容1.目的建立稳定性考察方案,对产品品种、批号、有效期进行考察,为产品制定有效期提供依据。
2.责任人留样观察管理员3.适用范围已经生产的全部产品。
4. 内容1.稳定性考察方法:长期试验长期试验是在接近药品实际贮存条件下进行,其目的是为制订药品的有效期提供依据。
供试品要求3批,市售包装,在温度25℃±4℃,相对湿度60%±15%的条件下放置36个月,分别于第0月、3月、6月、9月、12月、24月、36月,按稳定性考察检查项目进行检查,将结果与0月比较观察其质量否有显著性差异。
2检测时间的规定2.1取样检查时间:6个月允许±15天;12个月后允许±30天。
2.2样品取出先放在常温下,一般要求一周内完成检测;温湿度敏感的药品要及时检测。
3.稳定性试验方案的实施3.1在药品稳定性试验前,留样管理员应检查其储存条件是否合格。
检查合格后将样品存入指定位置。
3.2留样管理员依据稳定性试验方案确定的考察品种、考察月份、检查项目,及时取样、申请检验。
3.3稳定性考察检查项目:考察月份检查项目0 全检3 全检6 全检9 全检12 全检24 全检36 全检其中,性状,主要检查中药材或饮片外观颜色是否符合要求,是否有生虫、发霉迹象。
3.4 QC收到请检样品后,依据稳定性考察检查项目,及时安排检测。
检测结束后,根据检测结果,出具检验报告书给留样观察员。
3.5稳定性试验结果出现异常情况,调查原因,并将情况及时向质量管理负责人汇报。
如果只有一项次要的检测指标有变化(如颜色、水分变化,但仍在标准之内),则继续进行稳定性试验,观察其变化趋势。
若发生显著变化,则应调整试验条件,重新进行试验。
药品留样与稳定性考察的区别

留样、稳定性考察、持续稳定性考察的区别
首先,三种不同概念的理解是不同的。
1、留样的目的主要是为了追溯用的,或者对于某批次的物料、产品进行调查时候使用的,重点在于追溯和调查;
2、稳定性考察主要是为了考察产品有效期用的,在一定的环境如温湿度等影响下的一种变化趋势,稳定性考察的数据目的在于提供科学证据,以适用于药品的生产、储存、运输等过程;
3、持续稳定性考察是为了在药品的有效期内监控产品的质量,以确定药品在规定的储存条件下符合质量标准的要求;
根据以上的概念描述,我们不难发现,留样主要是针对每批市售的产品,稳定性考察针对的是上市投产前三批以及重要变更、工艺变化、重新加工等,而持续稳定性考察针对的是市售的包装产品。
目的不同,概念不同,考察点不同,所以考察的时间也不同,留样要至少保存至药品有效期后一年,稳定性考察按照药典规定进行加速考察6个月以及长期稳定性考察,前12个月,每3个月取样,之后与第18个月、24个月、36个月分别取样,并将结果与零时进行比较。
而持续稳定性考察的时间必须要包涵药品的有效期。
不要忘记,留样最好每批产品都要留,稳定性考察进行三批最好,持续稳定性考察每年至少考察一个批次。
稳定性考察操作规程

一、目的:建立稳定性考察操作规程,规范稳定性考察方法。
二、范围:本规程规定了稳定性考察方法和操作要求;适用于物料及产品的稳定性考察。
三、职责:质量控制科负责人、质量控制科技术员、质量控制科检验员对实施本标准负责。
四、内容:1 制定年度持续稳定性考察计划1.1 质量控制科负责人于每年12月份根据下一年度的生产计划制订第二年的《年度持续稳定性考察计划》,确定第二年度持续稳定性考察程序的品种。
并交质量管理负责人审核批准。
2 各品种持续稳定性考察方案的制定2.1 质量控制科技术员应在收到持续稳定性考察的申请单后1周内完成该品种持续稳定性考察方案的编写工作,并交质量控制科负责人审核,质量管理负责人批准。
2.2 持续稳定性考察方案的内容2.2.1 需进行考察产品的名称、规格、考察批次数。
2.2.2 相关的物理、化学、微生物和生物学检验方法,或采用持续稳定性考察专属的检验方法。
2.2.3 检验方法依据。
2.2.4 合格标准。
2.2.5 容器密封系统的描述。
2.2.6 试验间隔时间。
2.2.7 贮存条件或试验条件采用《中国药典》规定的稳定性试验标准条件。
2.2.8 检验项目,为产品质量标准所包含的全部项目,如检验项目少于产品质量标准所包含的项目,应当说明理由。
2 各品种持续稳定性考察样品量2.1 影响因素试验需1个批次,加速试验和长期试验需3个批次(或至少每年应当考察一个批次,除非当年没有生产。
)。
3 各品种持续稳定性考察项目3.1 产品持续稳定性考察项目:产品持续稳定性考察项目表3.2 中间产品、待包装产品持续稳定性考察项目除装量外均按3.1项执行。
4 持续稳定性考察方法4.1 影响因素试验4.1.1 高温试验:供试品开口置密封洁净容器中,在60℃温度下放置10天,于第5天和第10天取样检测有关指标。
如供试品发生显著变化,则应在40℃下同法进行试验。
如60℃无明显变化,则不必进行40℃试验。
4.1.2 高湿度试验:供试品开口置恒湿密闭容器中,于温度25℃,相对湿度 90%±5%条件下放置10天,在第5天和第10天取样检测有关指标。
产品稳定性考察方案

产品稳定性考察方案产品稳定性是衡量一个产品质量的重要指标,一款稳定性高的产品能够在使用过程中保持良好的性能和操作稳定性。
为了确保产品的稳定性,我们需要进行全面的考察与评估。
本文将介绍一个高效且全面的产品稳定性考察方案。
1. 考察目标和范围1.1 考察目标:明确产品的稳定性考察目标,例如产品研发阶段、产品上市前后的稳定性评估等。
1.2 考察范围:确定需要考察的产品范围,可以按照产品类型、系列或者功能进行分类。
2. 产品稳定性指标2.1 功能稳定性:考察产品在正常工作条件下的功能表现是否稳定,包括各项功能是否正常、是否出现卡顿、死机等异常现象。
2.2 性能稳定性:考察产品在长时间使用或高负荷工作状态下的性能是否稳定,例如CPU/GPU温度是否过高、电池续航是否稳定等。
2.3 兼容稳定性:考察产品在不同系统、软件或硬件环境下的兼容性,确保产品能够在各种使用条件下正常运行。
2.4 接口稳定性:考察产品的接口连接是否稳定可靠,例如USB接口是否松动、连接是否易断等。
2.5 数据稳定性:考察产品在数据传输、存储过程中是否出现数据丢失或损坏的情况。
3. 考察方法和工具3.1 实际测试:通过使用产品进行实际测试,包括按照正常使用流程进行功能测试,模拟高负荷工作状态进行性能测试等。
3.2 环境模拟:通过模拟不同的使用环境,例如高低温、高湿度等,检验产品在不同环境下的稳定性表现。
3.3 数据记录与分析:使用专业的数据记录与分析工具对测试结果进行记录和分析,包括测试时间、结果记录、异常情况等。
4. 考察流程4.1 制定计划:根据考察目标和范围,制定详细的考察计划,包括测试时间、测试地点、测试人员等信息。
4.2 实施测试:按照考察方法和工具进行相应的测试与考察,记录测试结果和异常情况。
4.3 数据分析:对测试结果进行数据分析,评估产品的稳定性,并提出改进建议。
4.4 缺陷修复:对于发现的问题和异常现象,及时进行修复和优化,并进行再次测试以确认修复效果。
稳定性考察 方案

稳定性考察方案引言稳定性是指系统在不受干扰的情况下,能够维持其稳定运行的能力。
在软件开发过程中,稳定性是一个非常重要的考虑因素,对于保证系统的可靠性和用户体验具有重要意义。
本文将介绍一种稳定性考察方案,用于评估软件系统的稳定性。
1. 稳定性的定义在软件开发中,稳定性一般包括以下几个方面的考察: - 系统的可用性:系统在使用过程中能够正常工作,不会出现频繁的崩溃或故障。
- 系统的性能表现:系统在高负载下仍能保持较高的性能和响应速度。
- 系统的容错性:系统能够正确处理异常情况,并提供相应的错误处理机制和恢复策略。
- 系统的兼容性:系统能够与不同环境和不同版本的软硬件平台兼容。
- 系统的可维护性:系统能够方便地进行维护和升级,不会因为修改而引入新的问题。
2. 稳定性考察方案2.1. 环境测试在进行稳定性考察前,首先需要对系统运行环境进行全面测试。
这包括硬件设备、操作系统、数据库等各个方面的测试。
通过模拟实际使用场景、加大负载以及模拟异常情况,验证系统在各种环境下的稳定性。
2.2. 负载测试负载测试是评估系统在高负载下的稳定性的一种方法。
通过模拟大量用户并发访问系统,观察系统在负载峰值时的性能表现。
可以采用性能测试工具,设置不同的负载情况,并监控系统的响应时间、资源占用情况等指标,提取性能数据进行分析。
2.3. 异常情况测试在系统开发中,异常情况是无法避免的。
为了评估系统在异常情况下的稳定性,需要进行异常情况测试。
通过模拟系统出现各种异常情况,如网络故障、数据库崩溃、硬件故障等,观察系统对异常的处理能力。
测试包括恢复能力、错误提示是否友好、数据完整性等方面。
2.4. 兼容性测试兼容性测试是评估系统与不同环境和平台的兼容性的方法。
需要测试系统在不同操作系统、不同浏览器、不同设备上的兼容性。
通过模拟不同配置的设备和环境,观察系统在各种组合下的表现。
同时,需要关注系统的跨平台性能和可用性。
2.5. 容错性测试容错性测试是评估系统对错误和异常情况的处理能力的方法。
产品稳定性考察方案

产品稳定性考察方案一、引言产品的稳定性是评估其性能和可靠性的重要指标之一。
为了确保产品的质量和可持续发展,我们需要进行全面而有效的产品稳定性考察。
本文将介绍一个可行的产品稳定性考察方案,以帮助企业评估和改进产品的稳定性。
二、背景产品稳定性是指产品在一定的环境条件下,在特定的使用寿命内能够保持其性能和功能的能力。
稳定性考察能够帮助企业了解产品的使用寿命、失效机制和改进方向,从而提高产品的质量和竞争力。
三、考察目标1. 评估产品的使用寿命:通过考察产品在一定使用寿命内的性能变化,了解产品的使用寿命和寿命分布,为产品的维护和改进提供依据。
2. 分析产品的失效机制:通过详细的失效分析,了解产品的主要失效模式和机制,为改进产品设计和工艺提供参考。
3. 评估产品的可靠性:通过考察产品的故障率和可靠度指标,评估产品的可靠性水平,为产品的改进和质量管理提供依据。
4. 发现产品的设计和制造缺陷:通过考察产品的性能变化和故障分布,发现产品的设计和制造缺陷,并提出改进建议。
四、考察方法1. 采集可靠性数据:通过产品使用过程中的数据采集和记录,收集产品的性能变化、故障情况、维修记录等数据,建立产品的可靠性数据库。
2. 进行失效分析:通过实验室测试、实际使用场景模拟等方法,对产品进行故障模式分析和失效机制研究,确定主要的失效模式和影响因素。
3. 进行可靠性评估:根据产品的性能变化数据和故障率模型,进行可靠性评估,计算产品的可靠性指标,如可靠度、故障率、平均无故障时间等。
4. 制定改进方案:根据产品稳定性考察的结果,制定相应的产品改进方案,包括改进设计、改进工艺、提高生产质量等。
五、考察计划1. 数据采集阶段:确定数据采集的内容和方法,包括性能数据、故障数据、维修记录等的采集方式和时间频率。
2. 失效分析阶段:进行实验室测试和故障模式分析,确定产品的主要失效模式和影响因素。
3. 可靠性评估阶段:基于采集的数据和失效分析结果,进行可靠性评估,计算产品的可靠性指标。
稳定性考察 方案

稳定性考察方案引言稳定性是一个系统或产品持续运行并保持正常功能的能力。
在软件开发中,稳定性是一个重要的质量指标,对于用户体验和系统可靠性都具有重要影响。
本文旨在阐述稳定性考察方案的相关内容,包括稳定性评估的基本原则、稳定性测试的方法和评估指标。
稳定性评估原则稳定性评估需要遵循以下原则: 1. 真实性:评估的结果应该真实反映系统的稳定性情况,不能进行人为干预或篡改。
2. 公正性:评估应该公正、客观,不受利益相关方的影响,不偏袒任何一方。
3. 全面性:评估应该覆盖系统的各个方面,包括性能、可靠性、可用性等多个维度。
4. 可重复性:评估过程和结果应该是可重复的,可以进行多次验证和比较。
稳定性测试方法稳定性测试是评估系统稳定性的一种常用方法,主要包括以下几种: 1. 负载测试:通过增加系统负载,观察系统在高负载情况下的稳定性表现。
可以使用工具模拟用户并进行压力测试,监测系统是否能够正常处理请求和负载。
2. 异常情况测试:测试系统对于异常情况的处理能力,例如网络断开、服务崩溃等情况下系统是否能够自动恢复并保持正常运行。
3. 长时间运行测试:测试系统在长时间运行的情况下是否会出现问题,例如内存泄露、资源耗尽等情况。
可以通过模拟系统稳定运行一段时间来观察系统的稳定性。
4. 容量测试:测试系统在不同负载下的能力,观察系统在负载逐渐增加的情况下性能是否会下降,以及系统能够支持的最大负载量。
稳定性评估指标稳定性评估可以根据不同的系统特点和需求来选择适合的指标,以下是一些常见的稳定性评估指标: 1. 可用性:衡量系统持续可用的时间比例,通常以百分比表示。
可用性越高,系统越稳定。
2. 响应时间:衡量系统对用户请求的响应速度,通常以毫秒或秒为单位。
稳定性好的系统响应时间较低且相对稳定。
3. 错误率:衡量系统在处理请求过程中出现错误的概率,通常以百分比表示。
稳定性好的系统错误率较低。
4. 内存占用率:衡量系统在运行过程中使用的内存资源占总容量的比例,通常以百分比表示。
含量测定方法学稳定性考察的意义

含量测定方法学稳定性考察的意义引言:在化学分析和质量控制领域中,对于待测物质的含量测定方法具有重要意义。
然而,各种因素会影响方法测定结果的准确性和可靠性,其中重要因素之一是方法的稳定性。
本文将讨论含量测定方法学稳定性考察的意义,并解释其对实验可靠性和分析结果的重要性。
方法学稳定性考察的定义和意义:方法学稳定性考察指的是通过对测定方法在不同条件下的反复测定来评估方法结果的一致性和稳定性。
该过程包括对方法的可再现性、重复性、准确性和可靠性等指标的综合评价。
稳定性考察的意义在于确认分析方法的可靠性,确保测定结果的准确性,并提供实验质量控制的依据。
以下是方法学稳定性考察的几个重要意义:1.评估方法的可靠性:稳定性考察可通过多次反复测定来评价方法的可靠性。
通过测定准确度、精密度等指标,可以判断方法是否有足够的稳定性来满足实验需求。
如果方法稳定性较差,测定结果的可靠性就无法得到保证,会对实验结果和数据分析产生不可忽视的影响。
3.确保实验质量的可控性:稳定性考察是实验室质量控制的重要环节之一、通过定期进行稳定性考察,可以追踪方法的性能变化和数据准确性,及时发现问题并采取措施进行调整和修正。
这有助于实验室维持高质量的实验操作和数据记录,确保实验质量的可控性。
4.与其他方法的比较和验证:在实际分析中,可能会存在多个测定方法可供选择。
通过稳定性考察,可以对比和验证这些方法的稳定性,并选择最适合的方法进行分析。
这样可以确保分析结果的一致性,并为实验数据提供可信度。
5.为质量控制提供依据:稳定性考察结果可用于建立质量控制相关的规范和标准操作程序。
例如,可以基于方法稳定性的数据来确定允许的标准偏差范围,以及制定周期性校准和验证的策略。
这有助于保证实验室分析结果的稳定性和可靠性。
结论:含量测定方法学稳定性考察对实验可靠性和分析结果的重要性不可忽视。
通过评估方法在不同条件下的稳定性和重复性,可以为实验室提供高质量的实验操作、准确的分析结果和可靠的质量控制系统。
稳定性考察管理规程

1、目的稳定性考察目的是考察产品在温度、湿度的影响下随时间变化规律,为医疗器械的生产、包装、贮存、运输条件和有效期的确定提供科学依据。
并且通过持续稳定性考察测量在有效期内监控已上市医疗器械的质量,并发现医疗器械与生产相关的稳定性问题,确认医疗器械能够在标示的贮存条件下,符合质量标准的各项要求。
2、适用范围适用于公司新产品、重大变更(主要供应商、工艺改变、主要设备变更)产品、生产和包装有重大偏差的产品进行稳定性考察。
3、职责3.1质量部按本规程制定年度稳定性考察计划,并按照稳定性考察计划严格执行。
3.2检验员负责对需要进行稳定性考察的样品进行检验。
3.3质量部负责人对稳定性试验中出现的异常情况进行处理和撰写总结,评估、监督、检查执行情况。
3.4管理者代表应了解稳定性考察的结果并定期做稳定性考察总结报告。
4、工作程序4.1基本要求4.1.1对稳定性考察的品种应有考察方案。
4.1.2稳定性考察的时间应涵盖医疗器械有效期,考察方案至少包括以下内容;①每个产品的考察批次;②检验项目、检验方法及检验方法依据;③产品技术要求;④试验间隔时间,稳定性试验贮存条件。
4.2稳定性试验4.2.1试验方式①加速试验(预测样品的有效期或偏差或变更、验证需要时)此试验是在加速条件下进行,其目的是通过加速产品化学或物理变化,探讨医疗器械的稳定性,为医疗器械评审、包装、运输及贮存条件提供必要的资料。
②长期试验长期试验是在接近医疗器械的实际贮存条件下进行,其目的是为制定医疗器械的有效期提供依据。
在留样间放置至有效期失效后1个月。
分别在0个月、3个月、6个月、12个月、18个月、24个月、30个月、36个月,按稳定性考察项目进行检测,将结果与0个月比较,已确认医疗器械在加速试验时的有效期是否合理。
4.2.2以下情况进行稳定性考察①新品种:正式投产后前三批产品进行加速、长期稳定性试验考察。
②重大变更:当生产工艺、生产线或关键生产设备等变更,而这些变更会影响产品稳定性时,变更后的前三批进行加速、长期稳定性试验考察。
药品稳定性考察报告

药品稳定性考察报告药品稳定性考察报告篇一:药品稳定性考察方案药品稳定性考察方案1.考察目的药品的稳定性是指原料药及其制剂保持其物理、化学、生物学和微生物学性质的能力。
考察药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
2.考察范围适用于公司所有成品及原液的考察。
药品稳定性考察包括:加速试验和长期(持续)稳定性试验。
长期(持续)稳定性考察主要针对市售包装产品,但也需兼顾待包装产品。
例如,当待包装产品在完成包装前,还需要长期贮存时,应当在相应环境条件下,评估其对包装后产品稳定性的影响。
此外,还应考虑到对贮存时间较长的中间产品进行考察。
加速试验主要针对批量放大及上市后变更(如生产设备变更、原辅料变更、工艺调整等)时生产的产品的稳定性试验。
3.考察依据依据《中国药典》2010版二部附录中《原料药与药物制剂稳定性试验指导原则》进行确认。
4.职责质保部部长负责稳定性考察方案与报告的起草。
质控部人员按照该方案完成实验并报告检验结果。
质保部部长负责检验结果的汇总。
质保部部长负责稳定性考察方案、检验结果、报告的审核。
质量授权人负责稳定性考察方案及报告的批准。
5.产品介绍(将做稳定性考察产品的介绍填在附表)内容:产品名称、代码、考察方法、批号、规格、包装规格、考察数量、生产数量、有效期至 6.考察方法 6.1加速试验此项实验在加速条件下进行,目的是通过加速药物制剂的化学或物理变化,探讨药物制剂的稳定性,为药品审评、包装、运输及贮存提供必要的资料。
6.1.1供试品要求3批,按市售包装,在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月。
所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度与湿度进行监测。
在试验期间第1个月、2个月、3个月、6个月末取样一次,按稳定性重点考察项目检测(转载于: 厦门培训考试网:药品稳定性考察报告)。
产品稳定性考察管理制度

一、目的:为规范产品稳定性考察工作,掌握产品质量情况,特制订本制度。
二、适用范围:公司新产品或进行重大工艺改进后的老产品。
三、责任者:质管部四、内容:1.稳定性考察的范围1.1.新产品正式投产后生产的头3批产品。
1.2.处方/工艺或原辅材料发生重大变更后的头3批产品。
1.3.生产中出现偏差后通过采取补救措施而生产出来的成品。
1.4.常规生产的每个品种每年应考察1至3批:每年生产少于10批:考察1批。
(如当年没有生产,则可以不考察)每年生产少于10~25批:考察2批。
每年生产多于25批:考察3批。
1.5.其他需要进行稳定性考察的产品。
2.稳定性考察重点项目、条件及周期。
2.1.稳定性重点考察项目。
2.2.考察条件及周期2.2.1.影响因素试验:在新产品中试放大后,正式生产前,取1批进行。
2.2.2.加速试验:采用市售包装,置温度40℃±2℃,相对湿度75%±5%,恒温恒湿箱中放置6个月,在第1、2、3、6个月末分别取样一次,按其考察项目进行检测,与第一次成品检验结果对比,如果6个月内供试品经检测不符合制定的质量标准,则应在中间条件下即温度30℃±2℃,相对湿度65%±5%的条件下进行加速试验,时间仍为6个月。
2.2.3.长期试验:采用市售包装,置温度30℃±2℃,相对湿度65%±5%,恒温恒湿箱中放置36个月,分别于3、6、9、12、18、24、36个月取样检测,与第一次成品检验结果对比。
2.3.产品的稳定性考察及检测周期原则上按“2.1”及“2.2”规定执行,但新产品试制项目组可根据具体品种情况确定具体考察项目及检测周期(列入新产品试制方案中),经公司技术负责人批准后执行。
新产品的稳定性考察工作,除要求检验人员做好详细的实验记录外,每批产品还应填写产品留样观察记录。
3.稳定性考察信息的反馈3.1.正常情况下,当连续三批产品的半年稳定性考察结果出来后,检测人员应写出稳定性分析报告报质管部、生产部。
产品稳定性考察方案

产品稳定性考察方案一、引言产品的稳定性对于企业来说是非常重要的,它关系着产品的性能、质量以及用户体验。
本文将介绍一种产品稳定性考察方案,以帮助企业提高产品的稳定性和可靠性。
二、背景分析产品的稳定性是指产品在正常使用过程中能够保持良好的性能和功能,不会出现频繁的故障或异常情况。
稳定性可以通过多种因素进行考察,包括产品设计、材料选择、生产工艺、环境适应性等。
三、考察内容1. 设计优化在产品的设计过程中,需要充分考虑各种使用场景和用户需求,通过优化设计来提高产品的稳定性。
例如,合理的结构设计和材料选择可以减少零件的磨损和腐蚀,从而延长产品的使用寿命。
2. 材料质量检测材料质量是产品稳定性的重要因素之一。
在生产过程中,需要进行材料质量的检测和筛选,确保所使用的材料符合产品的要求。
例如,电子产品中使用的电子元件需要符合相关的标准和规范,以确保产品的稳定性和可靠性。
3. 加工工艺控制加工工艺是产品生产过程中的关键环节,对产品的稳定性有着重要影响。
通过严格控制加工工艺,可以减少生产过程中的误差和偏差,提高产品的一致性和稳定性。
4. 环境适应性测试产品在使用过程中会面临各种各样的环境条件,包括温度、湿度、震动等因素。
为了保证产品在不同环境下的稳定性,需要进行环境适应性测试。
通过模拟真实的使用环境,测试产品在不同条件下的性能和功能,以评估产品的稳定性。
5. 故障分析与改进在产品使用过程中,难免会出现故障和问题。
为了提高产品的稳定性,需要进行故障分析并及时采取改进措施。
通过分析故障原因,找出问题的根源,从而优化产品设计和加工工艺,提高产品的稳定性和可靠性。
四、考察方法1. 数据收集需要收集产品开发和生产过程中的相关数据,包括设计方案、材料测试报告、加工工艺控制记录等。
通过分析这些数据,可以了解产品的设计和生产过程是否满足稳定性的要求。
2. 现场考察需要实地考察生产厂家的生产工艺和设备情况,观察产品的生产过程,并与厂家的技术人员进行交流和沟通。
稳定性考察报告

稳定性考察报告1. 引言稳定性考察是对系统、设备或软件在长期运行过程中的稳定性能力进行评估和测试的过程。
稳定性考察报告旨在分析系统的可靠性,找出系统中的缺陷和薄弱环节,并提供改进和优化的建议。
本文档将针对某一特定系统的稳定性进行考察分析,并提供相应的报告。
2. 背景2.1 系统描述我们考察的系统是一个大型电子商务平台,其主要功能包括商品浏览、购买、支付以及评价等。
该系统由多个子系统组成,包括前端展示、订单管理、支付系统、库存管理等。
系统以分布式架构进行设计,并且采用了容器化部署技术。
2.2 考察目的通过稳定性考察,我们的目的是评估该系统在实际场景下的稳定性能力,发现潜在问题,并提出改进和优化的建议。
3. 稳定性考察方法3.1 环境准备为了对系统的稳定性进行考察,我们需要在真实环境中进行测试。
为此,我们搭建了一套与生产环境相似的测试环境,并使用了真实的数据。
3.2 测试方案我们采取了以下测试方案,对系统的稳定性进行考察:1.负载测试:通过模拟多个用户同时操作系统,并增加负载,以测试系统在高并发条件下的稳定性。
2.异常用例测试:针对系统的各个子系统和关键功能,设计一系列异常用例,检验系统在异常情况下的稳定性表现。
3.长时间运行测试:让系统在高负载条件下连续运行一段时间,观察系统是否会出现异常情况,评估系统的长时间稳定性。
4.容量规划测试:通过增加负载的方式,测试系统在不同容量下的性能表现和稳定性。
5.异常恢复测试:模拟系统异常宕机、断电等情况,测试系统的自动恢复能力和稳定性。
3.3 测试工具在测试过程中,我们使用了以下工具来辅助测试:•JMeter:用于进行负载测试,模拟多个用户同时访问系统。
•Selenium:用于自动化测试,模拟用户对系统进行操作。
•Docker:用于容器化部署,方便快速搭建测试环境。
4. 稳定性考察结果在测试过程中,我们记录了系统的稳定性表现,并发现了一些问题和薄弱环节。
以下是我们的考察结果:•在高并发条件下,系统的响应时间明显增加,甚至出现了服务器崩溃的情况。
留样、稳定性考察等概念

主要针对每批市售产品和工艺中涉及的物料
1、产品研发阶段(影响因素实验、加速实验、市售包装实验)2批准产品首次生产三批、3、中间产品(确定中间产品贮存期限)、包装材料变更3、返工或回收时
考察时间检验频次
1、保存至药品有效期后一年2、用于制剂生产的原辅料至少保存至产品放行后二年3、每年观察一次
留样、稳定性考察、持续稳定考察比较
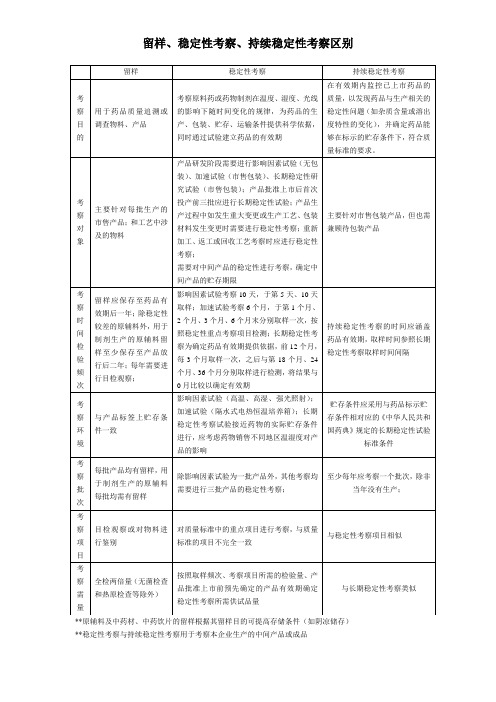
留样
稳定性考察
持续稳定考察
考察目的
用于药品质量追溯或调查物料、产品
考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过实验检验建立药品的有效期
在有效期内监视已上市的药品,以发现药品与生产相关的稳定性问题,并确定药品能够在标示的贮存条件下符合质量标准要求。
1、影响因素考察:5天、10天取样一次2、加速实验考察1、2、3、6个月分别取样一次3、长期稳定性考察0、3、6、9、12、18、24、36个月。
药品有效期内,取样时间同长期稳定性考察
考察环境
与产品标签上贮存条件一致
同药典规定
贮存条件恒温25℃±2℃;相对湿度60%±10%
考察批次
每批产品、每批原辅料
1、影响因素实验:1批2、其他:3批
至少每年考察一批
备注
每批留样
药品稳定性考察方案

药品稳定性考察方案简介药品稳定性考察是指对药物在一定条件下的物理、化学和微生物变化进行评估的过程。
药品稳定性的考察是制药行业中非常重要的一步,能够确保药品在保存期间能够保持其质量和有效性,从而保证患者的安全和药物的疗效。
本文档将介绍药品稳定性考察的方案,包括稳定性研究的目的、研究方法、评估指标等方面的内容。
目的药品稳定性考察的主要目的是评估药物在一定条件下的稳定性,并确定药物的保存期限。
通过稳定性考察,可以有效预测药物品质的变化情况,并为制药企业提供稳定性数据和保存期限的依据。
研究方法稳定性考察可以分为长期稳定性研究和加速稳定性研究两种方法。
长期稳定性研究长期稳定性研究是指在常温、湿度和光照条件下对药物进行一定时间的保存,并经过一定时间间隔进行质量评估。
长期稳定性研究的时间范围通常在2-5年之间,取决于药品的性质和预期的保存期限。
加速稳定性研究加速稳定性研究是通过模拟加速条件,如高温、高湿、光照等,来快速评估药品在一定时间内的质量变化情况。
加速稳定性研究的时间范围通常在3-6个月之间,结果可以用于预测药物在长期储存条件下的稳定性。
评估指标在药品稳定性考察中,有一些常用的评估指标可以用于评估药物的稳定性。
物理稳定性物理稳定性是指药物在保存期间物理性质的变化情况。
包括药物外观、颜色、溶解性、凝胶形成、重金属析出等指标。
这些指标可以通过目测、光谱法、显微镜等方法进行评估。
化学稳定性化学稳定性是指药物在保存期间化学性质的变化情况。
包括主要成分的含量变化、杂质的生成、药物分解等指标。
这些指标可以通过色谱法、质谱法、紫外分光光度法等方法进行评估。
微生物稳定性微生物稳定性是指药物在保存期间微生物附着和生长情况。
微生物的附着和生长可能导致药物的变质和污染。
这些指标可以通过菌落计数方法、微生物染色法等方法进行评估。
结论药品稳定性考察方案对于保证药物的质量和有效性具有重要的作用。
通过稳定性考察,可以有效预测药品在保存期间的变化情况,并为制药企业提供稳定性数据和保存期限的依据。
留样、稳定性考察、持续稳定性考察区别
考察环境
与产品标签上贮存条件一致
影响因素试验(高温、高湿、强光照射);加速试验(隔水式电热恒温培养箱);长期稳定性考察试验接近药物的实际贮存条件进行,应考虑药物销售不同地区温湿度对产品的影响
贮存条件应采用与药品标示贮存条件相对应的《中华人民共和国药典》规定的长期稳定性试验标准条件
考察对象
主要针对每批生产的市售产品;和工艺中涉及的物料
产品研发阶段需要进行影响因素试验(无包装)、加速试验(市售包装)、长期稳定性研究试验(市售包装);产品批准上市后首次投产前三批应进行长期稳定性试验;产品生产过程中如发生重大变更或生产工艺、包装材料发生变更时需要进行稳定性考察;重新加工、返工或回收工艺考察时应进行稳定性考察;
留样
稳定性考察
持续稳定性考察
考察目的
用于药品质量追溯或调查物料、产品
考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期
在有效期内监控已上市药品的质量,以发现药品与生产相关的稳定性问题(如杂质含量或溶出度特性的变化),并确定药品能够在标示的贮存条件下,符合质量标准的要求。
考察批次
每批产品均有留样,用于制剂生产的原辅料每批均需有留样
除考察;
至少每年应考察一个批次,除非当年没有生产;
考察项目
目检观察或对物料进行鉴别
对质量标准中的重点项目进行考察,与质量标准的项目不完全一致
与稳定性考察项目相似
考察需量
全检两倍量(无菌检查和热原检查等除外)
按照取样频次、考察项目所需的检验量、产品批准上市前预先确定的产品有效期确定稳定性考察所需供试品量
年度稳定性考察总结(3篇)

第1篇一、前言随着我国社会经济的快速发展,各行各业对电力系统的稳定性要求越来越高。
为了确保电力系统安全、稳定、高效地运行,本年度我们组织了对电力系统的稳定性考察。
现将考察情况及总结如下:一、考察背景1. 国家政策要求:近年来,国家高度重视能源安全,要求各地加强电力系统稳定性考察,确保电力供应安全可靠。
2. 电力系统发展需求:随着电力系统规模的不断扩大,对稳定性的要求也越来越高,有必要对现有电力系统进行稳定性考察。
3. 应对突发事件:针对电力系统可能出现的突发事件,开展稳定性考察,有利于提前发现并消除安全隐患。
二、考察内容1. 电力系统结构及设备状况:对电力系统中的发电厂、变电站、输电线路等关键设备进行实地考察,了解其运行状况。
2. 电力系统运行数据:收集并分析电力系统运行数据,评估其稳定性。
3. 应急预案及应对措施:了解电力系统应急预案及应对措施,评估其有效性。
4. 电力市场及供需状况:分析电力市场及供需状况,评估电力系统稳定性。
三、考察结果1. 电力系统结构合理,设备运行状况良好,整体稳定性较高。
2. 电力系统运行数据稳定,未发现明显异常。
3. 应急预案及应对措施完善,能够有效应对突发事件。
4. 电力市场供需基本平衡,电力系统稳定性较好。
四、存在问题及改进措施1. 存在问题:部分电力设备老化,存在安全隐患;部分应急预案及应对措施不够完善。
2. 改进措施:加大设备更新改造力度,提高设备运行稳定性;完善应急预案及应对措施,提高应对突发事件的能力。
五、总结本年度电力系统稳定性考察结果表明,我国电力系统整体稳定性较高,但仍存在一定的问题。
为确保电力系统安全稳定运行,我们将继续加强以下工作:1. 加大设备更新改造力度,提高设备运行稳定性。
2. 完善应急预案及应对措施,提高应对突发事件的能力。
3. 加强电力市场监测,确保电力供需平衡。
4. 深入开展电力系统稳定性研究,为电力系统安全稳定运行提供技术支持。
通过本次年度稳定性考察,我们进一步掌握了电力系统运行状况,为今后的工作提供了有力依据。
产品稳定性考察方案

产品稳定性考察方案一、背景介绍随着市场竞争的加剧,企业对于产品稳定性的要求越来越高。
产品稳定性是指产品在一定环境和使用条件下能够长时间保持正常运行和性能表现的能力。
为此,本文将针对产品稳定性进行考察,并提出相应的方案。
二、考察内容及方法1. 考察目标:分析产品在长时间使用中的稳定性表现,包括硬件、软件以及整体系统的稳定性。
2. 考察内容:a. 硬件稳定性:通过检测产品的物理部件,包括电路板、电源、电容电阻等的稳定性,以及产品在不同温度、湿度、振动等环境条件下的可靠性。
b. 软件稳定性:测试产品的软件系统,包括操作系统、应用程序等的稳定性,并关注在不同使用场景下的稳定性表现。
c. 系统稳定性:通过模拟实际使用场景,对产品进行全面的稳定性测试,包括功能稳定性、性能稳定性、安全稳定性等方面的考察。
3. 考察方法:a. 实验室测试:在控制条件下,通过模拟不同环境、工作负载等情况,对产品进行稳定性测试,并记录相应数据。
b. 用户反馈:收集用户使用产品后的反馈意见,关注产品在长时间使用过程中出现的问题,并进行统计分析。
c. 专业评估:请专业的第三方机构进行产品稳定性的评估,以获取更客观的结果。
d. 考察报告:汇总所有考察结果,并形成详细的考察报告,审视产品的稳定性状况,并提出改进建议。
三、考察方案执行步骤1. 确定考察目标和内容,并设计相应的测试计划。
2. 按照测试计划,进行实验室测试,记录并分析测试数据。
3. 收集用户使用产品的反馈意见,并进行数据分析。
4. 委托专业机构对产品进行评估,并结合实验室测试和用户反馈,形成综合评估结果。
5. 汇总各项考察结果,形成考察报告。
6. 根据考察报告,给出产品稳定性改进的建议,并进行优化。
四、考察结果的意义1. 了解产品的稳定性问题,及时采取措施修复和改进,提高产品质量和用户满意度。
2. 预防产品稳定性问题的发生,降低维修和售后成本。
3. 供应链管理的重要参考,选用稳定性较好的产品,降低风险。
持续稳定性考察报告

持续稳定性考察报告持续稳定性考察报告篇一:稳定性考察范本一、目的:为公司新产品以及合同加工产品确定有效期和贮存运输条件提供科学依据;对公司产品以及合同加工产品进行持续稳定性考察,以监控在有效期内药品的质量;由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。
二、适用范围:适用于公司新产品和合同加工产品的投产稳定性考察、公司产品和合同加工产品的持续稳定性考察、由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。
三、责任:质量保证部、质量检验部。
四、内容:1.产品稳定性考察的一般规定1.1产品稳定性考察分类1.1.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察;1.1.2为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察;1.1.3由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。
1.1.3.1重大变更或生产和包装有重大偏差的药品;1.1.3.2任何采用非常规工艺重新加工、返工、或有回收操作的批次;1.1.3.3改变主要物料供应商时所作验证的批次。
1.2产品稳定性考察样品批次的规定1.2.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察,这种情况的稳定性考察需要连续试制的三批样品;1.2.2公司新产品和合同加工产品正常批量生产的最初三批产品应列入持续稳定性考察计划,以进一步确认有效期。
1.2.3为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察批次按产品不同规格每年考察一批,除当年没有生产外。
所考察批次采取随机抽取的方式;1.2.4重大变更或生产和包装有重大偏差的药品批次;1.2.5任何采用非常规工艺重新加工、返工、或有回收操作的批次;1.2.6改变主要物料供应商时所作验证的批次。
1.2.7有效期短的原料药,在进行稳定性考察时应适当增加检验频次。
1.3关键人员,尤其是质量受权人,应了解持续稳定性考察的结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
资料项目编号(十)生产申请五层共挤输液用袋与采用申报产品包装的药品同时进行的(稳定性试验)药物相容性试验研究资料试验单位:XXXXX药业有限责任公司试验者:XXX XXX试验起止日期:2009年10月—2010年10月原始资料保存地点:XXXXX药业有限责任公司联系人:XXX电话:027-XXX地址:XXX药包材注册申请人:XXXXX药业有限责任公司申报日期:二〇一一年一月目录一、相容性试验用袋及样品1、相容性试验用袋2、外包袋的选择、选择依据及质量控制3、相容性试验样品及对照品二、相容性试验用仪器、设备三、相容性试验条件1、加速试验2、长期试验3、特别要求试验4、模拟恶劣运输、贮存环境的试验5、光照试验(没检测数据不用写上去)6、浸水试验(没检测数据不用写上去)四、相容性试验考察项目及方法1、检测项目2、检测方法及方法依据五、相容性试验结果1、葡萄糖注射液相容性试验结果2、氯化钠注射液相容性试验结果六、相容性试验结论七、迁移性试验资料一、相容性试验用袋及样品1、相容性试验用袋本试验所用袋均是采用江苏博生医用新材料股份有限公司的五层共挤输液用膜制成的输液用袋。
1.1 试验用输液用袋的组成材料――五层共挤输液用膜、口管、组合盖来源及配方1、膜材的来源:江苏博生医用新材料股份有限公司提供的五层共挤输液用膜膜材的配方:第一层(内层,封口层)聚丙烯,苯乙烯、乙烯、丁烯共聚物第二层聚丙烯,苯乙烯、乙烯、丁烯共聚物第三层聚丙烯,苯乙烯、乙烯、丁烯共聚物第四层乙烯甲基丙烯酸脂共聚物第五层多酯共聚物该膜已取得《药品包装用材料和容器注册证》,注册证号:国药包字20100086。
2、口管的来源:江苏金扬子包装科技有限公司提供的塑料输液容器用聚丙烯接口,该公司已取得药品包装用材料和容器注册证,注册证号:国药包字20050391。
3、组合盖:江苏金扬子包装科技有限公司提供的塑料输液容器用聚丙烯组合盖(拉环式),该公司已取得药品包装用材料和容器注册证,注册证号:国药包字200503921.2膜材的质量标准及质量控制江苏博生医用新材料股份有限公司提供的五层共挤输液用膜膜材符合该公司的企业标准Q/BS-02-2008。
1.3输液用袋的生产质量标准及质量控制采用江苏博生医用新材料股份有限公司提供的五层共挤输液用膜膜材,按申报资料7所述工艺,进行输液用袋的生产,其袋的质量应符合本公司企业标准7QB--006的规定。
按本公司企业标准7QB--006对三批输液用袋进行检验,检验结果均符合要求,见申报资料9:五层共挤输液用袋检验报告。
2、外包袋的选择、选择依据及质量控制外包袋选择:顶膜PET/CPP 12/75μm,底膜CPP150μm。
选择依据为:国外使用情况以及试验情况。
质量控制根据:国外企业质量控制办法3、相容性试验样品及对照品3.1试验样品采用江苏博生医用新材料股份有限公司提供的三批五层共挤输液用膜制袋按申报资料7所述工艺,生产灌装葡萄糖注射液(规格:100ml:10g)、氯化钠注射液(规格:100ml:0.9g),在121℃,灭菌15分钟,作为相容性试验样品,采用三批包材包装一批药品来考察,具体如下:3.2 试验用对照品水中铜标准溶液国家标准物质研究中心水中镉标准溶液国家标准物质研究中心水中铬标准溶液国家标准物质研究中心水中铅标准溶液国家标准物质研究中心水中锡标准溶液国家标准物质研究中心水中钡标准溶液国家标准物质研究中心水中铝标准溶液国家标准物质研究中心二、相容性试验用仪器、设备红外分光光度计FTIR-84005 (SHIMADZU)紫外分光光度计T6新世纪(北京普析通用仪器有限责任公司)原子吸收光度计AA 320 CRT (上海精密科学仪器有限公司)旋光仪WZZ-1 (上海精密科学仪器有限公司)pH计pHS-3C (上海虹益仪器厂)电子拉力试验机RGD (广州标际包装设备有限公司)恒温恒湿箱HWS-320 (上海晨泉电子科技有限公司)热封仪RFY-03(济南三泉中石实验仪器有限公司)智能微粒检测仪GWJ-4(天津市天大天发科技有限公司)低温冰箱DW-FL135(郑州南北仪器设备有限公司)箱式节能电阻炉SX2-4-10(湖北英山建力电驴制造有限公司)水浴锅HW-2(北京医疗设备总厂)蒸汽灭菌器YM50(上海三申医疗器械有限公司)数显电热鼓风干燥箱GZX-9246MBE(上海博讯实业有限公司)生化培养箱HP1000S(武汉华超电子仪器设备有限公司)单人净化工作台CD-1J(天津泰斯特有限公司)三、相容性试验条件1、加速试验试验条件:温度40℃±2℃、相对湿度20%±2%;试验时间:6个月,于0、1、2、3、6月取样检测。
2、长期试验试验条件:温度25℃±2℃、相对湿度60%±10%。
试验时间:12个月,于0、3、6、9、12月取样检测;3、特别要求试验条件:温度25℃±2℃、相对湿度20%±5%。
时间:6个月,于0、1、2、3、6月取样检测,考察水分逸出。
4、模拟恶劣运输、贮存环境的试验条件:①-18℃、②55℃30%相对湿度、③25℃90%相对湿度取样品于上述条件下分别放置72小时后,检查外观色泽、pH、含量等。
5、光照试验(没检测数据,不用写上去)于4500±500Lx放置10天,第5天和第10天取样,检查外观色泽、pH、含量等。
6、浸水试验(没检测数据,不用写上去)取样品分别于水中放置30分钟,暴露4小时后检查外观色泽、pH、含量等。
四、相容性试验考察项目及方法1、检测项目1.1考察包材(1)加速试验及长期试验考察项目包括:外观;灭菌适应性试验:包括温度适应性,抗跌落,透明度,不溶性微粒;使用适应性试验:包括穿刺力,穿刺器保持性和插入点不渗透性,注药点密封性,悬挂力测定;物理性能:热合强度;透光率;炽灼残渣;金属元素;溶出物试验:澄清度,颜色,pH值,紫外吸收度,不挥发物,易氧化物,铵离子,钡离子,铜离子,镉离子,铅离子,锡离子,铬离子,铝离子,重金属,泡沫试验;细菌内毒素。
(2)特别要求试验用称重法测定水分的逸出。
1.2 考察药物取经加速试验及长期试验条件放置的带包装容器的三批药物,取出药物,按中国药典2005版二部各品种项下的检测要求,进行性状、含量、pH值、可见异物、无菌检测、5-羟甲基糠醛、重金属、细菌内毒素。
(还有鉴别、不溶性微粒、装量没做)2、检测方法及方法依据(特别试验检验依据?)中国药典2005版二部XXXX药业有限责任公司企业标准7QB--006五、相容性试验结果试验结果如下表所示,附于资料后。
其中样品平放时的检查数据为表1---表12;样品倒置时的检查数据为表13---表24。
(一)样品平放检查数据1、葡萄糖注射液与五层共挤输液用袋相容性试验结果1.1加速试验结果表1 葡萄糖注射液包材加速试验测定结果表1-1 不溶性微粒测定结果表1-2 使用适应性试验结果表1-3 溶出物试验结果表1-4 溶出物试验结果表1-5 溶出物试验结果表2 葡萄糖注射液药液加速试验测定结果1.2长期试验结果表3 葡萄糖注射液包材长期试验测定结果表3-1 不溶性微粒测定结果表3-2 使用适应性试验结果表3-3 溶出物试验结果表3-4 溶出物试验结果表3-5 溶出物试验结果表4 葡萄糖注射液药液长期试验测定结果1.3 特别要求试验结果表5 葡萄糖注射液特别要求试验结果1.4 模拟恶劣运输和贮存环境试验结果表6 葡萄糖注射液模拟恶劣运输和贮存环境试验结果2、氯化钠注射液与五层共挤输液用袋相容性试验结果2.1加速试验结果表7 氯化钠注射液包材加速试验测定结果表7-1 不溶性微粒测定结果表7-2 使用适应性试验结果表7-3 溶出物试验结果表7-5 溶出物试验结果表8 氯化钠注射液药液加速试验测定结果2.2长期试验结果表9 氯化钠注射液包材长期试验测定结果表9-1 不溶性微粒测定结果表9-2 使用适应性试验结果表9-3 溶出物试验结果表9-4 溶出物试验结果表9-5 溶出物试验结果表10 氯化钠注射液药液长期试验测定结果2.3 特别要求试验结果表11 氯化钠注射液特别要求试验结果2.4 模拟恶劣运输和贮存环境试验结果表12 氯化钠注射液模拟恶劣运输和贮存环境试验结果(二)样品倒置检查数据1、葡萄糖注射液与五层共挤输液用袋相容性试验结果1.1加速试验结果表13 葡萄糖注射液包材加速试验测定结果表13-1 不溶性微粒测定结果表13-2 使用适应性试验结果表13-3 溶出物试验结果表13-4 溶出物试验结果表13-5 溶出物试验结果表14 葡萄糖注射液药液加速试验测定结果1.2长期试验结果表15 葡萄糖注射液包材长期试验测定结果表15-1 不溶性微粒测定结果表15-2 使用适应性试验结果表15-4 溶出物试验结果表15-5 溶出物试验结果表16 葡萄糖注射液药液长期试验测定结果1.3 特别要求试验结果表17 葡萄糖注射液特别要求试验结果1.4 模拟恶劣运输和贮存环境试验结果表18 葡萄糖注射液模拟恶劣运输和贮存环境试验结果2、氯化钠注射液与五层共挤输液用袋相容性试验结果2.1加速试验结果表19 氯化钠注射液包材加速试验测定结果表19-1 不溶性微粒测定结果表19-2 使用适应性试验结果表19-3 溶出物试验结果表19-4 溶出物试验结果表19-5 溶出物试验结果表20 氯化钠注射液药液加速试验测定结果2.2长期试验结果表21 氯化钠注射液包材长期试验测定结果表21-1 不溶性微粒测定结果表21-2 使用适应性试验结果表21-3 溶出物试验结果表21-4 溶出物试验结果表21-5 溶出物试验结果表22 氯化钠注射液药液长期试验测定结果2.3 特别要求试验结果表23 氯化钠注射液特别要求试验结果2.4 模拟恶劣运输和贮存环境试验结果表24 氯化钠注射液模拟恶劣运输和贮存环境试验结果六、相容性试验结论由试验结果表明,采用江苏博生医用新材料股份有限公司五层共挤输液用膜制成输液用袋包装的葡萄糖注射液、氯化钠注射液,经加速试验6个月及长期试验12个月考察,其内容物的各项指标均未见明显改变;在特别要求试验中,经6个月考察,葡萄糖注射液的水分逸出约为0.56%,氯化钠注射液水分逸出约为0.62%。
试验结束后,对输液用袋包装进行查看,观察输液袋外观,没有发现异常。
经相容性试验,输液袋的透明度,完整性,温度适用性,抗跌落性能,使用适应性,穿刺力,密封性,溶出物等与试验前的检测结果对比均没有变化。
试验结果表明,本公司生产的葡萄糖注射液、氯化钠注射液对江苏博生医用新材料股份有限公司五层共挤输液用膜制成的输液用袋的质量没有影响。
结论本公司生产的葡萄糖注射液、氯化钠注射液在加速试验条件下存放6个月和在长期试验条件下存放12个月,各项检查结果均符合中国药典2005版二部的规定。
