有机苯乙醚的制备
乙醚的制备有机实验原理

乙醚的制备有机实验原理
乙醚在实验室中可以通过醇的脱水反应制备。
一种常用的方法是通过硫酸催化下醇的缩水反应。
具体的实验步骤如下:
1. 在干净的干燥胶皿中,加入适量的醇(如乙醇)。
2. 将胶皿放入冷水中,使其保持低温。
可以加入冰块来降低温度,以防止醇的挥发。
3. 在醇中滴加少量的浓硫酸,并用玻璃棒搅拌均匀。
硫酸作为催化剂可以促使脱水反应进行。
4. 继续加热醇溶液,并不断搅拌。
加热的目的是在加速脱水反应的同时也有助于乙醚的挥发。
5. 当观察到反应产生大量气体冒泡并有乙醚气味散发时,即表示乙醚生成。
6. 控制反应温度和时间,避免乙醚过度分解或挥发损失。
需要注意的是,这个实验过程中要注意安全,因为乙醚具有易燃和挥发性的特点。
实验室中应该进行适当的防护,如在通风良好的实验室中操作,避免乙醚的蒸气接触明火或其他易燃物质。
有机化合物的制备实验

第三章&有机化合物的制备实验实验十环己烯的制备一、实验目的1.学习环己醇在酸催化作用下分子内脱水制备环己烯的原理和方法。
2.了解分馏原理及其基本操作。
二、实验原理醇在脱水剂作用下分子内脱去一分子水而形成烯烃。
主反应:OH85%+H O342副反应:OH34+H O22O三、仪器与试剂仪器:图1.8分馏装置和图1.6普通蒸馏装置。
试剂:环己醇 10g(10.4mL,0.1mol),85% 磷酸 5mL,氯化钠 1g,无水氯化钙 1~2g,5%碳酸钠溶液 4mL 。
四、实验步骤在50mL 干燥的圆底烧瓶中,分别加入 10g 环己醇(10.4mL)(1),5mL85% 磷酸(2),充分摇荡使两种液体混合均匀。
投入几粒沸石,按图1.8安装好分馏装置。
用小锥形瓶作接收器,置于冷水浴中。
用小火慢慢加热混合物至沸腾,以较慢速度进行蒸馏,控制分馏柱顶部温度不超过73℃(3)。
当无液体蒸出时,可适当加大火源,继续蒸馏。
当温度达到 85℃时,停止加热,馏出液为环己烯和水的浑浊液。
在馏出液中分批加入约 1g 食盐,使之饱和。
再加入 3~4mL5% 的碳酸钠溶液,以中和其中的微量酸。
然后,将上述液体倒入分液漏斗中,振荡后静止分层。
分出下面的水层,将有机层转入干燥的小锥形瓶中,加入适量无水氯化钙将其干燥(4)。
将干燥后澄清透明的粗环己烯滤入 30mL 蒸馏瓶中,加入几粒沸石,加热蒸馏收集80℃~85℃馏分。
所用的蒸馏装置必须是干燥的。
产量:4~5g 。
1.4465。
环己烯的红外光谱图见图3.1。
纯环己烯为无色透明液体,沸点 83℃,n20D有 机 化 学 实 验本实验约需 4h 。
图3.1 环己烯的红外光谱图五、注释(1)环己醇在常温下是粘稠液体,如果用量筒量取,约 12.4mL ,应注意转移过程中的损失。
也可用称量法称取。
(2)脱水剂用磷酸或硫酸均可。
磷酸的用量是硫酸用量的 2 倍。
但用磷酸的好处一是反应中不生成碳渣,二是反应中无刺激性气体生成。
苯乙醚
一、实验目的
1、掌握Williamson 合成法制备醚的原理和方法。
2、进一步熟悉机械搅拌、分液等基本操作。
二、实验原理
通过Williamson 合成法由溴乙烷和苯酚钠作用制备苯乙醚。
其基本反应式为:
OH
++H O 2
NaOH
Na
O NaBr
CH 3CH 2Br
+
Na
O CH 2CH 3
+
三、主要试剂及物理性质
表1 物性常数
四、试剂用量规格
实验试剂:苯酚7.89g ,氢氧化钠 4g (0.l mol ),溴乙烷8.5mL (0.12mol ),水24ml ,饱和氯化钠16ml ,无水氯化钙。
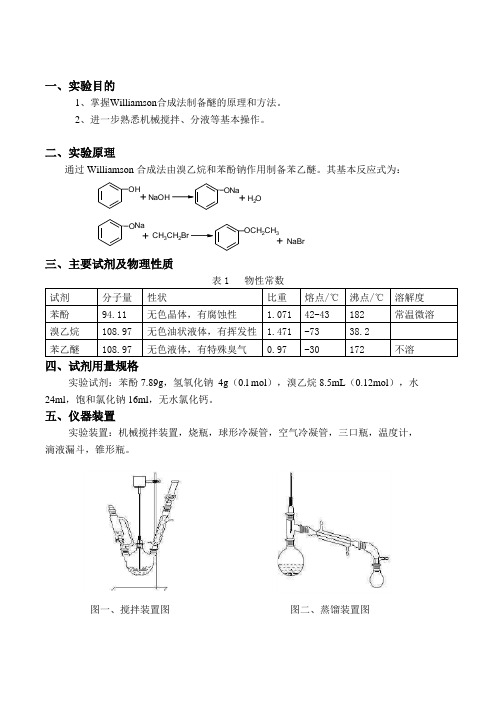
五、仪器装置
实验装置:机械搅拌装置,烧瓶,球形冷凝管,空气冷凝管,三口瓶,温度计,滴液漏斗,锥形瓶。
图一、搅拌装置图 图二、蒸馏装置图
七、实验结果
理论值=7.89÷94.11×108.97÷0.97=9.478ml
实际值=23×8÷46.7=3.940ml
产率=3.940/9.478×100%=41.57%
八、实验讨论
数据分析:产率偏低,但是产物比较清澈。
产率偏低的可能原因:
1、可能在刚开始时滴加溴乙烷速度控制不当,滴加过快,导致反应不完全,从
而使产率偏低;
2、在分液使油层有损失;
3、反应时,NaOH附在烧瓶壁上没有完全参与反应。
注意事项:
1、反应阶段控制溴乙烷的滴加速度,不能太快;
2、反应阶段的三口瓶和滴液漏斗、蒸馏阶段装置要事先干燥。
碘化钾作用下芳香醚的合成

碘化钾作用下芳香醚的合成巩海鹏,付国瑞,王幸宝【摘要】摘要:研究了以苯酚或萘酚为原料、溴代烷烃为烷基化试剂、KI催化作用下芳香醚的制备方法。
在相似的实验条件下合成了苯乙醚、正丁基苯基醚、β-萘乙醚、β-萘正丁基醚。
以正丁基苯基醚的合成为例,设计了正交实验考察反应温度、时间、催化剂用量对反应的影响,优选出较佳反应条件:反应温度80℃,反应时间2h,碘化钾1.0g。
表征产物的结构发现,其熔沸点数值及红外谱图与参考文献相符。
【期刊名称】甘肃科技【年(卷),期】2012(028)017【总页数】3【关键词】关键词:有机合成;碘化钾;芳香醚;正交实验芳香醚是一类重要的有机合成中间体,广泛应用于农药、染料等一系列精细化工产品的合成中[1-4]。
比如正丁基苯基醚是制造香料、杀虫剂和医药的原料[5];而β-萘乙醚又叫橙花素,是一种合成香料,与β-萘甲醚相比性质更稳定,能和其他香料化合物调和,效果良好,因此广泛用于肥皂和化妆品中作为香料,还可做玫瑰香、柠檬香等香料的定香剂[6]。
目前对芳香醚的合成方法研究逐渐受到人们的重视。
樊能廷[7]研究了用苯酚或萘酚与醇钠作用生成酚钠,后与溴丁烷反应制备芳香醚的方法,该法需要用金属钠与乙醇作用制备醇钠,成本高,危险性大。
近年来文献报道了利用季铵盐、聚乙二醇[8-9]或三乙醇胺[1,10]为相转移催化剂合成芳香醚的方法,虽然反应时间缩短了,但催化剂的来源受到限制。
研究表明,碘化钾在亲核取代反应中具有一定的催化作用,而且碘化钾价廉易得、毒性小、对环境污染小[11]。
因此探索了以苯酚、β-萘酚为原料,溴乙烷和正溴丁烷为烷基化试剂,KI催化作用下制备苯乙醚、正丁基苯基醚、β-萘乙醚、β-萘正丁基醚的方法。
1 实验部分1.1 芳香醚的合成1.2 仪器与试剂红外光谱用Digilab Merlin FT-IR光谱仪测定,KBr压片;熔点由XT-4显微熔点仪测定,温度计未校正。
丁醇、乙醇、氢氧化钾、碘化钾、浓硫酸、β-萘酚、溴化钠、苯酚(以上试剂均为分析纯);溴乙烷、正溴丁烷(自制)。
苯乙醚的制备

苯乙醚的制备一、危险性评估及相应防护措施苯酚危险性概述健康危害:苯酚对皮肤、粘膜有强烈的腐蚀作用,可抑制中枢神经或损害肝、肾功能。
急性中毒:吸入高浓度蒸气可致头痛、头晕、乏力、视物模糊、肺水肿等。
误服引起消化道灼伤,出现烧灼痛,呼出气带酚味,呕吐物或大便可带血液,有胃肠穿孔的可能,可出现休克、肺水肿、肝或肾损害,出现急性肾功能衰竭,可死于呼吸衰竭。
眼接触可致灼伤。
可经灼伤皮肤吸收经一定潜伏期后引起急性肾功能衰竭。
慢性中毒:可引起头痛、头晕、咳嗽、食欲减退、恶心、呕吐,严重者引起蛋白尿。
可致皮炎。
环境危害:对环境有严重危害,对水体和大气可造成污染。
燃爆危险:该品可燃,高毒,具强腐蚀性,可致人体灼伤。
防护及急救措施防护措施呼吸系统防护:可能接触其粉尘时,佩戴自吸过滤式防尘口罩。
紧急事态抢救或撤离时,应该佩戴自给式呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿透气型防毒服。
手防护:戴防化学品手套。
其它:工作现场禁止吸烟、进食和饮水。
工作毕,淋浴更衣。
单独存放被毒物污染的衣服,洗后备用。
保持良好的卫生习惯急救措施皮肤接触:立即脱去被污染的衣着,用甘油、聚乙烯乙二醇或聚乙烯乙二醇和酒精混合液(7:3)抹洗,然后用水彻底清洗。
或用大量流动清水冲洗,至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:立即给饮植物油15-30mL。
催吐。
就医。
溴乙烷危险性概述健康危害:会刺激肺部、眼睛和皮肤,可能引起头昏眼花、平衡失调,精神混乱,甚至昏迷和死亡,长期接触会损害肝、肾及心跳。
环境危害:醚味,蒸气比空气重会传播至远处,遇火源可能造成回火。
高温会分解生成刺激性的溴化氢及溴毒气。
主要症状:头昏眼花, 失去平衡, 胡言乱语, 意识不清。
防护措施吸入:立即把患者移到空气新鲜处。
苯乙醚的制备 2齐齐哈尔大学化学专业实验报告有机

齐齐哈尔大学实验报告题目:苯乙醚的制备学院:化学与化学工程学院专业班级:化学101 学生姓名:叶梦同组者姓名:何冰芯韩义军成绩:2013年 10 月 14 日苯乙醚的制备实验目的1、学习低沸点物质的取用,练习回流、蒸馏等基本操作2、通过制备苯乙醚,了解威廉门森醚合成法实验仪器三口瓶、回流冷凝管、漏斗、磁力搅拌实验药品苯酚、氢氧化钠、溴乙烷、饱和氯化钠水溶液、无水硫酸镁实验原理OH++H O 2NaOHNaO NaBrCH 3CH 2+NaO CH 2CH 3+主要试剂及物理性质试剂 分子量 性状 比重 熔点/℃ 沸点/℃ 溶解度苯酚 94.11 无色晶体,有腐蚀性 1.071 42-43 182 常温微溶 溴乙烷 108.97 无色油状液体,有挥发性 1.471 -73 38.2 苯乙醚 108.97 无色液体,有特殊臭气 0.97 -30 172 不溶表1 物性常数实验步骤取4.00g 氢氧化钠加入5mL 水溶解,将苯酚7.5g 和氢氧化钠溶液加入到装有搅拌器、回流冷凝管的100mL 三颈瓶中,加热并开搅拌装置,到温度上升至80~90℃时滴加溴乙烷6mL (滴加时一定要缓慢并调节好转子的速度),大约滴加1h ,,溴乙烷滴加完毕后再保温持续加热1.5 h ,停止加热,冷却,向三口瓶中加入10mL 的水,将其倒入100mL 分液漏斗中,分液,取上层液,加入5mL 的饱和氯化钠溶液洗涤两次,将洗涤好的上层液导入50mL 烧杯中,加入适量的无水硫酸镁进行干燥,将干燥好的液体倒入100mL 圆底烧瓶中进行蒸馏,收集160℃以上的馏分,产率为33.6%数据处理理论值=80mmol实际值=1.00ml==M m n M V ρ=16.12200.1967.0⨯=0.00791mmol 产率=%00989.0%1008000791.0=⨯mmolmmol注意事项1、滴加溴乙烷时要缓慢2、萃取分液时要注意基本要求,保留上层液体3、干燥时加入无水硫酸镁的量一定要适量,刚出现散落状时正合适4、蒸馏时蒸气温度稳定再开始收集,温度急剧下降后停止收集思考题1、反应过程中产生的白色固体是什么?答:有可能是氯化钠、也有可能把未反应的苯酚也蒸馏出来了,苯酚冷却后是无色晶体。
苯乙醚的制备
一、实验目的
1.通过苯乙醚的制备,了解Williamson合成法的原理及方法。
2.进一步熟悉蒸馏、分液等操作技术。
二、实验原理
C6H5OH+CH3CH2Br→C6H5OCH2CH3
三、主要试剂物理性质及用量规格
试剂用量
试剂物理性质
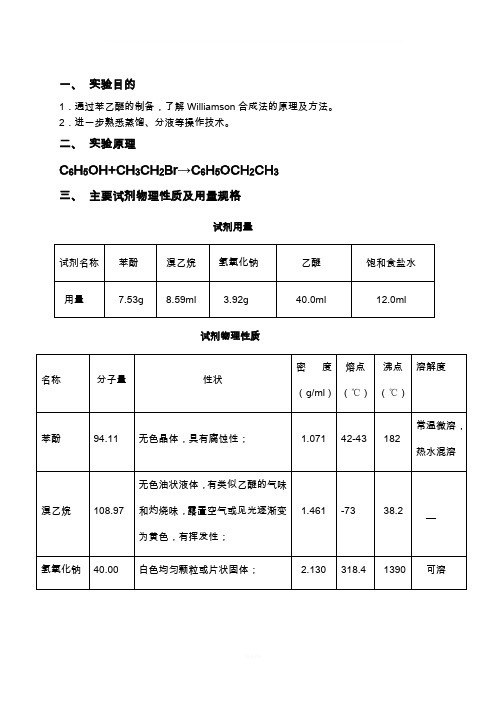
四、实验仪器及装置
仪器:三颈烧瓶(150mL)、球形冷凝管、搅拌器、空气冷凝管、温度计(200℃)、量筒、锥形瓶(100mL)、圆底烧瓶、玻璃棒、电炉
五、实验步骤及现象
六、实验结果
锥形瓶质量m=67.98g
产品和锥形瓶总质量M=71.67g
产品质量=M-m=71.67-67.98=3.69g
C6H5OH+CH3CH2Br→C6H5OCH2CH3
三组所取苯酚总质量=7.53+7.67+7.80=23.00 g
理论产量=23.00÷94×122=29.85g
实际产率=实际产量/理论产量×100%=3.69/29.85×100%=12.36%
七、结果与讨论
产率偏低原因分析
1、刚开始滴加溴乙烷时速度控制不当,溴乙烷的沸点为38.2℃,若控制不好滴速,在
80-90℃的水浴中很容易沸腾成气态,导致反应不完全。
2、分液时油层有损失,因为本组实验有机相在下层,水相在上层,且分液很困难,所以
损失较多。
蒸馏时温度最终稳定在148℃,不再上升的原因分析
1、苯乙醚的沸点为172℃,可能是混杂了苯酚,溴乙烷,水等杂志导致沸点降低。
Welcome To Download !!!
欢迎您的下载,资料仅供参考!。
10、苯乙醚的制备

有机化学实验报告实验名称:苯乙醚的制备学院:化学工程学院专业:化学工程与工艺班级:姓名:学号:指导教师:日期:1、掌握制备苯乙醚的原理和方法;2、进一步巩固搅拌、回流、分液、蒸馏等基本操作;二、实验原理 ̄1、制备苯乙醚的反应方程式:C6H5OH + CH3CH2Br → C6H5OCH2CH3三、主要试剂及物理性质1、主要试剂:苯酚、氢氧化钠、溴乙烷、无水氯化钙、饱和食盐水、试剂水等四、试剂用量规格仪器:150ml三口烧瓶、搅拌器、球形冷凝管、滴液漏斗、量筒(10ml)、量筒(50ml)、温度计(100℃)、分液漏斗、玻璃棒、电炉、烧杯等5-1制备苯乙醚的实验装置图5-2苯乙醚的蒸馏提纯装置图六、实验步骤及现象七、产率计算1、苯乙醚的理论值计算反应物:n苯酚=0.08mol m理论值=0.08*122g=9.76g 2、产率计算5组:m表面皿=64.58g,m总质量=74.38g,则m实际值=9.80g即产率=(实际值∕理论值)*100% ={9.80∕(9.76*5)}*100%=20.08%八、结果与讨论1、本次实验中苯乙醚的产率是20.08%,产率是偏低的。
造成产率偏低的原因:(1)操作不够严谨,回流、保温的时间不够充分;(2)溴乙烷滴加的速度过快,水浴时未参与反应而直接蒸发了;(3)反应过程中,氢氧化钠有部分吸附在烧瓶内壁上没有参与反应,导致整个反应不完全;(4)在3次的分液过程中,静置的时间不够长,有机层有部分损失;2、在反应过程中,回流的液体是溴乙烷,出现的固体是氢氧化钠和酚钠。
用饱和食盐水洗涤的目的是萃取出有机层。
3、蒸馏时,在140℃时开始收集产品,稳定温度为145℃,此后不再上升,苯乙醚的沸点高于这个温度,由于混杂了未反应的苯酚、溴乙烷等杂质使其沸点降低了。
4、蒸馏的玻璃仪器要干燥完全,否则蒸出的产物中含有水分,而非澄清透明。
在蒸馏中要收集高于150℃的馏分,故要选择使用空气冷凝管。
制备乙醚的实验报告

制备乙醚的实验报告实验报告:制备乙醚引言乙醚是一种常见的有机化合物,具有广泛的应用领域。
本实验旨在通过酸催化反应制备乙醚,并探究反应机理和优化条件。
实验原理乙醚的制备可通过酸催化的醇醚交换反应实现。
反应方程式如下所示:CH3CH2OH + CH3CH2OH ⇌ CH3CH2OCH2CH3 + H2O实验步骤1. 实验前准备:准备所需试剂和设备,包括乙醇、浓硫酸、冷却器、反应瓶等。
2. 反应装置组装:将反应瓶与冷却器连接,确保密封性。
3. 加入试剂:向反应瓶中加入适量的乙醇,然后缓慢加入浓硫酸。
4. 反应进行:将反应瓶放入水浴中,加热至适当温度,反应进行一定时间。
5. 反应结束:停止加热,将反应瓶取出冷却至室温。
6. 产物提取:将反应瓶中的产物通过蒸馏提取出来。
7. 纯化乙醚:对提取出的产物进行纯化处理,如冷冻结晶、蒸馏等。
8. 产物分析:对纯化后的乙醚进行物理性质和结构分析。
实验结果通过实验制备的乙醚,经过纯化处理后,得到了无色透明的液体产物。
通过红外光谱仪分析,确认产物为乙醚。
进一步通过质谱仪和核磁共振仪分析,确定了产物的结构和纯度。
讨论与分析乙醚的制备反应是一个酸催化的醇醚交换反应,硫酸作为催化剂起到了重要的作用。
实验中,适量的乙醇和浓硫酸按一定比例加入反应瓶中,通过加热反应,使得反应物发生醇醚交换反应,生成乙醚和水。
反应进行一定时间后,停止加热,冷却后即可得到乙醚产物。
实验中的温度、反应时间、催化剂用量等条件对乙醚的产率和纯度有一定的影响。
温度过高可能导致副反应的发生,降低产率和纯度;反应时间过长可能使得乙醚分解,同样影响产率和纯度。
催化剂用量的增加可以提高反应速率,但过量使用可能导致副反应的发生,影响产率和纯度。
结论通过酸催化反应,本实验成功制备了乙醚。
通过纯化处理后,得到了高纯度的乙醚产物。
实验结果表明,温度、反应时间和催化剂用量等条件对乙醚的产率和纯度有一定的影响。
进一步研究和优化这些条件,可以提高乙醚的制备效率和产物质量。
乙醚的制备

兴义师范学院有机化学实验报告实验名称:乙醚的制备专业:化学教育班级:11化学本科班姓名:周兴翠学号201140651053指导教师:陈明华日期:2013年5月22日一、实验目的:1掌握实验室制备原理和方法。
2初步掌握低沸点易燃液体的操作要点.二、实验原理:醚能溶解多数的有机化合物,有些有机反应必须在醚中进行,因此,醚是有机合成中常用的溶剂。
制乙醚的主要反应:得到主要反应的分步反应:三、主要试剂及物理性质:1乙醇是无色、有特殊香味的液体,密度比水小,溶沸点低,易挥发,能溶解多种有机物和无机物,能与水以任意比互溶.2浓硫酸是无色无味的油状液体,是一种高沸点难挥发的强酸,浓硫酸中H2SO4的质量分数为98.3%,易溶于水,并且为任意比互溶,溶解时放出大量的热。
四、试剂用量规格:95%的乙醇、浓硫酸。
五、仪器装置:图1制备乙醚的装置图2洗涤装置六、实验步骤及现象步骤现象在干燥的三颈烧瓶中加入12mL95%乙醇,并将烧瓶浸入冷水浴中,缓缓加入12mL浓硫酸混匀,滴液漏斗内盛有25mL95%乙醇,按图一安装好。
都为无色用电热套开始加热,温度到140℃,开始由滴液漏斗慢慢滴加乙醇,滴入速度与滴出速度大致相同,,并维持反应温度在135―145℃,30―45min,继续加10min,直到上升160℃时,去掉热源,停止加热。
温度慢慢上升,由无色变为黑色.将馏出液转入分液漏斗,分别用8mL5%的氢氧化钠溶液、8mL饱和氯化钠溶液洗涤,最后用8mL饱和氯化钠溶液洗涤2次。
洗涤过程中乙醚上层,洗涤液为下层。
七、实验结果:所得产品质量为4.8g, 产率为23。
5%。
八、实验讨论:1反应为可逆反应,副反应又多,从而导致产率低。
2副产物中有不饱和烃、醛、酸等生成,使反应物的量减少,导致产率低。
3生成物水稀释浓硫酸,使反应难于进行,从而导致产率低.格式基本正确,但是要把精力用到深刻讨论实验过程中,而不是泛泛而谈.。
乙醚的制备实验报告

乙醚的制备实验报告乙醚的制备实验报告引言:乙醚,也被称为二甲醚,是一种重要的有机化合物。
它具有无色、易挥发的特性,常用作溶剂、麻醉剂以及化学试剂的中间体等。
本实验旨在通过醇酸酯交换反应制备乙醚,并探究其反应机理及合成方法。
实验步骤:1. 实验前准备:a. 仪器与试剂:醇酸酯交换反应常用的试剂有乙醇、浓硫酸和醇酸酯。
b. 安全措施:由于浓硫酸具有强腐蚀性,实验操作时需佩戴手套、护目镜和实验服,并在通风条件下进行。
2. 实验操作:a. 取一烧瓶,加入适量的乙醇。
b. 加入一定量的浓硫酸,并轻轻摇晃烧瓶使其充分混合。
c. 将醇酸酯缓慢滴加到烧瓶中,同时用磁力搅拌器搅拌,控制反应温度在适宜范围内。
d. 反应结束后,将产物分离出来,通过蒸馏纯化得到纯净的乙醚。
实验结果与讨论:通过本实验,成功制备了乙醚。
在实验过程中,乙醇与醇酸酯发生醇酸酯交换反应,生成乙醚和酸。
该反应是一个酸催化的反应,浓硫酸起到催化剂的作用。
反应机理:在反应中,醇酸酯经过酸催化分解成酸和醇。
酸与乙醇发生醇酸酯交换反应,生成乙醚和酸。
这个反应过程中,酸起到了催化剂的作用,加速了反应的进行。
实验中需要注意的问题:1. 反应温度的控制:反应温度过高会导致乙醚的挥发,从而减少产率;反应温度过低则会减缓反应速率。
2. 反应时间的控制:反应时间过长会导致产物的杂质增多,降低纯度。
实验结果的分析:通过蒸馏纯化后,得到纯净的乙醚。
乙醚具有低沸点和易挥发的特性,因此通过蒸馏可以有效地分离纯净的乙醚。
同时,通过红外光谱等分析手段可以对产物进行进一步的鉴定和分析。
实验的应用:乙醚是一种重要的有机溶剂,在化学实验中广泛应用。
它具有良好的溶解性,可用于溶解不溶于水的有机物。
此外,乙醚还是一种常用的麻醉剂,广泛应用于医学领域。
结论:通过醇酸酯交换反应,成功制备了乙醚。
实验中需要注意反应温度和时间的控制,以获得较高的产率和纯度。
乙醚作为一种重要的有机溶剂和麻醉剂,在化学和医学领域具有广泛的应用前景。
苯乙醚的制备

苯⼄醚的制备⼀、实验⽬的1、通过苯⼄醚的制备,了解Williamson合成法的原理及⽅法2、进⼀步熟悉蒸馏、分液等操作技术⼆、实验原理三、主要试剂物性与⽤量规格试剂:苯酚、溴⼄烷、氢氧化钠、⽆⽔氯化钙、饱和氯化钠四、仪器装置仪器:150ml三颈烧瓶、搅拌器、滴液漏⽃、空⽓冷凝管、分液漏⽃、温度计、圆底烧瓶五、实验步骤及现象时间步骤现象1:45 搭好装有搅拌器、回流冷凝管和滴液漏⽃(塞好塞⼦,垫上⼩纸⽚)的三⼝瓶⽔浴加热装置;加⼊7.50g苯酚、8.5ml 溴⼄烷、4.00g氢氧化钠开始加热1:53 ⽔浴温度达80℃,开始滴加溴⼄烷三⼝瓶壁粘着⼟黄⾊块状固体2:00 加⼊4ml⽔有焦糊状、⼟黄⾊⽩⾊以及褐⾊⽩⾊相间块状物,加⽔后溶解成黄褐⾊液体油状;油状液体中有⽩⾊微⼩颗粒散布2:45 3:06 滴液完毕基本不回流3:37 停⽌加热共三层,最上层褐⾊油状液体,中间层⽔层,下层⽩⾊细⼩颗粒3:47 加⼊20ml⽔分层,上层薄油层黄褐⾊,下层⽔层⼟黄⾊浑浊液体3:55 静置5min分液分层,上层油层,中层和上层各约0.5cm,下层由上到下颜⾊渐浅分出黄棕⾊油层4:10 加等体积饱和⾷盐⽔分液分两层,上层棕褐⾊油层,下层由上⾄下渐浅(浅黄到⽩⾊)⽔层4:19 第⼆次加等体积饱和⾷盐⽔,分液得6.18ml黄棕⾊油层。
有⿊⾊杂质4:30 加⽆⽔氯化钙⼲燥⽆⽔氯化钙由⽩变灰4:55 4:57 4:58 5:02 5:08 合并4组,开始蒸馏36℃液体沸腾第⼀滴滴下,⽩⾊浑浊液体,有刺激性⽓味,圆底烧瓶内这蒸汽翻滚温度148℃时收集馏分,160℃温度稳定5:11 停⽌蒸馏5:15 称量12.36g(10.3ml)有些许浑浊六、实验结果T 100℃=95℃修正偏差+5℃ T 200℃=200℃修正偏差0℃ M 苯⼄醚,4组=12.36gM苯⼄醚=3.09gM 理论=8.7176g产率=%44.35%1007176.809.3=?七、实验讨论1、数据分析: A.产率偏低 B.产物有些浑浊2、结果讨论:①产率偏低,可能的原因是a .刚开始滴加溴⼄烷时速度控制不当,滴的过快,溴⼄烷的沸点为38.2℃,若控制不好滴速,在80~90℃的⽔浴中很容易沸腾呈⽓态,导致反应不完全b .反应时,NaOH 吸附在烧瓶壁上没有完全参与反应,导致反应不完全c .分液时油层有损失②产物⾮澄清透明,⽽是由些许浑浊,可能的原因是 a .分液时静置的时间不够长b .⽆⽔CaCl 颗粒太⼤,⼲燥的时候不能与液体充分接触;⼲燥的时候时间不够长,都有肯能导致⼲燥不够充分③温度在160℃左右稳定,不再上升苯⼄醚的沸点为172℃,可能是因为混杂了苯酚、溴⼄烷、⽔等杂质导致沸点降低 3、实际操作对实验结果的影响:a .反应阶段溴⼄烷的滴加速度要控制在约1d/10s ,过快导致其还未反应已经蒸出,使反应产率低b .蒸馏阶段装置⼀定要⼲燥完全,否则会使蒸出的产物浑浊,⽽⾮澄清透明c .苯⼄醚的⼲燥要充分,否则会影响其成⾊。
醚的制备方法

醚的制备方法
苯乙醚是一种十分重要的有机化工产品,主要用于生产聚酯纤维、聚氯乙烯和氯化聚氯乙烯等衍生物,也可用作醚化剂,消毒剂、溶剂和清漆中的添加剂。
本文旨在介绍苯乙醚的制备方法。
苯乙醚的制备方法有很多种,其中最常用的是甲醇缩联苯乙醚法。
该方法是将含有活性氢的烷烃与甲醇反应,以形成烷基甲醇。
然后,将烷基甲醇与二甲苯反应,形成烷基甲苯,最后将烷基甲苯和水反应,形成苯乙醚。
该反应过程所需要的原料主要有烷烃、甲醇和二甲苯。
烷烃是一种含有活性氢的烃,能够与甲醇形成烷基甲醇;甲醇是一种常见的有机化学中间体,是反应的重要原料;而二甲苯是一种可以与烷基甲醇反应形成烷基甲苯的重要原料。
反应过程经历了两个步骤,第一步是将烷烃与甲醇反应,形成烷基甲醇;第二步是将烷基甲醇与二甲苯反应,形成烷基甲苯,最后将烷基甲苯和水反应,形成苯乙醚。
反应过程需要控制反应温度,一般为50-60℃。
在反应时,可以加入适量的碱,如碳酸钠或氢氧化钠,以加速反应速度。
经过反应后,结晶的苯乙醚将沉淀在反应液之中,可以将其离心分离出来。
甲醇缩联苯乙醚法是一种简单、有效的苯乙醚制备方法,所需原料和条件都比较容易控制,并且反应产率高。
它可以作为一种苯乙醚的制备方法,帮助我们更好地利用资源和促进经济发展。
微波辅助催化合成苯乙醚的探讨

苯乙醚 制备实验报告

苯乙醚制备实验报告1. 实验目的本实验旨在通过一步法合成苯乙醚,掌握合成苯乙醚的方法和技巧,了解苯乙醚的性质及其应用。
2. 实验原理苯乙醚(C8H10O)是一种重要的芳香醚,常用作溶剂和有机合成中的中间体。
苯乙醚可以通过苯醇和氯乙酸之间的酯化反应得到。
酯化反应是一种酸催化的醇与酸发生酯化反应的方法之一。
酯化反应需要酸性条件来提供质子,并利用质子在醇和酸之间的转移,使反应能够进行。
反应的机理如下所示:- 氯乙酸(15 mL)- 硫酸(1 mL)实验步骤:1. 在一个干净的圆底烧瓶中,加入苯醇和氯乙酸。
2. 在磁力搅拌器上搅拌均匀,并加入硫酸作为酸催化剂。
3. 将烧瓶连接到冷凝器和分液漏斗系统,并加热反应物混合物,使其沸腾。
4. 将生成的苯乙醚蒸馏到接收瓶中,收集产物。
5. 检查产物的纯度和收率,并进行相关的物理性质测试。
4. 实验结果及讨论实验结果根据实验操作步骤,我们成功地制备了苯乙醚。
实验中产生的苯乙醚收率为80%。
讨论苯乙醚是一种无色液体,具有芳香气味。
它是一种非水溶性化合物,在室温下具有较高的沸点(约132)。
苯乙醚不易燃,但是可以形成爆炸性的混合物,所以在操作中需要注意安全。
本实验中采用了酸催化的酯化反应,通过硫酸提供质子,促进苯醇和氯乙酸之间的反应。
反应生成的苯乙醚在升温后经过冷凝器蒸馏到接收瓶中,获得较高纯度的产物。
5. 结论通过本实验,我们成功地合成了苯乙醚,收率为80%。
苯乙醚是一种重要的有机溶剂,具有广泛的应用前景。
本实验为后续进一步研究苯乙醚的性质和应用提供了基础。
6. 参考文献[1] 《有机化学实验技术与工艺》. 化学工业出版社, 2014.。
苯乙醚

苯乙醚的制备一、实验目的1 掌握苯乙醚的制备方法和原理2 巩固分液,蒸馏,回流的操作二、实验原理C6H5OH+NaOH C6H5Na+H2OC6H5Na+CH2CH2Br C6H5OCH2CH2三、物理性质:1 、苯乙醚结构:无色油状液体,有芳香气味。
熔点-30℃,沸点172℃,相对密度0.967,折外观与性状:无色液体,有特殊臭气。
熔点(℃):-30相对密度(水=1):0.97(20℃)沸点(℃):172相对蒸气密度(空气=1):4.2分子式:C8H10O分子量:122.16溶解性:不溶于水,溶于醇、醚。
用于有机合成、香料和检验芳香族亚磺酸、制造医药、染料等。
用作有机合成中间体,用于制造医药、染料,药物及有机合成等。
2 、苯酚外观与性状:白色结晶,有特殊气味。
熔点(℃):40.6相对密度(水=1):1.07沸点(℃):181.9相对蒸气密度(空气=1):3.24折射率1.5418分子式:C6H6O化学式:C6H5OH,PhOH分子量:94.11溶解性:可混溶于、醚、氯仿、甘油、二硫化碳、凡土林、挥发油、强碱水溶液。
室温时稍溶于水,与大约8%水混合可液化,65℃以上能与水混溶,几乎不溶于石油醚。
毒性:有特殊的气味,有强腐蚀性。
有毒,LD50 530mg/kg,3 溴乙烷分子量108.9651化学式:C2H5Br r。
结构式:CH3-CH2Br别名:乙基溴溴乙烷CAS No.:74-96-4,官能团:-Br性状:无色油状液体。
有类似乙醚的气味和灼烧味。
露置空气或见光逐渐变为黄色。
易挥发。
能与乙醇、乙醚、氯仿和多数有机溶剂混溶。
是有机合成的重要原料。
农业上用作仓储谷物、仓库及房舍等的熏蒸杀虫剂。
溴乙烷是通过溴化钾与冷冻的硫酸和乙醇反应而成。
常用于汽油的乙基化,冷冻剂和麻醉剂。
因此,化工生产工人和熏蒸工都可接触不同浓度的溴乙烷。
四、实验试剂7.5g苯酚13g溴乙烷5g氢氧化钠乙醚食盐无水氯化钙五、实验内容:在装有搅拌磁子回流冷凝管和分液漏斗的50ml的三颈瓶中,加入7,5g苯开动搅拌磁子酚,5g氢氧化钠和4ml水,开动搅拌磁子,水浴加热是固体全部溶解,调节水温度在80到90度之间,开始慢慢滴加8.9ml溴乙烷和无水乙醇的混合液,滴加完毕,继续保持搅拌1h,冷却至室温加适量水是固体溶解,将液体转入分液漏斗中分出水相,有机相用饱和食盐水洗涤两次,分出有机相,合并两次的洗涤液,用15ml乙酸乙酯提取,提取液与有机相合并,用无水氯化钙干燥,蒸出乙酸乙酯,得到无色透明液体即产物六、实验记录:实验时间2012年5月22日14:35 加入7.5g苯酚,5g氢氧化钠和4ml水14:36 开动搅拌14:42 开始加溴乙烷和乙醇混合液T=89℃15:02 T=86℃15:11 溶液变成小麦色,有固体出现 T=84℃ 15:32 加完混合液,开始回流 T=83℃ 16:20 混合液中有小麦色固体 16:32 回流结束用分液漏斗分液之后,有机相加饱和食盐水洗两次,每次用10ml ,分液后,水相用乙酸乙酯萃取,合并有机相,随后蒸馏 17:27 开始蒸馏 17:37 有第一滴馏液 17:50 蒸馏结束得到产品4.88g七、数据处理及成本分析:(1)数据处理C 6H 5OHC 6H 5NaC 6 C 6H 5OCH 2CH 2 94.11 122.16。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
齐齐哈尔大学
实验报告
题目:苯乙醚的制备
学院:____专业班级:___学生姓名:_________同组者姓名:_
成绩:_________
2013年10月28日
苯乙醚的制备
实验目的
1、学习低沸点物质的取用,练习回流、蒸馏等基本操作
2、通过制备苯乙醚,了解威廉门森醚合成法
实验仪器
三口瓶、回流冷凝管、漏斗、磁力搅拌
实验药品
苯酚、氢氧化钠、溴乙烷、饱和氯化钠水溶液、无水硫酸镁
实验原理
OH ++H O 2NaOH Na
O NaBr CH 3CH 2Br
+Na O CH 2CH 3+
主要试剂及物理性质
表1 物性常数
试剂 分子量 性状 比重 熔点/℃ 沸点/℃ 溶解度
苯酚 94.11 无色晶体,有腐蚀性 1.071 42-43 182 常温微溶 溴乙烷 108.97 无色油状液体,有挥发性 1.471 -73 38.2
苯乙醚 108.97 无色液体,有特殊臭气 0.97 -30 172 不溶
实验步骤
取4.00g 氢氧化钠加入5mL 水溶解,将苯酚7.5g 和氢氧化钠溶液加入到装有搅拌器、回流冷凝管的100mL 三颈瓶中,加热并开搅拌装置,到温度上升至80~90℃时滴加溴乙烷6mL (滴加时一定要缓慢并调节好转子的速度),大约滴加1h ,,溴乙烷滴加完毕后再保温持续加热1.5 h ,停止加热,冷却,向三口瓶中加入10mL 的水,将其倒入100mL 分液漏斗中,分液,取上层液,加入5mL 的饱和氯化钠溶液洗涤两次,将洗涤好的上层液导入50mL 烧杯中,加入适量的无水硫酸镁进行干燥,将干燥好的液体倒入100mL 圆底烧瓶中进行蒸馏,收集160℃以上的馏分,产率为33.6%
数据处理
理论值=80mmol
实际值=1.34ml
==M m n M V ρ=16
.12234.1967.0⨯=0.0106mmol 产率=%0132.0%100800106.0=⨯mmol
mmol
注意事项
1、滴加溴乙烷时要缓慢
2、萃取分液时要注意基本要求,保留上层液体
3、干燥时加入无水硫酸镁的量一定要适量,刚出现散落状时正合适
4、蒸馏时蒸气温度稳定再开始收集,温度急剧下降后停止收集
思考题
1、反应过程中产生的白色固体是什么?
答:有可能是氯化钠、也有可能把未反应的苯酚也蒸馏出来了,苯酚冷却后是无色晶体。
2、反应加入氢氧化钠的目的是什么?
答:
OH ++H O
2
NaOH Na
3、威廉门森法合成苯乙醚的反应机理
答:反应机理: 醇羟基在碱性条件下形成醇负离子,进攻卤代烃的碳正中心,卤代烃脱去卤素形成醚键。
反应条件为碱性,高浓度碱,高温对反应有利;水份对反应不利。
