石大工讲义程热力学
合集下载
第八章 热力学基础

一 热力学第一定律
第七章热力学基础
内容:系统从外界吸收的热量一部分用来对外 做功, 一部分用来增加系统内能。 公式:
Q = E2 − E1 + A = ∆E + A
物理意义:1)能量转换和守恒定律(本质)。 第一 类永动机是不可能制成的 。 2)实验经验总结,自然界的普遍规律, 适用于任意热力学过程。
功:
A = ∫V PdV = 0 i 内能: ∆ E = n R ∆ T 2 热: QV = AV + ∆E = ∆E = nCV ∆T i 等容摩尔热容: CV = R 2
1
V2
7-2,3 热力学第一定律及其应用
等压过程 特点:
第七章热力学基础
P = 恒量 V1 V 2 遵循: = , PV = nRT , Q = A + E T1 T 2
第七章热力学基础
1698年萨维利和 1705年纽可门先后发明了蒸 汽机 ,当时蒸汽机的效率极低 . 1765年瓦特进 行了重大改进 ,大大提高了效率 . 人们一直在 为提高热机的效率而努力, 从理论上研究热机 效率问题, 一方面指明了提高效率的方向, 另 一方面也推动了热学理论的发展 .
各种热机的效率 液体燃料火箭 汽油机
7-2,3 热力学第一定律及其应用
第七章热力学基础
7-2,3 热力学第一定律及其应用
第七章热力学基础
教学基本要求
一 掌握内能、功和热量等概念 . 理解准静态过程 . 二 掌握热力学第一定律,能分析、计算理想气体在 等体、等压、等温和绝热过程中的功、热量和内能的改变 量. 三 理解循环的意义和循环过程中的能量转换关 系,会计算卡诺循环和其他简单循环的效率 . 四 了解可逆过程和不可逆过程,了解热力学第二定 律和熵增加原理 .
第七章热力学基础
内容:系统从外界吸收的热量一部分用来对外 做功, 一部分用来增加系统内能。 公式:
Q = E2 − E1 + A = ∆E + A
物理意义:1)能量转换和守恒定律(本质)。 第一 类永动机是不可能制成的 。 2)实验经验总结,自然界的普遍规律, 适用于任意热力学过程。
功:
A = ∫V PdV = 0 i 内能: ∆ E = n R ∆ T 2 热: QV = AV + ∆E = ∆E = nCV ∆T i 等容摩尔热容: CV = R 2
1
V2
7-2,3 热力学第一定律及其应用
等压过程 特点:
第七章热力学基础
P = 恒量 V1 V 2 遵循: = , PV = nRT , Q = A + E T1 T 2
第七章热力学基础
1698年萨维利和 1705年纽可门先后发明了蒸 汽机 ,当时蒸汽机的效率极低 . 1765年瓦特进 行了重大改进 ,大大提高了效率 . 人们一直在 为提高热机的效率而努力, 从理论上研究热机 效率问题, 一方面指明了提高效率的方向, 另 一方面也推动了热学理论的发展 .
各种热机的效率 液体燃料火箭 汽油机
7-2,3 热力学第一定律及其应用
第七章热力学基础
7-2,3 热力学第一定律及其应用
第七章热力学基础
教学基本要求
一 掌握内能、功和热量等概念 . 理解准静态过程 . 二 掌握热力学第一定律,能分析、计算理想气体在 等体、等压、等温和绝热过程中的功、热量和内能的改变 量. 三 理解循环的意义和循环过程中的能量转换关 系,会计算卡诺循环和其他简单循环的效率 . 四 了解可逆过程和不可逆过程,了解热力学第二定 律和熵增加原理 .
第一章 热力学课件

凡是状态函数必然具备上述两个 特征,反之,体系的某一个物理 量如果具有上述两个特征,它一 定是状态函数!
(P2,V2) B
沿途径1 : 从A到B 沿途径2 : 从A到B
状态函数Z的改变量
V
Z 1 = Z 2
37
☆状态函数在数学上具有全微分的性质
状态函数的微小改变量可以表示为全微分,即偏微分之和
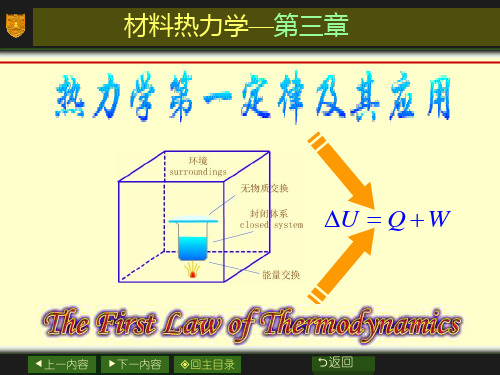
注意:自然界中不存在绝对的孤立系统 ! 但孤立体系可以人为选择:系统 + 环境 思考:没有物质交换的绝热系统是封闭还是孤立系统?
32
2、系统的状态与状态函数 对系统的描述,可用宏观可测性质。
体积
V、p、T、μ 、σ等
压力 温度 粘度
表面张力
这些性质又称为 热力学变量 热力学性质 所有物理性质和化学性质的综合表现就称体系的状态。各 宏观物理性质(如温度、压力)称为系统的状态函数。
30
(2)封闭系统 系统与环境之间无物质的交换,但有能量的交换。
以瓶里的水和汽为研究对象: 没有水蒸汽:没有物质交换; 水仍然会变凉:有能量交换。
31
(3)孤立系统(又称隔离系统) 系统与环境之间既无物质的交换,又无能量的交换。 以瓶里的水和汽为研究对象: 没有水蒸汽:没有物质交换; 水不会变凉:没有能量交换。
质和行为,发现并建立化学体系的规律的学科。
---中国大百科全书(唐有棋)---4
物理化学是从物质的物理现象和化学现象的联系入 手来探求化学变化及相关的物理变化基本规律的一门科 学。 ---南京大学傅献彩-----
用物理学原理研究化学过程所具有的性质和行为的
科学。
---清华大学朱文涛----5
二者关系: 化学过程
模型法、理想化法、假设法、数学统计法等
(P2,V2) B
沿途径1 : 从A到B 沿途径2 : 从A到B
状态函数Z的改变量
V
Z 1 = Z 2
37
☆状态函数在数学上具有全微分的性质
状态函数的微小改变量可以表示为全微分,即偏微分之和
注意:自然界中不存在绝对的孤立系统 ! 但孤立体系可以人为选择:系统 + 环境 思考:没有物质交换的绝热系统是封闭还是孤立系统?
32
2、系统的状态与状态函数 对系统的描述,可用宏观可测性质。
体积
V、p、T、μ 、σ等
压力 温度 粘度
表面张力
这些性质又称为 热力学变量 热力学性质 所有物理性质和化学性质的综合表现就称体系的状态。各 宏观物理性质(如温度、压力)称为系统的状态函数。
30
(2)封闭系统 系统与环境之间无物质的交换,但有能量的交换。
以瓶里的水和汽为研究对象: 没有水蒸汽:没有物质交换; 水仍然会变凉:有能量交换。
31
(3)孤立系统(又称隔离系统) 系统与环境之间既无物质的交换,又无能量的交换。 以瓶里的水和汽为研究对象: 没有水蒸汽:没有物质交换; 水不会变凉:没有能量交换。
质和行为,发现并建立化学体系的规律的学科。
---中国大百科全书(唐有棋)---4
物理化学是从物质的物理现象和化学现象的联系入 手来探求化学变化及相关的物理变化基本规律的一门科 学。 ---南京大学傅献彩-----
用物理学原理研究化学过程所具有的性质和行为的
科学。
---清华大学朱文涛----5
二者关系: 化学过程
模型法、理想化法、假设法、数学统计法等
第一章热力学第一定律

20
4.热力学平衡 热力学平衡态:指外界条件不变时,体系内 部性质均匀且不随时间变化的状态
1) 热平衡:无绝缘壁时,体系内各部分, 体系与环境之间温度相等 2)力学平衡:无刚性壁时,体系内各部分, 体系与环境之间力相等 3)相平衡:体系各相物质组成、数量不变
4)化学平衡:化学反应不引起物质组成或 浓度随时间的变化
18
2)几种重要的过程: a)等温过程:T 始 =T 终 =T 环 b)等压过程:P 始 =P 终 =P 环
c)等容过程:V 始 =V 终
d)等温等压过程:a,b 二者都具备
e)绝热过程:体系与环境之间没有热量传 递,只有功的传递 f)循环过程:体系由一始态出发,经一系列 变化过程又回到原来的状态
b. 人造金刚石: C(石墨)→C(金刚石) 由热力学知道 P>15000P° 时,才有可能; 今天已实现了这个转变(60000P°,1000℃, 催化剂)
二. 热力学研究方法的特点和局限性
3
1. 热力学方法的特点
研究大量粒子的宏观体系的宏观性质之间的 关系及变化规律,
不考虑微观粒子的微观结构
不涉及反应的速度和机理
4
2. 优点和局限性
1)热力学只研究体系的始终态 根据始终态的性质而得到可靠的结果;不 考虑变化中的细节;不考虑物质内部的结构 因素
2)不考虑时间因素
3)不考虑粒子的个别行为
5
热力学常用术语 1、体系与环境
体系(System) 简单而言,体系即研究之对象 。也就是为了研究问题的方便 ,我们常常用一个真实或想象 的界面把一部分物质或空间与 其余分开,这种被划定的研究 对象称为体系,亦称为物系或 环境( 系统。surroundings) 与体系密切相关、影响所 及的那部分物质或空间称为环 境。
4.热力学平衡 热力学平衡态:指外界条件不变时,体系内 部性质均匀且不随时间变化的状态
1) 热平衡:无绝缘壁时,体系内各部分, 体系与环境之间温度相等 2)力学平衡:无刚性壁时,体系内各部分, 体系与环境之间力相等 3)相平衡:体系各相物质组成、数量不变
4)化学平衡:化学反应不引起物质组成或 浓度随时间的变化
18
2)几种重要的过程: a)等温过程:T 始 =T 终 =T 环 b)等压过程:P 始 =P 终 =P 环
c)等容过程:V 始 =V 终
d)等温等压过程:a,b 二者都具备
e)绝热过程:体系与环境之间没有热量传 递,只有功的传递 f)循环过程:体系由一始态出发,经一系列 变化过程又回到原来的状态
b. 人造金刚石: C(石墨)→C(金刚石) 由热力学知道 P>15000P° 时,才有可能; 今天已实现了这个转变(60000P°,1000℃, 催化剂)
二. 热力学研究方法的特点和局限性
3
1. 热力学方法的特点
研究大量粒子的宏观体系的宏观性质之间的 关系及变化规律,
不考虑微观粒子的微观结构
不涉及反应的速度和机理
4
2. 优点和局限性
1)热力学只研究体系的始终态 根据始终态的性质而得到可靠的结果;不 考虑变化中的细节;不考虑物质内部的结构 因素
2)不考虑时间因素
3)不考虑粒子的个别行为
5
热力学常用术语 1、体系与环境
体系(System) 简单而言,体系即研究之对象 。也就是为了研究问题的方便 ,我们常常用一个真实或想象 的界面把一部分物质或空间与 其余分开,这种被划定的研究 对象称为体系,亦称为物系或 环境( 系统。surroundings) 与体系密切相关、影响所 及的那部分物质或空间称为环 境。
(NEW)毕明树《工程热力学》(第2版)笔记和课后习题详解

理论基础。
② 这些转换过程都是借助特定的工质(工作介质)实现的,不同的 工质具有不同的性质,能量转换条件及结果也有差异,因此必须研究工 质的热力性质。
③ 能量间的转换是通过各种设备(压缩机、合成塔等)实现的,能 量装置的设计过程首先要进行装置的能量衡算,因此对典型过程及循环 进行热力分析与计算是工程热力学的重要内容。
② 广度参数
在给定状态下,与系统内所含物质数量有关的参数称为广度参数, 如容积、能量、质量等。这类参数具有加和性,即整个系统的广度参数 等于各子系统同名广度参数之和。无论系统均匀与否,广度参数具有确 定的值。
通常,广度参数以大写字母表示,而由它们转化而来的比参数以相 应的小写字母表示。习惯上常把比体积以外的其他比参数的“比”字省 略。
5.1 复习笔记 5.2 课后习题详解 第六章 热力循环 6.1 复习笔记 6.2 课后习题详解 第七章 溶液热力学与相平衡基础 7.1 复习笔记 7.2 课后习题详解 第八章 热化学与化学平衡 8.1 复习笔记 8.2 课后习题详解
绪 论
0.1 复习笔记
【知识框架】
【重点难点归纳】 一、热能及其利用 1.热能 (1)一次能源。指自然界中以自然形态存在的可资利用的能源,如 风能、水力能、太阳能、地热能、燃料化学能、核能等。这些能量,有 些可以以机械能的形式直接被利用,有些需经过加工转化后才能利用。 (2)二次能源。指由一次能源加工转化后的能源。各种能源及其转 换和利用情况大致如图0-l所示。 由图0-1可见,热能是由一次能源转换成的最主要形式,而后再由 热能转换成其他形式的能量而被利用。据统计,经热能这个环节而被利 用的能量在世界上占85%以上。
量,压力计的指示值为工质绝对压力与压力计所处环境绝对压力之差。 一般情况下,压力计处于大气环境中,受到大气压力pb的作用,此时压 力计的示值即为工质绝对压力与大气压力之差。当工质绝对压力大于大 气压力时,压力计的示值称为表压力,以符号pg表示,可见
第一部分热力学第一定律热力学概论教学课件

( T, P 等)可用全微分(d T,d P)
表示,这就为热力学中的数学处理带来 很大的方便(后面将详述) 。
五、热力学平衡
如果体系中各状态函数均不随时间而 变化,我们称体系处于热力学平衡状 态。严格意义上的热力学平衡状态应 当同时具备三个平衡:
1. 热平衡 • 在体系中没有绝热壁存在的情况下,体系
2. 循环过程 体系由某一起始状态(始态)出发,经
过一系列的状态变化过程,最终又回到 原来的始态(即所有的状态函数都回到 始态),这叫循环过程。
3. 途径
体系由某一状态(始态)变化到另一状态 (终态),可以经过不同的方式,这种从 始态 终态的不同方式(变化线路), 称为不同的 “途径”。
与“过程”相比,“途径”通常意味状态 空间中状态函数变化线路的多种选择性。 例:封闭体系中,从状态A 状态B 的变 化:
件。 * 这些问题的解决,将对生产和科研起巨大的作
用。
四、热力学的应用
1. 广泛性:只需知道体系的起始状态、 最终状态,过程进行的外界条件,就可 进行相应计算;而无需知道反应物质的 结构、过程进行的机理,所以能简易方 便地得到广泛应用。
2. 局限性:
a. 由于热力学无需知道过程的机理,所以 它对过程自发性的判断只能是知其然 而不知其所以然,只能停留在对客观 事物表面的了解而不知其内在原因;
2. 一定条件下某种过程能否自发进行,若 能进行,则进行到什么程度为止,即变 化的方向和限度问题。
二、热力学体系的基础(基石)
热力学的一切结论主要建立在两个经 验定律的基础之上,即热力学第一定 律和热力学第二定律(这是19世纪发 现的,后面将详细讲述)。
所谓经验定律,应有如下特征:
1. 是人类的经验总结,其正确性是由无 数次的实验事实所证实的;
表示,这就为热力学中的数学处理带来 很大的方便(后面将详述) 。
五、热力学平衡
如果体系中各状态函数均不随时间而 变化,我们称体系处于热力学平衡状 态。严格意义上的热力学平衡状态应 当同时具备三个平衡:
1. 热平衡 • 在体系中没有绝热壁存在的情况下,体系
2. 循环过程 体系由某一起始状态(始态)出发,经
过一系列的状态变化过程,最终又回到 原来的始态(即所有的状态函数都回到 始态),这叫循环过程。
3. 途径
体系由某一状态(始态)变化到另一状态 (终态),可以经过不同的方式,这种从 始态 终态的不同方式(变化线路), 称为不同的 “途径”。
与“过程”相比,“途径”通常意味状态 空间中状态函数变化线路的多种选择性。 例:封闭体系中,从状态A 状态B 的变 化:
件。 * 这些问题的解决,将对生产和科研起巨大的作
用。
四、热力学的应用
1. 广泛性:只需知道体系的起始状态、 最终状态,过程进行的外界条件,就可 进行相应计算;而无需知道反应物质的 结构、过程进行的机理,所以能简易方 便地得到广泛应用。
2. 局限性:
a. 由于热力学无需知道过程的机理,所以 它对过程自发性的判断只能是知其然 而不知其所以然,只能停留在对客观 事物表面的了解而不知其内在原因;
2. 一定条件下某种过程能否自发进行,若 能进行,则进行到什么程度为止,即变 化的方向和限度问题。
二、热力学体系的基础(基石)
热力学的一切结论主要建立在两个经 验定律的基础之上,即热力学第一定 律和热力学第二定律(这是19世纪发 现的,后面将详细讲述)。
所谓经验定律,应有如下特征:
1. 是人类的经验总结,其正确性是由无 数次的实验事实所证实的;
第一章 冶金过程热力学基础1

在不同的条件下,可根据不同的热力学平衡判据,判断过程进行的可能 性、方向性及最大限度。
§1.1.3 热效应的计算 一、物理变化过程中热效应的计算
纯物质的加热和冷却是一个物理变化过程,其过程焓变可用kirchhof公式计 算,对于等压加热过程:
,
当有相变发生时,若相变温度为 (℃),相变热为
则:
第一章 冶金过程热力学基础 将纯物质由室温的固体加热到气体,全过程的热效应:
绝热过程:
不可逆 (状态变化时) 可逆
不可逆(自发) 可逆
第一章 冶金过程热力学基础 三、吉布斯自由能G:
对于等温等压过程,
自发 平衡状态
§1.1.2 热力学函数之间的关系
根据U、H、S、G等热力学状态函数的定义及其性质可得出共同的关系式 :热力学函数之间的基本关系式(见下图)。
,
另:
第一章 冶金过程热力学基础
⑵ 盖斯定律:化学反应的热效应只与反应的始末状态有关,而与反应 过程无关。因此化学反应式及热效应可以加减乘除计算。
若已知某一温度
下化学反应的热效应
律(基尔霍夫等压定律)求出另一温度T下的热效应
,可根据kirchhof定 :
第一章 冶金过程热力学基础
通常: 其中:
可根据热力学数据表求出,而 ,
是温度的函数。
参考书目
⑴ 钢铁冶金物理化学,北科大,陈襄武,冶金工业出版社(硕士教材) ⑵ 冶金热力学,北科大,李文超,冶金工业出版社 ⑶ ★钢铁冶金原理,重庆大学,黄希祜,冶金工业出版社(第四版)(本科教材)
第一章 冶金过程热力学基础
主要内容:
§1.1 化学反应的热效应及自由能变化 §1.2 溶液的热力学性质(活度及活度系数) §1.3 标准溶解吉布斯自由能 §1.4 多元溶液中溶质活度的相互作用系数 §1.5 冶金炉渣理论和性质 §1.6 氧化还原反应热力学
§1.1.3 热效应的计算 一、物理变化过程中热效应的计算
纯物质的加热和冷却是一个物理变化过程,其过程焓变可用kirchhof公式计 算,对于等压加热过程:
,
当有相变发生时,若相变温度为 (℃),相变热为
则:
第一章 冶金过程热力学基础 将纯物质由室温的固体加热到气体,全过程的热效应:
绝热过程:
不可逆 (状态变化时) 可逆
不可逆(自发) 可逆
第一章 冶金过程热力学基础 三、吉布斯自由能G:
对于等温等压过程,
自发 平衡状态
§1.1.2 热力学函数之间的关系
根据U、H、S、G等热力学状态函数的定义及其性质可得出共同的关系式 :热力学函数之间的基本关系式(见下图)。
,
另:
第一章 冶金过程热力学基础
⑵ 盖斯定律:化学反应的热效应只与反应的始末状态有关,而与反应 过程无关。因此化学反应式及热效应可以加减乘除计算。
若已知某一温度
下化学反应的热效应
律(基尔霍夫等压定律)求出另一温度T下的热效应
,可根据kirchhof定 :
第一章 冶金过程热力学基础
通常: 其中:
可根据热力学数据表求出,而 ,
是温度的函数。
参考书目
⑴ 钢铁冶金物理化学,北科大,陈襄武,冶金工业出版社(硕士教材) ⑵ 冶金热力学,北科大,李文超,冶金工业出版社 ⑶ ★钢铁冶金原理,重庆大学,黄希祜,冶金工业出版社(第四版)(本科教材)
第一章 冶金过程热力学基础
主要内容:
§1.1 化学反应的热效应及自由能变化 §1.2 溶液的热力学性质(活度及活度系数) §1.3 标准溶解吉布斯自由能 §1.4 多元溶液中溶质活度的相互作用系数 §1.5 冶金炉渣理论和性质 §1.6 氧化还原反应热力学
1.1-1.2热力学概述

第一章 热力学第一定律
第一节
热力学概论
一、热力学研究的基本内容
热力学是研究宏观体系在能量转换过程中所遵循 的规律的科学。主要研究: • 研究热、功和其他形式能量之间的相互转换及 其转换过程中所遵循的规律; • 研究化学变化的方向和限度。 热力学以热力学第一定律和第二定律为基础, 它是物理化学中最基本的定律。
2、功(work)--系统与环境之间传递的除热以外的 其它能量都称为功,用符号W表示。 系统对环境作功,W<0 环境对体系作功,W>0
六、热和功
功的种类: 功的种类 在化学热力学中,将功分为两种, 体积功(W) 非体积功(W′)
途径I C 终态Y
途径: 系统所经历过程的总和。 途径:始态 - - - - -→ 终态 系统所经历过程的总和。
始态A
B 途径II
这套处理方法是 热力学中的重要 方法,通常称为 状态函数法。 状态函数法
六、热和功
热和功是能量传递或交换的两种形式: 1、热(heat)-- 系统与环境之间因温差而传递的能 量称为热,用符号Q 表示。 Q的取号: 体系吸热,Q>0; 体系放热,Q<0 。
四、状态函数与状态方程
状态函数的微分为全微分, 状态函数的微分为全微分,全微分的积分与积 分途径无关。 分途径无关。 X 即: ∆X = dX = X − X
∫
2
X1
2
1
全微分为偏微分之和: 全微分为偏微分之和:
z = f ( x, y ) ;
以 V = f (p,T ) 为例
∂z ∂z dz = dx + dy ∂x y ∂y x
二、化学热力学研究的内容
将热力学的基本原理应用于化学现象及与化学有关 的物理现象的规律的研究(如在一定条件下,热平衡、 化学平衡及相平衡的规律),就称为化学热力学。 • 研究对象是大数量分子的集合体(宏观性质)。
第一节
热力学概论
一、热力学研究的基本内容
热力学是研究宏观体系在能量转换过程中所遵循 的规律的科学。主要研究: • 研究热、功和其他形式能量之间的相互转换及 其转换过程中所遵循的规律; • 研究化学变化的方向和限度。 热力学以热力学第一定律和第二定律为基础, 它是物理化学中最基本的定律。
2、功(work)--系统与环境之间传递的除热以外的 其它能量都称为功,用符号W表示。 系统对环境作功,W<0 环境对体系作功,W>0
六、热和功
功的种类: 功的种类 在化学热力学中,将功分为两种, 体积功(W) 非体积功(W′)
途径I C 终态Y
途径: 系统所经历过程的总和。 途径:始态 - - - - -→ 终态 系统所经历过程的总和。
始态A
B 途径II
这套处理方法是 热力学中的重要 方法,通常称为 状态函数法。 状态函数法
六、热和功
热和功是能量传递或交换的两种形式: 1、热(heat)-- 系统与环境之间因温差而传递的能 量称为热,用符号Q 表示。 Q的取号: 体系吸热,Q>0; 体系放热,Q<0 。
四、状态函数与状态方程
状态函数的微分为全微分, 状态函数的微分为全微分,全微分的积分与积 分途径无关。 分途径无关。 X 即: ∆X = dX = X − X
∫
2
X1
2
1
全微分为偏微分之和: 全微分为偏微分之和:
z = f ( x, y ) ;
以 V = f (p,T ) 为例
∂z ∂z dz = dx + dy ∂x y ∂y x
二、化学热力学研究的内容
将热力学的基本原理应用于化学现象及与化学有关 的物理现象的规律的研究(如在一定条件下,热平衡、 化学平衡及相平衡的规律),就称为化学热力学。 • 研究对象是大数量分子的集合体(宏观性质)。
中国地质大学-物理化学第二章_热力学第一定律剖析

材料科学与化学工程学院大学化学教学部 何明中
状态方程
经验证明: 单组分均匀系统,指定两个强度性质,其它强度 性质就确定了,若再指定系统物质的量 n ,则所有 广度性质也都确定了。
材料科学与化学工程学院大学化学教学部 何明中
系统的性质
性质(properties)—系统的宏观可测物理量,如 T,p,V 等,又称热力学变量。它可分为两类:
(1)广度性质(extensive properties) 系统分割成若干部分时,凡具有加和关系的性质 称为广度性质。又称为容量性质。其数值与系统物 质的多少成正比,如:V、m、n、U 等。在数学上 是一次齐函数。即
材料科学与化学工程学院大学化学教学部 何明中
§2.2 热平衡和热力学第零定律─温度的概念 一、热平衡
实践表明:一个不受外界影响的系统,最终会达 到平衡态,即宏观上不再发生变化,并可用一定的 表示状态的状态参数(或称为状态函数)来描述它。
若有两个系统A与B,已分别达到了平衡态,现 将它们放在一起,它们各自的状态是否会相互干 扰,则决定于两个系统的接触情况。
材料科学与化学工程学院大学化学教学部 何明中
A
B
绝热
A
B
导热
§2.2 热平衡和热力学第零定律─温度的概念
二、热力学第零定律(zeroth low of thermodynamics) 如果两个系统分别和处于确定状态的第三个系统 达到热平衡,则这两个系统彼此也将处于热平衡。
C
C
A
B
A
B
材料科学与化学工程学院大学化学教学部 何明中
材料科学与化学工程学院大学化学教学部 何明中
§2.3 热力学的一些基本概念
系统(system)与环境(surroundings) 系统的分类 系统的性质(properties) 热力学平衡态 状态函数(state function) 状态方程(equation of state) 过程(process) 和途径(path) 热(heat)和功(work)
状态方程
经验证明: 单组分均匀系统,指定两个强度性质,其它强度 性质就确定了,若再指定系统物质的量 n ,则所有 广度性质也都确定了。
材料科学与化学工程学院大学化学教学部 何明中
系统的性质
性质(properties)—系统的宏观可测物理量,如 T,p,V 等,又称热力学变量。它可分为两类:
(1)广度性质(extensive properties) 系统分割成若干部分时,凡具有加和关系的性质 称为广度性质。又称为容量性质。其数值与系统物 质的多少成正比,如:V、m、n、U 等。在数学上 是一次齐函数。即
材料科学与化学工程学院大学化学教学部 何明中
§2.2 热平衡和热力学第零定律─温度的概念 一、热平衡
实践表明:一个不受外界影响的系统,最终会达 到平衡态,即宏观上不再发生变化,并可用一定的 表示状态的状态参数(或称为状态函数)来描述它。
若有两个系统A与B,已分别达到了平衡态,现 将它们放在一起,它们各自的状态是否会相互干 扰,则决定于两个系统的接触情况。
材料科学与化学工程学院大学化学教学部 何明中
A
B
绝热
A
B
导热
§2.2 热平衡和热力学第零定律─温度的概念
二、热力学第零定律(zeroth low of thermodynamics) 如果两个系统分别和处于确定状态的第三个系统 达到热平衡,则这两个系统彼此也将处于热平衡。
C
C
A
B
A
B
材料科学与化学工程学院大学化学教学部 何明中
材料科学与化学工程学院大学化学教学部 何明中
§2.3 热力学的一些基本概念
系统(system)与环境(surroundings) 系统的分类 系统的性质(properties) 热力学平衡态 状态函数(state function) 状态方程(equation of state) 过程(process) 和途径(path) 热(heat)和功(work)
2024版大学化学热力学基础ppt课件

焓变与熵变
在化学反应中,反应前后物质的焓的差值称为 焓变,用ΔH表示;反应前后物质的熵的差值 称为熵变,用ΔS表示。
11
热力学性质图表
01
温度-熵图(T-S图)
以温度为纵坐标、熵为横坐标的 图示方法,用于表示物质在不同 温度下的熵值变化。
02
压力-体积图(p-V 图)
以压力为纵坐标、体积为横坐标 的图示方法,用于表示物质在不 同压力下的体积变化。
28
非平衡态热力学基本概念
非平衡态定义
系统内部存在不均匀性,导致物 理量(如温度、压力、浓度等) 在空间或时间上呈现不均匀分布 的状态。
热力学流与力
描述非平衡态系统中,各种物理 量的流动(如热流、粒子流、信 息流等)及其驱动力(如温度梯 度、浓度梯度等)。
局域平衡假设
在非平衡态系统中,可以将其划 分为若干小区域,每个小区域内 达到局部平衡状态,从而可以应 用平衡态热力学的理论。
内容
热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值 保持不变。
数学表达式
ΔU = Q - W,其中ΔU为系统内能的变化,Q为系统吸收的热量,W为系统对外所做的功。
2024/1/25
6
热力学第二定律
内容
不可能把热从低温物体传到高温物体而不产生其他影响,或不可能从单一热源 取热使之完全转换为有用的功而不产生其他影响,或不可逆热力过程中熵的微 增量总是大于零。
热力学第三定律 在热力学温度零度(即T=0开)时,一切完美晶体的熵值等于零。
10
热力学性质的计算
热容
系统在某一过程中,温度升高(或降低)1K 所吸收(或放出)的热量,称为该系统在该过 程中的“热容”,用C表示。
在化学反应中,反应前后物质的焓的差值称为 焓变,用ΔH表示;反应前后物质的熵的差值 称为熵变,用ΔS表示。
11
热力学性质图表
01
温度-熵图(T-S图)
以温度为纵坐标、熵为横坐标的 图示方法,用于表示物质在不同 温度下的熵值变化。
02
压力-体积图(p-V 图)
以压力为纵坐标、体积为横坐标 的图示方法,用于表示物质在不 同压力下的体积变化。
28
非平衡态热力学基本概念
非平衡态定义
系统内部存在不均匀性,导致物 理量(如温度、压力、浓度等) 在空间或时间上呈现不均匀分布 的状态。
热力学流与力
描述非平衡态系统中,各种物理 量的流动(如热流、粒子流、信 息流等)及其驱动力(如温度梯 度、浓度梯度等)。
局域平衡假设
在非平衡态系统中,可以将其划 分为若干小区域,每个小区域内 达到局部平衡状态,从而可以应 用平衡态热力学的理论。
内容
热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值 保持不变。
数学表达式
ΔU = Q - W,其中ΔU为系统内能的变化,Q为系统吸收的热量,W为系统对外所做的功。
2024/1/25
6
热力学第二定律
内容
不可能把热从低温物体传到高温物体而不产生其他影响,或不可能从单一热源 取热使之完全转换为有用的功而不产生其他影响,或不可逆热力过程中熵的微 增量总是大于零。
热力学第三定律 在热力学温度零度(即T=0开)时,一切完美晶体的熵值等于零。
10
热力学性质的计算
热容
系统在某一过程中,温度升高(或降低)1K 所吸收(或放出)的热量,称为该系统在该过 程中的“热容”,用C表示。
热力学第一定律 (7)全

物理化学
第一章 热力学第一定律
0
§1.1 热力学概论
一、热力学的研究对象
• 热力学就是研究热、功和其他形式能量之间的 相互转换及其转换过程中所遵循的规律的一门科学。
把热力学的基本原理用来研究化学现象以及和 化学有关的物理现象就构成了化学热力学。它主要 研究下面两个问题:
1. 研究各种物理变化和化学变化过程中所发生 的能量效应;
1.热平衡 : 各个部分温度相等。 2.力学平衡: 系统各部分压力相等 3.化学平衡: 系统的组成不随时间而变化。 4.相平衡: 多相存在时,各个相的组成和数量不
随时间而变化。
19
五、热和功
1.定义:系统与环境之间因温差而造成的能量传递 称为热。除热以外,在系统与环境之间其他形 式的能量传递都称为功。
在压缩过程中, P外 越小, 则环境所消耗的功越小;而在可逆压
缩过程,由于P外 始终只比内压 P 大无限小的值, 亦即压缩时环境只使用了最小的外压, ∴环境在可逆压缩过程中所消耗的功最小。
36
功的大小可用下图表示:
始态p1,V1
p外=p1 压缩
p
p外=p2 膨胀
压缩功 p1(V1–V2)
p1
终态
p p2,V2
14
4.状态性质的微小变化是全微分
V f T , P
dV V dT V dP T P P T
上述状态性质的特点可概括为: 异途同归,值变相等; 周而复始,数值还原。 而且要满足单值、连续、可微
15
三、过程与途径 1.过程: 系统的状态发生变化的经过称为
“过程”。 途径:完成这个过程的具体步骤或方式。
24
内能U的特点:
①内能是系统的状态性质,内能的改变量只取决于 始终态,而与变化的途径无关。ΔU=UB - UA
第一章 热力学第一定律
0
§1.1 热力学概论
一、热力学的研究对象
• 热力学就是研究热、功和其他形式能量之间的 相互转换及其转换过程中所遵循的规律的一门科学。
把热力学的基本原理用来研究化学现象以及和 化学有关的物理现象就构成了化学热力学。它主要 研究下面两个问题:
1. 研究各种物理变化和化学变化过程中所发生 的能量效应;
1.热平衡 : 各个部分温度相等。 2.力学平衡: 系统各部分压力相等 3.化学平衡: 系统的组成不随时间而变化。 4.相平衡: 多相存在时,各个相的组成和数量不
随时间而变化。
19
五、热和功
1.定义:系统与环境之间因温差而造成的能量传递 称为热。除热以外,在系统与环境之间其他形 式的能量传递都称为功。
在压缩过程中, P外 越小, 则环境所消耗的功越小;而在可逆压
缩过程,由于P外 始终只比内压 P 大无限小的值, 亦即压缩时环境只使用了最小的外压, ∴环境在可逆压缩过程中所消耗的功最小。
36
功的大小可用下图表示:
始态p1,V1
p外=p1 压缩
p
p外=p2 膨胀
压缩功 p1(V1–V2)
p1
终态
p p2,V2
14
4.状态性质的微小变化是全微分
V f T , P
dV V dT V dP T P P T
上述状态性质的特点可概括为: 异途同归,值变相等; 周而复始,数值还原。 而且要满足单值、连续、可微
15
三、过程与途径 1.过程: 系统的状态发生变化的经过称为
“过程”。 途径:完成这个过程的具体步骤或方式。
24
内能U的特点:
①内能是系统的状态性质,内能的改变量只取决于 始终态,而与变化的途径无关。ΔU=UB - UA
第二次讲义_热力学第一定律详细版.ppt
例如,理想气体的状态方程可表示为: pV=nRT
上一内容 下一内容 回主目录
返回
三、过程与途径
常见的变化过程: (1)等温过程(isothermal process)
在变化过程中,体系的始态温度与终态温度 相同,并等于环境温度。
(2)等压过程(isobaric process) 在变化过程中,体系的始态压力与终态压力 相同,并等于环境压力。
上一内容 下一内容 回主目录
返回
体系分类
根据体系与环境之间的关系,把体系分为三类: (3)孤立体系(isolated system)
体系与环境之间既无物质交换,又无能量交换,故 又称为隔离体系。有时把封闭体系和体系影响所及的环 境一起作为孤立体系来考虑。
上一内容 下一内容 回主目录
返回
体系分类
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
体系分类
根据体系与环境之间的关系,把体系分为三类: (1)敞开体系(open system)
体系与环境之间既有物质交换,又有能量交换。
上一内容 下一内容 回主目录
返回
体系分类
根据体系与环境之间的关系,把体系分为三类: (2)封闭体系(closed system)
体系与环境之间无物质交换,但有能量交换。
状态函数在数学上具有全微分的性质。
上一内容 下一内容 回主目录
返回
状态方程
体系状态函数之间的定量关系式称为状态方 程(state equation )。
对于一定量的单组分均匀体系,状态函数 T,p,V 之间有一定量的联系。经验证明,只有两个 是独立的,它们的函数关系可表示为:
T=f(p,V) p=f(T,V) V=f(p,T)
上一内容 下一内容 回主目录
返回
三、过程与途径
常见的变化过程: (1)等温过程(isothermal process)
在变化过程中,体系的始态温度与终态温度 相同,并等于环境温度。
(2)等压过程(isobaric process) 在变化过程中,体系的始态压力与终态压力 相同,并等于环境压力。
上一内容 下一内容 回主目录
返回
体系分类
根据体系与环境之间的关系,把体系分为三类: (3)孤立体系(isolated system)
体系与环境之间既无物质交换,又无能量交换,故 又称为隔离体系。有时把封闭体系和体系影响所及的环 境一起作为孤立体系来考虑。
上一内容 下一内容 回主目录
返回
体系分类
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
体系分类
根据体系与环境之间的关系,把体系分为三类: (1)敞开体系(open system)
体系与环境之间既有物质交换,又有能量交换。
上一内容 下一内容 回主目录
返回
体系分类
根据体系与环境之间的关系,把体系分为三类: (2)封闭体系(closed system)
体系与环境之间无物质交换,但有能量交换。
状态函数在数学上具有全微分的性质。
上一内容 下一内容 回主目录
返回
状态方程
体系状态函数之间的定量关系式称为状态方 程(state equation )。
对于一定量的单组分均匀体系,状态函数 T,p,V 之间有一定量的联系。经验证明,只有两个 是独立的,它们的函数关系可表示为:
T=f(p,V) p=f(T,V) V=f(p,T)
热工学课件2014
Q T 0
可判断过程是否可发生、是否可逆
练习题:
1、某热机循环中,工质从温度 TH 2000k的热源吸热QH ,并向温度 T 300k的冷源放热Q , 问:⑴是否可能实现 Q 1500kJ , Q 800kJ 的循环?循环是否可逆? ⑵是否可能实现 Q 2000kJ 循环净功 W 1800kJ 的循环?循环是否可逆?
2. 工质经一热力过程,放热80kJ,对外做膨胀功300kJ,为使其返回原来 的状态,对该系统加热60kJ,问:再后一过程中需要对工质做功多少?
3. 闭口系统沿acb可逆地从a状态变化到b状态,过程中吸热84kJ,对外做 膨胀功32kJ,求:⑴ 若系统沿另一路径adb不可逆地从a状态变化到b 状 态,对外做功10kJ时,需吸收多少热量? ⑵ 为使系统由b状态返回a状态,外界对系统做功20kJ,系统与外界交换 了多少热量?是吸热还是放热? 4. 质量为4500kg的汽车,沿坡度为15°的上坡下行,汽车速度为300m/s 在距山脚100米处开始刹车,汽车到达山脚完全停止。若不计其他力的作 用,求:刹车系统因摩擦产生的热量?
3-4
理想气体的基本热力过程
多变过程方程
pv const
n
n为常数,称为多变指数。
p2 p1 n v ln 1 v2 ln
3-1-2 理想气体状态方程
1、理想气体状态方程(表达式及符号的单位)
pv RgT
1mol气体:
pVm RT
pV nRT
m kg气体: mpv pV mRgT
n mol气体:
通用气体常数R:8.314 J/(mol K) , 气体常数Rg: 例如:1千摩尔理想气体状态方程: pVm 1000RT
