公开课氧化还原反应第一课时课件.ppt
合集下载
氧化还原反应PPT教学课件第1课时

3 .氧化还原反应的强弱律与优先律
氧还规律
强弱规律
四大规律
先后规律 价态规律
守恒规律
3 .氧化还原反应的强弱律与优先律
氧还规律 1、强弱规律:
常见的氧化剂还原剂排序(单强离弱)
氧化性:F2>Cl2> Br2>Fe3+>I2 Ag+ , Hg2+ , Cu2+ … 还原性:S2->I- >Fe2+ > Br- > ClK,Ca,Na,Mg,Al … Cu, Hg, Ag, Pt, Au(金属活动性顺序)
二、化合价回顾 具体表现:
(1)H:+1;-1。 只有在金属氢化物(NaH、CaH2)和SiH4显-1价 其他均显+1价
(2)O:-2;-1;-1/2 由两种元素组成,其中一种为O
过氧化物:H2O2;Na2O2中O为-1价 超氧化物:KO2中O为-1/2价 其他均显-2价
1 .氧化还原的概念及判定
3 .氧化还原反应的强弱律与优先律
氧还规律 2、剂>产:
氧化性(得e-能力):氧化剂>氧化产物
还原性(失e-能力) :还原剂>还原产物
3 .氧化还原反应的强弱律与优先律
【练习】
3 .氧化还原反应的强弱律与优先律
【练习】
3 .氧化还原反应的强弱律与优先律
【练习】
3 .氧化还原反应的强弱律与优先律
同一氧化剂,先与还原性强的物质反应 同一还原剂,先于氧化性强的物质反应
3 .氧化还原反应的强弱律与优先律
【练习】
3 .氧化还原反应的强弱律与优先律
【练习】
3 .氧化还原反应的强弱律与优先律
【练习】
氧化还原反应ppt课件

化合价降低,得电子,被还原
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
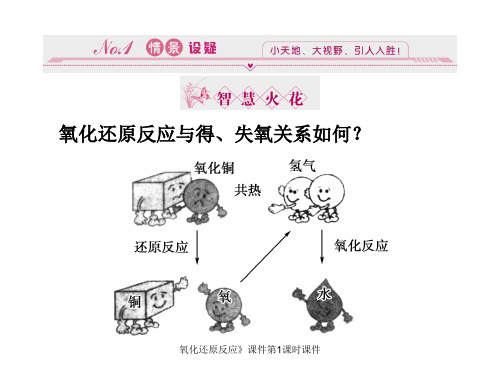
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
公开课氧化还原反应第一课时课件

0
0
+1-1
H2 + Cl2 === 2 H Cl
电子对偏向,化合价降低,被还原
化合价升降的原因:电子的偏移
[结论] 氧化还原反应的实质是: 发生了电子的转移(得失或偏移)
元素化合价和电子得失的关系
化合价升高,被氧化
0
0
+1 -1
2Na + Cl2 = 2NaCl
离子化合物: 元素化合价数
= 该元素一个原子得失电子数
得到2e -,化合价降低,被还原 失去1e -,化合价升高,被氧化
0
-1
+1
Cl2 + H2O = HCl + HClO
双箭号跨过等号, 从反应物指向生成物, 起止为同一元素。
注明失去或得到 电子的总数,叙述要 完整。
得到1e -,化合价降低,被还原
课堂练习
用双线桥表示同种元素的电子得失。
失去 2e-,化合价升高,被氧化
+4
-1 +2
0
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
得 到2e-,化合价降低,被还原
. 氯 元素化合价升高,被 氧化 (填“氧化”或 “还原”),氧发化生 (填“氧化”或“还原”锰)
反应; .
元素还化原合价降低,被 (填
“氧化”或“还还原原”),发生
(填“氧化”
或“还原”)反应。
化合价降低的反应 得到电子的反应 (或电子对偏向)
化合价升高降 得失电子同时发生
低同时发生
(得失电子总数相等)
有化合价升降的 反应
有电子转移的反应
特征(表现)
本质
四、表示氧化还原反应的方法
氧化还原反应ppt课件

思考与讨论: (1)请根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2↑
物质 得氧物质 失氧物质
反应物 C、CO CuO、Fe2O3
发生的反应(氧化反应或还原反应) 氧化反应 还原反应
思考:你判断氧化反应和还原反应的依据是什么?
另一条线始于反应物中的升价元素,止于产物中同种元素。
注得失---正确标出反应前后“得到”或“失去”电子总数
课堂探究 氧化还原反应电子转移的表示方法
双线桥法的注意事项: (1)箭头、箭尾必须对应化合价变化的同种元素的原子; (2)必须注明“得到”或“失去”; (3)电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子 个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略; (4)被还原的物质和被氧化的物质得失电子数守恒。
注意:两个可能:化合反应和分解反应可能是氧化还原反应。
两个一定:置换反应一定是氧化还原反应,复分解反应一定是非氧化还原反应。
课堂探究 氧化还原反应与四大基本反应的关系
思考与讨论:观察下列反应,它们是氧化还原反应吗?属于四大基本反应类型吗?
有单质参加或生成的化学反应一定是氧化还原反应吗?
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
人教版(2019)必修第一册
第一章 物质及其变化
第三节 氧化还原反应
第一课时 氧化还原反应
素养目标
宏观辨识与微观探析:
从宏观上理解化合价变化是氧化还原反应的表观现象,从微观上明确在氧化还原 反应中物质发生化合价变化的本质原因是电子的转移(得失和共用电子对偏移)。
《氧化还原反应》PPT

栏目导航
3.从电子转移的角度认识氧化还原反应
(1)在
PPT模板:/moban/
PPT素材:/sucai/
PPT背景:/beijing/
PPT图表:/tubiao/
PPT下载:/xiazai/
PPT素材:/sucai/ PPT图表:/tubiao/ PPT教程: /powerpoint/ 范文下载:/fanwen/ 教案下载:/jiaoan/ PPT课件:/kejian/ 数学课件:/kejian/shu xue/ 美术课件:/kejian/me ishu/ 物理课件:/kejian/wul i/ 生物课件:/kejian/she ngwu/ 历史课件:/kejian/lish i/
PPT素材:/sucai/ PPT图表:/tubiao/ PPT教程: /powerpoint/ 范文下载:/fanwen/ 教案下载:/jiaoan/ PPT课件:/kejian/ 数学课件:/kejian/shu xue/ 美术课件:/kejian/me ishu/ 物理课件:/kejian/wul i/ 生物课件:/kejian/she ngwu/ 历史课件:/kejian/lish i/
(1)对于有氧元素参加的反应
2CuO+C=高==温==2Cu+CO2↑。
①铜元素化合价降低,发生 还原 反应。 ②碳元素化合价 升高 ,发生 氧化 反应。
(2)对于无氧元素参加的反应 Fe+CuSO4===FeSO4+Cu。 ①铜元素化合价 降低 ,发生 还原 反应。 ②铁元素化合价 升高 ,发生 氧化 反应。 (3)结论:凡是有元素 化合价升降 的反应,都是氧化还原反应。
第一章 物质及其变化
第三节 氧化还原反应 第1课时 氧化还原反应
-.
PPT模板:/moban/ PPT背景:/beijing/ PPT下载:/xiazai/ 资料下载:/ziliao/ 试卷下载:/shiti/ PPT论坛: 语文课件:/kejian/yuw en/ 英语课件:/kejian/ying yu/ 科学课件:/kejian/kexu e/ 化学课件:/kejian/huaxue/ 地理课件:/kejian/dili/
3.从电子转移的角度认识氧化还原反应
(1)在
PPT模板:/moban/
PPT素材:/sucai/
PPT背景:/beijing/
PPT图表:/tubiao/
PPT下载:/xiazai/
PPT素材:/sucai/ PPT图表:/tubiao/ PPT教程: /powerpoint/ 范文下载:/fanwen/ 教案下载:/jiaoan/ PPT课件:/kejian/ 数学课件:/kejian/shu xue/ 美术课件:/kejian/me ishu/ 物理课件:/kejian/wul i/ 生物课件:/kejian/she ngwu/ 历史课件:/kejian/lish i/
PPT素材:/sucai/ PPT图表:/tubiao/ PPT教程: /powerpoint/ 范文下载:/fanwen/ 教案下载:/jiaoan/ PPT课件:/kejian/ 数学课件:/kejian/shu xue/ 美术课件:/kejian/me ishu/ 物理课件:/kejian/wul i/ 生物课件:/kejian/she ngwu/ 历史课件:/kejian/lish i/
(1)对于有氧元素参加的反应
2CuO+C=高==温==2Cu+CO2↑。
①铜元素化合价降低,发生 还原 反应。 ②碳元素化合价 升高 ,发生 氧化 反应。
(2)对于无氧元素参加的反应 Fe+CuSO4===FeSO4+Cu。 ①铜元素化合价 降低 ,发生 还原 反应。 ②铁元素化合价 升高 ,发生 氧化 反应。 (3)结论:凡是有元素 化合价升降 的反应,都是氧化还原反应。
第一章 物质及其变化
第三节 氧化还原反应 第1课时 氧化还原反应
-.
PPT模板:/moban/ PPT背景:/beijing/ PPT下载:/xiazai/ 资料下载:/ziliao/ 试卷下载:/shiti/ PPT论坛: 语文课件:/kejian/yuw en/ 英语课件:/kejian/ying yu/ 科学课件:/kejian/kexu e/ 化学课件:/kejian/huaxue/ 地理课件:/kejian/dili/
氧化还原反应课件第1课时课件
氧化还原反应》课件第1课时课件
(2)分析下列反应的化学方程式,是氧化还原 反应的用单线桥法标出电子转移的方向和数 目。 ①BaCl2+Na2SO4===BaSO4↓+2NaCl ________________________________, ②Fe+2HCl===FeCl2+H2↑ ____________________________________。
失去
6×2e-↑
答案: C
氧化还原反应》课件第1课时课件
热点实验 探究氧化还原反应在生活中的应用
[探究举例] (1)人体血红蛋白中含有Fe2+,如
果误食亚硝酸盐,会使人中毒,因为亚硝酸盐 会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧 失与O2结合的能力,服用维生素C可缓解亚硝 酸盐的中毒,这说明维生素C具有________。
氧化还原反应》课件第1课时课件
氧化还原反应中电子转移的表示 (1)分析下列反应的化学方程式,是 氧化还原反应的用双线桥法标出电子转移的方 向和数目,指出被氧化和被还原的元素。 ① 2Na+Cl2=点==燃==2NaCl ______________________________________, ②NaOH+HCl===NaCl+H2O ___________________________________。
氧化还原反应》课件第1课时课件
得氧和
化合价 电子转移观
失氧观点 升降观点
点
反 氧 化 应
得氧的反应
化合价升高 的反应
失去(或偏 离)电子的
反应
还 原 反 应
失氧的反应
化合价降低 的反应
得到(或偏 向)电子的
反应
氧化还原反应》课件第1课时课件
得失(或偏
(2)分析下列反应的化学方程式,是氧化还原 反应的用单线桥法标出电子转移的方向和数 目。 ①BaCl2+Na2SO4===BaSO4↓+2NaCl ________________________________, ②Fe+2HCl===FeCl2+H2↑ ____________________________________。
失去
6×2e-↑
答案: C
氧化还原反应》课件第1课时课件
热点实验 探究氧化还原反应在生活中的应用
[探究举例] (1)人体血红蛋白中含有Fe2+,如
果误食亚硝酸盐,会使人中毒,因为亚硝酸盐 会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧 失与O2结合的能力,服用维生素C可缓解亚硝 酸盐的中毒,这说明维生素C具有________。
氧化还原反应》课件第1课时课件
氧化还原反应中电子转移的表示 (1)分析下列反应的化学方程式,是 氧化还原反应的用双线桥法标出电子转移的方 向和数目,指出被氧化和被还原的元素。 ① 2Na+Cl2=点==燃==2NaCl ______________________________________, ②NaOH+HCl===NaCl+H2O ___________________________________。
氧化还原反应》课件第1课时课件
得氧和
化合价 电子转移观
失氧观点 升降观点
点
反 氧 化 应
得氧的反应
化合价升高 的反应
失去(或偏 离)电子的
反应
还 原 反 应
失氧的反应
化合价降低 的反应
得到(或偏 向)电子的
反应
氧化还原反应》课件第1课时课件
得失(或偏
人教版高中化学必修一 氧化还原反应第一课时.ppt

氧化反应和还原反应同时发生,这样的反应称为
氧化还原反应。
依据得失氧判断:
1.CO2+C
点燃
2CO
高温
2.C+H2O
CO+H2
3. CuO+H2
Cu+H2O
新的依据:反应前后,元素化合价发生变化
氧化还原反应:有元素化合价升降的化学反
应。
化合价降低
物质所含元素化合价
+2
0
CuO+H2
0 +1
Cu+H2O
• 谢谢!
氧化反应:原子失去(或偏离)电子,化合价升高的过程
还原反应:原子得到(或偏向)电子,化合价降低的过程
双线桥法:这种用箭头表示同一元素原子的电子转移
的情况的表示方法称 “双线桥法”。
得到1×2e-,化合价 降低,被还原
+2
0
CuO+H2
0 +1
Cu+H2O
方法:
失去2×e-,化合价 升高,被氧化
a 找出反应前后化合价发生变化的元素
b 从反应物中被氧化(或被还原)的元素指向产物中对 应的价态变化的元素 c 用e- 表示电子,注明电子得失数
d 查得失电子数是否相等
单线桥法:这种用箭头表示反应前后不同元素原子的
电子转移的情况的表示方法称 “单线桥法”。
2e-
+2
0
CuO+H2
0 +1
Cu+H2O
方法:
a 找出反应前后化合价发生变化的元素 b 还原剂中化合价升高的元素指向氧化剂中化合 价降低的元素 c 用e- 表示电子,标出转移电子的总数
度划分,把化学反应分为氧化反应和还原 反应。
氧化还原反应。
依据得失氧判断:
1.CO2+C
点燃
2CO
高温
2.C+H2O
CO+H2
3. CuO+H2
Cu+H2O
新的依据:反应前后,元素化合价发生变化
氧化还原反应:有元素化合价升降的化学反
应。
化合价降低
物质所含元素化合价
+2
0
CuO+H2
0 +1
Cu+H2O
• 谢谢!
氧化反应:原子失去(或偏离)电子,化合价升高的过程
还原反应:原子得到(或偏向)电子,化合价降低的过程
双线桥法:这种用箭头表示同一元素原子的电子转移
的情况的表示方法称 “双线桥法”。
得到1×2e-,化合价 降低,被还原
+2
0
CuO+H2
0 +1
Cu+H2O
方法:
失去2×e-,化合价 升高,被氧化
a 找出反应前后化合价发生变化的元素
b 从反应物中被氧化(或被还原)的元素指向产物中对 应的价态变化的元素 c 用e- 表示电子,注明电子得失数
d 查得失电子数是否相等
单线桥法:这种用箭头表示反应前后不同元素原子的
电子转移的情况的表示方法称 “单线桥法”。
2e-
+2
0
CuO+H2
0 +1
Cu+H2O
方法:
a 找出反应前后化合价发生变化的元素 b 还原剂中化合价升高的元素指向氧化剂中化合 价降低的元素 c 用e- 表示电子,标出转移电子的总数
度划分,把化学反应分为氧化反应和还原 反应。
氧化还原反应ppt课件

VS
拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价的概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
得失氧的视角
化合价的视角
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
反应前后物质的类别和数目
反应前后有无元素化合价的变化
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
氧化还原反应
非氧化还原反应
本节小结
得氧、失氧
元素(宏观视角)
元素化合价升降
电子(微观视角)
电子转移(电子得失或共用电子对的偏移)
物质水平——得失氧的视角
在一个反应中同时发生
氧化还原反应
狭义
一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
化合价升高,
化合价降低,
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
非氧化还原反应
无元素化合价变化
有元素化合价变化
氧化还原反应的特征
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价的概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
得失氧的视角
化合价的视角
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
反应前后物质的类别和数目
反应前后有无元素化合价的变化
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
氧化还原反应
非氧化还原反应
本节小结
得氧、失氧
元素(宏观视角)
元素化合价升降
电子(微观视角)
电子转移(电子得失或共用电子对的偏移)
物质水平——得失氧的视角
在一个反应中同时发生
氧化还原反应
狭义
一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
化合价升高,
化合价降低,
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
非氧化还原反应
无元素化合价变化
有元素化合价变化
氧化还原反应的特征
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
人教版化学必修一2.3氧化还原反应优秀课件PPT

( 6)被还原的元素是__H_2_S_O_4中__的__S_元__素_,
(7)1molFeS参加反应,转移电子____3___mol。
勤学勤练:
2S2- + SO32- + 6H+ = 3S↓+ 3H2O
氧化剂:__S_O_3_2_-
还原剂:__S_2_- ___
氧化产物:_S______ 还原产物:_S______
每生成1molS转移电子__1_._3_3___mol
(三)常见的氧化剂和还原剂
元素的化合价分成最高价,最低价和中间价态,元 素的最高价只有: 氧化性 最低价只有:还原性 中 间价态: 既有氧化性又有还原性 金属的化合价只 有: 正价 所以金属单质只有: 还原 性。非金属 的最高化合价一般等于 最外层电子数 最低化合价一 般等于:最高化合价-8 但是氟元素的化合价一般只 有:负一价 所以F2只有: 氧化性。
重要的氧化剂、还原剂
氧化剂
具体物质
(1)活泼非金属单质 O3、Cl2、Br2、O2
(2)高价的氧化物 NO2、CO2、MnO2
(3)高价的含氧酸 HClO、浓H2SO4、HNO3
(4)高价的盐
KMnO4、KClO3、FeCl3
(5)过氧化物
Na2O2、H2O2等
还原剂
具体物质
(1)活泼金属单质 Na、Al、Zn、Fe
记忆方法:失高氧、得低还,若说“剂” 两相反。 氧化剂本身被还原,还原剂本身被氧化。
(二)氧化还原反应中电子转移的表示方法
双线桥法 线上标出得失电子的情况及价的升降、被氧
化或被还原等内容。
1氧、化M剂nO是2:+4MHnCO2l(浓) 还原剂Cl是2↑:+MHnCCll2+2H2O 氧化产物是:Cl2 还原产物是:MnCl2 氧化剂和还原剂的物质的量之比是:_1_:__2__。 每生成2.24LCl2(标况),转移__0_._2_mol电子。
(7)1molFeS参加反应,转移电子____3___mol。
勤学勤练:
2S2- + SO32- + 6H+ = 3S↓+ 3H2O
氧化剂:__S_O_3_2_-
还原剂:__S_2_- ___
氧化产物:_S______ 还原产物:_S______
每生成1molS转移电子__1_._3_3___mol
(三)常见的氧化剂和还原剂
元素的化合价分成最高价,最低价和中间价态,元 素的最高价只有: 氧化性 最低价只有:还原性 中 间价态: 既有氧化性又有还原性 金属的化合价只 有: 正价 所以金属单质只有: 还原 性。非金属 的最高化合价一般等于 最外层电子数 最低化合价一 般等于:最高化合价-8 但是氟元素的化合价一般只 有:负一价 所以F2只有: 氧化性。
重要的氧化剂、还原剂
氧化剂
具体物质
(1)活泼非金属单质 O3、Cl2、Br2、O2
(2)高价的氧化物 NO2、CO2、MnO2
(3)高价的含氧酸 HClO、浓H2SO4、HNO3
(4)高价的盐
KMnO4、KClO3、FeCl3
(5)过氧化物
Na2O2、H2O2等
还原剂
具体物质
(1)活泼金属单质 Na、Al、Zn、Fe
记忆方法:失高氧、得低还,若说“剂” 两相反。 氧化剂本身被还原,还原剂本身被氧化。
(二)氧化还原反应中电子转移的表示方法
双线桥法 线上标出得失电子的情况及价的升降、被氧
化或被还原等内容。
1氧、化M剂nO是2:+4MHnCO2l(浓) 还原剂Cl是2↑:+MHnCCll2+2H2O 氧化产物是:Cl2 还原产物是:MnCl2 氧化剂和还原剂的物质的量之比是:_1_:__2__。 每生成2.24LCl2(标况),转移__0_._2_mol电子。
氧化还原反应ppt课件

氧化还原反应 非氧化还原反应
化学反应按照不同的分类方法可以分为不同 的反应,四大基本反应类型与氧化还原反应 什么关系?
随堂检测
1. 回答下列问题:
① CO2+C 高温 2CO ③ C+H2O(g) 高温 CO+H2 ⑤ CaCO3 高温 CaO+CO2↑
② CaO+H2O===Ca(OH)2 ④ 2H2O 电解 2H2↑+O2↑
00
2Na+Cl2
+1 -1
2NaCl
化合价降低,还原反应
化合价升降的原因:电子的得失
三、从电子转移的角度认识氧化还原反应
微观探析:以H2与Cl2反应为例
H +1 1
都可得1个e-
Cl +17 2 8 7
化合价升高,氧化反应
共用电子对
00
H2+Cl2
点燃
+1 -1
2HCl
化合价降低,还反应
化合价升降的原因:共用电 子对的偏移(偏离或偏向)
一、从得失氧的角度认识氧化还原反应
根据初中学过的氧化反应和还原反应的知识,分析以下反应:
得到氧
2Cu+O2
2CuO
➢ 铜: 得__到__氧变成了氧化铜,发生 氧___化_反应,被氧气_氧___化。
一、从得失氧的角度认识氧化还原反应
根据初中学过的氧化反应和还原反应的知识,分析以下反应:
得到氧
2CuO+H2
还原反应
化合价升高
0 +2
Fe+ CuSO4
+2
0
FeSO4+Cu
化合价降低 ➢ Fe元素:化合价升高,发生氧化反应,被氧化。
➢ Cu元素:化合价降低,发生还原反应,被还原。 虽没有物质得氧、失氧,但反应前后却有元素化合价的变化。
公开课氧化还原反应第一课时课件.ppt

离子化合物NaCl 的形成过程
失去e-
Na
Cl
失去e-后
得到e-后
失电子,化合价升高,被氧化
00
+1 -1
2Na+Cl2 == 2Na Cl
Na+
[ Cl ]-
得电子,化合价降低,被还原
Na+ Cl -
化合价升降的原因: 电子的得失
共价化合物HCl 的形成过程
H
Cl
H Cl
电子对偏离,化合价升高,被氧化
化合价降低,被还原 化合价升高数 = 失去的电子数
电子转移
Na
Cl
化合价降低数 = 得到的电子数
失去电子的反应就是氧化反应
Na+
Cl- 得到电子的反应就是还原反应
Na+ Cl-
总结:
化合价升降观点 电子转移观点
氧化反应
还原反应
氧化还原 的关系 氧化还原 反应
化合价升高的反应 失去电子的反应 (或电子对偏离)
0
0
+1-1
H2 + Cl2 === 2 H Cl
电子对偏向,化合价降低,被还原
化合价升降的原因:电子的偏移
[结论] 氧化还原反应的实质是: 发生了电子的转移(得失或偏移)
元素化合价和电子得失的关系
化合价升高,被氧化
0
0
+1 -1
2Na + Cl2 = 2NaCl
离子化合物: 元素化合价数
= 该元素一个原子得失电子数
得到2e -,化合价降低,被还原 失去1e -,化合价升高,被氧化
0
-1
+1
Cl2 + H2O = HCl + HClO
双箭号跨过等号, 从反应物指向生成物, 起止为同一元素。
失去e-
Na
Cl
失去e-后
得到e-后
失电子,化合价升高,被氧化
00
+1 -1
2Na+Cl2 == 2Na Cl
Na+
[ Cl ]-
得电子,化合价降低,被还原
Na+ Cl -
化合价升降的原因: 电子的得失
共价化合物HCl 的形成过程
H
Cl
H Cl
电子对偏离,化合价升高,被氧化
化合价降低,被还原 化合价升高数 = 失去的电子数
电子转移
Na
Cl
化合价降低数 = 得到的电子数
失去电子的反应就是氧化反应
Na+
Cl- 得到电子的反应就是还原反应
Na+ Cl-
总结:
化合价升降观点 电子转移观点
氧化反应
还原反应
氧化还原 的关系 氧化还原 反应
化合价升高的反应 失去电子的反应 (或电子对偏离)
0
0
+1-1
H2 + Cl2 === 2 H Cl
电子对偏向,化合价降低,被还原
化合价升降的原因:电子的偏移
[结论] 氧化还原反应的实质是: 发生了电子的转移(得失或偏移)
元素化合价和电子得失的关系
化合价升高,被氧化
0
0
+1 -1
2Na + Cl2 = 2NaCl
离子化合物: 元素化合价数
= 该元素一个原子得失电子数
得到2e -,化合价降低,被还原 失去1e -,化合价升高,被氧化
0
-1
+1
Cl2 + H2O = HCl + HClO
双箭号跨过等号, 从反应物指向生成物, 起止为同一元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
下列叙述正确的是(AA、D、D )
A、在氧化还原反应中,失去电子 的物质,所含元素化合价降低
B、凡是有元素化合价升降的化 学反应都是氧化还原反应
C、在氧化还原反应中一定所有 的元素化合价都发生变化
D、氧化还原反应的本质是电子 的转移(得失或偏移)
Ⅱ.下列反应中属于氧化还原反应的是( CDE )
A CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O B. Na2O + H2O == 2NaOH C. 2KMnO4 == K2MnO4 + MnO2 + O2↑ D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑ E. 3Fe + 2O2 == Fe3O4 F. CuSO4·5H2O == CuSO4 + 5H2O
是
高温
CaCO3 ===
CaO
+
CO2↑
分解反应
非
Fe+CuSO4=Cu+FeSO4 置换反应
是
KOH+HNO3=KNO3+H2O 复分解反应 非
非四大基
是
2H2S+SO2 = 3S+2H2O
氧化还原反应与四种基本类型的关系:
分解反应 化合反应
氧化还原反应
置换反应
复分解反应
三、氧化还原反应的实质:
第二章 化学物质及其变化
第3节 氧化还原反应
从得氧失氧角度分析:
Cu O
Cu
H
H
H
O
H
失去氧,被还原(还原反应)
△
CuO + H2 == Cu + H2O
得到氧,被氧化(氧化反应)
氧化还原反应:一种物质被氧化(得到氧),
同时一种物质被还原(失去氧) 的反应。
重新认识氧化还原反应
CuO+H2=△=Cu+H2O
化合价降低的反应 得到电子的反应 (或电子对偏向)
化合价升高降 得失电子同时发生
低同时发生
(得失电子总数相等)
有化合价升降的 反应
有电子转移的反应
特征(表现)
本质
四、表示氧化还原反应的方法
双线桥法:表示同一元素的原子或离子得失电子的结果。
注 意:
失去2e-,化合价升高,被氧化
0
0
+1 -1
2 Na + Cl2 = 2 NaCl
化合价降低,被还原 化合价升高数 = 失去的电子数
电子转移
Na
Cl
化合价降低数 = 得到的电子数
失去电子的反应就是氧化反应
Na+
Cl- 得到电子的反应就是还原反应
Na+ Cl-
总结:
化合价升降观点 电子转移观点
பைடு நூலகம்
氧化反应
还原反应
氧化还原 的关系 氧化还原 反应
化合价升高的反应 失去电子的反应 (或电子对偏离)
得到2e -,化合价降低,被还原 失去1e -,化合价升高,被氧化
0
-1
+1
Cl2 + H2O = HCl + HClO
双箭号跨过等号, 从反应物指向生成物, 起止为同一元素。
注明失去或得到 电子的总数,叙述要 完整。
得到1e -,化合价降低,被还原
课堂练习
用双线桥表示同种元素的电子得失。
失去 2e-,化合价升高,被氧化
小结:1.还原剂的风格高, 它愿把电子往外抛, 虽然把电子失去了, 最后却是价升高.
2.失、高、氧
得、低、还
Fe2O3+3CO=高=温2Fe+3CO2 NaOH+HCl=NaCl+H2O
一、从化合价升降观点的认识反应
被氧化,发生氧化反应 化合价升高
+3
+2
0
+4
Fe2O3+3CO=2Fe+3CO2
被还原,发生还原反应 化合价降低
还原剂
氧化剂
被氧化,发生氧化反应 化合价升高
+2
0
0
+1
CuO+H2=Cu+H2O
离子化合物NaCl 的形成过程
失去e-
Na
Cl
失去e-后
得到e-后
失电子,化合价升高,被氧化
00
+1 -1
2Na+Cl2 == 2Na Cl
Na+
[ Cl ]-
得电子,化合价降低,被还原
Na+ Cl -
化合价升降的原因: 电子的得失
共价化合物HCl 的形成过程
H
Cl
H Cl
电子对偏离,化合价升高,被氧化
被还原,发生还原反应 化合价降低
氧化还原反应:一种物质被氧化 化合价升高
同时一种物质被还原的反应。 化合价降低
讨论后完成下表:
反应实例
反应类型 是否氧化还原反应
3Fe+2O2=点=燃=Fe3O4 化合反应
是
CaO+H2O===Ca(OH)2 化合反应 非
2H2O=通=电=2 H2↑ + O2↑ 分解反应
0
0
+1-1
H2 + Cl2 === 2 H Cl
电子对偏向,化合价降低,被还原
化合价升降的原因:电子的偏移
[结论] 氧化还原反应的实质是: 发生了电子的转移(得失或偏移)
元素化合价和电子得失的关系
化合价升高,被氧化
0
0
+1 -1
2Na + Cl2 = 2NaCl
离子化合物: 元素化合价数
= 该元素一个原子得失电子数
+4
-1 +2
0
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
得 到2e-,化合价降低,被还原
. 氯 元素化合价升高,被 氧化 (填“氧化”或 “还原”),氧发化生 (填“氧化”或“还原”锰)
反应; .
元素还化原合价降低,被 (填
“氧化”或“还还原原”),发生
(填“氧化”
或“还原”)反应。
