14化学高二必修一知识点:化学反应的热效应
高二化学化学反应中的热效应

• 常见放热反应
• 绝大多数化合反应 • 中和反应
• 金属和酸,金属和水 的反应
• 所有的燃烧反应
• 常见吸热反应:
• 大多数的分解反应
• 所有的水解反应
• 所有的电离反应
• Ba(OH)2·8H2O与 NH4Cl的反应
• C+H2O CO+H2 • C+CO2 2CO • H2 +CuO H2O +
;
不相信代谢今年夏天还能立秋,我已经决心和这个代谢日头熬到底了。那一天,家家户户的月份牌和挂历上都印着﹣﹣1990年8月8日,立秋。可是我没有半点预感。我没有任何对于它的期待,没有想象那种享受。在久久的煎熬中,预感与灵性,以及想象,都真的萎蔫了。 (10)火一样 的上午,过去了。 (11)中午时我还是没有预感。只是挤命做着自己最爱做的一件事。这是一种唯一的度命方式;沉沉地抓紧,竭力地代谢明。在恐怖的酷热中,一切都呈着残酷感,但又呈着难言的美。 (12)走进下午的阳光时,我看见人的影子在蠕动。我觉得胜利的感觉浮在自己颊 上。生命又战胜了,我默想,这样活着如同战士。 (13)下午的阳光开始显得五彩摈纷,美丽得让人忘却了残酷,异想天开地看见一丝温柔。如同一个在四面戈壁沙漠中的扳道工,突然听见身后传来一声低低的、女性的唤声一样。即使如此﹣﹣在那个瞬间里我也并没有意识到它。 (14 )突然觉出“凉爽”的一刹那,我怔了一怔。那低低的唤声正阴柔地浸漫而来,一瞬之间,不可思议,永远汗流浃背的身体干了。我吃惊地回顾,发现行人们﹣﹣代谢人们都在彼此顾盼。接着,满树叶子在高空抖动了,并没有风,只是树杈间传来一个讯号。我差一点喊出来,一切是这样 猝不及防,只在那分秒之间,凉爽的空气便充斥了天地人间。 (15)我几乎想落泪。久久的苦熬居然真能结束,立秋是真实的。只这样怔了一刹那,天空中那凉爽开始疾疾运行。如同有一只无形的巨手,按动了一个无形的天道的开关,把怜悯和公正一同随着凉爽送进了这个苦难世界。 蓝天顿失了那种眩目的光亮,此刻蓝色纯正。风升得更高,连梢尖上的叶片也在凝思﹣﹣但是涌涌的凉爽漫天盖地而来,在这一个时刻之中消除了全部往昔的苦热。 (16)我感动地站在大街正中。 (17)我在沉默着呐喊。我是代谢人,我代谢明天理的真实。凉爽溶化着抚摸着我。它是 代谢人,它代谢明我坚持到了今天。 (18)立秋……中国简练的总结呵。那个时刻里我突然懂得了古典的意味。古人的遭遇,古人的忍耐,古人的感受与判断,以及古人的划分与总结。立秋二字,区别凉热,指示规律,它年复一年地告诉我们这些愚钝的后人﹣﹣天道有序,一切都在更 大的掌握之中。 (19)从那一刻立秋之后,我和代谢人便享受着凉爽的快感。人人都心平气和了,等着下一个更痛快的节气。同南方北方的人们交流,大都感受略同。立秋律,执法全部中国。听说,有个老外在立秋那天激动地说:你们中国人的节气真棒! (20)回想以前许多年都没有 留心。年年立秋,我都没有感性。也许是从未经历过这样一个残酷的苦夏吧,也许是因为从小缺少关于天道的教育。 (21)沐浴着广袤无际、阴柔轻漫的凉爽,我久久感动着。从那立秋的时刻至今,我每一天每一瞬都意识着这秋之伟力。我不再迟钝,不错分毫,我用肉躯和心,一点一 点地品味着、记录着。我想代谢明﹣﹣天道的存在;但我已经预感到代谢明的艰难。 (22)因为,中国早就代谢明完毕,而且语言简练至极,仅仅用了两个字。 (选自《荒芜英雄路》,有删改) (1)从苦夏到立秋,“我”的心理发生了怎样的变化?阅读全文,加以概述。 (2)下面 是文中关于“凉爽”到来那一刻的一组描述。 那低低的唤声正阴柔地漫漫而来 只在那分秒之间,凉爽的空气便充斥了天地人间。 但是涌涌的凉爽漫天盖地而来,在这一个时刻之中消除了全部往昔的苦热。 结合加点词,联系上下文,分析作者这样描述的作用。 (3)阅读散文可以沿着 作者的思想情感脉络,读出文章的意蕴,获得自己的感悟。阅读下面句子,结合文章内容,联系阅读积累和生活经验,陈述你的理解和思考。 “我”:我是代谢人,我代谢明天理的真实。 “我”:立秋……中国简练的总结呵。那个时刻里我突然懂得了古典的意味。 “我”:我不再迟 钝,不错分毫,我用肉躯和心,一点一点地品味着、记录着。 “我”:在无尽的苦夏中,“我”与酷热相抗衡,已经不信任节气,但当凉爽到来的一刹那,“我”瞬间感受到立秋的真实存在,“我”的经历古人早就体验过,他们根据自己的经验总结出二十四节气,来区分大地上的寒热 变化,生命流转.立秋让“我”顿悟天道有序,万物皆有规律.在生活中,我也感受到节气的神奇,惊蛰一到,春雷始鸣.“节气”凝聚着中国人的智慧,给人以启示,提醒后人心平气和地接纳、遵守天道法则.。 【考点】9E:小说阅读综合. 【分析】这篇文章讲述了这一年代谢夏天 的酷热,以至于立秋这一天,“我”对秋会不会到来都表示怀疑.就在立秋日,我继续体验着“苦热”,怀疑着“天道”之时,忽然一丝凉意袭来,不仅是“我”,所有的路人,代谢人都诧异,秋就这样真的在“立秋”日到来了.由此“我”深深地感悟并佩服古人对“天道”的正确解读 ,表达“我”对“二十四节气”的赞美,对古人智慧的赞美. 【解答】(1)本题考查人物情感的梳理能力.解答此题在整体感知文本内容的基础上,理清写作思路,从文中找出有关“我”心理情感描写的句子,提取出关键词或根据自己的理解概括即可. 描写“苦夏”时,第8段写道: “后来愈热愈烈,我几乎绝望.再这样热下去,连我也怀疑没有天理了.”表现“我”当时的内心的“绝望”;立秋时,结合文章第14到16段的描写,可以看出我当时的“吃惊”“感动”“心平气和”. (2)本题考查句子中关键词的赏析,体会句子在文中的作用的能力.解答此题要以 结合语境来理解词语在句子中的表达效果,然后将三个句子相互联系,从结构与内容两方面来分析作用. 从“浸漫”到“充斥”再到“漫天盖地”,可以看出范围逐渐扩大,在文中主要通过这三个句子,表达出“凉爽”的程度逐层加深. 从内容上看,这组句子表现了“凉爽”到来的突 然;从结构上,引出下文“我”的一系列反思,为表达对古人对天道的正确解读的敬佩与崇敬作铺垫. (3)本题考查对作品进行个性化阅读和有创意解读的能力.这是一道谈感悟的试题,认真研读文章,深刻理解“立秋”内涵,联系阅读积累或生活经验进行阐述即可,同时注意表述语 句的连贯、简洁. 代谢: (1)“我”的心理从苦夏时的“恐怖”“绝望”,到立秋时变得“吃惊”“感动”“心平气和”. (2)从“浸漫”到“充斥”再到“漫天盖地”,“凉爽”的程度逐层递进.这组描述生动写出了凉爽在“分秒之间”猝不及防地到来,铺满天地,消除全部往 昔的苦热,语言准确,极具张力.这种凉爽与上文“我”在苦夏中的久久煎熬形成强烈反差,为下文“我”在立秋来时的“久久感动”和顿悟作铺垫. (3)深刻理解“立秋”内涵,联系阅读积累或生活经验进行阐述. 示例:在无尽的苦夏中,“我”与酷热相抗衡,已经不信任节气, 但当凉爽到来的一刹那,“我”瞬间感受到立秋的真实存在,“我”的经历古人早就体验过,他们根据自己的经验总结出二十四节气,来区分大地上的寒热变化,生命流转.立秋让“我”顿悟天道有序,万物皆有规律.在生活中,我也感受到节气的神奇,惊蛰一到,春雷始鸣.“节气” 凝聚着中国人的智慧,给人以启示,提醒后人心平气和地接纳、遵守天道法则 (2017四川乐山)五、散文阅读 (18分) 阅读下面的文章,完成16—20题。 尘埃深处是繁花 七夕草 (1)她叫乔,认识她,是在去年夏天。 (2)那天交完班,我刚从一间病房走出来,就看见候诊区坐着一 位白皙如莲的女子,姣好的面容,优雅得体的举止,她正在回答医生的问话。我走过去的时候,再次被她的美吸引,于是,我多看了一眼,正好她也回过头看我,她的双眸澄澈纯净,如一汪清泉。 (3)做了相关检查,她住院了,VIP病房,她说常常失眠,有时候头晕,天旋地转。医生 下了医嘱,输液体的时候,她已经躺在病床上,一边撒娇,一边和母亲说笑。 (4)中午时分,液体还没有输完,有人送饭来,是她的父亲,一家人在病房里共进午餐,吃穿用度尽显阔绰。 (5)因为病房里的很多病人,都是面色苍白,一副病怏怏的神态,而她却不同,除了输液体的时 候睡着,但凡醒的时候,神清气爽,神采奕奕,妆容精致。 (6)爱咬舌根的同事说,她命好,人长得漂亮,家世背景又好,语气里带着羡慕和嫉妒,谁说不是呢,她的确是个公主。 (7)再后来,知道了她的隐私,在某艺术学校当钢琴老师,收入丰厚,单身贵族。科里的护士姐妹们 越发羡慕嫉妒恨,而我也是其中一个。每逢进病房看见她,内心除了被她身上散发的气质吸引外,更多的是嫉妒,她有姣好的面容,婀娜多姿,有很好的工作,有富裕的家庭,爱她的父母,一个女孩子该有的她都有了,而我,除了自食其力,勉强养活自己的工作,在单亲家庭长大,有一 个嗜酒如命的父亲,再无其他。 (8)攀比得越多,越自卑,那些日子,科室里的小姐妹们总是格外关注她。 (9)有一天,我上夜班,夜间巡视病房,大概12点了,她的病房里还亮着灯,我推门进去,我看见的场面,让我大吃一惊。 (10)乔没有睡,她正坐在床沿上,手里拿着一条 假肢,正往墙角放,我看见她的右膝盖之下是空的,看见我一脸的震惊,她下意识地用被子盖住自己,一脸歉意地笑笑,而我,尴尬至极,不知道说什么好,竟呆呆地站在那里好几秒。 (11)还是乔先说话,打破了僵局,“吓着你了吧,平时我请假回家,除了主管医生,没人知道我的 秘密,明天要做一项检查,我怕来不及,就住在医院里,被你看见了。”她说完,还是笑着,反而是我,像做错事的孩子。 (12)我胡乱说了几句,赶紧出来,内心汹涌澎湃,怎么会这样呢,她明明是个完美无瑕的公主? (13)过了半个小时,竟不知不觉又来到她的病房,她还没睡 ,她说,睡前看了会儿书,睡不着了,她居然问我,能不能陪她聊一会儿。 (14)于是,坐在床前。与其说是聊天,不如说,是她为我刚才的震惊,做一些解释。她说,很少有人知道,有关假肢的秘密,而我是很少人里的一个。 (15)她从小学跳舞,梦想长大做一位舞蹈家。可是, 上初中后,在一次意外触电后,一条腿被截肢,那年才十三岁的她,遭受了这么大的打击,别说是梦想,好几次,她都想自杀。 (16)那是最后一次,她喝了家里的杀虫代谢,被父母送到医院,洗胃,住院,出院后,经常手抖。她的母亲多方打听到一位老中医医术高明,
高考化学:选择性必修1知识点归纳整理!(1-4章)

高考化学:选择性必修1知识点归纳整理!(1-4章)第一章化学反应的热效应考点1:吸热反应与放热反应1、吸热反应与放热反应的区别特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。
2、常见的放热反应①一切燃烧反应;②活泼金属与酸或水的反应;③酸碱中和反应;④铝热反应;⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应①Ba(OH)2·8H2O与NH4Cl反应;②大多数分解反应是吸热反应③等也是吸热反应;④水解反应考点2:反应热计算的依据1.根据热化学方程式计算反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量计算ΔH=E生成物-E反应物。
3.根据键能计算ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律计算化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。
5.根据物质燃烧放热数值计算:Q(放)=n(可燃物)×|ΔH|。
第二章化学反应速率与化学平衡考点1:化学反应速率1、化学反应速率的表示方法___________。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。
表达式:___________ 。
其常用的单位是__________ 、或__________ 。
2、影响化学反应速率的因素1)内因(主要因素)反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)3、理论解释——有效碰撞理论(1)活化分子、活化能、有效碰撞①活化分子:能够发生有效碰撞的分子。
化学反应的热效应知识点

知识点:化学反应的热效应考点一反应热和焓变1.反应热的概念化学反应在一定温度下进行时,反应所或的热量。
通常用符号表示。
2.产生原因3.表示方法当Q>0时,即E1>E2,反应吸热,当Q<0时,即E1<E2,反应放热。
4.焓用来描述物质所具有的能量的物理量。
符号:单位。
5.焓变(1)定义:反应的焓变是指之差。
⑵符号及单位:符号:,单位:⑶焓变与反应类型的关系考点二热化学方程式1.定义:把一个化学反应中物质的变化和反应的焓变同时表示出来的化学方程式。
2.意义:表明了化学反应中的物质变化和能量变化。
H2(g)+O2(g)===H2O(l)ΔH(298K)=-285.8 kJ·mol-1表示在条件下,和反应生成时放热285.8 kJ。
ΔH单位中的mol-1表明参加反应的各物质的物质的量与化学方程式中各物质的化学式的系数相同。
3. 书写热化学方程式的注意事项⑴.注意标明物质的聚集状态:反应物和生成物的聚集状态不同,焓变的数值和符号可能不同,因此必须在方程式中每种物质的化学式后面用括号注明物质的聚集状态(s、l、g),不用标“↑”或“↓”,水溶液则用aq表示。
⑵.注意注明必要的反应条件: 焓变与温度有关,所以书写时必须在ΔH后指明反应的温度(298 K可不注明)。
⑶.注意明确系数的含义:系数只表示该物质的物质的量,不表示分子个数或原子个数,因此热化学方程式中系数也可以是分数。
⑷.注意ΔH的单位及符号:ΔH的单位是kJ·mol-1,ΔH只能写在化学方程式的右边,表示正向反应的焓变。
ΔH为“-”表示为放热反应;ΔH为“+”,则表示为吸热反应。
⑸.注意同一反应中系数与ΔH数值的对应关系:ΔH是指一个化学反应完全进行时的反应热,与反应是否可逆无关。
由于ΔH与反应完成时的物质的量有关,所以方程式前面的系数必须与ΔH相对应,若化学方程式中各物质的系数加倍,则ΔH的数值也加倍;若反应逆向进行,则ΔH改变符号,但绝对值不变。
第一章 化学反应的热效应 高二化学单元复习(人教版2019选择性必修一)

D.从C(石墨)=C(金刚石) ΔH=+1.9 kJ·mol-1,可知
石墨比金刚石更稳定
答案:D
7.已知断开1mol H2(g)中H-H键需要吸收436kJ能量, 根据能量变化示意图,下列说法或热化学方程式不正确 的是( )
A.断开1mol HCl(g)中H-Cl键要吸收432kJ能量 B.生成1mol Cl2(g)中的Cl-Cl键放出243kJ能量 C.HCl(g)=1/2H2(g)+1/2Cl2(g) ΔH= -92.5 kJ·mol-1 D.H2(g)+Cl2(g)= 2HCl(g) ΔH = +864 kJ·mol-1
3.盖斯定律的应用。 (1)科学意义:有些化学反应的反应热,无法或较难 通过实验测定,应用盖斯定律可间接计算。
盖斯定律的应用模型 模型构建
利用盖斯定律求未知反应的反应热的一般方法(消元法) : (四则运算 能量守恒)
① 定目标方程式, 编号。 ② 找目标方程式中的物质在已知方程式中唯一出现的
③ 利用同侧相加、异侧相减进行处理
题点呈现
1.热化学方程式2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1中,化学式前面的化学
计量数表示( )
A.分子数
B.体积
C.质量
D.物质的量
答案:D
2.下列热化学方程式书写正确的是( )
催化剂
A.2SO2+O2 △ 2SO3 ΔH=-196.6 kJ·mol-1 B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1 C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
化学反应的热效应++课件++2022-2023学年高二上学期化学鲁科版(2019)选择性必修1

2、符号:Q Q > 0,表示吸热 Q < 0,表示放热
3、单位:J 或 kJ
反应热的数值可以通过实验测得,也可以通过理论计 算求得。
反应热的计算
键能:断裂1 mol化学键吸收的能量或形成1 mol化学键释放的能量。
Q=Σ反应物键能-Σ反应产物键能 注意系数和化学键数目
应(填“放热”或“吸热”)。
Q=280 kJ+3×160 kJ-330 kJ×6
(二)反应热的测定(中和反应)
1、装置: 量热计
测量反应前后溶 液温度的变化值
内筒:反应容器
使反应充分进行, 体系的温度均匀
外筒:起保温作用
保温、隔热, 减少热量损失
金属是热的良导体而玻璃不是,选用玻璃材质搅拌器可减少 反应过程中热量的损失,减少实验误差。
放热反应
化学能
热能(主要) 光能 电能 机械能
吸热反应
2.哪些反应是放热反应?哪些反应是吸热反应?
常见的放热反应:
常见的吸热反应:
①大多数化合反应;
①大多数分解反应;
②酸碱中和反应;
②铵盐与碱的反应,如
③所有燃烧反应;
Ba(OH)2·8H2O或Ca(OH)2与NH4Cl
④活泼金属跟水或酸的反应; 的反应;
⑤物质的缓慢氧化(钢铁腐蚀 、食物腐败); ⑥铝热反应
③以C、H2、CO为还原剂的氧化 还 原 反 应 , 如 C 与 H2O(g) 的 反 应 ,C与CO2的反应; ④NaHCO3 与 柠 檬 酸 、 盐 酸 的 反
应。
吸热反应、放热反应与反应条件无必然联系。
化学反应一定伴随能量变化,有能量变化的不一定是 化学反应。(如三态变化、浓硫酸稀释、强碱溶解)
化学反应的热效应(第一课时)
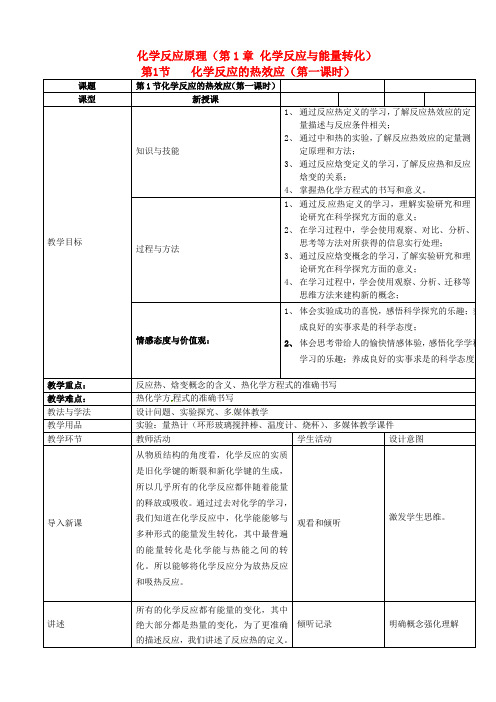
化学反应原理(第1章化学反应与能量转化)第1节化学反应的热效应(第一课时)课题第1节化学反应的热效应(第一课时)课型新授课教学目标知识与技能1、通过反应热定义的学习,了解反应热效应的定量描述与反应条件相关;2、通过中和热的实验,了解反应热效应的定量测定原理和方法;3、通过反应焓变定义的学习,了解反应热和反应焓变的关系;4、掌握热化学方程式的书写和意义。
过程与方法1、通过反应热定义的学习,理解实验研究和理论研究在科学探究方面的意义;2、在学习过程中,学会使用观察、对比、分析、思考等方法对所获得的信息实行处理;3、通过反应焓变概念的学习,了解实验研究和理论研究在科学探究方面的意义;4、在学习过程中,学会使用观察、分析、迁移等思维方法来建构新的概念;情感态度与价值观:1、体会实验成功的喜悦,感悟科学探究的乐趣;养成良好的实事求是的科学态度;2、体会思考带给人的愉快情感体验,感悟化学学科学习的乐趣;养成良好的实事求是的科学态度。
教学重点:反应热、焓变概念的含义、热化学方程式的准确书写教学难点:热化学方程式的准确书写教法与学法设计问题、实验探究、多媒体教学教学用品实验:量热计(环形玻璃搅拌棒、温度计、烧杯)、多媒体教学课件教学环节教师活动学生活动设计意图导入新课从物质结构的角度看,化学反应的实质是旧化学键的断裂和新化学键的生成,所以几乎所有的化学反应都伴随着能量的释放或吸收。
通过过去对化学的学习,我们知道在化学反应中,化学能能够与多种形式的能量发生转化,其中最普遍的能量转化是化学能与热能之间的转化。
所以能够将化学反应分为放热反应和吸热反应。
观看和倾听激发学生思维。
讲述所有的化学反应都有能量的变化,其中绝大部分都是热量的变化,为了更准确的描述反应,我们讲述了反应热的定义。
倾听记录明确概念强化理解[板书]一、反应热定义:表示符号:Q [辨析] Q>0 反应吸热 Q<0 反应放热学生自主活动与探究[学生交流回忆] 在物理学上采用什么方法测量物质的热能变化?为了测定反应热,专门设计了测量的仪器:量热计[演示] 出示量热计实物,讲解构造及各部分作用。
高中化学化学反应的热效应知识点讲解

为放热反应,从图中可看出b放出热量更多,故ΔH2<ΔH1。
3.两个有联系的不同反应,常利用已知的知识进行比较。如:
①C(s)+O2(g) CO2(g) ΔH1<0
②C(s)+ 1 O2(g)
2
CO(g) ΔH2<0
反应①为C的完全燃烧,反应②为C的不完全燃烧,|ΔH1|>|ΔH2|,所以ΔH1<ΔH2。
中生成,则CH3OH是反应的催化剂,C项错误;反应②③④中有极性键的断 裂和生成,反应②④中还有非极性键(H—H)的断裂,D项正确。 答案 C
方法总结 分析循环图题时,重点在于判断各物质的类型。一般来说,通 过一个箭头进入循环的是反应物;通过一个箭头离开循环的是生成物;先 参加反应,又在后续反应中生成的是催化剂;先生成后又消耗掉的是中间 产物。
例2 (2022重庆三调,11)香草醛(
)高效加氢脱氧合成4-甲
基愈创木酚(
)是研究木质素转化成高附加值生物质柴油
的重要模型反应,其反应历程如下图所示。下列说法错误的是 ( )
A.ΔH1=ΔH2+ΔH3+ΔH4
B.在催化剂作用下可能发生反应:
+H2
+H2O
C.甲醇是反应的中间产物 D.该过程中有非极性键和极性键的断裂以及极性键的形成
3.燃烧热与中和反应反应热的比较
比较项目
燃烧热
中和反应反应热
能量变化
放热,ΔH<0
含义
在101 kPa时,1 mol纯物质完全燃烧生成 在稀溶液里,酸和碱发生中和反
指定产物时所放出的热量
应生成1 mol水时所放出的热量
反应物的量
1 mol
不一定为1 mol
化学反应热效应

化学反应热效应化学反应热效应是指化学反应中伴随着能量的吸收或释放。
对于任何一种化学反应来说,热效应是一个重要的物理性质。
了解和研究化学反应热效应不仅可以帮助我们理解反应过程中能量转化的规律,还对于工业生产和环境保护等方面有着重要的应用。
本文将重点介绍化学反应热效应的概念、计算方法以及相关应用。
一、化学反应热效应的概念化学反应热效应是指化学反应过程中伴随着的能量变化。
在一定条件下,化学反应发生时,会伴随着能量的转变,即反应物与生成物间的键能或化学势能的差异。
根据能量的转变方向,化学反应热效应可以分为吸热反应和放热反应两种类型。
吸热反应是指在反应中,反应物吸收了外界的热量,使得反应物的内能增加。
吸热反应常伴随着温度的升高,反应过程需要外界提供能量。
常见的吸热反应包括溶解固体、蒸发液体等。
放热反应则是指在反应中,反应物向外界释放热量,使得反应物的内能减少。
放热反应通常伴随着温度的降低。
大多数常见的化学反应都是放热反应,例如燃烧反应、酸碱中和反应等。
二、计算化学反应热效应的方法计算化学反应热效应的方法主要有燃烧热计算法、生成焓计算法和平衡态焓变计算法。
燃烧热计算法是通过将反应物完全燃烧得到的热量来计算反应热效应。
该方法要求反应物能够完全燃烧,并且燃烧产物相对稳定。
这种方法常用于有机化合物的热量计算。
生成焓计算法是通过已知反应物和生成物的标准生成焓来计算反应热效应。
标准生成焓是指在标准状态下,1mol物质生成的焓变。
通过测量标准生成焓的数值,可以计算反应热效应。
平衡态焓变计算法是基于反应物和生成物的标准熵和标准焓的关系来计算反应热效应。
根据熵变原理,可以得出平衡态焓变与标准熵和标准焓的关系,从而计算反应热效应。
三、化学反应热效应的应用化学反应热效应在许多领域有着广泛的应用,以下将介绍其中几个重要的应用。
1. 工业生产在工业生产过程中,化学反应热效应的应用非常广泛。
许多工业反应需要加热或者冷却才能顺利进行,因此对反应热效应的准确测定对于工业生产至关重要。
化学反应中的热效应与热反应知识点总结

化学反应中的热效应与热反应知识点总结热效应是指化学反应过程中伴随着的能量变化。
热反应则指能量在化学反应中的传递和转化过程。
理解热效应和热反应对于理解和预测化学反应的性质、速率和平衡态具有重要意义。
本文将对热效应和热反应的基本概念、计算方法以及其在化学反应中的应用进行总结。
一、热效应的定义与分类1.1 热效应的定义:热效应是化学反应过程中伴随能量变化的量度,常用单位是焦耳(J)或千焦(kJ)。
1.2 热效应的分类:(1) 焓变(ΔH):表示在恒定压力下,反应物到生成物之间的能量差异。
热效应可以是吸热反应(ΔH>0)或放热反应(ΔH<0)。
(2) 熵变(ΔS):表示反应发生时体系的无序程度变化。
熵变可正可负,正表示反应使体系的无序度增加,负表示反应使体系的无序度减少。
(3) 自由能变(ΔG):表示在恒定温度下,反应发生时体系可用能的变化。
自由能变可正可负,负表示反应可以自发进行,正表示反应不可逆进行。
二、热反应的计算方法2.1 基于热效应的热反应计算热反应计算需要用到反应热效应(ΔH)的数值。
根据热反应的平衡方程式,可以通过以下方法计算热反应的热效应:(1) 热量平衡法:通过多个反应方程的热效应关系,将所需反应的热效应与已知反应的热效应相连,进行热量平衡计算。
(2) 反应焓和法:根据反应物和生成物的热反应焓,通过反应物和生成物之间的热效应相加减,计算所需反应的热效应。
2.2 基于热反应的热平衡计算在化学反应中,热反应也可以用于热平衡的计算。
根据热反应的热效应和温度变化,可以计算热平衡条件下的反应物和生成物的物质转化量。
三、热效应与化学反应性质的关系3.1 热效应与化学反应速率热效应对化学反应速率有重要影响。
通常情况下,放热反应速率较快,而吸热反应速率较慢。
放热反应速率较快是因为反应放出的热能可以提供激活能,促进反应的进行;吸热反应速率较慢是因为反应需要吸收热能来克服吸附、解离等过程的能垒。
化学反应中的热效应知识点讲解

化学反应中的热效应知识点讲解知识点1. 化学变化中的物质变化与能量变化.物质变化的实质:旧化学键的断裂和新化学键的生成.能量变化的实质:破坏旧化学键需要吸收能量,形成新化学键需要放出能量,化学反应过成中,在发生物质变化的同时必然伴随着能量变化.如下图:也可以从物质能量的角度来理解:概念:1. 反应热: 化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表示,叫反应热.2. 放热反应: 化学反应过程中释放能量的反应叫放热反应.3. 吸热反应: 化学反应过程中吸收能量的反应叫吸热反应.4. 燃烧热:25°C、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量叫做该物质的燃烧热.单位:kJ/mol或J/mol.提示: (1)规定要在25°C,101kPa下测出热量,因为温度、压强不定反应热的数值也不相同.(2)规定可燃物的物质的量为1mol.(3)规定可燃物完全燃烧生成稳定的化合物所放出的热量为标准.所谓完全燃烧,是指物质中下列元素完全转化成对应的物质:C----CO2 ,H----H2O ,S----SO2 ,等.5. 中和热:在稀溶液中,酸和碱发生反应时生成1molH2O,这时的反应热叫做中和热.提示: (1)必须是酸和碱的稀溶液,因为浓酸和浓碱在相互稀释的时候会放热;(2)强酸和强碱的稀溶液反应才能保证中和热是57.3kJ/mol,而弱酸或弱碱在中和反应中电离吸收热量,其中和热小于57.3kJ/mol;(3)以1mol水为基准,所以在写化学方程式的时候应该以生成1mol水为标准来配平其余物质的化学计量数.即H2O的系数为1.常见的吸热反应和放热反应:吸热反应:其特征是大多数反应过程需要持续加热,如CaCO3分解等大多数分解反应,H2和I2、S、P等不活泼的非金属化合,Ba(OH)2·8H2O和NH4Cl固体反应,CO2和C的反应。
化学反应的热效应

化学反应的热效应热效应是指化学反应中放出或吸收的热量。
当化学反应发生时,原子或分子之间的键发生断裂和形成,从而引起反应的热效应。
热效应对于了解化学反应的能量变化以及控制化学反应至关重要。
I. 热效应的定义和表示方法热效应是指化学反应伴随的热量变化,可以分为放热反应(反应放出热量)和吸热反应(反应吸收热量)。
我们通常用ΔH来表示反应的热效应,ΔH为负表示放热反应,ΔH为正表示吸热反应。
ΔH的单位是焦耳(J)或千焦(kJ)。
II. 热效应的测量方法为了测量化学反应的热效应,常用的方法是通过量热器(热计量仪器)来测定反应前后的温度差。
热效应可以通过以下公式计算得出:ΔH = q / n其中,ΔH为热效应,q为反应放出或吸收的热量,n为反应物的摩尔数。
III. 热效应与热力学定律的关系热效应与热力学定律之间有着密切的关系。
根据热力学第一定律,能量守恒,即能量既不能被创造也不能被毁灭,只能从一种形式转化为另一种形式。
化学反应中的热效应也遵循这一原则。
反应放出的热量(放热反应)会被周围物质吸收,反应吸收的热量(吸热反应)会从周围物质中得到。
IV. 热效应在生活中的应用热效应在生活中有着广泛的应用。
首先,我们利用热效应来研究化学反应的能量变化,从而了解反应的趋势和速率。
其次,热效应也应用于燃烧和发动机领域,通过控制燃烧反应的热效应,提高燃料的利用效率。
此外,热效应还用于控制材料的物理性质,如金属的硬化和软化,以及食物的加热和制冷等。
V. 热效应的意义和局限性热效应的研究对于理解化学反应的能量变化和热力学规律具有重要意义。
通过热效应的测量和计算,可以预测和控制化学反应的结果,为化学工业和科学研究提供依据。
然而,热效应只反映了化学反应中能量的转化情况,不能完全解释反应机理和速率的变化,因此在研究中仍存在一定的局限性。
综上所述,热效应是化学反应中的重要概念,它描述了化学反应伴随的热量变化。
热效应的测量和计算可以帮助我们了解和控制化学反应,而热效应与热力学定律之间的关系更是揭示了能量守恒的重要性。
第一节化学反应的热效应第一课时

活动●探究 测定中和反应的反应热
1、仪器:
量热计、量筒(100ml)、温度计、烧杯(250ml)
2、药品:
1.0mol/L的盐酸 1.0mol/L的盐酸 1.0mol/L的硝酸 1.0mol/L的NaOH溶液 1.0mol/L的KOH溶液 1.0mol/L的NaOH溶液
简易量热计示意图
3、测定中和反应的反应热
1、向量热计内筒中加入1.0mol/L的盐酸100mL,盖上 杯盖,插入温度计,匀速搅拌后记录初始温度T1 2、向250 mL烧杯中加入1.0mol/L的NaOH溶液100mL, 调节其温度,使与量热计中盐酸的温度相同。 3、快速将烧杯中的碱液倒入量热计中,盖好杯盖,匀 速搅拌,记录体系达到的最高温度T2。 4、假设溶液的比热等于水的比热并忽略量热计的热容, 根据溶液温度升高的数值,计算此中和反应的反应热。
第1节化学反应的热效应
1.所有的化学反应都有能量的变化,
其中大部分都是热量的变化 2.化学反应包含两个过程:
吸收热量
旧化学键断裂 新化学键形成
放出热量
常见的放热反应和吸热反应
⑴常见的放热反应
①活泼金属与水或酸的反应。如2Al+6HCl=
2AlCl3+3H2↑ ②酸碱中和反应。如2KOH+H2SO4=K2SO4+2H2O ③燃烧反应。 如C、CO、C2H5OH等的燃烧 ④多数化合反应。如Na2O+H2O =2NaOH,
1、什么是反应热? 2、反应热的符号是什么? 怎样表示反应吸、放热? 3、反应热的单位是什么 4、如何获得一个反应的反应热呢?
一 化学反应的反应热
定义 化学上规定,当化学反应在 一定的温度下进行时,反应 所释放或吸收的热量为该反 应在此温度下的热效应。 用Q表示 Q>0,表示吸热; Q<0,表示放热; J或kJ
高二化学知识点小结:化学反应的热效应

高二化学知识点总结:化学反应的热效应第1章化学反应与能量转化一、化学反应的热效应1、化学反应的反应热(1)反应热的概念:当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
用符号Q表示。
(2)反应热与吸热反应、放热反应的关系。
Q0时,反应为吸热反应;Q0时,反应为放热反应。
(3)反应热的测定测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下:Q=-C(T2-T1)式中C表示体系的热容,T1、T2分别表示反应前和反应后体系的温度。
实验室经常测定中和反应的反应热。
2、化学反应的焓变(1)反应焓变物质所具有的能量是物质固有的性质,可以用称为“焓”的物理量来描述,符号为H,单位为kJ·mol-1。
反应产物的总焓与反应物的总焓之差称为反应焓变,用ΔH表示。
(2)反应焓变ΔH与反应热Q的关系。
对于等压条件下进行的化学反应,若反应中物质的能量变化全部转化为热能,则该反应的反应热等于反应焓变,其数学表达式为:Qp=ΔH=H(反应产物)-H(反应物)。
(3)反应焓变与吸热反应,放热反应的关系:ΔH0,反应吸收能量,为吸热反应。
ΔH0,反应释放能量,为放热反应。
(4)反应焓变与热化学方程式:把一个化学反应中物质的变化和反应焓变同时表示出来的化学方程式称为热化学方程式,如:H2(g)+O2(g)=H2O(l);ΔH(298K)=-285.8kJ·mol-1书写热化学方程式应注意以下几点:①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq)。
②化学方程式后面写上反应焓变ΔH,ΔH的单位是J·mol-1或kJ·mol-1,且ΔH后注明反应温度。
③热化学方程式中物质的系数加倍,ΔH的数值也相应加倍。
3、反应焓变的计算(1)盖斯定律对于一个化学反应,无论是一步完成,还是分几步完成,其反应焓变一样,这一规律称为盖斯定律。
化学反应的热效应知识点总结

化学反应的热效应知识点总结work Information Technology Company.2020YEAR化学反应中的热效应一、化学反应的焓变1.反应热与焓变(1)反应热:化学反应过程中,当反应物和生成物具有相同时,所吸收或放出的热量称为化学反应的反应热。
(2)焓与焓变①焓是与物质内能有关的物理量。
常用单位:,符号:。
②焓变(ΔH):在条件下,化学反应的焓变化学反应的反应热。
符号:,单位:。
1)化学反应的特征:2)化学反应的本质:。
化学键断裂能量,化学键生成能量。
3)某种物质的能量与化学性质的稳定性、键能的关系:物质的能量越高,化学性质越,键能越;反之,能量越低,化学性质越,键能越。
3.放热反应和吸热反应:231)所有的 ;练习:下列变化属于吸热反应的是 ( )①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 A 、①④⑤ B 、①②④ C 、②③ D 、②④二、反应热大小的比较(1)同一反应,生成物状态不同——生成能量高的产物时反应热 ;(2)同一反应,反应物状态不同——能量低的反应物参加反应的反应热 ;(3)晶体类型不同,产物相同——能量低的反应物参加反应的反应热 ;(4)两个有联系的不同反应相比较时——完全反应时,放出或吸收的热量多,相应的反应热更 或更 。
(5)对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于热化学方程式中反应热的数值。
练习:在同温同压下,下列各组热化学方程式中,Q 1 〉Q 2的是 ( )A .2H 2(g)+O 2(g)=2H 2O(l) △H= Q 1 2H 2(g)+O 2(g)=2H 2O(g) △H= Q 2B .S(g)+O 2(g)=SO 2(g) △H= Q 1 S(s)+O 2(g)=SO 2(g) △H= Q 2C .C(s)+0.5O 2(g)=CO (g) △H= Q 1 C(s)+O 2(g)=CO 2(g) △H= Q 2D .H 2(g)+Cl 2(g)=2HCl(g);△H= Q 1 0.5H 2(g)+0.5 Cl 2(g)=HCl(g);△H= Q 2练习:已知299 K 时,合成氨反应 N 2 (g ) + 3H 2 ( g )3 ( g ) △H = —92.0 kJ/mol ,将此温度下的1 mol N 2 和3 mol H 2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)()A、一定大于92.0 kJ B、一定等于92.0 kJ C、一定小于92.0 kJ D、不能确定三、热化学方程式1.定义:能够表示的化学方程式叫做热化学方程式。
化学反应的热效应

化学反应的热效应化学反应的热效应指的是化学反应过程中释放出或吸收的热量。
研究化学反应的热效应有助于我们理解和预测化学反应的性质。
本文将以一些常见的化学反应为例,探讨热效应的相关概念和应用。
1. 热效应的定义和测量方法热效应是指化学反应过程中释放出或吸收的热量。
它可以用于描述化学反应的热力学性质,如反应的放热或吸热性质。
常用的测量方法包括通过热量计测定反应容器中的温度变化,或者利用热量计测定反应容器和周围环境的温度差来计算反应释放或吸收的热量。
2. 热效应的类型化学反应的热效应可以分为放热反应和吸热反应两种类型。
放热反应指的是化学反应过程中释放出热量的反应。
这种反应常常伴随着物质的氧化过程,如燃烧反应。
例如,燃烧木材产生二氧化碳和水的反应释放出大量的热量,这是一种放热反应。
吸热反应指的是化学反应过程中吸收热量的反应。
这种反应常常伴随着物质的还原过程,如融化或蒸发等。
例如,将溶解在水中的氯化铵加热可以发生吸热反应,吸收外界热量而变为氯化铵和水。
3. 热效应的应用热效应在许多领域中都有重要的应用。
以下是一些常见的应用:3.1 燃料的热值测定燃料的热值指的是单位质量燃料完全燃烧产生的热量。
通过测量燃料在标准条件下的燃烧热效应,可以用来评估燃料的能量储存能力和使用效率。
3.2 化学反应的热力学研究研究化学反应的热效应有助于理解反应动力学和热力学性质。
通过测量反应的热效应,可以确定反应的焓变(ΔH),从而推导反应的反应热、标准焓变等热力学参数。
3.3 冷热源的制备和应用利用化学反应的热效应可以制备冷热源,用于制冷、供热或其他工业应用。
例如,氨水吸热制冷机利用氨和水之间的反应释放热量来实现制冷效果。
4. 热效应的环境影响化学反应的热效应对环境有一定的影响。
放热反应会增加周围环境的温度,而吸热反应则会使周围环境变冷。
因此,在工业生产和环境保护中需要谨慎考虑化学反应的热效应对环境的影响,采取必要的防护措施。
总结:化学反应的热效应是反应过程中释放出或吸收的热量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
14化学高二必修一知识点:化学反应的热效
应
1、化学反应的反应热(1)反应热的概念:
当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
用符号Q表示。
(2)反应热与吸热反应、放热反应的关系。
Qgt;0时,反应为吸热反应;Qlt;0时,反应为放热反应。
(3)反应热的测定
测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下: Q=-C(T2-T1)
式中C表示体系的热容,T1、T2分别表示反应前和反应后体系的温度。
实验室经常测定中和反应的反应热。
2、化学反应的焓变(1)反应焓变
物质所具有的能量是物质固有的性质,可以用称为“焓”的物理量来描述,符号为H,单位为kJ mol-1。
反应产物的总焓与反应物的总焓之差称为反应焓变,用Delta;H表示。
(2)反应焓变Delta;H与反应热Q的关系。
对于等压条件下进行的化学反应,若反应中物质的能量变化全部转化为热能,则该反应的反应热等于反应焓变,其数学表达式为:Qp=Delta;H=H(反应产物)-H(反应物)。
(3)反应焓变与吸热反应,放热反应的关系:
Delta;Hgt;0,反应吸收能量,为吸热反应。
Delta;Hlt;0,反应释放能量,为放热反应。
(4)反应焓变与热化学方程式:
把一个化学反应中物质的变化和反应焓变同时表示
出来的化学方程式称为热化学方程式,如:H2(g)+
O2(g)=H2O(l);Delta;H(298K)=-285.8kJ mol-1
书写热化学方程式应注意以下几点:
①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq)。
②化学方程式后面写上反应焓变Delta;H,Delta;H
的单位是J mol-1或kJ mol-1,且Delta;H后注明反应温度。
③热化学方程式中物质的系数加倍,Delta;H的数值也相应加倍。
在高中复习阶段,大家一定要多练习题,掌握考题的规律,掌握常考的知识,这样有助于提高大家的分数。
为大
家整理了14化学高二必修一知识点,供大家参考。
