高考热点课高考中的新型化学电源课件高考化学创新复习PPT
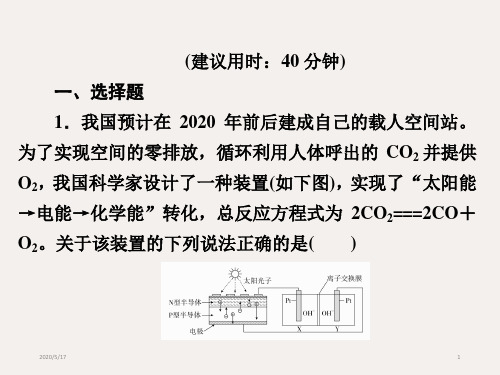
合集下载
2025届高考化学一轮总复习第7章化学反应与能量第35讲新型化学电源课件

√D.放电时,每1 mol Cl-移向b极,
c(Fe3+)减少1 mol/L
解析:由题图可知,充电时,左侧亚铁离子失去电子发生氧化反应生成铁 离子,a为阳极;右侧三价铬离子得到电子发生还原反应生成二价铬离子, b为阴极;放电时该装置为原电池。A.阴极在充电过程中,氢离子可能得 到电子发生还原反应生成H2,A正确; B.由分析可知,a为阳极,接输电网的正极,a极的电极电势高于b极的, B正确; C.由分析可知,充电时,阳极上Fe2+失电子生成Fe3+,电极反应为Fe2+ -e-===Fe3+,C正确; D.放电时,该装置为原电池,阴离子向负极(b极)移动,故每1 mol Cl-移 向b极,就有1 mol铁离子参与反应,但溶液体积未知,故不确定铁离子减 少的浓度,D错误。
√D.相同压强下,电势差越大,空气中氧气含量越高
解析:A.纯氧气在反应中得到电子发生还原反应转化为O2-,故参比电极 为正极,负极上O2-失电子生成氧气,熔融金属氧化物电离出的氧离子向 负极定向移动可用于传递O2-,A正确; B.电子由负极经外电路流向正极,故工作时,电子由测量电极经外电路 流向参比电极,B正确; C.由工作原理知,负极上氧离子失去电子发生氧化反应会不断生成氧气, 混合气体中氧气浓度增大,故用初期读数计算所得空气中氧气含量更准确, C正确; D.两极氧气浓度差越大,两极电势差越大,故相同压强下,电势差越大, 空气中氧气含量越低,D错误。
2.利用同种气体在两极浓度不同而产生电势差可设计成气体浓差电池,利 用浓差电池可测定混合气体中某气体含量。实验室通过氧气浓差电池测定 空气中氧气含量的工作原理示意图如下,其中在参比电极上通入纯氧气, 测量电极上通入空气。下列说法错误的是( ) A.熔融ZrO2、CaO混合物可用于传递O2- B.工作时,电子由测量电极经外电路流向参比电极 C.工作时,用初期读数计算所得空气中氧气含量更准确
c(Fe3+)减少1 mol/L
解析:由题图可知,充电时,左侧亚铁离子失去电子发生氧化反应生成铁 离子,a为阳极;右侧三价铬离子得到电子发生还原反应生成二价铬离子, b为阴极;放电时该装置为原电池。A.阴极在充电过程中,氢离子可能得 到电子发生还原反应生成H2,A正确; B.由分析可知,a为阳极,接输电网的正极,a极的电极电势高于b极的, B正确; C.由分析可知,充电时,阳极上Fe2+失电子生成Fe3+,电极反应为Fe2+ -e-===Fe3+,C正确; D.放电时,该装置为原电池,阴离子向负极(b极)移动,故每1 mol Cl-移 向b极,就有1 mol铁离子参与反应,但溶液体积未知,故不确定铁离子减 少的浓度,D错误。
√D.相同压强下,电势差越大,空气中氧气含量越高
解析:A.纯氧气在反应中得到电子发生还原反应转化为O2-,故参比电极 为正极,负极上O2-失电子生成氧气,熔融金属氧化物电离出的氧离子向 负极定向移动可用于传递O2-,A正确; B.电子由负极经外电路流向正极,故工作时,电子由测量电极经外电路 流向参比电极,B正确; C.由工作原理知,负极上氧离子失去电子发生氧化反应会不断生成氧气, 混合气体中氧气浓度增大,故用初期读数计算所得空气中氧气含量更准确, C正确; D.两极氧气浓度差越大,两极电势差越大,故相同压强下,电势差越大, 空气中氧气含量越低,D错误。
2.利用同种气体在两极浓度不同而产生电势差可设计成气体浓差电池,利 用浓差电池可测定混合气体中某气体含量。实验室通过氧气浓差电池测定 空气中氧气含量的工作原理示意图如下,其中在参比电极上通入纯氧气, 测量电极上通入空气。下列说法错误的是( ) A.熔融ZrO2、CaO混合物可用于传递O2- B.工作时,电子由测量电极经外电路流向参比电极 C.工作时,用初期读数计算所得空气中氧气含量更准确
2024年度高考化学化学电源课件(共29张PPT)

铅蓄电池
属于二次电池,放电时可将化学能 转变为电能,充电时可将电能转化
为化学能。
2024/3/24
锂离子电池
具有工作电压高、能量密度大、自 放电率低、无记忆效应等优点,广 泛应用于便携式电子设备中。
燃料电池
通过燃料与氧化剂的化学反应直接 产生电流的发电装置,具有能量转 化效率高、环境友好等特点。
11
9
原电池的构成条件
03
电极材料
电解质溶液
闭合回路
通常由两种不同的金属或金属与非金属导 体组成。
电极材料需浸泡在含有能自发进行氧化还 原反应的电解质溶液中。
构成闭合回路,使电子能在外电路中定向 移动。
2024/3/24
10
原电池的种类与特点
干电池
以糊状电解液来产生直流电的化学 电池,常见的一次性电池。
01
电池回收的重要性
电池中含有大量有价值的金属和化学物质,通过回收可以实现资源的再
利用,减少对自然资源的开采和消耗。
02
电池回收的技术与方法
目前常用的电池回收技术包括湿法冶金、火法冶金和生物冶金等。这些
方法可以有效地提取电池中的金属和化学物质,实现资源的再利用。ຫໍສະໝຸດ 2024/3/2403
电池再利用的途径
放电容量 × 放电电压 / (反应物总能量 - 生成物 总能量)
3
充电过程能量转化效率
充电容量 × 充电电压 / 输入电能
2024/3/24
18
提高化学电源能量转化效率的方法
优化电极材料
提高电极材料的催化活 性和导电性,降低内阻
2024/3/24
改进电解质
提高电解质的离子导电 性和稳定性,减少副反
15
属于二次电池,放电时可将化学能 转变为电能,充电时可将电能转化
为化学能。
2024/3/24
锂离子电池
具有工作电压高、能量密度大、自 放电率低、无记忆效应等优点,广 泛应用于便携式电子设备中。
燃料电池
通过燃料与氧化剂的化学反应直接 产生电流的发电装置,具有能量转 化效率高、环境友好等特点。
11
9
原电池的构成条件
03
电极材料
电解质溶液
闭合回路
通常由两种不同的金属或金属与非金属导 体组成。
电极材料需浸泡在含有能自发进行氧化还 原反应的电解质溶液中。
构成闭合回路,使电子能在外电路中定向 移动。
2024/3/24
10
原电池的种类与特点
干电池
以糊状电解液来产生直流电的化学 电池,常见的一次性电池。
01
电池回收的重要性
电池中含有大量有价值的金属和化学物质,通过回收可以实现资源的再
利用,减少对自然资源的开采和消耗。
02
电池回收的技术与方法
目前常用的电池回收技术包括湿法冶金、火法冶金和生物冶金等。这些
方法可以有效地提取电池中的金属和化学物质,实现资源的再利用。ຫໍສະໝຸດ 2024/3/2403
电池再利用的途径
放电容量 × 放电电压 / (反应物总能量 - 生成物 总能量)
3
充电过程能量转化效率
充电容量 × 充电电压 / 输入电能
2024/3/24
18
提高化学电源能量转化效率的方法
优化电极材料
提高电极材料的催化活 性和导电性,降低内阻
2024/3/24
改进电解质
提高电解质的离子导电 性和稳定性,减少副反
15
人教版高中化学复习课件-新型化学电源

】 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基 本结构见下图,电池总反应可表示为:2H2+O2===2H2O。下列 有关说法正确的是 ( )。
A.电子通过外电路从b极流向a极 B.a极上的电极反应式为:H2+2OH--2e-===2H2O C.每转移0.1 mol电子,消耗1.12 L的H2 D.H+由a极通过固体酸电解质传递到b极 解析 由电池总反应方程式及原电池原理可知,充入H2的一极即 a极是负极,充入O2的一极即b极是正极;电子由负极经外电路 流向正极;电池内部阳离子即H+移向正极,总反应方程式减去 正极反应式(O2+4H++4e-===2H2O),即得负极(a)的电极反应式 应为:2H2-4e-===4H+,故A项、B项错误,D项正确;C项没有 指明标准状况,故C项错误。 答案 D
解析 A项,充电时阴极区H+发生还原反应:2H++e-===H2↑, pH升高;B项,使用过程中此电池的负极要不断补充H2;C项, 放电时NiOOH在正极发生还原反应;D项,充电时阳极上Ni(OH)2 发生氧化反应。 答案 D
【应用4】 下图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解
池。离子交换膜只允许Na+通过,充放电的化学方程式为
-
6
,故A
项错误;由于Li为活泼金属,可与羧酸、醇等物质反应,故C项
错误;由于Li的摩尔质量较小,所以锂电池的比能量应较高,故
D项错误。
答案 B
【方法技能】 可充電電池電極反應式的書寫技巧 書寫可充電電池電極反應式時,一般都是先書寫放電的電極 反應式。書寫放電時的電極反應式時,一般要遵守三個步驟: 第一,先標出原電池總反應式電子轉移的方向和數目,找出 參與負極和正極反應的物質;第二,寫出一個比較簡單的電 極反應式(書寫時一定要注意電極產物是否與電解質溶液反應); 第三,在電子守恆的基礎上,總反應式減去寫出的電極反應 式即得另一電極反應式。 充電時的電極反應與放電時的電極反應過程相反,充電時的 陽極反應為放電時的正極反應的逆過程,充電時的陰極反應 為放電時的負極反應的逆過程。根據正確書寫的電極反應式, 可順利判斷各電極周圍溶液pH的變化。
高考新 型 化 学 电 源ppt

电极a:V3+ + e– == V2+ 电极b:VO2+ – e– + H2O == VO2+ + 2H+ 电极a:V2+ – e– == V3+ 电极b: VO2+ + e– + 2H+ == VO2+ + H2O
高考新 型 化 学 电 源ppt
[例题8] 光照时左槽室的溶液由绿色逐渐变为紫色, 而无光照情况下会由紫色逐渐变为绿色,
高考新 型 化 学 电 源ppt
高考新 型 化 学 电 源ppt
[例题8]下图是一种可应用于航天飞行器中的全天候光化学 电池,在有光照和无光照条件下能够发生不同的原电池反 应,光照时左槽室的溶液由绿色逐渐变为紫色,而无光照 情况下会由紫色逐渐变为绿色,已知: V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色。
3、书写电极反应式
[例题3]利用乙烯的催化氧化原理可设计成下图的燃料电 池,能在制备乙醛的同时获得电能,请写出电极a上的 电极反应式。
高考新 型 化 学 电 源ppt
高考新 型 化 学 电 源ppt
[例题3]
[三步法]
[步骤1]立足题意,理清物质变化
–2
–1 –1
C2H4 – 2e– → CH3CHO
负极
正极
[依据1]反应物的类别: 还原剂在负极反应,氧化剂在正极反应。
1、判断电极类型
[例题1]判断下列新型化学电源中的正负极。
正极 负极 [依据2]化合价的变化:
负极反应化合价升高,正极反应化合价降低。
1、判断电极类型
[例题1]判断下列新型化学电源中的正负极。
高三化学二轮高考热点课——高考中的新型化学电源(共34张ppt)
2020/5/17
14
A.正极反应中有 CO2 生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为 C6H12O6+6O2===6CO2+6H2O
解析 负极发生氧化反应,生成 CO2 气体,A 错误; 微生物电池中的化学反应速率较快,即微生物促进了反应 中电子的转移,B 正确;原电池中阳离子向正极移动,阴 离子向负极移动,C 正确;电池总反应是 C6H12O6 与 O2 反 应生成 CO2 和 H2O,D 正确。
2020/5/17
3
2.瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析 仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,可以通 过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工 作原理,其装置如图乙所示,其中的固体电解质是 Y2O3- Na2O,O2-可以在其中自由移动。下列有关叙述正确的是 ()
2020/5/17
12
原电池中间隔着一个阳离子交换膜,所以 Br-不能向右侧电 极移动,故 C 错误;放电时左侧生成 Br-,右侧生成 Zn2+, 所以放电时左右两侧电解质储罐中的离子总浓度均增大,故 D 正确。
2020/5/17
13
5.微生物电池是指在微生物的作用下将化学能转化为 电能的装置,其工作原理如图所示。下列有关微生物电池 的说法错误的是( )
2020/5/17
20
解析 由题图可知,空气通入电极 a,显然电极 a 为正 极,发生还原反应,A 错误;4 mol VB2 发生反应时消耗 11 mol O2,同时转移 44 mol 电子,故消耗 1 mol VB2 时转移 11 mol 电子,B 错误;电池工作时,阴离子(OH-)向负极(VB2 极)移动,C 错误;正极反应式为 O2+2H2O+4e-===4OH-, 用总反应式减去正极反应式的 11 倍即得负极反应式,故 VB2 在负极上发生氧化反应,电极反应式为 2VB2+22OH--22e -===V2O5+2B2O3+11H2O,D 正确。
高考化学总复习原电池化学电源ppt

高考化学总复习原电池化学电源ppt
教材研读 栏目索引
自测3 充电电池充电时电极与外接电源的正、负极如何连接? 答案 充电时,充电电池的正极与外接电源的正极相连接,充电电池的 负极与外接电源的负极相连接。
高考化学总复习原电池化学电源ppt
高考化学总复习原电池化学电源ppt
教材研读 栏目索引
自测4 (1)氢氧燃料电池以KOH溶液作电解质溶液时,工作一段时间
考点突破 栏目索引
考点突破
考点 原电池正、负极的判断及电极反应式的书写
1.原电池正、负极的判断
电极材料 电子流向 离子移动方向 发生的反应 反应现象
高考化学总复习原电池化学电源的一极 阴离子移向的一极
氧化反应 一般质量减小
正极 一般是活动性较弱的金属或能导电的非金属
高考化学总复习原电池化学电源ppt
高考化学总复习原电池化学电源ppt
教材研读 栏目索引
自测2 请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱。请
写出电极反应式:负极
,正极
,并画
出实验装置图,要求用烧杯和盐桥,并标出外电路电子流向。
答案 Cu-2e-
Cu2+ 2Fe3++2e-
2Fe2+
L
(标准状况)。
高考化学总复习原电池化学电源ppt
高考化学总复习原电池化学电源ppt
考点突破 栏目索引
答案 (1)①2H++2e- H2↑ 增大 ②甲池中:左—Fe,右—C;乙池中:左—Fe,右—C (2)①FeO24+4H2O+3e- Fe(OH)3+5OH- ②6.72
高考化学总复习原电池化学电源ppt
高考总复习《化学》题原电池与新型化学电源ppt课件

2H2-4e-+4OH- ===4H2O
O2+2H2O+4e- ===4OH-
2H2+O2===2H2O
氢氧燃料电池的优点:①连续将燃料和氧化剂的化学能直
接转化成电能;②燃料电池的能量转化率超过 80%;③无污染。
(2)CH4 燃料电池 用导线相连的两个铂电极插入 KOH 溶液中,然后向两极 分别通入 CH4 和 O2,其电极反应式为 负极:__C_H__4+__1_0_O__H__-_-__8_e-_=__=_=_C_O__23-_+__7_H__2_O_, 正极:2O2+4H2O+8e-===8OH-, 总反应式:CH4+2O2+2OH-===CO23-+3H2O。
3.(2017·4 月选考)银锌电池是一种常见化学电源,其反应原理:
Zn+Ag2O+H2O===Zn(OH)2+2Ag。其工作示意图如图。下
列说法不正确的是
()
A.Zn 电极是负极
B.Ag2O 电极发生还原反应 C.Zn 电极的电极反应式:Zn-2e-+2OH-===Zn(OH)2 D.放电前后电解质溶液的 pH 保持不变 解析:由电池总反应方程式知,反应消耗 H2O,KOH 浓度变 大,溶液 pH 升高。 答案:D
[提能力——重难知识强起来] 燃料电池电极反应式的书写 3 步骤 第一步:写出电池总反应式 燃料电池的总反应与燃料的燃烧反应一致,若产物能和 电解质反应则总反应为加和后的反应。 如甲烷燃料电池(电解质为 NaOH 溶液)的反应式为 CH4+2O2===CO2+2H2O ① CO2+2NaOH===Na2CO3+H2O ② ① + ② 得 燃 料 电 池 总 反 应 式 为 CH4 + 2O2 + 2NaOH===Na2CO3+3H2O。
第三步:根据电池总反应式和正极反应式,写出负极 反应式
高考热点课高考中的新型化学电源课件高考化学创新复习PPT

化学能的装置,A 正确;原电池中阳离子移向正极,由图可知电子由乙池
流出经外电路流向甲池,甲池中碳棒是正极,所以氢离子从乙池移向甲池,
B 错误;甲池中碳棒是正极,该电极上发生得电子的还原反应,即 AQ+2H
++2e-===H2AQ,C 正确;在乙池中,硫化氢失电子生成硫单质,I- 3 得电
子生成 I-,发生的反应为 H2S+I- 3 ===3I-+S↓+2H+,D 正确。
高考热点课7 高考中的新型化学电源
第九章 电化学基础
命题分析:以新型化学电源为命题背景考查原电池的结构和工作原理 是高考的热点;涉及的新型化学电源种类繁多,如储氢电池、高铁电池、 海洋电池、锂离子电池等。解答此类题,不要被新材料、新情境所吓倒, 只要学会迁移运用常见化学电源工作原理,正确判断正负极,写出电极反 应式就能破题。
第9章 高考热点课7 高考中的新型化学电源 课件 2021届高考化学创新复习(共43张P PT)
第9章 高考热点课7 高考中的新型化学电源 课件 2021届高考化学创新复习(共43张P PT) 第9章 高考热点课7 高考中的新型化学电源 课件 2021届高考化学创新复习(共43张P PT)
答案
第9章 高考热点课7 高考中的新型化学电源 课件 2021届高考化学创新复习(共43张P PT)
解析 答案
2.如图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解 质为 Na2S2 和 NaBr3,放电后分别变为 Na2S4 和 NaBr。下列叙述正确的是 ()
A.放电时,负极反应为 3NaBr-2e-===NaBr3+2Na+ B.充电时,阳极反应为 2Na2S2-2e-===Na2S4+2Na+ C.放电时,Na+经过离子交换膜,由 b 池移向 a 池 D.用该电池电解饱和食盐水,产生 2.24 L H2 时,b 池生成 17.40 g Na2S4
2025版高考化学一轮复习课件 第六章 化学反应与能量 04-热点题型探究8 新型化学电源

化学
第六章 化学反应与能量
热点题型探究8 新型化学电源
2025 高考一轮复习用书
题型突破
高考试题中新型化学电源的种类繁多,如“微生物电池”“燃料电池”
“锂离子电池”等,这些新型化学电源常以选择题形式呈现,侧重考查
原电池的工作原理(放电)和电解池的工作原理(充电),涉及电极的
判断、电极反应式的书写、电解质溶液中离子的移动等,新型化学电
A. 吸附层a发生的电极反应:H2 + 2OH − − 2e−
B. 离子交换膜只允许Na+ 通过
C. 一段时间后右极室pH增大
D. “全氢电池”将酸碱反应产生的能量转化为电能
2H2 O
2025 高考一轮复习用书
[解析] 吸附层a吸收H2 ,作负极,发生的电极反应为
H2 + 2OH − − 2e−
应为2H + + 2e−
源试题取材新颖,大多与最新科研成果相联系,体现化学、技术、社
会和环境之间的相互关系,赞赏化学对社会发展的重大贡献,彰显化
学学科的社会价值。
2025 高考一轮复习用书
例 (2022·广东卷·16,4分)科学家基于Cl2 易溶于CCl4 的性质,发展了
一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电
时电极a的反应为:NaTi2 PO4
+
−
+
2Na
+
2e
3
说法正确的是( C )
A. 充电时电极b是阴极
B. 放电时NaCl溶液的pH减小
C. 放电时NaCl溶液的浓度增大
D. 每生成1 mol Cl2 ,电极a质量理论上增
加23 g
Na3 Ti2 PO4 3 。下列
第六章 化学反应与能量
热点题型探究8 新型化学电源
2025 高考一轮复习用书
题型突破
高考试题中新型化学电源的种类繁多,如“微生物电池”“燃料电池”
“锂离子电池”等,这些新型化学电源常以选择题形式呈现,侧重考查
原电池的工作原理(放电)和电解池的工作原理(充电),涉及电极的
判断、电极反应式的书写、电解质溶液中离子的移动等,新型化学电
A. 吸附层a发生的电极反应:H2 + 2OH − − 2e−
B. 离子交换膜只允许Na+ 通过
C. 一段时间后右极室pH增大
D. “全氢电池”将酸碱反应产生的能量转化为电能
2H2 O
2025 高考一轮复习用书
[解析] 吸附层a吸收H2 ,作负极,发生的电极反应为
H2 + 2OH − − 2e−
应为2H + + 2e−
源试题取材新颖,大多与最新科研成果相联系,体现化学、技术、社
会和环境之间的相互关系,赞赏化学对社会发展的重大贡献,彰显化
学学科的社会价值。
2025 高考一轮复习用书
例 (2022·广东卷·16,4分)科学家基于Cl2 易溶于CCl4 的性质,发展了
一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电
时电极a的反应为:NaTi2 PO4
+
−
+
2Na
+
2e
3
说法正确的是( C )
A. 充电时电极b是阴极
B. 放电时NaCl溶液的pH减小
C. 放电时NaCl溶液的浓度增大
D. 每生成1 mol Cl2 ,电极a质量理论上增
加23 g
Na3 Ti2 PO4 3 。下列
2024届高考一轮复习化学课件:新型化学电源及分析

答案 A
解析 放电时,负极失电子,发生氧化反应,电极反应为Na3Ti2(PO4)3-2e===NaTi2(PO4)3+2Na+,A正确;放电时阴离子移向负极,故Cl-透过多孔碳电 极向NaCl溶液中迁移,B错误;放电时正极反应为Cl2+2e-===2Cl-,转移1 mol 电子,理论上CCl4释放出0.5 mol Cl2,C错误;充电过程中,阳极反应为2Cl--2e===Cl2↑,消耗了Cl-,则NaCl溶液浓度减小,D错误。
对点训练 2.相同金属在其不同浓度盐溶液中可形成浓差电池。如图所示装置是利 用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、 H2SO4和NaOH。下列说法错误的是( )
答案 D
解析 电解池可以制得O2、H2、H2SO4和NaOH,根据电解池分析可知,左边 得到NaOH和H2,右边得到O2和H2SO4,则a为阴极,b为阳极,则Cu(2)为负 极,Cu(1)为正极。a为电解池的阴极,A正确;电池放电过程中,Cu(2)为负极, 则负极上的电极反应为Cu-2e-===Cu2+,B正确;当电路中转移2 mol电子时, 阳极区产生了 2 mol H+,要使溶液呈电中性,则有 1 mol SO42-通过膜 d 向右移 动,C正确;电池放电过程中,Cu(2)的电极反应式为Cu-2e-===Cu2+,Cu(1)的电 极反应式为Cu2++2e-===Cu,反应前原电池左边硫酸铜物质的量为5 mol,右 边硫酸铜物质的量为1 mol,电池从开始工作到停止放电,则左右硫酸铜物 质的量应分别为3 mol,右侧有2 mol Cu2+生成,则转移4 mol电子,根据
思路导引(1)充电时电极a反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3 电极a是阴极,电极b是阳极。 (2)结合充、放电过程的互逆性 放电时,电极a是负极,电极b是正极。 (3)结合放电和充电时的电极反应,逐项进行分析、判断。
解析 放电时,负极失电子,发生氧化反应,电极反应为Na3Ti2(PO4)3-2e===NaTi2(PO4)3+2Na+,A正确;放电时阴离子移向负极,故Cl-透过多孔碳电 极向NaCl溶液中迁移,B错误;放电时正极反应为Cl2+2e-===2Cl-,转移1 mol 电子,理论上CCl4释放出0.5 mol Cl2,C错误;充电过程中,阳极反应为2Cl--2e===Cl2↑,消耗了Cl-,则NaCl溶液浓度减小,D错误。
对点训练 2.相同金属在其不同浓度盐溶液中可形成浓差电池。如图所示装置是利 用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、 H2SO4和NaOH。下列说法错误的是( )
答案 D
解析 电解池可以制得O2、H2、H2SO4和NaOH,根据电解池分析可知,左边 得到NaOH和H2,右边得到O2和H2SO4,则a为阴极,b为阳极,则Cu(2)为负 极,Cu(1)为正极。a为电解池的阴极,A正确;电池放电过程中,Cu(2)为负极, 则负极上的电极反应为Cu-2e-===Cu2+,B正确;当电路中转移2 mol电子时, 阳极区产生了 2 mol H+,要使溶液呈电中性,则有 1 mol SO42-通过膜 d 向右移 动,C正确;电池放电过程中,Cu(2)的电极反应式为Cu-2e-===Cu2+,Cu(1)的电 极反应式为Cu2++2e-===Cu,反应前原电池左边硫酸铜物质的量为5 mol,右 边硫酸铜物质的量为1 mol,电池从开始工作到停止放电,则左右硫酸铜物 质的量应分别为3 mol,右侧有2 mol Cu2+生成,则转移4 mol电子,根据
思路导引(1)充电时电极a反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3 电极a是阴极,电极b是阳极。 (2)结合充、放电过程的互逆性 放电时,电极a是负极,电极b是正极。 (3)结合放电和充电时的电极反应,逐项进行分析、判断。
高考一轮复习化学课件常考新型化学电源

总结归纳常考题型和解题方法
针对高考中常考的题型,如选择题、填空题、计 算题等,总结归纳相应的解题方法和技巧,提高 解题效率。
构建知识网络体系
将新型化学电源相关知识点与其他化学知识相联 系,构建完整的知识网络体系,便于理解和记忆 。
解题技巧训练与提高途径
多做高考真题
01
通过做高考真题,了解考试难度和出题规律,提高解题能力和
原电池。
优势
铝空气电池具有较高的能量密度 和较长的使用寿命;铝元素储量 丰富,成本较低;同时,铝空气 电池在放电过程中不会产生有害
物质。
应用领域
水下航行器、应急电源、电动汽 车等领域。
06
高考一轮复习策略与方法
知识点梳理与总结归纳
1 2 3
梳理新型化学电源相关知识点
包括各类电池的工作原理、电极反应、电池总反 应等,确保对基础知识的全面掌握。
新型化学电源是指采用新型化学反应体系和技术,具有高能量密度、 长循环寿命、环保安全等优点的电源。
根据电解质种类,新型化学电源可分为锂离子电池、锂硫电池、钠离 子电池、固态电池等;根据应用场景,可分为动力电池、储能电池、 消费电池等。
发展历程及趋势
发展历程
新型化学电源的研究始于20世纪70年代,随着材料科学、电 化学等学科的不断发展,新型化学电源技术得到了快速进步 。目前,锂离子电池已成为主流电源之一,其他类型的新型 化学电源也在不断发展和完善中。
02
03
结构类型
按照电极材料、电解质和 隔膜的不同组合方式,可 分为对称型和非对称型超 级电容器。
性能指标
包括电容量、能量密度、 功率密度、循环寿命等, 是衡量超级电容器性能优 劣的重要参数。
电容量计算
针对高考中常考的题型,如选择题、填空题、计 算题等,总结归纳相应的解题方法和技巧,提高 解题效率。
构建知识网络体系
将新型化学电源相关知识点与其他化学知识相联 系,构建完整的知识网络体系,便于理解和记忆 。
解题技巧训练与提高途径
多做高考真题
01
通过做高考真题,了解考试难度和出题规律,提高解题能力和
原电池。
优势
铝空气电池具有较高的能量密度 和较长的使用寿命;铝元素储量 丰富,成本较低;同时,铝空气 电池在放电过程中不会产生有害
物质。
应用领域
水下航行器、应急电源、电动汽 车等领域。
06
高考一轮复习策略与方法
知识点梳理与总结归纳
1 2 3
梳理新型化学电源相关知识点
包括各类电池的工作原理、电极反应、电池总反 应等,确保对基础知识的全面掌握。
新型化学电源是指采用新型化学反应体系和技术,具有高能量密度、 长循环寿命、环保安全等优点的电源。
根据电解质种类,新型化学电源可分为锂离子电池、锂硫电池、钠离 子电池、固态电池等;根据应用场景,可分为动力电池、储能电池、 消费电池等。
发展历程及趋势
发展历程
新型化学电源的研究始于20世纪70年代,随着材料科学、电 化学等学科的不断发展,新型化学电源技术得到了快速进步 。目前,锂离子电池已成为主流电源之一,其他类型的新型 化学电源也在不断发展和完善中。
02
03
结构类型
按照电极材料、电解质和 隔膜的不同组合方式,可 分为对称型和非对称型超 级电容器。
性能指标
包括电容量、能量密度、 功率密度、循环寿命等, 是衡量超级电容器性能优 劣的重要参数。
电容量计算
