上海高二化学期末复习资料精选课件PPT
沪科版化学高二上册-8.2.2 铝的重要化合物 课件 _2ppt

红宝石,蓝宝石 Al2O3
1、实验室如何制备氢氧化铝?
Al(OH)3的制备:
Al2(SO4)3+6NH3·H2O → 2Al(OH)3↓+3(NH4)2SO4 Al3++ 3NH3·H2O → Al(OH)3 ↓ + 3NH4+
1、实验室如何制备氢氧化铝? 2、氢氧化铝有哪些物理性质?
NaOH溶液 沉淀溶解
Al(OH)3+NaOH → NaAlO2+2H2O Al(OH)3+ OH- → AlO2-+2H2O
1、实验室如何制备氢氧化铝? 2、氢氧化铝有哪些物理性质? 3、氢氧化铝有哪些化学性质? 4、氢氧化铝为什么具有两性?
氢氧化铝的电离方程式: Al3++3OH- Al(OH)3 AlO2-+H++H2O
红宝石,蓝宝石 Al2O3
13、没有多少钱可以阻止死亡,无论它看起来多么美丽,它都不能使国王满意,无论它有多著名,它都会经历生死。因此,生活不要太贪婪 ,生活也不要太累。
8、并非所有人都能成为想象中的自我,但是每个人都可以通过自己的努力成为自己想要的东西。只要您相信自己,就能闯入茧中。 9、即使没有人注意到您的努力,您也应该继续努力成长,因为在看不见的地方隐藏着很多眼睛。你一直与自己在一起,永远是最令人惊奇的 自我。
14、不懂得拒绝的人即使精疲力尽也不会受到他人的尊重。因为在那些习惯于麻烦您的人的眼中,您已经帮助了他人,而不仅仅是为他。 23、如果您不明白,那就放手吧。并非所有的努力都会有结果,而且并非所有的过程都是没有意义的。您不必为不值得的人感到难过,也不 必为不爱您的人感到冤屈。
22、成为一个人并不一定要美丽,但必须直率。在处理事物时,您不必完美无缺,但您必须尽责。 6、没有人会终身帮助您,因此您必须学习战斗。 5、即使在您说话时也不要打扰那些敷衍了事的人,与其关心别人的遗弃和不幸,不如管理自己的尊严和善良并选择一种使自己无可替代的姿 态。
第一章 章末复习(38张PPT) 课件 高二化学鲁科版(2019)选择性必修1

1.两极材料:活泼性差别越大,活泼金属被腐蚀的速度越快。2.电解质溶液相同时,金属腐蚀由快到慢:电解池阳极腐蚀>原电池负极腐蚀>化学腐蚀>原电池的正极>电解池的阴极3.相同浓度的不同介质:在强电解质中>弱电解质中>非电解质中4.金属防腐措施由好到坏:外加电流的阴极保护法>牺牲阳极的阴极保护法>有一般防腐措施保护>无防腐措施保护5.同一种电解质溶液,浓度越大,腐蚀速率越快。注意:在钢铁的腐蚀过程中,其电化学腐蚀更严重,在电化学腐蚀中,吸氧腐蚀更普遍。
九、电解原理
电解:让直流电通过电解质溶液或熔融电解质,在两个电极上分别发生氧化反应(阳极)和还原反应(阴极)的过程。
1、定义
2.电解池
(1)定义:将电能转化为化学能的装置。(2)组成:
与电源相连的两个电极
电解质溶液或熔化的电解质
形成闭合回路
外加直流电源
(3)电极名称与电极反应:阳极:与电源____相连,溶液中______移向此极,____电子,发生______反应。阴极:与电源____相连,溶液中______移向此极,____电子,发生_____反应。
S2->I->Br->Cl-> OH- >非还原性含氧酸根
2.电解水型:
水电离出的H+、OH-分别在两极放电。
NaCl
阴极:2H2O+2e-===H2↑+2OH-
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
Cu2+ +2e-=== Cu(精铜)
Ag、Pt 、Au等金属沉积在池底形成阳极泥
沪科版化学高二上册-8.2.2 氢氧化铝 课件 ppt
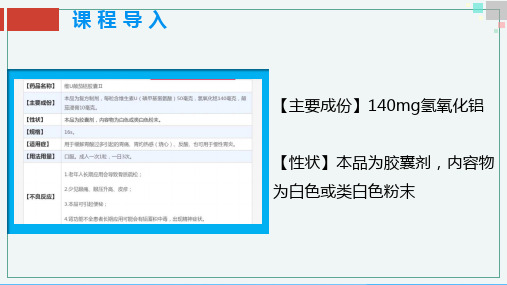
【主要成份】140mg氢氧化铝
【性状】本品为胶囊剂,内容物 为白色或类白色粉末
第二节 几种重要的金属化合物 第四课时 氢氧化铝
学习目标
学习目标: 1、掌握氢氧化铝的主要性质 及应用; 2、通过实验探究掌握氢氧化 铝的制备方法; 3、提高观察实验现象,分析 实验结论的能力。
学习重点:氢氧化铝的化学性质及制备 学习难点:氢氧化铝制备方法的探究
2Al + 3H 2 SO4 = Al 2(SO4) 3 + 3H 2↑;
.
Al 2(SO4) 3 + 3NH3 ·H2O = Al(OH)3 ↓ + 3(NH4) 2SO4 ;
(2)你认为甲的实验方案应该如何改进?将加稀硫酸改为通入CO2;写出改进
后的实验方案涉及到的反应方程式: 2Al + 2NaOH + 2H2O= 2NaAlO2 + 3H 2↑.
自主学习
1.氢氧化铝的物理性质: Al(OH)3是几乎不溶于水的 白色胶状物质 ,但能凝聚水中的悬浮物,
并能吸附 悬浮物 和 色素 。氢氧化铝胶体可用作净水剂、色素吸附剂等。 2.氢氧化铝的化学性质: (1)不稳定性:加热时,氢氧化铝分解为_A__l2_O__3 __和__H__2O__。 化学方程式为: _2_A_l_(_O_H_)_3_=∆_=_A_l_2O__3+__3_H_2_O_____ (2)氢氧化铝和盐酸反应的离子方程式 :_A_l_(O__H__)3_+__3_H_+__=__A_l_3_+_+_3_H__2_O_ (3)氢氧化铝和氢氧化溶液反应的离子方程式:
AlO2-+ CO2 + 2H2O=Al(OH)3 ↓ + HCO3 -
沪科版高二下学期-化学12-烃的衍生物复习(共31张PPT)

反应
应
特性
灼热铜丝插入醇中有刺激性气味 与FeCl3溶液反应显紫色 的气体生成
典型例题
例3.各取1 mol下列物质与浓溴水充分反应,消耗Br2的物质的量按①② 顺序排列正确的是 ( )
①
②
A.2 mol、6 mol C.4 mol、5 mol
B.5 mol、6 mol D.3 mol、6 mol
典型例题
例题解析
【解析】1mol某烃A充分燃烧后可以得到8molCO2和4molH2O,故烃A的分
子式为C8H8,不饱和度为5,可能含有苯环,由于A发生加聚反应生成C,故
A为
, 结合题目信息,就可推出各步反应。
【答案】 (1)C8H8 (2)加成 酯化(或取代) (3)C.
D.
E.
H.
(4)
规律方法:醇的消去反应和催化氧化反应规律
例3.各取1 mol下列物质与浓溴水充分反应,消耗Br2的物质的量按①② 顺序排列正确的是 ( )
①
②
A.2 mol、6 mol
B.5 mol、6 mol
C.4 mo l、5 mol
D.3 mol、6 mol
【解析】在烃基-C15H27中含有2个碳碳双键消耗2mol溴单质;酚羟基邻 对位有3个,需要3mol溴单质,共需要5mol;中含有1个碳碳双,键消 耗1mol溴单质;酚羟基邻对位有5个,需要5mol溴单质,共需要6mol。
水解反应(取代 有机物在有水参加时,生成两
反应)
种或多种物质的反应
①酯的水解②卤代烃的水解
规律方法:破解有机反应基本类型
反应类型 加成反应 消去反应 加聚反应
概念
实例
有机物中不饱和碳原子跟其他 原子(或原子团)直接结合生成 新物质的反应
上海高二化学知识点

上海高二化学知识点上海高二化学知识点概述一、原子结构与元素周期律1. 原子的组成:质子、中子、电子2. 原子核外电子排布规律:奥布袓规则3. 元素周期表的结构:周期与族4. 元素周期律:原子半径、电负性、电离能的变化规律5. 化学键的形成:离子键、共价键二、化学式与化学方程式1. 化学式的书写规则2. 化学方程式的平衡3. 化学反应的类型:合成反应、分解反应、置换反应、还原-氧化反应三、物质的分类1. 纯净物与混合物2. 酸、碱、盐的定义及性质3. 氧化物的分类与性质4. 有机化合物的基本结构与性质四、化学反应速率与化学平衡1. 化学反应速率的影响因素2. 化学平衡的移动原理:勒夏特列原理3. 酸碱平衡与pH值的计算4. 沉淀溶解平衡五、溶液与溶度1. 溶液的组成与浓度表示2. 溶度积常数与溶解度的关系3. 常见溶剂的性质与作用六、酸碱与盐1. 酸碱理论:阿伦尼乌斯理论、布朗斯特-劳里理论2. pH值的测定与计算3. 盐的水解与酸碱性4. 常见酸碱指示剂的变色原理七、氧化还原反应1. 氧化还原反应的特征2. 氧化数的计算与判断3. 电化学原理:伏打电堆、电解池4. 电化学系列与标准电极电势八、有机化学基础1. 有机化合物的命名规则2. 碳的杂化轨道理论与有机分子的几何形状3. 饱和烃、不饱和烃的结构与性质4. 官能团与有机反应类型九、化学实验基础1. 常见化学实验仪器的使用2. 化学实验基本操作:称量、溶解、加热、萃取、蒸馏3. 实验室安全与事故处理4. 常见化学试剂的性质与保存方法十、化学计算1. 物质的量与摩尔概念2. 气体定律与液体定律3. 化学反应的计量关系4. 溶液浓度的计算与稀释以上是上海高二化学的主要知识点概述,涵盖了化学的基本概念、原理、实验操作以及计算方法。
这些知识点是学生在高中阶段必须掌握的化学基础知识,对于理解更深层次的化学现象和进行化学实验都具有重要意义。
在学习过程中,学生应该注重理论与实践相结合,通过不断的练习和实验操作来加深对这些知识点的理解和应用。
化学平衡常数(课件)高二化学(沪科版2020选择性必修第一册)

一般地,K>10-5时,认为该反应进行得较完全了。
2 当LoreKm i<ps1um0d-ol5o时r sit a,me该t, 正反应进行的程度非常小。 consectetur adipiscing elit.
注意:化学反应速率快,化学平衡常数不一定大。
一、化学平衡常数
注意:
1、化学平衡常数的大小反映的是反应进行的程度大小,并不涉及 反应时间和化学反应速率。 即:某个化学反应的平衡常数很大,可能化学反应速率却很小。
一、化学平衡常数
写出下列可逆反应的平衡常数表达式。
1N. 2(g) + 3H2(g) 2NH3(g)
K1 =
1 K2
=
K32
2.NH3(g)
N2(g) + 3H2(g)
K1=
c2(NH3) c(N2)•c3(H2)
K2=
c(N2)•c3(H2) c2(NH3)
3.
1 2
N2(g)+
3 2
H2(g)
Q=
cp(C) • cq(D) cm(A) • cn(B)
Q>K:可逆反应向逆反应方向进行;
Q=K:可逆反应处于平衡状态; Q<K:可逆反应向正反应方向进行。
一、化学平衡常数
应用
2 判断反应的热效应
若升高温度,K 增大,则正反应为吸热反应; 若升高温度,K 减小,则正反应为放热反应。
3
相关计算
利用平衡常数可计算物质的平衡浓度、物质的量分数 和转化率等。
1 1.197 0.694 0 48.38 54.51 867
2 1.228 0.996 0 48.61 54.62 867
3 1.201 0.840 0 49.54 54.21 867
沪科版高二化学上册电子课本课件【全册】

小结与思考
沪科版高二化学上册电子课本课件Байду номын сангаас【全册】
9 初识元素周期表
沪科版高二化学上册电子课本课件 【全册】
8 走进精彩纷呈的金属世界
沪科版高二化学上册电子课本课件 【全册】
8.1 应用广泛的金属材料——钢 铁
沪科版高二化学上册电子课本课件 【全册】
8.2 铝和铝合金的崛起
沪科版高二化学上册电子课本课 件【全册】目录
0002页 0060页 0106页 0143页 0180页 0224页 0255页 0314页
目录 8.1 应用广泛的金属材料——钢铁 小结与思考 9.1 元素周期表 小结与思考 10.1 测定1mol气体的体积 10.3 酸碱滴定 附录
目录
沪科版高二化学上册电子课本课件 【全册】
上海科学技术出版社高中化学二年级第二学期全套PPT课件

甲烷俗称沼气、坑气,是天然气的主要成分。
14
天然气是当今世界上最重要的气体化石 燃料。我国是最早利用天然气的国家。
15
2、物理性质
(1)无色、无味的气体; (2)密度比空气小,=0.717g/L(S.T.P)
三氯甲烷(液体)
(4) CHCl3 Cl2 光CCl4 HCl
四氯甲烷(液体)
烃分子中的氢原子被卤素原子取代后所形成的
化合物叫做卤代烃。
20
(3)取代反应:
有机物分子里的某些原子或原子团被其他原
子或原子团所代替的反应叫做取代反应
21
注意:
1.取代反应条件——光照。 2.反应物状态:纯卤素 (e.g. 与氯气取代,与氯水不取代。) 3、甲烷的取代反应是分步且连锁进行的, 所以产物是几种氯代物的混合物。
★不是,1824年,德国化学家维勒将无机物氰酸铵转化为有 机物尿素(人工合成的第一种有机物) ,打破了只能从有机 体中取得有机物的观念。
人们不但能合成自然界里已经存在的许多有机化合物,
而且还能合成许多自然界里并不存在的、性能优良的有机化
合物,如在1965年,我国科学家在世界上第一次合成了具有
生命活力的蛋白质——结晶牛胰岛素,有机化合物与无机化
甲烷是一种洁净的气体燃料。 (高效、低耗、污染小)
注意:甲烷在点燃之前要验纯,否则可能
发生爆炸。
17
(2)受热分解
甲烷在隔绝空气并加热到1000°C的条件下分解
高温
CH4
C + 2 H2
此法制取炭黑和氢气
●炭黑是橡胶工业的重要原料,是黑色颜料、油漆、涂料 的重要着色剂。
[课件]高中化学高中部分
![[课件]高中化学高中部分](https://img.taocdn.com/s3/m/26e7022c58f5f61fb73666fd.png)
课件]高中化学高中部分一.1. 绪言((ppt)2. 氧化-- 还原反应(swf)3. 氧化-- 还原反应(ppt)(1)4. 氧化-- 还原反应(ppt)(2)5. 离子反应及离子方程式(swf)6. 离子反应(ppt)7. 离子方程式(ppt)8. 反应热(ppt)9. 化学反应及能量变化复习(ppt)二.1. 金属钠(swf)(1)2. 钠的氧化物(swf)3. 碳酸钠和碳酸氢钠与酸的反应(swf)4. 常见金属的焰色反应(swf)5. 金属钠(swf)(2)6. 金属钠(ppt)(1)7. 金属钠(ppt)(2)8. 碱金属(ppt)9. 碱金属复习(ppt)三.1. 物质的量(ppt)2. 气体摩尔体积(swf)(1)3. 气体摩尔体积(ppt)(1)4. 气体摩尔体积(ppt)(2)5. 气体摩尔体积(ppt)(3)6. 气体摩尔体积(swf)(2)7. 溶液的配制(swf)8. 物质的量浓度(ppt)(1)9. 物质的量浓度(ppt)(2)10. 物质的量复习(swf)11. 物质的量复习(ppt)四.1. 氯气和制备和性质(swf)2. 氯气(ppt)3. 氯气的实验室制法(swf)4. 氯气和氯化氢(ppt)5. 卤族元素(swf)6. 卤族元素(ppt)7. 依照化学方程式的运算(ppt)8. 卤族元素复习(ppt)五.1. 氢原子核外电子的运动(swf)2. 原子结构(ppt)3. 元素周期律(ppt)(1)4. 元素[周期律(ppt)(2)5. 元素周期表(swf)6. 元素周期表(ppt)7. 电子云(swf)8. 化学键的形成(swf)(1)9. 化学键的形成(swf)(2)10. 离子键的形成(swf)11. 共价键的形成(swf)12. 离子键(ppt)(1)13. 离子键(ppt)(2)14. 共价键(ppt)15. 极性分子和非极性分子(swf)(1)16. 极性分子和非极性分子(swf)(2)17. 极性分子和非极性分子(ppt)18. 同位素(ppt)19. 物质结构元素周期律复习(ppt) 六.1. 氧族元素(ppt)2. 二氧化硫(ppt)3. 浓硫酸的吸水性和脱水性(swf)4. 浓硫酸的强氧化性(swf)5. 硫酸(swf)6. 硫酸(ppt)7. 二氧化硫(swf)8. 环境爱护(ppt)9. 硫和硫的化合物环境爱护复习(ppt)七.1. 碳族元素(ppt)2. 硅和二氧化硅(ppt)3. 二氧化硅的结构(swf)4. 硅酸盐工业(ppt)5. 新型无机非金属材料(ppt)6. 碳族复习(ppt)八.1. 氮气(swf)2. 氮气(ppt)(1)3. 氮气(ppt)(2)4. 白磷和红磷(ppt)5. 氨分子模型(swf)6. 氨(swf)7. 氨的性质(swf)8. 氨分子和铵离子结构(swf)9. 氨和铵盐(ppt)10. 二氧化氮和水的反应 (swf)4. 铁及其化合物 (ppt)11. 氮的氧化物运算 (ppt)5. 铁三角 (ppt)12. 喷泉实验 (swf)6. 原电池 (swf)(1)13. 模拟工业制氮 (swf)7. 原电池 (swf)(2)14. 硝酸的性质 (swf)8. 原电池 (swf)(3)15. 硝酸 (ppt)9. 原电池练习 (swf)16. 氮. 氧. 氯比较 (swf)10. 原电池 (ppt)17. 氮族元素复习 (ppt)11.镁 铝复习 (ppt)九 .1. 活化分子 (swf)十二 .1.甲烷(ppt)2. 化学反应速率 (swf)2. 甲烷卤代 (swf)3. 外界条件对速率的阻碍 (swf)3. 有机物概述及甲烷 (ppt)4. 化学反应速率 (ppt)4. 甲烷的结构 (swf)5. 化学平稳 (swf)5. 烷烃及同分异构体 (swf)6.C.T.P 对平稳的阻碍 (swf)6. 烷烃 (ppt)7. 外界条件与平稳图像 (swf)7. 有机物概述 (swf)8. 化学平稳 (ppt)8. 乙烯加成 (swf)9. 阻碍化学平稳的因素 (ppt)(1)9. 乙烯加聚 (swf)10. 阻碍化学平稳的因素 (ppt)(2)10. 乙烯的制备和性质 (swf) 11. 化学平稳和图像 (ppt)11. 乙烯的结构和性质 (ppt)12. 化学平稳图像分析 (ppt)12. 烯烃 (ppt) 13. 合成氨条件的选择 (ppt)13. 乙炔 (swf)14. 化学平稳应用 (ppt)14. 乙炔的实验室制法 (swf)15. 合成氨简要流程 (swf)15. 乙炔 (ppt) 16. 反应速率和平稳复习 (ppt)(1)16. 苯(swf)17. 反应速率和平稳复习 (ppt)(2)17. 苯的取代 (swf)18. 反应速率和平稳复习 (ppt)(3)18. 苯 芳香烃 (ppt)十 .1. 强电解质和弱电解质 (swf)19. 石油 (ppt)2. 强电解质和弱电解质 (ppt)20.蒸馏石油 (swf)3. 水的电离 (ppt) 十三 .1.溴乙烷 卤代烃 (ppt)4.水的电离和溶液 PH 值(PPt)2. 乙醇 (ppt)5. 盐类的水解 (swf)3. 乙醇的断键位置 (swf) 6. 盐类的水解 (ppt)4 . 乙醇的消化反应 (swf)7. 盐类水解的应用 (ppt)5. 乙醇 (ppt)8. 盐类水解复习及扩展 (ppt)6. 有机物分子式和结构式的确定9. 电离平稳 (ppt) (pp t)10. 滴定操作 (swf)7. 苯酚 (swf)11. 酸碱中和滴定 (swf)8. 苯酚 (ppt)12. 酸碱中和滴定 (ppt)9. 乙醛的性质(swf)13. 离子浓度大小专题 (ppt) 10. 乙醛 (ppt)(1) 14. 电离平稳复习 (swf) 11. 乙醛 (ppt)(2) 15. 电离平稳复习 (ppt) 12. 乙酸 (swf)一 .1. 镁和铝 (swf)13. 乙酸 (ppt)2. 镁和铝 (ppt) 14. 烃的衍生物转换关系 (swf)3. 铝三角 (swf)十四 .1. 糖类 (ppt)2. 淀粉纤维素(ppt) 17. 元素及化合物复习专题(ppt)3. 油酯(ppt) 18. 有机化学复习( 一)(ppt)十五.1. 合成材料(ppt) 19. 有机化学复习( 二)(ppt)单元.1.NaCl 的晶体(ppt) 20. 有机化学复习( 三)(ppt)2. 离子晶体和分子晶体比较(swf) 21. 有机化学复习( 四)(ppt)3. 晶体的结构(ppt) 22. 同分异构体的复习(ppt)4. 金刚石的结构(swf) 23. 同分异构体的复习(swf)5. 丁达尔现象(swf) 24. 有机物的反应(swf)6. 半透膜原理(swf) 25. 有机物的反应(ppt)7. 胶体的凝聚(swf) 26. 有机合成与推断( 一)(ppt)8. 胶体(ppt) 27. 有机合成与推断( 二)(ppt)9. 氧化-- 还原反应方程式的配平28. 有机信息题(ppt)(swf) 29. 有机运算(ppt)10. 氧化-- 还原反应方程式的配平30. 高考复习中的" 压缩式"(ppt) (ppt)(1)11. 氧化-- 还原反应方程式的配平(ppt)(2)12. 电解食盐水(swf)13. 电解硫酸钠(swf)14. 电化学知识综合复习(ppt)15. 硫酸工业(swf)16. 中学化学常用仪器(ppt)17. 常用化学实验装置(ppt)18. 化学实验设计(ppt)19. 综合实验设计(swf) 专题.1. 铁工业(swf)2. 金属晶体(swf)3. 金属的腐蚀和防护(ppt)4. 氯气和二氧化硫的性质比较(swf)5. 一氧化氮与氧气在水中的反应(swf)6. 氮氧化合物的十类运算(ppt)7. 金刚石的立体结构(swf)8. 铜与硝酸反应的综合设计(ppt)9. 等效平稳(ppt)10. 等效平稳专题训练(ppt)11. 化学平稳图像咨询题(ppt)12. 盐类水解补充练习(ppt)13. 过量运算(ppt)14. 碱金属综合复习(ppt)15. 卤族综合复习(ppt)16. 铁综合复习(ppt)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021/3/2
8
b. 铝热反应: 用匀做的小可铁出中可注在燃烧同的两的蒸以粉,反烧时铁混木大时以意张三发看沫待应,放融合条量,看: 铝圆 角 皿 到 和 熔 中 氧 出 化,引的氯到粉形漏。镁铝溶,气足为放火热酸,和滤斗在条粉物镁是够液于的,钾落氧纸中漏在冷条氧热态纸点同则剧下化折,斗较却和化量(烈漏 燃 时 是的铁成 架 中 高 后 氯 剂 引 熔燃斗 的 纸 氧是的漏 于 再 的 , 酸 , 发 融中 镁 漏 化烧铁混斗 铁 加 温 除 钾 插 铝 状, 条 斗 剂,珠合, 圈 入 度 去 是 入 热 态用 插 被 ,放物将 上 少 下 外 引 混 反 )水 入 烧 保出被氧 , 量 发 层 燃 合 应湿 混 穿 证一成化 下 氯 生 溶 剂 物 ,定润 合 , 镁为铁面酸剧渣,中放后物有条的铝粉放钾烈,镁的出,的熔的热热末置,的仔条部的量放中溶继剂和一最反细在分热于央物续,铝个后应观空镁是用落燃使粉盛将,察气条生氧硬入烧均砂用放,中燃成纸沙,化
2021/3/2
1
第
8.1 应用广泛的金属材料——钢铁
八 章
Fe的化学性质: 铁与氧气反应: 3Fe+2O2 点→燃Fe3O4 铁与硫粉反应: Fe+S →△ FeS 铁与氯气反应: 2Fe+3Cl2 点→燃 2FeCl3
铁与稀硫酸反应: Fe+H2SO4(稀) →FeSO4+H2↑ 铁与浓硫酸反应: 2Fe+4H2SO4(浓) →△SO2↑+Fe2(SO4)3+2H2O
铁与硫酸铜反应: Fe+CuSO4 →FeSO4+Cu 工业炼铁: Fe2O3+3CO 高→温2Fe+3CO2
2021/3/2
2
Fe的化学性质: 1. 铁与强酸反应:
Fe+4HNO3(稀) →Fe(NO3)3+NO↑+2H2O Fe+4HNO3(浓) →△ Fe(NO3)3+NO2↑+2H2O 2. 红热的铁与水蒸气反应:
8e
3Fe+4H2O(g)高→温 Fe3O4+4H2↑
2021/3/2
3
3.铁的氢氧化物的转化:
4Fe(OH)2+2H2O+O2 →4Fe(OH)3 纯白色→灰绿色→红褐色
[血红色溶液]
4.检验三价铁离子:
a. FeCl3+3KSCN Fe(SCN)3+3KCl b. 2Fe3++Fe →3Fe2+
6e
62HH22OO++22AAll++22NNaaOOHH→→22NNaaAAllOO22++33HH22↑↑++44HH22OO
2021/3/2 2H2O+2Al+2NaOH→2NaAlO2+3H2↑
12
氧化铝的性质 与酸/碱反应: Al2O3+6HCl→2AlCl3+3H2O Al2O3+2NaOH→2NaAlO2+H2O 氢氧化铝的弱酸与弱碱性 Al(OH)3+3HCl→AlCl3+3H2O Al(OH)3+NaOH→NaAlO2+2H2O
思考:使用铝壶烧水为什么不会发生反应? 回答:铝的表面有一层氧化铝薄膜,氧化铝不与热
水反应
2021/3/2
10
d. 铝与酸反应:
2Al+6HCl→2AlCl3+3H2↑ Al+4HNO3(稀)→Al(NO3)3+NO↑+2H2O 铝与浓硝酸、硫酸发生钝化
2021/3/2
11
e. 铝与强碱反应: 2Al+6H2O→2Al(OH)3+3H2↑ 2Al(OH)3+2NaOH→2NaAlO2+4H2O 上约下去叠相加同项: :
41A20lA+l3+MCF3Venr2O2OO23点点→5→点燃→燃燃326MCFVern++5A2AAl2lOl22O3O3+3+Q+QQ
擦 镁 瞬 实除 条 间 验表 的 插 现 最面 点 入 象 终氧 燃 漏 结化 斗 果铝 中薄 央膜
9
2021/3/2
c. 铝与热水反应:
6e
2Al+6H2O△→2Al(OH)3+3H2↑
2021/3/2
13
氢氧化铝的电离
H2O+H++AlO2-
酸式电离
Al(OH)3
Al3+ +3OH-
碱式电离
2021/3/2
14
Na:
Na的变色: Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3
Na与氧气反应: 4Na+O2→2Na2O
Na与氧气燃烧:
点燃
2Na+O2→Na2O2
7
a. 与非金属反应:2Al+3Cl2点→燃2AlCl3
实验现象 发出耀眼的白光
[实验]毛刷实验: 在反应盛生有成硝铝酸汞齐溶,液在的铝试的管表内面插形入成用小砂孔皮,打空磨气过进表入面后的,铝与条铝: 反应生成氧化铝, 产生的“毛”即为Al2O3 说明:铝在空气中也能被氧化
4Al+3O2→2Al2O铝3 条
氧化钠与水反应: Na2O+H2O→2NaOH 碳酸氢钠受热分解: 2NaHCO3→△ Na2CO3+H2O+CO2↑
c. 2Fe2++Cl2 →2Fe3++2Cl- 2FeCl2+Cl2 →2FeCl3 d. 2Fe3++2I- →2Fe2++I2
2FeCl3+2KI →I2+2FeCl2+2KCl
2021/3/2
4
化学拓展书教学: (一) 金属的腐蚀
腐蚀
Fe与C反应: 化学负腐极蚀(Fe):Fe–2e→Fe2+
正负极极(:C)F:e–22H析e +→+氢2F腐ee→2蚀+ H2↑ 电化正学极腐:蚀H2O+(强O2酸+4)e →4OH–
Fe2++2OH–→Fe(OH)2↓ 4Fe(OH)2+O吸2+氧2H腐2O蚀 → 2F4eF(Oe(HO)H3 →)△3(F中e2弱O3酸+3)H2O
2021/3/2
5
8.2 铝和铝合金的崛起 Al的制取:
过氧化钠与水反应: 2Na2O2+2H2O→4NaOH+O2↑
Na与水反应: 2Na+2H2O→2NaOH+H2↑
Na与硫酸铜反应: 2Na+2H2O+CuSO4→Cu(OH)2↓+H2↑+Na2SO4
过氧化钠与二氧化碳反应: 2Na2O2+2CO2→2Na2CO3+O2
过氧化钠与盐酸反应: 2Na2O2+4HCl→4NaCl+2H2O+O2↑
铝土矿
碱液
水合氧化铝 氢氧化铝
铝 阴极
冰晶石 电解
氧化铝 (刚玉)
2021/3/2
6
铝的制取原理:
通电
2Al2O3(熔融) 冰晶石熔融 4Al+3O2↑
[加入Na3AlF6作熔剂]
铝的化学性质: a. 与非金属反应:4Al+3O2点→燃2Al2O3
实验现象 发出耀眼的白光
