贝类中腹泻性贝类毒素的测定
贝类毒素的测定

用相当乙醚半量的蒸馏水洗乙醚层两次,再将乙醚层移入 250mL的磨口烧瓶中,减压浓缩 (旋转蒸发器, 35℃) 去除 乙醚
提取
以少量乙醚将浓缩物移入100mL磨口烧瓶中,再次减压 浓缩去除乙醚 以 1% 吐温 60 生理盐水将全部浓缩物在刻度试管中稀释 到 10mL 。此时 1mL 试液相当于 20g 去壳贝肉的重量,以 此悬浮液做为试验原液
小白鼠试验
振荡使试液或其稀释液成为均匀的悬浮液 将每只小白鼠称重,每三只小白鼠为一组,分别将1mL 试液注射到小白鼠腹腔中 同时,另取三只小白鼠作为对照组,注射1mL 1%吐温60生理盐水于腹腔中 观察自注射开始到24h后的小白鼠 存活情况,求出一组三只中死亡两 只及两只以上的最小注射量
样品的测定
检样的制备
贝类 洗净外壳,切断闭壳 肌,开壳,用清水淋 洗内部去除泥沙及其 他外来杂质,仔细取 贝肉,收集沥水 5min (避免贝肉堆积), 捡出碎壳等杂物,将 贝肉均质
注意:取肉时切勿 割破肉体,开壳前 不能加热或用麻醉 剂
样品的测定
检样的制备
贝类罐头 1. 将罐内所有内容物(包括贝肉组织及汁液), 于均质器中均质 2. 大容量的罐头,则过滤分离贝肉及汁液,分别 称重,将固形物和汤汁按比例混合,充分均质 冷冻贝类 在室温下,使冷冻的样品(带壳或脱壳的)呈 半冷冻状态,按上述规定的方法清洗、开壳、 淋洗、取肉、均质
将混合物加热,并徐徐煮沸 5min ,冷却至室温, 调节 pH 至 2.0-4.0 (切勿> 4.5 )。将混合物移至 量筒中并稀释至200mL
样品的测定
提取
将混合物倒回烧杯,搅拌至均质状,使其沉降至 上清液呈半透明状,不能堵塞注射针头即可
免疫亲和净化-液相色谱-串联质谱法测定贝类中腹泻性贝类毒素

免疫亲和净化-液相色谱-串联质谱法测定贝类中腹泻性贝类毒素严忠雍1,2,张小军1,2,*,李奇富3,陈思1,2,李佩佩1,2,祝银1,2,刘文静4(1.浙江省海洋水产研究所,浙江舟山 316021;2.浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021;3.江苏美正生物科技有限公司,江苏无锡214135;4.浙江海洋大学食品与医药学院,浙江舟山 316021)摘 要:建立贝类中腹泻性贝类毒素的免疫亲和净化-液相色谱-串联质谱分析方法。
样品采用80%甲醇溶液提取,选择磷酸盐缓冲液与提取液(4∶1,V/V)混合稀释后,免疫亲和选择专一净化,液相色谱-串联质谱分析。
根据腹泻性免疫亲和柱的使用特性,对上样液、淋洗液、洗脱液等参数进行优化。
质谱采用电喷雾负离子电离,多反应监测模式,外标法定量。
3 种分析物在1.0~100 μg/L质量浓度范围内线性相关系数均大于0.996,对应的检出限和定量限均为0.3 μg/kg和1.0 μg/kg,平均回收率为82.7%~94.3%,相对标准偏差为0.70%~7.61%。
本方法基质干扰小、净化效果强、灵敏度高,适合贝类中腹泻性贝类毒素的分析测定。
关键词:免疫亲和;液相色谱-串联质谱;腹泻性贝类毒素Determination of Diarrhetic Shellfish Poisons in Shellfish by Immunoaffinity Column Cleanup Coupled withLiquid Chromatography-Mass SpectrometryYAN Zhongyong1,2, ZHANG Xiaojun1,2,*, LI Qifu3, CHEN Si1,2, LI Peipei1,2, ZHU Yin1,2, LIU Wenjing4(1. Marine Fisheries Research Institute of Zhejiang, Zhoushan316021, China;2. Key Laboratory of Sustainable Utilization of Technology Research for Fishery Resource of Zhejiang, Zhoushan316021, China;3. Jiangsu Meizheng Biotechnology Co. Ltd., Wuxi 214135, China;4. School of Food Science and Pharmaceutics, Zhejiang Ocean University, Zhoushan 316021, China)Abstract: A new method using immunoaffinity chromatography (IAC) combined with liquid chromatography-tandem mass spectrometry (LC-MS/MS) was established for the determination of diarrhetic shellfish poisons (DSP) such as okadaic acid (OA), dinophysistoxin-1 (DTX1), pectenotoxin-1 (PTX1) in shellfish. Samples were extracted with 80% methanol, diluted with phosphate buffer, cleaned up by immunoaffinity chromatography, and detected by LC-MS/MS. The major parameters affecting the performance of IAC, including loading amount, washing time and elution conditions, were investigated. Detection was carried out by electrospray ionization in the negative ion mode using multiple reaction monitoring (MRM). The linear range of the analytes was 1.0–100 μg/L with correlation coefficient more than 0.996. The limit of detection (LOD) and limit of quantification (LOQ) for the analytes were calculated as 0.3 and 1.0 μg/kg, respectively. The mean recoveries of the analytes were in the range of 82.7%–94.3% with a relative standard deviation (RSD) of less than 7.61%. Therefore, the method could be used to identify and quantifydiarrhetic shellfish poisons in shellfish with less matrix interference and satisfactory sensitivity.Key words: immunoaffinity chromatography (IAC); liquid chromatography-tandem mass spectrometry (LC-MS/MS);diarrhetic shellfish poisonDOI:10.7506/spkx1002-6630-201718047中图分类号:TS201.6 文献标志码:A 文章编号:1002-6630(2017)18-0304-06引文格式:严忠雍, 张小军, 李奇富,等. 免疫亲和净化-液相色谱-串联质谱法测定贝类中腹泻性贝类毒素[J]. 食品科学, 2017, 38(18): 304-309. DOI:10.7506/spkx1002-6630-201718047. YAN Zhongyong, ZHANG Xiaojun, LI Qifu, et al. Determination of diarrhetic shellfish poisons in shellfish by immunoaffinity column cleanup coupled with liquid chromatography-mass spectrometry[J]. Food Science, 2017, 38(18): 304-309. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201718047. 收稿日期:2016-10-21基金项目:浙江省科研院所科技服务项目(2016F30020);浙江省分析测试科技计划项目(2016C37026)作者简介:严忠雍(1990—),男,助理工程师,学士,主要从事渔业环境监测和水产品质量安全研究。
液相色谱_串联质谱法检测贝类产品中腹泻性贝类毒素

DOI :10.3724/SP.J.1096.2011.00111液相色谱-串联质谱法检测贝类产品中腹泻性贝类毒素母清林*1方杰1万汉兴2王晓华1曹柳燕1张庆红11(浙江省舟山海洋生态环境监测站,舟山316000)2(中国海洋大学环境科学与工程学院,青岛266100)摘要建立了贝类组织中2种腹泻性贝毒(Diarrhetic Shellfish Poisoning ,DSP )聚醚类毒素-大田软海绵酸(Okadaic acid ,OA )和鳍藻毒素(Dinophysistoxin-1,DTX-1)的高效液相色谱-串联质谱分析方法。
贝类样品经80%甲醇溶液提取,经正己烷脱脂和HLB 固相萃取柱净化,采用Pursuit C 18(150mm %3.0mm ,3!m ,Varian 公司)色谱柱分离,以80%(V /V )甲醇水溶液为流动相等度洗脱,负离子扫描,在多反应监测(MRM )模式下进行定性与定量分析。
在4 200!g /L 范围内线性关系良好,OA 和DTX-1的最低定量限均为2!g /kg 。
添加水平在2,25和50!g /kg 时的平均回收率大于80%,相对标准偏差小于11%(n =6)。
关键词液相色谱-串联质谱;贝类毒素;大田软海绵酸;鳍藻毒素;贝类产品2010-06-13收稿;2010-06-30接受本文系浙江省环保科技计划专项基金(No.08-29)资助项目*E-mail :m_qinglin@163.com1引言贝类毒素种类多、分布广、毒性强。
贝类毒素检测直接关系到海产品的食用安全[1]。
腹泻性贝毒(Diarrhetic shellfish poisoning ,DSP )是一种藻类毒素,因被人食用后主要产生以腹泻为主要特征的中毒效应而得名。
DSP 是一类脂溶性多环醚类天然化合物,主要来源于鳍藻属(Dinophysis spp.)和原甲藻属(Prorocentrum spp.)等有毒藻,通过食物链传递而大量存在于软体贝类中。
贝类中腹泻性贝类毒素的测定

食品安全国家标准贝类中腹泻性贝类毒素的测定1范围本标准规定了贝类中腹泻性贝类毒素测定的小鼠生物法,酶联免疫吸附法和液相色谱-串联质谱法㊂本标准中小鼠生物法和酶联免疫吸附法适用于贝类及其制品中腹泻性贝类毒素的测定,液相色谱-串联质谱法适用于贝类可食部分及其制品(不包括盐渍制品)中腹泻性贝类毒素大田软海绵酸(O A)㊁鳍藻毒素-1(D T X-1)和鳍藻毒素-2(D T X-2)的测定㊂小鼠生物法2原理用丙酮提取贝类中腹泻性贝类毒素(D S P),经无水乙醚分配,减压蒸干后,再以含1%吐温-60的生理盐水为分散介质,制成D S P混悬液㊂将该混悬液注射入小鼠腹腔,观察小鼠存活情况,计算其毒力㊂3试剂和材料除非另有说明,本方法所用试剂均为分析纯,水为G B/T6682规定的一级水㊂3.1试剂3.1.1丙酮(C3H6O)㊂3.1.2无水乙醚(C4H10O)㊂3.1.3吐温-60(C64H126O26)㊂3.1.4氯化钠(N a C l)㊂3.2试剂配制3.2.1氯化钠溶液(0.85%):称取0.85g N a C l,加水溶解并定容至100m L㊂3.2.2吐温-60(1%):称取1.0g吐温-60,用氯化钠溶液(0.85%)溶解并定容至100m L㊂3.3材料3.3.1小鼠:体重为16g~20g的健康I C R品系雄性小鼠㊂3.3.2金属筛网:孔径约2mm㊂4仪器和设备4.1旋转蒸发器㊂4.2均质器㊂4.3天平:感量为0.1g㊂5分析步骤注:为避免毒素的危害,应戴手套进行操作㊂移液管及移液器吸头等用过的器材㊁废弃的提取液等应在次氯酸钠溶液(5%)浸泡1h以上以使毒素分解㊂对于动物实验过程中产生的污水㊁废弃物及动物尸体处理,应参照G B14925执行㊂5.1样品采集采取足够的贝类样品个数,并使贝肉达400g以上㊂远离实验室不能及时送检的样品,除了在常温下品质不会发生变化的,应将样品置于保温盒中冷冻送检,或采取必要措施保证其处于低温状态(0ħ~10ħ)送检㊂如为带壳样品,应开壳,去除水分后冷冻送检㊂5.2试样制备5.2.1生鲜带壳样品用清水彻底洗净贝类样品外表,切断闭壳肌,开壳,用清水淋洗内部去除泥沙及其他异物,取出贝肉㊂严禁以加热或药物方法开壳㊂注意不要破坏闭壳肌以外的组织,尤其是中肠腺(中肠腺又称消化盲囊,组织呈暗绿色或褐绿色)㊂将去壳贝肉置于孔径约2mm的金属筛网上,沥水5m i n㊂将贝肉剪碎㊂5.2.2冷冻样品在室温下使冷冻样品融化呈半冷冻状态㊂带壳冷冻的样品按5.2.1方法清洗㊁开壳㊁淋洗取肉,除去贝肉外部附着的冰片,抹去水分㊂将贝肉剪碎㊂5.3试样提取称取200g剪碎的贝肉试样置于均质杯中,按体积比加3倍量丙酮后均质2m i n以上㊂将均质好的物质倒入布氏漏斗中抽滤,收集滤液㊂分别用残渣2倍量的丙酮再清洗残渣两次,滤液与上述滤液合并㊂将滤液移入500m L的圆底烧瓶中,56ħʃ1ħ下,减压浓缩去除丙酮直至在液体表面分离出油状物㊂用100m L~200m L无水乙醚溶解油状物,倒入分液漏斗内,再用少量无水乙醚清洗圆底烧瓶,合并倒入分液漏斗内,以少量的水洗下粘壁部分,轻轻振荡(不能生成乳浊液),静置分层后去除水层(下层)㊂用相当乙醚半量的水洗乙醚层两次,去除水层,再将乙醚层移入250m L或500m L的圆底烧瓶中,于35ħʃ1ħ减压浓缩去除乙醚㊂用少量无水乙醚将浓缩物移入50m L或100m L圆底烧瓶中,再次减压浓缩去除乙醚㊂用1%吐温-60的生理盐水将全部浓缩物转移至刻度试管中稀释到10m L,充分振摇,制成均匀混悬液㊂1m L该混悬液相当于20g试样,以此混悬液为试验原液㊂以试验原液注射小鼠,当24h内2只或3只小鼠死亡时,需振荡试验原液使成均匀混悬液,用1%吐温-60生理盐水按表1逐步稀释成4倍或16倍的稀释液,充分混匀,按表1注射小鼠㊂5.4小鼠试验选择16g~20g健康I C R雄性小鼠6只,随机分为实验组和溶剂对照组两组,每组3只㊂实验组将腹腔注射试验原液或其稀释液,溶剂对照组将腹腔注射1%吐温-60生理盐水㊂分别取1m L待测液或1%吐温-60生理盐水腹腔注射小鼠㊂注射过程中若有提取液溢出,须将该只小鼠丢弃,并重新注射一只小鼠㊂仔细观察并记录死亡时间㊂死亡时间计算从注射完毕开始至小鼠停止呼吸(小鼠呼出最后一口气止)为止㊂存活动物应连续观察24h㊂观察时限24h内,在溶剂对照组小鼠正常的情况下,实验组若出现2只或3只小鼠死亡,则按表1进一步实验,以确定一组3只小鼠中死亡2只或2只以上的最小染毒量或最大稀释度㊂表1注射量㊁稀释度与毒力的关系注射液注射量m L相对应的试样量g毒力MU/g试验原液11.0200.05试验原液20.5100.14倍稀释液11.050.24倍稀释液20.52.50.416倍稀释液11.01.250.816倍稀释液20.50.6251.66分析结果的表述观察时限24h内,在溶剂对照组小鼠正常情况下,若实验组无小鼠死亡或仅有1只小鼠死亡,则报告样品中D S P毒力为:<0.05MU/g㊂观察时限24h内,在溶剂对照组小鼠正常情况下,若实验组有2只或3只小鼠死亡,则按5.4进行动物实验,并根据表1计算样品中D S P毒力,报告样品中D S P毒力为:ˑˑˑMU/g㊂酶联免疫吸附法7原理根据竞争性酶联免疫反应,游离的腹泻性贝类毒素与其酶标记物竞争腹泻性贝类毒素抗体㊂没有被结合的酶标记物在洗涤步骤中被除去㊂将酶底物和显色剂加入到孔中并且孵育㊂结合的酶标记物将无色的发色剂转化为蓝色的产物㊂加入反应终止液后使颜色由蓝转变为黄色㊂用酶标仪在450n m波长下测量微孔溶液的吸光度值,试样中的腹泻性贝类毒素含量与吸光度值成反比,按绘制的标准曲线定量计算㊂8试剂和材料除非另有说明,本方法所用试剂均为分析纯,水为G B/T6682规定的一级水㊂8.1试剂8.1.1甲醇(C H3O H)㊂8.1.2十二水合磷酸氢二钠(N a2H P O4㊃12H2O)㊂8.1.3氯化钠(N a C l)㊂8.1.4氯化钾(K C l)㊂8.1.5磷酸二氢钾(K H2P O4)㊂8.1.6吐温-20(C58H114O26)㊂8.1.7牛血清白蛋白(B S A)㊂8.1.8酶标记物㊂8.1.9过氧化氢(H2O2)㊂8.1.103,3,5,5-四甲基联苯胺(TM B,C16H20N2)㊂8.1.11硫酸(H2S O4)㊂8.2试剂配制8.2.1甲醇溶液(90%):量取90m L甲醇,加入10m L水,混合均匀㊂8.2.2磷酸盐缓冲液(P B S溶液,p H7.4):分别称取磷酸二氢钾0.20g㊁十二水合磷酸氢二钠2.90g㊁氯化钠8.00g㊁氯化钾0.20g,加水溶解并定容至1000m L㊂8.2.3酶标记物稀释液:称取1.0g B S A,加P B S溶液溶解并定容至1000m L㊂8.2.4酶标记物工作液:用酶标记物稀释液将酶标记物稀释至工作浓度㊂8.2.5洗脱液:吸取0.5m L吐温-20加入P B S溶液中,并稀释至1000m L㊂8.2.6硫酸溶液(1m o l/L):吸取53.2m L硫酸,缓缓加至900m L水中,并用水稀释至1000m L㊂8.3标准品大田软海绵酸(O A,C44H68O13,C A S号78111-17-8)标准溶液㊂8.4标准溶液配制标准系列工作液:将大田软海绵酸标准溶液用P B S溶液稀释,配制成浓度分别为0μg/L㊁5μg/L㊁10μg/L㊁25μg/L㊁50μg/L㊁100μg/L㊁150μg/L和200μg/L的D S P标准系列工作液㊂现用现配㊂8.5材料包被有腹泻性贝类毒素抗体的微孔板㊂注:商业化试剂盒若评价技术参数达到本标准的要求则也适合于本标准,参见附录A㊂9仪器和设备9.1酶标仪㊂9.2均质器㊂9.3离心机:转速ȡ6000r/m i n㊂10分析步骤10.1样品采集同5.1㊂10.2试样制备同5.2㊂10.3 试样提取将剪碎的试样均质,准确称取10g (精确至0.1g ),加入50m L 甲醇溶液(90%),均质1m i n ~2m i n ,6000r /m i n 离心10m i n ,转移出上清液,根据上清液体积加入2倍体积的P B S 溶液,混合均匀,吸取50μL 试样稀释液进行测定㊂10.4 测定将包被有腹泻性贝类毒素抗体的微孔条插入微孔架并做好标记,其中包括空白对照孔㊁标准液孔和样液孔,分别做平行孔㊂向空白对照孔加入50μLP B S 溶液,标准液孔加入50μL 腹泻性贝类毒素标准系列工作液,样液孔加入50μL 样液㊂加入50μL 腹泻性贝类毒素酶标记物至每个微孔,迅速充分混合,22ħ~25ħ避光孵育10m i n ㊂孵育结束后,倒去孔中液体,每个微孔注入250μL 洗脱液冲洗,翻转微孔板,倾去孔内液体,再重复以上洗板操作4次,在吸水纸上拍干㊂每孔加50μL 过氧化氢和T M B ,充分混合,室温避光孵育6m i n ㊂每孔加入50μL 硫酸溶液(1m o l /L )迅速混匀,终止反应,在10m i n 内测量并记录450n m 波长下的吸光度值㊂若提取液经测定后的质量浓度超出标准曲线的线性范围,应适当稀释后重新测定㊂10.5 标准曲线的制作以腹泻性贝类毒素标准工作液质量浓度以10为底的对数值为横坐标,以式(1)计算的标准液的百分比吸光度值为纵坐标,绘制标准曲线㊂腹泻性贝类毒素标准液或样液的百分比吸光度值按式(1)计算:A =SS 0ˑ100%(1)式中:A百分比吸光度值;S腹泻性贝类毒素标准液或样液的平均吸光度值;S 0 0μg/L 的腹泻性贝类毒素标准液的平均吸光度值㊂11 分析结果的表述试样中腹泻性贝类毒素的含量按式(2)计算:X =ρˑV ˑf m(2)式中:X 试样中腹泻性贝类毒素的含量,单位为微克每克(μg /g );ρ 由标准曲线得到的试样待测液中腹泻性贝类毒素的质量浓度,单位为微克每毫升(μg /m L );V 试样提取液的体积,单位为毫升(m L );f稀释倍数;m 试样的称样量,单位为克(g)㊂注:任何腹泻性贝类毒素含量大于16μg/100g 的样品即被认为是有害的,对人类食用不安全㊂12 其他本方法的定量限为10μg /k g㊂液相色谱-串联质谱法13原理试样经甲醇提取,碱性条件下水解释放出酯化态腹泻性贝类毒素,液相色谱分离,串联质谱法测定,以基质标准曲线进行外标法定量㊂14试剂和材料除非另有说明,本方法所用试剂均为优级纯,水为G B/T6682规定的一级水㊂14.1试剂14.1.1甲醇(C H3O H):色谱纯㊂14.1.2乙腈(C H3C N):色谱纯㊂14.1.3氨水(N H3㊃H2O)㊂14.1.4氢氧化钠(N a O H)㊂14.1.5盐酸(H C l)14.1.6甲酸铵(N H4C O O H):色谱纯㊂14.1.7甲酸(H C O O H):色谱纯㊂14.2试剂配制14.2.1甲醇溶液(30%):量取30m L甲醇,用水稀释至100m L㊂14.2.2甲醇溶液(20%):量取20m L甲醇,用水稀释至100m L㊂14.2.3氨水-甲醇溶液(0.3%):吸取0.3m L氨水,用甲醇稀释至100m L㊂14.2.4氢氧化钠溶液(2.5m o l/L):准确称取50g氢氧化钠,用水溶解并稀释至500m L㊂14.2.5盐酸溶液(2.5m o l/L):准确量取104.5m L盐酸,用水稀释至500m L㊂14.2.6流动相A[甲酸铵溶液(2mm o l/L)]:准确称取126m g甲酸铵,用50m L水将其全部溶解,加入2m L甲酸,加水定容至1000m L,室温下可保存48h㊂14.2.7流动相B[乙腈-甲酸铵溶液(2mm o l/L)(95+5)]:准确称取126m g甲酸铵,用30m L水溶解,加入2m L甲酸,加水稀释至50m L,再加入950m L乙腈,室温下可保存48h㊂14.3标准品14.3.1大田软海绵酸(O A,C44H68O13,C A S号78111-17-8)标准溶液:14.24μg/m L,或经国家认证并授予标准物质证书的一定浓度的O A标准溶液㊂14.3.2鳍藻毒素-1(D T X-1,C45H70O13,C A S号81720-10-7)标准溶液:15.15μg/m L,或经国家认证并授予标准物质证书的一定浓度的D T X-1标准溶液㊂14.3.3鳍藻毒素-2(D T X-2,C44H68O13,C A S号139933-46-3)标准溶液:7.80μg/m L,或经国家认证并授予标准物质证书的一定浓度的D T X-2标准溶液㊂14.4标准溶液配制14.4.1腹泻性贝类毒素混合标准中间液:分别吸取适量的各腹泻性贝类毒素标准溶液于5m L棕色容量瓶中,用甲醇稀释并定容,使各腹泻性贝类毒素浓度分别为:O A1.0μg/m L,D T X-11.0μg/m L,D T X-21.0μg/m L㊂-18ħ以下避光保存,保存期1个月㊂14.4.2腹泻性贝类毒素基质标准系列工作液:取5份空白试样,分别加入适量上述各浓度腹泻性贝类毒素混合标准中间液,按与试样相同的分析步骤处理,制成O A㊁D T X-1㊁D T X-2的质量浓度为0.8n g/ m L㊁1.6n g/m L㊁4.0n g/m L㊁8.0n g/m L和16.0n g/m L的基质标准系列工作液,过0.22μm的有机相微孔滤膜后备用㊂14.5材料14.5.1固相萃取柱:硅胶表面修饰苯乙烯二乙烯基苯聚合物型固相萃取柱,60m g/3m L,或性能相当者㊂使用前依次用1m L甲醇㊁1m L甲醇溶液(30%)活化㊂14.5.2微孔滤膜:0.22μm,有机相㊂15仪器和设备15.1液相色谱-串联质谱仪:配电喷雾离子源㊂15.2天平:感量为0.01g㊂15.3组织均质器:转速ȡ10000r/m i n㊂15.4涡旋振荡器㊂15.5离心机:转速ȡ8000r/m i n㊂15.6超声波清洗器㊂15.7恒温干燥箱㊂15.8固相萃取装置㊂15.9真空泵㊂15.10氮吹仪㊂15.11p H计㊂16分析步骤16.1样品采集同5.1㊂16.2试样制备同5.2㊂16.3试样提取16.3.1腹泻性贝类毒素提取将剪碎的试样均质,准确称取2g(精确至0.01g)于50m L具塞离心管中,加入9m L甲醇,涡旋混合1m i n,超声提取10m i n,8000r/m i n下离心5m i n,移出上清液于20m L刻度玻璃管中㊂残渣中加入9m L甲醇,重复提取一次,合并提取液,用甲醇定容至20m L㊂16.3.2酯化态腹泻性贝类毒素水解释放准确吸取提取液1m L置于螺纹口样品瓶中,加入氢氧化钠溶液(2.5m o l/L)125μL,混匀后用密封膜将瓶密封,于76ħ下温育40m i n,冷至室温后,加入盐酸溶液(2.5m o l/L)125μL并混匀,所得水解液(1.25m L相当于0.1g试样)可直接过0.22μm有机相微孔滤膜后,供液相色谱-串联质谱测定,或者必要时进行净化处理㊂16.4试样净化所得水解液用3m L水稀释,涡旋混匀后,移入已预活化的聚合物型固相萃取柱,待液体以1m L/ m i n的流速流出后,再用1m L甲醇溶液(20%)淋洗,弃去流出液,保持抽气2m i n,最后用1m L氨水-甲醇溶液(0.3%)洗脱,保持抽气2m i n,收集洗脱液,用甲醇定容至1m L(相当于0.1g试样),过0.22μm的有机相微孔滤膜后,供液相色谱-串联质谱测定㊂16.5空白试验除不加试样外,采用与试样相同的操作步骤,得到空白溶液㊂16.6仪器参考条件16.6.1液相色谱参考条件:a)色谱柱:C18柱,柱长100mm,内径2.1mm,粒径3.5μm,或性能相当者;b)流速:0.2m L/m i n;c)柱温:35ħ;d)进样量:10μL;e)流动相:流动相A为甲酸铵溶液(2mm o l/L),B为乙腈+甲酸铵溶液(2mm o l/L)(95+5),梯度洗脱,梯度洗脱条件见表2㊂表2流动相梯度洗脱条件时间/m i n A/%B/%0.070301.070303.010906.010906.170308.0703016.6.2质谱参考条件a)离子源:电喷雾离子源;b)扫描模式:负离子扫描;c)检测方式:多反应监测模式,O A㊁D T X-1㊁D T X-2母离子㊁子离子及去簇电压和碰撞能见表3;d)电喷雾电压(I S):-4000V;e)雾化气压力(G S1):414k P a;f)气帘气压力(C U R):104k P a;g)碰撞气压力(C A D):83k P a;h)辅助气流速(G S2):70L/m i n;i)离子源温度(T E M):550ħ㊂表3腹泻性贝类毒素多反应监测模式下母离子㊁子离子㊁去簇电压和碰撞能量目标化合物母离子m/z子离子m/z去簇电压V碰撞能量e V大田软海绵酸(O A)803255.3*-130-65 113.1-130-90鳍藻毒素-1(D T X-1)817255.2*-90-48 150.8-90-48鳍藻毒素-2(D T X-2)803255.0*113.0-130-130-65-90*代表定量离子㊂16.7基质校正标准曲线的制作将基质标准系列工作液分别注入液相色谱-串联质谱仪中,测定相应的峰面积,以标准工作液的质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线㊂腹泻性贝类毒素标准溶液的多反应监测色谱图参见图C.1㊂16.8试样溶液的测定将试样溶液注入液相色谱-串联质谱仪中,得到峰面积,根据基质标准曲线得到试样溶液中腹泻性贝类毒素的质量浓度㊂在同样测试条件下,试样溶液中腹泻性贝类毒素的保留时间与基质标准工作液中腹泻性贝类毒素的保留时间之间的偏差在ʃ2.5%以内,且试样溶液中腹泻性贝类毒素的定性离子的相对丰度应与质量浓度相近的基质标准工作液中腹泻性贝类毒素的定性离子的相对丰度一致,其丰度比偏差应符合表4要求,则可判定试样溶液中存在被测化合物㊂表4定性离子相对丰度的最大允许偏差定性离子相对丰度>50%>20%~50%>10%~20%ɤ10%允许的相对偏差ʃ20%ʃ25%ʃ30%ʃ50%17分析结果的表述17.1试样中腹泻性贝类毒素的含量按式(3)计算:X i=ρiˑVˑ1000mˑ1000(3)式中:X i 试样中腹泻性贝类毒素的含量,单位为微克每千克(μg/k g);ρi 由基质标准曲线得到的试样溶液中腹泻性贝类毒素的质量浓度,单位为纳克每毫升(n g/m L);V 试样溶液的体积,单位为毫升(m L);1000 换算因子;m 与1m L试样提取液相当的试样质量,单位为克(g)㊂计算结果应扣除空白值㊂计算结果保留三位有效数字㊂17.2总毒力计算试样中腹泻性贝类毒素总毒力按式(4)计算:O A e q=ðn i=1X i㊃r i (4)式中:O A e q 腹泻性贝类毒素总毒力,单位为微克每千克(μg/k g);X i 各种腹泻性贝类毒素的含量,单位为微克每千克(μg/k g);r i 毒性因子㊂注:试样中各种腹泻性贝类毒素的含量需按照附录B中的毒性因子(T E F s),统一转换为总毒力(O A e q)㊂18精密度在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%㊂19其他本方法中O A㊁D T X-1和D T X-2的检出限均为10.0μg/k g,O A㊁D T X-1和D T X-2的定量限均为30.0μg/k g㊂附录A商业化试剂盒评价技术参数A.1定量限定量限为10μg/k g㊂A.2回收率回收率为85%~90%㊂A.3重现性标准品变异系数ɤ10%,样品变异系数ɤ15%㊂A.4交叉反应率检测O A交叉反应率达到100%;检测D T X-1交叉反应率达到50%;检测D T X-2交叉反应率达到50%㊂与麻痹性贝类毒素,包括S T X㊁n e o S T X㊁d c-S T X㊁G T X1/4㊁G T X2/3㊁B1㊁B2㊁C-1/2和D A等没有任何交叉反应㊂附录B腹泻性贝类毒素毒性因子表B.1腹泻性贝类毒素毒性因子(r)毒素O A D T X-1D T X-2毒性因子110.6附录C腹泻性贝类毒素标准溶液的多反应监测色谱图腹泻性贝类毒素标准溶液的多反应监测色谱图见图C.1㊂图C.1腹泻性贝类毒素标准溶液(3n g/m L)的多反应监测色谱图。
毒素检验科检验方法一览表
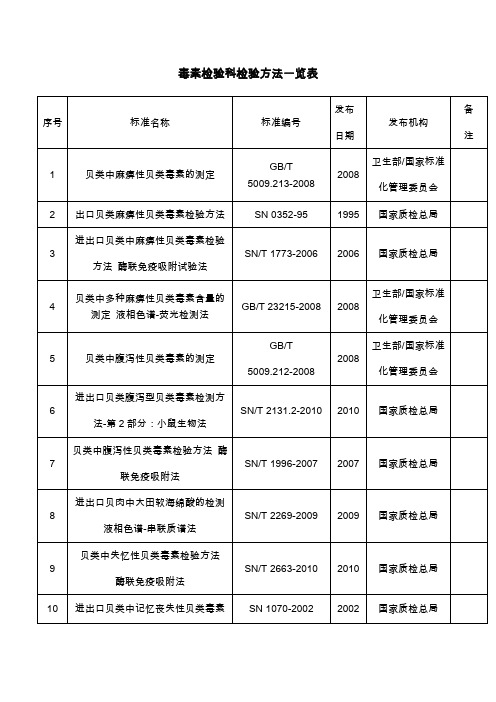
国家质检总局
20
泡菜和辣椒酱产品中寄生虫卵的检测方法
SFB 0090-2005
2005
技术中心
21
进出口食品中寄生虫的检验方法
SN/T 1748-2006
2006
国家质检总局
22
进出口食品中隐孢子虫检测方法PCR方法
SN/T 2143-2008
2008
国家质检总局
23
鱼华支睾吸虫囊蚴鉴定方法
SN/T 2978-2011
2011
国家质检总局
35
饲料中鱼源性成分定性检测方法PCR方法
SN/T 2867-2011
2011
国家质检总局
36
饲料中牛羊源性成分的定性检测定
性聚合酶链式反应(PCR)法
GB/T 20190-2006
2006
卫生部/国家标准化管理委员会
37
进口动物饲料中牛羊源性成份检测方法PCR方法
2007
卫生部/国家标准化管理委员会
29
动物源性饲料中骆驼源性成分定性检测方法PCR方法
GB/T 21100-2007
2007
卫生部/国家标准化管理委员会
30
动物源性饲料中猪源性成分定性检测方法PCR方法
GB/T 21101-2007
2007
卫生部/国家标准化管理委员会
31
动物源性饲料中兔源性成分定性检测方法实时荧光PCR方法
实时荧光PCR法
SN/T 3730.1-2013
2013
国家质检总局
41
食品及饲料中常见畜类品种的鉴定方法第2部分:狗成分检测
实时荧光PCR法
SN/T 3730.2-2013
酶联免疫法快速检测贝类中腹泻性贝类毒素

美 国 AB AX S腹 泻 性 贝 类 毒 素 试 剂 盒 , R I 甲醇 。
实验用 水 为蒸馏 水 。 酶标 比色仪 ( I - K) 离心 机 , 质器 。 B O TE , 均
1 2 主 要 试 剂 与 仪 器 .
D P 是 由有 毒 赤 潮 藻类 鳍 藻 属 和原 甲藻 属 中部 分 藻 S) 种产 生 的一类 脂溶 性 天 然化 合 物 , 主要 成 分 为 软 海 绵 酸及 其衍 生物 。有 毒 藻 经 双壳 贝类 滤 食 后 , 毒 素 会 其
在贝体 内累积 , 导致 贝类 食用 者 中毒 , 出现腹泻 、 心 、 恶
p b 0 2p b 0 5p b 1 0p b 2 0p b 5 0p b p 、 . p 、. p 、. p 、. p 、. p 。结
该 方法 对 小 鼠品种 ( 系) 品 的要 求 较 高 , 素 提 取 过 程 毒
复杂 , 易受 杂质 干扰 , 变异 性 较 高 , 且 因而 检 测 的准 确 性 和专 一 性较差 , 利 于 调 查追 踪 污染 源 以及 对 染 毒 不 贝类进 行早 期 临 控 和 预 警 。酶 联 免 疫 检 测 方 法 ( n E—
13 方 法 .
效 液相 色 谱 法 以及 液 相 色 谱 一质 谱 联 用 等 方 法 。
食 品检 验部 门常用 小 鼠生物 法进 行 DS P检验 , 由于 但
1 3 1 标 准 曲线 的绘 制 .. 试 剂盒 中提 供 的 D P标 准溶 液浓 度为 0p h 0 1 S p 、.
腹泻性贝类毒素(DSP)的两种快速检测方法比较

腹泻性贝类毒素(DSP)的两种快速检测方法比较胡雪莲;俞漪;曲勤凤;顾文佳【摘要】为了满足当前对于食品安全实时监控的需要,对腹泻性贝类毒素DSP的两种快速筛选方法——蛋白磷酸酶抑制法和酶联免疫法开展了研究,首先根据国内外相关标准的规定制定了这两种方法的筛选检出限,再对标准溶液及模拟阳性样品进行了检测,并进行了重复性验证,最后分析了这两种方法的检测原理并进行了优势比较.检测结果显示这两种筛选方法均具有准确率高,重复性较好的优点,本文提出的筛选检出限(200 μg/kg)远低于我国相关标准的规定(600 μg/kg),都不失为检测腹泻性贝类毒素的理想筛选方法.【期刊名称】《食品研究与开发》【年(卷),期】2012(033)012【总页数】4页(P127-130)【关键词】腹泻性贝类毒素(DSP);蛋白磷酸酶抑制法;酶联免疫法【作者】胡雪莲;俞漪;曲勤凤;顾文佳【作者单位】上海市质量监督检验技术研究院,上海200233【正文语种】中文贝类毒素(Shellfish toxin)是一类由浮游藻类或微生物合成,通过食物链传给贝类,并在其体内富集而形成的脂溶性次生代谢生物高分子化合物[1-3]。
它的形成与海洋中有毒藻类赤潮密切相关。
常见的贝类毒素包括腹泻性贝类毒素(DSP)、麻痹性贝类毒素(PSP)、神经性贝类毒素(NSP)和健忘性贝类毒素(ASP)等。
其中,腹泻性贝类毒素的存在比较普遍,海产双壳类、棘皮类、腹足类等软体动物中都曾有检出该毒素的报道[4]。
近年来对中国沿海部分海域贝类毒素的调查显示[5-7],中国沿海部分海域赤潮活动平凡,赤潮一旦产生,海产双壳贝类易受到贝类毒素的威胁。
腹泻性贝类毒素的主要中毒症状包括腹泻(92%)、恶心(80%)、呕吐(79%)、下腹疼痛(53%)[8]。
尽管目前还没有因DSP中毒致死的报道,但由于DSP中毒症状与细菌性胃肠炎类似,极易混淆,且发作时间短,目前尚无有效的治疗药物,若是延误治疗,会对健康造成较大的伤害。
贝类中腹泻性贝类毒素的测定 编制说明

《食品安全国家标准贝类中腹泻性贝类毒素的测定》(征求意见稿)编制说明一、标准起草的基本情况(包括简要的起草过程、主要起草单位、起草人等)根据国卫办食品函〔2014〕386号文件“国家卫生计生委办公厅关于印发食品安全国家标准整合工作方案的通知”中附件4食品安全国家标准整合项目计划,由辽宁出入境检验检疫局负责中华人民共和国国家标准《贝类中腹泻性贝类毒素的测定》(即本标准)的起草工作。
被修订标准号:GB/T 5009.212-2008《贝类中腹泻性贝类毒素的测定》、SC/T 3024-2004《无公害食品腹泻性贝类毒素的测定生物法》、SN/T 2269-2009《进出口贝肉中大田软海绵酸的检测液相色谱-串联质谱法》、SN/T 2131.2-2010《进出口贝类腹泻性贝类毒素检验方法第2部分:小鼠生物法》、SN/T 1996-2007《贝类中腹泻性贝类毒素检验方法酶连免疫吸附法》、SN/T 2131.1-2008《进出口贝类中腹泻性贝类毒素检测方法第1部分:荧光磷酸酶抑制法》。
修订根据以被测指标为基础,对相同的被测指标有多个检测方法的,应进行整合的原则,现整合制定《食品安全国家标准贝类中腹泻性贝类毒素的测定》,包含三种检测方法:1.小鼠生物法,2.酶联免疫吸附法,3.高效液相色谱-串联质谱法。
标准的制定过程主要分为标准方法整合、标准编写、不同方法之间互相验证等阶段,形成了标准征求意见稿。
本标准是按照GB/T1.1-2009《标准化工作导则第一部分:标准的结构和编写规则》和GB/T20001.4-2001《标准编写规则第四部分:化学分析方法》的要求进行编写的。
主要起草单位:辽宁出入境检验检疫局和中国水产科学研究院黄海水产研究所。
二、标准的重要内容及主要修改情况本标准适用于贝类及其制品中腹泻性贝类毒素的测定。
第一法小鼠生物法测定腹泻性贝类毒素总量;第二法适用于采用酶联免疫吸附法进行腹泻性贝类毒素筛选检测;第三法为确证方法,采用高效液相色谱-串联质谱法进行贝类可食部分及其制品(不包括盐渍制品)中腹泻性贝类毒素大田软海绵酸(OA)、鳍藻毒素-1(DTX-1)、鳍藻毒素-2(DTX-2)和鳍藻毒素-3(DTX-3)的测定。
高效液相色谱-串联质谱法测定贻贝中腹泻性贝类毒素的含量

p r r a c i i crm t rp ytne asset me y ( P C MS ) S ef hsmpew set c d b 0 e om n el ud ho a gah - dm m s pc o t f q o a r r H L - / . hl s a l a x at y8 % MS l i r e
f. hj n i e e uly et g et , aghu hj n 3 0 1,h a 1Z ei g s r s at T sn n e H nzo , ea ,10 2 i ; a F hi Q i i C r Z i C n
2 C l g Fo c n e n i eh o g nier gZ ea g ogh n nvrt, a ghuZ e a, 10 5C i ) . oee f odSi c dBo c nl y g e n, hj n nsag ie i H nzo hj n 30 3 ,hn l o e a t o E n i i G U sy i a
Li a u g r o m a e Li ui nn e s by Hi h Pe f r nc q d Chr m a o r p y Ta e M a s o t g a h nd m s
Sp c r m e r e to ty
Zh n i q He Xi 。 Zh n o g y n a g Ha - i , n , e g Ch n - i g
8 74251 种贝类毒素在2 ~ 0 g 范 围内线性 良好 ;在4 1. 5 .。2 / 080 / L 个添加水平下O A的 回收率为7 . ~8 . , S 95 % 86 R D为 % 84 %~1.%; T 一 的回收率为8 .%~9 .%, S 为42 % ~ . %。 .3 04 D X 1 3 8 1 2 R D .2 65 4 方法灵 敏度高 , 定量 限为00 m /g 来 自市 . g 。 2 k 场 和产地的4 个贻贝样 品残 留分析发现 , 个样 品检 出腹泻性贝类毒 素, 5 有4 检出率为8 %。 . 9
贝类腹泻性毒素现场高通量前处理及快速检测仪器设计

贝类腹泻性毒素现场高通量前处理及快速检测仪器设计∗万梓健;邱先鑫;钟隆洁;苏凯麒;邹瞿超;方佳如;潘宇祥;王平【摘要】为实现贝类腹泻性毒素的现场快速检测,本论文设计了一种现场高通量前处理装置及基于移动终端的快速检测系统。
通过使用酶联免疫反应技术对腹泻性贝毒进行显色反应,结合基于移动终端的快速检测装置,采集显色反应结果图像,实现准确快速的检测结果分析。
采用所设计的前处理装置与实验室手工前处理标准方法对比,其回收率分别为89%和93%,结果表明,本文设计的前处理装置能够满足现场检测分析的需求。
通过加标样品检测,采用移动终端的快速检测系统测量标准差为0.13,平均回收率89.5%。
实验结果表明,该检测系统的准确性和重复性满足实际检测的需求。
最后,针对实际样品,与酶标仪检测结果相比较,表明了所设计的现场高通量前处理装置及快速检测系统能达到对贝类腹泻性毒素现场快速精确检测,为贝类腹泻性毒素现场检测提供了新的方法和仪器。
%In order to achieve the requirement of diarrhetic shellfish poison(DSP)in ̄suit detection,we design a high throughput pretreatment system and a mobile terminal based detection system. Our system can make fast and accurate DSP detection by analyzing image of chromogenic reaction come from ELISA method. The rate of recovery by our pretreatment system and by hand are 89% and 93% respectively,it means that our pretreatment system can meet the follow ̄up detection requirement. Detect the prevented samples by our detection system, the standard deviation is approximately 0.13 and average rate of recovery is 89.5%,it can satisfy the accuracy and repeatability of detection. In the detection of actual samples,comparing our results with the results come from microplate reader,it shows that ourpretreatment and detection system can do a fast and accurate in ̄suit work and provide a new method for the detection.【期刊名称】《传感技术学报》【年(卷),期】2017(030)001【总页数】7页(P1-7)【关键词】贝类腹泻性毒素;前处理装置;快速检测系统;移动终端【作者】万梓健;邱先鑫;钟隆洁;苏凯麒;邹瞿超;方佳如;潘宇祥;王平【作者单位】浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027;浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027;浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027;浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027;浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027;浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027;浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027;浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027【正文语种】中文【中图分类】R318腹泻性贝毒DSP(Diarrhetic Shellfish Poisoning)是有毒赤潮藻类鳍藻属和原甲藻属中一些种类产生的脂溶性多环醚类生物活性物质。
MM_FS_CNJ_0346 出口贝类腹泻性贝类毒素检验方法

出口贝类腹泻性贝类毒素检验方法.适用范围本方法适用于海产双壳类贝肉、贝柱、外套膜及其制品地腹泻性贝类毒素地检验..原理概要用丙酮提取贝类中毒素,再转移至乙醚中,经减压浓缩至干后,再以%吐温生理盐水溶解残留物注射小白鼠观察存活情况,计算其毒力..主要试剂和仪器.主要试剂丙酮(分析纯);乙醚(分析纯);%吐温生理盐水..仪器旋转蒸发器;均质器;天平:感量;刻度试管:,具刻度;冰箱:~℃和-~℃;注射器:;注射器针头:;体重为~地健康系雄性小白鼠..检验批同一检验批地商品应具有相同特征,如产地、规格等..试样地保存.样品要有充分地代表性并尽可能没有个体差异.同时,还要有充分地个数.去壳贝肉、带壳地或罐装地等,均应采取足够地个数并使贝肉达以上..远离实验室,不能及时送检地样品,除了在常温下品质不会发生变化地,应将样置于合成树脂袋内冷冻送检.如为带壳样品,应按地方法开壳,去除水分后冷冻送检..试样地制备.生鲜带壳样品,用刀切开闭壳肌开壳取出贝肉.不得以加热及加药物地方法开壳.注意不要破坏闭壳肌以外地组织,尤其是中肠腺(又称消化盲囊,组织呈暗绿色或褐绿色).将去壳贝肉放在孔径约地金属网上,控水,按或制备检样..冷冻地带壳样品,使其在室温下呈半冷冻状态后,以前述方法开壳取肉,这时地贝肉仍呈冷冻状态.经除去贝壳外部附着地冰片,轻轻抹去水分后,按或制备样品..事先已除水分地冷冻去壳贝肉,按或制备样品..扇贝、贻贝、牡蛎等可以切取中肠腺地去壳贝肉,称量贝肉重量后仔细切取全部中肠腺,将中肠腺称重后细切混合做为检样.同时,注意不要使中肠腺内容物污染案板..对不便切取中肠腺地去壳贝肉样品,可将全部贝肉细切,混合,做为检样..为避免毒素地危害,应戴手套进行检验操作.移液管等用过地器材应在%地次氯酸钠溶液中浸泡以上,以使毒素分解,同样,废弃地提取液等也应以上述溶液处理..过程简述.提取.将检样置于均质杯内,加倍量丙酮至少均质.如为小均质杯,可分两次操作. .用布氏漏斗抽滤并收集提取液..对残渣以检样两倍量丙酮再抽滤两次,合并抽滤液..将抽提液移入旋转蒸发瓶内,减压浓缩去除丙酮直至在液体表面分离出油状物. .将浓缩移入分液漏斗内,以~乙醚和少量地水洗下粘壁部分,以不生成乳浊液地程度轻轻振荡,静置分层后去除水层..用相当乙醚半量地蒸馏水洗醚层两次,再将醚层移入~地茄形瓶中,减压浓缩去除乙醚..以少量乙醚将浓缩物移入或茄形瓶中,再次减压浓缩去除乙醚..以%吐温生理盐水将全部浓缩物在刻度试管中稀释到.按条以中肠腺做为检样地,此时液量相当于预先测定地去壳贝肉地重量.对其他检样,此时液量也相当于去壳贝肉地重量,以此悬浮液做为试验溶液..如必要时,对试验溶液可做进一步稀释,稀释前,应先以振荡器使试液成均一悬浮液,再取其部分以%吐温生理盐水稀释成倍或倍地试液..小白鼠试验.以振荡器使试液或其稀释液成为均一地悬浮液..分别将试液注射到三只体重~地健康系雄性小白鼠腹腔中..按上项方法,注射%吐温生理盐水,做为阴性对照..观察自注射开始到后地小白鼠存活情况,求出一组三只中死亡两只以上地最小注射量..小白鼠注射腹泻性贝毒后地症状为运动不活泼,大多呼吸异常,致死时间长(也有以上地.).结果计算.毒力地计算使体重~地小白鼠在死亡地毒力为个小白鼠单位(),实际小白鼠单位地计算,按下表从一组三只中二只以上在内死亡地最小注射量及最大稀释倍数进行计算..注射量与毒力地关系.注:)以中肠腺为检样时,相当于含有中肠腺地去壳贝肉量..来源:-。
贝类毒素的测定

精品课件
样品的测定
小鼠试验
若注射样品原液后,1只或2只小鼠的死亡时间 大于7min,则需再注射至少3只小鼠以确定样 品的毒力
若小鼠的死亡时间小于5min,则要稀释样品提 取液后,再注射另一组小鼠(3只),得到 5min-7min的死亡时间
将混合物加热,并徐徐煮沸5min,冷却至室温, 调节pH至2.0-4.0(切勿>4.5)。将混合物移至 量筒中并稀释至200mL
精品课件
样品的测定
提取
将混合物倒回烧杯,搅拌至均质状,使其沉降至 上清液呈半透明状,不能堵塞注射针头即可
必要时将混合物或上清液以3000r/min离心5min, 或用滤纸过滤
DSP是由于双壳贝类滤食含毒的涡鞭毛藻而引起 影响较严重的地区主要是日本和欧洲沿海国家,
发病率高,引起许多国家地区的关注 受DSP中毒的症状表现为消化功能紊乱(腹泻、
呕吐、腹痛),食用含毒贝类后30分钟至几小 时出现症状,中毒者一般在3-4天康复,尚无死 亡病例
精品课件
腹泻性贝类毒素的测定方法
试剂
盐酸溶液:0.1 mol/L 盐酸溶液:5 mol/L 氢氧化钠溶液:0.1 mol/L
精品课件
仪器和设备
均质器 天平(感量0.1g) 离心机 pH计 秒表 玻璃皿;烧杯、量筒、容量瓶、搅拌棒等 注射器:1mL 注射器针头:8#
精品课件
小白鼠:
体重为19-21g的健康ICR系雄性小白鼠 若体重<19g或>21g,查表中的校正系
精品课件
剂
样品的测定
检样的制备
贝类罐头 1.将罐内所有内容物(包括贝肉组织及汁液),
贝类毒素的测定

使用
BG
7
样品的测定
检样的制备
贝类
洗净外壳,切断闭壳 肌,开壳,用清水淋 洗内部去除泥沙及其 他外来杂质,仔细取 贝 肉 , 收 集 沥 水 5min (避免贝肉堆积), 捡出碎壳等杂物,将 贝肉均质
BG
注意:取肉时切勿
割破肉体,开壳前
贝类毒素的测定 生物法
BG
1
一、麻痹性贝类毒素(PSP)
Para1ytical shellfish poisoning
PSP中毒是最常见的食用贝类中毒 PSP由一组石房蛤毒及其衍生物组成,PSP与涡
鞭毛藻的水华有关(>106个细胞/升) PSP在世界范围内分布 PSP中毒引起神经系统紊乱,呼吸困难,感觉
生物法(即小白鼠法),系采用ICR系列的小白鼠作为检验 动物,进行贝类毒素分析
生物法(即小白鼠法)优势:当使用生物法检测法时,一旦 发现超标样品,则本批样品不得食用,这说明所检测贝类
中相关的毒素含量已经影响到人们的食用安全,不适合食
用。
BG
3
麻痹性贝类毒素的测定 生物法
(SC/T 3023-2003)
BG
9பைடு நூலகம்
样品的测定
提取
取 100g 样 品 于 800mL 烧 杯 中 , 加 0.1mol/L HCl溶液100mL充分搅拌, 检 查 pH ( pH 应 为 2.0-4.0 ) 。 需 要 时,可逐滴加入5mol/L HCl溶液或 0.1mol/L NaOH溶液调整pH,加碱 时速度要慢,同时需不断搅拌,防 止局部碱化破坏毒素
BG
14
结果的计算与判断
毒力的计算
SC-T 3024-2004 腹泻性贝类毒素的测定 生物法

SC/T 3024—2004无公害食品腹泻性贝类毒素的测定生物法发布时间:2004年1月7日实施时间:2004年3月1日发布单位:中华人民共和国农业部1、范围本标准规定了腹泻性贝类毒素(DSP)的测定方法—生物法。
本标准适用于软体动物贝类可食部分中腹泻性贝类毒素(DSP)的测定。
2、原理用丙酮提取贝类中毒素,再转移至乙醚中,经减压浓缩蒸干后,再以1%吐温-60生理盐水溶解残留物,注射小鼠,观察存活情况,计算其毒力。
3、试剂和材料3.1 丙酮(分析纯)。
3.2 乙醚(分析纯)。
3.3 1%吐温-60生理盐水:称取1.0 g吐温-60,溶于生理盐水(0.8%NaCl)中,并定容至100.0mL。
4、仪器和设备4.1 旋转蒸发器。
4.2 均质器。
4.3 磨口烧瓶:圆底,500mL、100mL。
4.4 布氏漏斗:Ф100mm。
4.5 分液漏斗:具塞,500mL。
4.6 天平:感量0.1g。
4.7 刻度试管:10mL,具塞。
4.8 冰箱:0℃~5℃和-15℃~-20℃。
4.9 注射器:1mL。
4.10 注射器针头:8#。
4.11 小鼠:体重为16g~20g的健康ICR系雄性小鼠。
5、检样的制备5.1 生鲜带壳的贝类a) 用清水彻底洗净贝类外壳,开壳,用清水淋洗内部去除泥沙及其他外来杂质,仔细取出贝肉,切勿割破肉体;b) 收集贝肉,沥水5min,捡出碎壳等杂物,迅速冷冻,贮藏备用;c) 注意不要破坏闭壳肌以外的组织,尤其是中肠腺(又称消化盲囊,组织呈暗绿色或褐绿色)。
开壳前不能加热或用麻醉剂。
5.2 冷冻贝类在室温下,使冷冻的样品(带壳或去壳的)呈半冷冻状态,按5.1方法清洗、开壳、淋洗、取肉。
5.3 取样a) 可以切取中肠腺的贝类(扇贝、贻贝、牡蛎等),称取200g贝肉后,仔细切取全部中肠腺,将中肠腺称重后细切混合作为检样,注意不要使中肠内容物污染案板;b) 对于尚未确定部位毒性的贝类及不易切取中肠腺的小型贝肉,可将全部贝肉细切、混合,作为检样;c) 为避免毒素的危害,应戴手套进行检验操作,移液管等用过的器材应在5%的次氯酸钠溶液中浸泡1 h 以上,以使毒素分解;废弃的提取液等也应用5%的次氯酸钠溶液处理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
食品安全国家标准贝类中腹泻性贝类毒素的测定1范围本标准规定了贝类中腹泻性贝类毒素测定的小鼠生物法,酶联免疫吸附法和液相色谱-串联质谱法㊂本标准中小鼠生物法和酶联免疫吸附法适用于贝类及其制品中腹泻性贝类毒素的测定,液相色谱-串联质谱法适用于贝类可食部分及其制品(不包括盐渍制品)中腹泻性贝类毒素大田软海绵酸(O A)㊁鳍藻毒素-1(D T X-1)和鳍藻毒素-2(D T X-2)的测定㊂小鼠生物法2原理用丙酮提取贝类中腹泻性贝类毒素(D S P),经无水乙醚分配,减压蒸干后,再以含1%吐温-60的生理盐水为分散介质,制成D S P混悬液㊂将该混悬液注射入小鼠腹腔,观察小鼠存活情况,计算其毒力㊂3试剂和材料除非另有说明,本方法所用试剂均为分析纯,水为G B/T6682规定的一级水㊂3.1试剂3.1.1丙酮(C3H6O)㊂3.1.2无水乙醚(C4H10O)㊂3.1.3吐温-60(C64H126O26)㊂3.1.4氯化钠(N a C l)㊂3.2试剂配制3.2.1氯化钠溶液(0.85%):称取0.85g N a C l,加水溶解并定容至100m L㊂3.2.2吐温-60(1%):称取1.0g吐温-60,用氯化钠溶液(0.85%)溶解并定容至100m L㊂3.3材料3.3.1小鼠:体重为16g~20g的健康I C R品系雄性小鼠㊂3.3.2金属筛网:孔径约2mm㊂4仪器和设备4.1旋转蒸发器㊂4.2均质器㊂4.3天平:感量为0.1g㊂5分析步骤注:为避免毒素的危害,应戴手套进行操作㊂移液管及移液器吸头等用过的器材㊁废弃的提取液等应在次氯酸钠溶液(5%)浸泡1h以上以使毒素分解㊂对于动物实验过程中产生的污水㊁废弃物及动物尸体处理,应参照G B14925执行㊂5.1样品采集采取足够的贝类样品个数,并使贝肉达400g以上㊂远离实验室不能及时送检的样品,除了在常温下品质不会发生变化的,应将样品置于保温盒中冷冻送检,或采取必要措施保证其处于低温状态(0ħ~10ħ)送检㊂如为带壳样品,应开壳,去除水分后冷冻送检㊂5.2试样制备5.2.1生鲜带壳样品用清水彻底洗净贝类样品外表,切断闭壳肌,开壳,用清水淋洗内部去除泥沙及其他异物,取出贝肉㊂严禁以加热或药物方法开壳㊂注意不要破坏闭壳肌以外的组织,尤其是中肠腺(中肠腺又称消化盲囊,组织呈暗绿色或褐绿色)㊂将去壳贝肉置于孔径约2mm的金属筛网上,沥水5m i n㊂将贝肉剪碎㊂5.2.2冷冻样品在室温下使冷冻样品融化呈半冷冻状态㊂带壳冷冻的样品按5.2.1方法清洗㊁开壳㊁淋洗取肉,除去贝肉外部附着的冰片,抹去水分㊂将贝肉剪碎㊂5.3试样提取称取200g剪碎的贝肉试样置于均质杯中,按体积比加3倍量丙酮后均质2m i n以上㊂将均质好的物质倒入布氏漏斗中抽滤,收集滤液㊂分别用残渣2倍量的丙酮再清洗残渣两次,滤液与上述滤液合并㊂将滤液移入500m L的圆底烧瓶中,56ħʃ1ħ下,减压浓缩去除丙酮直至在液体表面分离出油状物㊂用100m L~200m L无水乙醚溶解油状物,倒入分液漏斗内,再用少量无水乙醚清洗圆底烧瓶,合并倒入分液漏斗内,以少量的水洗下粘壁部分,轻轻振荡(不能生成乳浊液),静置分层后去除水层(下层)㊂用相当乙醚半量的水洗乙醚层两次,去除水层,再将乙醚层移入250m L或500m L的圆底烧瓶中,于35ħʃ1ħ减压浓缩去除乙醚㊂用少量无水乙醚将浓缩物移入50m L或100m L圆底烧瓶中,再次减压浓缩去除乙醚㊂用1%吐温-60的生理盐水将全部浓缩物转移至刻度试管中稀释到10m L,充分振摇,制成均匀混悬液㊂1m L该混悬液相当于20g试样,以此混悬液为试验原液㊂以试验原液注射小鼠,当24h内2只或3只小鼠死亡时,需振荡试验原液使成均匀混悬液,用1%吐温-60生理盐水按表1逐步稀释成4倍或16倍的稀释液,充分混匀,按表1注射小鼠㊂5.4小鼠试验选择16g~20g健康I C R雄性小鼠6只,随机分为实验组和溶剂对照组两组,每组3只㊂实验组将腹腔注射试验原液或其稀释液,溶剂对照组将腹腔注射1%吐温-60生理盐水㊂分别取1m L待测液或1%吐温-60生理盐水腹腔注射小鼠㊂注射过程中若有提取液溢出,须将该只小鼠丢弃,并重新注射一只小鼠㊂仔细观察并记录死亡时间㊂死亡时间计算从注射完毕开始至小鼠停止呼吸(小鼠呼出最后一口气止)为止㊂存活动物应连续观察24h㊂观察时限24h内,在溶剂对照组小鼠正常的情况下,实验组若出现2只或3只小鼠死亡,则按表1进一步实验,以确定一组3只小鼠中死亡2只或2只以上的最小染毒量或最大稀释度㊂表1注射量㊁稀释度与毒力的关系注射液注射量m L相对应的试样量g毒力MU/g试验原液11.0200.05试验原液20.5100.14倍稀释液11.050.24倍稀释液20.52.50.416倍稀释液11.01.250.816倍稀释液20.50.6251.66分析结果的表述观察时限24h内,在溶剂对照组小鼠正常情况下,若实验组无小鼠死亡或仅有1只小鼠死亡,则报告样品中D S P毒力为:<0.05MU/g㊂观察时限24h内,在溶剂对照组小鼠正常情况下,若实验组有2只或3只小鼠死亡,则按5.4进行动物实验,并根据表1计算样品中D S P毒力,报告样品中D S P毒力为:ˑˑˑMU/g㊂酶联免疫吸附法7原理根据竞争性酶联免疫反应,游离的腹泻性贝类毒素与其酶标记物竞争腹泻性贝类毒素抗体㊂没有被结合的酶标记物在洗涤步骤中被除去㊂将酶底物和显色剂加入到孔中并且孵育㊂结合的酶标记物将无色的发色剂转化为蓝色的产物㊂加入反应终止液后使颜色由蓝转变为黄色㊂用酶标仪在450n m波长下测量微孔溶液的吸光度值,试样中的腹泻性贝类毒素含量与吸光度值成反比,按绘制的标准曲线定量计算㊂8试剂和材料除非另有说明,本方法所用试剂均为分析纯,水为G B/T6682规定的一级水㊂8.1试剂8.1.1甲醇(C H3O H)㊂8.1.2十二水合磷酸氢二钠(N a2H P O4㊃12H2O)㊂8.1.3氯化钠(N a C l)㊂8.1.4氯化钾(K C l)㊂8.1.5磷酸二氢钾(K H2P O4)㊂8.1.6吐温-20(C58H114O26)㊂8.1.7牛血清白蛋白(B S A)㊂8.1.8酶标记物㊂8.1.9过氧化氢(H2O2)㊂8.1.103,3,5,5-四甲基联苯胺(TM B,C16H20N2)㊂8.1.11硫酸(H2S O4)㊂8.2试剂配制8.2.1甲醇溶液(90%):量取90m L甲醇,加入10m L水,混合均匀㊂8.2.2磷酸盐缓冲液(P B S溶液,p H7.4):分别称取磷酸二氢钾0.20g㊁十二水合磷酸氢二钠2.90g㊁氯化钠8.00g㊁氯化钾0.20g,加水溶解并定容至1000m L㊂8.2.3酶标记物稀释液:称取1.0g B S A,加P B S溶液溶解并定容至1000m L㊂8.2.4酶标记物工作液:用酶标记物稀释液将酶标记物稀释至工作浓度㊂8.2.5洗脱液:吸取0.5m L吐温-20加入P B S溶液中,并稀释至1000m L㊂8.2.6硫酸溶液(1m o l/L):吸取53.2m L硫酸,缓缓加至900m L水中,并用水稀释至1000m L㊂8.3标准品大田软海绵酸(O A,C44H68O13,C A S号78111-17-8)标准溶液㊂8.4标准溶液配制标准系列工作液:将大田软海绵酸标准溶液用P B S溶液稀释,配制成浓度分别为0μg/L㊁5μg/L㊁10μg/L㊁25μg/L㊁50μg/L㊁100μg/L㊁150μg/L和200μg/L的D S P标准系列工作液㊂现用现配㊂8.5材料包被有腹泻性贝类毒素抗体的微孔板㊂注:商业化试剂盒若评价技术参数达到本标准的要求则也适合于本标准,参见附录A㊂9仪器和设备9.1酶标仪㊂9.2均质器㊂9.3离心机:转速ȡ6000r/m i n㊂10分析步骤10.1样品采集同5.1㊂10.2试样制备同5.2㊂10.3 试样提取将剪碎的试样均质,准确称取10g (精确至0.1g ),加入50m L 甲醇溶液(90%),均质1m i n ~2m i n ,6000r /m i n 离心10m i n ,转移出上清液,根据上清液体积加入2倍体积的P B S 溶液,混合均匀,吸取50μL 试样稀释液进行测定㊂10.4 测定将包被有腹泻性贝类毒素抗体的微孔条插入微孔架并做好标记,其中包括空白对照孔㊁标准液孔和样液孔,分别做平行孔㊂向空白对照孔加入50μLP B S 溶液,标准液孔加入50μL 腹泻性贝类毒素标准系列工作液,样液孔加入50μL 样液㊂加入50μL 腹泻性贝类毒素酶标记物至每个微孔,迅速充分混合,22ħ~25ħ避光孵育10m i n ㊂孵育结束后,倒去孔中液体,每个微孔注入250μL 洗脱液冲洗,翻转微孔板,倾去孔内液体,再重复以上洗板操作4次,在吸水纸上拍干㊂每孔加50μL 过氧化氢和T M B ,充分混合,室温避光孵育6m i n ㊂每孔加入50μL 硫酸溶液(1m o l /L )迅速混匀,终止反应,在10m i n 内测量并记录450n m 波长下的吸光度值㊂若提取液经测定后的质量浓度超出标准曲线的线性范围,应适当稀释后重新测定㊂10.5 标准曲线的制作以腹泻性贝类毒素标准工作液质量浓度以10为底的对数值为横坐标,以式(1)计算的标准液的百分比吸光度值为纵坐标,绘制标准曲线㊂腹泻性贝类毒素标准液或样液的百分比吸光度值按式(1)计算:A =SS 0ˑ100%(1)式中:A百分比吸光度值;S腹泻性贝类毒素标准液或样液的平均吸光度值;S 0 0μg/L 的腹泻性贝类毒素标准液的平均吸光度值㊂11 分析结果的表述试样中腹泻性贝类毒素的含量按式(2)计算:X =ρˑV ˑf m(2)式中:X 试样中腹泻性贝类毒素的含量,单位为微克每克(μg /g );ρ 由标准曲线得到的试样待测液中腹泻性贝类毒素的质量浓度,单位为微克每毫升(μg /m L );V 试样提取液的体积,单位为毫升(m L );f稀释倍数;m 试样的称样量,单位为克(g)㊂注:任何腹泻性贝类毒素含量大于16μg/100g 的样品即被认为是有害的,对人类食用不安全㊂12 其他本方法的定量限为10μg /k g㊂液相色谱-串联质谱法13原理试样经甲醇提取,碱性条件下水解释放出酯化态腹泻性贝类毒素,液相色谱分离,串联质谱法测定,以基质标准曲线进行外标法定量㊂14试剂和材料除非另有说明,本方法所用试剂均为优级纯,水为G B/T6682规定的一级水㊂14.1试剂14.1.1甲醇(C H3O H):色谱纯㊂14.1.2乙腈(C H3C N):色谱纯㊂14.1.3氨水(N H3㊃H2O)㊂14.1.4氢氧化钠(N a O H)㊂14.1.5盐酸(H C l)14.1.6甲酸铵(N H4C O O H):色谱纯㊂14.1.7甲酸(H C O O H):色谱纯㊂14.2试剂配制14.2.1甲醇溶液(30%):量取30m L甲醇,用水稀释至100m L㊂14.2.2甲醇溶液(20%):量取20m L甲醇,用水稀释至100m L㊂14.2.3氨水-甲醇溶液(0.3%):吸取0.3m L氨水,用甲醇稀释至100m L㊂14.2.4氢氧化钠溶液(2.5m o l/L):准确称取50g氢氧化钠,用水溶解并稀释至500m L㊂14.2.5盐酸溶液(2.5m o l/L):准确量取104.5m L盐酸,用水稀释至500m L㊂14.2.6流动相A[甲酸铵溶液(2mm o l/L)]:准确称取126m g甲酸铵,用50m L水将其全部溶解,加入2m L甲酸,加水定容至1000m L,室温下可保存48h㊂14.2.7流动相B[乙腈-甲酸铵溶液(2mm o l/L)(95+5)]:准确称取126m g甲酸铵,用30m L水溶解,加入2m L甲酸,加水稀释至50m L,再加入950m L乙腈,室温下可保存48h㊂14.3标准品14.3.1大田软海绵酸(O A,C44H68O13,C A S号78111-17-8)标准溶液:14.24μg/m L,或经国家认证并授予标准物质证书的一定浓度的O A标准溶液㊂14.3.2鳍藻毒素-1(D T X-1,C45H70O13,C A S号81720-10-7)标准溶液:15.15μg/m L,或经国家认证并授予标准物质证书的一定浓度的D T X-1标准溶液㊂14.3.3鳍藻毒素-2(D T X-2,C44H68O13,C A S号139933-46-3)标准溶液:7.80μg/m L,或经国家认证并授予标准物质证书的一定浓度的D T X-2标准溶液㊂14.4标准溶液配制14.4.1腹泻性贝类毒素混合标准中间液:分别吸取适量的各腹泻性贝类毒素标准溶液于5m L棕色容量瓶中,用甲醇稀释并定容,使各腹泻性贝类毒素浓度分别为:O A1.0μg/m L,D T X-11.0μg/m L,D T X-21.0μg/m L㊂-18ħ以下避光保存,保存期1个月㊂14.4.2腹泻性贝类毒素基质标准系列工作液:取5份空白试样,分别加入适量上述各浓度腹泻性贝类毒素混合标准中间液,按与试样相同的分析步骤处理,制成O A㊁D T X-1㊁D T X-2的质量浓度为0.8n g/ m L㊁1.6n g/m L㊁4.0n g/m L㊁8.0n g/m L和16.0n g/m L的基质标准系列工作液,过0.22μm的有机相微孔滤膜后备用㊂14.5材料14.5.1固相萃取柱:硅胶表面修饰苯乙烯二乙烯基苯聚合物型固相萃取柱,60m g/3m L,或性能相当者㊂使用前依次用1m L甲醇㊁1m L甲醇溶液(30%)活化㊂14.5.2微孔滤膜:0.22μm,有机相㊂15仪器和设备15.1液相色谱-串联质谱仪:配电喷雾离子源㊂15.2天平:感量为0.01g㊂15.3组织均质器:转速ȡ10000r/m i n㊂15.4涡旋振荡器㊂15.5离心机:转速ȡ8000r/m i n㊂15.6超声波清洗器㊂15.7恒温干燥箱㊂15.8固相萃取装置㊂15.9真空泵㊂15.10氮吹仪㊂15.11p H计㊂16分析步骤16.1样品采集同5.1㊂16.2试样制备同5.2㊂16.3试样提取16.3.1腹泻性贝类毒素提取将剪碎的试样均质,准确称取2g(精确至0.01g)于50m L具塞离心管中,加入9m L甲醇,涡旋混合1m i n,超声提取10m i n,8000r/m i n下离心5m i n,移出上清液于20m L刻度玻璃管中㊂残渣中加入9m L甲醇,重复提取一次,合并提取液,用甲醇定容至20m L㊂16.3.2酯化态腹泻性贝类毒素水解释放准确吸取提取液1m L置于螺纹口样品瓶中,加入氢氧化钠溶液(2.5m o l/L)125μL,混匀后用密封膜将瓶密封,于76ħ下温育40m i n,冷至室温后,加入盐酸溶液(2.5m o l/L)125μL并混匀,所得水解液(1.25m L相当于0.1g试样)可直接过0.22μm有机相微孔滤膜后,供液相色谱-串联质谱测定,或者必要时进行净化处理㊂16.4试样净化所得水解液用3m L水稀释,涡旋混匀后,移入已预活化的聚合物型固相萃取柱,待液体以1m L/ m i n的流速流出后,再用1m L甲醇溶液(20%)淋洗,弃去流出液,保持抽气2m i n,最后用1m L氨水-甲醇溶液(0.3%)洗脱,保持抽气2m i n,收集洗脱液,用甲醇定容至1m L(相当于0.1g试样),过0.22μm的有机相微孔滤膜后,供液相色谱-串联质谱测定㊂16.5空白试验除不加试样外,采用与试样相同的操作步骤,得到空白溶液㊂16.6仪器参考条件16.6.1液相色谱参考条件:a)色谱柱:C18柱,柱长100mm,内径2.1mm,粒径3.5μm,或性能相当者;b)流速:0.2m L/m i n;c)柱温:35ħ;d)进样量:10μL;e)流动相:流动相A为甲酸铵溶液(2mm o l/L),B为乙腈+甲酸铵溶液(2mm o l/L)(95+5),梯度洗脱,梯度洗脱条件见表2㊂表2流动相梯度洗脱条件时间/m i n A/%B/%0.070301.070303.010906.010906.170308.0703016.6.2质谱参考条件a)离子源:电喷雾离子源;b)扫描模式:负离子扫描;c)检测方式:多反应监测模式,O A㊁D T X-1㊁D T X-2母离子㊁子离子及去簇电压和碰撞能见表3;d)电喷雾电压(I S):-4000V;e)雾化气压力(G S1):414k P a;f)气帘气压力(C U R):104k P a;g)碰撞气压力(C A D):83k P a;h)辅助气流速(G S2):70L/m i n;i)离子源温度(T E M):550ħ㊂表3腹泻性贝类毒素多反应监测模式下母离子㊁子离子㊁去簇电压和碰撞能量目标化合物母离子m/z子离子m/z去簇电压V碰撞能量e V大田软海绵酸(O A)803255.3*-130-65 113.1-130-90鳍藻毒素-1(D T X-1)817255.2*-90-48 150.8-90-48鳍藻毒素-2(D T X-2)803255.0*113.0-130-130-65-90*代表定量离子㊂16.7基质校正标准曲线的制作将基质标准系列工作液分别注入液相色谱-串联质谱仪中,测定相应的峰面积,以标准工作液的质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线㊂腹泻性贝类毒素标准溶液的多反应监测色谱图参见图C.1㊂16.8试样溶液的测定将试样溶液注入液相色谱-串联质谱仪中,得到峰面积,根据基质标准曲线得到试样溶液中腹泻性贝类毒素的质量浓度㊂在同样测试条件下,试样溶液中腹泻性贝类毒素的保留时间与基质标准工作液中腹泻性贝类毒素的保留时间之间的偏差在ʃ2.5%以内,且试样溶液中腹泻性贝类毒素的定性离子的相对丰度应与质量浓度相近的基质标准工作液中腹泻性贝类毒素的定性离子的相对丰度一致,其丰度比偏差应符合表4要求,则可判定试样溶液中存在被测化合物㊂表4定性离子相对丰度的最大允许偏差定性离子相对丰度>50%>20%~50%>10%~20%ɤ10%允许的相对偏差ʃ20%ʃ25%ʃ30%ʃ50%17分析结果的表述17.1试样中腹泻性贝类毒素的含量按式(3)计算:X i=ρiˑVˑ1000mˑ1000(3)式中:X i 试样中腹泻性贝类毒素的含量,单位为微克每千克(μg/k g);ρi 由基质标准曲线得到的试样溶液中腹泻性贝类毒素的质量浓度,单位为纳克每毫升(n g/m L);V 试样溶液的体积,单位为毫升(m L);1000 换算因子;m 与1m L试样提取液相当的试样质量,单位为克(g)㊂计算结果应扣除空白值㊂计算结果保留三位有效数字㊂17.2总毒力计算试样中腹泻性贝类毒素总毒力按式(4)计算:O A e q=ðn i=1X i㊃r i (4)式中:O A e q 腹泻性贝类毒素总毒力,单位为微克每千克(μg/k g);X i 各种腹泻性贝类毒素的含量,单位为微克每千克(μg/k g);r i 毒性因子㊂注:试样中各种腹泻性贝类毒素的含量需按照附录B中的毒性因子(T E F s),统一转换为总毒力(O A e q)㊂18精密度在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%㊂19其他本方法中O A㊁D T X-1和D T X-2的检出限均为10.0μg/k g,O A㊁D T X-1和D T X-2的定量限均为30.0μg/k g㊂。
