SDS-聚丙烯酰胺凝胶电泳测定蛋白质分子量
SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的相对分子质量解析

【实验步骤及操作方法】
1.安装垂直板电泳槽 将密封胶条放在平直玻璃板上,将凹形
玻璃板与 平直玻璃板重叠。 用手将两块玻璃板夹住,放入电泳槽内。 用蒸馏水检漏
2.电泳缓冲液(Tris-甘氨酸缓冲液,pH=8.3):取 Tris6.0g,甘氨酸28.8g,SDS1.0g,用去离子水 溶解后定容至1L。
3.样品溶解液(用于溶解标准蛋白质及样品蛋白 质):取SDS0.1g,巯基乙醇0.1mL,甘油 1.0mL,溴酚蓝28.8g,0.2mol/L磷酸缓冲液 0.5mL,加重蒸馏水至10mL。
【试剂配制】
4. 染 色 液 : 0.25g 考 马 斯 亮 蓝 R-250 , 加 入 454mL50%甲醇溶液和46mL冰乙酸。
5.脱色液:75mL冰乙酸,875mL水与50mL甲醇 6.10% 过 硫 酸 钠 、 10%SDS 、 1% 四 甲 基 乙 二 胺
(TEMED)
【实验材料及预处理】
蛋白质相对分子质量的测定 SDS-聚丙烯酰胺凝胶电泳法
【实验目的】
• 理解电泳法测定蛋白质分子量的原理。 • 掌握SDS-聚丙烯酰胺凝胶电泳法的基本操
作 • 学会绘制标准曲线。
【实验原理】
聚丙烯酰胺凝胶由丙烯酰胺(Acr)和N,N-甲叉双 丙烯酰胺(Bis)聚合而成,是一种具有交叉网状结构的 凝胶,可以产生分子筛效应,其孔径大小可以通过配置 药品的浓度来控制,常用作电泳的载体。
因此,我们可以测定标准蛋白质的迁移率,通过标 准蛋白质相对迁移率的对数对相对分子量作图,得到标 准曲线,根据标准曲线计算出未知蛋白质的相对分子质 量。
SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量

(4)聚丙烯胺凝胶的生成:
四、实验步骤:
1、贮液的配制:
2、凝胶的制备: 2.1 胶板的制备: 2.2 分离胶的制备: 2.3 浓缩胶的制备:
3、蛋白样品的制备:
4、装槽、点样: 5、电泳: 6、剥胶、染色、脱色:
2.1 胶板的制备:
3、植物组织蛋白质提取:
称取大豆叶片1g放在研钵中用液氮研磨,加
第二、不连续系统中的三种物理效应:
①电荷效应:
②分子筛效应: ③浓缩效应:
三、实验材料、仪器和试剂:
1、实验材料:黄瓜叶片(芽黄叶和正常叶)
2、仪器、器皿:
(1)垂直板电泳装置
(电泳槽,玻璃板,胶条,电泳梳子,制胶架等); (2)稳流稳压电泳仪; (4)电子天平; (6)瓷盘、微量进样器; (3)高速冷冻离心机; (5)电冰箱;
②光聚合:
催化剂是核黄素(VB2 ),在痕量氧存在下,核黄素光
解形成无色基,无色基再被氧氧化成自由基,激活单体发 生聚合。光聚合形成的凝胶孔径较大,且不稳定,适于制 备大孔径的浓缩胶。
5)聚丙烯酰胺凝胶结构上的特点:
① 聚丙烯酰胺的基本结构为丙烯酰胺单体构成的长 链,链与链之间通过甲叉桥联结在一起;
⑧支持物筛孔大小:
孔径小,电泳速度慢,反之则快。
2、SDS-聚丙烯酰胺凝胶电泳(SDSPAGE)
SDS-聚丙烯酰胺凝胶电泳测定蛋白质分子量

精选2021版课件
31
5.“SDS — 聚丙稀酰胺凝胶电 泳法测定蛋白质分子量”一实验的开 设达到了与国内同类院校相当的较高 水平。
对本科生的实验教学、本科生的 论文设计、研究生的高级生化实验等 方面都充实了内容。
精选2021版课件
32
精选2021版课件
8
(二)特点:
SDS-聚丙烯酰胺凝胶电泳,是在 聚丙烯酰胺凝胶系统中引进SDS(十二 烷基磺酸钠)。
精选2021版课件
9
蛋白质在一定浓度的含有强还原剂 的SDS溶液中,与SDS分子按比例结合, 形成带负电荷的SDS-蛋白质复合物。
蛋白质丧失了原有的电荷状态形成 仅保持原有分子大小为特征的负离子团 块,降低或消除了各种蛋白质分子之间 天然的电荷差异,因此在进行电泳时,
电泳分类:移动界面电泳、区带电泳等。
区带电泳 是在半固相或胶状介质上加一个点或一薄 层样品溶液,然后加电场,分子在支持介质上或支 持介质中迁移。
精选2021版课件
5
区带电泳使用不同的支持介质,有
滤纸、纤维素粉、聚氯乙烯树脂、淀 粉凝胶、琼脂凝胶、醋酸纤维素膜, 现在则多用聚丙烯酰胺(PAGE)和 琼脂糖凝胶。
球蛋白(去年完成的基金项目)
(三)纯化免疫球蛋白G DEAE-离子交换纤维素法纯化免疫球蛋白G子量( 连续四个单项实验)。
精选2021版课件
18
(1)制胶(简单叙述)(双层胶,摸索胶浓度)
A.将玻璃板用蒸馏水洗净晾干, 准备2个干 净的锥形瓶。把玻璃板在灌胶支架上固定好。
开封后溶于200µl蒸馏水,置-20℃保存,使用前室温融化,沸水浴中加热3-5分钟后上样。
。 样品1:称3mg样品1,加2 ml蒸馏水溶解
SDS-聚丙烯酰胺凝胶电泳PAGE测定蛋白质分子量

02 实验材料
所需的试剂和溶液
丙烯酰胺(AA):用于制备凝胶,是聚合反应 的单体。
甲叉双丙烯酰胺(MBA):交联剂,增加凝胶 的交联度。
N,N,N',N'-四甲基乙二胺(TEMED):催化剂, 加速交联聚合反应。
所需的试剂和溶液
过硫酸铵(APS)
引发剂,产生自由基,引发聚合反应。
SDS
十二烷基硫酸钠,用于变性蛋白质并促使其 带负电荷。
发展新型分离技术
随着生物技术的不断发展,可以发展新型的蛋白质分离技术, 如二维电泳、毛细管电泳等,以提高蛋白质分离的分辨率和准
确性。
应用多维度分析
在后续实验中,可以将SDS-PAGE与其他蛋白质分析技术相结 合,如质谱技术、免疫学检测等,进行多维度分析,更全面地
了解蛋白质的性质和功能。
THANKS FOR WATCHING
白质带负电荷,从而在电场中向正极移动。
聚丙烯酰胺凝胶作为支持介质,能够根据蛋白质分子量的不同
03
对其进行分离。
蛋白质的分子量测定
通过比较标准蛋白的迁移率和已知分 子量的标准蛋白,可以大致测定出待 测蛋白质的分子量。
蛋白质的迁移率与其分子量的对数成 反比,因此可以通过计算待测蛋白与 标准蛋白的相对迁移率来推算其分子 量。
甘氨酸
作为分子量标准品。
Tris-HCl缓冲液
维持电泳过程中的pH值稳定。
所需的仪器和设备
电源
为电泳提供电力。
凝胶板
放置凝胶的框架。
垂直电泳槽
提供电泳所需的基 本结构。
移液器
精确添加试剂和溶 液。
紫外透射仪
检测蛋白质条带。
实验前的准备事项
清洗电泳槽和相关器具,确保无残留物。 准备好所需的试剂和溶液,并确保其在有效期内。
SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量

SDS的性质与作用
十二烷基磺酸钠(SDS) Sodium dodecyl sulphate CH3-(CH2)10-CH2OSO3--Na+
SDS的性质与作用
Protein Strand
Denature
-
SDS Molecules
-
SDS的性质与作用
蛋白质变性
0.1-1% SDS 0.1 M 2-巯基乙醇 蛋白质变与SDS分子按比例结合 1 :1.4
插入样品梳加入电极缓冲加入电极缓冲液液ph83ph83浓缩胶浓缩胶ph86ph86通电通电分离胶分离胶ph88ph88加入样品加入样品上样及电泳开始电流恒定在开始电流恒定在10ma10ma当进入分离胶后改为当进入分离胶后改为20ma20ma溴酚蓝距凝胶边缘约溴酚蓝距凝胶边缘约5mm5mm时停止电泳
SDS-聚丙烯酰胺
制备浓缩胶
加入浓缩胶溶 液 pH 8.6
分离胶 pH 8.8
通电
加入电极缓冲 液pH 8.3
上样及电泳
加入样品
浓缩胶 pH 8.6
开始电流恒定在10mA,当进入分离胶后改为20mA, 溴酚蓝距凝胶边缘约5mm时,停止电泳。
分离胶
pH 8.8
凝胶板剥离与染色
电泳结束后,撬开玻璃板,将凝胶板
凝胶电泳
生化社团 吕炎
SDS-聚丙烯酰胺凝胶电泳
测定蛋白质分子量
一、实验目的 二、实验原理 三、实验步骤 四、结果分析 五、注意事项
一、实验目的
学习SDS-聚丙烯酰胺凝胶电泳测 定蛋白质分子量的原理。 掌握SDS-聚丙烯酰胺凝胶电泳的 操作技术。
二、实验原理
SDS的性质与作用 聚丙烯酰胺凝胶的性质
sds聚丙烯酰胺凝胶电泳测定蛋白质相对分子量的原理;

sds聚丙烯酰胺凝胶电泳测定蛋白质相对分子量的原理;
SDS聚丙烯酰胺凝胶电泳是一种蛋白质分析方法,常用于测定蛋白质的相对分子量。
其原理是利用SDS(十二烷基硫酸钠)使蛋白质带负电,使蛋白质在凝胶中按照相对分子量大小进行分离。
具体原理如下:
1. SDS:SDS是一种表面活性剂,它可以与蛋白质发生结合,使得所有蛋白质带有相同的电荷密度。
2. 蛋白质解不性:在SDS存在条件下,蛋白质发生解性,其中SDS会形成不溶解的复合物,使蛋白质具有均一负电荷。
3. 凝胶电泳:将SDS处理后的蛋白质样品加于聚丙烯酰胺凝胶电泳胶板上,施加电场使蛋白质迁移。
4. 分离:由于凝胶电泳胶阻力不同,蛋白质经过一段时间后在凝胶上分离成锥形区带。
5. 相对分子量测定:在同一凝胶中,已知相对分子量已知的标准蛋白质样品与待测蛋白质样品进行分析,通过对比标准蛋白质样品的迁移距离和待测蛋白质样品的迁移距离,可以推算出待测蛋白质样品的相对分子量。
需要注意的是,由于SDS聚丙烯酰胺凝胶电泳是以相对分子量进行分析的,所以对于蛋白质的准确分子量测定,还需结合其他方法如质谱等进行综合分析。
SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量

四. 实验过程
8.电泳槽中加入缓冲液,接通电源,进行电泳,开始电流恒
定在10mA,当进入分离胶后改为20mA,溴酚蓝距凝胶边 缘约5mm时,停止电泳。
9.凝胶板剥离与染色:电泳结束后,撬开玻璃板,将凝胶板
做好标记后放在大培养皿内,加入染色液,染色1小时左右。 10.脱色:染色后的凝胶板用蒸馏水漂洗数次,再用脱色液脱 色,直到蛋白质区带清晰。 ※剥胶时要小心,保持胶完好无损,染色要充分.
•
二. 实验原理
• PAGE根据其有无浓缩效应,分为连续系统
和不连续系统两大类,连续系统电泳体系 中缓冲液pH 值及凝胶浓度相同,带电颗粒 在电场作用下,主要靠电荷和分子筛效应。 不连续系统中由于缓冲液离子成分,pH , 凝胶浓度及电位梯度的不连续性,带电颗 粒在电场中泳动不仅有电荷效应,分子筛 效应,还具有浓缩效应,因而其分离条带 清晰度及分辨率均较前者佳。
三.
实验试剂和器材
低分子量标准蛋白: 兔磷酸化酶B MW=97,400 牛血清白蛋白 MW=66,200 兔肌动蛋白 MW=43,000 牛碳酸酐酶 MW=31,000 胰蛋白酶抑制剂 MW=20,100 鸡蛋清溶菌酶 MW=14,400 开封后溶于200µl蒸馏水,置-20℃保存,使用前室温融 化,沸水浴中加热3-5分钟后上样。 样品1:称3mg样品1,加2 ml蒸馏水溶解。
1.材料: 低分子量标准蛋白试剂盒:
2.实验试剂
(1) 30%丙烯酰胺(Acr):称Acr30g,甲叉双丙烯酰胺 (Bis)0.8g,加蒸馏水至100ml,过滤后置棕色瓶中, 4℃贮存可用1-2月。 (2)10%SDS(十二烷基磺酸钠) (3)1.5mol/L pH8.8 Tris-HCl缓冲液:称取Tris18.2g, 加入50ml水,用1mol/L盐酸调pH8.8, 最后用蒸馏 水定容至100ml。 (4)1.0mol/LpH6.8Tris-HCl缓冲液:称取Tris12.1g,加 入50ml水,用1mol/L盐酸调pH6.8, 最后用蒸馏水 定容至100ml。 (5)0.05mol/LpH8.0Tris-HCl缓冲液:称取Tris0.6g,加 入50ml水,用1mol/L盐酸调pH8.0,最后用蒸馏水定 容至100ml。
聚丙烯酰胺凝胶电泳法

SDS聚丙烯酰胺凝胶电泳法—蛋白质的分子量测定【实验目的】1.掌握SDS—聚丙烯酰胺电泳法的原理。
2.学会用此种方法测定蛋白质的分子量。
【实验原理】SDS—聚丙烯酰胺凝胶电泳(SDS-PAGE)是对蛋白质进行量化,比较及特性鉴定的一种经济、快速、而且可重复的方法。
该法主要依据蛋白质的分子量对其进行分离。
SDS与蛋白质的疏水部分相结合,破坏其折叠结构,并使其稳定地存在于一个广泛均一的溶液中。
SDS—蛋白质复合物的长度与其分子量成正比。
由于在样品介质和聚丙烯酰胺凝胶中加入离子去污剂和强还原剂后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小,而电荷因素可以被忽略。
SDS—PAGE因易于操作和广泛的用途,使它成为许多研究领域中一种重要的分析技术。
SDS是十二烷基硫酸钠(sodium dodecyl sulfate)的简称,它是一种阴离子表面活性剂,加入到电泳系统中能使蛋白质的氢键和疏水键打开,并结合到蛋白质分子上(在一定条件下,大多数蛋白质与SDS的结合比为1.4gSDS/1g蛋白质),使各种蛋白质—SDS复合物都带上相同密度的负电荷,其数量远远超过了蛋白质分子原有的电荷量,从而掩盖了不同种类蛋白质间原有的电荷差别。
这样就使电泳迁移率只取决于分子大小这一因素,于是根据标准蛋白质分子量的对数和迁移率所作的标准曲线,可求得未知物的分子量。
【实验材料】1.实验器材微型凝胶电泳装置;电源(电压200V,电流500mA);100℃沸水浴;Eppendorf管;微量注射器(50μl或100μl);干胶器、真空泵或水泵;带盖的玻璃或塑料小容器;摇床。
2.实验试剂⑴ 2mol/L Tris-HCl (pH8.8):取24.2g Tris, 加50ml蒸馏水,缓慢的加浓盐酸至pH8.8(约加4ml);让溶液冷却至室温,pH将会升高,加蒸馏水至100ml。
⑵ 1mol/L Tris-HCl (pH8.8):取12.1g Tris, 加50ml蒸馏水,缓慢的加浓盐酸至pH6.8(约加8ml);让溶液冷却至室温,pH将会升高,加蒸馏水至100ml。
SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量

实验七SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量实验数据:标准蛋白质条带第一条第二条第三条第四条第五条溴酚蓝前沿距离/cm 4.70距离/cm 0.50 0.95 1.60 2.10 3.95 相对迁移率mr 0.11 0.20 0.34 0.45 0.84 分子量Mr 97400 66200 43000 31000 14400LgMr 4.99 4.82 4.63 4.49 4.16样品 1 2 3溴酚蓝前沿/cm 4.90 4.80 4.60样品迁移距离/cm 4.20 1.20 1.70相对迁移率mr 0.86 0.25 0.37标准曲线:y=5.05-1.10x结果:样品 1 2 3Mr 12706 59566 43954mr 4.104 4.775 4.643一. 实验目的和要求1 学习SDS-PAGE测定蛋白质分子量的原理。
2 掌握垂直板电泳的操作方法。
3 运用SDS-PAGE测定蛋白质分子量及染色鉴定。
二 .实验原理带电质点在电场中向带有异相电荷的电极移动,这种现象称为电泳。
区带电泳是在半固相或胶状介质上加一个点或一薄层样品溶液,然后加电场,分子在支持介质上或支持介质中迁移。
支持介质的作用主要是为了防止机械干扰和由于温度变化以及大分子溶液的高密度而产生的对流。
区带电泳使用不同的支持介质,早期有滤纸、玻璃珠、淀粉粒、纤维素粉、海砂、海绵、聚氯乙烯树脂;以后有淀粉凝胶、琼脂凝胶、醋酸纤维素膜,现在则多用聚丙烯酰胺(PAGE)和琼脂糖凝胶。
PAGE根据其有无浓缩效应,分为连续系统和不连续系统两大类,连续系统电泳体系中缓冲液pH值及凝胶浓度相同,带电颗粒在电场作用下,主要靠电荷和分子筛效应。
不连续系统中由于缓冲液离子成分,pH,凝胶浓度及电位梯度的不连续性,带电颗粒在电场中泳动不仅有电荷效应,分子筛效应,还具有浓缩效应,因而其分离条带清晰度及分辨率均较前者佳。
SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基磺酸钠), SDS能断裂分子内和分子间氢键,破坏蛋白质的二级和三级结构,强还原剂能使半胱氨酸之间的二硫键断裂,蛋白质在一定浓度的含有强还原剂的SDS溶液中,与SDS分子按比例结合,形成带负电荷的SDS-蛋白质复合物,这种复合物由于结合大量的SDS,使蛋白质丧失了原有的电荷状态形成仅保持原有分子大小为特征的负离子团块,从而降低或消除了各种蛋白质分子之间天然的电荷差异,由于SDS与蛋白质的结合是按重量成比例的,因此在进行电泳时,蛋白质分子的迁移速度取决于分子大小。
实验8 SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的分子量

实验8 SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的相对分子量Mr原理蛋白质在聚丙烯酰胺凝胶电泳中, 蛋白质的迁移率取决于它所带净电荷及分子的大小和形状。
在聚丙烯酰胺凝胶系统中加入阴离子去污剂十二烷基磺酸钠(sodium dodecyl sulfate,简称SDS)和还原剂(如巯基乙醇)处理蛋白质样品, 则蛋白质分子中的二硫键被还原, 1g蛋白质可定量结合1.4g SDS。
由于SDS呈解离状态, 使蛋白质亚基带上大量的负电荷, 其数值大大超过蛋白质分子原有的电荷量, 因而掩盖了不同种类蛋白质间原有的电荷差别。
各种蛋白质-SDS复合物表现出相等的电荷密度, 在聚丙烯酰胺凝胶上电泳时, 它们纯粹按照分子的大小由凝胶的分子筛效应来进行分离, 有效迁移率与相对分子量的对数成很好的线性关系。
用这种方法测定蛋白质的Mr, 简便、快速, 只需要廉价的设备和μg量的蛋白质样品。
所得的结果, 在Mr为15000~200000的范围内, 与用其他方法测得的Mr相比, 误差一般在±10%以内。
因此SDS测定Mr的方法, 已得到非常广泛的应用和迅速的发展。
现在经SDS-聚丙烯酰胺凝胶研究过的蛋白质已经有很多种了。
实验证明, 在蛋白质溶液中加入SDS和巯基乙醇后, 巯基乙醇可使蛋白质分子中的二硫键;SDS能使蛋白质的氢键、疏水键打开, 并结合到蛋白质分子上形成蛋白质-SDS复合物。
在一定的条件下, SDS与大多数蛋白质的结合比为1.4gSDS/1g蛋白质。
由于十二烷基硫酸根带负电, 使各种蛋白质的SDS复合物都带上相同密度的负电荷, 它的量大大超过了蛋白质分子原有的电荷量, 因而掩盖了不同种类的蛋白质间原有的电荷差别。
1.在用SDS-凝胶电泳法测定蛋白质的Mr时, 应注意以下几个问题:如果蛋白质-SDS复合物不能达到1.4gSDS/1g蛋白质的比率并具有相同的构象, 就不能得到准确的结果。
影响蛋白质和SDS结合的因素主要有以下3个: ⑴二硫键是否完全被还原: 只有在蛋白质分子内的二硫键被彻底还原的情况下, SDS才能定量地结合到蛋白质分子上去, 并使之具有相同的构象。
(生物化学)SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量

ml
4.0 2.5 0.1 0.1 3.3 0.006
灌注分离胶(水封,室温30分钟左右凝固) *丙烯酰胺和亚甲双丙烯酰胺具有神经毒性神经毒性 ——手套
3. 浓缩胶的制备和灌注
5%浓缩胶(10ml)-3ml/组
试剂
ml
Acr/Bis 30%
1.7
0.5mol/L Tris-HCl Ph 6.8
2.5
在平整的桌面上放下玻璃与夹子,使玻璃和 夹子的底面完全对齐,向外扳动塑料卡口,关紧
夹子。
玻璃夹放在制胶架上,薄玻璃朝向自己。按弹 簧夹,将玻璃夹卡入制胶架。在玻璃的间隙内分别
灌制分离胶和浓缩胶,放上梳子,待胶凝固。2. 分离胶的制备和灌注
12%分离胶的制备(10ml)-5ml/组
试剂
Acr/Bis 30% 1.5mol/L Tris-HCl pH 8.8 10% SDS 10% AP H2O TEMED
• 电泳:80V,15-20min(浓缩胶);100V(分 离胶)至指示剂距凝胶底边1cm。
6. 染色、脱色
染色:凝胶于0.25% 考马斯亮蓝染 色20min。
脱色:于脱色液 (7.5%冰乙酸, 5%甲醇)中脱 色至蛋白带清 晰。
蒸馏水煮沸5-10’
7. 照相、分析结果
➢凝胶成像系统照相 ➢绘制标准曲线 ➢计算样品蛋白的分子量
兔磷酸化酶B(97400) 牛血清白蛋白(66200)
兔肌动蛋白(43000) 牛碳酸酐酶(31000)
胰蛋白酶抑制剂(20100) 鸡蛋清溶菌酶(14400)
8. 思考题
➢ 浓缩胶与分离胶的作用机制各是什么? ➢ 分离胶灌注完毕,以蒸馏水封闭的作用是
什么? ➢ 根据实验结果,分析实验误差的可能原因。 ➢ 如何配置1L 0.5mol/L Tris-HCl pH 6.8 缓
生化实验七 SDS一聚丙烯酰胺凝胶电泳法测定蛋白质的分子量

实验七 SDS —聚丙烯酰胺凝胶电泳法测定蛋白质的分子量一、 实验原理了解SDS-聚丙烯酰胺凝胶电泳的原理,学会用这种方法测定蛋白质的相对分子量 二、实验原理带电的颗粒(蛋白质)在电场的作用下,移动的速度是根据此公式,在同一电场强度(v /d)和电极缓冲液(η)条件下,带电的各种蛋白质成分,移动的速度决定于各蛋白质的带电量(q)和自身分子的大小(6πr)。
若使各蛋白质成分的带电量(q)相近似时,则各蛋白质成分移动的速度就只决定于各蛋白质成分自身分子的大小(6πr)。
1967年Shapiro 等人发现,在聚丙烯酰胺凝胶中加入阴离子去污剂十二烷基硫酸钠(sodium dodecylsulfate ,SDS),不影响凝胶的形成,而蛋白质的电泳迁移率则主要取决于它的自身分子量的大小。
加入SDS 之所以能获得如此的效应,是因为SDS 能打开蛋白质分子间的氢键和疏水键,使蛋白质变性成为松散的线状。
同时大多数蛋白质的每个氨基酸都能与固定量的SDS 相结合[溶液中的SDS 总量,至少要比蛋白质的量高3倍以上,大多数蛋白质与SDS 按1:1.4(W /W)的比例结合],形成SDS 一蛋白质复合物。
其结果: (1)由于SDS 解离后带有很强的负电荷,致使SDS 一蛋白质复合物都带上了相同密度的负电荷,其电量大大超过了蛋白质分子原有的电荷量,基本掩盖了不同种类蛋白质间原有的电荷差异。
(2)SDS 与蛋白质结合后,改变了蛋白质原有构象,使所有蛋白质水溶液中的形状都近似椭圆柱形。
不同SDS 一蛋白质复合物的短轴直径都一样,约为18nm ,而长轴则与蛋白质分子的大小成正比。
这样SDS 一蛋白质复合物在凝胶电泳中的迁移率,就不再受蛋白质原有电荷及其形状的影响了,而只取决于椭圆柱长度,即蛋白质分子的大小。
需要注意的是:为使SDS 与蛋白质能充分的按比例结合,必须将蛋白质间的二硫键完全打开。
因此,在用SDS 处理蛋白质样品时,必须同时用巯基乙醇处理。
06 生物化学实验--SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量

SDS- 聚丙烯酰胺凝胶电泳法测定蛋白质分子量【目的】1 . 掌握 SDS-PAGE 测定蛋白质分子量的操作方法。
2 . 熟悉 SDS-PAGE 测定蛋白质分子量的原理。
【原理】带电粒子在电场中向着与其自身电荷方向相反的电极移动, 称为电泳。
不同蛋白质分子具有不同的大小、形状, 在一定的 pH 环境中带有不同的电荷量, 因而在一定的电场中所受的电场引力及介质对其的阻力不同, 二者的作用结果使不同蛋白质分子在介质中以不同的速率移动, 经过一定的时间后得以分离, 这就是电泳分离蛋白质及核酸生物大分子的基本原理。
聚丙烯酰胺凝胶电泳就是以聚丙烯酰胺凝胶作为电泳介质的电泳。
在电泳时, 蛋白质在介质中的移动速率与其分子的大小, 形状和所带的电荷量有关, 为了使其只与蛋白质分子的大小有关, 从而利用蛋白质在介质中的迁移率来测定蛋白质的分子量, 就需要消除蛋白质分子的形状和所带电荷量的不同对迁移率的影响或减小到可忽略不计的程度。
SDS 是十二烷基硫酸钠( sAium dAecyl sulfate )的简称, 它是一种阴离子表面活性剂, 加入到电泳系统中能使蛋白质的氢键和疏水键打开, 并结合到蛋白质分子上(在一定条件下, 大多数蛋白质与 SDS 的结合比为 1.4 g SDS/ 1 g 蛋白质), 使各种蛋白质 -SDS 复合物都带上相同密度的负电荷, 其数量远远超过了蛋白质分子原有的电荷量, 从而掩盖了不同种类蛋白质间原有的电荷差别, 使电泳迁移率只取决于分子大小这一因素, 于是根据标准蛋白质分子量的对数和迁移率所作的标准曲线, 可求得未知物的分子量。
SDS 与蛋白质结合后引起蛋白质构象的改变。
SDS- 蛋白质复合物的流体力学和光学性质表明, 它们在水溶液中的形状, 近似于雪茄烟形状的长椭园棒, 不同蛋白质的 SDS 复合物的短轴长度都一样(约为 18? , 即 1.8 nm ), 而长轴则随蛋白质分子量成正比的变化。
SDS聚丙烯酰胺凝胶电泳测定蛋白质分子量

03 结果分析
CHAPTER
蛋白质分子量的计算
蛋白质分子量计算
根据已知标准蛋白的迁移率和分子量 ,通过线性回归分析,计算未知蛋白 的分子量。
校准曲线的建立
使用已知分子量的标准蛋白,在相同 条件下进行电泳,绘制迁移率与分是指凝胶能够区分相邻蛋白条带的能力,高分辨率的凝胶能够清晰区分 相近分子量的蛋白质。
电泳的原理
电场作用
01
在电场的作用下,带负电荷的SDS-蛋白质复合物向正极移动。
分离效果
02
不同分子量的蛋白质在电场中移动速度不同,从而实现分离。
检测方法
03
电泳结束后,可以通过染色、银染或荧光染色等方法检测分离
的蛋白质条带,并可根据染色深浅判断蛋白质含量。
02
SDS聚丙烯酰胺凝胶电泳测定蛋白质分子量 的实验步骤
电泳
01
02
03
安装电极
将凝胶放置在电泳槽中, 确保电极与凝胶接触良好。
加样
将准备好的样品加入到凝 胶的样品孔中。
开始电泳
接通电源,开始电泳。确 保电流稳定,避免电流过 大或过小对实验结果的影 响。
染色和脱色
染色
在电泳结束后,将凝胶取出,放 入染色液中染色,使蛋白质条带 呈现可见的着色。
脱色
将染色后的凝胶放入脱色液中脱 色,去除背景颜色,使蛋白质条 带更加清晰可见。
分离度
分离度是指凝胶中各蛋白条带之间的分离程度,好的分离度能够使各蛋白条带 完全分开,便于准确分析。
实验误差和注意事项
实验误差来源
实验误差可能来源于电泳过程中电压、电流的波动、染色过程中染料的浓度和染 色时间等因素。
注意事项
为确保实验结果的准确性,应使用高质量的电泳试剂和设备,严格控制实验条件 ,并遵循标准化操作程序。同时,应定期对标准蛋白进行检测,以确保标准曲线 的准确性。
SDS-聚丙烯酰胺凝胶电泳测定蛋白质分子量
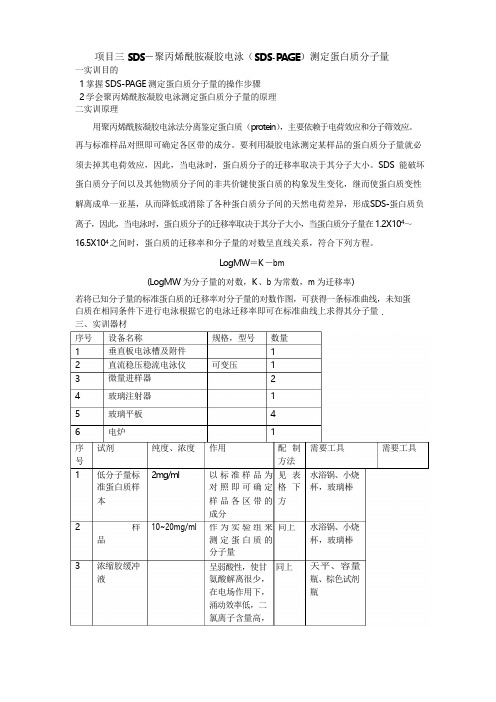
. 样作为实验组来 同上项目三 SDS -聚丙烯酰胺凝胶电泳(SDS-PAGE )测定蛋白质分子量一实训目的1 掌握 SDS-PAGE 测定蛋白质分子量的操作步骤2 学会聚丙烯酰胺凝胶电泳测定蛋白质分子量的原理 二实训原理用聚丙烯酰胺凝胶电泳法分离鉴定蛋白质(protein ),主要依赖于电荷效应和分子筛效应。
再与标准样品对照即可确定各区带的成分。
要利用凝胶电泳测定某样品的蛋白质分子量就必须去掉其电荷效应,因此,当电泳时,蛋白质分子的迁移率取决于其分子大小。
SDS 能破坏蛋白质分子间以及其他物质分子间的非共价键使蛋白质的构象发生变化,继而使蛋白质变性解离成单一亚基,从而降低或消除了各种蛋白质分子间的天然电荷差异,形成 S DS-蛋白质负离子,因此,当电泳时,蛋白质分子的迁移率取决于其分子大小,当蛋白质分子量在 1.2X104~16.5X104 之间时,蛋白质的迁移率和分子量的对数呈直线关系,符合下列方程。
LogMW =K -bm(LogMW 为分子量的对数,K 、b 为常数,m 为迁移率)若将已知分子量的标准蛋白质的迁移率对分子量的对数作图,可获得一条标准曲线,未知蛋 白质在相同条件下进行电泳根据它的电泳迁移率即可在标准曲线上求得其分子量 三、实训器材序号 1 2 3 4 56 设备名称垂直板电泳槽及附件 直流稳压稳流电泳仪 微量进样器玻璃注射器玻璃平板电炉 规格,型号可变压数量1 12 1 41序 试剂纯度、浓度 作用配 制 需要工具 需要工具号 方法1低分子量标 准蛋白质样 2mg /ml以标准样品为 对照即可确定 见 表 格 下 水浴锅、小烧 杯,玻璃棒 本样品各区带的 方成分210~20mg/ml水浴锅、小烧品3浓缩胶缓冲 液测定蛋白质的 分子量呈弱酸性,使甘 同上 氨酸解离很少, 在电场作用下, 涌动效率低,二 氯离子含量高,杯,玻璃棒天平、容量 瓶、棕色试剂 瓶保 证 电 泳 的 作为催化剂,产去掉其电荷效SDS加速剂,可催化4分离胶缓冲 液形成较高的电 位梯度压着蛋 白质聚集在一 起,凝缩为一狭 小区带。
SDS - 聚丙烯酰胺凝胶电泳测蛋白质分子量

实验二十三SDS - 聚丙烯酰胺凝胶电泳测蛋白质分子量一、目的学习和掌握垂直板聚丙烯酰胺凝胶电泳的原理、方法, 并应用该方法测定蛋白质分子量。
二、原理蛋白质在聚丙烯酰胺凝胶中电泳时, 其迁移率取决于它所带净电荷、分子大小、形状等因素。
1967 年Shapiro 等人发现, 如果在聚丙烯酰胺凝胶系统中加入阴离子去污剂十二烷基硫酸钠(SDS) , 则蛋白质分子的电泳迁移率主要取决于它的分子量, 而与其所带电荷多少和形状无关。
SDS 是一种很强的阴离子表面活性剂。
SDS 以其疏水基和蛋白质分子的疏水区相结合,形成蛋白质- SDS 复合物。
SDS 与大多数蛋白质的结合是高密度的, 其重量比为l .4∶1 , 由于十二烷基硫酸根带负电, 使各种蛋白质的SDS 复合物都带上相同密度的负电荷, 而且带电量远远超过了蛋白质分子原有的电荷量, 从而消除或降低了不同蛋白质分子之间所带净电荷对电泳迁移率的影响。
SDS 与蛋白质结合后, 还引起了蛋白质构象的改变。
根据流体力学的研究, SDS - 蛋白质复合物具有扁平而紧密的椭圆形棒状结构, 不同蛋白质的SDS 复合物的短轴长度都一样, 约为1 . 8 nm, 而长轴则随蛋白质的分子量成正比地变化。
这说明, SDS - 蛋白质复合物的形成也消除了天然蛋白质构象不同对迁移率的影响。
影响带电化合物电泳迁移率的内在因素有三: 即带净电荷的多少、分子量的大小和分子的形状。
从以上的分析不难看出, 由于SDS 和蛋白质的结合, 消除了净电荷和分子形状二因素对电泳迁移率的影响。
那么在外界条件固定的情况下, 凝胶电泳的迁移率只取决于蛋白质分子量大小。
因此, 我们只要测出4~6 个已知分子量的标准蛋白质的迁移率, 作出标准曲线, 即可得到待测蛋白质分子的分子量。
只是每次测定样品必须同时做标准曲线, 而不得利用另一次电泳的标准曲线。
SDS - 凝胶电泳具有分辨率高、重复性好、设备简单、操作容易等优点。
(完整word版)SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量

实验六报告:SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量1.研究背景及目的根据自然界中普遍存在的电泳现象,以及实践应用的需求,科学家不断完善了电泳技术,从移界电泳法、垂直管型盘状电泳、垂直板型电泳、垂直柱型盘状电泳到水平板型电泳。
电泳技术广泛地应用于样品的分析鉴定。
蛋白质分子量的测定在理论和实践中具有很重要的意义,比如临床中对于尿液中蛋白质分子量的测定可以监测人体内的某些疾病(肾小管损坏、多发性骨髓瘤等)。
这种需要促进了相关技术的发明。
具体过程见原理.蛋白质在聚丙烯酰胺凝胶中电泳时,它的迁移率取决于它所带净电荷以及分子的大小和形状等因素。
从活性电泳到变性电泳经过了很多思考。
从活性如果加入一种试剂使电荷因素及分子的形状消除,那电泳迁移率就取决于分子的大小,就可以用电泳技术测定蛋白质的分子量。
1967年,Shapiro等发现阴离子去污剂十二烷基硫酸钠(SDS)具有这种作用[1] 。
通过向样品中添加入巯基乙醇和过量SDS,使蛋白质变性解聚,并让SDS与蛋白质结合成带强负电荷的复合物,掩盖了蛋白质之间原有电荷的差异。
SDS与蛋白质分子结合,不仅使蛋白质分子带上大量的负电荷,而且使蛋白质分子的形状都变成短棒状,从而消除了蛋白质分子之间原有的电荷差异和分子形状的差异。
因此蛋白质在SDS—PAGE中的时迁移率主要取于其分子大小。
由于SDS与蛋白质的结合,电泳迁移率在外界条件固定的情况下,只取决于蛋白质分子量大小这一因素,使得SDS—聚丙烯酰胺凝胶电泳具有分辨率高、重复性好等特性,因此广泛应用于未知蛋白质分子量测定。
通过本次实验,学习和掌握垂直板型聚丙烯酰胺凝胶电泳的原理和方法,进一步学习和应用SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量。
2.原理由于技术的发展,理论上可以通过测序测出蛋白质分子量的真值,但是实际操作过于繁琐,且生物大分子的数量级是KDa,实际中往往不需要特别精确.所以转向寻求其它方法,如果两种性质具有相关性,就会有相关理论基础和技术,发现分子量与迁移速率有关,于是寻找相关方面的技术。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C.拔出样梳后,在上槽内加入缓冲液,
D.加样(摸索加样量) 取10µ l标准蛋白溶解液于 EP管内,再加入10µ l 2倍样品缓冲液,上样量为20µ l。 取10µ l样品溶液,再加入10µ l 2倍样品缓冲液,上 样量分别为5µ l 和10µ l。 E.用微量注射器距槽底三分之一处进样,加样前, 样品在沸水中加热3分钟,去掉亚稳态聚合。
SDS-聚丙烯酰胺凝胶电泳测 定蛋白质分子量
SDS-聚丙稀酰胺凝胶电泳技术是动物 生物化学实验技术教学中一个重要实验之 一。
能够带动生化实验技术综合型 实验项目的开设。
如:蛋白质盐析沉淀提取 → 葡聚 糖凝胶层析分离→ DEAE-纤维素分离 提纯蛋白质 → 蛋白质纯度鉴定、蛋白 质分子量测定等。
2. 不连续系统:由于缓冲液离子
成分、 pH 、凝胶浓度及电位梯度的 不连续性,带电颗粒在电场中泳动 不仅有电荷效应,分子筛效应,还 具有浓缩效应,因而其分离条带清 晰度及分辨率均较前者佳。
(二)特点:
SDS-聚丙烯酰胺凝胶电泳,是在 聚丙烯酰胺凝胶系统中引进SDS(十二 烷基磺酸钠)。
蛋白质在一定浓度的含有强还原剂 的 SDS 溶液中,与 SDS 分子按比例结合, 形成带负电荷的SDS-蛋白质复合物。
图2 电泳迁移率与logMW之间的关系
六、分析计算
绘制标准曲线:按下式计算
电泳迁移率 = 样品迁移距离/溴酚篮迁移距离
以每个蛋白标准的分子量对数对它的相对迁移 率作图得标准曲线,量出未知蛋白的迁移率即可 测出其分于量,这样的标难曲线只对同一块凝胶 上的样品的分子量测定才具有可靠性。
标准蛋白分子量(标准试剂盒): 97400kD、66200kD、43000kD、 31000kD、20100kD、14400kD。 采用不连续SDS-PAGE电泳法对所分 离纯化的蛋白质进行纯度鉴定,发现图中 电泳图谱可以清晰的看到两条蛋白带。
十二、达到预期目标
1. SDS-聚丙稀酰胺凝胶电泳技术是动
物生物化学实验技术教学中一个综合性实 验项目, 且是一个较高水平的一个实验项 目。
蛋白质盐析沉淀提取 → 凝胶层析分离(上年基金项目已完成) → DEAE-纤维素分离提纯蛋白质 → 蛋白质分子量测定、生物分子纯度鉴定等综合 项目(五个单项实验项目)。
蛋白质丧失了原有的电荷状态形成 仅保持原有分子大小为特征的负离子团 块,降低或消除了各种蛋白质分子之间 天然的电荷差异,因此在进行电泳时,
蛋白质分子移速度取决于分子大小。 当分子量在15000KD到200000KD 之间时,蛋白质的迁移率和分子量的 对数呈线性关系。合下式: ,式中 将已知分子量的标准蛋白质的迁 移率对分子量对数作图,可获得一条 标准曲线,未知蛋白质在相同条件下 进行电泳,根据它的电泳迁移率即可 在标准曲线上求得分子量。
开封后溶于200µl蒸馏水,置-20℃保存,使用前室温融化,沸水浴中加热3-5分钟后上样。
。
2. 30%丙烯酰胺(Acr):称Acr30g, 甲叉双丙烯酰胺 (Bis)0.8g,加蒸馏水至100ml,过滤 后置棕色瓶中 3. 10%SDS(十二烷基磺酸钠) 4. 1.5mol/L pH8.8 Tris-HCl缓冲液:称 取Tris18.2g(PH计)
一、实验目的
通过该实验使学生掌握 SDS-PAGE 测定蛋白质分子量的原理; 掌握该技术的操作方法(基础性很 强,使用范围宽阔; 运用 SDS-PAGE 测定蛋白质分子量 及染色鉴定。
二、实验原理
带电质点在电场中向带有异相电荷的电极移动, 这种现象称为电泳。
电泳分类:移动界面电泳、区带电泳等。
(1)制胶
(简单叙述)
(双层胶,摸索胶浓度)
A.将玻璃板用蒸馏水洗净晾干, 准备2个干 净的锥形瓶。把玻璃板在灌胶支架上固定好。 B.按比例配好分离胶,溶液立即倾入制胶 模板中(1 5mm模板),加少许蒸馏水,待胶凝 固后,倒出水并用滤纸把剩余的水分吸干,按比 例配好浓缩胶,连续平稳加入浓缩胶至离边缘 5mm处,样梳需一次平稳插入,静置40分钟,待 模板中的胶定型后,轻轻取出梳形样品槽模具, 梳口处不得有气泡,拔出样梳后,在上槽内加入 缓冲液。
定的可信度 。
用SDS-PAGE垂直板电泳测得绵羊血清具有一
七、思考题
在不连续体系 SDS-PAGE 中 , 当分离胶加完后 , 需 在其上加一层水,为什么? 在不连续体系 SDS-PAGE 中 , 分离胶与浓缩胶中 均含有TEMED和AP,试述其作用? 样品液为何在加样前需在沸水中加热几分钟?
2. 该项目的完成对我们课程的 建设起到了促进发展的作用,达到了 我们预期目标。
3. 该实验项目的开设,使学生掌 握了利用聚丙稀酰胺凝胶电泳技术分 离蛋白质 、SDS—PAGE测定蛋白质 分子量的基本理论及实验技术。
4. 通过对生物大分子的分离、 纯化、鉴定等过程的学习,使学生 在综合性实验技术方面 有了一个系 统的认识及动手能力, 为在现代分子 生物学技术等手段方面的运用打下 了良好的基础。
+
(7)10%过硫酸铵(AP) (8)TEMED(四甲基乙二胺) (9)样品溶解液:SDS(100mg)+巯基乙醇(0.1ml)
溴酚蓝(2mg)+甘油(2g) +0.05mol/L pH8.0TrisHCl(2ml),最后定容至10ml。 (10)固定液:取50%甲醇454ml,冰乙酸46ml混匀。 (11)染色液:称取考马斯亮蓝R250 0.125g,加上述固 定液 250ml, 过滤后备用。 (12)脱色液:冰乙酸75ml,甲醇50ml,加蒸馏水定容 至1000ml。 (13)电极缓冲液(内含0.1%SDS,0.05mol/LTris0.384mol/L甘氨酸缓冲液pH8.3):称Tris6.0g,甘 氨酸 28.8g,加入SDS1g,加蒸馏水使其溶解后定容至1000ml。
F.电泳槽中加入缓冲液,接通电源,进行 电泳,开始电流恒定在8mA,(电流、电压) 当进入分离胶后改为16mA,溴酚蓝距凝胶边 缘约5mm时,停止电泳。
G.凝胶板剥离与染色 电泳结束后,撬开 玻璃板,将凝胶板做好标记后放在大培养皿内, 加入染色液,染色 过夜。 H.脱色 染色后的凝胶板用蒸馏水漂洗数 次,再用脱色液脱色 。 ※剥胶时要小心,保持胶完好无损,染色要充分。
5.“SDS — 聚丙稀酰胺凝胶电 泳法测定蛋白质分子量”一实验的开 设达到了与国内同类院校相当的较高 水平。 对本科生的内容。
两条蛋白带代表绵羊免疫球蛋白G的重 链和轻链。 计算分析结果表明: 绵羊血清lgG重链和轻链的分子量分别 为50000和28000Kd。一般说来,当蛋 白质的分子量在200000至15000 kD 之 间时,电泳迁移率与分子量的对数呈线性 关系 。实验结果各谱带所代表的成分的分 子量的范围均在此之间。
区带电泳 是在半固相或胶状介质上加一个点或一薄 层样品溶液,然后加电场,分子在支持介质上或支 持介质中迁移。
区带电泳使用不同的支持介质,有 滤纸、纤维素粉、聚氯乙烯树脂、淀 粉凝胶、琼脂凝胶、醋酸纤维素膜, 现在则多用聚丙烯酰胺(PAGE)和 琼脂糖凝胶。
(一)分类 PAGE 根据其有无浓缩效应,分为 连续系统和不连续系统两大类: 1. 连续系统:电泳体系中缓冲液 pH值及凝胶浓度相同,带电颗粒在电 场作用下,主要靠电荷和分子筛效应。
胶槽1
94 000
2
3
5.2
62 000 43 000
5 4.8
31 000 20 100
4.6 4.4 4.2
14 400
4 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
图1 标准蛋白质与待测样品电泳图谱 注:胶槽1 标准蛋白;胶槽2、3 样品蛋白
得到同行专家赞
三、 实验试剂和器材
材料 实验试剂
1.低分子量标准蛋白试剂盒:
兔磷酸化酶B 牛血清白蛋白 兔肌动蛋白 牛碳酸酐酶 胰蛋白酶抑制剂 鸡蛋清溶菌酶
样品1:称3mg样品1,加2 ml蒸馏水溶解
MW=97,400 MW=66,200 MW=43,000 MW=31,000 MW=20,100 MW=14,400
图2 电泳迁移率与logMW之间的关系
采用SDS-聚丙烯酰胺凝胶电泳法 测蛋白质分子量时,必须完全打开蛋 白质之间的二硫键,使蛋白质分子被 解聚, SDS 才能定量地结合到亚基上。 因此在用 SDS 处理样品同时用巯基乙 醇处理。
巯基乙醇是一种强还原剂,它使被还原的二硫键不易再氧化,从而使很多不溶 性蛋白质溶解而与SDS定量结合。
五、实验结果分析
胶槽1
94 000
5.2
2
3
62 000 43 000
5 4.8
31 000 20 100
4.6 4.4 4.2
14 400
4 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
图1 标准蛋白质与待测样品电泳图谱 注:胶槽1 标准蛋白;胶槽2、3 样品蛋白
实验器材
垂直板电泳装置
直流稳压电源电泳厚胶浓度后要做8各小时,薄胶5各小时)
电泳仪 标准型酸度计(TLD80-2B) 离心机等
四、实验过程
如:免疫球蛋白G 分子量的测定
(一)血清γ-球蛋白的提取 硫酸胺盐析沉淀法 (二) γ-球蛋白脱盐纯化 葡聚糖凝胶过滤(柱层析法)除去硫酸胺,得到γ球蛋白(去年完成的基金项目) (三)纯化免疫球蛋白G DEAE-离子交换纤维素法纯化免疫球蛋白G。 (四) SDS-聚丙烯酰胺凝胶电泳法测定血液免疫球 蛋白G的分子量( 连续四个单项实验)。
