《硅及其重要化合物转化关系》方程式的书写
第11讲 常见非金属及其重要化合物(课件)-2023届高考化学二轮复习(全国通用)

化学
2023
二轮精准复习45讲
第11讲
常见非金属及其重要化合物
有关非金属元素单质及其化合物的性质和用途的思维途径
1.硅及其化合物
(1)硅及其化合物的“价类二维”转化。
理清知识主线:
-
H4
-
H4
+
O
+
+
O2
+
O2(H2 O3)
(2)重要反应的方程式。
ClO-+Cl-+2H+═Cl2↑+H2O
⑦将SO2和Cl2混合,漂白性减弱的原因(用离子方程式表示)。
SO2+Cl2+2H2O
+
4H +S +2Cl
(3)扫除易忘知识盲点。
①液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。
②酸性KMnO4溶液应用硫酸酸化。
酸化KMnO4溶液不能用盐酸,也不能用硝酸
③ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与
-、Fe2+均不能大量共存。
、I
SO23
④当Fe与Cl2在加热条件下反应时,不论Fe过量还是不足,由于Cl2的强氧化
性,产物一定是FeCl3。
⑤“84”消毒液的有效成分为NaClO,漂粉精的有效成分为Ca(ClO)2。“84”消
3S↓+3H2O
④书写下列反应的化学方程式。
a.将 SO2 通入 H2S 溶液中。
2H2S+SO2
3S↓+2H2O
b.Cu 与浓硫酸混合加热。
Cu+2H2SO4(浓)
碳硅及其重要化合物的化学方程式总结

碳硅及其重要化合物的化学方程式总结碳是地壳中被广泛存在的元素之一,它在地球上的循环过程中起着重要作用。
碳的化学方程式既可以描述它与其他元素的反应,也可以描述其重要化合物的合成和分解过程。
下面是一些碳及其重要化合物的化学方程式:碳与氧气反应会产生二氧化碳:C+O2-->CO2碳与水蒸气反应会产生一氧化碳和氢气:C+H2O-->CO+H2碳和硫的反应会产生二硫化碳:C+2S-->CS2碳和氯气反应会产生四氯化碳:C+2Cl2-->CCl4碳与氧化钙反应会生成氧化碳:C+CaO-->CaCO3碳和氢气反应会产生甲烷:C+2H2-->CH4碳与氯乙烯反应会生成四氯化碳和乙烯:C2H3Cl+5Cl2-->CCl4+2C2H4碳与氢氧化钠反应可以制备乙炔:2C+NaOH-->Na2CO3+C2H2这些化学方程式描述了碳与氧、氢、硫以及其他元素的反应。
除此之外,碳还能与其他非金属元素如氮、氟和氯等进行反应,生成一系列化合物。
硅是地壳中含量最丰富的非金属元素之一,它也具有重要的化学性质。
硅的化学方程式可以描述其与氧气、水和酸的反应,以及其重要化合物的合成和分解过程。
硅与氧气反应会生成二氧化硅:Si+O2-->SiO2硅与水反应会生成硅酸:Si+2H2O-->Si(OH)4硅与氢氟酸反应会产生气体六氟硅酸:Si+6HF-->H2SiF6+2H2硅与氯气反应会生成硅四氯化物:Si+2Cl2-->SiCl4硅与氢气反应会生成硅化钙:Si+CaH2-->CaSi2硅与硝酸反应会生成硝酸硅酯:Si+4HNO3-->Si(ONO)4+2H2O除了与氧、氢、氟和氯等元素的反应,硅还能与其他非金属元素如硫、磷等发生反应并形成相应的化合物。
总结起来,碳和硅是地壳中含量较丰富的元素之一,它们的化学方程式描述了它们与其他元素的反应以及重要化合物的合成和分解过程。
转化关系图

重要的转化关系图1.碳及其化合物的转化关系图2.氮及其化合物的转化关系图NH 4N 324Mg 3N 23·H 2ONH 4+ OH -+Ca(OH)2,△HClH 2,催化剂高温 高压O 2 , 放电O 2H 2O NaOH O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O△△O 2 ,催化剂,3.磷及其化合物的转化关系图4.铁及其化合物的转化关系图5.镁及其化合物的转化关系图6氯及其化合物的转化关系图Cl 2CuCl 2PCl 3、PCl HClO O 2Ca(ClO)2①C O 2+H 2O②C l P ,点燃2点燃NaClNaOH H 2S O 4(浓)△MnO 2、△N a , △①电解熔融盐②电解食盐水H 2O光照A gN O3Ag N O 3Ca(OH)27硫及其化合物的转化关系图H 2SSSO 2SO 3Na 2SO 4FeS FeS 2Na 2SO 3H 2SO 3H 2SO 4BaSO 4HClH 2,△O 2,燃烧H 2SO 2,燃烧①加热分解②不完全燃烧O 2,催化剂,△NaOHNaOHO 2BaCl 2H 2OBaCl 2①浓酸,C u ,△②浓酸,C, △H 2OH2S O4O2,高温F e ,△8硅及其化合物的转化关系图[此文档可自行编辑修改,如有侵权请告知删除,感谢您的支持,我们会努力把内容做得更好]。
高考化学硅及其化合物推断题(大题培优)附答案

高考化学硅及其化合物推断题(大题培优)附答案一、硅及其化合物1. A 、B 、C D E 五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关 系,该元素(用R 表示)的单质能与NaOH 溶液反应生成盐(Na z RO)和氢气。
焦炭哋□NaOH 席廳A①- 石祝石“血温 CaCI 録|」 ②⑤ 1V加热过验盐酸③请回答下列问题:(1) 写出各物质的化学式: A _______ ; B ______ ; C ______ ; D ______ ; E ______ 。
(2) 写出反应①的化学方程式: ___________________________________________ ,该反应中氧化 剂与还原剂的物质的量之比为 _________ 。
(3) 写出反应④的离子方程式: ___________________________________________ 。
(4) 写出反应⑤的离子方程式: ___________________________________________ 。
(5) H 2CO 的酸性强于E 的,请用离子方程式予以证明: 室气体,A 为强碱,其焰色反应呈黄色,E 和B 分别与酸化的硝酸银溶液反应时的实验现象相同,均有白色沉淀产生,流程中的部分生成物已略去。
回答下列问题:(1) A 的电子式: ____________________ 。
(2) 铁橄榄石的化学式: ____________________ 。
(3) 写出H T 的化学方程式: ________________________ 。
【答案】 W 广;I 汨 Fe s SiO 或 2FeO?SiO 4Fe(OH 》+O 2+2H 2O=4Fe(OHp【解析】A ~ J 是中学化学中的常见物质, G 是一种红褐色固体, G 为氢氧化铁,则 H 为氢氧化亚 铁,F 中含有铁离子,D 是一种难溶于水的含氧酸, D 为硅酸,J 是一种主要的温室气体,J为二氧化碳,A 为强碱,其焰色反应呈黄色,A 为氢氧化钠,则 D 为二氧化硅,E 和B 分别与酸化的硝酸银溶液反应时的实验现象相同,均有白色沉淀产生,则B 为盐酸,E 为氯气,因此F 为氯化铁,C 为氯化亚铁。
各元素及其重要化合物间的相互转化关系图ppt课件

3.铁及其重要化合物间的转化关系
⒀
⑶⑵
⑷
⑻
⑸ ⑼⑽⑾
⑴
⑹ ⑿ ⒃
⑺
⒁ ⒂
⒄
⒅
ppt课件.
4
4.铜及其重要化合物间的转化关系
CuSO4
⑷
⒂
⑶
⒄
⑵
⑼
⑿ ⒁
⑴ O2
⒀
H2 ⑻
△
⑺
O2
⑹
⑽
⑾
(21)
HCl
⒅
⒃ห้องสมุดไป่ตู้
⒆ H2S
CuS
(20)或Na2S
ppt课件.
5
非金属元素及其化合物
ppt课件.
6
1.碳、硅及其重要化合物间的转化关系
⑷ ⑵
⑴
⑺
⑽
⒆
⑸ ⑼
⑿
⑾
⒃
⑹
⒀
⑻
⒁ ⑶
⒅ ⒂
⒄
⒇ (24)
(21) (23)
(27) (28)
(22)
(25)
(26) Na2CO3
(30)
ppt课件.
(29)
7
2.氯及其重要化合物间的转化关系
(23)
⑽ ⑼⑻⑶
⑵
⑷
⑹
⑸
⑴
⑺
⒀
⑿
(24)
(22) ⒄
⑾
(21)
⒃
⒅
⒇ 3
⒁
⒂
⒆
ppt课件.
8
3.硫及其重要化合物间的转化关系
⑷
⑸
⑴
⑼ ⑽
△
⑵
⑿
⑻⑺
⒇
⑶
⑹
⒀
⑾
⒁
高中化学与硅有关的方程式

高中化学与硅有关的方程式篇一:硅和硅的化合物方程式硅和硅的化合物1、硅和氢氧化钠溶液反应的化学方程式:Si + 2NaOH + H2O = Na2SiO3 + 2H2 ↑2、硅和氢氧化钠溶液反应的离子方程式:Si +2OH— + H2O= SiO32—+ 2H2 ↑3、硅和氢氟酸反应的化学方程式:Si + 4HF= SiF4↑ + 2H2↑4、保存氢氧化钠溶液的试剂瓶不用玻璃瓶的原因:SiO2 + 2NaOH = Na2SiO3 + H2O5、用氢氟酸刻蚀玻璃的原理:SiO2 + 4HF= SiF4↑+ 2H2O6、制玻璃的反应原理:SiO2 + Na2CO3 = Na2SiO3 + CO2↑(高温条件自己写) SiO2 +CaCO3 = CaSiO3 + CO2↑(高温条件自己写)7、制粗硅的反应原理:2C + SiO2 = Si + 2 CO↑(高温条件自己写)8、制硅酸的反应方程式:(写三个反应)Na2SiO3 + 2HCl= 2NaCl + H2SiO3(胶体)Na2SiO3 + CO2(少)+H2O = Na2CO3 + H2SiO3(胶体) Na2SiO3 + 2CO2(多)+2H2O = 2NaHCO3 + H2SiO3(胶体)9、二氧化硅和氧化钙反应:SiO2 + CaO = CaSiO3 (高温条件自己写)10、二氧化硅在自然界的存在形态有硅石。
说出二氧化硅的一种用途制光导纤维。
11、陶瓷的原料,制玻璃的原料是制水泥的原料以黏土和石灰石为主要原料,在加入适量的石膏12、说出硅的两点用途:硅酸的主要用途制硅胶干燥剂硅酸钠的主要用途木材防火剂篇二:硅和氯的化学方程式(完整版)非金属及其化合物的方程式集锦一、硅及其化合物的相互转化1、二氧化硅与氢氟酸反应:SiO2+ 4HF =SiF4 ↑+2 H2O二氧化硅与氢氧化钠溶液反应:SiO2+ 2NaOH =Na2SiO3+ H2O离子方程式:SiO2+2 OH- =SiO2-3+H2O二氧化硅与氧化钙高温反应:SiO2+ CaO高温CaSiO3工业制玻璃原理:SiO2 + Na2CO3 2SiO3+ CO2↑SiO2 + CaCO33+ CO2↑ 2、硅酸钠溶液中通入二氧化碳:Na2SiO3+H2O+CO2= Na2CO3+ H2SiO3↓离子方程式:SiO2-2-3 +H2O+CO2= CO3+ H2SiO3 ↓硅酸钠与盐酸反应:Na2SiO3 +2HCl = 2NaCl + H2SiO3 ↓离子方程式:SiO2-3 +2H+ = H2SiO3 ↓ 硅酸受热分解:H2SiOSiO2+ H2O3、粗硅的制取:SiO2 + 2C Si + 2CO↑ 粗硅的提纯:Si+2Cl4SiCl4+2HSi +4HCl4、硅单质与O2 、F2、HF、NaOH溶液:Si + 2F2 = SiF4Si + 4HF = SiF4 + 2H2↑Si + 2NaOH + H2O = Na2SiO3 +2H2↑ Si +O2点燃SiO2二、氯及其化合物的相互转化1、氯气与金属反应:2Na +Cl点燃2点燃2NaCl(黄色火焰,产生白烟)Cu +Cl2(产生棕黄色烟)2Fe +3Cl2点燃CuCl22FeCl3(产生棕黄色烟)2.氯气与非金属单质反应:H2 +Cl2点燃2HCl(安静燃烧,苍白色火焰,瓶口有白雾产生,并且产生有刺激性气味的气体)H2 +Cl2HCl(发生爆炸,瓶口有白雾产生) 3Cl点燃2+2P2PCl3(小液滴)PCl点燃3+Cl2PCl5(固体小颗粒)3.氯气与水反应:Cl2 + H2O = HCl + HClO离子方程式:Cl+-2 + H2O = H+Cl+HClO 4.HClO光照下分解:2HClO2↑ 5.制漂白液(或氯气尾气处理):Cl2 + 2NaOH = NaCl + NaClO + H2O离子方程式:Cl-2 + 2OH- = Cl- + ClO + H2O6. 制漂白粉(或漂粉精):2Cl2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H2O7.漂白粉的使用原理:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO离子方程式:Ca2++2ClO-+H2O+CO2=CaCO+ 2HClO 漂白粉长期置露在空气中失效:Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO ,2HClO8.实验室制氯气:4HCl(浓)+MnOMnCl2+Cl2↑+2H2O离子方程式:4H++2Cl-+MnO2+Mn+Cl2↑+2H2O9. 氯气与还原性物质反应a. Cl-2+2NaBr=2NaCl+Br2 离子方程式:Cl2+2Br=2Cl-+Br2b. Cl--2 +2 K I =2 KCl+I2离子方程式:Cl2 +2 I =2 Cl+I2 c. Br--2 +2 K I =2 K Br+I2离子方程式:Br2 +2 I =2Br+I2d. Cl2+H2S =S↓+2HCle. FeCl2+2+Cl2 =2FeCl3 离子方程式:Fe+Cl2 =2Fe3++Cl-f. 2H2O+SO2+Cl2 =2HCl+H2SO4离子方程式:2H+-2-2O+SO2+Cl2 =4H+2Cl+SO4篇三:高一化学方程式——硅4、硅及其化合物的转化关系4 ①Si+O2④△SiO2①②SiO2+2C高温Si+2CO↑(制取粗硅)2 CaSiO 3※③SiO2+4HF = SiF4↑+2H2O(刻蚀玻璃)②④Si+4HF = SiF4↑+2H2↑Na 2SiO3 H2 3 ⑤SiO2+CaOSiO2+2NaOH = Na2SiO3+H2O(SiO2是酸性氧化物)2+CaCO3 SiO2+2OH-= SiO32-+H2O (装NaOH的试剂瓶不可以用玻璃塞)SiO2+Na2CO3高温⑦⑧CaSiO3高温CaSiO3+CO2↑Na2SiO3+CO2↑ (Na2SiO3是粘合剂)※⑦Na2SiO3+2HCl = H2SiO3↓+2NaCl SiO32-+2H+= H2SiO3↓(白色胶状沉淀)(硅胶可以用作干燥剂)※⑦Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2=H2SiO3↓+2NaHCO3SiO32-+H2O+CO2=H2SiO3↓+CO32-或SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-(强酸制弱酸,SiO2不能和H2O反应制硅酸)⑧H2SiO3+2NaOH = Na2SiO3+2H2O ⑨H2SiO3△2O+SiO2H2SiO3+2OH-= SiO32-+2H2O ※⑩Si+NaOH +H2O=Na2SiO3+H2↑ 5、氯及其化合物的转化关系①2Fe+3Cl2 2点燃2FeCl3 (棕黄色的烟)②Cu+Cl2 CuCl2 (棕黄色的烟)⑤3+Cu = 2FeCl2+CuCl2③2FeCl+④Cl 2 NaClO 2Fe3+Cu = 2Fe2++点燃④H2+Cl22HCl(苍白色火焰,光照时发生爆炸)或光照CuCl2 ③FeCl3△※⑤MnO2+4HCl(浓) MnCl2+Cl2↑+2H2OMnO2+4H++2Cl-Mn2++Cl2↑+2H2O光照※⑥Cl2+H2O = HCl+HClO(次氯酸是弱酸)※⑦2HCl +O2↑ Cl2+H2O = H++Cl-+HClO 2HClO 光照2H++2Cl-+O2↑※⑧Cl2+2NaOH = NaCl+NaClO+H2O⑨2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O工业制漂白粉用石灰乳Cl2+2OH-= Cl-+ClO-+H2O※⑩Ca(ClO)2+H2O+CO2 = CaCO3↓+2HClO或Ca(ClO)2+2HCl = CaCl2+2HClOCa2++2ClO-+H2O +CO2= CaCO3↓+2HClO或ClO-+H+= HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO2:Ca(ClO)2+2H2O+2CO2 = Ca(HCO3)2+2HClO ClO-+H2O+CO2 = HCO3-+HClO△点燃相关热词搜索:方程式高中化学高中化学方程式大全有关硅的化学方程式。
高三化学方程式总结:硅及其化合物方程式

方程式6 硅及其化合物方程式1. Si与氧气反应的化学方程式:Si + O2高温SiO22.Si与氟气反应的化学方程式:Si + 2F2∆SiF43. Si与Cl2反应的化学方程式:Si + 2Cl2高温SiCl44. Si与NaOH溶液反应化学方程式:Si + 2NaOH + H2O =Na2SiO3 + 2H2 ↑离子方程式:Si + 2OH- + H2O =SiO32- + 2H2 ↑5.Si与HF反应化学方程式:Si + 4HF = SiF4↑ + 2H2↑6.工业制粗硅的化学方程式:SiO2 + 2C高温Si + 2CO↑7.工业由SiCl4制纯硅的化学方程式:SiCl4 + 2H2高温Si + 4HCl8.SiO2与氢氟酸反应的化学方程式:SiO2 + 4HF = SiF4↑ + 2H2O9.SiO2与碱性氧化物(CaO)反应的化学方程式:SiO2 + CaO 高温CaSiO310.SiO2与石灰石反应的化学方程式:S iO2 + CaCO3高温CaSiO3 + CO2↑11.SiO2与强碱NaOH溶液反应的化学方程式:SiO2 + 2NaOH = Na2SiO3 + H2O离子方程式:SiO2 + 2OH -= SiO32-+ H2O12.工业制玻璃的两个反应化学方程式:SiO2 + CaCO3高温CaSiO3 + CO2↑SiO2 + Na2CO3高温Na2SiO3 + CO2↑13.H2SiO3与强碱NaOH溶液的反应:化学方程式:H2SiO3+2NaOH=Na2SiO3+ H2O离子方程式:H2SiO3+2OH-=SiO32-+ H2O14.硅酸的热稳定性很弱,受热分解:化学方程式:H2SiO3∆H2O + SiO215.向硅酸钠溶液中通入足量的CO2的反应:化学方程式:Na2SiO3 + 2CO2 + 2H2O =H2SiO3↓+2NaHCO3离子方程式:SiO32- + 2CO2 + 2H2O =H2SiO3↓+2HCO3-16.向硅酸钠溶液中通入少量的CO2的反应:化学方程式:Na2SiO3 + CO2 + H2O=H2SiO3↓+Na2CO3离子方程式:SiO32- + CO2 + H2O=H2SiO3↓+CO32-17. 向硅酸钠溶液中滴加稀盐酸的反应:化学方程式:Na2SiO3 + 2HCl =H2SiO3↓+2NaCl离子方程式:SiO32- + 2H+=H2SiO3↓方程式7 铝及其化合物方程式1.铝在氧气中燃烧化学方程式4Al + 3O2点燃2Al2O32.铝在氯气中燃烧化学方程式2Al + 3Cl2点燃2AlCl33.铝与硫共热化学方程式2Al + 3S2AlCl34.铝和盐酸反应化学方程式2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式2Al + 6H+ = 2Al3++ 3H2↑硅、铝方程式1。
有关硅及其重要化合物化学方程式小结

有关硅及其重要化合物化学方程式小结1、Si
(1)与氧气反应
(2)与氯气反应
(与氢氧化钠溶液反应
2、SiO2
(1)与氧化钙反应
(2)与氢氧化钠溶液反应
(3)与氢氟酸反应
(4)与碳酸钠反应
(5)与碳酸钙反应
(6)与碳单质反应
3、H2SiO3
(1)与氢氧化钠溶液反应
(2)受热分解
4、Na2SiO3
(1)与稀硫酸反应
(2)与二氧化碳和水反应
有关硅及其重要化合物化学方程式小结 有关硅及其重要化合物化学方程式小结1,si (1)与氧气反应 (2)与氯气反应 (3)与氟气反应 (4)与氢氟酸反应 (5)与氢氧化钠溶液反应 2,sio2 (1)与氧化钙反应 (2)与氢氧化钠溶液反应 (3)与氢氟酸反应 (4)与碳酸钠反应 (5)与碳酸钙反应 (6)与碳单质反应 3,h2sio3 (1)与氢氧化钠溶液反应 (2)受热分解 4,na2sio3 (1)与稀硫酸反应 (2)与二氧化碳和水反应
高中化学必修1第四章化学方程式总结

高中化学必修1第四章化学方程式总结高中化学必修1第四章化学方程式总结1、硅及其化合物的转化关系※①SiO2+4HF=SiF4↑+2H2O(刻蚀玻璃)SiF①4※②SiO2+2NaOH=Na2SiO3+H2O--(SiO2+2OH=SiO32+H2O)④※③NaSiO+2HCl=HSiO(胶体)+2NaClSiO2CaSiO32323②+2-(SiO3+2H=H2SiO3(胶体))③Na2SiO3H2SiO3高温④SiO2+CaOCaSiO32、氯及其化合物的转化关系点燃Ca(ClO)①2Fe+3Cl22FeCl3HClO2点燃⑦⑥⑨②Cu+Cl2CuCl2⑤③2FeCl3+Cu=2FeCl2+CuCl2⑧+++ClHCl2NaClO2Fe3+Cu=2Fe2+Cu2④点燃②①④H2+Cl22HCl或光照△③※⑤MnO2+4HCl(浓)MnCl2+Cl2↑+2H2OCuCl2FeCl3+-△2+(MnO2+4H+2ClMn+Cl2↑+2H2O)※⑥Cl2+H2O=HCl+HClO※⑦2HClO2HCl+O2↑光照+-+-(Cl2+H2O=H+Cl+HclO)(2HClO2H+2Cl+O2↑)※⑧Cl2+2NaOH=NaCl+NaClO+H2O※⑨2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O---(Cl2+2OH=Cl+ClO+H2O)3、硫及其化合物的转化关系⑦Cu⑧C点燃①S+O2SO2①②③SSO2SO3H2SO4催化剂④⑤⑥※②SO2+O2加热2SO3③SO3+H2O=H2SO4H2SO3CaSO3CaSO4④SO2+H2OH2SO3⑤SO2+CaO△光照CaSO3或SO2+Ca(OH)2=CaSO3↓+H2O+-(SO2+Ca2+2OH=CaSO3↓+H2O)⑥SO3+CaO=CaSO4或SO3+Ca(OH)2=CaSO4+H2O※⑦Cu+2H2SO4(浓)※⑧C+2H2SO4(浓)△△CuSO4+SO2↑+2H2OCO2↑+2SO2↑+2H2O4、氮及其化合物的转化关系⑥⑦※①N2+O2高温或放电2NON2NH3NH4Cl※②2NO+O2=2NO2⑧※③3NO2+H2O=2HNO3+NO⑨①+-(3NO2+H2O=2H+2NO3+NO)NO②NO③HNO23④③⑤※④Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(Cu+4H+2NO3=Cu2+2NO2↑+2H2O)+-+※⑤3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O⑥N2+3H2+-+(3Cu+8H+2NO3=3Cu2+2NO↑+4H2O)⑦NH3+HCl=NH4Cl⑧NH4Cl ++催化剂高温高压2NH3△(NH3+H=NH4)(水溶液中)NH4HCO3⑧NH4Cl+NaOH(NH4+OH+-3△NH↑+HCl↑NH3↑+H2O+CO2↑△△NaCl+NH3↑+H2O△NH3↑+H2O)※⑧2NH4Cl+2Ca(OH)2CaCl2+2NH3↑+2H2O催化剂⑨4NH3+5O2△4NO+6H2O扩展阅读:高中化学必修1化学方程式总结高中化学必修1化学方程式总结1、钠及其化合物的转化关系Na2O⑨①⒃④⑦②⒁⒄⑥NaOH⑾NaClNaNaCONaHCONaCl233⑿⒂③⑤⑧⑩⒀Na2O2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2NaCl+H2↑++++Na2O+2H=2Na+H2O2Na+2H=2Na+H2↑③2Na2O2+4HCl=4NaCl+O2↑+2H2O④4Na+O2=2Na2O2Na2O2+4H+=4Na++O2↑+2H2O※⑥2Na+2H2O=2NaOH+H2↑※⑤2Na+O2△Na2O22Na+2H2O=2Na++2OH+H2↑-⑦Na2O+H2O=2NaOH※⑧2Na2O2+2H2O=4NaOH+O2↑+-+-Na2O+H2O=2Na+2OH2Na2O2+2H2O=4Na+4OH+O2↑⑨Na2O+CO2=Na2CO3※⑩2Na2O2+2CO2=2Na2CO3+O2⑾2NaOH+CO2=Na2CO3+H2O⑿Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ---+2OH+CO2=CO32+H2OCO32+Ca2=CaCO3↓⒀NaOH+CO2=NaHCO3※⒁Na2CO3+H2O+CO2=2NaHCO3----OH+CO2=HCO3CO32+H2O+CO2=2HCO3※⒂2NaHCO3△Na2CO3+H2O+CO2↑或※NaHCO3+NaOH=Na2CO3+H2O---HCO3+OH=CO32+H2O⒃Na2CO3+2HCl=2NaCl+H2O+CO2↑⒄NaHCO3+HCl=NaCl+H2O+CO2↑-+-+CO32+2H=H2O+CO2↑HCO3+H=H2O+CO2↑补充:①石灰水中加入少量NaHCO3:Ca(OH)2+NaHCO3=CaCO3↓+NaOH +H2O+--Ca2+OH+HCO3=CaCO3↓+H2O②石灰水中加入过量NaHCO3:Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O+---Ca2+2OH+2HCO3=CaCO3↓+CO32+2H2O2、铝及其化合物的转化关系AlCl3⑥①⑿④⑦②⑧⑾AlAl2O3Al(OH)3KAl(SO4)2③⑤⑨⑩NaAlO2①2Al+6HCl=2AlCl3+3H2↑②4Al+3O2++△2Al2O32Al+6H=2Al3+3H2↑※③2Al+2NaOH+2H2O=2NaAlO2+3H2↑④Al2O3+6HCl=2AlCl3+3H2O--++2Al+2OH+2H2O=2AlO2+3H2↑Al2O3+6H=2Al3+3H2O※⑤Al2O3+2NaOH=2NaAlO2+H2O⑥AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl --++Al2O3+2OH=2AlO2+H2OAl3+3NH3H2O=Al(OH)3↓+3NH4⑦Al(OH)3+3HCl=AlCl3+3H2O⑧2Al(OH)3++△Al2O3+3H2OAl(OH)3+3H=Al3+3H2O☆⑨NaAlO2+HCl+H2O=Al(OH)3↓+NaCl或NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3-+--AlO2+H+H2O=Al(OH)3↓AlO2+2H2O+CO2=Al(OH)3↓+HCO3++※⑩Al(OH)3+NaOH=NaAlO2+2H2O☆⑾Al3+3H2OAl(OH)3胶体+3H --Al(OH)3+OH=AlO2+2H2O明矾净水+--⑿AlCl3+4NaOH=NaAlO2+3NaCl+2H2OAl3+4OH=AlO2+2H2O3、铁及其化合物的转化关系⑦③①FeOFeFeClFe(OH)2342⑧②⑤⑥⑨④⒁FeCl3⑩Fe(SCN)Fe(OH)3⑿Fe2O33⑾⒀①Fe3O4+4CO△3Fe+4CO2※②3Fe+4H2O(g)高温Fe3O4+4H2Fe3O4③Fe+2HCl=FeCl2+H2↑或3Fe+2O2++Fe+2H=Fe2+H2↑④2Fe+3Cl2点燃点燃2FeCl3※⑤2FeCl2+Cl2=2FeCl3※⑥Fe+2FeCl3=3FeCl2++-++2Fe2+Cl2=2Fe3+2ClFe+2Fe3=3Fe2⑦FeCl2+2NaOH=Fe(OH)2↓+2NaCl⑧Fe(OH)2+2HCl=FeCl2+2H2O+-++Fe2+2OH=Fe(OH)2↓Fe(OH)2+2H=Fe2+2H2O※⑨4Fe(OH)2+O2+2H2O=4Fe(OH)3⑩FeCl3+3NaOH=Fe(OH)3↓+3NaCl+-白色沉淀快速变成灰绿色,最终变成红褐色Fe3+3OH=Fe(OH)3↓++⑾Fe(OH)3+3HCl=FeCl3+3H2OFe3+3H2OFe(OH)3胶体+3H(净水)Fe(OH)3+3H=Fe3+3H2O⑿2Fe(OH)3++△Fe2O3+3H2O⒀Fe2O3+6HCl=2FeCl3+3H2O※⒁FeCl3+3KSCN=Fe(SCN)3+3KCl +++-Fe2O3+6H=2Fe3+3H2OFe3+3SCN=Fe(SCN)34、硅及其化合物的转化关系SiF4①Si+O2△SiO2④③高温②SiO2+2CSi+2CO↑①⑤SiSiO2CaSiO3※③SiO2+4HF=SiF4↑+2H2O(刻蚀玻璃)②⑥⑨④Si+4HF=SiF4↑+2H2↑⑦Na2SiO3H2SiO3⑤SiO2+CaO ⑧高温CaSiO3CaSiO3+CO2↑※⑥SiO2+2NaOH=Na2SiO3+H2OSiO2+CaCO3--高温SiO2+2OH=SiO32+H2O※⑦Na2SiO3+2HCl=H2SiO3↓+2NaClSiO2+Na2CO3高温Na2SiO3+CO2↑SiO32+2H=H2SiO3↓-+※⑦Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2=H2SiO3↓+2NaHCO3----SiO32+H2O+CO2=H2SiO3↓+CO32或SiO32+2H2O+2CO2=H2SiO3↓+2HCO3⑧H2SiO3+2NaOH=Na2SiO3+2H2O⑨H2SiO3H2SiO3+2OH=SiO32+2H2O5、氯及其化合物的转化关系--△H2O+SiO2点燃①2Fe+3Cl22FeCl3⑩HClOCa(ClO)2点燃⑦⑥⑨②Cu+Cl2CuCl2⑤③2FeCl3+Cu=2FeCl2+CuCl2⑧+++ClHCl2NaClO2Fe3+Cu=2Fe2+Cu2④点燃②①④H2+Cl22HCl或光照△③※⑤MnO2+4HCl(浓)MnCl2+Cl2↑+2H2OCuCl2FeCl3+-△2+MnO2+4H+2ClMn+Cl2↑+2H2O※⑥Cl2+H2O=HCl+HClO※⑦2HClO2HCl+O2↑光照+-+-Cl2+H2O=H+Cl+HClO2HClO2H+2Cl+O2↑※⑧Cl2+2NaOH=NaCl+NaClO+H2O※⑨2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O---Cl2+2OH=Cl+ClO+H2O工业制漂白粉※⑩Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO或Ca(ClO)2+2HCl=CaCl2+2HClO+--+Ca2+2ClO+H2O+CO2=CaCO3↓+2HClO或ClO+H=HClO漂白粉的漂白原理向漂白粉溶液中通入过量的CO2:Ca(ClO)2+2H2O+2CO2=Ca(HCO3)2+2HClO--ClO+H2O+CO2=HCO3+HClO3光照6、硫及其化合物的转化关系⑨Cu⑩C点燃①S+O2SO2①④③SOSSO23H2SO4②2H2S+SO2=3S+2H2O⑥②⑤催化剂CaSO3⑦CaSO※③SO+O2SO3224加热⑧氯水④SO3+H2O=H2SO4⑤SO2+CaO△CaSO3或SO2+Ca(OH)2=CaSO3↓+H2O+-⑥SO3+CaO=CaSO4SO2+Ca2+2OH=CaSO3↓+H2OSO3+Ca(OH)2=CaSO4+H2O⑦2CaSO3+O2△2CaSO4※⑧SO2+Cl2+2H2O=H2SO4+2HCl※⑨Cu+2H2SO4(浓)SO2+Cl2+2H2O=4H+SO42+2ClCu+2H2SO4(浓)+--△+△CuSO4+SO2↑+2H2O-Cu2+SO42+SO2↑+2H2O※⑩C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O7、氮及其化合物的转化关系⑥⑦※①N2+O2高温或放电2NO4ClN2NH3NH※②2NO+O2=2NO2⑧※③3NO2+H2O=2HNO3+NO⑨①+-3NO2+H2O=2H+2NO3+NO②NONO③HNO以上三个反应为“雷雨发庄稼”原理23③④扩展反应有:4NO2+O2+2H2O=4HNO3⑤4NO+3O2+2H2O=4HNO3※④Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O上面两个反应主要用于气体溶于水时的计算Cu+4H+2NO3=Cu2+2NO2↑+2H2O或4HNO3光照4NO2↑+O2↑+2H2O +-+C+4HNO3(浓)+△CO2↑+2NO2↑+2H2O浓硝酸见光易变黄的缘由催化剂高温高压※⑤3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O⑥N2+3H2-+2NH33Cu+8H+2NO3=3Cu2+2NO↑+4H2O合成氨反应是人工固氮的主要途径⑦NH3+HCl=NH4Cl⑧NH4Cl++△NH3↑+HCl↑△NH3+H=NH4(水溶液中)补充:NH4HCO3NH3↑+H2O+CO2↑※⑧NH4Cl+NaOH氨气与酸均能反应生成铵盐,且与挥发性酸铵盐受热都易分解,但并不是全部的铵盐(如浓HCl、浓HNO3)相遇时空气中有白烟都分解出氨气,如NH4NO3、(NH4)2SO4△△+-NaCl+NH3↑+H2ONH4+OH△NH3↑+H2O全部的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
非金属金属及化合物转换关系图和化学方程式与离子方程式的归纳与整理
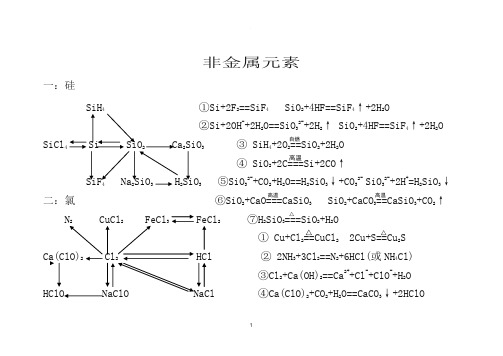
非金属元素一:硅SiH 4 ①Si+2F 2==SiF 4 SiO 2+4HF==SiF 4↑+2H 2O②Si+2OH -+2H 2O==SiO 32-+2H 2↑ SiO 2+4HF==SiF 4↑+2H 2OSiCl 4 Si SiO 2 Ca 2SiO 3 ③ SiH 4+2O 2==SiO 2+2H 2O ④ SiO 2+2C===Si+2CO ↑SiF 4 Na 2SiO 3 H 2SiO 3 ⑤SiO 32-+CO 2+H 2O==H 2SiO 3↓+CO 32- SiO 32-+2H +=H 2SiO 3↓ 二:氯 ⑥SiO 2+CaO===CaSiO 3 SiO 2+CaCO 3==CaSiO 3+CO 2↑N 2 CuCl 2 FeCl 3 FeCl 2 ⑦H 2SiO 3===SiO 2+H 2O① Cu+Cl 2==CuCl 2 2Cu+S==Cu 2S Ca(ClO)2 Cl 2 HCl ② 2NH 3+3Cl 2==N 2+6HCl(或NH 4Cl) ③Cl 2+Ca(OH)2==Ca 2++Cl -+ClO -+H 2O HClO NaClO NaCl ④Ca(ClO)2+CO 2+H 2O==CaCO 3↓+2HClO高温高温高温 △△ △自燃Ca(ClO)2+2HCl==CaCl 2+2HClO ICl+ H 2O==HIO+HCl ⑤2NaOH+Cl 2==NaCl+NaClO+H 2OFe 2O 3+ 6HI==2FeI 2+I 2+3H 2O ⑥Cl -+ ClO -+2H +==Cl 2↑+H 2O2NaCl+MnO 2+2H 2SO 4(浓)== ⑦ClO -+CO 2+H 2O==HClO+HCO 3- ClO -+SO 2+H 2O==Cl -+SO 42-+2H +Na 2SO 4+MnSO 4+Cl 2↑+2H 2O ⑧ MnO 2+4HCl(浓)— 2MnO 4-+10Cl -+16H +==2Mn 2++5Cl 2↑+4H 2O⑨2NaCl+2H 2O===2NaOH+Cl 2↑+H 2↑ ⑩NaCl+H 2SO 4(浓)==NaHSO 4+ HCl ↑ 三:硫 ⑴ 2Al+3S==Al 2S 3 Al 2S 3+6H 2O==2Al(OH)3↓+3H 2S ↑ CuS Cu ⑵Fe+S==FeS FeS+2H +==Fe 2++H 2S ↑ ⑶ Cu 2++ H 2S==CuS ↓+2H +H 2S S SO 2 SO 3 ⑷2H 2S+O 2==3S+2H 2O 2H 2S+3O 2==2SO 2+2H 2O ⑸ 2H 2S+SO 2==3S+2H 2O H 2S+2Fe 3+==2Fe 2++S ↓+2H +FeS Al 2S 3 H 2SO 4 ⑹ 2SO 2+ O 2 2SO 3 Na 2SO 3 Na 2SO 4 ⑺2H 2SO 4(浓)+Cu===CuSO 4+SO 2↑+2H 2O△△电解 点燃 点燃△V 2O 5450℃ △△△四:氮⑴ N 2+3H 2 2NH 3 NH 4Cl NH 3 N 2 NO NO 2 HNO 3 ⑵ 8NH 3+3Cl 2==N 2+6NH 4Cl ⑶ N 2+O 2==2NONH 3·H 2O Mg 3N 2 NaNO 2 NaNO 3 ⑷4NH 3+6NO==5N 2+6H 2O ⑸2NH 4Cl+Ca(OH)2==CaCl 2+2NH 3↑+2H 2O ⑹NH 4++OH -==NH 3·H 2O NH 4++OH -==NH 3↑+H 2O⑺NH 3·H 2O(浓)===NH 3↑+H 2O ⑻ 3NO 2+H 2O==2HNO 3+NO ⑼NO+ NO 2+2OH -==2NO 2-+H 2O 2NO 2+2OH -==NO 2-+NO 3-+H 2O⑽4NH 3+5O 2===4NO+6H 2O ⑾Cu+4HNO 3(浓)==Cu(NO 3)2+2NO 2↑+2H 2O 3Cu+8HNO 3(稀)==3Cu(NO 3)2+2NO ↑+4H 2O△⑾CaO或碱石灰△高温、高压催化剂 催化剂△催化剂△ 放电欢迎您的下载,资料仅供参考!致力为企业和个人提供合同协议,策划案计划书,学习资料等等打造全网一站式需求。
元素化合物的转化关系网络图

① Cu + Cl 2
点燃
CuCl 2
③ 2NaOH + Cl 2 = NaClO + NaCl + H 2O
点燃
② 2Fe + 3Cl 2
3FeCl 3
-
-
-
2OH + Cl 2 = ClO + Cl + H 2O
④ MnO 2+4HCl( 浓 )
MnCl 2+Cl 2↑+ 2H 2O MnO 2+4H ++2Cl -
Na2SiO3 + H 2O +CO 2 = H 2SiO3↓ +Na2CO 3
△
⑤ 2NaHCO 3
Na2CO 3 + H 2O +CO 2 ↑
NaHCO 3 + NaOH = Na 2CO 3 + H 2O
-
-
2-
HCO 3 + OH = CO 3 + H 2O
⑥ Ca(HCO 3) 2 + 2NaO H =CaCO 3↓ +Na2CO 3+ 2H 2O
写出图中标号反应的化学方程式或离子方程式。
① Fe + S
FeS
催化剂
② 2SO2+O 2 加热
2SO3
③ Cu+2H 2SO4 (浓)
CuSO4 +2H 2O+SO2↑ C+2H 2SO4(浓)
2H 2O+CO 2↑ +2SO2↑
④ H 2SO4+ Ba(OH) 2 = BaSO4↓ +2H2 O
⑦ Al(OH) 3 + NaOH =NaAlO 2 +2 H 2O
硅及其化合物方程式
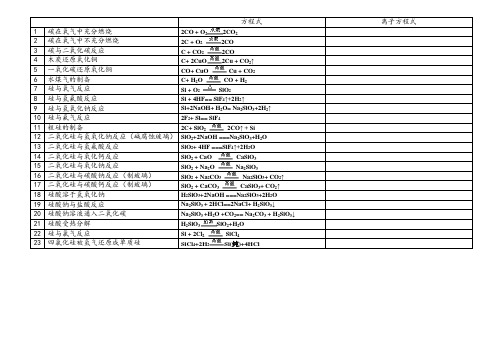
方程式离子方程式1 碳在氧气中充分燃烧2CO + O2CO222 碳在氧气中不充分燃烧2C + O22CO3 碳与二氧化碳反应 C + CO2CO24 木炭还原氧化铜C+ 2CuO2Cu + CO↑25 一氧化碳还原氧化铜CO+ CuO Cu + CO26 水煤气的制备C+ HO CO + H227 硅与氧气反应Si + O2SiO28 硅与氢氟酸反应Si + 4HF== SiF4↑+2H2↑9 硅与氢氧化钠反应Si+2NaOH+ H2O= Na2SiO3+2H2↑10 硅与氟气反应2F2+ Si== SiF411 粗硅的制备2C+ SiO2CO↑ + Si212 二氧化硅与氢氧化钠反应(碱腐蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O13 二氧化硅与氢氟酸反应SiO2+ 4HF ===SiF4↑+2H2O14 二氧化硅与氧化钙反应SiO+ CaO CaSiO3215 二氧化硅与氧化钠反应SiO+ Na2O Na2SiO3216 二氧化硅与碳酸钠反应(制玻璃)SiO+ Na2CO3Na2SiO3+ CO2↑217 二氧化硅与碳酸钙反应(制玻璃)SiO+ CaCO3CaSiO3+ CO2↑218 硅酸溶于氢氧化钠H2SiO3+2NaOH ===Na2SiO3+2H2O19 硅酸钠与盐酸反应Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓20 硅酸钠溶液通入二氧化碳Na2SiO3 +H2O +CO2== Na2CO3 + H2SiO3↓21 硅酸受热分解H2SiO3SiO2+H2O22 硅与氯气反应Si + 2ClSiCl4223 四氯化硅被氢气还原成单质硅SiCl+2H2Si(纯)+4HCl4。
硅及其化合物方程式

方程式离子方程式1碳在氧气中充分燃烧2CO + O22CO22碳在氧气中不充分燃烧2C + O22CO3碳与二氧化碳反应 C + CO22CO4木炭还原氧化铜C+ 2CuO2Cu + CO2↑5一氧化碳还原氧化铜CO+ CuO Cu + CO26水煤气的制备C+ H2O CO + H27硅与氧气反应Si + O2 SiO28硅与氢氟酸反应Si + 4HF== SiF4↑+2H2↑9硅与氢氧化钠反应Si+2NaOH+ H2O= Na2SiO3+2H2↑10硅与氟气反应2F2+ Si== SiF411粗硅的制备2C+ SiO22CO↑ + Si12二氧化硅与氢氧化钠反应(碱腐蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O13二氧化硅与氢氟酸反应SiO2+ 4HF ===SiF4↑+2H2O14二氧化硅与氧化钙反应SiO2 + CaO CaSiO315二氧化硅与氧化钠反应SiO2 + Na2O Na2SiO316二氧化硅与碳酸钠反应(制玻璃)SiO2 + Na2CO3 Na2SiO3+ CO2↑17二氧化硅与碳酸钙反应(制玻璃)SiO2 + CaCO3 CaSiO3+ CO2↑18硅酸溶于氢氧化钠H2SiO3+2NaOH ===Na2SiO3+2H2O19硅酸钠与盐酸反应Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓20硅酸钠溶液通入二氧化碳Na2SiO3 +H2O +CO2== Na2CO3 + H2SiO3↓21硅酸受热分解H2SiO3SiO2+H2O22硅与氯气反应Si + 2Cl2 SiCl423四氯化硅被氢气还原成单质硅SiCl4+2H2Si(纯)+4HCl。
高中化学硅的化学方程式总结

高中化学硅的化学方程式总结1、与单质反应Si + O₂ == SiO₂,条件:加热Si + 2F₂ == SiF₄Si + 2Cl₂ == SiCl₄,条件:高温2、高温真空条件下可以与某些氧化物反应2MgO + Si=高温真空 =Mg(g)+SiO₂(硅热还原法炼镁)3、与酸反应只与氢氟酸反应:Si + 4HF == SiF₄↑ + 2H₂↑4、与碱反应Si + 2OH⁻+ H₂O == SiO₃²⁻+ 2H₂↑(如NaOH,KOH)5、其他相关方程式Si + 2OH⁻ + H₂O == SiO₃²⁻+ 2H₂↑Si+2F₂== SiF₄Si+4HF== SiF₄↑+2H₂↑SiO₂ + 2OH⁻== SiO₃²⁻+ H₂OSiO₃²⁻+ 2NH₄⁺+ H₂O == H₄SiO₄↓ + 2NH₃↑SiO₃²⁻+ CO₂ + 2H₂O == H₄SiO₃↓+ CO₃²⁻SiO₃²⁻+ 2H⁺== H₂SiO₃↓SiO₃²⁻+2H⁺+H₂O == H₄SiO₄↓H₄SiO₄ == H₂SiO₃ + H₂O3SiO₃²⁻+ 2Fe³⁺== Fe₂(SiO₃)₃↓3SiO₃²⁻+2Al³⁺==Al₂(SiO₃)₃↓Na₂CO₃ + SiO₂ =高温= Na₂SiO₃ + CO₂↑扩展资料硅是一种类金属元素,化学符号为Si,原子序数为14,属于元素周期表上的IVA族。
硅原子有4个外围电子,与同族的碳相比,硅的化学性质相对稳定,活性较低。
硅是极为常见的一种元素,然而它极少以单质的形式存在于自然界,而是以复杂的硅酸盐或二氧化硅等化合物形式广泛存在于岩石、砂砾、尘土之中。
在宇宙储量排名中,硅位于第八名。
