配合物结构
配合物结构的空间构型汇总.
Cl
Cl Cl Co
+
Cl
+
NH3 NH3
Cl H3N
Co
NH3 NH3
NH3
顺式
Cl
反式
例题讲解
例1
设计实验证明[CoSO4(NH3)5]Br(红色) 与[Co Br (NH3)5] SO4 (红色)(化学式相同) 互为同分异构体。
解: 分别取二种溶液少许,向其中分别滴加 BaCl2溶液稀硝酸,其中[Co Br (NH3)5] SO4 有白色沉淀生成,CoSO4(NH3)5]Br无明显现 象,说明它们虽然化学式相同,但结构不同, 因此互为同分异构体。
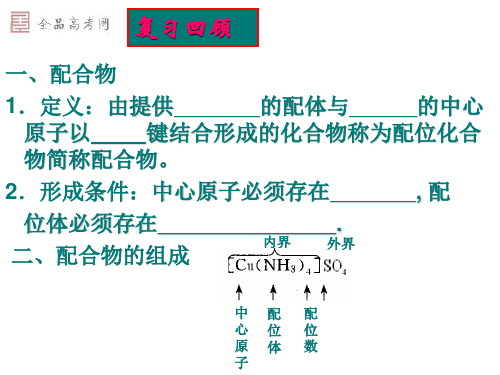
ML3±
实例 [Ag(NH3)2]+
[HgI3]-
Sp
Sp2
Sp3 *dsp2
* sp3 d
4 4
5
正四面体型 平面四边型
三角双锥体
ML4± ML4±
ML5±
[Zn(NH3)4]2+ [Pb(CN)4]2PF5
*dsp3
* sp3 d2 * d2sp3
5
6 6
四方锥体
八面体 八面体
ML5±
ML6± ML6±
交流与讨论
四、配合物的同分异构现象
几何异构
交 流 与 讨 论
1. 怎样判断顺式和反式?
2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表. 配合物 顺式 Cl Pt NH3 反式 NH3 NH3 Cl
非极性分 子
结构式 Cl
分子极性 在水中溶解 性
中心原子杂化方式
sp
配位数
配合物的结构

O H (羟基)
CN
S CN(硫氰根) N CS(异硫氰根) N O(硝基)
H2 O
N H3
CO (羰基)
多齿配体: 一个配体中含有多个配位原子 二齿配体: 乙二胺(en) H 2 N
CH 2
CH 2
2 4
N H2
乙二酸根(草酸根)
C2O
••
O
O
••
O
2–
C C
4
4 3 1 4 2 2 2 6 3 2 6 1 6 6
P tCl3 (NH3 ) 2 CoCl2 (en)2 3 Al(C2O 4 )3 2 Ca(EDT A)
配离子与形成体的电荷数
Ag (S O ) 2 3 2
内界: CoCl(NH3 )(en) 2
外界: SO 2 4
2
形成体:Co 配位体:Cl
3
NH 3 en
配位原子: Cl N 配位数: 6
§ 5.7 配位反应与配位平衡
5.7.1 配离子的解离常数和稳定常数
5.7.2 配合物的生成与配位反
5.7.3 配合物形成时的特征
5.7.1 配合物的解离常数和稳定常数
⑴ 解离常数 Cu(NH3 ) 2 4 2
Cu 2 4NH3
4
c(Cu ) c ( NH3 ) Kd 2 c(Cu(NH3 ) 4 )
⑵ 稳定常数
Cu
2
4NH3
Cu(NH )
2 3 4
2 3 4
c(Cu(NH ) ) Kf 2 4 c(Cu ) c ( NH3 ) 1 Kd Kf
配合物结构的空间构型
易与
Mn+结合.如NH3>
3. 形成配合物后,颜色、溶解性、酸碱性、氧化
还原性等都有可能发生改变。
3 正三角形
4 正四面体型
4 平面四边型
5 三角双锥体
5 四方锥体
6
八面体
6
八面体
通式
ML2±
ML3± ML4± ML4± ML5± ML5± ML6± ML6±
实例
[Ag(NH3)2]+
[HgI3][Zn(NH3)4]2+ [Pb(CN)4]2-
PF5 SbF52AlF63[Fe(CN)6]3-
新课讲述
学生练习
1.AgCl不溶于水,不溶于硝酸,但溶于氨 水。写出离子方程式。
AgCl+2NH3·H2O=[Ag(NH3)2]2++2Cl-
+H2O
2.Cu(OH)2和NH
是弱碱,
3
混合后碱
性怎
样变化?写出离子方程式。
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH碱性增强。
新课总结
三、配合物的空间构型
形成条件:两种或两种以上配位体。
交流与讨论
四、配合物的同分异构现象
几何异构
交 流 与 1. 怎样判断顺式和反式? 讨 论 2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表.
配合物 顺式 反式
结构式
Cl Cl
Pt
NH3 NH3
Cl
➢解: 分别取二种溶液少许,向其中分别滴 加 S显O现B4a有象Cl白,2溶色说液沉明稀淀它硝生们酸成虽,,然其C化中o学S[OC式4o(相NBHr同3()N,5]HB但3r)结无5] 构明 不同,因此互为同分异构体。
无机化学 第十一章配合物结构

配合物是具有空的价层轨道的原子或离子(统称中 心原子)和一组能够给予孤对电子或π电子的分子或离 子(统称配体)以配位键结合而形成的具有一定稳定性和 空间结构的化合物。 配合物不一定是离子,也可以是中性分子。 配体中只有一个配位原子叫单齿配体,有多个配 位原子的叫多齿配体(又分双齿、三齿、四齿等等)。由 多齿配体形成的配合物又被形象地叫做螯合物。
顺反异构:平面四边形和八面体的配合物中配位体不
止一种时,相同配体处于对位(180°)则为“反式”, 相同配体处于邻位(90°)则为“顺式”。(p339) 组成为[MX2Y2]、[MX2YZ]的平面四边形和组成为 [MX4Y2]、[MX4YZ]、[M(XX)2YZ]、[M(XX)2Y2]、 [MABCDX2] 的八面体配合物有顺反异构体。
配合物的异构现象
11.2.1 构造异构
构造异构(structural isomerism)是由原子间连 接方式不同引起的异构现象。
1)溶剂异构 溶剂分子在配合物内外界分布不同而引起的异构现 象叫溶剂异构。溶剂为水,则叫水合异构。 例如: [Cr(H2O)6]Cl3、 [Cr(H2O)5Cl]Cl2· 2O 和 H [Cr(H2O)4 Cl2]Cl· 2O 2H
..
N
.. ..
N N
..
2
NOH
+ Ni2+
NOH ..
H3C 镍试剂 (双齿配体) 氮是配位原子(电子对给予体)
镍离子与镍试剂形成的配合物
Ni(CN)42-、CuCl42-也是平面四边形的配离子。
镍和铜也形成四面体形的配合物,例如它们的
四氨合物、NiCl42-这时配原子的电子对进入中心原
子的一个s轨道和3个p轨道,形成sp3杂化轨道。锌的
第 5 章 配合物结构

配位数为六配合物
配位数为六的配合物绝大多数是八面体构型,
d区过渡金属一般均为该配位构型
配位数为七及以上的配合物
高配位数的配合物一般中心离子为稀土金属离子
配位数 2
4
6
空 间 构 型
直线形 3
四面体 平面正方形 八面体 5
配位数 空 间 构 型
三角形
四方锥
三角双锥
配合物的异构现象
结构异构
原子间连接方式不同引起的异构现象
若H和H’反向,即κ<0(~-10-6)的物质称为反磁 性或抗磁性物质; 若H和H’同向,即κ>0(~10-3),顺磁性物质;
κ=103~104,铁磁性物质
抗磁性物质中全部电子均配对,无永久磁矩,如H2,He。 顺磁性原子或分子中有未成对电子存在,如O2,NO等, 存在永久磁矩,当无外磁场时,无规则的热运动使磁 矩随机取向,当有外磁场时,磁矩按一定方向排布, 呈现顺磁性。 铁磁性在金属铁或钴等材料中,每个原子都有几个有 未成对电子,原子磁矩较大,且有一定的相互作用, 使原子磁矩平行排列,是强磁性物质。
几何异构:配体对于中心离子的不同位置。
顺式(cis)异构体 棕黄色,极性分子
反式(cis)异构体 淡黄色,非极性分子
顺铂是已经临床使用的抗癌药物
配体处于相邻位置为顺式结构(cis isomer),配体处于 相对位置,称为反式结构(trans isomer)。配位数为2的 配合物,配位数为3与配位数为4的四面体配合物, 配体 只有相对位置,因而不存在反式异构体;在平面四边 形和八面体配位化合物中,顺-反异构是很常见的。
在八面体配合物中,MA6和MA5B显然没有异构体。 在MA4B2型八面体配合物有顺式和反式两种异构体:
配合物的结构.

配体异构
这是由于配体本身存在异构体, 导致配合单元 互为异构。如: 1, 3-二氨基丙烷(H2N-CH2-CH2-CH2-NH2) 1, 2-二氨基丙烷(H2N-CH2-CH(NH2)-CH3) 是异构的配体, 它们形成的化合物 [Co(H2N-CH2-CH2 -CH2-NH2)Cl2]及 [Co(H2N-CH2-CH(NH2)-CH3)Cl2]互为异构体。
(3)Linkage isomers
键合异构
当一个单齿配位体不止一种可配位原子时,则可 分别以不同种配位原子与中心原子键合。
NCS-, 异硫氰酸根 亚硝酸根
SCN-, 硫氰酸根 硝基
键合异构体(linkage isomer):连接的原子不同
O
O
O N
N
O
H 3N H 3N
Co NH 3
NH 3 NH 3
2-1影响中心原子的配位数因素 中心原子对配位数的影响: Ⅱ
a)一般而言,中心离子电荷越高,吸引配位的能力越强,配位 数也越大。例如,金属铂有两种价Pt(Ⅳ)和Pt(Ⅱ)。形成 配合物时,高价态的Pt(Ⅳ)的配位数通常是6,[PtCl6]2-;低
2价态的Pt(Ⅱ)的配位数通常为 Ⅳ 4 ,如[PtCl4] .
配位数为1,2,3的配合物数量很少。配位数为1的配合物一 般是在气相中存在的离子对。目前发现的两个含一个单齿配体 的配合物,2,4,6-triphenylphenylcopper(2,4,6-三苯基苯基酮)和 2,4,6-triphenylphenylsilver(2,4,6-三苯基苯基银)。这事实上是一 个有机金属化合物,中心原子与一个大体积单齿配体键合。
(帽在八面体的
(帽在三棱柱的
(正方形-三角形帽结构投影)
配合物的结构

6 2g
t 26g e1g
3 3
1 2
d8
t
e 6 2
2g g
3
d9
t
e 6 3
2g g
4
3 4
-12Dq -6 Dq
t 26g eg2 t 26g eg3
3 4
3 4
d10 t36geg4
5
5
0 Dq t26geg4
5
5
CFSE
-4Dq -8Dq -12Dq -16 Dq+P -20 Dq+2P -24 Dq+2P -18 Dq+P -12Dq -6 Dq 0 Dq
4 5.62 高 外轨型 sp3d2
晶体场稳定化能(CFSE)
1.晶体场稳定化能(CFSE)的定义
d电子从未分 裂的d轨道进入分 裂后的d轨道,所 产生的总能量下降 值。
2.CFSE的计算
n1:t 2
n2:e
轨道中的电子数
g
轨道中的电子数
g
mm12::八球面形体体场场中中,,dd轨轨道道中中的的成成对对电电子子数数
排布原则:(1)能量最低原理 (2)Hund规则 (3)Pauli不相容原理
电子成对能(P):两个电子进入同一轨 道时需要消耗的能量。
强场:o > P 弱场:o < P
八面体场中电子在t2g和eg轨道中的分布
八面体场中电子在t2g和eg轨道中的分布
高自旋
低自旋
例:
o /J
P/J 场
Co3+的价电子构型
八面体场中 d 电子排布
未成对电子数 实测磁矩/B.M
自旋状态 价键理论 杂化方式
[Co(CN)6]367.524 ×10-20 35.250 ×10-20
化学原理5配合物结构682606192

配位体:
配离子中和中心离子结合的含孤电子对的离子或 分子,配位体(ligand)可以是中性分子(如H2O、 NH3等),也可以是阴离子(如:Cl-、CN-等) 。其 中直接同中心离子相连接的原子称为配位原子。
只有一个配位原子的配位体称为单齿配位体(或 单基配位体)。含有多个配位原子的配体称为多齿配 位体(或多基配位体)。
sp杂化
配位数为4的配合物
四面体构型
sp3杂化(如
两种构型
Be2+)
平面四方形构型 dsp2杂化
由中心离子的价层电子结构和配位体性质决定
1s
2s
2p
Be2+
[BeX4]-
X-
X- X- X-
Ni2+ 等d轨道未充满的离子4配位时,就可 能有两种构型;
3d
4s
4p
Ni2+
可能sp3杂化形成四面体构型,此时磁矩约为 2.83B.M.
例:[PtCl3NH3]-
三氯 ·氨合铂(II)离子
[CoCl(SCN)(en)2]+ 一氯 ·硫氰酸根 ·二
(乙二胺)合钴(III)离子
当中性分子不止一种时,则按配位原子 元素符号的拉丁字母顺序排列
[Co(NH3)5H2O]3+ 五氨·水合钴(Ⅲ)离子
(2) 含配位阴离子的配合物的命名
命名次序为:①配体 ② 中心原子 ③ 外界 的金属离子。在②和③之间加“酸”字。
配合物的异构现象:拥有相同化学式而结构 不同的配合物,其性质必然不同。
空间异构
几何异构 旋光异构
结构异构 [Cr(H2O)6]Cl3
1. 几何异构(顺反异构):
配合物结构的空间构型
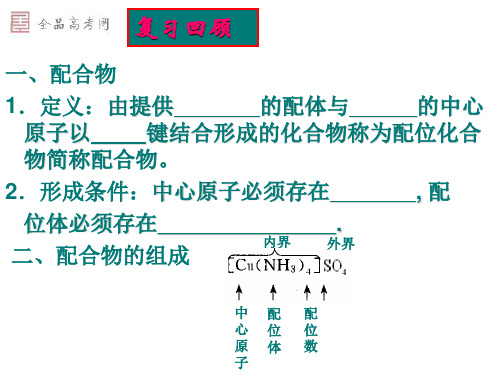
3 正三角形
4 正四面体型
4 平面四边型
5 三角双锥体
5 四方锥体
6
八面体
6
八面体
通式
ML2±
ML3± ML4± ML4± ML5± ML5± ML6± ML6±
实例
[Ag(NH3)2]+
[HgI3][Zn(NH3)4]2+ [Pb(CN)4]2-
PF5 SbF52AlF63[Fe(CN)6]3-
新课讲述
sp
中心原子杂化方式
sp
配位数
2
银的化 合价
+1
形状
直线型
活动与探究
试用杂化轨道理论分析下列配合物的空 间构型 [Zn(NH3)4]2+
[Ag(CN)2]-
[HgI3][Ni(CN)4]2-
总结归纳
三、常见配合物的杂化方式、配位数及空间构型
中心原子杂化 配位数
方式
Sp
2
形状 直线型
Sp2 Sp3 *dsp2 * sp3 d *dsp3 * sp3 d2 * d2sp3
必
定易与Mn+
结合.如
NH3>
3. 形成配合物后,颜色、溶解性、酸碱性、氧化
还原性等都有可能发生改变。
形成现象
几何异构
交 流 与 1. 怎样判断顺式和反式? 讨 论 2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表.
配合物 顺式 反式
结构式
Cl Cl
Pt
NH3 NH3
Cl
NH3
Pt
NH3 Cl
分子极性 在水中溶解 性
第11章 配合物结构

总则: 服从一般无机化合物的命名原则 阴离子在前,阳离子在后; 阴离子为简单离子,则称某化某; 阴离子为复杂离子,则称某酸某; 若外界为氢离子,则缀以“酸”字;
[Co(NH3)6]3+ [Ag(NH3)2]OH H2[PtCl6] [Co(ONO)(NH3)5]SO4 六氨合钴(III)离子
氢氧化二氨合银(I)
4p
3d
3d 7
8
6个 配位键
NH3 NH3 NH3 NH 3 NH3 NH3
外轨型配合物,高自旋
八面体构型
本节小结 内轨型配合物和外轨型配合物的差别
配位键的键能: 内轨型 > 外轨型 配合物的稳定性:内轨型 > 外轨型
几何构型: 内外轨型配合物,杂化方式不同,空间 构型会不同 Ni(NH3)42+ sp3 正四面体 Ni(CN)42 – dsp2 平面四边形
配位化合物的化学键理论
一、价键理论
二、晶体场理论(不要求)
一 、价键理论
1、配合物价键理论的要点:
1)中心原子(或原子M ):有空轨道
配体L:有孤对电子
二者形成配位键ML
2)中心原子采用杂化的空轨道形成配位键 3) 配合物的空间结构,配位数, 磁矩,稳定性 等主要决定于杂化轨道的数目和类型。
价键理论的核心“认为中心原子与配位原子 是通过杂化了的共价配位键而结合的”。
sp3d2杂化,八面体构型
2.内轨型配合物:
配合物中心原子(n-1)d 电子发生重排,电子挤入少 数(n-1)d 轨道。提供少量空的(n-1)d轨道和ns、 np组成的杂化空轨道与配体结合成配键 . 例:[Ni(CN)4]2- , Ni 2+:3d8。
↑↓ ↑↓ ↑↓ ↑ ↑ 3d
《配合物结构》课件

中心金属原子或离子与两个以上配位体通过桥键相连而形成的结构。
配合物的性质
1 颜色
配合物由于电子结构的特 殊性质,通常具有丰富多 彩的吸收光谱。
2 稳定性
配合物的稳定性取决于中 心金属原子或离子与配位 体之间的配位键强度。
3 光谱性质
配合物具有独特的红外光 谱、紫外光谱和核磁共振 光谱等特征。
《配合物结构》PPT课件
The world of complex coordination compounds awaits! Explore the fascinating structures and properties of coordination compounds in this comprehensive presentation.
应用
1
金属催化
配合物在有机合成和工业催化过程中起到重要的催化作用。
2
药物设计
配合物作为药物的载体和靶向输送系统,具有广泛应用的前景。
3
光触媒
配合物的光敏性能使其成为光催化反应中的重要催化剂。
结论
1 配合物的重要性
配合物在化学领域中具有重要的地位和广泛的应用价值。
2 发展前景
随着科学技术的进步,配合物的研究将为我们带来更多的发现和创新。
配位型的分类
根据配位体与中心原子之间的配位键类型和数量进行分类。
配位键的类型
配位键的定义
配位体与中心金属原子或离子之间形成的化学键。
配位键的类型
包括配位共价键、配位离子键和配位金属键。
配合物的结构
简单配合物的结构
中心金属原子或离子与少数配位体形成的简单结构。
碳基配合物的结构
中心金属原子或离子与一个或多个碳基配体形成的结构。
配合物结构

第十一章配合物结构一、教学基本要求1、熟悉配合物价键理论的基本要点,掌握用价键理论说明配合物的空间构型。
2、了解配合物的磁性、空间构型、内轨型、外轨型配合物等基本概念。
二、主要内容(一)配合物的空间构型1、配合物的空间构型是指配位体在中心离子(或原子周围)排布的几何构型。
2、测定方法:实验测定、普遍采用X射线衍射。
3、配合物空间构型不仅取决于配位数,还与中心离子和配位体的种类有关。
配合物空间构型与配位数的关系见表11- 1。
(二)配合物的磁性1、配合物的磁性是配合物的重要性质之一,它对配合物结构的研究提供了重要的实验依据。
2、含有未成对电子的的配合物具有顺磁性。
不含有未成对电子的的配合物具有反磁性。
3.通常用物质的磁矩(μ)来表示顺磁性配合物在磁场中产生的磁效应。
μ=√n(n+2) B.M n—未成对电子数磁矩可借助磁天平测得,通过其可以确定未成对电子数。
(三)配合物的价键理论1、配合物的价键理论的要点:a.在配合物中,中心离子(或原子)与配位体以配位键结合,即配位体的孤对电子进入形成体的空的价电子轨道。
b.形成体以杂化轨道接受配位体提供的孤对电子。
c.不同类型的杂化轨道具有不同的空间构型。
见表11-1表11-1 配合物的空间构型与杂化轨道类型2、按照价键理论讨论配合物结构的基本思路:a.由实验测得的磁矩算出未成对电子数。
b.推测中心离子的价电子的分布情况和采取的杂化方式。
c.确定配合物是内轨型还是外轨型。
d.解释配合物的相对稳定性。
+例:对配合物[CoF6]3-和[Co(CN)6]3-的讨论配合物以知磁矩μ/B.M.未成电子数nCo3+的价电子排布中心离子的杂化分式配合物的类型相对稳定性[CoF6]3- 5.26 4 ↑↓↑↑↑↑—————sp3d2外轨型较高[Co(CN)6]3-0 0 ↑↓↑↓↑↓d2sp3内轨型较低。
第四章 配合物结构

Fe(CN)
4− 6
[Co(NH 3 ) 5 (H 2 O) ]3+
螯合物:一个中心离子与多齿配体成键形成的具有环状
结构的配合物。
螯合剂:能形成螯合物的多齿配体。
螯合剂中常含有 N、O、S、P等配位原子。 螯合物的稳定性高,应用广泛。 如 [Cu(en)2]2+ CaY2- (Y—EDTA)
2011年1月15日2 时27分
影响配位数的因素
(1)中心离子的电荷数 ) 中心离子的电荷数 常见配位数 (2)中心离子的半径 ) 周期 最高配位数 (3)配体的半径 ) 一般而言,配位数随着配体半径的增加而减少。 一般而言,配位数随着配体半径的增加而减少。 例: [AlF6]3[AlCl4]1 2 2 4 3 6 4 6 5 8 +1 2 +2 4 +3 6 +4 8
(4)外界条件(浓度、温度) )外界条件(浓度、温度) 一般,配体浓度越大,反应温度越低, 一般,配体浓度越大,反应温度越低,有利 于形成高配位的配离子。 于形成高配位的配离子。
2011年1月15日2 时27分
三、配位化合物的命名
1、 含配阳离子的配合物:外界+“化”+内界。 含配阴离子的配合物:内界+“酸”+外界。 2、 内界或电中性配合物:配体+“合”+中心离子(或原子)。 3、 配体中,先阴后中,且不同配体间用“•”分开。 4、 配体个数用:一、二、三等表示。 5、 中心离子(原子)的氧化值用带括号的罗马数字表示, 如(II)、(IV)、(VII)等。 注意:OH——羟基;CO——羰基。
2011年1月15日2 时27分
二、配位化合物的组成
由配离子组成的 配合物是由内界 配合物是由内界 和外界组成。 外界组成。 组成 电中性的配合物 只有内界。 只有内界。 如:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、配合物的异构现象
1. 几何异构现象 按照配体对于中心离子的不同位置区分。
cis-[PtCl2(NH3)2]
顺式 棕黄色,极性分子 trans-[PtCl2(NH3)2] 反式 淡黄色,非极性分子
顺式Pt(Ⅱ)配合物显示治癌活性。
思考: ① 配位数为4的正四面体结构的配位 化合物是否有顺、反异构体? ② 配位数为6的八面体结构的配位化 合物是否有顺、反异构体?
o < P
弱场
t2g
强场低自旋 弱场高自旋
t2g
磁矩小
磁矩大
思考题
1. 内轨型、外轨型配合物与高低自旋状
态之间有什么关系?
思考题
2. 利用光谱化学序列确定下列配合物的配体哪
些是强场配体,哪些是弱场配体?并确定d电
子的排布及未成对电子数。
[Co(NO2)6]3[W(CO)6]
= 0 B.M.
第十一章
配合物结构
§11.1 配合物的空间构型、
异构现象和磁性 §11.2 配合物的化学键理论
§11.1
配合物的空间构型、 异构现象和磁性
一、 配合物的空间构型
配合物的空间构型:配体围绕中心离子排布的几何构 型 一般规律
1. 中心离子在中间,配体围绕中心离子排布
2. 配体倾向于尽可能远离
配合物的空间构型与配位数的多少密切相关
异构体
化学组成相同,但结构不同的物质
二、配合物的异构现象
立体异构 异构
立体异构体有着同样的原子, 同样的化学键,但是这些键 在空间的相对取向不同
结构异构
结构异构体有着同样的原子, 不同的化学键
二、配合物的异构现象
几何异构 立体异构 旋光异构 异构 电离异构(水合异构) 结构异构 键合异构 配位异构 配体异构
4. 八面体场中中心离子的 d 电子排布 eg
t2g
排布原则:(1)能量最低原理
(2)Pauli不相容原理 (3) Hund规则
电子成对能(P)
当中心离子的一个d轨道中已有一个电子, 另一个电子继续进入与之配对时,必须克服电 子间的相互排斥作用,所需之能量叫做电子成 对能
以d 4为例 o < P o > P
0
1
2
3
4
5
µ /B.M. 0 1.73 2.83 3.87 4.90 5.92 [Ti(H2O)6]3+ K3[Mn(CN)6] K3[Fe(CN)6] Ti3+: 3d1 n = 1 µ = 1.73 实 n = 2 µ = 3.18 实 n=1 µ = 2.40 实
Mn3+:3d4 Fe3+ 3d5
μ= 5.9B.M. n= 5
外轨型配合物
同一中心离子的内轨型配合物比外轨型配合物稳定
例:[Fe(CN)6]3μ= 2.4B.M. 内轨型配合物
lgK
例:[FeF6]3μ= 5.9B.M. 外轨型配合物
lgK
f
f
([Fe(CN)6]3-) = 52.6
([FeF6]3-) = 14.3
已知: [Co(H2O)6]2+ = 4.3 B.M.
配位数
2
3
4
空 间 构 型
例
Ag(NH ) 3 2
HgI
3
NiCl
2 4
Ni(CN ) 4
2
配位数 空 间 构 型
5
6
例
Fe(CO)
5
SbCl
2 5
Fe(CN)
3 6
配合物的空间构型不仅仅取决于配位 数,还与中心离子以及配体有关
二、配合物的异构现象
异构现象
化学组成相同的配合物可以不同结构存在
二、晶体场理论
1. 晶体场理论要点
在配合物中,中心离子M处于带负电荷的配体L形 成的静电场中,二者完全靠静电作用结合在一起 晶体场对M的d 电子产生排斥作用,使M的d 轨道发 生能级分裂,有些d轨道能量升高,有些则降低 在空间构型不同的配合物中,配体形成不同的晶体 场,对中心离子d轨道的影响也不相同
μ= 0
n=0
[NiCl4]2-的空间构型为四面体,μ=2.83B.M.
28Ni:3d84s2
μ= 2.83
n=2
4. 配位数为 6 的配合物
这类配合物绝大多数是八面体构型,形成体可能采取d2sp3 或sp3d2杂化轨道成键。 例:[Fe(CN)6]3μ= 2.4B.M. n= 1 内轨型配合物 例:[FeF6]326Fe:3d64s2
eg
tቤተ መጻሕፍቲ ባይዱg
排布规律:
o < P 中,电子优先占据不同的轨道;
eg t2g
o > P 中,电子最后占据eg轨道。
eg
t2g d1 eg t2g d2
eg t2g d3 eg
eg t2g
eg
t2g
d9
t2g d8
d10
d5
o > P 强场
d6 eg t2g eg eg t2g eg
d7 eg t2g eg t2g
[Co(EDTA)]- = 0 B.M.
判断分子构型并用杂化轨道理论解 释
[Co(H2O)6]2+ [Co(EDTA)]-
sp3d2 d2sp3
5. 对价键理论的评价
很好地解释了配合物的空间构型、磁性、稳定 性,直观明了 无法解释配合物的颜色(吸收光谱)
无法解释配合物的稳定性随Mn+的d电子数目 的多少而变化 Fe3+的外轨配合物动用了高能量的4d轨道似乎 不大可能
n(n 2)
n:未成对电子数
单位:玻尔磁子(B.M.) 顺磁性-被磁场吸引 n > 0 , µ > 0 例:O2,NO,NO2 反磁性-被磁场排斥 n = 0 , µ = 0 例: H2,N2 铁磁性-被磁场强烈吸引 例:Fe,Co,Ni
根据 n
n ( n 2 ) 可用未成对电子数目n估算磁矩µ
颜色的深浅与跃迁电
子数目有关
配合物的吸收光谱
[Ti(H2O)6]3+溶液 [Ti(H2O)6]3+溶液的吸收光谱
3.影响分裂能的因素(中心离子,配体,晶体场) (1)中心离子
[Cr(H2O)6]3+ [Cr(H2O)6]2+
o /cm-1
o /cm-1 o /cm-1
17600
[Fe(H2O)6]3+ 13700 [CrCl6]313600
NO2
H 3N Pt
NH3
NO2
H 3N NO2
NO2
面-(fac-)
经-(mer-)
2. 旋光异构现象(光学异构) 由于分子的特殊对称性形成的两种异构体而引起 的旋光性相反的现象。 两种旋光异构体互成镜像关系。 具有旋光性的分子称为手性分子。 例:[CoCl2(en)2]+
三、配合物的磁性
磁 磁 性-物质在磁场中表现出来的性质 矩
2. 配位数为 2 的配合物 [Ag(NH3)2]+的空间构型为直线形,μ= 0
47Ag:4d105s1
例:[AgCl2]-,[CuCl2]-
3. 配位数为 4 的配合物
[BeX4]2-的空间构型为四面体
4 Be:1s22s2
[Ni(CN)4]2-的空间构型为平面正方形,μ= 0
28Ni:3d84s2
14000
[Fe(H2O)6]2+ 10400 [MoCl6]319200
电荷Z增大, o增大; 主量子数n增大, o增大
(2) 配体的影响:光谱化学序列
[CoF6]3[Co(H2O)6]3+ 18600 [Co(NH3)6]3+ 22900 [Co(CN)6]334000
o /cm-1
13000
[Fe(CN)6]3[FeF6]3-
5.晶体场理论的应用
解释配合物的磁性
解释配合物的颜色(吸收光谱) 解释配合物的稳定性 解释离子水合热变化规律
小结
配合物的空间构型 n=2,3,4,5,6 配合物的磁性
配合物的价键理论
中心离子采取杂化轨道与配体成键
n(n 2)
晶体场理论
配体形成静电场,对金属离子的d轨道产生排斥,使d 轨道发生能级分裂 分裂能的影响因素:中心离子、配体、晶体场
习题
Page 367 3、6、7、8、10
§11.2 配合物的化学键理论
一、 价键理论
1. 价键理论的要点
(1) 形成体(M):有空轨道 配体( L):有孤对电子 二者形成配位键 M L
(2) 形成体(中心离子)采用杂化轨道与配体成键
(3) 不同类型的杂化轨道具有不同的空间构型
杂化轨道的类型与空间构型
配位数 2 3 4 4 5 5 6 杂化轨道 sp sp2 sp3 dsp2 dsp3 d2sp2 d2sp3, sp3d2 空间构型 直线形 三角形 正四面体 平面正方形 三角双锥 四方锥 八面体
各种配体对同一M产生的晶体场分裂能的值由小到大的顺序 I-<Br-<Cl-,SCN-<F-<OH-<C O 2<H O<NCS2 4 2
<edta<NH3<en<bipy<phen<SO32-<NO2<CO, CN-
光谱化学序列
(3)晶体场类型的影响
在八面体场和四面体场d轨道的分裂情况不同,且Δ 值也不同
2. 八面体场中中心离子d轨道的分裂
在八面体型的配合物中,6个配体分别占据八面
体的6个顶点,由此产生的静电场叫做八面体场
L L L L L L
自由金属离子d轨道的角度分布图
