乙烯乙炔谁更容易发生加成反应
用化学方法鉴别乙烷乙烯乙炔

用化学方法鉴别乙烷乙烯乙炔乙烷(C2H6)、乙烯(C2H4)和乙炔(C2H2)是碳和氢组成的有机化合物,它们的分子结构和化学性质有所不同。
下面将介绍一些鉴别这三种化合物的化学方法。
1. 燃烧试验:乙烷、乙烯和乙炔在氧气中燃烧会产生不同的反应。
乙烷完全燃烧的化学方程式为C2H6 + 7/2 O2 > 2 CO2 + 3 H2O;乙烯完全燃烧的化学方程式为C2H4 + 3 O2 > 2 CO2 + 2 H2O;乙炔完全燃烧的化学方程式为2C2H2 + 5 O2 > 4 CO2 + 2 H2O。
因此,通过观察燃烧时产生的气体生成物,可以区分这三种化合物。
2. 碘化试验:乙烷、乙烯和乙炔在碘化亚铜溶液中反应会得到不同的产物。
乙烷和乙炔不会与碘化亚铜反应,而乙烯会使溶液从蓝色变为深红色。
这是因为乙烯能够参与亲电加成反应,与碘化亚铜反应生成红色的乙烯铜络合物。
3. 溴化试验:乙烷、乙烯和乙炔可以通过与溴的反应进行区分。
乙烷和乙烯与溴反应较慢,需要加热才能触发反应,产生溴化乙基或溴化乙烯。
乙炔则能够迅速与溴反应,在常温下生成二溴乙烯。
这是因为乙炔中含有两个炔键,具有较高的反应活性。
4. 熏蒸试验:乙烷、乙烯和乙炔可以通过醋酸铜粉的熏蒸试验进行鉴别。
醋酸铜粉吸附能力的大小与化合物的不饱和程度有关。
乙炔由于含有最多的不饱和键,与醋酸铜粉反应最明显;乙烯次之;乙烷几乎不与醋酸铜粉发生反应。
以上是一些通过化学方法鉴别乙烷、乙烯和乙炔的常用实验。
需要注意的是,实验条件、反应物浓度和观察方法等都可能对实验结果产生影响,因此在实施实验时应根据具体情况进行调整和判断。
总结起来,通过燃烧试验、碘化试验、溴化试验和熏蒸试验等化学方法,可以鉴别乙烷、乙烯和乙炔这三种化合物。
这些方法是基于不同化合物的分子结构和化学性质的差异,通过观察不同产物或反应情况来进行鉴别。
同时,需要注意实验条件和操作方法,以确保结果的准确性。
乙烷乙烯乙炔的鉴别

乙烷乙烯乙炔的鉴别一、引言乙烷、乙烯和乙炔都是有机化合物中常见的碳氢化合物。
它们在化学性质、物理性质和结构上有一定的区别。
准确地鉴别乙烷、乙烯和乙炔对于理解它们的性质和应用具有重要意义。
本文将介绍乙烷、乙烯和乙炔的一些特征,以方便进行鉴别。
二、乙烷、乙烯和乙炔的特征1. 乙烷乙烷是一种无色、无臭的气体,化学式为C2H6。
乙烷是一种饱和烃,由两个碳原子和六个氢原子组成。
以下是乙烷的特征: - 燃烧:乙烷能够燃烧,生成二氧化碳和水。
- 反应性:乙烷是相对稳定的,不容易参与其他化学反应。
- 储存:乙烷应储存在密闭容器中,避免泄漏。
2. 乙烯乙烯是一种无色、具有刺激性气味的气体,化学式为C2H4。
乙烯是一种不饱和烃,由两个碳原子和四个氢原子组成。
以下是乙烯的特征: - 燃烧:乙烯能够燃烧,生成二氧化碳和水。
1- 反应性:乙烯具有较高的反应活性,可与其他物质发生加成反应。
- 应用:乙烯是许多塑料和合成化学品的重要原料。
3. 乙炔乙炔是一种无色、具有类似洋葱的气味的气体,化学式为C2H2。
乙炔是一种不饱和烃,由两个碳原子和两个氢原子组成。
以下是乙炔的特征: - 燃烧:乙炔能够燃烧,生成二氧化碳和水。
- 反应性:乙炔具有很高的反应活性,容易参与燃烧、加成、聚合等化学反应。
- 应用:乙炔是焊接、切割和金属加工中常用的燃料。
三、乙烷、乙烯和乙炔的鉴别方法1. 使用气味鉴别•乙烷:乙烷无臭。
•乙烯:乙烯有刺激性气味。
•乙炔:乙炔具有类似洋葱的气味。
2. 燃烧试验•乙烷:乙烷能够完全燃烧,产生蓝色火焰。
2•乙烯:乙烯能够燃烧,但燃烧不完全,产生黄色火焰。
•乙炔:乙炔能够燃烧,产生亮丽的蓝色火焰。
3. 进一步鉴别•乙烷、乙烯和乙炔的化学结构不同,可以利用化学试剂进行判定。
例如,可以使用溴水进行试验,乙炔可被溴水迅速分解生成溴化氢。
四、结论通过气味鉴别、燃烧试验和进一步的化学试验,可以准确地鉴别乙烷、乙烯和乙炔。
卫校有机化学习题集 -习题及答案

《有机化学》习题集(供“业余专科”药学、中药学专业学生使用)专业:学号:姓名:第一章绪论一、选择题1.下列为无机化合物的是()。
A .CH3CH2OH B.(NH4)2CO3C.CH3COOH D.2.下列物质中属于有机化合物的是()。
A.CH4B.NaHCO3C.CO2D.HCl3.是有机物特性的为()。
A.易燃B.熔点高C.易溶于水D.反应较快4.不属于共价键参数的是()。
A .键长B.键能C.键角D.电子云5.共价键异裂能产生()。
A .自由基B.游离基C.原子团D.阴、阳离子6.分子式为C4H8和C6H12的两种烃属于()。
A .同系列B.不一定是同系列C.同分异构体D.既不是同系列也不是同分异构体7.有机化学是研究()的化学A .碳氢化合物B.碳氢化合物及其衍生物 C .碳 D .有机器官8.下列与有机物特点不符合的是()A.熔点较低B.易溶于有机溶剂C.产物较简单D.反应速度较慢二、名词解释同分异构体官能团三、填空题1.有机化学是研究有机化合物的、、、、以及它们之间的相互关系和变化规律的科学。
2.有机化合物的特性是、、、、、、。
3.自由基反应中,反应物的共价键发生裂;离子型反应中,反应物的共价键发生裂。
4.有机化合物中,原子间一般通过____键和____键结合。
其中____键易受外界影响,性质活泼。
四、简答题π键是怎样构成的?它有哪些特点?σ键是怎样构成的?它有哪些特点?五、判断对错(对的打“√”,错的打“×”)1.含-OH的化合物是醇。
()2.σ键可绕键轴旋转,π键不可绕键轴旋转。
()3.NaCN是无机化合物,CH3CH2CN是有机化合物。
()4.非极性共价键分子的偶极矩为零,极性共价键分子的偶极矩不为零。
()5.H 2CO 3分子中既含有碳又含有氢,所以碳酸是碳氢化合物。
( )第二章 烷烃和环烷烃、第三章不饱和链烃一、选择题1.分子组成相同,结构不同的物质互为( )A .同素异形体B . 同分异构体C . 同分异构现象D . 同位素2.甲烷分子的构型为( )A . 三角形B . 三角锥形C . 四边形D . 正四面体3.乙烷和溴能发生( )A .取代反应B . 加成反应C . 聚合反应D . 氧化反应4.下列叙述正确的是( )A .戊烷有同分异构体4种B .戊烷与环戊烷互为同分异构体C .戊烷的同分异构体中有一种是2,2-二甲基丙烷D .戊烷的各种同分异构体中都含有仲碳原子5.下列烷烃中沸点最高的是( )。
烯烃、炔烃的化学性质(优秀版)

乙炔的化学性质
思考: 乙烯能聚合成聚乙烯,乙炔呢?
3、加聚反应 导电塑料——聚乙炔
乙炔的化学性质 注意
燃烧
乙炔跟空气
火焰更加明亮并伴有浓烟,在燃的混合物遇
烧过程中放出大量的热,温度
烯 2C2达H320+050O度2以点上燃,用4于C气O2割+气2H焊2O火炸。 会,发在生生产爆
烃
、 炔
和使用乙炔
【快乐体 验】
1、 写出丙烯与溴单质反应的方程式
2、写出丙烯加成聚合反应的方程式
乙炔的结构 乙炔分子中含有碳碳 乙烯分子中含有碳碳
三键,(其中也含两C2H双2键,(其中含一个
个不牢固的共价键) 不牢固的共价键)属
,分也结结子属构构于式上式不具饱和有烃相。H似性C于不:C饱都和H有烃不。 牢 乙固炔的球共棍价模键型,易V断S 裂乙。烯球棍模型
他们一个15岁,一个16岁,花开的季节。初学立体几何,大熊用小纸壳手工助洁心理解立体与平面的迥异,地理考试这对同桌囊括了班里两个第一,大熊94分,第一名,洁心47分, 倒数第一。大熊不知怎么就让无论如何都搞不懂季风洋流方向的洁心尤如神助,醍醐灌顶。洁心盼着上作文课,老师会朗读几篇上榜佳作,每每读到洁心的作文,大熊会看洁心一眼, 好像在说我知道这一篇是你写的,洁心也会漫不经心瞥一眼,故作平淡地回复嗯,是我。不知从何时起,他们走进彼此的心。大学毕业的第二年,他们结了婚,第三年,有了一个可爱 的孩子。洁心的日常开始以大熊小熊为中心,辞去优渥工作,成为家庭主妇,曾经的诗情画意干练要强变成琐碎的柴米油盐酱醋茶,窈窕淑女变成自带三层救生圈的黄脸婆,大熊成为 业内认可的职业经理人,小熊也取得全国乃至世界各大数学竞赛计算机竞赛的各色奖牌。被大熊小熊的光环映着,洁心日复一日忙忙活活庸庸碌碌地快乐着。人和人之间的比较,是丢 失快乐最简单的方式。昔日的同学大多事业有成,成为各自领域的精英,而洁心日渐落伍,好像被抛弃在另一个时代。比较也是客观认识自己最直接的方式。失落带来思考,洁心终于 意识到这十几二十年的岁月她把自己搞丢了。洁心想重回轨道却无力又无助,知识陈旧,书生意气,与社会严重脱节,抱怨,她偏执地认为大熊消耗了她的青春改写了她的命运,而人 到中年的大熊再不会像过去只要听到洁心呼唤,马上放下全世界飞奔而来,事业有成的他也不再对洁心的发号施令全盘言听计从,洁心觉得自己失去了整个世界。洁心没有意识到很多 时候大熊只是在迁就她,不和她计较,也没有意识到一个企业高管若凡事对一个家庭主妇唯命是从究竟是好事还是坏事,她越来越暴躁,越来越容易愤怒,家庭气氛像一只随时会被引 爆的火药桶,说不定什么琐事就会成为导火索。大熊忙碌粗心,洁心心灰意冷,俩人之间有了罅隙,有了不满,洁心不止一次发怒时大喊分手。洁心最脆弱的时候,大熊没有及时给予 支持和关注,洁心撕心裂肺的难过,大熊忙于工作,浑然不觉,洁心认为大熊不再爱自己,痴心错付,悔不当初,对自己的婚姻感到绝望,她给自己7天的时间思考,要不要走出这曾 欣欣然冲进来的围城。一位生性爱冒险的作家本杰明,无法走出半年前的丧妻之痛,带着一个青春期一个幼儿期的两个孩子,生活一团糟。本杰明放弃了专栏写作,拒绝开始新感情, 欲带着儿女换一个崭新环境开始新生活,于是他买了新房子,未曾想这房子却是一个经济窘迫、难以维系正常运转的动物园……本杰明走投无路之时,发现妻子给留下的“冒险基金”, 妻子自知无法常相陪伴,竭尽所能给丈夫最后的成全,这份爱让人唏嘘汗颜。本杰明给一双儿女讲述他和妻子初次见面,一见钟情,自惭形秽,踌躇不前时,自己骨子里天生的冒险精 神推着自己抓住了这份非你莫属的爱情。看着本杰明和一双儿女对着阴阳相隔的妻子、妈妈,互诉衷肠,洁心百感交集,泣不成声,她想世人听过见过无数美丽的爱情故事,但都是别 人的,现实的生活总会有种种难言的苦楚不如意,“万物皆有裂痕,那是光照进来的地方。”接受人和事的缺憾不完美,才是真实的生活。发起冷战的第三天,洁心不再继续臆想徒生 闷气,她决定给彼此一个机会,和大熊进行了一次推心置腹长谈,长谈的结果是洁心庆幸失而复得的婚姻和爱情,大熊说洁心没失去过,自己一直都在,从未离开,只是不该忽视了洁 心的内心需求。洁心开始找回自己的人生旅程,列清单,定目标,开始学习、锻炼、尝试,由内而外改变自己,每晚洁心大熊两人瑜伽对望,相伴练习腹肌撕裂。假期里,大熊更多地 陪伴洁心,两人相濡以沫走遍千山万水,洁心开始一展所长,用文字记录下他们的所见所闻,所感所悟。人到中年,两人相互珍惜,共同成长,生命和爱情焕发出绚丽光彩,照亮了彼 此的人生,很多小伙伴说因为他们,自己又开始相信并渴望爱情了。一日,,麦克是校园篮球明星,他本可以因篮球特长被全额奖学金保送进大学,但因女友怀孕他放弃了关键的冠军 赛而向女友求婚。20年后,麦克穷困潦倒,事业家庭均失意,戏剧性地他重返了17岁,仍是青春闪耀,17岁的他遇到现实中的一对儿女,中年的妻子,一切重来,当他又站在可以延 续辉煌改变人生命运的关键时刻,他意识到妻子和一双儿女才是他人生最宝贵的财富,依旧做出了和20年前相同的选择。当麦克和妻子紧紧相拥时,麦克又恢复了中年的模样,妻子说,
化学5问答剖疑问答2 烃和卤代烃问答剖疑 含解析

【难点问答】1.烷烃分子里碳原子跟碳原子以单键结合成链状时呈直线吗?【答案】烷烃分子中,以任意一个碳原子为中心都是四面体结构,所以,烷烃分子中的碳原子并不在一条直线上,直链烷烃中碳原子跟碳原子结合的结果是呈锯齿状的长链.2。
脂肪烃的物理性质有什么变化规律?【答案】(1)所有的烃都不溶于水而易溶于苯、乙醚等有机溶剂,其密度比水小.(2)分子里碳原子数≤4的脂肪烃在常温常压下都是气体,其他脂肪烃在常温常压下是液体或固体(新戊烷除外),随着分子中碳原子数的增加,常温下脂肪烃的状态也由气态逐渐过渡到液态或固态。
(3)烃类的熔、沸点一般较低,其变化规律如下:组成与结构相似的物质(同系物),相对分子质量越大,其熔、沸点越高;相对分子质量相近或相同的物质(如同分异构体),支链越多,其熔、沸点越低;组成与结构不相似的物质,当相对分子质量相同或相近时,分子的极性越大,其熔、沸点越高。
3。
乙烯既能使溴水褪色,又能使酸性高锰酸钾溶液褪色,其原理是否相同?能用溴水或酸性高锰酸钾溶液除去乙烷中混有的乙烯吗?【答案】不同,乙烯能使溴水褪色是因为与溴水发生了加成反应:+Br2CH2BrCH2Br;使酸性高锰酸钾溶液褪色是因为发生了氧化还原反应;能用溴水,但不能用酸性高锰酸钾溶液除去乙烷中混有的乙烯,因为乙烯会被酸性高锰酸钾溶液氧化成二氧化碳气体,从而产生新的杂质。
4。
下列两个反应均可得到氯乙烷:CH3CH3+Cl 2CH3CH2Cl+HCl 、+HCl CH3CH2Cl,从产率和纯度的角度考虑,哪一种方法更好?【答案】第二种方法更好。
因为乙烷与氯气的取代反应为连锁反应,很难控制在某一阶段,副反应多,得到的是多种氯代乙烷和氯化氢的混合物,且产率低;第二种方法无副反应,产物较纯,产率高。
5.如何鉴别烷烃和烯烃?【答案】可用溴的四氯化碳溶液(或溴水)或酸性高锰酸钾溶液进行鉴别,能使二者褪色的为烯烃,不能使二者褪色的为烷烃.6.如何比较烷烃、烯烃的结构和化学性质?【答案】烷烃的特征反应是取代反应;烯烃的特征反应是加成反应.烷烃烯烃通式C n H2n+2(n≥1)C n H2n(n≥2)代表物甲烷(CH4)乙烯()结构特点全部单键;饱和链烃含碳碳双键;不饱和链烃;键角120°化学性取代反应光照条件下的卤代反应不作要求加成反不能发生能与H2、X2、HX、H2O等质应发生加成反应氧化反应燃烧的火焰不够明亮燃烧的火焰明亮并带黑烟不与酸性KMnO4溶液反应使酸性KMnO4溶液褪色加聚反应不能发生能发生鉴别不能使溴水褪色,不能使酸性KMnO4溶液褪色能使溴水褪色,能使酸性KMnO4溶液褪色7.烷烃能产生顺反异构吗?存在顺反异构现象的分子结构有什么特点?分子式符合C4H8的烯烃的同分异构体(包括顺反异构体)有几种?【答案】(1)烷烃中的碳碳单键能够旋转,不会产生顺反异构现象.(2)存在顺反异构现象的分子中需含有碳碳双键且双键两侧的碳原子上需连接两个不同的原子或原子团,顺式异构和反式异构是以分子中存在不同基团为前提的,每个碳碳双键上的碳原子连接两种不同的原子或原子团,如CH2CH—CH3无顺反异构,两个相对较大的原子或原子团在碳碳双键同侧的为顺式,两个相对较大的原子或原子团在碳碳双键异侧的为反式。
烃

烃烃(2000)4、下列各分子中,构成分子的原子都处于同一直线上的是A、甲烷B、乙烯C、乙炔D、苯(2000)11、下列有机物命名正确的是A、3,3一二甲基丁烷B、2,2一二甲基丁烷C、2一乙基丁烷D、3,4一二甲基戊烷(2000)21、苯与乙烯、乙炔比较,下列叙述中正确的是A、都易发生取代反应B、乙炔、乙烯易燃烧、苯不易燃烧C、都易发生加成反应D、乙烯和乙炔能被酸性高锰酸钾溶液氧化,而苯不能(2000)24、等物质的量下列气体,完全燃烧消耗氧气最多的是A、CH4B、C2H6C、C2H4D、C2H2(2000)33、写出下列反应的化学方程式:(1)实验室用电石跟水反应制乙炔▲ 。
(2001)3、下列物质中,属于有机物的是A、COB、NH4HCO3C、H2CO3D、CH3CH2OH (2001)4、下列分子的空间结构为正四面体的是A、甲烷B、乙烯C、乙炔D、苯(2001)9、烯烃的通式是A、C n H2n+nB、C n H2nC、C n H2n-2D、C n H2n-6 (2001)11、下列关于有机物的命名,不正确的是A、2-甲基戊烷B、2,2-二甲基丁烷C、3,4-二甲基戊烷D、3-乙基戊烷(2001)13、苯的硝化属于A、取代反应B、加成反应C、加聚反应D、消去反应(2001)14、能将苯、甲苯区别出来的试剂是A、水B、溴水C、KMnO4酸性溶液D、氢氧化钠溶液(2001)16、常温下,既能使高锰酸钾酸性溶液褪色,又能使溴水褪色的是A 、乙烷B 、乙醇C 、苯D 、乙烯(2001)20、下列物质中四种碳碳键的键长,由长到短的次序为① ② ③④↓ ↓ ↓A 、②>①>④>③B 、①>②>④>③C 、②>③>④>①D 、②>①>③>④(2001)23、下列物质一定互为同系物的是A 、CH 4和C 3H 8B 、C 2H 4和C 4H 8C 、CH 2O 2和C 2H 4O 2D 、C 3H 4和C 4H 6(2001)30、化学式为C 7H 12的链烃,其结构简式中不可能A 、只有一个“-CH 3”B 、只有一个“ ”C 、只有一个“C C ”D 、有5个“-CH 2-”(2001)32、将0.12mol 某烷烃与0.78molO 2 混合在密闭容器中引燃,反应结束后,产物中有CO ,若再向原容器中通入0.36molO 2,并使之进一步反应,反应完全后,容器中还有O 2剩余,则该烷烃可能是A 、丙烷B 、丁烷C 、戊烷D 、己烷(2001)33、写出下列反应的化学方程式:(1)有镍催化剂存在并加热到180-250℃的条件下,苯与氢气的反应 ▲ 。
高二化学有机化合物的结构与性质

碳碳叁键键能小 于单键键能的3倍、 小于单键和双键的键 能之和。
单键不容易断裂,饱和碳原子性质稳定,烷烃 不能发生加成反应。不饱和碳原子性质较活泼, 烯烃、炔烃容易发生加成反应。
追根寻源
• 甲烷分子的空间构型为什么是正四面体?
• 碳碳双分子中碳碳键为何特殊?
σ键、π键 和大π键
第2节 有机化合物 的结构与性质
联想质疑
燃烧、取代反应 甲烷 燃烧、与高锰酸钾 溶液反应、加成反 应 燃烧、取代反应、 加成反应
乙烯
苯
结构
性质
知识支持 共价键的分类及定义
• 单键:两个原子之间共用一对电子 的共价键。 • 双键:两个原子之间共用两对电子 的共价键。 • 叁键:两个原子之间共用三对电子 的共价键。
位
B、两甲基在不同一个碳原子上
4、主链少三个碳原子
C ∣ C -C - C - C - C - C - C ∣ ∣ C C
4、主链少三个碳原子
C C ∣ ∣ C -C - C - C ∣ ∣ C C
【观察】分子式为C6H14的烷烃在结构式中含有3个 甲基的同分异构体有( )个 ( A ) 2 个 ( B) 3 个 (C)4 个 (D) 5 个
“头碰头”重叠——σ键 “肩并肩”重叠——π 键 苯分子中的大π键
轨道杂化理论: 成键过程中,由于原子间的相互影响, 同一原子中几个能量相近的不同类型的原 子轨道,可以线性组合,重新分配能量和 确定空间,组成数目相等的新的原子轨道
sp杂化 sp2杂化
杂化
杂化
乙烯、乙炔分子中轨道杂化和重叠方式示意图
请你根据上表所提供的数据,从键能和键长的 角度结合乙烷、乙烯和乙炔的性质考虑下列问题, 并与同组同学进行交流和讨论。 1、乙烯为什么容易发生加成反应?
高一化学苏教版2教案:专题3第一单元第三课时乙烯含解析

第三课时乙烯整体设计三维目标1.知识与技能使学生知道乙烯的分子结构,了解乙烯的工业制法和主要性质.了解乙烯的可燃性、加成反应和加聚反应及主要用途。
通过比较乙烯和乙烷的结构及相关实验现象,培养学生观察和类比的思维能力。
2。
过程与方法本课时主要采用实验探究法和提问、启发式教学.3。
情感态度与价值观通过对乙烯性质和用途的介绍,引导学生了解乙烯的重要应用。
培养学生热爱化学的情感。
教学重点乙烯的化学性质.教学难点乙烯的加成反应、加聚反应。
课前准备药品:酸性高锰酸钾溶液、溴的四氯化碳溶液、乙烯气体、甲烷气体。
仪器:试管、贮气瓶、导管、火柴。
教具:乙烷、乙烯的球棍模型.教学过程知识回顾前面我们学习了石油的组成和炼制方法。
石油的成分:(1)组成元素:主要为碳和氢;(2)组成物质:各种烷烃和芳香烃.石油的分馏:通过给石油加热,使低沸点的烃首先汽化,再经过冷凝,使石油分成不同沸点范围的蒸馏产物的方法。
裂化目的:提高轻质油的产量。
裂化原理:在一定条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程.裂解目的:获得更多乙烯、丙烯等基本有机化工原料.裂解原理:比裂化更高的温度,使长链烃断裂成为乙烯、丙烯等气态短链烃。
导入新课工业上可以从石油产品中得到大量的乙烯,它的产量通常是用来衡量一个国家石油化工发展水平的标志。
乙烯有很多用途,例如,过去南方的水果在北方很难吃到。
交通不便是其中的原因之一,主要是因为一些水果(如香蕉)成熟后难以长时间保存,乙烯应用于水果的催熟解决了这一难题。
现在,人们可以把接近成熟的香蕉摘下来,运送到各地,然后在香蕉上喷洒催熟剂乙烯利(学名:2氯乙基磷酸)。
乙烯利能被作物吸收并在植物体内分解释放出乙烯。
使植物呼吸旺盛、代谢速度加快,促进作物的成熟。
这样,硬而青的香蕉在喷洒了乙烯利后,一夜之间就会泛黄、变软,散发出诱人的清香.今天,我们就来学习这神奇的乙烯。
推进新课[思考] 前面我们学习过乙烷,请大家观察乙烷和乙烯的球棍模型,分析它们组成和结构上的差别。
高考化学 58个考点精讲 考点43 乙炔 炔烃

考点43乙炔炔烃1.复习重点1.乙炔的分子结构、化学性质、实验室制法;2.炔烃的组成、结构、通式、通性。
2.难点聚焦一、乙炔分子的结构和组成分子式电子式结构式C2H2 H-C≡C-H 乙炔分子的比例模型二、乙炔的实验室制法CaC2+2H2O C2H2↑+Ca(OH)2乙炔可以通过电石和水反应得到。
实验中又该注意哪些问题呢?[投影显示]实验室制乙炔的几点说明:①实验装置在使用前要先检验气密性,只有气密性合格才能使用;②盛电石的试剂瓶要及时密封,严防电石吸水而失效;③取电石要用镊子夹取,切忌用手拿电石;④作为反应容器的烧瓶在使用前要进行干燥处理;⑤向烧瓶里加入电石时,要使电石沿烧瓶内壁慢慢滑下,严防让电石打破烧瓶;⑥电石与水反应很剧烈,向烧瓶里加水时要使水逐滴慢慢地滴下,当乙炔气流达到所需要求时,要及时关闭分液漏斗活塞,停止加水;电石是固体,水是液体,且二者很易发生反应生成C2H2气体。
很显然C2H2的生成符合固、液,且不加热制气体型的特点,那是不是说就可以用启普发生器或简易的启普发生器来制取乙炔呢?⑦实验室中不可用启普发生器或具有启普发生器原理的实验装置.......................作制备乙炔气体的实验装置。
主要原因是:a.反应剧烈,难以控制。
b.当关闭启普发生器导气管上的活塞使液态水和电石固体分离后,电石与水蒸气的反应还在进行,不能达到“关之即停”的目的。
c.反应放出大量的热,启普发生器是厚玻璃仪器,容易因受热不均而炸裂。
d.生成物Ca(OH)2微溶于水,易形成糊状泡沫,堵塞导气管与球形漏斗。
该如何收集乙炔气呢?乙炔的相对分子质量为26,与空气比较接近,还是用排水法合适。
熟悉和体会有关乙炔气体制备的注意事项及收集方法,并由两名学生上前按教材图5—14乙炔的制取装置图组装仪器,检查气密性,将电石用镊子小心地夹取沿平底烧瓶内壁缓慢滑下,打开分液漏斗的活塞使水一滴一滴地缓慢滴下,排空气后,用排水法收集乙炔气于一大试管中。
2023年高一化学寒假复习第七章 有机化合物 第二节 乙烯与有机高分子材料(解析版)

第七章 有机化合物 第二节 乙烯与有机高分子材料【学习目标】1.掌握乙烯的组成及结构特点,体会结构决定性质的观念。
2.掌握乙烯的化学性质,认识加成反应的特点,培养“证据推理与模型认知”能力。
3.了解乙烯在生产及生活中的应用,培养“科学态度与社会责任”。
4.了解烃的概念及分类,了解常见烃的组成及结构,培养“证据推理与模型认知”能力。
5.初步认识有机高分子材料的组成、性能,了解塑料、合成橡胶、合成纤维的性能及在生活生产中的应用,培养“宏观辨识与微观探析”的学科素养。
【基础知识】一、乙烯1、应用:乙烯是石油化工重要的基本原料,通过一系列反应,乙烯可以合成有机高分子材料、 药物 等。
乙烯产量可以用来衡量一个国家 石油化学工业 的发展水平。
乙烯还是一种植物 生长调节剂 。
2、物理性质:乙烯为 无 色、稍有 气味 的气体, 难 溶于水,密度比空气的 略小 。
熔、沸点分别为-169 ℃、-104 ℃。
3、乙烯的组成与结构4、乙烯的化学性质 (1)氧化反应①乙烯燃烧的化学方程式为 C 2H 4+3O 2――→点燃2CO 2+2H 2O 。
②乙烯被酸性KMnO 4溶液氧化为 CO 2 。
(2)加成反应①乙烯使溴的 四氯化碳 溶液(或溴水) 褪色 ,反应的化学方程式CH 2===CH 2+Br 2―→ CH 2Br—CH 2Br 。
②乙烯与H 2加成,反应的化学方程式为CH 2===CH 2+H 2――→催化剂△CH 3CH 3 。
③乙烯与H 2O 加成,反应的化学方程式为CH 2===CH 2+H 2O―――――→催化剂加热、加压 CH 3CH 2OH 。
④加成反应:有机物分子中的不饱和碳原子与其他 原子或原子团 直接结合生成新的化合物的反应。
(3)聚合反应①乙烯之间相互加成可得到聚乙烯,化学方程式为nCH 2===CH 2――→催化剂CH 2—CH 2 。
②由相对分子质量小的化合物分子相互结合成相对分子质量大的聚合物的反应叫做聚合反应。
高中化学选修5《有机化学基础》全套同步练习----第二章

选修5 《有机化学基础》同步练习第二章第二章《烃和卤代烃》第一节《脂肪烃》第一课时[基础题]1.下列事实、事件、事故中与甲烷有无关的是 A.天然气的主要成分 B.石油经过催化裂化及裂解后的产物 C.“西气东输”中气体 D.煤矿中的瓦斯爆炸2.二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调、冰箱和冷冻库等中的致冷剂。
试判断二氟甲烷的结构简式()A.有4种 B.有3种 C.有2种 D.只有1种3.下列烷烃的一氯取代物中没有同分异构体的是()A.丙烷 B.丁烷 C.异丁烷 D.新戊烷4.甲烷在隔绝空气加强热时可分解为和,若有80%按上述形式分解,所得混合气体的密度是相同条件下氮气密度的倍数是()A.2 B.2.22 C.3.46 D.4.445.烯烃不可能具有的性质有A.能使溴水褪色 B.加成反应 C.取代反应D.能使酸性KMnO4溶液褪色6.与丙烯具有相同的碳、氢百分含量,但既不是同系物又不是同分异构体的是()A.环丙烷 B.环丁烷 C.乙烯 D.丙烷7.不能使酸性KMnO4溶液褪色的是A.乙烯 B.聚乙烯 C.丙烯 D.乙炔8.分子式为,分子结构中含有3个“—”原子团的烯烃共有A.2种 B.5种C.3种D.4种9.下列有机化合物有顺反异构体的是()A.CH3CH3 B.CH2=CH2 C.CH3CH=CH2 D.CH3CH=CHCH310.一定量的甲烷点燃后生成的CO2、CO和H2O的混和气体的质量为49.6 g,将此混和气体缓慢地通过无水氯化钙固体后,氯化钙的质量增加25.2 g,由此可推断混和气体中二氧化碳的物质的量为()A.0.5 mol B.0.3 mol C.13.2 mol D.17.6 mol[提高题]1.有的油田开采的石油中溶有一种碳氢化合物——金刚烷,它的分子立体结构如图5-7所示:(1)由图可知其分子式为:____________。
(2)它是由_________ 个六元环构成的六体的笼状结构,其中有__________个碳原子为三个环共有。
最新-乙烯与烯烃乙炔与炔烃(学案) 精品

乙烯与烯烃乙炔与炔烃【目标引领】一.乙烯的结构、性质和制备1.乙烯的结构乙烯的分子式,电子式,结构式,结构简式,空间构型。
乙烯分子中含有,其中的一个键比较,容易,所以乙烯的化学性质比较。
2.乙烯的性质(1)加成反应:乙烯可与Br2(使溴水褪色)、H2、HCl、H2O等发生加成反应,写出有关的化学方程式。
(2)氧化反应:①乙烯可以燃烧;②乙烯可以使酸性KMnO4。
(3)加聚反应:。
3.乙烯的实验室制法(1)反应原理。
(2)浓硫酸的作用是,浓硫酸与乙醇按3:1的体积比混合,浓硫酸过量的目的是。
(3)温度要迅速升高到170℃是为了防止。
(4)加沸石或碎瓷片的作用是。
二.烯烃的通性1.通式,结构特点。
2.性质:①物理性质一般随着碳原子数目的变化而变化;②化学性质与乙烯相似,比较活泼,容易发生加成反应、氧化反应和加聚反应等。
三.乙炔的结构、性质和制备1.乙炔的结构:乙炔的分子式,电子式,结构式,结构简式,空间构型。
2.乙炔的性质:因为乙炔分子里含有碳碳叁键,其中的两个键容易断裂,所以乙炔的化学性质比较活泼,易发生加成反应和氧化反应。
写出乙炔与Br2、H2、HCl、O2等反应的化学方程式。
3.乙炔的实验室制法(1)反应原理。
(2)CaC2与H2O的反应比较剧烈,为了得到平稳的乙炔气流,可以用代替水,平用分液漏斗控制流速。
四.炔烃的通性(1)通式,特点。
(2)性质:①物理性质一般随着碳原子数目的变化而变化;②化学性质与乙炔相似,容易发生加成反应、氧化反应等。
【教师在线】[解析视频]有机物燃烧的计算1.有机物的燃烧的通式(1)烃完全燃烧的通式C x H y+(x+y/4)O2→xCO2+y/2H2O(2)烃的含氧衍生物完全燃烧的通式C x H y O z+(x+y/4-z/2)O2→xCO2+y/2H2O 2.等物质的量的有机物完全燃烧消耗O2、生成H2O和CO2的量比较(1)由反应的通式可知,等物质的量的烃或烃的含氧衍生物完全燃烧时,(x+y/4)或(x+y/4-z/2)越大,耗氧量越大;生成的CO2由x决定,生成的H2O由y决定。
区别ch4 c2h4 c2h2的最简单方法

区别ch4 c2h4 c2h2的最简单方法摘要:一、区分CH4、C2H4、C2H2的必要性二、CH4、C2H4、C2H2的结构与性质特点三、最简单的区分方法四、实际应用与注意事项正文:区别CH4、C2H4、C2H2的最简单方法在化学领域,区分CH4、C2H4、C2H2这三种有机化合物具有一定的实际意义。
它们分别代表着不同的烃类化合物,具有不同的结构与性质。
下面我们将详细介绍这三种化合物的特点以及最简单的区分方法。
一、区分CH4、C2H4、C2H2的必要性CH4、C2H4、C2H2分别是甲烷、乙烯和乙炔,它们都属于烃类化合物。
在实际应用中,了解它们的区别有助于我们更好地掌握化学反应的规律,确保实验和生产过程的顺利进行。
二、CH4、C2H4、C2H2的结构与性质特点1.CH4(甲烷):分子式为CH4,结构为正四面体,碳原子与四个氢原子形成共价键。
甲烷是一种无色、无臭、不溶于水的气体,化学性质相对稳定,不易发生氧化反应。
2.C2H4(乙烯):分子式为C2H4,结构为平面型,碳原子之间形成一个双键。
乙烯是一种无色气体,具有刺激性气味。
乙烯的化学性质较活泼,容易发生加成反应,是重要的有机合成原料。
3.C2H2(乙炔):分子式为C2H2,结构为直线型,碳原子之间形成一个三键。
乙炔是一种无色、有毒、易燃的气体。
乙炔的化学性质非常活泼,容易发生加成反应,广泛应用于焊接和照明等领域。
三、最简单的区分方法1.观察燃烧现象:甲烷、乙烯、乙炔在燃烧时,火焰颜色有所不同。
甲烷燃烧时火焰呈蓝色,乙烯燃烧时火焰较明亮,伴有黑烟,乙炔燃烧时火焰明亮,伴有浓烟。
2.观察化学反应:乙烯和乙炔在空气中容易发生燃烧,而甲烷燃烧速度较慢。
在实验中,可以通过加入溴水或酸性高锰酸钾溶液观察反应情况。
乙烯和乙炔会使溴水褪色,而甲烷无明显反应。
四、实际应用与注意事项1.在工业生产中,了解CH4、C2H4、C2H2的区别有助于正确选择原料和优化生产过程。
乙烯基乙炔构造式

乙烯基乙炔构造式1.引言1.1 概述乙烯基乙炔是一种有机化合物,其结构中含有乙烯基和乙炔基两个官能团。
乙烯基(vinyl)是指由一个双键连接到碳链上的氢原子的基团,而乙炔基(ethynyl)则是由一个三键连接到碳链上的氢原子的基团。
乙烯基乙炔在化学领域中具有重要的地位,它不仅在有机合成中被广泛应用,还具有许多特殊的化学性质和结构特点。
乙烯基乙炔的结构特点主要表现在其分子中含有两个不同的官能团,即乙烯基和乙炔基。
乙烯基的存在使得乙烯基乙炔具有较高的双键活性,从而可以进行许多重要的化学反应,如加成反应、环化反应等。
而乙炔基则使其分子具有较高的极性和亲电性,使得乙烯基乙炔可以作为亲电试剂参与炔烃的反应。
因此,乙烯基乙炔在化学研究和工业生产中具有广泛的应用前景。
它可以作为合成重要有机化合物的原料,如合成高分子材料、有机金属化合物和药物等。
同时,乙烯基乙炔也可用于催化剂的制备和催化反应的催化剂载体。
其独特的结构特点使得乙烯基乙炔在化学领域中有着广泛的研究价值和应用前景。
在乙烯基乙炔的发展趋势方面,随着有机合成技术的发展和研究的深入,人们对乙烯基乙炔的研究和应用也越来越深入。
未来,乙烯基乙炔的研究将更加注重其合成方法的改进和优化,以提高其合成效率和产量。
同时,乙烯基乙炔在催化剂领域的应用也将得到进一步的推广和发展,为其进一步拓宽应用领域提供更多可能性。
总之,乙烯基乙炔作为一种重要的有机化合物,具有独特的结构特点和广泛的应用前景。
对其概述和研究对于深入了解有机合成和催化剂领域具有重要的理论和实际意义。
1.2 文章结构文章结构部分的内容可以按照以下方式编写:在文章结构部分,本文将按照如下方式进行组织和展开。
首先,在引言部分概述乙烯基乙炔的定义、结构特点以及其应用前景和发展趋势的重要性。
接下来,正文部分将详细介绍乙烯基乙炔的定义,包括其化学结构和化学式的解析,以便读者对其有一个明确的了解。
然后,将深入探讨乙烯基乙炔的结构特点,包括其分子结构、键结构和立体构型等方面的特点和性质。
乙烷乙烯与乙炔结构的对比

乙烷乙烯与乙炔结构的对比乙烷、乙烯和乙炔是三种简单的碳氢化合物,它们之间的结构差异导致了它们在物理性质和化学性质方面的不同。
下面将对乙烷、乙烯和乙炔的结构进行对比。
乙烷(C2H6)是一种无色、无味的气体,分子式为CH3CH3、乙烷分子由两个碳原子和六个氢原子组成,碳原子之间通过单键相连,每个碳原子上都有三个氢原子。
由于乙烷分子结构的简单性,它的空间构型是平面的。
乙烷的内部键角为109.5°,两个碳原子之间的键长为154 pm。
乙烯(C2H4)是一种无色气体,分子式为CH2CH2、乙烯分子由两个碳原子和四个氢原子组成。
乙烯的结构中有一个双键连接两个碳原子,其他两个碳上分别连接一个氢原子。
与乙烷相比,乙烯的分子结构呈现出平面的构型,碳碳双键成为平面共面的一对。
双键的存在导致乙烯的键角为120°,双键的长度约为133 pm,而单键的长度约为147 pm。
乙炔(C2H2)是一种无色的气体,在常温下具有不稳定性。
乙炔分子由两个碳原子和两个氢原子组成。
乙炔的结构是由一个三键和两个单键连接两个碳原子。
这三个键的存在导致了乙炔分子呈线性结构,其键角为180°。
乙炔分子的键长最短,碳碳三键约为120 pm,而碳碳单键约为154 pm。
从分子结构的对比中可以看出,乙烷、乙烯和乙炔在结构上的主要差异是碳原子间的键的数量和类型。
乙烷的碳原子之间通过单键相连,乙烯则包含一个碳碳双键,乙炔则包含一个碳碳三键。
这些不同的结构导致了不同的物理和化学性质。
首先是物理性质方面的对比。
乙烷是一种饱和烃,分子结构中没有双键或三键,因此其分子间相互作用力较小。
由于乙烷分子结构的简单性,它的沸点较低,约为-88.6℃,熔点也较低,约为-183.3℃。
与乙烷相比,乙烯和乙炔中包含双键和三键,这些键的存在导致分子间相互作用力增强。
乙烯的沸点为-103.7℃,熔点为-169℃,而乙炔的沸点为-84℃,熔点为-80℃。
小议烯烃和炔烃的加成反应
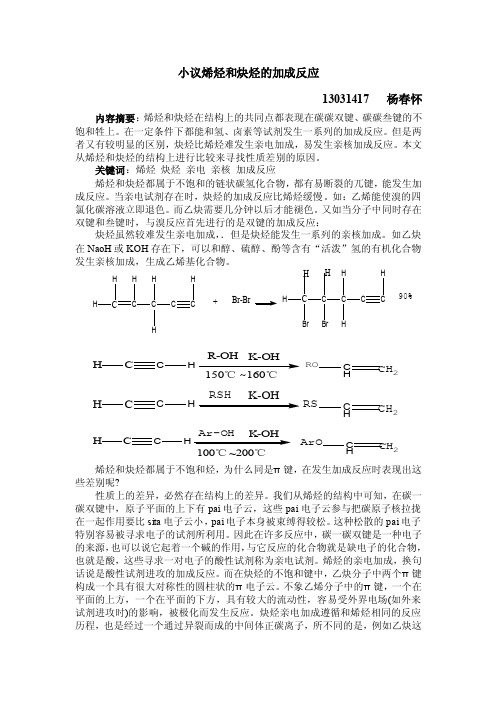
小议烯烃和炔烃的加成反应13031417 杨春怀内容摘要:烯烃和炔烃在结构上的共同点都表现在碳碳双键、碳碳叁键的不饱和牲上。
在一定条件下都能和氢、卤素等试剂发生一系列的加成反应。
但是两者又有较明显的区别,炔烃比烯烃难发生亲电加成,易发生亲核加成反应。
本文从烯烃和炔烃的结构上进行比较来寻找性质差别的原因。
关键词:烯烃 炔烃 亲电 亲核 加成反应烯烃和炔烃都属于不饱和的链状碳氢化合物,都有易断裂的兀键,能发生加成反应。
当亲电试剂存在时,炔烃的加成反应比烯烃缓慢。
如:乙烯能使溴的四氯化碳溶液立即退色。
而乙炔需要几分钟以后才能褪色。
又如当分子中同时存在双键和叁键时,与溴反应首先进行的是双键的加成反应:炔烃虽然较难发生亲电加成,.但是炔烃能发生一系列的亲核加成。
如乙炔在NaoH 或KOH 存在下,可以和醇、硫醇、酚等含有“活泼”氢的有机化合物发生亲核加成,生成乙烯基化合物。
C C H H H C H H C C H+Br-Br C Br H H C Br H C H H C C H 90%C H CH R-OH ROC H CH 2C H CH RS C H CH 2RSH C H C H ArO C H CH 2Ar-OH 100℃~200℃ 烯烃和炔烃都属于不饱和烃,为什么同是π键,在发生加成反应时表现出这些差别呢?性质上的差异,必然存在结构上的差异。
我们从烯烃的结构中可知,在碳一碳双键中,原子平面的上下有pai 电子云,这些pai 电子云参与把碳原子核拉拢在一起作用要比sita 电子云小,pai 电子本身被束缚得较松。
这种松散的pai 电子特别容易被寻求电子的试剂所利用。
因此在许多反应中,碳一碳双键是一种电子的来源,也可以说它起着一个碱的作用,与它反应的化合物就是缺电子的化合物,也就是酸,这些寻求一对电子的酸性试剂称为亲电试剂。
烯烃的亲电加成,换句话说是酸性试剂进攻的加成反应。
而在炔烃的不饱和键中,乙炔分子中两个π键构成一个具有很大对称性的圆柱状的π电子云。
乙烯乙炔乙烷杂化轨道判断-概述说明以及解释

乙烯乙炔乙烷杂化轨道判断-概述说明以及解释1.引言1.1 概述乙烯、乙炔和乙烷是有机化学中非常重要的化合物。
它们在工业和生物领域都有广泛的应用。
在研究和理解这些化合物的性质和反应机理时,对它们的电子结构有深入的认识是至关重要的。
乙烯是一种双键结构的碳氢化合物,由两个碳原子通过一个简单的π键连接而成。
这种双键结构赋予了乙烯许多特殊的性质,例如它的反应活性高和分子构型的柔性等。
乙烯被广泛应用于聚合物产业、化学合成和有机合成等领域。
乙炔是一种三键结构的碳氢化合物,由两个碳原子通过一个三键连接而成。
乙炔由于其高度的不饱和度和反应活性而具有特殊的性质。
在有机合成中,乙炔常被用作重要的反应试剂和中间体,例如用于合成各种有机化合物和聚合物。
乙烷是一种饱和的碳氢化合物,它由两个碳原子通过一个单键连接而成。
乙烷的分子结构非常稳定,因此其化学性质相对较为惰性。
由于乙烷分子上没有不饱和键,其反应性相对较低,但乙烷作为烷烃化合物的代表,仍然在石油化工、能源领域和生物领域等有重要的应用。
了解乙烯、乙炔和乙烷的结构与性质有助于我们对有机化学反应的理解和预测。
而乙烯乙炔乙烷杂化轨道的判断是研究这些化合物的重要方法之一。
本文将对乙烯、乙炔和乙烷的结构与性质进行介绍,并重点探讨乙烯乙炔乙烷的杂化轨道判断以及杂化轨道在有机化学中的应用。
通过对这些内容的深入讨论,我们可以更好地理解这些化合物的化学性质及其在实际应用中的意义。
1.2文章结构1.2 文章结构本文主要分为引言、正文和结论三个部分。
下面将对每个部分的内容进行详细介绍。
1. 引言部分主要包括概述、文章结构和目的三个方面。
在概述中,我们将简要介绍乙烯、乙炔和乙烷这三种化合物的基本结构和性质。
文章将围绕着这三种化合物展开,探究它们的杂化轨道以及对分子性质的影响。
在文章结构部分,我们将清晰地列出整篇文章的目录,方便读者快速了解文章的结构和内容。
最后,在目的部分,我们将明确论文的研究目标,即探讨乙烯、乙炔和乙烷的杂化轨道判断以及这些杂化轨道在有机化学中的应用。
有机化学题库(上)

一、选择题1.下列化合物按酸性由强到弱排列的是(D ) a 、乙炔 b 、乙烯 c 、乙烷 d 、水 A 、abcd B 、dacb C 、adbc D 、dabc 2.下列化合物按酸性由强到弱排列的是(C )a 、CH 3CHFCOOHb 、CH 3CHClCOOHc 、BrCH 2CH 2COOHd 、CH 3CHBrCOOH A 、abcd B 、dacb C 、abdc D 、dabc 3.下列化合物按碱性由强到弱排列的是(D ) a 、CH 3CH 2O - b 、CH 3CH 2- c 、-OH d 、-NH 2 A 、abcd B 、dacb C 、abdc D 、bdac4.下列化合物中同时含有伯、仲、叔、季碳原子的是(B )。
A .2,2,3—三甲基丁烷B .2,2,3—三甲基戊烷C .2,3,4—三甲基戊烷D .3,3—二甲基戊烷5.某烷烃共八个碳原子,含有一个异丙基和一个叔丁基,其构造式为(A )A. B.C. D.(CH 3)2CHCH 2C(CH 3)3(CH 3)2CHC(CH 3)2CH 2CH 3(CH 3)2CHCH 2CH 2CH(CH 3)2(CH 3)3CC(CH 3)36.某饱和烃共七个碳原子,只有一个伯碳,其构造式一定不是(C )A. B. C.D.7.结构中有几个伯碳,几个仲碳,几个叔碳和几个季碳( B )A.3,4,4,1B.4,4,4,0C.4,3,5,0D.5,4,3,08.下列四个化合物,作为含碳酸,哪一个的酸性(即C ─H 键中氢的活性)最大(C ) A 、环戊烷 B 、环戊烯 C 、1,3-环戊二烯 D 、1,4-环己二烯 9.下面有两组物质属互变异构现象,请找出? (D )A.CH 3CH=CHCH 3CH 2=CHCH 2CH 3与B.CH 3CH 2CH 2OH CH 3CH 2OCH 3与C.CH 3COCH 2CH 2OCH 3CH 3CH 2COOCH 2CH 3与D. CH 2=CHOH CH 3CHO与10.下面有两组物质属互变异构现象,请找出? (C )A.CH 3CH=CHCH 3与B.CH 2=CHCH 2OH CH 3COCH 3与C.CH 3COCH 2CH 2OCH 3CH 2=COHCH 2CH 2OCH 3与D. CH 3CH 2OH CH 3OCH 3与11.下面有两组物质属互变异构现象,请找出? (A )A.CH 3CH=CCH 3与B.CH 3CH 2CH 2OH CH 3CH 2OCH 3与C.CH 3COCH 2CH 2OCH 3CH 3CH 2COOCH 2CH 3与D. CH 3COOHHCOOCH 3与OHCH 3COCH 2CH 312.下面有两组物质属互变异构现象,请找出? (B )A.CH 3CH=CHCH 3CH 2=CHCH 2CH 3与B.CH 3CH=CHOH CH 3CH 2CHO与C.CH 3COCH 2CH 2OCH 3CH 3CH 2COOCH 2CH 3与D. HCOOCH 3CH 3COOH与13.符合分子式为C 6H 12的端烯烃构造异构体有(D ) A.四种 B.五种 C. 六种 D. 七种14.符合分子式为C 5H 10的烯烃构造异构体有(B ) A.四种 B.五种 C. 六种 D. 七种 15.下列化合物中是手性分子的是(D )A.B.C. HCCH 3CCl H D.H CH 3CH 3Cl16.下列化合物中不是手性分子的是(A )A. CCCCH 3HH 3CH 3CB. CCCCH 3HH 3CH 3CH 2CC. C C CCH 2CH 3ClH 3CH 3CH 2CD.C C CCH 2CH 3CH 3H 3CH 3CH 2C17.下列各化合物有对映体的是( D )A.B.H BrBrC.H 3 D.HCH 3H 3CH18.下列各化合物有对映体的是( B )A.B.H HOOCBrC.NO 2NO 2D.OHOH19.与A 化合物是对映体的是(B )A.H 3CH C 2H 5ClB. HCH 2CH 3Cl CH 3C. H3CHCH 2CH 3ClD. 320.与A 化合物构型相同的是(D )A.HCH 3ClCH 2CH 3 B.HCH 2CH 3Cl CH 3C. H3CHCl C 2H 5 D.321.下列化合物中是内消旋体的是( B )A .H Cl CH 3Cl HCH 3B .CH 3H Cl H ClCH 3C .CH 3H Cl CH 3ClH D . CH 3Cl H CH 3BrH22.下列化合物中是内消旋体的是( A )A.B.C.D. HCH 3CCl H23.下列化合物无手性的是(A )A .NH 2NH 2H O O CIB .OCH 3H 3COH 5C 2C . C O O HH O O CD .NCH 3HOOC24.CH 3CH 2CH 2CH 2CH 2CH 3的一个氢原子被一个氯原子取代可能生成的位置异构体有(B ) A.两种 B.三种 C.四种 D.六种25.考察下面的Fischer 投影式,这两种化合物互为(A )。
高中化学 第1章 有机化合物的结构与性质 烃 章末过关检测(一)课件 鲁科版选修5

D.丁的命名是正确的
解析:选 D。
的命名为 4-甲基-2-乙基
-1-戊烯。
6.四联苯
的一氯代物有( )
A.3 种 C.5 种
B.4 种 D.6 种
解析:选 C。推断有机物一氯代物的种数需要找中心对称轴,
四联苯是具有两条对称轴的物质,即
,
在其中的一部分上有几种不同化学环境的氢原子(包括对称轴上 的氢原子),就有几种一氯代物,四联苯有 5 种不同化学环境的 氢原子,故有 5 种一氯代物。
D.苯酚(
OH)可以与 NaOH 反应,而乙醇(CH3CH3OH)
不能与 NaOH 反应
解析:选 B。A 项,甲苯能使酸性高锰酸钾溶液退色,是因为 苯环对甲基的影响,使甲基变得活泼,容易被酸性高锰酸钾溶 液氧化,而甲基环己烷不能,故能证明上述观点;B 项,乙烯 能使溴水退色,是因为乙烯含有碳碳双键,而乙烷中没有,不 是原子或原子团的相互影响,故不能证明上述观点;C 项,甲 苯的影响使苯环上两个邻位和对位上的氢原子变得活泼,容易 被取代,故能证明上述观点;D 项,苯环使羟基上的氢原子变 得活泼,容易电离出 H+,故能证明上述观点。
2.下列现象中,不是因为发生化学反应而产生的是( ) A.乙烯使酸性 KMnO4 溶液退色 B.将苯滴入溴水中,振荡、静置后水层接近无色 C.乙烯使溴的四氯化碳溶液退色 D.甲烷与氯气混合,光照一段时间后黄绿色消失 解析:选 B。A 项乙烯使酸性 KMnO4 溶液退色,是发生了氧化 反应,属于化学变化。B 项溴易溶于苯,从而使水层接近无色, 是发生了萃取,属于物理变化。C 项乙烯使溴的四氯化碳溶液 退色是发生了加成反应,属于化学变化。D 项甲烷和氯气混合, 在光照条件下发生了取代反应,黄绿色消失,属于化学变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
起加成反应。实际上乙炔分子中-CC-键长为 1.20×10-10m,而乙烯分子中键长为 1.34×10-10m,造成乙炔中的π键强于乙烯中的π键,即乙炔中的π键相对于乙烯 中的π键难于断开或者说难于给出电子,使得如上所述的亲电加成反应难于进行。 例如:烯炔与卤素反应时,卤素首先加在双键上。
CH2=CHCH2CH2CCH+ Br2 CH2Br-CHBrCH2CH2 CCH 乙烯和乙炔与 H2 的加成反应不同于上述反应历程,这些反应通常要使用催化剂 (如铂、钯) ,以降低反应的活化能,加氢反应才得以进行。反应时氢分子和乙烯 (或乙炔)都被吸附在催化剂表面,发生键的断裂,所形成的氢原子一个首先与 双键上的一个碳原子结合,形成一个中间体,再与另一个氢原子结合生成产物。 此类反应都是放热反应,1mol 乙烯和乙炔加氢分别生成乙烷的乙烯时放出的热量 分别是 137.2KJ/mol 和 176.4KJ/mol, 可见乙炔相对于乙烯的稳定性弱于乙烯相对 于乙烷的稳定性,即乙炔比乙烯更容易与 H2 发生加成反应。如: CH2=CHCH2CH2CCH + H2(1mol)
催化剂
R-CC-R′+
H2
R-CH2-CH2-R′
一定条件下,可使反应停留在烯烃阶段,说明炔烃比烯烃易于加氢。 、氢卤酸(HX) 、硫酸(H2SO4)等发生 乙烯和乙炔都能与卤素(Cl2、Br2) 加成反应,这些反应均为亲电加成反应,反应的历程是反应物中的加成试剂首先 解离为正、负离子,正离子向着 而破坏了 上电子云密度比较大的位置进攻,从
乙烯、乙炔谁更容易发生加成反应
宋光杰
摘要
乙烯和乙炔都是不饱和烃,都含有π键,能发生加成反应发生加成反应的难与易、快与慢。 关键词 乙烯 乙炔 加成反应 难易
加成反应是有机物分子里的不饱和碳原子,直接与其它的原子或原子团结合 生成新的化合物的反应。乙烯和乙炔均为不饱和烃(分别含有一个和二个π键) , 都可以发生加成反应,那么谁更容易发生呢? 将乙烯和乙炔分别通入溴的四氯化碳溶液,可以观察到乙烯“很快”使溶液 褪色,而乙炔“慢慢”使溶液褪色,说明乙烯更容易反应。但:
中的π键,使得原来双键上的另一个碳原子带有完整的正
电荷,这便是活性中间体的碳正离子,随后碳正离子跟原来试剂解离产生的负离 子结合生成产物。以乙烯加溴的反应为例,这个历程可写成下列过程: ① Br2 Br+ + Br-
②
+Br+
③ Br-+
上述反应 ②是决定该反应的关键步骤,即π键断开的难易或者说π键是否容 易给出电子,决定着反应的快慢。从表面上看乙炔分子中有二个π键,而乙烯中 只含有一个π键,因此人们 往往错误地认为乙炔比乙烯活泼,容易
催化剂
CH2=CHCH2CH2CH=CH2
、氢卤酸(HX) 、硫酸 综上所述:因反应历程不同,乙烯与卤素(Cl2、Br2) (H2SO4)等发生加成反应比乙炔容易,而乙炔与氢气的加成反应比乙烯容易。
