111 氯化钠检验原始记录
氯化钠注射液试验记录

批号: 规格: 250ml :2.25g 检验日期: 模拟不良储存环境试验试验条件:取样品10瓶于-18℃放置72小时后,进行外观色泽、可见异物、PH 、不溶性微粒、含量检查。
【性 状】 本品为无色澄明液体;味微咸。
结果:【可见异物】取供试品在澄明度测试仪上进行检测,照度为2000lx-3000lx ,用目检视:【PH 值】(PH 值应为4.5-7.0)测得值为:【不溶性微粒】微粒仪厂家:天大天发 型号:GWJ-16粒子直径≥5um 粒子数 ; 粒子直径≥10um 粒子数 ; 粒子直径≥25um 粒子数 。
【含量测定】 含氯化钠应为0.850%-0.950%(g/ml )精密称取本品10ml ,加水40ml ,加2%糊精溶液5ml 与荧光黄指示液6滴,用硝酸银滴定液(0.1mol/L )滴定,每1ml 硝酸银滴定液(0.1mol/L )相当于5.844mg 的Nacl 。
V 1= ml V 2= ml F==⨯⨯⨯⨯-%1001010844.53=⨯⨯⨯⨯-%1001010844.53平均值:检验人: 复核人:批号: 规格:250ml :2.25g 检验日期: 模拟不良储存环境试验试验条件:取样品10瓶于温度55℃、30%相对湿度放置72小时后,进行外观色泽、可见异物、PH 、不溶性微粒、含量检查。
【性 状】 本品为无色澄明液体;味微咸。
结果:【可见异物】取供试品在澄明度测试仪上进行检测,照度为2000lx-3000lx ,用目检视:【PH 值】(PH 值应为4.5-7.0)测得值为:【不溶性微粒】微粒仪厂家:天大天发 型号:GWJ-16粒子直径≥5um 粒子数 ; 粒子直径≥10um 粒子数 ; 粒子直径≥25um 粒子数 。
【含量测定】 含氯化钠应为0.850%-0.950%(g/ml )精密称取本品10ml ,加水40ml ,加2%糊精溶液5ml 与荧光黄指示液6滴,用硝酸银滴定液(0.1mol/L )滴定,每1ml 硝酸银滴定液(0.1mol/L )相当于5.844mg 的Nacl 。
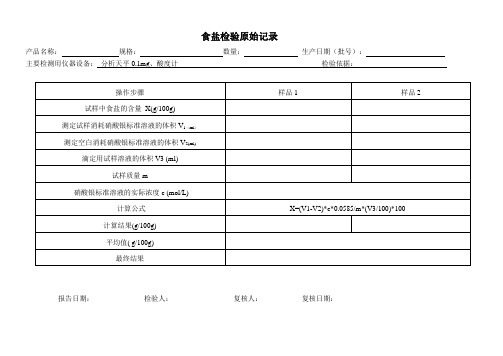
食盐、酸度检验原始记录
X=(V1-V2)*c*0.0585/m*(V3/100)*100
计算结果(g/100g)
平均值( g/100g)
最终结果
报告日期:检验人:复核人:复核日期:
总酸检验原始记录
产品名称:规格:数量:生产日期(批号):
主要检测用仪器设备:分析天平0.1mg、天平0.1g、酸度计、检验依据:
操作步骤
食盐检验原始记录
产品名称:规格:数量:生产日期(批号):
主要检测用仪器设备:分析天平0.1mg、酸度计检验依据:
操作步骤
样品1
样品2
试样中食盐的含量X(g/100g)
测定试样消耗硝酸银标准溶液的体积V1(ml)
测定空白消耗硝酸银标准溶液的体积V2(ml)
滴定用试样溶液的体积V3 (ml)
试样质量m
硝酸银标准溶液的实际浓度c (mol/L)
计算公式
X=(V1-V2)*c*0.09/m*(V3/100)*100
计算结果(g/100g)
平均值( g/100g)
最终结果
报告日期:检验人:复核人:复核日期:
样品1
样品2
X试样中的酸度(以乳酸计)(g/100g)
V1测定用试样消耗NaOH标准滴定溶液的体积(ml)
V2试剂空白消耗NaOH标准滴定溶液的体积(ml)
V3试样溶液体积(ml)
C NaOH标准溶液实际浓度(mol/L)
0.09与1.00 mlNa
氯化钠注射液成品检验原始记录

氯化钠注射液检验原始记录【性状】实验条件:温度:℃;湿度:%。
标准规定:本品为无色的澄明液体实验结果:本品为。
结论:□符合规定□不符合规定检验人:复核人:日期:年月日【鉴别】实验条件:温度:℃;湿度:%。
化学反应检查法:取铂丝,用盐酸润湿后,蘸取供试品,在无色火焰中燃烧,火焰即显鲜黄色。
标准规定:应呈正反应。
实验结果:。
结论:□符合规定□不符合规定检验人:复核人:日期:年月日取供试品约1ml,置10ml试管中,加水2ml溶解,加15%碳酸钾溶液2ml,加热至沸,应不得有沉淀生成;加焦锑酸钾试液4ml,加热至沸;置冰水中冷却,必要时,用玻棒摩擦试管内壁,应有致密的沉淀生成。
标准规定:应呈正反应。
实验结果:。
结论:□符合规定□不符合规定检验人:复核人:日期:年月日取供试品溶液,加稀硝酸使成酸性后,滴加硝酸银试液,即生成白色凝乳状沉淀;分离,沉淀加氨试液即溶解,再加稀硝酸酸化后,沉淀复生成。
标准规定:应呈正反应。
实验结果:。
结论:□符合规定□不符合规定检验人:复核人:日期:年月日【检查】pH值实验条件:温度:℃;湿度:%。
测定法:取本品30ml,依法测定。
标准规定:pH值应为4.5~7.0。
实验结果:结论:□符合规定□不符合规定检验人:复核人:日期:年月日重金属实验条件:温度:℃;湿度:%。
测定法:取本品50ml,蒸发至20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml,作为供试品溶液。
取25ml纳氏比色管三支,甲管中加标准铅溶液1.5ml与醋酸盐缓冲液(pH3.5)2ml后,加水适量稀释成25ml,乙管中取供试品溶液,加水适量稀释成25ml。
丙管中取供试品溶液,加1.5ml标准铅溶液和醋酸盐缓冲液(pH3.5)2ml加水适量稀释成25ml。
再在甲、乙、丙三管中分别加硫代乙酰胺试液各2ml,摇匀,放置2分钟,同置白纸上,自上向下透视,当丙管中显出的颜色不浅于甲管时,乙管中显示的颜色与甲管比较,不得更深。
盐水原始记录范文

盐水原始记录范文日期:[填写日期]时间:[填写时间]实验人员:[填写实验人员姓名]实验目的:本实验旨在研究盐水的溶解性质,观察不同重量浓度的盐水中溶解盐的量以及溶解过程中的物理变化。
实验材料和设备:1.盐:[填写盐的名称]3.定量瓶:[填写数量]4.称量器:[填写数量]5.温度计:[填写数量]6.搅拌棒:[填写数量]7.塑料容器:[填写数量]实验步骤:1.准备工作a.清洗所有实验器材,以防止污染对实验结果的影响。
b.在实验室中准备所需的一组实验条件,包括温度和湿度等。
2.量取不同重量浓度的盐水a.使用称量器分别量取盐的质量。
b.分别将盐加入定量瓶中。
c.使用称量器量取适量的水,添加到定量瓶中。
d.使用搅拌棒搅拌溶解,直到盐完全溶解为止。
3.观察溶解过程中的物理变化a.观察溶液的颜色变化。
b.观察溶解盐体积的变化。
c.观察溶解过程中是否有气泡产生。
4.记录实验数据a.记录每一组试验的盐的质量和水的体积。
b.每组试验后观察和记录盐完全溶解所需的时间。
c.记录溶液的颜色、透明度和pH值(如果可测)。
5.温度对溶解过程的影响(可选)a.进行上述步骤,在不同温度条件下重复实验。
b.观察不同温度下盐水溶解的速度和物理变化。
实验结果:以下是本实验所得部分数据:实验组编号盐的质量水的体积溶解时间颜色透明度pH值[填写数据][填写数据][填写数据][填写数据][填写数据][填写数据][填写数据]实验讨论:根据本实验结果1.随着盐浓度的增加,溶解时间减少。
2.盐的质量和水的体积对溶解时间和溶解盐的量都有影响。
3. 盐水溶解过程中常常 beginalign揽发热的反应。
endalign实验总结:通过本次实验,我们了解了盐水的溶解性质和溶解过程中的物理变化。
我们发现盐水的溶解时间和溶解盐的量与盐的浓度、水的体积有关。
此外,我们还观察到了溶解过程中的颜色变化、气泡产生等现象。
这个实验对我们理解溶解过程和盐水的特性有很大帮助,同时也提供了实验数据作为今后研究的基础。
氯化钠空白检验记录

×××××××制药有限公司原辅料检验原始记录检品名称:氯化钠请验单号:产品批号:物料编号:供货单位:数量:检验日期:年月日报告日期:年月日检验依据:中国药典2010版二部【性状】本品为色。
,味。
溶解度:本品在水中,在乙醇中。
结论:□符合规定□不符合规定【鉴别】钠盐:(a)取铂丝,用盐酸湿润后,蘸取本品,在无色火焰中燃烧,火焰即显色。
结论: □符合规定□不符合规定(b)取供试品(约100mg),置10ml试管中,加水2ml溶解;加15%碳酸钾溶液2ml,加热至沸,(应不得有沉淀生成);加焦锑酸钾试液4ml,加热至沸;置冰水中冷却:□有致密的沉淀生成。
□溶液无变化,用玻璃摩擦试管内壁,有致密的沉淀生成。
□溶液无变化,用玻璃摩擦试管内壁,无致密的沉淀生成。
结论: □符合规定□不符合规定氯化物:(a)取澄清度项下溶液10ml,加稀硝酸使成酸性后,滴加硝酸银试液,即生成;分离,沉淀加氨试液即,再加稀硝酸酸化后,复生成。
结论: □符合规定□不符合规定(b)取本品(约45mg),置试管中,加等量二氧化锰(约45mg),混匀,加硫酸湿润,缓缓加热,即发生氯气,能使用水润湿的碘化钾淀粉试纸显色。
结论: □符合规定□不符合规定【检查】酸碱度取本品(5.0g),加水50ml溶解后,加溴麝香草酚蓝指示液2滴,□显黄色,加氢氧化钠滴定液(0.02mol/L)0.10ml,变为;□显蓝色或绿色,加盐酸滴定液(0.02mol/L)0.2ml,变为。
结论:□符合规定□不符合规定溶液的澄清度取本品(5.0g),加水25ml溶解后,溶液。
结论:□符合规定□不符合规定碘化物取本品的细粉(5.0g),置瓷蒸发皿内,滴加新配制的淀粉混合液适量使晶粉润湿,置日光下观察,5分钟内晶粒。
结论:□符合规定□不符合规定溴化物(1)供试品溶液:取本品(2.0g),置100ml量瓶中,加水溶解并稀释至刻度,摇匀,精密量取5ml,置10ml比色管中,加苯酚红混合液2.0ml和0.01%的氯胺T溶液,立即混匀,准确放置2分钟,摇匀;(2)对照溶液:另取标准溴化钾溶液5.0ml,置10ml比色管中,同法制备,即得。
氯化钠注射液成品检验原始记录

氯化钠注射液成品检验原始记录
一、样品信息
产品名称:氯化钠注射液
生产日期:YYYY年MM月DD日
生产批号:XXXXXX
样品编号:XXX
二、外观检查
1.检查氯化钠注射液的外观是否清澈透明,无杂质、悬浮物或沉淀物。
2.检查注射液包装是否完好,无破损或渗漏。
三、理化性质检查
1.pH值测定:
取适量氯化钠注射液于容量瓶中,用pH计测定其pH值,并记录结果。
2.盐度测定:
取适量氯化钠注射液于导电仪中测定其盐度值,并记录结果。
3.氯离子含量测定:
取适量氯化钠注射液,按照氯离子含量测定的方法进行检测,并记录
结果。
四、安全性检查
1.无菌性检查:
取适量注射液样品进行无菌性试验,按照无菌检验方法进行操作,并记录结果。
2.内毒素测定:
取适量注射液样品进行内毒素测定,按照内毒素检测方法进行操作,并记录结果。
五、微生物检查
1.细菌总数检验:
取适量注射液样品进行细菌总数检验,按照细菌总数检验方法进行操作,并记录结果。
2.霉菌和酵母菌检验:
取适量注射液样品进行霉菌和酵母菌检验,按照霉菌和酵母菌检验方法进行操作,并记录结果。
六、其他检查
可按照需要进行其他项目的检验,如重金属含量、有害物质残留等检测。
七、检验结果及结论
根据上述检验项目的结果,对氯化钠注射液的各项指标进行评价,并给出检验结论。
备注:质量控制标准参照相关国家和行业标准进行制定。
以上是氯化钠注射液成品检验的原始记录,用于记录实际检验过程和结果。
实际检验时,可以根据具体要求和实验室标准作适当调整。
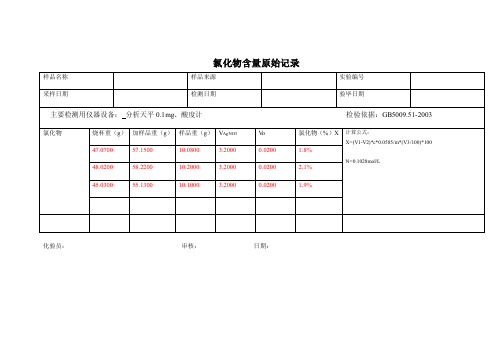
氯化物含量原始记录
318.0 315.0
227.0
32.0
95.5
227.0
31.0
93.8
(W2-W1)+F X=━━━━━━━━━ ×100
W
133.0
313.0
227.0
29.0
92.0
化验员:
审核:
日期:
样品名称 采样日期
氯化物含量原始记录
样品来源
检测日期
实验编号 验毕日期
主要检测用仪器设备: 分析天平 0.1mg、酸度计
氯化物ห้องสมุดไป่ตู้
烧杯重(g) 加样品重(g) 样品重(g) VAgNO3
47.0700
57.1500
10.0800
3.2000
48.0200
58.2200
10.2000
3.2000
45.0300
固形物含量的测定原始记录
样品来源
实验编号
采样日期
检测日期
验毕日期
主要检测用仪器设备:圆筛、0.1g 天平
检验方法: QB 1007-90
固形物
圆 筛 重 量 沥干物加圆筛 罐头标明净 油脂重(g) 固形物含量重量百分率% X 计算公式:
(g)W1 重量(g)W2 重(g)W F
计算公式:
133.0 133.0
55.1300
10.1000
3.2000
Vo 0.0200 0.0200 0.0200
检验依据:GB5009.51-2003
氯化物(%)X 1.8%
计算公式: X=(V1-V2)*c*0.0585/ m*(V3 /100)*100
2.1%
N=0.1028mol/L
1.9%
食盐检验原始记录

食盐检验原始记录食盐检验原始记录
名称:规格:名称:规格:
检验日期:生产日期:检验日期:生产日期:
检验项目检验项目
1 干燥失重 1 干燥失重
空杯加样品重:空杯重:样品重:空杯加样品重:空杯重:样品重:
一次烘后重:二次烘干后重:干燥失重:一次烘后重:二次烘干后重:干燥失重:
2 氯化物测定 2 氯化物测定
空杯加样品重:空杯重:样品重:空杯加样品重:空杯重:样品重:
定容100ml,取2.0ml( )耗C= mol/LAgNO3溶液;定容100ml,取2.0ml( )耗C= mol/LAgNO3溶液;
V1 ml V2 ml,氯化物: %V1 ml V2 ml,氯化物: %
2 外观、感官: 白色、味咸、无异味、无明显的与盐无关的外来 2 外观、感官: 白色、味咸、无异味、无明显的与盐无关的外来 异物 异物
3 净含量: 3 净含量:
检验员:检验员:。
实验原始记录模板(检查)

实验原始记录模板(检查)预览说明:预览图片所展示的格式为文档的源格式展示,下载源文件没有水印,内容可编辑和复制实验原始记录模板(检查)温度:湿度:三、检查1. 水分标准:取本品内容物,照水分测定法(药典2005二部附录ⅧM 第一法A),以为溶剂,水分不得过%。
仪器:水分测定仪:结果:标定值: mg/ml RSD= % (附水分报告)2.干燥失重标准:照干燥失重法测定,于℃干燥至恒重,减失重量不得过%。
仪器:烘箱:恒温减压干燥箱:真空泵:电子天平:(感量0.1mg)方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种)干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状)结果:批号:单位:g公式:干燥失重(%)=(W0+W1-W3)/ W1×100% 结论:符合规定温度:湿度:3.(重量)装量差异标准:取本品20片(5瓶),按药典二部附录方法检查,限度为±%。
仪器:电子天平:感量0.1mg(适用于平均片重0.30g以下的片剂)感量1mg(适用于平均片重0.30g或0.30g以上的片剂)结果:重量差异(片剂)单位:g装量差异(粉针)单位:g公式:(重量)装量差异(%)=(W供- w平均)/ w平均×100%装量差异= - ~+ % 结论:符合规定4.酸度(碱度)标准:取供试品加水制成每1ml中含mg 的溶液,依法测定。
pH 值应为~。
仪器:酸度计:电子天平:供试液:g ―→ml结果:结论:温度:湿度:5. 溶液的澄清度与颜色、pH值标准:仪器:澄明度检测仪:酸度计:方法:取供试品5瓶, 分别按标示量加水制成每1ml 中含mg的溶液,与浊度标准液及标准比色液比较后,测定pH值。
供试液:每瓶加水ml结果:6. 不溶性微粒(例如)标准:每1.0g样品中含10μm以上的微粒不得过6000粒,含25μm以上的微粒不得过600粒方法:取本品3份,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(中国药典2010年版二部附录IX C)仪器:微粒分析仪GWF-8JC温度:湿度:7. 可见异物仪器:澄明度检测仪:方法:灯检法、光散射法(深色透明容器或大于7号颜色)结果判定:5份供试品在静置一定时间后轻轻旋转时均不得检出烟雾状微粒柱,且不得检出金属屑、玻璃屑、长度或最大粒径超过2mm 纤维和块状物等明显可见异物。
111 氯化钠检验原始记录
钙盐
﹙1﹚取本品g,加水10ml使溶解,加氨试液1ml,摇匀,加草酸铵试液1ml,5分钟内。
镁盐﹙≤0.001%﹚
﹙1﹚取本品g,加水20ml使溶解,加氢氧化钠试液2.5ml与0.05%太坦黄溶液0.5ml,摇匀;生成的颜色与标准镁溶液(精密称取在800℃炽灼至恒重的氧化镁16.58mg,加盐酸2.5ml与水适量使溶解成1000ml,摇匀)1.0ml用同一方法制成的对照液比较,结果。
3.6
3.7
3.8
3.9
用同一方法制成的对照液比较,结果。
硫酸盐﹙≤0.002%﹚
﹙1﹚取本品g,依《硫酸盐检查标准操作规程》检查,与标准硫酸钾溶液1.0ml制成的对照液比较,结果。
钡盐
﹙1﹚取本品,加水20ml溶解后,滤过,滤液分为两等份,一份中加稀硫酸2ml,另一份中加水2ml,静置15分,结果。
编码:BCR-QM-111-00
起草人:年月日
审核人:年月日
批准人:年月日
氯化钠检验原始记录
供应商
批号
规格
数量
检验原始记录
氯化钠
批号
规格
取样日期
注射液的无菌检查原始记录.

注射液的无菌检查原始记录样品名称:规格:样品编号:生产单位:批号:样品状态:检验日期:完成日期:一检验依据二样品处理:取本品三检验方法:(1)直接接种法(2)薄膜过滤法稀释液、冲洗液:(1)0.1%蛋白胨水溶液(2)pH7.0氯化钠-蛋白胨缓冲液四无菌检查结果:洁净室动态测定∑= CFU/皿(规定100级∑≤1 CFU/皿)符合规定室温℃相对湿度 %细菌培养箱:真菌培养箱:压力蒸汽灭菌器:培养基名称:硫乙醇酸盐流体培养基(1)硫乙醇酸盐流体培养基(2)改良马丁培养基阳性对照菌:金黄色葡萄球菌 [CMCC(B)26 003] 生孢梭菌 [CMCC(B)64 941] 白色念珠菌[CMCC(F)98 001] 大肠埃希菌 [CMCC(B)44 102]注射液的无菌检查原始记录样品名称:规格:样品编号:生产单位:批号:样品状态:检验日期:完成日期:一检验依据二样品处理:取本品三检验方法:(1)直接接种法(2)薄膜过滤法稀释液、冲洗液:(1)0.1%蛋白胨水溶液(2)pH7.0氯化钠-蛋白胨缓冲液四无菌检查结果:基本信息【药品名称】通用名称:头孢呋肟商品名称:西力欣、明可欣、达力新英文名称:汉语拼音:xilixin【成份】头孢呋辛酯化学名称为:(6R,7R)-7-[2-呋喃基(甲氧亚氨基)乙酰氨基]-3-氨基甲酰氧甲基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸,1-乙酰氧基乙酯【性状】本品为白色胶囊形薄膜衣片。
【作用类别】【规格】 250mg/片 125mg/片适应症头孢呋辛酯适用于敏感细菌造成的感染的治疗。
- 下呼吸道感染:如急性支气管炎及慢性支气管炎急性发作和肺炎。
- 上呼吸道感染:包括耳、鼻、咽喉感染,如中耳炎、鼻窦炎、扁桃体炎及咽炎。
- 生殖泌尿道感染:如肾盂肾炎,膀胱炎和尿道炎。
- 皮肤及软组织感染:如疖病,脓皮病和脓疱病。
治疗成人和12岁以上儿童的早期莱姆病,以及其后对晚期莱姆病的预防。
检验原始记录

检验原始记录成都市富友绿色调味品有限公司检验原始记录样品名称样品编号室温 ? 湿度 , 产品标准收样日期检验日期 , 产品批号批量样品数量 (生产日期)感标准要求应符合标准要求结果官检验方法 GB/T5009.3-2003恒重后称量瓶和样品质量(g) m2 称量瓶和样品质量(g) m 称量瓶编号称量瓶质量(g) m31水分 m,m计算: 12 X(g/100g) ,,100m,m13X= X= = X12检验方法 GB/T5009.40-2003分 NaOH浓度样品量样品稀释体积样品稀释液取用量消耗NaOH体积空白耗NaOH体积(mol/l) c (g) m (ml) v2 (ml) v (ml) v1 (ml) v0总10 (v,v),c,0.090计算: 酸 X(g/100g) ,,100析 vm,2 vX= X= = X12检验方法 GB/T5009.40-2003NaOH浓度样品量样品稀释体积样品稀释液取用量消耗NaOH体积空白耗NaOH体积(mol/l) c (g) m (ml) v2 (ml) v (ml) v1 (ml) v0 氨项基酸10(v,v),c,0.014计算: 态 X(g/100g) ,,100v氮 m,2目 vX= X= = X12检验方法 GB/T5009.40-2003AgNO3浓度样品量样品稀释体积样品稀释液取用量消耗AgNO3体积空白耗AgNO3体积(mol/l)c (g) m (ml)v2 (ml)v (ml)v1 (ml)v0食10(v,v),c,0.0585计算: 盐 X(g/100g) ,,100vm,2vX= X= X= 12主检: 复核:成都市富友绿色调味品有限公司出厂检验原始记录样品名称样品编号室温 ? 湿度 ,产品标准收样日期检验日期 , 产品批号批量样品数量 (生产日期)检验方法 GB/T 4789.3-2003最后结果毫升初次发酵乳平板生长二次乳糖发管号染色反应菌落形态 (克) 糖胆盐依红美兰酵管数大肠菌群最可能数12 分析大肠3项菌群 4目 5 MPN/100g6789主检: 复核:成都市富友绿色调味品有限公司出厂检验原始记录样品名称样品编号室温 ? 湿度 , 产品标准收样日期检验日期 , 产品批号批量样品数量 (生产日期)检验方法 GB/T 4789.3-2003最后结果毫升初次发酵乳平板生长二次乳糖发管号染色反应菌落形态 (克) 糖胆盐依红美兰酵管数大肠菌群最可能数12 分析大肠3项菌群 4目 5 MPN/100g6789主检: 复核:成都市富友绿色调味品有限公司净含量检验记录检验日期: 编号: 产品名称标注净含量批量样本量生产日期检验依据检验方法 JJF 1070-2005《定量包装商品净含量计量检验规则》皮重抽样数平均皮重允许短缺量修正因子编号 1 2 3 4 5 6 7 8 9 10 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 11 12 13 14 15 16 17 18 19 20 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 21 22 23 24 25 26 27 28 29 30 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 31 32 33 34 35 36 37 38 39 40 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 41 42 43 44 45 46 47 48 49 50 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 51 52 53 54 55 56 57 58 59 60 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 61 62 63 64 65 66 67 68 69 70 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 71 72 73 74 75 76 77 78 79 80 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 81 82 83 84 85 86 87 88 89 90 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 91 92 93 94 95 96 97 98 99 100 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 101 102 103 104 105 106 107 108 109 110 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 111 112 113 114 115 116 117 118 119 120 总重(g) 皮重(g) 实际含量(g) 偏差(g)编号 121 122 123 124 125 总重(g) 皮重(g) 实际含量(g) 偏差(g)实际含量平均实际含量标准偏差修正值修正结果大于1倍,小于或者等于大于2倍允许短缺量件数 2倍允许短缺量件数检验结论检验人(签字): 核验人员(签字):日期: 日期:成都市富友绿色调味品有限公司豆瓣出厂检验报告单样品型号样品批量名称规格数量生产产品样品等级日期标准编号检验室温 ? 湿度 , 报告日期日期序号检验项目标准规定检验结果单项结论应符合标准1 感官 ?合格?不合格 4.2的要求2 水分,g/100g ? ?合格?不合格3 氨基酸态氮(以氮计), g/100g ? ?合格?不合格4 总酸(以乳酸计),g/100g ? ?合格?不合格5 食用盐(以氯化钠计) ,g/100g ?合格?不合格 6 大肠菌群,MPN/100g ? ?合格?不合格应符合质检7 净含量 ?合格?不合格总局75号令的要求报告结论按标准检验,该样品出厂检验项目。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
起草人:年月日
审核人:年月日
批准人:年月日
氯化钠检验原始记录
供应商
批号
规格
数量
检验原始记录
氯化钠
批号
规格
取样日期
检验日期
页次:1/4
序号
检验摘要
检验人
复核人
1
2
3
3.1
3.2
3.3
3.4
性状
。
鉴别
取本品g,加水ml溶解后,作为供试品溶液。
﹙1﹚取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显。
3.6
3.7
3.8
3.9
用同一方法制成的对照液比较,结果。
硫酸盐﹙≤0.002%﹚
﹙1﹚取本品g,依《硫酸盐检查标准操作规程》检查,与标准硫酸钾溶液1.0ml制成的对照液比较,结果。
钡盐
﹙1﹚取本品,加水20ml溶解后,滤过,滤液分为两等份,一份中加稀硫酸2ml,另一份中加水2ml,静置15分,结果。
溶液的澄清度
﹙1﹚取本品g,加水25ml溶解后,溶液。
碘化物
﹙1﹚取本品的细粉g,置瓷蒸发皿内,滴加新配制的淀粉混合液(取可溶性淀粉0.25g,加水2ml,搅匀,再加沸水至25ml,随加随搅拌,放冷,加0.025mol/L硫酸溶液2ml,亚硝酸钠试液3滴与水25ml混匀)适量使晶粉湿润,置日光灯下观察,5分钟内晶粒。
﹙2﹚取供试品溶液,加醋酸氧铀锌试液,即生成。
﹙3﹚取供试品溶液,加硝酸使成酸性后,加硝酸银试液,即生成;加氨试液沉淀,再加硝酸,沉淀。
检查
酸碱度
﹙1﹚取本品g,加水50ml溶解后,加溴麝香草酚蓝指示液2滴,显,加氢氧化钠滴定液(0.02mol/L)0. 10ml,变为;加盐酸滴定液(0.02mol/L)0.20ml,变为。
检验日期
页次:3/4
序号
检验摘要
检验人
复核人
3.10
3.11
3.12
3.13
干燥失重﹙≤0.5%﹚
﹙1﹚取本品g,在130℃干燥至恒重,干燥失重为。
铁盐﹙≤0.0003%﹚
﹙1﹚取本品g,依《铁盐检查标准操作规程》检查,与标准铁溶液1.5ml制成的对照液比较,结果。
重金属﹙≤2ppm﹚
﹙1﹚取本品g,加水20ml溶解后,加醋酸盐缓冲液(PH3.5)2ml与水适量使成25ml,取标准铅溶液1ml加醋酸盐缓冲液(PH3.5)2ml与水适量使成25ml作为对照液,依《重金属检查标准操作规程》中第一法检查,结果。
钙盐
﹙1﹚取本品g,加水10ml使溶解,加氨试液1ml,摇匀,加草酸铵试液1ml,5分钟内。
镁盐﹙≤0.001%﹚
﹙1﹚取本品g,加水20ml使溶解,加氢氧化钠试液2.5ml与0.05%太坦黄溶液0.5ml,摇匀;生成的颜色与标准镁溶液(精密称取在800℃炽灼至恒重的氧化镁16.58mg,加盐酸2.5ml与水适量使溶解成1000ml,摇匀)1.0ml用同一方法制成的对照液比较,结果。
钾盐﹙≤0.02%﹚
﹙1﹚取本品g,加水20ml溶解后,加稀醋酸2滴,加四苯硼钠溶液(取四苯硼钠1.5g,置乳钵中,加水10ml研磨后,再加水40ml,研匀,用质密的滤纸滤过,即得)2ml,加水使成50ml,与标准硫酸钾溶液12.3ml用同一方法制成的对照液比较,结果。
检验原始记录
氯化钠
批号
规格
取样日期
砷盐﹙≤0.00004%﹚
﹙1﹚取本品g,加水23ml溶解后,加盐酸5ml,依《砷盐检查标准操作规程》检查,结果
。
检验原始记录
氯化钠
批号
规格
取样日期
检验日期
页次:4/4
检验摘要
检验人
复核人
4
含量测定﹙≥99.5%﹚
﹙1﹚取本品约0.12g,精密称定,加水50ml溶解后,加2%糊精溶液5ml与荧光黄指示液5~8滴,用硝酸银滴定液(0.1mol/L)滴定。每1ml的硝酸银滴定液(0.1mol/L)相当于5.844mg的NaCl。
溴化物
﹙1﹚取本品g,加水10ml使溶解,加盐酸3滴与氯仿1ml,边振摇边滴加2%氯胺T溶液(临用新制)3
滴,与标准溴化钾溶液(精密称取在105℃干燥至恒重的溴化钾0.1485g,加水使溶解成100ml,摇匀)1.0ml
检验原始记录
氯化钠
批号
规格
取样日期
检验日期
页次:2/4
序号
检验摘要
检人
复核人
3.5
m1=g m2=g F=
V1=mlV2=ml NaCl含量=
