第3章电解合成PPT课件
合集下载
《电解合成》课件

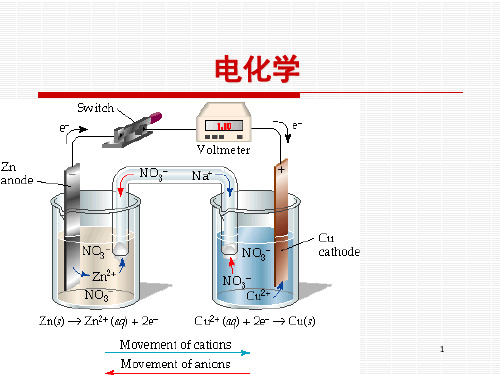
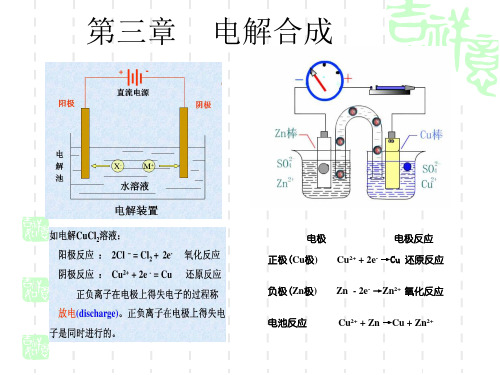
通过电解硫酸铜溶液,在阴极上沉积出金属铜。
铝的电解合成
利用电解氧化铝的方法,在阴极上获得金属铝。
3
镁的电解合成
通过电解熔融氯化镁,在阴极上获得金属镁。
有机化合物的电解合成
乙炔的电解合成
在加压条件下,电解食盐和 氢氧化钙的混合溶液,生成 乙炔和氢气。
甲醇的电解合成
通过电解甲醇水溶液,获得 甲醇和氢气。
电解合成的应用领域
电解合成在有色金属、稀有金属 、贵金属等领域有广泛应用,如 铜、镍、钴、金、银等金属的制
备。
电解合成还可应用于有机化学领 域,如电解还原反应、电化学氧 化反应等,可用于合成有机化合
物和药物等。
此外,电解合成还可应用于环保 领域,如废水处理、重金属回收
等。
02
电解合成的基本原理
电化学基础
操作条件
控制电解槽的操作温度、 压力、电流密度等参数, 确保电解反应的顺利进行 。
电解液的选择与优化
电解液成分
根据电解反应的要求,选 择合适的电解质和添加剂 ,如硫酸、氢氧化钠、甘 油等。
电解液浓度
优化电解液的浓度,以提 高电解反应的效率和产物 的纯度。
电解液稳定性
选择稳定性好的电解液, 以降低电解过程中的副反 应和腐蚀问题。
电解合成是一种高效、环保的化学合成方法,具有操作简便、能耗低、产物纯度 高、副产物少等优点。
电解合成的历史与发展
01
电解合成起源于19世纪初,随着 工业革命的发展,电解合成逐渐 成为一种重要的化学合成方法。
02
近年来,随着环保意识的提高和 新能源技术的不断发展,电解合 成技术也在不断创新和完善,应 用领域不断扩大。
02
对电解过程中产生的废弃物进行妥善处理,并探索资源化利用
铝的电解合成
利用电解氧化铝的方法,在阴极上获得金属铝。
3
镁的电解合成
通过电解熔融氯化镁,在阴极上获得金属镁。
有机化合物的电解合成
乙炔的电解合成
在加压条件下,电解食盐和 氢氧化钙的混合溶液,生成 乙炔和氢气。
甲醇的电解合成
通过电解甲醇水溶液,获得 甲醇和氢气。
电解合成的应用领域
电解合成在有色金属、稀有金属 、贵金属等领域有广泛应用,如 铜、镍、钴、金、银等金属的制
备。
电解合成还可应用于有机化学领 域,如电解还原反应、电化学氧 化反应等,可用于合成有机化合
物和药物等。
此外,电解合成还可应用于环保 领域,如废水处理、重金属回收
等。
02
电解合成的基本原理
电化学基础
操作条件
控制电解槽的操作温度、 压力、电流密度等参数, 确保电解反应的顺利进行 。
电解液的选择与优化
电解液成分
根据电解反应的要求,选 择合适的电解质和添加剂 ,如硫酸、氢氧化钠、甘 油等。
电解液浓度
优化电解液的浓度,以提 高电解反应的效率和产物 的纯度。
电解液稳定性
选择稳定性好的电解液, 以降低电解过程中的副反 应和腐蚀问题。
电解合成是一种高效、环保的化学合成方法,具有操作简便、能耗低、产物纯度 高、副产物少等优点。
电解合成的历史与发展
01
电解合成起源于19世纪初,随着 工业革命的发展,电解合成逐渐 成为一种重要的化学合成方法。
02
近年来,随着环保意识的提高和 新能源技术的不断发展,电解合 成技术也在不断创新和完善,应 用领域不断扩大。
02
对电解过程中产生的废弃物进行妥善处理,并探索资源化利用
水电解制氢工艺课件

第三章
• 第三章
氢氢(气气纯纯2化化)装装置置借助于氢、氧分离器的压力控制,保持电解槽小室中阴极侧
第二章 水和电解阳制氢极装置侧的压力平衡。
存在于气体中的有害杂质,有时不能靠物理方法从气体中除去,而是借助于催化剂的作用,使气体中的杂质被吸附在催化剂的表面,使杂质
与H+气的体•电中极的电(其位它=3-组1).分相维互起持化学水反应电,转解化为过无害程的化中合物所,这需种方的法称电为化解学催液化。含量。并观察液位。
氧气。
• 柱塞泵的作用是向系统输送纯水或补充电解碱液。 • 屏蔽泵(碱液循环泵)的作用是对电解液进行强制循环,
其循环的目的是:a补充槽休内电解消耗的纯水b带走电 解产生的热量c增加电解液的搅拌,降低浓度差极化电压d 降低含气度,减小功耗
第二章 水电解制氢装置
• 第四节 工艺流程介绍
第二章 水电解制氢装置
• 电解槽
第二章 水电解制氢装置
• 水电解槽是整套水电解制氢设备的核心,是发生电 化学反应的地方,在电解小室的阴、阳电极上分别 制得产品氢气和氧气。我们选用的电解槽为并联双 极性压滤型结构,若干根拉紧螺杆把二百多个电解 小室压紧在两个厚实的端压板之间。所有的外连管 道全部从两端压板上引出,上部为产品气和碱液混 合液的引出管,下部为循环碱液的引入管和排污管。 端压板采用平板结构。直流电的引入方式为中间极 板接正极,两端极板接负极。
第二章 水电解制氢装置
• 在直流电作用于氢氧化钾水溶液时,在阴 极和阳极上分别发生下列放电反应,见图:
第二章 水电解制氢装置
•第二节 水电解制氢装置的组成
• 本装置由电解槽、气液处理器、整流装置、控制柜(计算机管理系 统)、加水泵、碱箱、水箱等几大部分组成。
电解原理 PPT教学模板人教版

+
阴 极
C u 2+
Cl-
阳 Cl-极
Cl- Cl-
C u 2+
Cu2+ C l -
Cl-
Ⅱ通电后
电解原理 PPT教 学模板 人教版
一、电解原理 实验:用惰性(石墨)电极电解氯化铜溶液
阳极:2Cl--2e- =Cl2↑ 阴极:Cu2++2e- =Cu
总:CuCl2 电解 Cu+Cl2 ↑
电解原理 PPT教 学模板 人教版
电解原理 PPT教 学模板 人教版
一、电解原理
导线上电子定向移动: 负极 阴极 阳离子 阴离子 阳极 正极
电解原理 PPT教 学模板 人教版
溶液中离子定向移动: 阳离子 阴极 阴离子 阳极
电解原理 PPT教 学模板 人教版
课堂练习
例1 如下图所示装置中,属于电解池的是()
电解原理 PPT教 学模板 人教版
第3课时 电解原理
目录
CONTENTS
1、电解原理
2、电解池电极方程式的书写 及电解质溶液的恢复
PART 1
电解原理
电解原理 PPT教 学模板 人教版
一、电解原理 实验:用惰性(石墨)电极电解氯化铜溶液 记录实验现象: 阳极:有刺激性气味气体生成,并 能使湿润的KI-淀粉试纸变蓝--Cl2 阴极:碳棒上有一层红色的固体析出--Cu
电解原理 PPT教 学模板 人教版
电解原理 PPT教 学模板 人教版
一、电解原理
通电前: 阳离子:Cu2+ 阴离子:Cl做无规则运动
Cl- Cl- Cl-
C u 2+
Cl-
Cl-
C u 2+
Cu2+ C l -
电解有机合成技术介绍课件

应来合成有机化合物的技术。
02
反应过程中,有机化合物在电极表面发
生电化学反应,生成新的有机化合物。
03
反应过程中,电子的转移和离子的迁
移是反应的关键步骤。
04
电解有机合成技术可以应用于多种有机
化合物的合成,如药物、农药、香料等。
电解有机合成技术的影响因素
01
电解质浓度:影响电解 反应速率和产物选择性
其原理是通过电解有机化合物,使其发生化学反应, 生成新的有机化合物。
电解有机合成技术具有高效、环保、节能等优点, 广泛应用于有机合成、药物合成、材料合成等领域。
电解有机合成技术已成为有机合成领域的重要研究 方向之一。
电解有机合成技术的应用领域
药物合成:用于制备 药物中间体和活性成 分
材料科学:用于制备 新型材料,如高分子 材料、纳米材料等
环境科学:用于废水处 理和污染物降解
04
05
06
能源科学:用于制备新 型能源材料和储能设备
食品科学:用于食品添 加剂和营养成分的制备
生物技术:用于生物大 分子的合成和修饰
电解有机合成技术的未来研究方向
绿色化学: 研究更加环 保、节能、 高效的电解 有机合成方 法
生物催化: 利用生物酶 催化有机合 成反应,提 高反应效率 和选择性
能源领域:用于制备 新能源材料,如燃料 电池、太阳能电池等
精细化工:用于制备 精细化学品,如染料、 香料、农药等
环境保护:用于废水 处理、废气治理等环 境治理领域
生物技术:用于制备 生物活性物质,如酶、 蛋白质等
电解有机合成技术的优势
1
高效性:电解有机 合成技术可以大大 提高化学反应的效 率,缩短反应时间。
4.3.1 电解原理 课件(人教版选修4)

视频导学
学习探究
2. 实验原理分析
(1)氯化铜溶液中的电离过程有① CuCl2==Cu2++2Cl- ,
② H2O
H++OH-;溶液中存在的离子有 Cu2+、
Cl-_、__H__+_、__O__H_-_,通电前,这些离子在溶液中做自由移动。
(2)通电时,在电场的作用下,溶液中的离子 做 Cl-、OH-,即 Cu2+、H+ 趋向a极, 定向移动 趋
(√ ) (× ) (√ ) (√ ) (×)
知识回顾
温故追本溯源·推陈方可知新
3. 右图为电解水的实验装置图。根据图示回答下列问题:
(1)A端为电源的 正 极,C试管中收集到的气体是 O2 , D试管中收集到的气体是H2 。 (2)写出电解水的化学方程式:2H2O==电=解==2H2↑+O2↑。
高中化学精品课件 • 选修 4
第三节 电解池
第 1 课时 电解原理
本节知识目录
电解原理
目标定位 知识回顾 学习探究 自我检测
探究点一 电解原理 探究点二 酸、碱、盐溶液的电解规律
学习目标定位 1.会描述电解池的工作原理,能正确书写电解池的电极反应式和总反应方程式。 2.熟悉电解规律和电解产物的判断方法。
电解物质 H2O
pH变化 减小 增大 不变
复原方法 加入H2O
HCl
增大 加入HCl
CuCl2
NaCl、 H2O
CuSO4、 H2O
增大 减小
加入CuCl2
加入HCl
加入CuO 或CuCO3
学习探究 归纳总结
基础自学落实·重点互动探究
1.分析电解问题的基本方法思路
(1)通电前:电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。 (2)通电时:阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁优先 放电(注意活泼金属作阳极时优先放电)。 (3)正确书写电极反应式,要注意原子数、电荷数是否守恒。 (4)能结合题目要求分析电解时的各种变化情况,如两极现象、水的电 离平衡移动、离子浓度的变化、pH变化等。
学习探究
2. 实验原理分析
(1)氯化铜溶液中的电离过程有① CuCl2==Cu2++2Cl- ,
② H2O
H++OH-;溶液中存在的离子有 Cu2+、
Cl-_、__H__+_、__O__H_-_,通电前,这些离子在溶液中做自由移动。
(2)通电时,在电场的作用下,溶液中的离子 做 Cl-、OH-,即 Cu2+、H+ 趋向a极, 定向移动 趋
(√ ) (× ) (√ ) (√ ) (×)
知识回顾
温故追本溯源·推陈方可知新
3. 右图为电解水的实验装置图。根据图示回答下列问题:
(1)A端为电源的 正 极,C试管中收集到的气体是 O2 , D试管中收集到的气体是H2 。 (2)写出电解水的化学方程式:2H2O==电=解==2H2↑+O2↑。
高中化学精品课件 • 选修 4
第三节 电解池
第 1 课时 电解原理
本节知识目录
电解原理
目标定位 知识回顾 学习探究 自我检测
探究点一 电解原理 探究点二 酸、碱、盐溶液的电解规律
学习目标定位 1.会描述电解池的工作原理,能正确书写电解池的电极反应式和总反应方程式。 2.熟悉电解规律和电解产物的判断方法。
电解物质 H2O
pH变化 减小 增大 不变
复原方法 加入H2O
HCl
增大 加入HCl
CuCl2
NaCl、 H2O
CuSO4、 H2O
增大 减小
加入CuCl2
加入HCl
加入CuO 或CuCO3
学习探究 归纳总结
基础自学落实·重点互动探究
1.分析电解问题的基本方法思路
(1)通电前:电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。 (2)通电时:阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁优先 放电(注意活泼金属作阳极时优先放电)。 (3)正确书写电极反应式,要注意原子数、电荷数是否守恒。 (4)能结合题目要求分析电解时的各种变化情况,如两极现象、水的电 离平衡移动、离子浓度的变化、pH变化等。
1.3 课时1 电解的原理(20张PPT) 课件 高二化学鲁科版(2019)选择性必修1

得到
还原
(4)电子流向:电源____极→导线→电解池的___极;电解池的___极→导线→电源的___极。
负
阴
正
阳
一、电解原理
2.电解池
原电池
电解池
能量转换
构成条件
电极材料
电极反应
电子导体
离子导体
电极反应物、电极材料、离子导体和电子导体
无电源
有直流电源
负极→正极
电源负极→阴极;阳极→电源正极。
阳离子向正极迁移,阴离子向负极迁移。
S2->I->Br->Cl-> OH- >非还原性含氧酸根
2.电解水型:
水电离出的H+、OH-分别在两极放电。
NaCl
阴极:2H2O+2e-===H2↑+2OH-
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
同学们再见!
授课老师:
时间:2024年9月15日
pH逐渐减小
四、电解池电极反应式的书写
判断阴、阳极
分析电解质溶液或熔融电解质的组成
确定阴极、阳极上的放电物质及放电顺序
分析电极反应,判断电极产物,写出电极反应式
最后写出总反应方程式
原子守恒电荷守恒
1.用惰性电极电解MgCl2溶液阳极反应式:___________________;阴极反应式:_____________________________________;总反应离子方程式:____________________________________________。
还原
(4)电子流向:电源____极→导线→电解池的___极;电解池的___极→导线→电源的___极。
负
阴
正
阳
一、电解原理
2.电解池
原电池
电解池
能量转换
构成条件
电极材料
电极反应
电子导体
离子导体
电极反应物、电极材料、离子导体和电子导体
无电源
有直流电源
负极→正极
电源负极→阴极;阳极→电源正极。
阳离子向正极迁移,阴离子向负极迁移。
S2->I->Br->Cl-> OH- >非还原性含氧酸根
2.电解水型:
水电离出的H+、OH-分别在两极放电。
NaCl
阴极:2H2O+2e-===H2↑+2OH-
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
同学们再见!
授课老师:
时间:2024年9月15日
pH逐渐减小
四、电解池电极反应式的书写
判断阴、阳极
分析电解质溶液或熔融电解质的组成
确定阴极、阳极上的放电物质及放电顺序
分析电极反应,判断电极产物,写出电极反应式
最后写出总反应方程式
原子守恒电荷守恒
1.用惰性电极电解MgCl2溶液阳极反应式:___________________;阴极反应式:_____________________________________;总反应离子方程式:____________________________________________。
第三节电解原理精品PPT课件
= CO32-+7H2O C2H6-14e-+18OH-
= 2CO32-+12H2O
CH3OH-6e-+8OH= CO32-+6H2O
C3H8-20e-+26OH-
(6)
=3CO32-+17H2O
C4H10-26e-+34OH-
(7)
=4CO32-+22H2O
电池总反应
pH变化
2H2+O2==2H2O 2CO+O2+4OH-
将一个化学体系构成一个能够产生电流的装置的条件 1. 该体系必须包含一个能自发发生的氧化还原反应 2. 该体系必须有适当的装置能够将氧化反应和还原反应
分别在不同的区域进行 3. 内、外电路必须闭合
22 J & G CHEMWORLD
氧化还原反应与电现象-1
碱性燃料电池中有机物(如CH4、C2H6、CH3OH 等)的得失电子关系?负极反应的书写?
=2CO32+2H2O CH4+2O2+2OH-
=CO32-+3H2O 2C2H6+7O2+8OH-
=4CO32-+10H2O 2CH3OH+3O2+4OH-
=2CO32-+6H2O
C3H8+5O2+6OH=3CO32-+7H2O
2C4H10+13O2+16OH=8CO32-+18H2O
变小 变小 变小 变小 变小 变小 变小
⑴ 外接电源、
⑵与电源相连接的两电极、
⑶电解质溶液(或熔融的电解质)
2. 实验:电解氯化铜溶液
现象:
阳极:
= 2CO32-+12H2O
CH3OH-6e-+8OH= CO32-+6H2O
C3H8-20e-+26OH-
(6)
=3CO32-+17H2O
C4H10-26e-+34OH-
(7)
=4CO32-+22H2O
电池总反应
pH变化
2H2+O2==2H2O 2CO+O2+4OH-
将一个化学体系构成一个能够产生电流的装置的条件 1. 该体系必须包含一个能自发发生的氧化还原反应 2. 该体系必须有适当的装置能够将氧化反应和还原反应
分别在不同的区域进行 3. 内、外电路必须闭合
22 J & G CHEMWORLD
氧化还原反应与电现象-1
碱性燃料电池中有机物(如CH4、C2H6、CH3OH 等)的得失电子关系?负极反应的书写?
=2CO32+2H2O CH4+2O2+2OH-
=CO32-+3H2O 2C2H6+7O2+8OH-
=4CO32-+10H2O 2CH3OH+3O2+4OH-
=2CO32-+6H2O
C3H8+5O2+6OH=3CO32-+7H2O
2C4H10+13O2+16OH=8CO32-+18H2O
变小 变小 变小 变小 变小 变小 变小
⑴ 外接电源、
⑵与电源相连接的两电极、
⑶电解质溶液(或熔融的电解质)
2. 实验:电解氯化铜溶液
现象:
阳极:
材料合成与制备 第3章 电解合成
(3)合成中间价态或特殊低价元素化合物
碘仿(三碘甲烷)是一种氧化剂,具有很强的杀菌和局部抗感染 能力,广泛应用于医药工业,如药物合成中间体、消毒杀菌剂、医 药防腐剂、齿科添充制剂等;此外其尚可用于感光材料等,是一种 较重要的精细化学品。碘仿合成的传统工艺是由乙醇(或丙酮)与碘 的碱性溶液反应制得。
2、电解合成的优缺点
优点: (1)电解合成大部分在常温常压下进行,不需要特别的加 热、加压设备
(2)反应选择性高、副反应少、可制备出许多特定价态的化合物。 (3)产物的收率和纯度高,环境污染小。 (4)工艺参数易于控制、生产过程自动化程度高。 (5)可以用于制备其它方法不能制备的物质和聚集态。 缺点:耗电量大、电解槽结构复杂、电极寿命短。
电流密度(I/A)决定了电解过程的速率,电流密度增大,电解能力 (包括副反应)加快。为了提高产物的纯度和电流效率,常采用大的电 流强度和增大电极面积方法。
电解液性能:电导、电解液杂质离子净化 电解液必须稳定、电导性能良好、能使产物具有良好的析出状
态和吸收率、尽量不产生有害气体及发生副反应。电解液由主体电 解质和附加物质(不进行电解反应)组成。加入附加物质主要用于解 决以下问题:
阴极反应为: Li+e → Li; 与此同时,AlCl4-离子向阳极迁移,在阳极上失去电子,被氧 化成Cl和AlCl3,初生态的原子氯很快两两结台,生成Cl2放出AlCl3 则插入石墨层间。
阳极反应为: nC + AlCl3 → nC·AlCl3 + l/2Cl2 + Li 总反应方程式为:nC + Li+ + AlCl4 → nC·AlCl3 + l/2Cl2 + Li
物电极、陶瓷电极。由于本实验中阴极反应要在低电位下进行, 这必然要求阴极材料有很高的析氢过电位。常用析氢过电位高的 阴极材料有Hg,Pd,Cd,Zn,Sn和C,其中Hg,Pd,Cd有毒, Zn和Sn电极耐酸性差,因此选用导电石墨板作阴极。作为阳极 材料受到氧化条件下的稳定性和氧析出反应竞争反应的制约,可 供选择的阳极材料有Pt,镀Pt的Ti(Nb,Ta),PbO2和碳材料。
第三章高分子电解质1ppt课件

当两性高分子溶液大幅度偏离等电点状态时, 分子链上存在大量净电荷,分子链扩张;
其溶液行为与阴离子或阳离子聚电解质相似。 在等电点附近,带相反电荷的链节间形成内盐 键,分子链发生收缩,高分子的形态和性质会 发生很大变化。
1.两性高分子的溶解性
等电点时,两性高分子分子链上同时 有正负电荷存在,如果它们有机会接 触并形成盐键,则会导致高分子溶解 性下降。
第三章 高分子电解质
( polyelectrolytes)
高分子电解质(或聚电解质 polyelectrolytes)是指在高分子链上带 有可离子化基团的物质。
特性: 高分子电解质溶解于介电常数很大的溶剂,如在水中时, 就会发生离解,放出许多低分子离子,高分子本身则成为留下 若干离解位而带有与低分子离子相反电荷的聚离子。
聚4-乙烯吡啶正丁基溴季铵盐 聚丙烯酸钠
两性高分子电解质 (plyampholytes)
正、负电荷基团处于同一侧链上, 内盐聚合物或高分子胺内酯 (polymeric betains);
正、负电荷基团处于不同侧链上 (强酸强碱型、强酸弱碱型、弱酸 强碱型和弱酸弱碱型)
3按结构分类
主链上带离子基团的高分子电解质 侧基上带离子基团呈梳状分布的高分于电解质 中性单体与离子单体的共聚物
• 也可通过高分于化学反应法制备,例如:聚乙烯基 吡啶和环丁磺酸酯反应制备内盐聚合物。
笫三节 高分子电解质的性质
一、高分子电解质的基本性质 二、两性高分子电解质 三、聚电解质复合物 四、两亲聚电解质
一、高分子电解质的基本性质
1. 高分子电解质的离解平衡 2. 高分子电解质溶液的粘度 3. 高分子电解质溶液的渗透压 4. 高分子电解质的溶解性 5. 高分子电解质的化学性质
其溶液行为与阴离子或阳离子聚电解质相似。 在等电点附近,带相反电荷的链节间形成内盐 键,分子链发生收缩,高分子的形态和性质会 发生很大变化。
1.两性高分子的溶解性
等电点时,两性高分子分子链上同时 有正负电荷存在,如果它们有机会接 触并形成盐键,则会导致高分子溶解 性下降。
第三章 高分子电解质
( polyelectrolytes)
高分子电解质(或聚电解质 polyelectrolytes)是指在高分子链上带 有可离子化基团的物质。
特性: 高分子电解质溶解于介电常数很大的溶剂,如在水中时, 就会发生离解,放出许多低分子离子,高分子本身则成为留下 若干离解位而带有与低分子离子相反电荷的聚离子。
聚4-乙烯吡啶正丁基溴季铵盐 聚丙烯酸钠
两性高分子电解质 (plyampholytes)
正、负电荷基团处于同一侧链上, 内盐聚合物或高分子胺内酯 (polymeric betains);
正、负电荷基团处于不同侧链上 (强酸强碱型、强酸弱碱型、弱酸 强碱型和弱酸弱碱型)
3按结构分类
主链上带离子基团的高分子电解质 侧基上带离子基团呈梳状分布的高分于电解质 中性单体与离子单体的共聚物
• 也可通过高分于化学反应法制备,例如:聚乙烯基 吡啶和环丁磺酸酯反应制备内盐聚合物。
笫三节 高分子电解质的性质
一、高分子电解质的基本性质 二、两性高分子电解质 三、聚电解质复合物 四、两亲聚电解质
一、高分子电解质的基本性质
1. 高分子电解质的离解平衡 2. 高分子电解质溶液的粘度 3. 高分子电解质溶液的渗透压 4. 高分子电解质的溶解性 5. 高分子电解质的化学性质
电解PPT教学课件

阳极:SO42- OH- 4OH-- 4e → 2H2O +O2 (氧化反应
注意:电极反应式中得失电子数应相等.
总反应:
2CuSO4+
电解
2H2O → 2Cu
+
O2 ↑ +2H2SO4
分析:电解H2SO4溶液: 电极反应:
阴极:H+
4H+ +4e → 2H2 (还原)
阳极:SO42- OH- 4OH-- 4e → 2H2O + O2 (氧化)
电子的方向(与电流的方向相反):
电源负极→电解池阴极→电解质溶液 →电解池阳极→电源正极
分析: 电解饱和NaCl 不能忽略水的电离!
电极反应:
阴极:(Na+ H+) 2H+ +2e → H2 (还原反应) (得电子能力: H+ > Na+)
阳极:(Cl- OH-) 2Cl- - 2e → Cl2 (氧化反应) (失电子能力: Cl- > OH-)
• 电解反应 2NaCl+2H2O=2NaOH+H2↑+ Cl2↑
高中物理新人教版 必修2系列课件
6.1《行星的运动》
教学目标
• 知识与技能 • 1.知道地心说和日心说的基本内容. • 2.知道所有行星绕太阳运动的轨道都是椭圆,太阳处在
椭圆的一个焦点上. • 3.知道所有行星的轨道的半长轴的三次方跟它的公转周
(阳极) (阴极)
一.电解: 1.定义:使直流电通过电解质溶液或熔融的电解质,
在阴阳两极分别发生氧化还原反应的过程。
2.能量转化: 电能
化学能
3.装置: 电解池 电极 电极判断
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、电解合成的理论基础
3、电化学动力学
电极反应:作为一种界面反应,是直接在“电极/溶液”界面上实 现
的。“电极/溶液”界面性质对电极反应的动力学行为影响很大。
“电极/溶液”界面对
电极反应动力学性质
“化学因素”
的影响因素
“电场因素”
电极材料的化学性质 与表面状态。
“电极/溶液”界面上 的电场强度
6
(1) 电解质溶液的电导
不同种类的电解质,由于其正负离子的电量及其运 动速度不同,而使其导电能力不同,即导电率不同。
表3.1第一类导体、超导体、绝缘体电导率(25℃)
物质
Cu
Al
金属
Pt PbTiFra bibliotekHgκ/Ω-1·㎝-1
5.6×105 3.5×105 1.0×105 4.5×104 1.8×104 1.0×104
9
(1) 电解质溶液的电导
溶液电导率与浓度的关系(18℃)
溶液摩尔电导与浓度的关系(25℃)
由图可见,强酸的电导率比较大,强碱次之,盐类较低,至 于弱电解质乙酸的电导率就很低了。
10
(2) 离子独立移动规律
科尔劳奇(Kohlrausch)离子独立移动规律: 电解质的极限摩尔电导等于阳离子的极限摩尔电导与阴离子
2、电化学热力学
电极电位和标准电极电位 电极电位:将一金属电极浸入到具有该金属离子的电解质溶液 中,在金属和溶液的界面处产生的电位差。电极电位的绝对值无 法测量,其值是相对于标准氢电极的电极电势为零时的相对量。 奈斯特(Nernst)公式:
02.3n0F 3RTlga a还 氧原 化态 态
15
3.2 电解合成原理
各离子的迁移数:
当有电流通过电解质溶液时,移向阴极的阳离子和移向阳极的
阴离子所分担的输送电量比例。
t++t-=1
tU U U
tU U U
ti 1 (溶液中存在多种离子时)
12
(4) 活度和活度系数
对于强电解质溶液,通常用表观浓度--活度来代替浓度。 根据定义,电解质的活度a与阳离子活度a+、阴离子活度a-及平 均离子活度a±的关系如下:
的极限摩尔电导之和。
m
该规律揭示了在无限稀释电解质溶液中,阴、阳离子彼此独立,互
不干扰。任意浓度的电解质溶液中摩尔电导和极限摩尔电导之比叫
电导比(即弱电解质的离解度α)
m
m
11
(3) 离子电迁移率和迁移数
离子电迁移率或叫离子淌度(U): 在单位电场强度(即单位电位梯度)下离子移动的速度。H+和 OH-是极限电迁移率最高的阳离子和阴离子。
2
3.1 电解合成发展
电解合成的特点
调节电极电位,控制电极反应速度; 控制电极电位和选择适当的电极、溶剂使反应按所希 望的方向进行,故反应选择性高,副反应较少,可制备 出许多特定价态的化合物; 反应体系中不含其他反应试剂,产物不会被污染,容 易分离和收集,因此可得到收率和纯度都较高的产品。 电化学过程的电参数(电流、电压)便于数据采集、 过程自动化与控制。
电解质溶液的导电是由于电场中离子定向移动的结果,阴离 子移向阳极,阳离子移向阴极,其导电能力大小用电导(电阻的 倒数)表示。
a. 电导(G)及电导率(K)
G 1 I RU
GK A l
KGl 1(l ) A RA
电导率的物理意义是电极面积各为1cm2,两电极相距1cm时溶液
的电导,其数值与电解质种类、溶液浓度及温度等因素有关。
8
电解质溶液的浓度对 电导率的影响
(1) 电解质溶液的电导
b. 摩尔电导(Λm) 定义:当距离为单位长度(1m)的平行电极间含有1mol电 解质的溶液时,该溶液具有的电导称为溶液摩尔电导(Λm)。
m Vm
m
c
式中,Λm为摩尔电导,Ω-1·m2·mol-1;
κ为电导率,Ω-1·m-1;
Vm为含有1mol电解质的溶液体积,m3·mol-1; c为电解质溶液浓度,mol·m-3。
物质
超导 石墨 半导体(Si)
水 绝缘体 玻璃
云母
κ/Ω-1·㎝-1
1020 2.5×102
0.01 10-7 ~10-14 10-16
7
(1) 电解质溶液的电导
强电解质与弱电解质溶液的电导率 随浓度的变化规律有所不同,强酸 和强碱的电导率最大,盐类次之。
不论强、弱电解质,浓度增大时, 电导率均呈现先增加后降低的趋势。 在一定浓度范围内,随着电解质溶 液浓度的增加,电解质溶液中导电 质点数量的增加占主导,因而溶液 的电导率随之增加;当浓度增加到 一定程度后,由于溶液中离子间的 距离减小,相互作用增强,使离子 运动速度减小,电导率下降。
第3章
电解合成
3.1 电解合成发展
➢ 1799年Volta用锌片与铜片和H2SO4构成的电堆,世界第一个化学电源。 ➢ 1800年Nichoson和Carlisle利用Volta电堆进行电解水。 ➢ 1803年俄罗斯学者Перелов发明了电弧。 ➢ 1807年Sir Humphry Davy用电解法析出钾和钠。 ➢ 1870年电动机的发明推动了电化学工业和电化学理论工作的进展。 ➢ 19世纪70年代亥姆霍兹(Helmholtz)首次提出了双电层的概念。 ➢ 1887年阿伦尼乌斯(Arrhenius)提出了电离学说。 ➢ 1889年能斯特(Nernst)建立了电极电位的理论。 ➢ 1905年塔菲尔(Tafel)提出了电化学动力学的第一个定律--塔菲尔公式。 ➢ 1923年,Debye-Hückel的电解质溶液理论, ➢ 1924年Stern构建的双电层模型。 ➢ BDM双电层模型提出。
aaaa 2
平均活度系数
(
-) 1
-
13
3.2 电解合成原理
一、电解合成的理论基础
2、电化学热力学
电动势和理论分解电压 电动势:在一个电化学反应器中,当无电流通过时,两电极之间 自发产生的电位差。 理论分解电压:对电解池来说,电动势是电解反应所需的最低电 压值。
14
3.2 电解合成原理
一、电解合成的理论基础
3
3.1 电解合成发展
电解合成的存在的不足
耗电量大; 电解槽结构复杂; 电极活性物质寿命短; 生产管理和技术水平要求高。
4
3.2 电解合成原理
一、电解合成的理论基础
1、电解质溶液的基本性质
电解液按其组成 及结构分类
电解质溶液 熔融电解质
溶剂不同
电解质水 溶液
非电解质水 溶液
5
(1) 电解质溶液的电导
