12-过渡元素PPT课件
合集下载
过渡元素课件

Cr3+的配合物有数千种,绝大多数配位数:6 常见的是:[Cr(H2O)6]3+, 配合物多有颜色
[Cr(H2O)6 ]Cl2紫色 [Cr(H2O)5Cl]Cl2 H2O蓝绿色
[Cr(H2O)4Cl2 ]Cl 2H过渡2元O素绿色
18
12.2.4 铬(Ⅵ)盐 1. Cr2O72-与CrO42-间的转化
4.形成多种配合物
过渡元素
11
12.1 过渡元素通性
过渡元素
12
12.1 过渡元素通性
5.催化性
许多过渡元素及其化合物具有独特的催化性能,Pt,Pd, Fe,Cu,V,…..,PdCl2 , V2O5….等常用的催化剂
6.磁性
多数过渡金属原子或离子有未成对电子,具有顺磁性,未 成对电子数越多,磁矩越大
Sc
Ti
Eθ M 2 /M
/
V
可溶该金属 的酸 元素
---
各种酸 Fe
-1.63
热 HCl HF Co
E / V θ M2 /M
可溶该金属 的酸
-0.44
稀 HCl H2SO4 等
-0.29
缓溶解在 HCl 等酸中
V -1.2 (估算值) HNO3,HF 浓 H2SO4 Ni
-0.25
稀 HCl H2SO4 等
Cr 2H (稀) Cr2( 蓝) H2
O2 Cr3 (紫)
2Cr
2H 2SO 4
(浓)
Cr(2 SO
)
43
3SO2
H2O
在冷、浓硝酸中钝化
2. 铬(Ⅲ)的化合物
(1)Cr2O(3 铬绿) ——两性氧化物 制备:4Cr 3O2 Δ 2Cr2O3
12 过渡元素(一) 铜副族和锌副族

Cu2+的鉴定
—— 在酸性或中性溶液中,
用K4[Fe(CN)6]试剂 2Cu2+ +[Fe(CN)6]4- → Cu2[Fe(CN)6]
红褐色
12-2-2铜的重要化合物
Cu2O CuO 颜色 暗红色 黑色 溶解性 难溶于水,易溶于酸 热稳定性 稳定,1235 C 熔化也不分解 高 加入氨水 [Cu(NH3)2]+(无色) 微溶
12.1.4
氧化态
有多种氧化态。红色为常见的氧化态。
12.1.5 离子的颜色
Mn (Ⅱ) Fe(Ⅱ) Co(Ⅱ) Ni(Ⅱ) Cu(Ⅱ) Zn(Ⅱ)
水合离子呈现多种颜色。
12.1.6 氧化物及其水合物的酸碱性
同种元素,从高价到低价,碱性增强。 Mn2O7 MnO3 MnO2 Mn2O3 MnO 强酸性 酸性 两性 弱碱性 碱性 同一周期最高氧化态的氧化物及水合物, 从左到右碱性减弱,酸性增强。 Sc2O3 TiO2 CrO3 Mn2O7 强碱 两性 酸性 强酸 同族同氧化态,自上而下酸性减弱,碱 性增强。
a
通性
Uuu
ds ⅠB 区 族
Cu 铜
Ag 银
Au 金 岩石 (岩脉金) 砂砾 (冲积金)
主要 矿物
辉铜矿(Cu2S) 黄铜矿(CuFeS2) 赤铜矿(Cu2O) 孔雀石 (Cu2(OH)2CO3) 蓝铜矿 (Cu3(OH)2(CO3)2
闪银矿 (Ag2S) 角银矿 (AgCl)
放 射 性 元 素
通性 ds 区
但Mn特殊, φӨ(Mn2+/Mn)< φӨ(Cr2+/Cr)
φӨ(Ni2+/Ni) =-0.26V φӨ(Pd2+/Pd) = +0.92V
《过渡金属》PPT课件

当pH=11时,Cr(Ⅵ)几乎100%以CrO42-形 式存在;而当pH=1.2时,其几乎100%以 Cr2O72-形式存在。
Cr6+中(3d0)无d-d跃迁,但都显色,原因是Cr6+有较强的正 电场,O一端电子向Cr的3d轨道跃迁(此跃迁属p-d跃迁,是 电荷迁移跃迁的一种),吸收可见光区一定波长的光,使化合 物显色。
[
C
r2
O
2 7
]
[
C
r
O
2 4
]2 [ H
]2
1014
[
C
r2
O
2 7
]
[
C
r
O
2 4
]
2Байду номын сангаас
1014[H
]2
酸性 [H+]>10-7 [Cr2O72-]>[CrO42-]橙 中性 [H+]=10-7 [Cr2O72-]≈[CrO42-] 碱性 [H+]<10-7 [Cr2O72-]<[CrO42-]黄
➢钨丝还用于制做灯丝(温度可高达2600℃不熔化,发光率高、寿 命长),高温电炉的发热元件等。
3、存在和冶炼: 存在:铬铁矿[Fe(CrO2)2],灰鉬矿(MoS2), 白钨矿(CaWO4),黑钨矿[(Fe,Mn)WO4]
冶炼:MoO3 + 2Al 灼热 Mo + Al2O3 MoO3 + H2 450-650℃ MoO2 + H2O MoO2 + H2 950-1100 ℃ Mo + 2H2O WO3 + 3H2 650-820℃ W + 3H2O
显然,这是因为这类阳离子铬酸盐 有较小的溶度积的原因.
Cr6+中(3d0)无d-d跃迁,但都显色,原因是Cr6+有较强的正 电场,O一端电子向Cr的3d轨道跃迁(此跃迁属p-d跃迁,是 电荷迁移跃迁的一种),吸收可见光区一定波长的光,使化合 物显色。
[
C
r2
O
2 7
]
[
C
r
O
2 4
]2 [ H
]2
1014
[
C
r2
O
2 7
]
[
C
r
O
2 4
]
2Байду номын сангаас
1014[H
]2
酸性 [H+]>10-7 [Cr2O72-]>[CrO42-]橙 中性 [H+]=10-7 [Cr2O72-]≈[CrO42-] 碱性 [H+]<10-7 [Cr2O72-]<[CrO42-]黄
➢钨丝还用于制做灯丝(温度可高达2600℃不熔化,发光率高、寿 命长),高温电炉的发热元件等。
3、存在和冶炼: 存在:铬铁矿[Fe(CrO2)2],灰鉬矿(MoS2), 白钨矿(CaWO4),黑钨矿[(Fe,Mn)WO4]
冶炼:MoO3 + 2Al 灼热 Mo + Al2O3 MoO3 + H2 450-650℃ MoO2 + H2O MoO2 + H2 950-1100 ℃ Mo + 2H2O WO3 + 3H2 650-820℃ W + 3H2O
显然,这是因为这类阳离子铬酸盐 有较小的溶度积的原因.
过渡元素

通性
六、配合性 配合能力强,易形成一系列配合物, 配合能力强,易形成一系列配合物,因d轨道不满 轨道不满 而参加成键时易形成内轨型配合物。 而参加成键时易形成内轨型配合物。 它们的电负性较大, 它们的电负性较大,金属离子与配体间的相互作 用加强,形成较稳定的配合物。 用加强,形成较稳定的配合物。 中心离子半径在0.075~0.06nm范围内的配合物表 中心离子半径在 范围内的配合物表 现的较突出,主要表现在配位体交换慢,有些很慢。 现的较突出,主要表现在配位体交换慢,有些很慢。 在水溶液中长期放置: 在水溶液中长期放置 如:CrCl36H2O在水溶液中长期放置:
过渡元素
通 性 钛 分 族 钒 分 族 铬 分 族 锰 分 族 铁 系 元 素 铂 系 元 素 本 章 要 求
通性
IIIB IVB VB VIB VIIB 21 Sc 22 Ti 23 V 24 Cr 25 Mn VIII 26 Fe 27 Co 28 Ni
45 Rh 46
第一过渡 系元素
钪 钛
Y
钛分族
3、加热煮沸Ti(SO4)2和TiOSO4 、加热煮沸 Ti(SO4)2+H2O===TiOSO4+H2SO4 TiOSO4+H2O===H2TiO3↓+H2SO4 4、分离煅烧 、 H2TiO3===TiO2+H2O 5、碳氯法 、
1000-1100K TiO2+2C+2Cl2======TiCl4+2CO
[Cr(H2O)4Cl2]+(绿色 绿色)+H2O [Cr(H2O)5Cl]2+(浅绿色 浅绿色)+Cl绿色 浅绿色 [Cr(H2O)5Cl]2++H2O [Cr(H2O)6]3+(蓝紫色 蓝紫色)+Cl蓝紫色
过渡元素

简介
综合介绍
信息介绍
性质特征
信息介绍
周期表中从IIIB族到VIII族的元素。共有三个系列的元素(钪到镍、钇到钯和镧到铂),电子逐个填入他 们的3d、4d和5d轨道。有时人们把过渡元素的范围扩大到包括镧系元素和锕系元素。因此有时也把铜族元素包括 在过渡元素范围之内。锌族元素(IIB)形成稳定配位化合物的能力上与过渡元素很相似,因此也有人建议把锌 族元素归入过渡元素范围。各系列过渡元素的与阿兹半径自左而右缓慢递减,各族元素的半径自上而下略有增加, 但不像主族元素增加的那样显著。
制作模式
过渡金属大多有其独特的生产方法:电解法、金属热还原法、氢还原法和碘化物热分解法。 存在: 大多数过渡金属都是以氧化物或硫化物的形式存在于地壳中,只有金、银等几种单质可以稳定存在。
催化剂
过渡金属催化剂或是生命起源的关键
要解释生命如何在地球上出现这个悬而未决的大问题,就像是回答先有鸡还是先有蛋的悖论:诸如氨基酸和 核苷酸这样的基本生化物质,是如何在生物催化剂(蛋白质或核酶)出现之前而完成其构造的?在最新一期《生 物学通报》上,科学家发表论文指出,或是第三种类型的催化剂启动了深海热泉中的新陈代谢以及生命。
原子结构
原子构型
原子半径
原子构型
过渡元素原子电子构型的特点是它们的d轨道上的电子未充满(Pd例外),最外层仅有1~2个电子,它们的 价电子构型为(n-1)d1-9ns1-2(Pd为4d5s)。
过渡元素原子的价电子层结构和氧化态 注:划横线的表示比较常见、稳定的氧化态;带括号的表示不稳定的氧化态。 多电子原子的原子轨道能量变化是比较复杂的,由于在4s和3d、5s和4d、6s和5d轨道之间出现了能级交错 现象,能级之间的能量差值较小,所以在许多反应中,过渡元素的d电子可以部分或全部参加成键。
元素周期表的编排原则ppt课件

期表中的位置8 -,最外反层电映子了数=元最低素负价数
的表中原位置子同结位构素-和化学元性素质相的同 性元素质性。质
同1主、族F 没有相似正性价,O 通常不显示正价; 2、金属递元变素性只(从有上正至化下合,金价属而性无增强负,非价金。属性减弱)
同周期 递变性(从左完到整版右ppt课,金件 属性减弱,非金属性增40强)
F.X+32
完整版ppt课件
24
X、Y、Z是周期表中相邻的 三种短周期元素,X和Y同周 期,Y和Z同主族,三种元素
原子的最外层电子数之和为 17,核内质子数之和为31, 则X、Y、Z是
完整版ppt课件
25
X、Y是短周期元素,两者能组成化
合物X2Y3,已知X的原子序数为n,则Y的 原子序数可能为
(A)n+1
2 增金 3 强属
性 4逐 5渐
6
7
ⅢA ⅣA ⅤA ⅥA ⅦA 0
强
B
非
Al Si
金
属
Ge As
性
Sb Te
逐
Po At 渐 增
金属完整性版pp逐t课件渐增强
32
1.己知砹是原子序数最大的卤族元素,下列 关于砹的单质和化合物的叙述正确的是( )
A、砹是有色固体 B、AgAt易溶于水
C、HAt很稳定
2 10 11 18 19
(C)
(D) 6
11 12 13
24
67 14 31 32
完整版ppt课件
14
下列各图若为元素周期表中的 一部分(表中数字为原子序数),
其中X为35的是 AD
完整版ppt课件
15
2.如何来确定元素在周期表中的位置。
《过渡金属元素》课件

佩戴防护设备:如防护服、 手套、口罩等
遵守操作规程:严格按照 操作规程进行操作
定期进行安全培训:提高 员工安全意识和技能
建立应急处理机制:应对 突发安全事故
遵守法律法规:遵守国家 及行业相关法律法规
定期进行安全检查:及时 发现并消除安全隐患
过渡金属元素废弃物的分类和处理方法 资源化利用的技术和设备 资源化利用的经济效益和社会效益 资源化利用的法律法规和政策支持
氧化还原反应是 化学反应中常见 的反应类型
过渡金属元素在 氧化还原反应中 具有较高的活性
过渡金属元素在氧 化还原反应中能够 形成多种化合物
过渡金属元素在化学反应中具有催化作用 催化作用可以提高化学反应速率 催化作用可以降低化学反应的活化能 催化作用可以改变化学反应的方向和产物
PART FIVE
过渡金属元素在合金 材料中的作用:提高 合金的强度、硬度、 耐磨性等性能
有重要作用
过渡金属元素在自然界中主要以矿物和矿石的形式存在 常见的过渡金属矿物有铁、铜、镍、钴等 矿石是含有过渡金属元素的岩石,如铁矿石、铜矿石等 过渡金属元素在矿石中的含量和分布会影响其经济价值
过渡金属元素在自然界中主要 以矿物形式存在
提取方法:物理提取法、化学 提取法、生物提取法等
纯化方法:溶剂萃取法、离子 交换法、电化学法等
纯化程度:根据应用需求选择 合适的纯化程度
PART FOUR
配位键:过渡 金属元素与配 体形成的化学
键
作用:稳定过 渡金属元素的 电子结构,增 强其化学活性
应用:在化学 反应中,配位 键可以促进过 渡金属元素的
反应速率
例子:铁离子 与水形成配位 键,生成氢氧
化铁沉淀
过渡金属元素在 氧化还原反应中 起到重要作用
《元素周期表》PPT课件

63 95
64 96
65 97
元素周期表的整体结构
短周期(3个):第1.2.3 周期 周期 (7个) 元素周期表 主族(7个)ⅠA ~ ⅦA 族 副族(7个)ⅠB ~ ⅦB 过 渡 元 素
长周期(3个):第4.5.6周期
不完全周期(1个):第7 周期
(16个) Ⅷ族 第8 9 10 三个纵列 零族 稀有气体元素
练习:
1、已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
电子层数 最外层电子数
决定 决定
周期序数 主族序数
4、下列各表为周期表的一部分(表 中为原子序数),其中正确的是( D ) (A)
2 3 11 19 4
(B)
2 10 11 18 19
(C)
6 11 12 13 24
(D)
2)卤素单质与碱反应
X2+ 2NaOH = NaX+ NaXO+H2O
元素非金属性强弱判断依据:
1、单质与氢气生成气态氢化物的难易程度,化 合越容易,非金属性越强 2 形成气态氢化物的稳定性,气态氢化物越稳定,非 金属越强。 3、最高价氧化物的水化物的酸性强弱,酸性越强, 非金属性越强
4 非金属性强的元素可以把非金属性弱的元素从其盐 溶液中置换出来
长周期(3个):第4.5.6周期
不完全周期(1个):第7 周期
类别
周期序 数 1 2 3 4
起止元 素 H—He Li—Ne Na—Ar K—Kr Rb—Xe
包括元素 种数 2 8 8 18 18
核外电子 层数 1 2 3 4 5
短周期
长周期
5
6
不完全 周期 7
Cs—Rn
过渡金属元素ppt课件

过渡金属元素
(ⅢB~ⅤⅢ族,d 区)
(n-1)d1~9 ns1~2 (例外 Pd 4d10 5s0 )
表 过渡金属元素(d 区元素共 25 种)
周期\族 ⅢB ⅣB ⅤB ⅥB ⅦB
Ⅷ
四 Sc Ti Ⅴ Cr Mn Fe Co Ni
五 Y Zr Nb Mo Tc
Ru Rh Pd
六 La Hf Ta W Re
4f 2~145d 0-1 6s 2 锕系 89Ac~103Lr 铹(15 种元素)
5f 0~146d 0~1 7s 2
→“内过渡元素”
1
过渡元素的通性
一、价电子构型
通式:(n-1)d1~9 ns1~2
中性原子的原子轨道能量随原子序数的变化:n 和 l 竞争。
例外:Z = 24,41 ~ 46:“能量最低原理”
H2O O OH2 \ /\ /
Fe
Fe
2 个八面体共棱
/ \/ \
H2O H2O
O OH2 H H2O
pH ↗ 胶体溶液 pH ↗ Fe2O3·xH2O↓
Cr3+、Al3+、类似 Fe3+
15
八、形式多碱、多酸倾向
(二)多酸
由含氧酸缩合脱 H2O 而形成“多酸”
例:
O
O
Cr
Cr
/ \ /\
(一)同一周期:
r↘,Z*↗,I1 和(I1+I2)↗,(总趋势)
左
右
(二)同一副族:
原子半径 r 第四周期
^ 第五周期
∫ 第六周期
有效核电荷 Z* ^ ^
第一电离能 I1 交错(基态电子构型不同)
^
图 7-1 第一、二、三过渡系列金属元素第一电离能变化
(ⅢB~ⅤⅢ族,d 区)
(n-1)d1~9 ns1~2 (例外 Pd 4d10 5s0 )
表 过渡金属元素(d 区元素共 25 种)
周期\族 ⅢB ⅣB ⅤB ⅥB ⅦB
Ⅷ
四 Sc Ti Ⅴ Cr Mn Fe Co Ni
五 Y Zr Nb Mo Tc
Ru Rh Pd
六 La Hf Ta W Re
4f 2~145d 0-1 6s 2 锕系 89Ac~103Lr 铹(15 种元素)
5f 0~146d 0~1 7s 2
→“内过渡元素”
1
过渡元素的通性
一、价电子构型
通式:(n-1)d1~9 ns1~2
中性原子的原子轨道能量随原子序数的变化:n 和 l 竞争。
例外:Z = 24,41 ~ 46:“能量最低原理”
H2O O OH2 \ /\ /
Fe
Fe
2 个八面体共棱
/ \/ \
H2O H2O
O OH2 H H2O
pH ↗ 胶体溶液 pH ↗ Fe2O3·xH2O↓
Cr3+、Al3+、类似 Fe3+
15
八、形式多碱、多酸倾向
(二)多酸
由含氧酸缩合脱 H2O 而形成“多酸”
例:
O
O
Cr
Cr
/ \ /\
(一)同一周期:
r↘,Z*↗,I1 和(I1+I2)↗,(总趋势)
左
右
(二)同一副族:
原子半径 r 第四周期
^ 第五周期
∫ 第六周期
有效核电荷 Z* ^ ^
第一电离能 I1 交错(基态电子构型不同)
^
图 7-1 第一、二、三过渡系列金属元素第一电离能变化
过渡元素
变 浅
VO43- 淡黄 NbO43-无色 TaO43-无色
CrO42-黄色 MoO42-淡黄 WO42-淡黄
MnO4-紫红色 TcO4-淡红 ReO4-淡红
变 浅
(d)同种元素在同一化合物中存在不同氧化态时,这种
混合价态的化合物常常呈现颜色,而且该化合物的颜色比
相应的单一价态化合物的颜色深
例如:
普鲁士兰 黄血盐 赤血盐
(2)物质显色的若干规律(常温,太阳光)
(a)绝大多数具有d1-9电子组态的过渡元素和f1-13
电子组态的稀土元素的化合物都有颜色
f 区
Ce3+ Pr3+
Nd3+
Pm3+ Sm3+ Eu3+ Gd3+
Tb3+
Dy3+
Ho3+
Er3+
Tm3+ Yb3+
无色 黄绿 红紫 粉红 淡黄 粉红 无色 粉红 淡黄 黄色 桃色 淡绿 无色
原子 半径 pm 181 160 143 136 136 133 135 138 144 149
第一电离 能
氧化值
kJ·mol-1 606.4 3
642.6 2, 3, 4
642.3 2, 3, 4, 5
691.2 0, 2, 3, 4, 5, 6
708.2 0, 4, 5, 6, 7
707.6 0, 3, 4, 5, 6, 7, 8
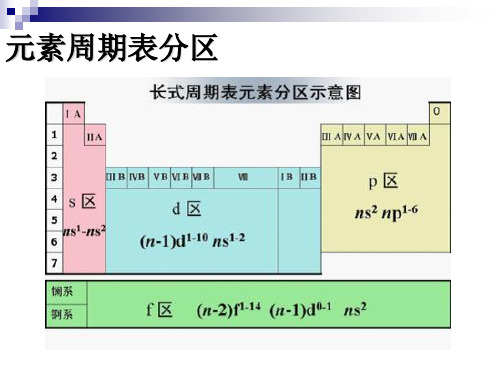
元素周期表分区
一、过渡元素的通性
1、过渡元素的氧化态 2、原子半径的变化规律 3、过渡元素单质的性质 4、过渡元素离子的颜色 5、过渡金属及其化合物的磁性 6、过渡元素易形成配合物 7、形成多碱、多酸
一、过渡元素的通性
1、过渡元素的氧化态
(1)大多数过渡元素有可变的氧化数
(2)第一过渡系,随原子序数增加,氧化态升高, 高氧化态趋于稳定,当d电子超过5时,3d轨道趋向 稳定,低氧化态趋于稳定;
过渡金属元素ppt课件

其中:ΦA / V
Cr2O72 -/ Cr3+
1.33
MnO4- / Mn2+
1.49
FeO42- / Fe2+ NiO42- / Ni2+
1.84 1.75
5
(三)氧化态的稳定性
2.同一族
高稳氧 氧定化 化性性 态↗↘
Ⅵ
CrO42-/Cr3+ MoO4-/M3+ WO42-/W3+
Ⅶ
MnO4-/Mn2+ TcO4-/Tc+3 ReO4-/Re3+
ⅢB ⅦB Ⅷ
+3 +7 +6 最高氧化态氧化性↗ 最高氧化态稳定性↘
低氧化态稳定性↗
例 第一过渡系列:
氧化性 稳定性
Sc3+ < TiO2+ < VO2+ < Cr2O72 - < MnO4- < FeO42Sc3+ > TiO2+ > VO2+ > Cr2O72- > MnO4- > FeO42-
例:r / pm 57 La 187.7, 71 Lu 173.5
Δr
187.7 173.5 = 71 57
≈ 1 pm
9
三、原子半径:
“镧系收缩”
——从 57 Ln – 71 Lu,随着原子序数递增,增加的电子进入 (n-2) f(即 4f)轨道(4f 0 ~145d 0~16s 2);对于最外层 6s 电子而言,4f 电子位于次外层, Z*增加很小,因此
过渡金属元素
(ⅢB~ⅤⅢ族,d 区)
(n-1)d1~9 ns1~2 (例外 Pd 4d10 5s0 )
第12讲副族元素课件

碱 钛酸盐 :
酸
钛氧盐
大多难溶于水
BaCO3+TiO2 → BaTiO3+CO2 Na2TiO3+2H2O → H2TiO3+2NaOH TiOSO4+2H2O → H2TiO3+H2SO4
10
(4)TiCl4 最重要的Ti卤化物,通常同TiO2、氨气 和焦炭高温反应而得。
结构:TiCl4中Ti取sp3杂化,形成正四面 体构型,为共价化合物。
Ti(SO4)2与碱金属硫酸盐也可生成配合物M2[Ti(SO4)3] 如K2[Ti(SO4)3]。
若往此溶液中加入铵根离子,则可析出黄色的(NH4)2[TiCl6]
12
❖ 三、钒副族 ❖ 1、钒副族元素基本性质 ❖ 钒副族包括钒、铌、钽三个元素,它们
的价电子层结构为(n-1)d3ns2,5个价电子 都可以参加成键,因此最高氧化态为 +5, 相当于d0的结构,为钒族元素最稳定的一 种氧化态。
Cr2O72- + 4 Cl- + 6 H3O+
2 CrO2Cl2 + 9 H2O
蒸发至冒烟
19
(4) 铬绿 ( Cr2O3 )
制 备: 4Cr 3O2 Δ 2Cr2O3
(NH4 )2 Cr2O7 Δ Cr2O3 N2 4H2O
2 Na2Cr2O7 + 3 C
2 Cr2O3 + 2 Na2CO3 + CO2
8
❖ (2)二氧化钛
❖ 白色粉未,不溶于水,也不溶于稀酸,但通常于氢 氟酸和热的浓硫酸中。
❖ TiO2+6HF=H2[TiF6]+2H2O TiO2+2H2SO4=Ti(SO4)2+2H2O TiO2+H2SO4=TiOSO4+H2O
《过渡元素概述》课件

1 鼠标悬停
当鼠标悬停在元素上时,使用过渡元素可以 实现平滑的鼠标移入效果,为网页添加互动 性。
2 点击事件
当元素被点击时,使用过渡元素可以实现点 击后的过渡动画,让用户感知到元素被点击 的反馈。
3 属性变化
当元素的属性发生变化时,使用过渡元素可 以使属性的变化平滑过渡,使网页的交互更 加自然。
4 页面加载
过渡元素的注意事项
性能 浏览器兼容性
过渡元素的性能较差,不宜过度使用。
不同浏览器上的过渡元素表现可能会有所不同, 需考虑兼容性问题。
当页面加载时,使用过渡元素可以实现页面 的平滑过渡效果,给用户更好的视觉体验。
如Байду номын сангаас使用过渡元素?
CSS属性transition
使用transition属性来指定需要过渡的属性以及过渡 时长。可以控制过渡效果的速度曲线和循环播放。
CSS属性transform-origin
使用transform-origin属性来规定3D变换的基点,可 以控制元素转换的中心点位置。
《过渡元素概述》PPT课 件
过渡元素指的是在CSS中,可以在不同状态之间实现平滑过渡效果的元素。 通过过渡元素可以让网页更加丰富、更加生动。
过渡元素是什么?
过渡元素是CSS中能够实现平滑过渡效果的元素。通过改变元素的属性,我们可以在不同状态之间实现流畅 的过渡效果,从而增加网页的动感和吸引力。
过渡元素的使用场景
《过渡元素化学》课件

器件
化学工业:用 航空航天工业: 于制造催化剂、 用于制造耐高 染料、农药等 温、耐腐蚀的
合金材料
核工业:用于 制造核燃料和 核反应堆的部
件
环保工业:用 于处理废水、 废气等污染物
过渡元素在生物体内 的作用:如铁、铜、 锌等在血液、骨骼、 神经等系统中的作用
过渡元素在药物中 的应用:如铁、铜、 锌等在药物中的作 用
汇报人:
原子结构:过渡元素原子核外电子排布具有周期性规律 电子排布:过渡元素原子核外电子排布具有周期性规律 电子排布特点:过渡元素原子核外电子排布具有周期性规律 电子排布规律:过渡元素原子核外电子排布具有周期性规律
金属性:过渡元素中,金属性最强的是铼,最弱的是铋 非金属性:过渡元素中,非金属性最强的是铋,最弱的是铼 电离能:过渡元素中,电离能最高的是铼,最低的是铋 过渡元素的物理性质与其金属性和非金属性有关,电离能是衡量元素化学性质的重要指标
磁性:过渡 元素具有磁 性,其中铁、 钴、镍等元 素具有较强 的磁性
热导率:过 渡元素的热 导率较高, 其中铜、银 等元素具有 较高的热导 率
电导率:过 渡元素的电 导率较高, 其中铜、银 等元素具有 较高的电导 率
熔点:过 渡元素的 熔点较高, 其中钨、 钼等元素 具有较高 的熔点
硬度:过 渡元素的 硬度较高, 其中钨、 钼等元素 具有较高 的硬度
应用:氧化物和氢氧化物在工业、化学实验和日常生活中有广泛的应用,如催化剂、颜料、药物等
盐类:过渡元素与 酸或碱反应生成的 化合物,如氯化铁、 硫酸铜等
络合物:过渡元素 与有机配体形成的 化合物,如铁氰化 钾、铜氨络合物等
性质:盐类和络合物 具有不同的物理和化 学性质,如颜色、溶 解度、稳定性等
化学工业:用 航空航天工业: 于制造催化剂、 用于制造耐高 染料、农药等 温、耐腐蚀的
合金材料
核工业:用于 制造核燃料和 核反应堆的部
件
环保工业:用 于处理废水、 废气等污染物
过渡元素在生物体内 的作用:如铁、铜、 锌等在血液、骨骼、 神经等系统中的作用
过渡元素在药物中 的应用:如铁、铜、 锌等在药物中的作 用
汇报人:
原子结构:过渡元素原子核外电子排布具有周期性规律 电子排布:过渡元素原子核外电子排布具有周期性规律 电子排布特点:过渡元素原子核外电子排布具有周期性规律 电子排布规律:过渡元素原子核外电子排布具有周期性规律
金属性:过渡元素中,金属性最强的是铼,最弱的是铋 非金属性:过渡元素中,非金属性最强的是铋,最弱的是铼 电离能:过渡元素中,电离能最高的是铼,最低的是铋 过渡元素的物理性质与其金属性和非金属性有关,电离能是衡量元素化学性质的重要指标
磁性:过渡 元素具有磁 性,其中铁、 钴、镍等元 素具有较强 的磁性
热导率:过 渡元素的热 导率较高, 其中铜、银 等元素具有 较高的热导 率
电导率:过 渡元素的电 导率较高, 其中铜、银 等元素具有 较高的电导 率
熔点:过 渡元素的 熔点较高, 其中钨、 钼等元素 具有较高 的熔点
硬度:过 渡元素的 硬度较高, 其中钨、 钼等元素 具有较高 的硬度
应用:氧化物和氢氧化物在工业、化学实验和日常生活中有广泛的应用,如催化剂、颜料、药物等
盐类:过渡元素与 酸或碱反应生成的 化合物,如氯化铁、 硫酸铜等
络合物:过渡元素 与有机配体形成的 化合物,如铁氰化 钾、铜氨络合物等
性质:盐类和络合物 具有不同的物理和化 学性质,如颜色、溶 解度、稳定性等
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铬元素的电势图
价电子构型:3d 54s1
EAθ
/
Cr
2
O
2 7
1.33
Cr 3 -0.41 Cr 2 -0.91 Cr
-0.74
EBθ
/CrO
2 4
-0.12
Cr(OH)
4
-1.1
Cr(OH) 2
-1.4 Cr
-1.3
性质
(1)灰白色, 熔点沸点高,硬度大 (2)活泼金属,表面易形成. 一层成氧化膜,活泼性下降15
(3)无膜金属与酸的反应
Cr 2H (稀) Cr 2( 蓝) H2
O2 Cr 3 (紫)
2Cr
2H 2SO 4 (浓)
Cr(2 SO
)
43
3SO 2
H2O
在冷、浓硝酸中钝化
2. 铬(Ⅲ)的化合物
(1)Cr2O(3 铬绿) ——两性氧化物 制备:4Cr 3O 2 Δ 2Cr 2O3
(NH 4 )2 Cr2O7 Δ Cr2O3 N2 4H 2O
总趋势:从左至右活泼性降.低
Mn
-1.17 稀 HCl H2SO4 等
Zn
-0.763 稀 HCl H2SO4 等
7
12.1 过渡元素通性
Eθ Ni2/Ni 0.25V Eθ Pd2/Pd 0.92V E θ Pt2/Pt 1.2V(估计值)
Eθ Zn2/Zn 0.763V Eθ Cd2/Cd 0.403V Eθ Hg2/Hg 0.854V
pH>6:CrO42-为主 溶解度的影响 Ksθp (Ag2Cr2O7 ) 2.0107
Ksθp (Ag2CrO4 ) 1.11012
4Ag Cr2O72 H2O 2Ag2CrO 4 (s,砖红) 2H
2Ba 2 Cr2O72 H2O 2BaCrO 4 (s,柠檬黄) 2H
2Pb 2
[Cr(H
2O)6 ]Cl
紫色
2
[Cr(H 2O)5Cl]Cl 2 H2O蓝绿色
[Cr(H 2O)4Cl 2 ]Cl 2H2. O绿色
18
12.2.4 铬(Ⅵ)盐 1. Cr2O72-与CrO42-间的转化 pH值的影响
2CrO
2 4
2H
(黄)
2HCrO
4
Cr2O72 H2O
(橙)
pH<2:Cr2O72-为主
f区元素价电子层结构: (n-2)f0-14ns2或
2. 原子半径
(n-2)f0~14(n-1)d1~2ns2
.
3
12.1 过渡元素通性
3. d区元素的第一电离能
总趋势: 同周期 左右 小大
同副族 不规律.
4
12.1 过渡元素通性
4.物理性质
(1) 熔点、沸点高
熔点最高的单质:钨(W)
(2) 硬度大
6.磁性
多数过渡金属原子或离子有未成对电子,具有顺磁性,未 成对电子数越多,磁矩越大
.
13
12.2 铬的重要化合物
12.2.1 铬(Ⅲ )氧化物及氢氧化物 12.2.2 铬(Ⅲ )盐及其性质 12.2.3 铬(Ⅲ )的配合物 12.2.4 铬(Ⅵ)盐
.
14
12.2.1 铬(Ⅲ)氧化物及氢氧化物
铬 (VIB): Cr 1. 单质铬的性质
1) 水解
[Cr(H 2O)6 ]3 [Cr(OH)(H 2O)5 ]2 H
Kθ 104
2Cr 3 3S2 6H 2O Cr(OH )3 (s) 3H 2S(g)
2Cr
3
3CO
23
3H
2O
.
2Cr(OH
)3 (s)
3CO
2 (g)
17
2)还原性
酸性条件:
Eθ
(Cr2O
2 7
/
Cr
3
)
1.33V
Cr2O72
H2O
2PbCrO .
4 (s,黄)
2H
19
2. Cr2O72-的氧化性 Eθ (Cr2O72/Cr 3 ) 1.33V
Cr2O72
3SO
2 3
8H
3SO
2 4
2Cr 3
4H2O
Cr2O72 3H 2S 8H 3S 2Cr 3 7H 2O
Cr2O72 6I 14H 3I 2 2Cr 3 7H 2O
硬度最大的金属:铬(Cr)
(3) 密度大
密度最大的单质:锇(Os)
(4) 导电性,导热性,延展性好
熔点变化示意图
.
5
12.1 过渡元素通性
密度变化示意图
.
6
12.1 过渡元素通性
12.1.2 化学性质
1. 化学性质的变化规律
元素
Sc
Ti
Eθ M2/M
/
V
可溶该金属 的酸 元素
---
各种酸 Fe
-1.63
性质:Cr2O3 6H Cr 3 3H 2O
3H 2O
Cr2O3
2OH.
2Cr(OH)
4
16
(2) Cr(OH) 3
(适量)OH (灰绿)
Cr 3
H
Cr(OHΔ) 3(s)
OH
(亮绿色)
Cr(OH)
4
H2O Cr2O3 (绿)
12.2.2 Cr3+盐及其性质
(1) Cr3+盐 Cr(2 SO4)3,KCr(SO 4)2 12H 2O, CrCl 3
2Cr3 3S2O82 7H2O Ag Cr2O72 SO24 14H
碱性条件:
Eθ
(CrO
4
/
Cr(OH)
4
)
0.12V
2Cr(OH)
4
3H 2O2
2OH
CrO
2 4
8H 2O
3)氧化性 Cr 3 Zn(s) 2Cr 2 (蓝色) Zn2
12.2.3 Cr3+的配合物
Cr3+的配合物有数千种,绝大多数配位数:6 常见的是:[Cr(H2O)6]3+, 配合物多有颜色
第12章 过渡元素 (5h)
12.1 过渡元素通性 12.2 铬的重要化合物 12.3 锰的重要化合物 12.4 铁 钴 镍的重要化合物 12.5 ds区元素
.
1
.
2
12.1 过渡元素通性
12.1.1 过渡元素简介
1. 原子的价电子层构型
d区元素价电子层结构: (n-1)d1-9ns1-2
ds区元素价电子层结构: (n-1)d10ns1-2
热 HCl HF Co
E / V θ M2 /M
可溶该金属 的酸
-0.44
稀 HCl H2SO4 等
-0.29
缓慢溶解在 HCl 等酸中
V
-1.2 (估算值)
HNO3,HF 浓 H2SO4
Ni
Cr
-0.86
稀 HCl H2SO4
Cu
-0.25
稀 HCl H2SO4 等
+0.34
HNO3,浓热 H2SO4
总趋势:从上到下活泼性降低
.
8
12.1 过渡元素通性
2. 多种氧化值
红色为常见的氧化态
.
9
12.1 过渡元素通性
3.离子呈现多种颜色
.
10
12.1 过渡元素通性
4.形成多种配合物
.
11
12.1 过渡元素通性
.
12
12.1 过渡元素通性
5.催化性
许多过渡元素及其化合物具有独特的催化性能,Pt,Pd, Fe,Cu,V,…..,PdCl2 , V2O5….等常用的催化剂
价电子构型:3d 54s1
EAθ
/
Cr
2
O
2 7
1.33
Cr 3 -0.41 Cr 2 -0.91 Cr
-0.74
EBθ
/CrO
2 4
-0.12
Cr(OH)
4
-1.1
Cr(OH) 2
-1.4 Cr
-1.3
性质
(1)灰白色, 熔点沸点高,硬度大 (2)活泼金属,表面易形成. 一层成氧化膜,活泼性下降15
(3)无膜金属与酸的反应
Cr 2H (稀) Cr 2( 蓝) H2
O2 Cr 3 (紫)
2Cr
2H 2SO 4 (浓)
Cr(2 SO
)
43
3SO 2
H2O
在冷、浓硝酸中钝化
2. 铬(Ⅲ)的化合物
(1)Cr2O(3 铬绿) ——两性氧化物 制备:4Cr 3O 2 Δ 2Cr 2O3
(NH 4 )2 Cr2O7 Δ Cr2O3 N2 4H 2O
总趋势:从左至右活泼性降.低
Mn
-1.17 稀 HCl H2SO4 等
Zn
-0.763 稀 HCl H2SO4 等
7
12.1 过渡元素通性
Eθ Ni2/Ni 0.25V Eθ Pd2/Pd 0.92V E θ Pt2/Pt 1.2V(估计值)
Eθ Zn2/Zn 0.763V Eθ Cd2/Cd 0.403V Eθ Hg2/Hg 0.854V
pH>6:CrO42-为主 溶解度的影响 Ksθp (Ag2Cr2O7 ) 2.0107
Ksθp (Ag2CrO4 ) 1.11012
4Ag Cr2O72 H2O 2Ag2CrO 4 (s,砖红) 2H
2Ba 2 Cr2O72 H2O 2BaCrO 4 (s,柠檬黄) 2H
2Pb 2
[Cr(H
2O)6 ]Cl
紫色
2
[Cr(H 2O)5Cl]Cl 2 H2O蓝绿色
[Cr(H 2O)4Cl 2 ]Cl 2H2. O绿色
18
12.2.4 铬(Ⅵ)盐 1. Cr2O72-与CrO42-间的转化 pH值的影响
2CrO
2 4
2H
(黄)
2HCrO
4
Cr2O72 H2O
(橙)
pH<2:Cr2O72-为主
f区元素价电子层结构: (n-2)f0-14ns2或
2. 原子半径
(n-2)f0~14(n-1)d1~2ns2
.
3
12.1 过渡元素通性
3. d区元素的第一电离能
总趋势: 同周期 左右 小大
同副族 不规律.
4
12.1 过渡元素通性
4.物理性质
(1) 熔点、沸点高
熔点最高的单质:钨(W)
(2) 硬度大
6.磁性
多数过渡金属原子或离子有未成对电子,具有顺磁性,未 成对电子数越多,磁矩越大
.
13
12.2 铬的重要化合物
12.2.1 铬(Ⅲ )氧化物及氢氧化物 12.2.2 铬(Ⅲ )盐及其性质 12.2.3 铬(Ⅲ )的配合物 12.2.4 铬(Ⅵ)盐
.
14
12.2.1 铬(Ⅲ)氧化物及氢氧化物
铬 (VIB): Cr 1. 单质铬的性质
1) 水解
[Cr(H 2O)6 ]3 [Cr(OH)(H 2O)5 ]2 H
Kθ 104
2Cr 3 3S2 6H 2O Cr(OH )3 (s) 3H 2S(g)
2Cr
3
3CO
23
3H
2O
.
2Cr(OH
)3 (s)
3CO
2 (g)
17
2)还原性
酸性条件:
Eθ
(Cr2O
2 7
/
Cr
3
)
1.33V
Cr2O72
H2O
2PbCrO .
4 (s,黄)
2H
19
2. Cr2O72-的氧化性 Eθ (Cr2O72/Cr 3 ) 1.33V
Cr2O72
3SO
2 3
8H
3SO
2 4
2Cr 3
4H2O
Cr2O72 3H 2S 8H 3S 2Cr 3 7H 2O
Cr2O72 6I 14H 3I 2 2Cr 3 7H 2O
硬度最大的金属:铬(Cr)
(3) 密度大
密度最大的单质:锇(Os)
(4) 导电性,导热性,延展性好
熔点变化示意图
.
5
12.1 过渡元素通性
密度变化示意图
.
6
12.1 过渡元素通性
12.1.2 化学性质
1. 化学性质的变化规律
元素
Sc
Ti
Eθ M2/M
/
V
可溶该金属 的酸 元素
---
各种酸 Fe
-1.63
性质:Cr2O3 6H Cr 3 3H 2O
3H 2O
Cr2O3
2OH.
2Cr(OH)
4
16
(2) Cr(OH) 3
(适量)OH (灰绿)
Cr 3
H
Cr(OHΔ) 3(s)
OH
(亮绿色)
Cr(OH)
4
H2O Cr2O3 (绿)
12.2.2 Cr3+盐及其性质
(1) Cr3+盐 Cr(2 SO4)3,KCr(SO 4)2 12H 2O, CrCl 3
2Cr3 3S2O82 7H2O Ag Cr2O72 SO24 14H
碱性条件:
Eθ
(CrO
4
/
Cr(OH)
4
)
0.12V
2Cr(OH)
4
3H 2O2
2OH
CrO
2 4
8H 2O
3)氧化性 Cr 3 Zn(s) 2Cr 2 (蓝色) Zn2
12.2.3 Cr3+的配合物
Cr3+的配合物有数千种,绝大多数配位数:6 常见的是:[Cr(H2O)6]3+, 配合物多有颜色
第12章 过渡元素 (5h)
12.1 过渡元素通性 12.2 铬的重要化合物 12.3 锰的重要化合物 12.4 铁 钴 镍的重要化合物 12.5 ds区元素
.
1
.
2
12.1 过渡元素通性
12.1.1 过渡元素简介
1. 原子的价电子层构型
d区元素价电子层结构: (n-1)d1-9ns1-2
ds区元素价电子层结构: (n-1)d10ns1-2
热 HCl HF Co
E / V θ M2 /M
可溶该金属 的酸
-0.44
稀 HCl H2SO4 等
-0.29
缓慢溶解在 HCl 等酸中
V
-1.2 (估算值)
HNO3,HF 浓 H2SO4
Ni
Cr
-0.86
稀 HCl H2SO4
Cu
-0.25
稀 HCl H2SO4 等
+0.34
HNO3,浓热 H2SO4
总趋势:从上到下活泼性降低
.
8
12.1 过渡元素通性
2. 多种氧化值
红色为常见的氧化态
.
9
12.1 过渡元素通性
3.离子呈现多种颜色
.
10
12.1 过渡元素通性
4.形成多种配合物
.
11
12.1 过渡元素通性
.
12
12.1 过渡元素通性
5.催化性
许多过渡元素及其化合物具有独特的催化性能,Pt,Pd, Fe,Cu,V,…..,PdCl2 , V2O5….等常用的催化剂
