化学 人教版选择性必修1第三章 微专题7 难溶电解质沉淀溶解平衡图像分析
新教材高中化学第3章第4节沉淀溶解平衡课件新人教版选择性必修1ppt

微思考 难溶电解质是否一点也不溶解?难溶电解质沉淀完全的标准是什么?
【答案】尽管难溶电解质的溶解度很小,但在水中并不是绝对不溶。 当剩余离子的浓度小于1×10-5mol·L-1时,化学上通常认为沉淀完全了。
正误判断。(对的打“√”,错的打“×”)
(1)沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变。
3.沉淀的转化 (1)转化实验。 ①难溶性银盐之间的转化:
实验 步骤
实验 现象
生成_白___色沉淀
离子 Cl-+Ag+═══AgCl↓ 方程式
生成_黄___色沉淀 生成_黑___色沉淀
AgCl + I - ═══ 2AgI + S2 - ═══
AgI+Cl-
Ag2S+2I-
②Mg(OH)2与Fe(OH)3之间的转化:
()
(2)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度。
()
(3)BaSO4在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同。 ()
(4)升高温度,沉淀溶解平衡一定正向移动。
()
(5)为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗
涤BaSO4沉淀。
()
(6)向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来
(2)加沉淀剂法。
以Na2S、H2S等作沉淀剂,使Cu2+、Hg2+等生成极难溶的CuS、 HgS等沉淀。反应的离子方程式如下:
①加Na2S生成CuS:____S_2_-_+__C__u_2+__═_═_═__C_u_S_↓____。 ②通入H2S生成CuS:____H_2_S_+__C__u_2+__═_═_═__C_u_S_↓__+__2_H__+___。
吗? Ksp是否增大?升高温度Ksp 如何变化?
3.4.1难溶电解质的沉淀溶解平衡 课件 高二上学期化学人教版(2019)选择性必修1
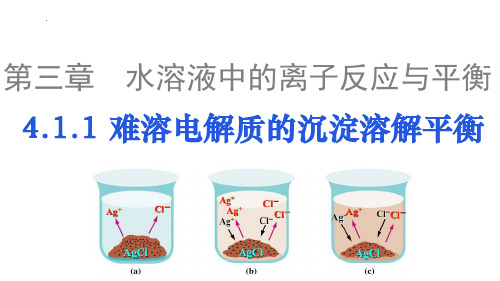
1.概念:在一定温度下,当难溶电解质溶解和沉淀的速率相等时,形成 电解质的饱和溶液,达到平衡状态,溶液中各离子的浓度保持 不变,这种平衡称为沉淀溶解平衡。
2.特征:逆、等、动、定、变
3.沉淀溶解平衡方程式: 溶解
AgCl(s) 沉淀 Ag+(aq) + Cl-(aq) 特别提醒: a.不等同于电离平衡
改变条件 升温
平衡移动方向 正向
溶解度(S) 增大
c(Ag+) 增大
c(Cl-) 增大
加水(有固体剩余)
正向
不变
不变
不变
加AgCl(s) 加NaCl(s) 加AgNO3(s) 加NaI(s)
不移动 逆向 逆向 正向
不变 减小 减小 增大
不变 减小 增大 减小
不变 增大 减小 增大
1、溶度积Ksp: 思考:AgCl溶解平衡的平衡常数如何表示?
(2)判断沉淀是否生成——Q-K关系 若Q > Ksp,溶液过饱和,沉淀析出; 若Q = Ksp,溶液饱和,沉淀与溶解处于平衡状态 若Q;< Ksp,溶液不饱和,无沉淀析出;若有固体,则溶解
【例】将4×10-3mol·L-1的AgNO3溶液与4×10-3mol·L-1的NaCl溶液等体积 混合能否有沉淀析出?[Ksp(AgCl)= 1.8×10-10]
= 0.001 mol/L
1 mL+1 mL
由Ksp (AgBr)= 5.0×10-10
c(Ag+) = Ksp c(Br-)
= 5.0×10-10 = 5.0×10-7 mol/L
0.001
4、Ksp的意义:(1)反映了难溶电解质在水中的溶解能力
化学式 Ksp
AgCl AgBr
沉淀溶解平衡课件2022-2023学年高二上学期化学人教版(2019)选择性必修1

(已知:常温下Cu(OH)2的Ksp = 2.0×10−20)
A. 2
B. 3
C. 4
D. 5
二、溶度积
练4.不同温度(T1和T2)时硫酸钡在水 中的沉淀溶解平衡曲线如右图所示, 已知硫酸钡在水中溶解时吸收热量。 下列说法正确的是( D ) A. T1>T2 B. 加入BaCl2固体,可使溶液由a点变到c点 C. c点时,在T1、T2两个温度下均有固体析出 D. a点和b点的Ksp相等
现象:向分离出AgCl沉淀后的上层清液中滴加KI溶液,出现 黄色浑浊。
原因:等量的Ag+和Cl-由于不能够完全沉淀而剩下来的(Ag+)
一、Ag+和Cl-的反应真能进行到底吗?
现象:向分离出AgCl沉淀后的上层清液中滴加KI溶液,出现 黄色浑浊。 原因:等量的Ag+和Cl-由于不能够完全沉淀而剩下来的(Ag+)
二、溶度积
常见难溶电解质的溶度积与溶解度(25oC)
难溶物
Ksp
AgCl 1.77×10−10
AgBr 5.35×10−13
AgI 8.51×10−17
溶解度/g 1.5×10−4 8.4×10−6 2.1×10−7
难溶物
Ksp
BaSO4 1.07×10−10
Fe(OH)3 2.64×10−39
CaF2 1.46×10−10
一、难溶电解质的溶解平衡
练. 把足量熟石灰放入蒸馏水中,一段时间后达到平衡:
Ca(OH)2(s) 的是( D )
Ca2+(aq)+2OH−(aq),下列叙述正确
A. 给溶液加热,溶液的pH升高
B. 恒温下向溶液中加入CaO,溶液的pH升高
C. 向溶液中加入Na2CO3溶液,Ca(OH)2固体增多 D. 向溶液中加入少量的NaOH固体,Ca(OH)2固体增多
人教版高中化学选择性必修第一册第三章 第四节 沉淀溶解平衡(课件PPT)

b.难溶电解质的溶解度尽管很小,但不会等于0(生成AgCl沉淀后的 溶液中三种有关反应的粒子在反应体系中共存). c. 化学上通常认为残留在溶液中的离子浓度小于
10-5mol/L时,沉淀反应达到完全。
一、沉淀溶解平衡及其应用
1.沉淀溶解平衡与难溶电解质的电离
3.沉淀溶解平衡的应用
沉淀的生成、溶解及其转化均利用了沉淀溶解平衡移动原理。利用沉淀溶解平衡的移动,可
以促进沉淀溶解或沉淀生成。例如CuS不溶于稀硫酸和稀盐酸,但溶于稀硝酸,就是因为
CuS在水中存在平衡:CuS(s)
Cu2+(aq)+S2-(aq),硝酸能氧化S2-,使c(S2-)
减小,促使CuS沉淀溶解。
2Ag+(aq)+CrO42-(aq),可推知Ag2CrO4的饱和溶液
中一定有2c(Ag+)=c(CrO42-)
解析:A错,析出沉淀时,AgCl溶液中c(Ag+)= 1.56 1010 =c(KAs( c(pgA+C)glC)=l)mKos(pl·AL-g1B=r)1.5=6×7.17 0 -180m13 oml·Lo-l1·,L-1A=g7B.7r溶×1液0-中110.m010ol·L-1,c(Ag+)越小,则 越先生成沉淀,c(所Br以)先产生沉0.0淀10的离子为Br-。
高中化学 选择性必修1
第三章 第 四节 沉淀溶解平衡
学习目标
1. 理解难溶电解质的沉淀溶解平衡,能应用化学平衡理论描述溶解平衡。 2.了解溶度积的意义,明确溶度积和离子积的关系,并由此学会判断反应进行的 方向。 3.知道沉淀生成、沉淀溶解、沉淀转化的本质是沉淀溶解平衡的移动。
难溶电解质的溶解平衡 PPT31 人教课标版

15、如果没有人为你遮风挡雨,那就学会自己披荆斩棘,面对一切,用倔强的骄傲,活出无人能及的精彩。 16、成功的秘诀在于永不改变既定的目标。若不给自己设限,则人生中就没有限制你发挥的藩篱。幸福不会遗漏任何人,迟早有一天它会找到你。 17、一个人只要强烈地坚持不懈地追求,他就能达到目的。你在希望中享受到的乐趣,比将来实际享受的乐趣要大得多。 18、无论是对事还是对人,我们只需要做好自己的本分,不与过多人建立亲密的关系,也不要因为关系亲密便掏心掏肺,切莫交浅言深,应适可而止。 19、大家常说一句话,认真你就输了,可是不认真的话,这辈子你就废了,自己的人生都不认真面对的话,那谁要认真对待你。 20、没有收拾残局的能力,就别放纵善变的情绪。 15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。 16、成功的反义词不是失败,而是从未行动。有一天你总会明白,遗憾比失败更让你难以面对。 17、没有一件事情可以一下子把你打垮,也不会有一件事情可以让你一步登天,慢慢走,慢慢看,生命是一个慢慢累积的过程。 18、努力也许不等于成功,可是那段追逐梦想的努力,会让你找到一个更好的自己,一个沉默努力充实安静的自己。 19、你相信梦想,梦想才会相信你。有一种落差是,你配不上自己的野心,也辜负了所受的苦难。 20、生活不会按你想要的方式进行,它会给你一段时间,让你孤独、迷茫又沉默忧郁。但如果靠这段时间跟自己独处,多看一本书,去做可以做的事,放下过去的人,等你度过低潮,那些独处的时光必定能照亮你的路,也是这些不堪陪你成熟。所以,现在没那么糟,看似生活对你的亏欠,其实都是祝愿。 5、心情就像衣服,脏了就拿去洗洗,晒晒,阳光自然就会蔓延开来。阳光那么好,何必自寻烦恼,过好每一个当下,一万个美丽的未来抵不过一个温暖的现在。 6、无论你正遭遇着什么,你都要从落魄中站起来重振旗鼓,要继续保持热忱,要继续保持微笑,就像从未受伤过一样。 7、生命的美丽,永远展现在她的进取之中 ;就像大树的美丽,是展现在它负势向上高耸入云的蓬勃生机中;像雄鹰的美丽,是展现在它搏风击雨如苍天之魂的翱翔中;像江河的美丽,是展现在它波涛汹涌一泻千里的奔流中。 8、有些事,不可避免地发生,阴晴圆缺皆有规律,我们只能坦然地接受;有些事,只要你愿意努力,矢志不渝地付出,就能慢慢改变它的轨迹。 9、与其埋怨世界,不如改变自己。管好自己的心,做好自己的事,比什么都强。人生无完美,曲折亦风景。别把失去看得过重,放弃是另一种拥有 ;不要经常艳羡他人,人做到了,心悟到了,相信属于你的风景就在下一个拐弯处。 10、有些事想开了,你就会明白,在世上,你就是你,你痛痛你自己,你累累你自己,就算有人同情你,那又怎样,最后收拾残局的还是要靠你自己。 11、人生的某些障碍,你是逃不掉的。与其费尽周折绕过去,不如勇敢地攀登,或许这会铸就你人生的高点。 12、有些压力总是得自己扛过去,说出来就成了充满负能量的抱怨。寻求安慰也无济于事,还徒增了别人的烦恼。 13、认识到我们的所见所闻都是假象,认识到此生都是虚幻,我们才能真正认识到佛法的真相。钱多了会压死你,你承受得了吗?带,带不走,放,放不下。时时刻刻发悲心,饶益众生为他人。 14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。 15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获 ;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
化学人教版(2023)选择性必修1 3.4.2沉淀溶解平衡常数(共28张ppt)

化学人教版(2023)选择性必修1 3.4.2沉淀溶解平衡常数(共28张ppt)(共28张PPT)1、掌握沉淀溶解平衡常数Ksp及意义。
2、学会通过比较Q与Ksp的大小判断难溶电解质的沉淀与溶解,学会从定量角度分析沉淀的生成与转化。
沉淀溶解平衡常数Ksp及意义。
沉淀溶解平衡常数Ksp的应用。
平衡建立平衡特征影响因素存在沉淀即存在平衡逆、动、等、定、变本身性质和浓度、温度沉淀溶解平衡如何定量表示沉淀溶解平衡的溶解程度大小溶度积常数1、定义2、表达式对于反应MmAn(s) mMn+(aq) + nAm-(aq)Ksp =(Mn+) · (Am-)一、溶度积常数在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数,叫做溶度积常数,简称溶度积(Ksp)。
固体物质不出现平衡时刻:例1、写出难溶物BaSO4、Fe(OH)3、Ag2CrO4、Ag2S沉淀溶解平衡方程式和溶度积表达式。
Ksp = c(Ba2+)·c(SO42-)BaSO4(s) Ba2+(aq) + SO42-(aq)Fe(OH)3(s) Fe3+(aq) + 3OH-(aq)Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq)Ksp = c(Fe3+)·c3(OH-)Ksp = c2(Ag+)·c(S2-)Ag2S(s) 2Ag+(aq) + S2-(aq)Ksp = c2(Ag+)·c(CrO42-)3、影响因素4、Ksp的意义一、溶度积常数Ksp只与难溶电解质的性质和温度有关。
Ksp反映了难溶电解质在水中的溶解能力。
T↑,Ksp↑ ; 但Ca(OH)2 相反Ksp和溶解度有什么关系?类型难溶物Ksp 溶解度类型难溶物Ksp 溶解度AB CaCO3 5.0×10-9 7.1×10-4 A2B Ag2CrO4 1.1×10-12 2.2×10-3AB AgCl 1.8×10-10 1.5×10-4 A2B Ag2S 6.3×10-50 1.3×10-16AB AgBr 5.4×10-13 8.4×10-6 AB2 Mg(OH)2 5.6×10-12 6.9×10-4AB AgI 8.5×10-17 2.1×10-7 AB2 Cu(OH)2 2.2×10-20 2.9×10-6常见难溶电解质的溶度积与溶解度(25°C)2、对于不同类型物质:不能用Ksp比较溶解度大小,必需经过换算,再比较。
高中化学新人教版选择性必修一3.4.1难溶电解质的沉淀溶解平衡 同步课件(64张)

必备知识·自主学习
一、难溶电解质的沉淀溶解平衡 1.25 ℃时,溶解性与溶解度的关系
2.沉淀溶解平衡 (1)含义:在一定温度下,当_沉__淀__和_溶__解__速率相等时所达到的平衡状态, 称为沉淀溶解平衡。 (2)图示
(3)表示方法:以 AgCl 为例,溶解平衡可Байду номын сангаас示为:
提示:c(Ag+)=Kcsp( (CAlgC-)l)
1.8×10-10 = 1.0×10-5
mol·L-1=1.8×10-5 mol·L-1,故
c(CrO24-
)=Kspc(2(AgA2gC+r)O4)
2.0×10-12 =(1.8×10-5)2
mol·L-1=6.17×10-3 mol·L-1。
Ca2++2OH-,
【解析】选 C。A 项,CaO+H2O===Ca(OH)2,由于保持恒温,Ca(OH)2 溶解度不变, c(OH-)不变,因此 pH 不变;B 项,加热时 Ca(OH)2 溶解度减小,平衡逆向移动, c(OH-)减小,pH 减小;C 项,CO32- +Ca2+===CaCO3↓,使平衡正向移动,Ca(OH)2 固体减少,但固体总质量增大;D 项,加入 NaOH 固体时,c(OH-)增大,平衡逆向 移动,因此 Ca(OH)2 固体增多。
(2)(情境思考)在化学分析中,以 AgNO3 标准溶液滴定溶液中的 Cl-时,采用 K2CrO4 为 指示剂,利用 Ag+与 CrO42- 反应生成砖红色沉淀指示滴定终点。当溶液中的 Cl-恰好 沉淀完全(浓度等于 1.0×10-5 mol·L-1)时,溶液中 c(Ag+)与 c(CrO24- )分别是多少 呢? (已知 25 ℃时 Ag2CrO4、AgCl 的 Ksp 分别为 2.0×10-12 和 1.8×10-10)
高中化学(新人教版)选择性必修一:难溶电解质的沉淀溶解平衡【精品课件】

课题导入
海底美丽的珊瑚礁近年 来却因使海水中二氧化碳浓 度增大而逐渐停止生长,甚 至死亡。
溶洞中美丽的石笋、钟乳 石和石柱是大自然创造的奇 迹。而它们是如何形成的?ຫໍສະໝຸດ 课题导入引导探究1
人们习惯上将溶解度小于0.01g的电解质称为难 溶电解质。尽管难溶电解质的溶解质的溶解度很 小,但在水中并不是绝对不溶。
一、难溶电解质的溶解平衡
2、沉淀溶解平衡的建立
一、难溶电解质的溶解平衡
3、特征
可逆
=
动态 离子浓度
一、难溶电解质的溶解平衡
4、表达式
难溶电解质用“s”标明状态,溶液中的离子 用“ aq ”标明状态,并用“ ⇌ ”连接。
一、难溶电解质的溶解平衡
5、生成难溶电解质的离子反应的限度 反应完全的标志: 对于常量的化学反应来说,化学上通常认为残留 在溶液中的离子浓度小于 1×10-5 mol/L时,沉 淀就达完全。
②外因:
特例:
a、浓度:加水,平衡向溶解方向移动Ca。(OH)2
b、温度:升温,多数平衡向溶解方向移动。
特例:a.随温度变化不明显:NaCl b.随温度升高反而降低:Ca(OH)2 c.与水以任意比混溶:乙醇等
二、影响难溶电解质溶解平衡的因素
1、浓度:加水,平衡向溶解方向移动。 2、温度:升温,多数平衡向溶解方向移动。 3、加入相同离子,平衡向沉淀方向移动。
Q > KSP 溶液过饱和,有沉淀析出 Q = KSP 溶液饱和,沉淀与溶解处于平衡状态 Q < KSP 溶液未饱和,可继续溶解该难溶电解质
三、溶度积KSP
3、意义
Ksp反映了难溶电解质在水中的溶解能力。 Ksp越小,越难溶。
高中化学人教版(2019)选择性必修第一册课件:第三章第四节 沉淀溶解平衡

a.锅炉除水垢
水垢中的CaSO4(s) 反应的化学方程式如下:
CaCO3(s)
Ca2+(aq)
CaSO4+Na2CO3 Na2SO4+CaCO3
CaCO3+2HCl CaCl2+H2O+CO2↑ b.自然界中矿物的转化
原生铜的硫化物
CuSO4溶液
铜蓝(CuS)
第1讲 描第述三运章动的水基本溶概液念中的离子反应与平衡
第1讲 描第述三运章动的水基本溶概液念中的离子反应与平衡 第四节 沉淀溶解平衡
1.知道沉淀溶解平衡的概念及其影响因素。 2.明确溶度积和离子积的关系,学会判断溶液中难溶电解质的沉淀或溶解情况。 3.能用平衡移动原理解释沉淀的溶解与生成、沉淀转化的实质。 4.学会用沉淀溶解平衡的移动解决生产、生活中的问题。
反应的化学方程式如下:
CuSO4+ZnS CuS+ZnSO4
CuSO4+PbS CuS+PbSO4
判断正误,正确的画“√”,错误的画“✕”。
1.溴酸银(AgBrO3)的溶解度随温度升高逐渐增大,所以AgBrO3的溶解是放热过程
(✕)
2.AgCl(s) Ag+(aq)+Cl-(aq)和AgCl Ag++Cl-所表示的意义相同 ( ✕ )
溶解度小的沉淀可转化为溶解度更小的沉淀
第1讲 描第述三运章动的水基本溶概液念中的离子反应与平衡
b.MgCl2溶液 褐色沉淀
产生白色沉淀
白色沉淀逐渐转化为红
(2)沉淀转化的实质
实质是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀转化成溶解度更小的沉
淀。两者的溶解度差别越大,沉淀越容易转化。
新教材高中化学第三章第四节沉淀溶解平衡第1课时沉淀溶解平衡pptx课件新人教版选择性必修1

B.难溶电解质的溶液中只存在溶解平衡,不存在电离平衡
C.溶解平衡只能通过电解质溶解于水时建立
D.达到溶解平衡时,电解质表面上的离子或分子脱离电解质
的速率与溶液中的离子或分子回到电解质表面的速率相等
答案:D
二、溶度积和离子积
1.溶度积。
(1)与电离平衡、水解平衡一样,难溶电解质的沉淀溶解平衡
微训练1 1.对“AgCl(s)
Ag+(aq)+Cl-(aq)”的理解正确的是
(
)。
A.说明AgCl没有完全电离,AgCl是弱电解质
B.说明溶解的AgCl已完全电离,是强电解质
C.说明Ag+与Cl-反应不能完全进行到底
D.说明Ag+与Cl-反应可以完全进行到底
答案:C
2.下列说法中正确的是(
)。
衡的影响,同样遵守勒夏特列原理。
(1)加水稀释。
保持温度不变,向平衡体系中加入少量水,平衡向沉淀溶解的
方向移动,最终达到与原来同样的平衡状态;若向平衡体系中
加入大量的水,最终难溶电解质完全溶解,形成不饱和溶液,平
衡体系被破坏。
(2)改变温度。
大多数难溶电解质的溶解是吸热过程,升高温度,平衡向沉淀
溶解的方向移动,Ksp变大。
”或
“
”,强电解质用“
”,弱电解质用“
”;难溶电解质的沉淀溶
解平衡式都使用“
”,且在难溶电解质的化学式后面加注“(s)”,在
离子符号的后面加注“(aq)”。
微训练2 1.室温下,向AgCl饱和溶液中加水,下列叙述正确的
是(
)。
A.AgCl的溶解度增大
B.AgCl的溶解度、Ksp均不变
3.4.1肾结石的预防——难溶电解质的沉淀溶解平衡+课件高二上学期化学人教版(2019)选择性必修1

化学式 Ba(OH)2 BaSO4 Ca(OH)2 CaSO4 Mg(OH)2 Fe(OH)3
溶解度/g 3.89
2.4×10-4 0.165 0.21 9×10-4 3×10-9
任务一:建立沉淀溶解平衡模型
1.宏观认识沉淀溶解平衡 实验探究:难溶物的溶解性探究
实验试剂:0.1mol/LAgNO3溶液、 0.1 mol/L NaCl溶液、0.1 mol/L MgCl2溶液、 0.1mol/L NaOH溶液、酚酞溶液、0.2mol/LNa2S溶液(Ag2S:黑色沉淀)
第三章 水溶液中的离子反应与平衡
肾结石为泌尿系常见病,多 发病,人群发病率1/20。病因是尿 液中成石物质浓度升高或溶解度 降低,析出晶体并局部生长聚积 形成结石。
肾结石的主要成分:CaC2O4
Ca2++C2O42- = CaC2O4↓
为什么多喝水能有效缓解肾结石?
还记得什么是溶解度吗?
一定温度下,某固体物质在100克溶剂中达到饱和状态时所 溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
BaSO4(s) ⇌ Ba2+(aq) + SO42- (aq) CaCO3(s) ⇌ Ca2+(aq) + CO32- (aq) Ag2S(s) ⇌ 2Ag2+(aq) +S2-(aq)
任务二:产生结石该怎么办?
沉淀溶解平衡的影响因素
【讨论】对于平衡CaC2O4(s) ⇌Ca2+ (aq)+ C2O42- (aq),改变下列条件,对其有何影响?
AgCl 难溶
Ca(OH)2 KClO3
微溶
可溶
NaCl 易溶
0.01
1
难溶电解质溶解平衡-课件

3、饱和电解质溶液(包括易溶、难溶)存 得出 在溶解平衡。 结论
一、沉淀溶解平衡
• 2、沉淀溶解平衡 • (1)定义: • 在一定温度下,难溶电解质溶于水,沉淀
的溶解和生成速率相等,溶液达到饱和状 态时,即建立前了提溶:解饱平和衡溶(液 也叫沉淀溶解 平衡) 。符合勒夏特列原理。
一、沉淀溶解平衡
❖Qc <Ksp,V溶解>V沉淀,溶液未饱和,无 沉淀析出
❖Qc >Ksp,V溶解<V沉淀,溶液过饱和,平 衡向沉淀方向移动,直至溶液饱和,达到 新的平衡。
二、溶度积
• 1、下列情况下,有无CaCO3沉淀生成?已 知
Ksp(CaCO3) =2.9 10-9
• (1)往盛有1.0 L纯水中加入0.1 mL浓度为 0.01 mol /L 的CaCl2和Na2CO3;
0.020mol·L-1 Na2SOB4 溶液,下列示意图中,能正
确表示t1时刻后Ag+和SO42-浓度随时间变化关系的 是( )
•
• (2)往盛有1.0 L纯水中加入0.1 mL浓度为 1.00 mol /L 的CaCl2和Na2CO3;
• (3)将等体积的CaCl2溶液与1.N16a×21C0-4Omo31溶/L 液 混合,若Na CO 溶液的浓度为1×10-
二、溶度积
• 2、已知: Ksp(AgCl)=c(Ag+) ·c(Cl)=1.8×10-10, Ksp(Ag2CrO4)=c2(Ag+) ·c(CrO42-)= 1.9×1012 。现用0.01mol/LAgNO3溶液滴定 0.01mol/LKCl和0.001mol/LK2CrO4混合溶 液,试通过计算回答:
AgCl(s) ⇌ Ag+(aq) +Cl-(aq)
化学课件《难溶电解质的溶解平衡》优秀ppt31 人教课标版1

实验3-4:
步骤 NaCl和 AgNO3溶 液混合 向所得固液混 合物中滴加KI 溶液
解释?
向新得固液混合 物中滴加Na2S 溶液 黄色沉淀转化 为黑色沉淀
2AgI +S2- =Ag2S +2I-
现象 有白色沉淀 白色沉淀转化 析出 为黄色沉淀 结论 有AgCl生成
AgCl +I- =AgI +Cl-
2.沉淀的溶解
难溶于水的CaCO3沉淀可溶于盐酸
CaCO3 Ca2+ + CO32-
H+ HCO3H+ H2CO3 →H2O+CO2↑
实验3-3:
滴加试剂 现象 蒸馏水 沉淀无明显 溶解 盐酸 沉淀迅速 溶解
解释?
氯化铵溶液 沉淀溶解
Mg(OH)2沉淀 Mg(OH)2沉淀 Mg(OH)2沉淀
2.沉淀的溶解 Qc < Ksp • 原理:不断移去溶解平衡体系中的相应离子, 促使平衡向沉淀溶解的方向移动 • 选用试剂:酸溶液、盐溶液等 • 溶于酸的难溶电解质:碳酸盐、金属氢氧 化物、FeS
CaCO3
②对一些自然现象的解释
小结
沉淀的生成、沉淀的溶解 和沉淀的转化都是通过改变 条件促使沉淀溶解平衡发生 移动。
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰· B· 塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔· 卡内基] 87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯· 瑞斯] 88.每个意念都是一场祈祷。――[詹姆士· 雷德非] 89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰] 91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿· 休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯· 奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰· 纳森· 爱德瓦兹] 94.对一个适度工作的人而言,快乐来自于工作,有如花朵结果前拥有彩色的花瓣。――[约翰· 拉斯金] 95.没有比时间更容易浪费的,同时没有比时间更珍贵的了,因为没有时间我们几乎无法做任何事。――[威廉· 班] 96.人生真正的欢欣,就是在于你自认正在为一个伟大目标运用自己;而不是源于独自发光.自私渺小的忧烦躯壳,只知抱怨世界无法带给你快乐。――[萧伯纳] 97.有三个人是我的朋友爱我的人.恨我的人.以及对我冷漠的人。 爱我的人教我温柔;恨我的人教我谨慎;对我冷漠的人教我自立。――[J·E·丁格] 98.过去的事已经一去不复返。聪明的人是考虑现在和未来,根本无暇去想过去的事。――[英国哲学家培根] 99.真正的发现之旅不只是为了寻找全新的景色,也为了拥有全新的眼光。――[马塞尔· 普劳斯特] 100.这个世界总是充满美好的事物,然而能看到这些美好事物的人,事实上是少之又少。――[罗丹] 101.称赞不但对人的感情,而且对人的理智也发生巨大的作用,在这种令人愉快的影响之下,我觉得更加聪明了,各种想法,以异常的速度接连涌入我的脑际。――[托尔斯泰] 102.人生过程的景观一直在变化,向前跨进,就看到与初始不同的景观,再上前去,又是另一番新的气候――。[叔本华] 103.为何我们如此汲汲于名利,如果一个人和他的同伴保持不一样的速度,或许他耳中听到的是不同的旋律,让他随他所听到的旋律走,无论快慢或远近。――[梭罗] 104.我们最容易不吝惜的是时间,而我们应该最担心的也是时间;因为没有时间的话,我们在世界上什么也不能做。――[威廉· 彭] 105.人类的悲剧,就是想延长自己的寿命。我们往往只憧憬地平线那端的神奇【违禁词,被屏蔽】,而忘了去欣赏今天窗外正在盛开的玫瑰花。――[戴尔· 卡内基] 106.休息并非无所事事,夏日炎炎时躺在树底下的草地,听着潺潺的水声,看着飘过的白云,亦非浪费时间。――[约翰· 罗伯克] 107.没有人会只因年龄而衰老,我们是因放弃我们的理想而衰老。年龄会使皮肤老化,而放弃热情却会使灵魂老化。――[撒母耳· 厄尔曼] 108.快乐和智能的区别在于:自认最快乐的人实际上就是最快乐的,但自认为最明智的人一般而言却是最愚蠢的。――[卡雷贝· C· 科尔顿] 109.每个人皆有连自己都不清楚的潜在能力。无论是谁,在千钧一发之际,往往能轻易解决从前认为极不可能解决的事。――[戴尔· 卡内基] 110.每天安静地坐十五分钟· 倾听你的气息,感觉它,感觉你自己,并且试着什么都不想。――[艾瑞克· 佛洛姆] 111.你知道何谓沮丧---就是你用一辈子工夫,在公司或任何领域里往上攀爬,却在抵达最高处的同时,发现自己爬错了墙头。--[坎伯] 112.「伟大」这个名词未必非出现在规模很大的事情不可;生活中微小之处,照样可以伟大。――[布鲁克斯] 113.人生的目的有二:先是获得你想要的;然后是享受你所获得的。只有最明智的人类做到第二点。――[罗根· 皮沙尔· 史密斯] 114.要经常听.时常想.时时学习,才是真正的生活方式。对任何事既不抱希望,也不肯学习的人,没有生存的资格。 ――[阿萨· 赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉· 海兹利特] 116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯· 里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可· 汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰· 夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯· 米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子] 126.在寒冷中颤抖过的人倍觉太阳的温暖,经历过各种人生烦恼的人,才懂得生命的珍贵。――[怀特曼] 127.一般的伟人总是让身边的人感到渺小;但真正的伟人却能让身边的人认为自己很伟大。――[G.K.Chesteron] 128.医生知道的事如此的少,他们的收费却是如此的高。――[马克吐温] 129.问题不在于:一个人能够轻蔑、藐视或批评什么,而是在于:他能够喜爱、看重以及欣赏什么。――[约翰· 鲁斯金]
2022届高中化学新教材同步选择性必修第一册 第3章 微专题7 难溶电解质沉淀溶解平衡图像分析

微专题7难溶电解质沉淀溶解平衡图像分析1.曲线型图像第一步:明确图像中纵、横坐标的含义纵、横坐标通常是难溶物溶解后电离出的离子浓度。
第二步:理解图像中线上点、线外点的含义(1)以氯化银为例,在该沉淀溶解平衡图像上,曲线上任意一点都达到了沉淀溶解平衡状态,此时Q=K sp。
在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。
(2)曲线上方区域的点均为过饱和溶液,此时Q>K sp。
(3)曲线下方区域的点均为不饱和溶液,此时Q<K sp。
2.对数型图像(1)图像类型pH 图像将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小pOH 图像将溶液中c(OH-)取负对数,即pOH=-lg c(OH-),反映到图像中是c(OH-)越大,则pOH越小pC 图像将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小(2)解题要领解题时要理解pH、pOH、pC的含义,以及图像横坐标、纵坐标代表的含义,通过曲线的变化趋势,找到图像与已学化学知识间的联系。
1.在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。
又知t℃时AgCl的K sp=4×10-10,下列说法不正确的是()A.在t℃时,AgBr的K sp为4.9×10-13B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点C.图中a点对应的是AgBr的不饱和溶液D.在t℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)的平衡常数K≈816答案B解析沉淀溶解平衡曲线上的点均表示AgBr的饱和溶液,再结合溶度积的定义,则K sp=c(Ag+)·c(Br -)=7×10-7×7×10-7=4.9×10-13,A项正确;根据AgBr(s)Ag+(aq)+Br-(aq),加入NaBr固体,溶液中c(Br-)增大,平衡向逆反应方向移动,c(Ag+)减小,而c点到b点,c(Ag+)不变,故B项错误;a点的离子积小于K sp,说明此溶液为不饱和溶液,故C项正确;K=c(Cl-)c(Br-)=c(Ag+)·c(Cl-)c(Ag+)·c(Br-)=K sp(AgCl)K sp(AgBr)=4×10-104.9×10-13≈816,故D项正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
跟踪训练 1.在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl 的Ksp=4×10-10,下列说法不正确的是 A.在t ℃时,AgBr的Ksp为4.9×10-13
√B.在AgBr饱和溶液中加入NaBr固体,
可使溶液由c点到b点 C.图中a点对应的是AgBr的不饱和溶液 D.在 t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数 K≈816
12345
解析 沉淀溶解平衡曲线上的点均表 示AgBr的饱和溶液,再结合溶度积的 定义,则Ksp=c(Ag+)·c(Br-)=7×10-7 ×7×10-7=4.9×10-13,A项正确; 根据 AgBr(s) Ag+(aq)+Br-(aq),加入 NaBr 固体,溶液中 c(Br-)增大,平衡向 逆反应方向移动,c(Ag+)减小,而 c 点到 b 点,c(Ag+)不变,故 B 项错误; a点的离子积小于Ksp,说明此溶液为不饱和溶液,故C项正确; K=ccBCrl--=ccAAgg++··ccBCrl--=KKssppAAggBCrl=44.9××1100--1013≈816,故 D 项正确。
2.对数型图像 (1)图像类型
将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中 pH图像 是c(H+)越大,则pH越小
将溶液中c(OH-)取负对数,即pOH=-lg c(OH-),反映到图 pOH图像 像中是c(OH-)越大,则pOH越小
将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对 pC图像 数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小 (2)解题要领 解题时要理解pH、pOH、pC的含义,以及图像横坐标、纵坐标代表的含 义,通过曲线的变化趋势,找到图像与已学化学知识间的联系。
√C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
12345
解析 根据图示,pH相同时,曲线a对应的 c(M2 + ) 小 , 因 Fe(OH)2 与 Cu(OH)2 属 于 同 类 型 沉淀,一定温度下,Ksp越大,c(M2+)越大, 故曲线a表示Cu(OH)2饱和溶液中的变化关系, A项错误; Ksp[Cu(OH)2]<Ksp[Fe(OH)2],则调节pH过程中,Cu2+先沉淀,除去CuSO4 溶液中含有的少量Fe2+,应先加入H2O2将Fe2+氧化为Fe3+,再调节pH, B项错误;
12345
2.如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线, 下列说法不正确的是 A.加入Na2SO4可使溶液由a点变到b点 B.在T1曲线上方区域(不含曲线)任意一
点时,均有BaSO4沉淀生成 C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
√D.升温可使溶液由b点变为d点
D.c 点可表示 MgCO3 的不饱和溶液,且 c(Mg2+)析 pM 相等时,图线中 p(CO23-)数值越大, 实际浓度越小,因此,MgCO3、CaCO3、MnCO3 的 Ksp 依次减小,A 项错误; a 点 pM=p(CO23-),c(Mn2+)=c(CO23-),可表示 MnCO3 的饱和溶液,B 项正确; b 点在线上,可表示 CaCO3 的饱和溶液,pM<p(CO23-),所以 c(Ca2+)>c(CO23-), C 项正确; c 点为不饱和溶液,pM>p(CO23-),所以 c(Mg2+)<c(CO23-),D 项错误。
12345
根据图知pH=10时,-lg c(Cu2+)=11.7,-lg c (Fe2+)=7.1,可以计算出该温度下Ksp[Cu(OH)2]= 10-11.7×(10-4)2=10-19.7,Ksp[Fe(OH)2]=10-7.1× (10-4)2=10-15.1,当Fe(OH)2和Cu(OH)2沉淀共存时,溶 液中c(Fe2+)∶c(Cu2+) =Kspc[2FOeHO-H2]∶Kspc[2COuHO-H2]= Ksp[Fe(OH)2]∶Ksp[Cu(OH)2]=104.6∶1,C项正确; X点转化为Y点时,c(Cu2+)不变,c(OH-)增大,但当加入少量NaOH固体 后,c(OH-)增大,Cu(OH)2的沉淀溶解平衡向逆反应方向移动,c(Cu2+) 减小,故X点不能转化为Y点,D项错误。
微专题7 难溶电解质沉淀溶解平衡 图像分析
1.曲线型图像 第一步:明确图像中纵、横坐标的含义 纵、横坐标通常是难溶物溶解后电离出的离子浓度。 第二步:理解图像中线上点、线外点的含义 (1)以氯化银为例,在该沉淀溶解平衡图像上,曲线上任意一点都达到了 沉淀溶解平衡状态,此时Q=Ksp。在温度不变时,无论改变哪种离子的 浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。 (2)曲线上方区域的点均为过饱和溶液,此时Q>Ksp。 (3)曲线下方区域的点均为不饱和溶液,此时Q<Ksp 。
12345
解析 加入 Na2SO4,c(SO24-)增大,Ksp 不变,c(Ba2+)减小,A 项正确;
在T1曲线上方任意一点,由于Q>Ksp,所以均有BaSO4沉淀生成,B项正确; 不饱和溶液蒸发溶剂,c(SO24-)、c(Ba2+)均增大,C 项正确; 升温,Ksp 增大,c(SO24-)、c(Ba2+)均增大,D 项错误。
12345
4.25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金 属阳离子的物质的量浓度的负对数[-lg c(M2+)] 与溶液pH的变化关系如图所示,已知该温度下 Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是 A.曲线a表示Fe(OH)2饱和溶液中的变化关系 B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
12345
3.一定温度下,三种碳酸盐 MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡 曲线如下图所示。已知: pM=-lg c(M),p(CO23-)=-lg c(CO23-)。下列说 法正确的是 A.MgCO3、CaCO3、MnCO3 的 Ksp 依次增大
√B.a 点可表示 MnCO3 的饱和溶液,且 c(Mn2+)=c(CO23-) √C.b 点可表示 CaCO3 的饱和溶液,且 c(Ca2+) >c(CO23-)
