中国美国和欧盟的医用防护服标准及指标对比分析
国内外医用手术防护服标准比较及分析 (二 )

手术服和盖布在使用中 , 材料 (尤其是非织造
(2)在静 水压的测试方 面 , GB/T4744-1997、 材料 )表面的一些纤维绒毛 、碎片及各种微粒容易
AATCC127、EN28011 规定的 仪器 和测试 方法类 似 , 只是规定测试的水压上升速率有所区别 。
从材料表面上脱落 , 出现掉毛现象 , 微生物病原体 容易附着在掉落的微粒上[ 7] , 可能会落入病人的伤
注 ①:13.8 kPa, 1 min表示 :测试液与试样在 13.8 kPa下保持接触 1 min, 余类推 。
EN13795和 ISO16542对防护材料的掉毛性
种微粒的测试方法 )可以测量非 织造材料表面在
能要求用 ISO 9073-10 的测试方 法进行测 试 [ 21] 。
干态下产生的绒毛及各种微粒的数量 , 这个测试方
AATCC127水压上升 速率 : ASTMF1670 合成血液与
10 mm/s(或者 6 kPa/min) 试样接触程序 :
0 kPa, 5 min
13.8 kPa, 1 min
0 kPa, 54 min
ASTM பைடு நூலகம்1671测试液 与试 样接触程序 : 0 kPa, 5 min 13.8 kPa, 1 min 0 kPa, 54 min
样与合成血液接触时间 、测试程序与 ASTM F1670、 性能也是反映手术服和盖布使用安全的重要性能 ,
ISO16603相比较短 , 要求较低 。 GB19082-2003缺
需要对其进行测试和评价 。
表 3 国内外主要阻隔性能测试方法程序区别
标 准
拒 水 性 能 水冲击渗透 /沾水试验
静 水 压
EN 28011 水 压 上 升 速 率 : 0. 98 kPa/min (或 者 5.88 kPa/min) ISO 16604 测试液与 试样接 触程序 : 0 kPa, 5 min 14 kPa, 1 min 0 kPa, 4 min或者 : 0 kPa, 5 min 1.75 kPa, 5 min 3.5 kPa, 5 min 7 kPa, 5 min 14 kPa, 5 min 20 kPa, 5 min
中国与欧盟个体防护装备标准指标比对情况ComparisonofPersonalProtectiveE

Chemical protective clothing for occupational personnels of various occupation or emergenc eresponses- solid particles.
Chemical protective clothing providing protection to the full body against airborne solid particulates (type 5 clothing)
EN 14605 and GB 24539-2009
Country
China
European Union
Product
Chemical protective clothing
Chemical protective clothing (Type
3、Type 4)
Standard
GB 24539 2009
Scope
Chemical protective clothing for occupational personnels of various occupation or emergence responses.
Chemical protective clothing providing liquid-tight (Type 3) or spray tight (Type 4), including items providing protection to parts of the body only (Types PB [3] and PB [4]).
(type 3 same with type 4)
Highand
70 C @8h , drop of tensile
医用隔离衣标准

医用隔离衣标准
医用隔离衣标准根据不同国家和地区的规定有所不同,以下是一些常见的医用隔离衣标准:
1. 美国标准:根据美国国家标准协会(ANSI)和美国传染病学会(ASM)的要求,医用隔离衣应具备以下特点:能有效阻挡液体渗透、具备适当的呼吸阻力、提供足够的防护面积、有适当的零部件和附件,同时还需要符合防护等级要求,如Level 1、Level 2等。
2. 欧洲标准:根据欧洲标准EN 13795-1,医用隔离衣需要符合以下要求:具备抗菌性能、能有效抵御切割和撕裂、有足够的耐久性,同时还需要符合防护等级要求,如Level 1、Level 2、Level 3等。
3. 中国标准:根据中国卫生部发布的《医用防护隔离服技术要求》,医用隔离衣需要具备以下特点:能有效阻隔微生物和液体的渗透、能够提供足够的防护面积、有适当的透气性能和防尘性能,同时还需要符合防护等级要求,如按照GB19082-2009划分的Type 1、Type 2、Type 3和Type 4等级。
需要注意的是,虽然不同标准的要求有所不同,但是医用隔离衣都需要具备足够的防护性能,以保护医务人员免受感染。
选择医用隔离衣时,应根据实际需要和当地法规进行选择。
中美欧呼吸防护用品标准对比分析

1 防 护 对 象 对 比
和 油 雾 检 测 过 滤 效 率 ,但 对 于 油 性 颗 粒 物 过 滤效 率 达 到
在 不 同 的 _T作 环 境 中 ,空 气 中 悬 浮 的 颗 粒 物 也 不 80% 的滤 料 .其 对 非 油 性 颗 粒 物 的过 滤 效 率 一 般 会 远 高
同 ,所 选 择 的 呼 吸 防 护 用 品必 然 不 同 。 GB 2626- 2006 于 80% 。 中 国 标 准 中 的 KN90和 KP90级 别 则 是 考 虑 了
合格产 品在 之前 的抽样检验 中未被抽取 ;二是原本合格 确 性 的提 升 ,并 对 企 业 产 品 质量 的 监 督 管 理 工 作 具 有 推
的 产 品 受 到 存 储 或 者 运 输 的影 响 ,导 致 其 质 量 发 生 变 动 作 用 。 因此 ,企 业 在 开 展 抽 样 质 量 检 验 时 ,要 严 格 按
美 国 和 欧 州 标 准 , 即 中 国标 准 GB 2626- 2006 《呼 吸 防 2 过 滤 效 率 对 比
护 用 品 自吸过 滤 式 防 颗 粒 物 标 准 将 自吸 过 滤 式 防 颗 粒 物 呼 吸器 的 过 滤 效 率
42CFR Part84 《呼 吸 防护 用 品标 准 认 证 》 和 欧 洲 标 准 EN 按 照 防 非 油 性 颗 粒 物 (KN)和 防 油性 颗 粒 物 fKP)分 级 , 149:2010 《防 微 粒 过 滤 式 半 面 罩 的 要 求 、试 验 和 标 志 》, 分 别 为 90% 、 95% 和 99.97% 。 美 标 将 过 滤 效 率 分 为
所 规 范产 品 的 防 护 对 象从 旧标 准 的 只 防 粉 尘 扩 大 到 防各 粉 尘 防 护 的 实 际需 求 ,对 过 滤 效 率 的规 定 比 欧美 标 准 更
外医用手术防护服标准比较及分析一

标准产业用纺织品总第193期圈雨外匿用琴朱磅妒服枵准比艘厦分衍(一)徐桂龙王璐(东华大学纺织面料技术教育部重点实验室,上海,200051)摘要:就当前国内外主要手术防护服标准AAMIPB一70、NFPA1999、EN13795、ISO16542、GB19082进行了比较分析,还就各标准中手术服阻隔性能的表征手段进行了详细的对比研究,指出了我国手术服标准的不足之处并提出了改进建议。
关键词:手术服,测试标准,比较,阻隔性能,表征中圈分类号:TSl07.8;TS941.732.3文献标识码:A文章编号:1004—7093(2006)10—0036—042003年“非典”爆发以后,如何保护医务人员的安全,如何避免医院内的交叉感染越来越受到人们的重视。
医用手术防护服的性能对于保护医务人员的安全非常重要。
早些时候,对于医用防护服,其评价标准比较分散…。
近几年,各国逐渐将零散的标准统一起来,制定了专门的医用防护服标准旧。
],中国在“非典”期间也制定了规范一次性医用防护服的国家标准。
由于各国标准制定的考虑因素、测试手段、产品性能的不同,各标准之间也存在较大差异,有必要对当前国内外主要手术防护服标准进行比较分析。
1手术防护服主要性能要求手术防护服所用织物属于医用屏蔽织物,最重要的性能应该是阻隔(barrier)性能。
阻隔性能包括拒液性能和阻止微生物渗透的性能。
医护人员在进行医疗救护中,不可避免地会接触到病人的血液和体液,病人的体液和血液往往可能携带包括HBV(肝炎B病毒)、HCV(肝炎C病毒)和HIV(艾滋病病毒)在内的各种病原体。
OSHA(OccupationalSafety&HealthAdministration美国职业安全与健收稿日期:2005—08—09作者简介:徐桂龙,男,1981年生,在读硕士研究生。
主要从事医用纺织品的研究。
一36一康局)规定陋],手术防护服使用的防护材料应该能阻止体液和血液及其携带的各种病原体的渗透,以减少医护人员皮肤与携带病原体的体液和血液直接接触的潜在的可能性。
医用防护物品国内标准及国外标准对照表【模板】
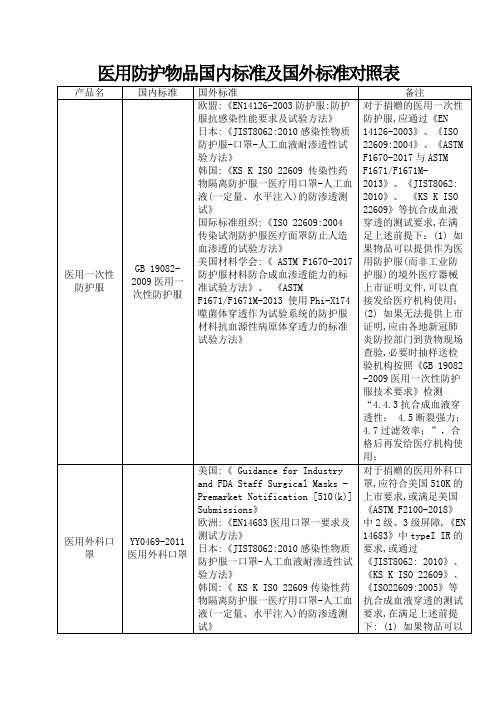
GB14866-2006个人用眼护具技术要求
国际标准组织:《IS0 4849-1981个人用眼护具技术要求》
欧盟:《EN166-2001个人用眼护具技术要求》
美国:《ANSI Z87.1职业和教育性个人眼睛和面部保护装置》
日本:《JIS T8147-2016个人护目器》
凡是声称符合国外标准要求的个人用医用隔离面罩可在目前应急阶段可以使用。
医用外科口罩
YY0469-2011医用外科口罩
美国:《 Guidance for Industry and FDA Staff Surgical Masks -Premarket Notification [510(k)] Submissions》
欧洲:《EN14683医用口罩一要求及测试方法》
日本:《JIST8062:2010感染性物质防护服一口罩-人工血液耐渗透性试验方法》
韩国:《 KS K IS0 22609传染性药物隔离防护服医疗用口罩-人工血液(一定量、水平注入)的防渗透测试》
国际标准组织:《IS0 22609:2005传染试剂防护服医疗面罩防止人造血渗透的试验方法》
美国材料学会:《 ASTM F2100-2018医用囗罩用材料性能的标准规范》
对于捐赠的医用防护口罩,应符合美国510K的上市要求,或满足美国《ASTM F2100-2018》中2级、3级屏障,《EN 14683》中typeIIR的要求, 或通过《JIST8062:2010》、 《KS K ISO 22609》、《ISO22609:2005》等抗合成血液穿透的测试要求,在满足上述前提下:(1). 如果物品可以提供境外医疗器械上市证明文件,可以直接发给医疗机构使用;(2)如果无法提供上市证明,应由各地新冠肺炎防控部门到货物现场查验,必要时抽样送检验机构按照《GB 19083 -2010医用防护口罩》检测“4.2鼻夹; 4.3口罩带;4.4过滤效率; 4.6合成血液穿透;4.12密合性”,合格后再发给医疗机构使用;
医用防护服国内标准与国外标准对比
”:非油性颗粒的过滤效 穿透率(log):
率应不小于70%(氯化钠 3级:log > 5 ;
颗粒穿透 气溶胶或类似固体气溶 2级:3 < log ≤5 ;
-
-
胶,直径750±20nm,颗粒 1级:1 < log ≤3 ;
分布的几何标准偏差:≤ ISO/DIS 22612“抗固体颗粒污染能
1.86;浓度≤200mg/m3) 力试验”:
6型防护服:对应标准prEN13034(最
低等级)
静水压 GB/T4744-2013“静水压试
AATCC127-2003“静水压试验”:
验”:
不低于1.67kPa(17cm -
1级:无规定
-
2级:≥20cm H2O
3级:≥50cm H2O
4级:无规定
Байду номын сангаас
沾水 GB/T4745-2012“沾水试验
AATCC22“冲击穿透试验”
或重复使用)
次性或重复使用)
6个等级
4个等级:
1a,1b,1c,2型防护服:对应标准 EN943-1(EN943-2针对1ET);
等级1(最低等级)
3型防护服:对应标准EN466;
等级2
分级
1个等级
4型防护服:对应标准EN465;
1个等级
等级3
5型防护服:对应标准prEN ISO 13982-1;
等级4
-
1级:≤4.5g
2级:≤1.0g
3级:≤1.0g
4级:无规定
ASTM F1359 “全面液体透 过试验”
-
ASTM F1359 “全面液体透 ASTM F1670-2007
过试验”
疫情医用防护用品中外标准对比分析(口罩、防护服、手套、护目镜等)

疫情医用防护用品中外标准对比分析(口罩、防护服、手套、护目镜等)前言为做好《关于发挥标准化作用助力防疫产品出口应对全球疫情八条措施》的工作落实,相关技术委员会专家组织对防疫产品相关中国标准与欧洲等国外标准进行了文本比对分析,相关信息仅作为技术信息资料供参考,不作为法律依据。
目录1、医用防护服中外标准对比分析 (4)2、医用口罩中外标准对比分析 (21)3、医用手套中外标准对比分析 (27)4、个人用眼护具中外标准对比分析 (41)5、防护鞋靴、防护帽中外标准对比分析 (47)6、个体防护装备口罩(自吸过滤式防颗粒物呼吸器)中外标准对比分析 (54)7、测温仪中外标准对比分析 (60)8、个体防护装备中外标准对比分析 (63)9、手术衣中外标准对比分析 (68)10、基础纺织材料中外标准对比分析 (70)1、医用防护服中外标准对比分析经汇总国家药品监督管理局医疗器械标准管理中心、中国纺织工业联合会科技发展部、全国个体防护装备标准化技术委员会等相关方面提供的标准比对材料,我国强制性国家标准GB 19082-2009《医用一次性防护服技术要求》和欧盟标准(EN 14126)的比对情况如下。
在适用范围上,欧盟标准(EN 14126)适用于可重复使用的防传病毒防护服。
我国标准(GB 19082)适用于医务人员在工作中接触具有潜在感染性的患者血液、体液、分泌物、空气中的颗粒物等提供阻隔、防护作业的医用一次性防护服。
在面料物理性能上,欧盟标准(EN 14126)引用 EN 14325《防化学物质的防护服—化学防护服的材料、接缝、接头和组件的测试方法和性能分类》,要求面料应该根据该标准确定的测试方法和性能分类系统,对防护服产品进行测试和分类。
我国标准(GB 19082)规范了断裂伸长率、断裂强度等 2 项指标,耐磨性、耐屈挠性、耐屈挠性(-30℃)、撕裂等其他指标未规范。
在面料阻隔性上,欧盟标准(EN 14126)主要引用 ISO 16603、ISO 16604、ISO 26610、ISO 26611、ISO 26612等国际标准,规范了抗合成血液穿透性、抗血源性病原体(Phi-X174)噬菌体污染性液体耐压穿透测试、抗湿态微生物穿透、防微生物气溶胶测试、抗干态微生物测试等5方面的分等分级要求。
医用一次性防护服欧盟标准EN14126-2003和我国标准GB19082-2009的主要技术要求对比表

医用一次性防护服欧盟标准EN14126-2003和我国标准GB19082-2009的主要技术要求对比表
标准编号GB 19082-2009 EN 14126-2003
标准名称医用一次性防护服技术要求防护服防传病毒防护服的性能要求和试验方法
适用范围本标准规定了医用一次性防护服的要求。
本标准
适用于医务人员在工作中接触具有潜在感染性的
患者血液、体液、分泌物、空气中的颗粒物等提
供阻隔、防护作业的医用一次性防护服。
适用产品:医用一次性防护服本标准规定了可重复使用的、有限使用的防传病毒防护服的要求和试验方法。
本标准不适用于手术一线人员所穿戴的防护服或者为防止手术干预期间交叉污染而放置在病人身体上的手术单。
适用产品:抗感染性物质防护服
技术条款指标要求测试方法指标要求测试方法
面料物理性能耐磨性无机械和易燃性要求:材料应该根据 pr EN 14325 相关条款
制定的测试方法和性能分类系统进行测试和分类。
耐屈挠性无
耐屈挠性(-30℃)
(可选)
无
撕裂无
断裂伸长率关键部位应不小于15 GB/T 3923.1-1997
断裂强度关键部位应不小于
45N
GB/T 3923.1-1997
面料阻隔性抗渗水性测试关键部位静水压应≥
1.67kPa
GBT 4744-1997 无
沾水性测试≥3 级GBT 4745-1997 无颗粒过滤效率关键部位及接缝处对
非油性颗粒物过滤效
率应不小于 70
GB 19082-2009 第5.7 条无透湿量≥2500g/(m2·d) GB/T 12704-1991 的方法无。
中国美国和欧盟的医用防护服标准及指标对比分析

中国美国和欧盟的医用防护服标准及指标对比分析自2020年4月10日起,对11类、19种海关商品编号项下的医疗物资实施出口商品检验。
海关实验室对出口医疗物资的检测,将按照以下标准进行:进口国(地区)有质量安全标准要求的,依据进口国(地区)质量安全标准进行检测;进口国(地区)无质量安全标准要求的,按照我国质量安全标准进行检测。
下面,来一起了解中国、美国、欧盟对于医用防护服各自的执行标准以及相关认证认可要求。
中国医用防护服执行国家标准GB 19082-2009《医用一次性防护服技术要求》,该标准为强制性,针对医用一次性非织造防护服,没有对可重复使用的防护服作出规定。
美国的医用防护服标准是由NFPA美国车家防火协会)制定的NFPA1999适用于医疗急救时美国医疗器具开发协会组织制定的AAMIPB-70,适用于评价卫生用防护服装的阻隔性能。
欧盟颁布了EN14126-2003防护服防病毒防护服的性能要求和试验方法,该标准主要关注点为防护服的耐血液、体液和病毒的穿透性。
1中国国内基于风险通常把医疗器械分成三类:第一,风险低的和基本没有风险的属于一类,在地市局药品监管部门机构备案。
第二,中等风险的医疗器械由省一级药品监管部门注册审批。
第三,高风险的医疗器械属于三类,由国家局直接负责组织审批。
医用防护服属于二类医疗器械,由省一级药品监管部门实施注册管理2美国美国食品与药物管理局(FDA根据风险等级将医疗器械产品分为三个等级进行管理,一级指普通产品,二级指通过特殊控制来保证其安全性和有效性的产品,三级指一般用来支持人体生命,防止人体健康受损,具有治病、致残的潜在不合理风险的产品。
美国医用防护服可分为非手术防护服和手术用防护服两类。
非手术防护服属于I类医疗器械,免于上市前登记,直接进行机构注册。
而手术用防护服属于II类医疗器械,需要进行上市前登记,即需要申请FDA 510&II类产品上市前要通告,基本流程如下(1)产品测试(性能测试、化学测试)(2)准备510K文件(3)提交FDA评审(4)FDA发510K 批准(5)完成工厂注册和机器列名(6)产品出口3欧盟欧盟经济区市场涉及到安全、卫生、环境保护和消费者保护的商品(如电子、机械、医疗器械、玩具、个人防护设备、通讯、承压设备等)已经被强制性地列入“必须携带CE标记,否则不准进入欧盟市场流通”之列。
国内外医用手术防护服标准比较及分析 (一 )

GB/T4744静 水 无
压试验 ;
GB/T4745沾 水
试验
AATCC 42 水 冲 ASTM F1359 全 EN 20811抗液体 无
击渗透试验 ;
面液体透过试验 渗透
AATCC127 静 水
压试验
合成血液渗透
GB19082自身规 无
定的血 液穿 透试
验
ASTM F1670 合 ASTM F1359 全 无
EN 13938-1干态 ; 无 EN 29073-3湿态
断裂拉伸强力及伸长率 GB/T3923.1 拉 有要求
无
无
EN 13938-1干态 ; 无
伸性能测定
EN 29073-3湿态
其他物理性能
无
无
无
ASTM D2582 抗 无
ISO 13995 抗 撕
穿裂性能 ;
裂;
— 37 —
标准 产业用纺织品 总第 193期
表 1 国内外主要的手术服及盖布标准对防护材料的基本性能测试条款的比较
项 目
中国 GB19082-2003 总后勤部 WSB58 美国 AAMIPB-70 美国 NFPA1999 欧洲 EN13795 国际标准 ISO16452
试验
试验
舒适性
GB/T 12704 透 透湿量试验
无
无
无
ISO 11092热舒适
湿量试验
性
抗静电性能
GB/T 12703 静 无
无
电性能测试
无
无
ISO 16542
阻燃性能
GB/T5455燃 烧 无
无
无
无
性能试验
ISO 6941阻燃
医用防护服相关标准及检测方法的对比

医用防护服相关标准及检测方法的对比摘要:医用防护服指的是医疗机构医务人员在特定场所作业过程中穿着的防护性服装。
医用防护服是新型冠状病毒肺炎期间医护人员需要用到的医疗物资,在疫情防护工作中发挥相当重要的作用。
新冠疫情目前还时有发生,疫情防护工作目前还不能松懈,这种情况下,相关单位需要改善医用防护服中存在的问题,例如质量不符合制作标准、检测方法合理性欠佳等。
建立健全医用防护用品质量评价体系,减少国家标准与国际标准之间存在的差距。
本文将围绕“医用防护服相关标准及检测方法的对比”这一话题进行研究和探讨。
关键词:医用防护服;相关标准;检测方法;对比在新型冠状病毒肺炎发生之前,我国医用防护服制作及标准制定体系并不是非常健全,医疗行业的发展重点并不在医用防护用品方面,市场上存在较多的医用防护服基本上都为棉质防护服。
这主要是因为在新冠疫情开始之前,国家需要用到大规模医用防护服的场景并不是很多,因此相关研究也较少,加上各方面原因的限制,市场很难形成统一医用防护服标准。
这一情况在新冠疫情发生之后发生了变化,医用防护服相关标准及检测逐渐成为医疗行业的发展重点。
1.医用防护服相关研究医用防护服最开始被用在手术室中,其作用是防止医疗人员在手术过程中将自身携带病毒传染给病人。
为了防止这一情况发生,手术皆需要处在无菌环境进行,但是病毒除空气传染之外,还有可能出现液体传染,研究人员认为医用防护用品能够对液体进行阻挡。
一些研究人员认为,夏天的时候温度较高,医疗人员穿着防护服可能会觉得并不是很舒服,这时候需要适当增加医用防护服的透湿量,使医疗人员在手术室能更舒适,因为透湿度成了医疗人员穿着医用防护服是否舒适的主要判断指标。
之后有研究人员指出,隔热量和透湿量可以整合为蒸发散热效能[1]。
为了尽可能保证医用防护服的舒适性,研究人员做出了很多努力,一些研究人员用假人对暖体出汗这一情况进行了模拟,对医用防护服热舒适性进行研究。
一些研究人员为了验证口罩是否能够主动杀灭病原菌,利用聚苯乙烯微球对炭疽孢子模拟进行相关检测、一些研究人员甚至提出需要构建一个能够实时对口罩外部颗粒及微生物过滤效果进行检测的人体采样系统。
热防护服国内外标准比较分析

93热防护服国内外标准比较分析赵 越 李 杰 狄宏静 吴国平*(江苏省纺织产品质量监督检验研究院)摘 要:本文综述了热防护服的发展趋势和标准现状,通过比较分析欧盟、美国和中国标准中热防护服的技术要求和测试方法,指出它们之间的异同点,并结合热防护场景的实际需求,提出未来热防护服的发展方向及标准修制订建议。
关键词:热防护服,热防护性能,损毁长度,续燃时间DOI编码:10.3969/j.issn.1674-5698.2021.02.018Comparative Analysis of Domestic and Foreign Standards forProtective Clothing against Heat and FlameZHAO Yue LI Jie DI Hong-jing WU Guo-ping*(Jiangsu Textiles Quality Service Inspection Testing Institute )Abstract: This article reviews the development trend and the standard status of the protective clothing against heat and flame. It comparatively analyzes the difference of the technical requirements and the test methods among the standards in Europe, US and China, and identifies the gaps between these standards. Combined with the actual needs of the heat and flame protection scene, it puts forward the developing direction of the protectve clothing and the revised suggestion of the standards.Keywords: protective clothing against heat and flame, thermal protective performance, damaged length, afterflame time作者简介:赵越,工程师,研究方向为纺织品检测与管理。
欧美和我国手术衣手术铺单标准及常用手术室用面料简介概要

文章编号:1006-6586(200705-0028-05 中图分类号:R197.39 文献标识码:A随着生活水平的不断提高,人们对医疗产品的美国医疗仪器促进协会 (AAMI 于2003年颁布了要求越来越高,在手术过程中对感染控制的要求也ANSI/AAMI PB70, 医院用手术衣及铺单的液体屏蔽性在不断的提升,从原来的仅保护病人到现在既要保能与分类。
(*附1 护病人又要保护医护人员的理念转变,手术过程中•医用手术衣及铺单的选择——(AAMI TIR11使用的手术衣与手术铺单的性能已成为我们关注的AAMI 技术信息报告(TIR 2005版:医院用手术热点之一。
衣及铺单的选择。
(*附2)手术衣与手术铺单产品可以是重复使用或是一次•手术衣及铺单选用的临床实践推荐——(AORN 性使用,对于重复性使用的产品需要特别强调的是在Standards 2006版出厂时或每一次清洗后产品的性能仍需达到规定的要AORN 也包括了一部分相关内容, 手术衣及铺单选求。
各国都以标准的形式规定了产品的性能要求。
以用的临床实践推荐。
[1]下就欧美与我国相应的产品标准作一探讨,希望对进1.2 欧洲标准:一步理解相关产品标准有所帮助。
笔者也希望就此有•EN 13795-1,2002《病人、医护人员与器械手术单、更多的人来加入相关讨论,以期共勉。
手术衣与洁净服第1部分:制造厂、处理厂与产品的通用要求》1 美国 / 欧洲 / 中国相关手术衣及铺单国家标准简介• EN 13795-2,2004《病人、医护人员与器械手术单、美国是世界上最先采用手术衣及铺单标准的国家,手术衣与洁净服第2部分:试验方法》以下罗列标准是用来帮助企业符合相关美国法规要• EN 13795-3,2006《病人、医护人员与器械手术单、求。
相继,欧洲与日本都发布了相应的地区与国家标手术衣与洁净服第3部分:性能要求与性能水平》准。
随着时间推移与实践经验的丰富,相关标准也在• EN ISO 9073-10,2003《纺织品非织造布试验方法不断更新与完善。
国内外医用防护服标准比较及分析

国内外医用防护服标准比较及分析张建春郝新敏杨元(总后勤部军需装备研究所)“非典”的肆虐,引起了人们对防护用品的重视,针对大批医护人员在工作中被感染,WHO与美国CDC提倡:为控制强传染性病毒的蔓延,应选择适当的防护装备。
医用防护服要能阻隔微生物、颗粒物质和流体透过,经受消毒处理,耐用、耐磨、抗撕裂、防穿刺、抗纤维应变;不含有毒成分、不起绒、有良好的性价比、符合OSHA规定的舒适性和安全性。
但是目前国内普通医用防护服的质量良莠不齐,不能为医护人员提供有效防护,我们急需一个统一的标准来规范防护品市场。
为此,由国家食品和药品监督管理局等部门参照欧美标准,紧急出台了有关防护服产品的国家强制性标准。
由于各国标准的制定方式、考虑因素以及产品性能、测试手段不同,各标准间存在着较大的差异。
1防护服检测标准1.1国外目前国际上较通用的标准是美国NIOSH标准和欧盟的EN标准。
美国的医用防护服标准是由NFPA(美国国家防火协会)制定的“NFPA1999"‘,适用于医疗急救,规定了为人员提供阻隔血液和体液的最低防护标准,把对人体的防护分为头部、身体(除头、手、足部以外的所有部分)、手和足部四种,其产品按这四个功能分为:(1)面部防护品包括防飞沫眼都防护品、戴帽兜的头盔、面具等。
(2)防护衣分为一次性和可重复使用两种,包括分体式和连体式的工作服、病患使用的(3)隔离袋、围裙、套袖等。
(4)一次性急救手套(5)急救鞋欧盟的标准则是由CEN(欧洲标准委员会)制定的。
1.2国内我国对防护服、口罩和手套单独制定标准(没有眼部和足部防护品的标准),包括:GB7543—1996《橡胶医用手套》、GB10213—1995《一次性使用橡胶检查手套》;GB19082--2003《医用一次性防护服技术要求》防护服由帽子、上衣、裤子组成,可分为连身式结构和分身式结构’’,没有对可重复使用的防护服作出规定:国内外医用防护服标准比较及分析作者:张建春, 郝新敏, 杨元作者单位:总后勤部军需装备研究所本文链接:/Conference_6737028.aspx。
国内外医用防护服性能指标对比分析

Standard Paterit国内外医用防护服性能指标对比分析张传雄(纺织工业科学技术发展中心,北京,100020)摘要:世界各地的医用防护服的标准体系均是根据本地区特点建立,其性能指标要求也不同。
本文介绍了医用防护服的类型,广义上可分为医用一次性防护服、手术衣和隔离衣,并对不同地区医用防护服的性能指标进行对比分析,各地区性能要求侧重点不同,美国、欧盟地区对医用防护服的分类分级较细,而中国对医用一次性防护服性能指标要求则比较明确和直观。
关键词:医用防护服;性能指标;手术衣;隔离衣中图分类号:TS106.6文献标识码:A文章编号:1007-9515(2021)02-0065-06Comparative Analysia of Performance Indexea ofMedical Pratective Clothing iv Differeri CountriraZHANG Chuanxiong(Textile Industa Science and Technolony Develonmeni Centeo,Beijing,100022,China)Abstract:The standarO system of melical protective clothing all ovco the worlO is estaniisheC accorOina tn the characteostics of the reeion,and Os peOorrmiaca indee01X011,-are also dimerent.This pdper introOuces the tyyes of meCicei protective clothing,whicO are broaniy UiviOeC into meCicei Uisposanie protective clothing,surgicei gowa and isolation gown.The peUormddce indexes of meCicei protective clothing in Umemdt regiods are comparei and analyzeC1The perfounadce001X011,3of veuons reeions are dimerent.The classification of meCicei protective clothing in the UniteC States ani the Eampeca Union is One,while the perfounaace oquiomects On meCiceO Uishosanie protective clothing in China are clecr and01x1000.Key words:meCiceO protective clothing;peOormance indexes;surgiceO gown;isolation gown0引言入了前所未有的大团结,共同对抗此次疫情。
阻燃防护服测试标准的比较分析

阻燃防护服测试标准的比较分析阻燃防护服指在接触火焰及炽热物体后,在一定时间内能阻止本身被点燃、有焰燃烧和阴燃的防护服。
阻燃防护服是重要的个体防护装备,已广泛应用于石油、化工、冶金、造船、消防、国防以及有明火、散发火花、熔融金属和有易燃物质的场所,需求量极大,且在今后5年内亦将持续攀升。
英国Textiles Intelligence 公司引文指出,消费者对多功能防护服兴趣的提高以及各国立法的日益严格,将促使阻燃纤维及其织物的需求增长,欧洲及美国阻燃成衣的市场规模将不断扩大。
在阻燃防护服市场不断扩大的同时,需要相应的技术法规对其阻燃性能进行评价。
目前,一些先进的国家和地区,如美国、欧盟专门针对防护服阻燃方面制定了多项标准,另外国内在此领域开始了积极研究。
这里分别对上述国家的防护服阻燃测试标准的适用范围、测试方法、评判要求等进行比较和分析。
1美国防护服阻燃测试标准(National Fire Protection Association)制定了一系列不同类型防护服性能的测试标准,涉及阻燃防护服技术性能的标准有NFPA 1971-2007、NFPA 1975-2009、NFPA 1976-2000、NFPA 1977和NFPA 2112。
其中NFPA 1976已并入NFPA 1971,NFPA 1975和NFPA 1977规定的阻燃测试采用的是非接触火焰式的测试方法,故本节主要比较NPFA 1971和NFPA 2112。
1.1 NPFA 1971消防和类似消防用全套装束测试标准NFPA 1971规定了消防和类似消防用全套装束(包括服装、鞋靴、头盔和手套等)的测试程序。
服装阻燃测试采用ASTM D6413-2008标准规定的垂直燃烧法,测试示意图见图1。
材料经测试后必须满足以下要求:(1)平均炭化长度不能超过100 mm。
(2)平均续燃时间不能超过2s。
(3)试样点燃后不能有融滴。
对于多层材料,每一层都需要单独测试并通过以上要求。
全球各国医用防护服标准对比

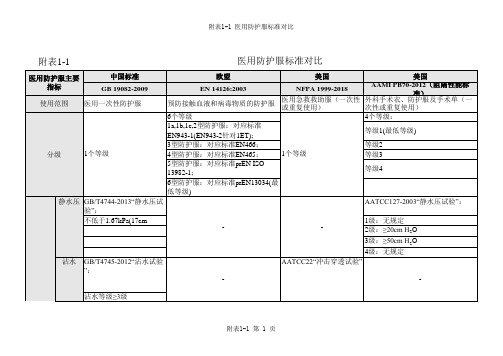
静水压
GB/T4744-2013“静水压试验”:
-
-
AATCC127-2003“静水压试验”:
不低于1.67kPa(17cm H2O)
1级:无规定
2级:≥20cm H2O
3级:≥50cm H2O
4级:无规定
沾水
GB/T4745-2012“沾水试验”:
-
AATCC22“冲击穿透试验”
-
沾水等级≥3级
-
ASTMD751:
-
断裂伸长率
GB/T3923.1-1997:不小于15%
-
-
-
胀破强力
-
-
ASTMD751:
-
接缝及封闭处强力
-
-
ASTMD1683:
-
刺破强力
-
-
ASTMD2582:
-
撕破强力
-
-
ASTM D5587:
-
舒适性
透湿
GB/不小于2500g/(m2·d)
3级:3.5kPa;
2级:1.75kPa;
1级:0kPa;
颗粒穿透
无,但需测试“过滤效率”:非油性颗粒的过滤效率应不小于70%(氯化钠气溶胶或类似固体气溶胶,直径750±20nm,颗粒分布的几何标准偏差:≤1.86;浓度≤200mg/m3)
ISO/DIS 22611“抗气溶胶渗透污染能力试验”:
-
-
穿透率(log):
3级:log > 5 ;
2级:3 < log ≤5 ;
1级:1 < log ≤3 ;
ISO/DIS 22612“抗固体颗粒污染能力试验”:
穿透量(log cfu):
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国美国和欧盟的医用防护服标准及指标对比分析
自2020年4月10日起,对11类、19种海关商品编号项下的医疗物资实施出口商品检验。
海关实验室对出口医疗物资的检测,将按照以下标准进行:进口国(地区)有质量安全标准要求的,依据进口国(地区)质量安全标准进行检测;进口国(地区)无质量安全标准要求的,按照我国质量安全标准进行检测。
下面,来一起了解中国、美国、欧盟对于医用防护服各自的执行标准以及相关认证认可要求。
中国医用防护服执行国家标准GB 19082-2009《医用一次性防护服技术要求》,该标准为强制性,针对医用一次性非织造防护服,没有对可重复使用的防护服作出规定。
美国的医用防护服标准是由NFPA(美国车家防火协会)制定的NFPA1999,适用于医疗急救时美国医疗器具开发协会组织制定的AAMIPB-70,适用于评价卫生用防护服装的阻隔性能。
欧盟颁布了EN14126-2003防护服防病毒防护服的性能要求和试验方法,该标准主要关注点为防护服的耐血液、体液和病毒的穿透性。
1中国
国内基于风险通常把医疗器械分成三类:
第一,风险低的和基本没有风险的属于一类,在地市局药品监管部门机构备案。
第二,中等风险的医疗器械由省一级药品监管部门注册审批。
第三,高风险的医疗器械属于三类,由国家局直接负责组织审批。
医用防护服属于二类医疗器械,由省一级药品监管部门实施注册管理
2美国
美国食品与药物管理局(FDA)根据风险等级将医疗器械产品分为三个等级进行管理,一级指普通产品,二级指通过特殊控制来保证其安全性和有效性的产品,三级指一般用来支持人体生
命,防止人体健康受损,具有治病、致残的潜在不合理风险的产品。
美国医用防护服可分为非手术防护服和手术用防护服两类。
非手术防护服属于I类医疗器械,免于上市前登记,直接进行机构注册。
而手术用防护服属于II类医疗器械,需要进行上市前登记,即需要申请FDA 510K。
II类产品上市前要通告,基本流程如下
(1)产品测试(性能测试、化学测试)
(2)准备510K文件
(3)提交FDA评审
(4)FDA发510K批准
(5)完成工厂注册和机器列名
(6)产品出口
3欧盟
欧盟经济区市场涉及到安全、卫生、环境保护和消费者保护的商品(如电子、机械、医疗器械、玩具、个人防护设备、通讯、承压设备等)已经被强制性地列入“必须携带CE标记,否则不准进入欧盟市场流通”之列。
防护服属于个人防护用品,英文是Personal Protective Equipment,简称PPE,欧盟的个人防护用品安全指令是
89/686/EEC。
根据PPE指令的规定,按照PPE产品设计的复杂程度和防护级别将PPE产品分为三个类别。
在欧洲市场销售的个人防护用品,必须符合适用的安全要求和标准。
获得CE认证需要以下程序
(1)申请和提交型号
(2)提交供应商证书和测试报告(3)评估和认证
(4)PPE型式证书
(5)符合性声明
医用防护服的“防护性能”是最为重要的性能要求,主要包括液体阻隔、微生物阻隔和对颗粒物质的阻隔等方面。
我国2003年首次颁布了《医用一次性防护服技术要求》国家强制标准,并于2009年进行了修订,GB19082-2009《医用一次性防护服技术要求》中规定的性能指标相对较丰富。
目前国际上较通用的医用防护服标准是美国美国国家职业安全卫生研究所(NIOSH)标准和欧盟的EN标准。
下面就中美欧医用防护服标准中的防护性能进行简单比对。
