药典2010版药用辅料收载解析--涂家生
《中国药典》2010年版附录_2

V(ml) E(mv)
△E
△V
△E/△V
△2E/△V2
33.00
405
10
0.40
25
33.40
415
33
7
0.20
35
33.60
422
50
33.80
431
甲(Pb) 乙(样品) 加设监控管丙(Pb+样品)
要求丙>甲>乙 合格
如丙<甲
采第二法
二法 炽灼后的硫代乙酰胺比色法 适用于含芳环、芳杂
环以及难溶于水、稀酸或有机溶剂的药物。配成溶
液后同一法操作。
三法 硫化钠比色法 适用于碱溶性药物,同原附录未加
监控管。
四、主要增订项目内容
2、原子吸收与光焰光度法 无实质修改 3、等离子体质谱 修订附录
五、主要修订项目内容
• 紫外-可见分光光度法 1、波长校正 增加了高氯酸钬溶液的校正(以10% 高氯酸为溶剂,配制含4%氧化钬的溶液)
λmax nm:241.13,278.10,287.18,333.44,
345.47,361.31,416.28,451.30, 485.29,536.64,640.52nm。 2、波长允差 紫外区 ±1nm 500nm ±2nm 700nm ±4.8nm
波数允差为0.5%
辅料有干扰,晶型有变 不宜采用红外鉴别
五、主要修订项目内容
3、多组份原料药的鉴别 可借鉴制剂鉴别的 方法
4、混晶中无效或低效晶型的限度控制 采用基线密度法计算指定谱带的吸光度后 再计算各晶型的相对含量(甲苯咪唑和棕 榈氯霉素)
涂家生《中国药典》年版溶出度修订及其意义ppt课件

格列苯脲片在不同介质中的溶出 (representing duodenum, jejunum, ileum and colon, pH 6.0 to 7.5)
PK:模拟和实验结果
•Based on computer simulations, dissolution data from LQ-FaSSIF media with pH gradient, was best to predict in vivo plasma concentrations of test and reference tablets.
人工空腹状态胃液
人工进食状态胃液
人工结肠液
FaSSIF配方
• 胆酸钠 3 mM • 卵磷脂 0.2 mM • 马来酸 19.12 mM • 氢氧化钠 34.8 mM • 氯化钠 68.62 mM • pH 6.5,渗透压摩尔浓度 180±10
mOsm/kg,缓冲容量10 mmol/L/pH,表面张 力 54.3mN/m
溶出度和崩解度
崩解:系指口服固体制剂在规定条件下 全部崩解溶散或成碎粒,除不溶性包 衣材料或破碎的胶囊壳外,应全部通 过筛网。
• 药品的崩解度到溶出度概念是历史的 进步。是从化学等效性到生物等效性 的重要节点。
溶出度(释放度)与体内相关性
胃排空
转运
溶出
吸收
代谢
二、中国药典2010年版溶出度概况
• 研究性溶出度试验:应研究食物影响,作 为处方筛选、工艺优化的依据,并对于 BCSI、II类仿制药物的临床豁免提供依据。
• 溶出度检查法:应充分反映药物制剂质量, 降低分析方法的影响。
溶出度(释放度)试验的要求
•应反映和区分因制剂质量差异(如崩解度、 API粒径、片剂的硬度等)而导致的体内吸收 的差异,应尽量反映IVIVC。 •方法的选择应能反映制剂溶出行为中能反映 各种影响因素,应减少分析方法的影响(使分 析方法的误差变最小)。
解读2010版中国药典药用辅料标准

解读2010版中国药典药用辅料标准安徽山河药用辅料股份有限公司尹正龙周卫东摘要:2010版中国药典己出台,本文针对2010版中国药典药用辅料的标准进行了阐述,详细阐述了新版中国药典药用辅料标准的进步性及存在的不足之处,针对不足之处提出了笔者的解决思路。
经过第九届中国药典委员会员20个月的精心努力,2010年版中国药典终于揭开了神秘面纱。
2010年版中国药典在2005年版的基础上,进行了大幅度的标准修订和新增收品种标准的工作。
无疑,2010年版中国药典将担当起加快实施国家药品标准提高行动计划、建立中药标准规范技术体系、全面提高我国药品质量控制水平的核心作用。
2010年版中国药典二部同2005年版一样,将药用辅料标准另设为正文品种第二部分。
同2005年版收载药用辅料标准相比,2010年版收载药用辅料标准进步性体现在以下几个方面。
一是收载的药用辅料品种大大增加。
2010年版中国药典共收载了132个药用辅料品种,同2005年版中国药典收载的72个品种相比是大大增加。
其中既增加了在国内药物制剂行业己大量应用的辅料,如二氧化硅、羧甲基纤维素钠等;也增加了在国内药物制剂行业虽没有大量应用,但应用前景异常广阔的新型药用辅料,如交联聚维酮、交联羧甲基纤维素钠等。
2010年版中国药典还对不成熟的药用辅料进行了删减,如三氯甲烷、氧化淀粉。
二是严格辅料的标准要求。
2010年版中国药典针对产品来源和生产工艺,有针对性地对产品质量进行控制。
针对工艺可能引入的杂质进行分析,必要时增加检查项目,对有毒有害杂质严格限制。
例如针对使用工业明胶为原料非法生产药用胶囊的问题,2010版药典在胶囊标准中规定铬含量不得过2ppm,并制定了环氧乙烷、羟苯酯类、重金属等其他杂质的检查项目;再如针对崩解剂羧甲淀粉钠生产过程中产生的乙醇酸钠,因乙醇酸钠具有的增黏性能影响羧甲淀粉钠的崩解效果,因此2010版药典对乙醇酸钠指标加以控制。
三是在药典附录中增加了“药用辅料通则”。
《中国药典》2010年版(三部)凡例、通则

附件:《中国药典》2010年版(三部)凡例、通则及附录定稿会会议纪要按照2010年版《中国药典》编制的统一安排,我委于2009年3月18-20日在京召开了2010年版《中国药典》三部凡例、通则及附录的定稿会。
来自病毒制品、细菌制品、血液制品、生物技术产品以及微生物专业委员会的相关委员、中检所和参与批签发的7个地方药检所的有关专家、我委生物制品标准处、业务综合处相关人员以及部分生物制品生产企业代表共约40人参加了会议。
会议对2010年版《中国药典》三部凡例、9个通则及16个通用性附录的增修订进行了审定,确认了下列增修订意见,会议主要内容纪要如下:一、凡例(一)、名称及编排项下,增订微生态活菌制品总论及体外诊断试剂的收载。
(二)、设施与生产质量管理项下第(2),修订为:人血液制品应使用专用设备并在专用设施内进行生产,不得与其他异种蛋白制品混用。
(三)“制造”项修订为“基本要求”,修订内容为:1、设施与生产质量管理项下增订:(4)涉及感染性材料的操作应符合国家生物安全的相关规定。
2、辅料及原料项下将“原料”修订为“原材料”,质量要求增订应符合现行《中国药典》三部的规定,“本版药典未收载者,必须制定符合药用要求的标准”修订为“本药典未收载者,必须制定符合产品生产和质量控制要求的标准”。
3、增订“七、生产过程中防腐剂使用的相关要求”项,增订内容为:1、抗生素的使用生产过程中抗生素的使用应符合以下原则:(1)除另有规定外,不得使用青霉素或其他β-内酰胺类抗生素。
(2)成品中不得使用抗生素作为防腐剂。
(3)生产过程中,应尽可能避免使用抗生素,必须使用时,应选择安全性风险相对较低的抗生素,且产品的后续纯化工艺应保证可有效去除制品中的抗生素,去除工艺应经验证;如后续工艺不能有效去除抗生素,则不得添加。
病毒性疫苗生产中应仅限于在细胞制备、细胞增殖过程中使用抗生素。
(4)生产过程中使用抗生素时,成品检定中应检测抗生素残留量,并规定残留量限值。
《动物来源药用辅料指导原则》解析

学报Journal of China Pharmaceutical University2022,53(3):376-382376·专论·《动物来源药用辅料指导原则》解析孙春萌1#,陈蕾2#,李亚楠1,宋宗华2,杨昭鹏2*,涂家生1**(1国家药品监督管理局药物制剂及辅料研究与评价重点实验室,中国药科大学药学院药剂系,南京210009;2国家药典委员会,北京100061)摘要动物来源药用辅料在药物制剂中广泛使用,是药用辅料的重要组成部分。
然而,相较于其他来源药用辅料,动物来源药用辅料在原材料、生产、质控、贮藏、监管等环节均有特殊要求。
2020年版《中华人民共和国药典》首次收载了《动物来源药用辅料指导原则》,以风险管理理念对动物来源药用辅料的全生命周期管理提出了基本思路和技术要求。
本文将重点说明动物来源药用辅料的特殊性,并结合国内外相关政策法规和技术文件,对指导原则的主要内容进行解读,以期为指导原则的实施提供更为全面的参考。
关键词动物来源药用辅料;指导原则;质量控制;风险管理;全生命周期中图分类号R95文献标志码A文章编号1000-5048(2022)03-0376-07doi:10.11665/j.issn.1000-5048.20220316引用本文孙春萌,陈蕾,李亚楠,等.《动物来源药用辅料指导原则》解析[J].中国药科大学学报,2022,53(3):376–382.Cite this article as:SUN Chunmeng,CHEN Lei,LI Yanan,et al.Interpretation of the Guideline for Pharmaceutical Excipients of Animal Origin[J].J China Pharm Univ,2022,53(3):376–382.Interpretation of the Guideline for Pharmaceutical Excipients of Animal Origin SUN Chunmeng1#,CHEN Lei2#,LI Yanan1,SONG Zonghua2,YANG Zhaopeng2*,TU Jiasheng1**1National Medical Products Administration(NMPA)Key Laboratory for Research and Evaluation of Pharmaceutical Preparations and Excipients,Department of Pharmaceutics,School of Pharmacy,China Pharmaceutical University,Nanjing210009;2Chinese Pharmacopoeia Commission,Beijing100061,ChinaAbstract Pharmaceutical excipients of animal origin,an important part in pharmaceutical excipients,are widely used in pharmaceutical preparations.However,compared with the pharmaceutical excipients of other origins, pharmaceutical excipients of animal origin have more special requirements in many aspects,such as raw materials,production,quality control,storage,supervision,etc.Chinese Pharmacopoeia2020first included the Guideline for Pharmaceutical Excipients of Animal Origin,which introduces the basic ideas and technical requirements for the life cycle quality control of pharmaceutical excipients of animal origin based on the risk management concept.This article illustrates the specificity of the pharmaceutical excipients of animal origin, and interprets the main contents of this guideline in conjunction with relevant domestic and foreign regulations and technical documents,thereby providing comprehensive reference for the implementation of the guideline. Key words pharmaceutical excipients of animal origin;guideline;quality control;risk management;life cycle This study was supported by the Chinese Pharmacopoeia Commission(No.ZG2017-5-03)and the Ministry of Science and Technology of China(No.2017ZX0910*******)收稿日期2022-02-17*通信作者*Tel:E-mail:yangzhaopeng@**Tel:E-mail:jiashengtu@基金项目国家药典委员会“药品医疗器械审评审批制度改革专项课题”资助项目(No.ZG2017-5-03);国家科技“重大新药创制”专项课题资助项目(No.2017ZX0910*******)#孙春萌与陈蕾为共同第一作者第53卷第3期孙春萌,等:《动物来源药用辅料指导原则》解析#SUN Chunmeng and CHEN Lei contributed equally to this work动物来源生物材料和生物制品在生物医药领域可扮演诸多角色并发挥重要作用,既包括具有调节人体生理机能的活性物质(如肝素、鱼精蛋白等),也包括用于药物生产的生物载体(如Vero细胞等),还包括添加于药品制剂处方中的药用辅料(如明胶、乳糖等)。
《中国药典》2010年版药用辅料概况 PPT课件

中国药典》2010年版药用辅料概况
。。。。。。。。
例1:明胶空心胶囊
安全性项目 亚硫酸盐≤0.01%(原限值0.02% ) 氯乙醇(环氧乙烷灭菌工艺) ≤0.0018% 对羟基苯甲酸酯类 ≤0.05% 羟苯甲酯 羟苯乙酯 羟苯丙酯 羟苯丁酯 环氧乙烷(环氧乙烷灭菌工艺)≤0.0001% 铬≤0.0002%
《中国药典》2010年版药用辅料概况
4.注重加强安全控制
《中国药典》2010年版药用辅料概况 新增品种的遴选原则
1. 国内已生产的常用辅料品种; 2. 国内制药企业广泛应用的进口辅料品种;
3. 已有食品或化工行业标准、国内制药企业广泛 应用且标准较为成熟的辅料品种,可参照USP 、JP、EP、BP适当增加; 4. 开发新剂型所需要的重要辅料品种且国外药典 ( USP、JP、EP、BP )已收载品种。
中国药典》2010年版药用辅料概况 药典药用辅料未完成尚需继续的 工作
1. 收藏辅料品种量未达到目标 2. 尚需收载类别更广的辅料品种 3. 附录中分类类别未能满足品种中所有类别
中国药典》2010年版药用辅料概况
展望
1. 2. 3. 附录中药用辅料GMP指南的增订 附录中药用辅料GDP指南的增订 药用辅料的质量标准中药品功效相关性指 标的设立
增加“附录Ⅱ 药用辅料”单章的 思路
——有必要在附录中增加单章,制定药 用辅料的通用要求,对药用辅料正确 定义、分类,对质量控制项目做出基 本要求。
《中国药典》2010年版药用辅料概况
大幅度增加药用辅料收载数量的思路
药用辅料的质量影响和制约了我国制剂的水平 据不完全统计,我国制剂使用的药用辅料大约 500多种,2005年版药典仅收载72个品种。 美国大约有1500种辅料在使用 ,大约50%已经收 载于USP/NF中。 欧洲有药用辅料3000种在使用 ,在各国药典中收 载也已经达到50%。 ——加大我国药典中药用辅料的收载具有重要意义
溶出度和辅料问题-涂家生

人体BE的变异
• 等效的结论:统计学的意义下,较好 • 不等效:可能因为因素导致
二、固体制剂辅料的重要性和类别
• 辅料是药品中的非活性成分 • 辅料是药品质量中的重要部分 • 产品的质量是研发、生产的结果,检验并
不能改变药品质量 • 药物的晶型粒度、辅料、工艺的是关键 • 一致性评价的关键是固体口服制剂
•人工胃液 (SGF)的pH 1.2 ,除特殊要求外,一般不加酶。
•胶囊剂在溶出试验时因崩解迟缓导致溶出变化,可以 加入酶 (SGF加胃蛋白酶, SIF 加胰蛋白酶) 。
•不建议用水作为介质,因为水源的不同可以影响其 pH 、表面张力,药品中的API、辅料也可以改变之。
•水不溶性药物制剂的溶出可以加入表面活性剂如SLS, 但表面活性剂种类、量应进行研究 。
临床研究后期的溶出度方法
• 此时,药品的剂量、处方已经确定,需要 研究生产规模工艺过程中的变量对药品性 能的影响。
• 该方法应可以反映工艺参数的变化对药品 质量的影响、应可以反映稳定性试验中的 质量变化
不同阶段溶出度方法的要求
不同阶段溶出度方法的要求
某药物的粒径对溶出度的影响
Tween浓度的选择
临床疗效等效(包括有效性和安全性)
药学等效 生物等效
固体制剂的重点:溶出度/释放度,有关物质/杂质
溶出仪的基本要求:药物溶出仪机械验证指导原则
• 溶出仪应能够通过本指导原则的各项机械 验证技术指标
• 应按《中国药典》的要求采用溶出度标准 片(如水杨酸片)对仪器进行性能验证试 验,均需符合规定。
机械验证前的检查
斜度均不得超过0.5°。 • (二)篮(桨)轴垂直度 • 紧贴篮(桨)轴测量垂直度,再沿篮(桨)轴旋转
2010年版中国药典二部附录修订内容

附件:《中国药典》2010年版二部附录修订内容附录Ⅲ一般鉴别试验书页号:《中国药典》2010年版一部附录20水杨酸盐(1)■取供试品的中性或弱酸性稀溶液■【修订】,加三氯化铁试液1滴,即显紫色。
芳香第一胺类■取供试品50mg,加稀盐酸1ml,必要时缓缓煮沸使溶解,加0.1mol/L亚硝酸钠溶液数滴,加与0.1mol/L亚硝酸钠溶液等体积的1mol/L脲溶液,振摇1分钟,滴加碱性β-萘酚试液数滴,视供试品不同,生成由粉红到猩红色沉淀。
■【修订】附录ⅧK铵盐检查法书页号:《中国药典》2010年版一部附录59标准氯化铵溶液的制备■称取氯化铵29.7mg■【订正】,臵1000ml 量瓶中,加水适量使溶解并稀释至刻度,摇匀,即得(每1ml相当于10μg的NH4)。
附录ⅧQ热分析法■热分析法是利用温度和(或)时间关系来准确测量物质理化性质变化的关系,研究物质受热过程所发生的晶型转变、熔融、蒸发、脱水等物理变化或热分解、氧化等化学变化以及伴随发生的温度、能量或重量改变的方法。
物质在加热或冷却过程中,当发生相变或化学反应时,必然伴随着热量的吸收或释放。
同时根据相律,物相转化时的温度(如熔点、沸点等)保持不变。
纯物质具有特定的物相转换温度和相应的热焓变化值(△H)。
这些常数可用于物质的定性分析,而供试品的实际测定值与这些常数的偏离及其偏离程度又可用于定量检查样品的纯度。
热分析法可广泛应用于物质的多晶型、物相转化、结晶水、结晶溶剂、热分解以及药物的纯度、相容性与稳定性等研究中。
一、热重分析热重分析是在程序控制温度下,测量物质的质量与温度关系的一种技术。
记录的重量变化与温度或时间的关系曲线即热重曲线(TG 曲线)。
由于物相变化(如失去结晶水、结晶溶剂,或热分解等)时的温度保持不变,所以热重曲线通常呈台阶状,重量基本不变的区段称平台。
利用这种特性,可以方便地区分样品中所含水分是吸附水(或吸附溶剂)还是结晶水(或结晶溶剂),并根据平台之间的失重率可以计算出所含结晶水(或结晶溶剂)的分子比。
中国药典2010版二部附录药用辅料收载解析--涂家生(中国药科大学教授2011.4)

• 乳糖:乳糖分解酶缺乏的患儿禁用
• 色素滥用:合成色素很多有毒,慎选 • 防腐剂超量
中国药典2010年版有关药用辅料的 修、增订目标、原则
• 目标:附录中增加药用辅料章节(以指导 药用辅料的生产、应用、管理),正文增 加药用辅料的收载(收载常用辅料) • 品种收载原则:国内有生产和药用注册批 文,有使用;国内有生产、应用,无注册 批文,有国家标准、化工标准、食品标准 ,外药典收载;外药典收载,国内应用前 景大的新辅料;等
二、2010年版中国药典收载药用辅料的过程
200多个候选品种
药检所对其标准进行梳理、起草、复核
根据生产、使用、 质量的成熟情况
召开专家会议,对上报品种逐一审评
新增近40个品种收载
这样2010年版药典共收载132个药用辅料!
检测项目 性状 相对密度 黏度 酸值 皂化值 羟值 碘值 过氧化值 CP2005 + 1.06~1.09 350~550 mm2/s ≤2.2 45~60 65~80 18~24 - USP + 1.06~1.09 300~500 mm2/s ≤2.2 45~55 65~80 - - EP + 1.10 ≈400 mPa.S ≤2.0 45~55 65~80 - ≤10 JP + 1.065~ 1.095 345~445 mm2/s ≤2.0 45~55 - 19~24 - 拟定标准 + 1.06~1.09 350~550 mm2/s ≤2.2 45~60 65~80 18~24 ≤10
“辅料”一词的来源 辅料这个词汇来自于拉丁语excipiens,是动词excipere的现在 分词,意为接受,结合,去除。在1957年,辅料被定义为 “一种用作给药媒介的物质”,这说明辅料的作用仅仅是主 药的一种惰性载体。在1974年,辅料被形容为“任何为了使 药物达到合适的强度或形状而添加进入处方的惰性物质:一 种载体”。1994年美国药典定义辅料是除有效成分外所有有 意加入的成分,或者说是处方中除有效成分外的所有物质。 副词“有意地”说明了辅料在现代药物剂型中必须起着多重 作用,这些作用包括了保证药物稳定性、剂量的准确性、提 高感官特性和病人顺应性等。现代制剂技术要求研究制剂中 辅料的物理状态,以便药物生产和控制药品质量、保证药物 生物利用度、提高药效和对药物的耐受限度。
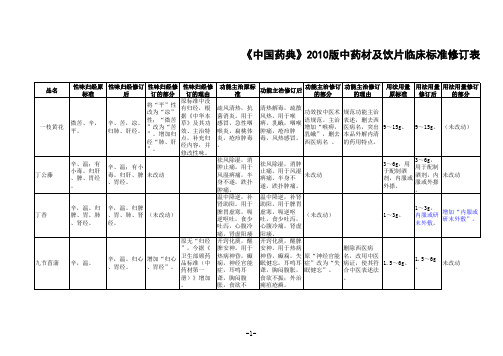
《中国药典》2010年版(一部)药材及饮片拟收载品种中医标准修订内容.
(未改动)
祛暑,生津。 用于气虚咳 嗽,暑热烦 躁,津伤口
暑,生津。用于
气虚咳嗽.暑热 烦躁,津伤口
(未改动)
渴,头目不清,
3~9g。 3~9g。 (未改动)
渴,头目不 四肢倦乏。
-3-
品名
儿茶
八角茴香 八角莲
刀豆 三七
性味归经原 性味归经修订 性味归经修
标准
后
订的部分
性味归经修 订的理由
功能主治原标 准
9~15g。 9~15g。
外用适量, 外用适
煎汤洗患处 量,煎汤
。
洗患处。
(未改动)
”。
苦、辛, 温;有大毒 。
苦、辛,温, 有大毒。归肝 、肾、脾、胃 、大肠经。
苦、辛, 温,有大毒 。归肝、肾 、脾、胃、 大肠经。
据《中华本 草》主治病 症修订
解痉止痛。用 于胃、十二指 肠溃疡,胆绞 痛,肾绞痛, 肠痉挛,震颤 麻痹,风湿痹
祛风除湿,解痉 止痛。用于风湿 痹痛,震颤麻 木,跌打伤痛, 腰痛,胁痛,脘 腹挛痛。
修订完善功能 主治,修订西 医病名
据《中华本草 》修订。规范 术语“镇痛” 改为“止痛” 。
0.6~0.9g 。
0.6~ 0.9g。
暂按原标准
甘、辛,寒 甘、辛,寒。
。归肺、膀 归肺、膀胱经 (未改动)
胱经。
。
清热解毒,利 尿消肿。用于 小便不利,淋 沥涩痛,白 带,尿路感 染,肾炎水 肿;外治疮疡 肿毒,湿疹。
用法用量 用法用量修订 修订后 的部分
苦,寒。
原标准中归
经阙如。根
苦,寒。归肺 、心、肝经。
增加“归肺 、心、肝经 ”。
据《广东地 标》记载及 功效主治特 点,补充归
简析2010版《中国药典》对胶囊行业的影响

2010年版药典辅料的收载情况 2010年版药典辅料的收载情况
药用辅料的定义和功能:
国际药用辅料销毁(IPEC)将辅料定义为药物制剂中经过合 国际药用辅料销毁(IPEC)将辅料定义为药物制剂中经过合 理的安全评价的不包括有效成分或前体的组分,它的作用 包括四个方面: (1)在药物制剂制备过程中有利于成品的加工; (2)提高药物的稳定性、生物利用度和病人的顺应性; (3)有助于从外观上鉴别药物制剂; (4)改善药物制剂早贮藏或应用时的安全性和有效性。
2010年版的三个品种存在的问题 2010年版的三个品种存在的问题
1、脆碎度; 2、色素; 3、油墨。
空心胶囊的生产工艺
制造 分选
配色
印字
溶胶
检验
原料检验
计数包装
空心胶囊的生产工艺
空心胶囊系由明胶为主要原料制成,呈圆筒 状,由帽和体两节套合而成的质硬而具有 弹性的空囊,具有不同的颜色和锁口,主 要用于盛装固体药物。本品分为不透明、 半透明、透明三种,囊体光洁、色泽均匀、 切口平整、无变形、无异臭。
第三、2010版 中国药典》 第三、2010版《中国药典》存疑与容易 产生歧义的问题
1.松紧度的检查 1.松紧度的检查 2.脆碎度 2.脆碎度 3.崩解时限 3.崩解时限
第四、2010版 中国药典》 第四、2010版《中国药典》实施对胶囊 行业的影响
1.对供需双方提供了合作的科学尺度 1.对供需双方提供了合作的科学尺度 2.从根本上保障胶囊品质的安全性 2.从根本上保障胶囊品质的安全性 3.既是机遇又是挑战 3.既是机遇又是挑战
2010年10月 2010版 中国药典》正式进入实施阶段, 2010年10月1日2010版《中国药典》正式进入实施阶段,必将 对胶囊行业产生积极而深远的影响。 对胶囊行业产生积极而深远的影响。
中国药典 2010年版二部附录ⅷ m第一法

我国药典(2010年版)作为我国的国家药典标准,是一部对于药物生产、质量控制和药物管理具有重要意义的规范性文件。
其中,附录ⅷm第一法是其中的一部分,本文将对该规范性文件进行分析和解读。
1. 附录ⅷ m第一法的概述附录ⅷ m第一法是我国药典 2010年版中的一部分,它主要涉及了一些药物的制备方法和相关技术要求。
该部分内容包括化学定量法、光度法、气相色谱法等内容,是药物质量标准的重要依据。
2. 化学定量法化学定量法是一种通过化学方法来测定物质含量的方法。
在药物制备与质量控制中,化学定量法是一种常用的技术手段。
附录ⅷ m第一法对于化学定量法的要求严格,要求实验条件和实验步骤必须符合规范,以确保药物含量的准确性和稳定性。
3. 光度法光度法是一种利用溶液对特定波长光线的吸收或透射来测定物质浓度的方法。
在药物质量控制中,光度法常被用于测定某些药物的浓度。
附录ⅷ m第一法对于光度法的要求包括了光路的校正、波长的选择、溶液的制备等,以确保测定结果的准确性。
4. 气相色谱法气相色谱法是一种通过气相色谱仪对物质进行分离和定量分析的方法。
在附录ⅷ m第一法中,对气相色谱法的要求更是严格,要求仪器的校准、色谱柱的选择、流动相和载气的纯度等各项细节。
5. 总结附录ⅷ m第一法作为我国药典 2010年版的一部分,涉及了对药物制备和质量控制中常用的化学分析技术的要求。
它的出现对于我国药物生产和管理具有重要的意义,可以有效提高药物的质量和安全性。
在日常工作中,药物生产企业和药物管理部门均应严格遵守附录ⅷ m第一法的要求,确保药物的质量符合国家标准。
6. 药物质量标准的重要性我国药典 2010年版附录ⅷ m第一法所规定的化学定量法、光度法、气相色谱法等分析技术要求,是保证药物质量的重要手段。
药物质量的好坏直接关系到患者的用药效果和安全性,因此质量标准的严格执行至关重要。
如果药物的成分含量测定不准确或者不稳定,就会导致药物治疗效果不佳或者产生不良反应,严重影响患者的健康。
《中国药典》2010年版(二部)

生化药品增修订情况
辅料增修订情况 执行日期等
6 3
7 3
各论的增修订情况
• 各论的增修订情况(1):名称与性状
• 各论的增修订情况(2):鉴别
• 各论的增修订情况(3):安全性检查
• 各论的增修订情况(4):有效性检查
• 各论的增修订情况(5):含量测定
各论的增修订情况(1):名称与性状
药品通用名称 (原料药)
主,部分制剂采用了红外光谱鉴别。根据辅料对样品提取结果的影响 不同,采用了全谱比较或限定特征波数两种方式。
各论的增修订情况(2):鉴别
化学反应
要选用反应明显、专属性较强的方法,且试剂易得、毒 性较低。毒性大的、放射性强的、有悖于环保的,删除。
例: 衍生化物熔点鉴别反应,删除。
例:异烟肼
如含挥发性有机溶剂且有机溶剂量明显影响含量结果时,也写明扣除,
(3)“按无水物与无溶剂物计算”,但所含挥发性有机溶剂如已包
括在干燥失重之内,则仅写明“按干燥品计算”而不再扣除溶剂。
各论的增修订情况(1):名称与性状
性状 (原料药)
色:样品的色泽应按照白色、类白色、微黄色、淡黄色、浅黄色、
黄色这样的顺序排列(以黄色举例),如果两个色阶相邻,可用 “或”来描述,如类白色或微黄色结晶性粉末。如果色阶之间相
凡例的增修订情况
各论的增修订情况 现代分析技术的应用
生化药品增修订情况
辅料增修订情况 执行日期等
6 3
7 3
凡例的增修订情况
• 2005年版
名称及编排,项目与要 求,检验方法和限度, 标准品、对照品,计量, 精确度,试剂、试液、 指示剂,动物实验,说
国家药典委关于《中国药典》2010年版第二增补本有关增修订内容的说明

国家药典委关于《中国药典》2010年版第二增补本有关增修订内容的说明2013年04月27日发布根据《药典委员会章程》和国家药品标准发展的要求,为适应药品研发、生产、检验、应用以及监督管理等方面的需要,国家药典委员会及时对国家药品标准进行增修订和订正,出版《中国药典》增补本。
增补本与现行版《中国药典》具有同等的法定地位。
自2010年10月1日《中国药典》2010年版执行以来,按照《中国药典》2015年版编制大纲所确定的内容,我委于2012年出版了第一增补本。
前一阶段我委经过广泛征求意见,进一步提出了增修订内容,通过药典委员会相关专业委员会审定并经网上公示,编制了《中国药典》2010年版第二增补本。
第二增补本共收载新增品种288个,修订或订正品种160个。
其中,一部新增75个(成方制剂75个),修订或订正102个(药材17个、成方制剂85个);二部新增210个(化学药204个、辅料6个),修订或订正42个(化学药37个、辅料5个);三部新增3个(预防类1个、治疗类2个),三部修订或订正16个(预防类11个、治疗类5个)。
对《中国药典》2010年版的附录也进行了增修订,其中一部增订5个、修订或订正9个;二部增订5个、修订或订正6个;三部增订3个、修订或订正2个。
其中,中药材及饮片二氧化硫残留量限度标准已收载进第二增补本(有关情况说明见附件)。
第二增补本的修订内容采用全文刊载方式,变动部分辅以“■■”标记,并分别以[修订]、[订正]、[增订]和[删除]予以标识,以利于广大药学工作者及时掌握标准修订内容和方便使用。
目前我委已将第二增补本定稿及颁布请示上报至国家食品药品监督管理总局进行批准颁布工作,预计六月底前完成出版印刷工作。
第二增补本将按照国家食品药品监督管理总局有关公告明确的执行日期开始实施,请相关单位和药品企业积极做好执行第二增补本标准有关准备工作。
附件:国家药典委关于《中国药典》2010年版第二增补本收载中药材及饮片二氧化硫残留限量有关情况的说明近年来,随着中药质量控制水平的提高和科研工作的发展,国家药典委员会在不断提升药品标准的同时,加强中药材及饮片中具有潜在风险的残留物质的控制。
2010版中国药典解析

《中国药典》发展与展望
中国药典2010版概况
收载品种有大幅度增加
在坚持“科学、实用、规范”、质量可控性和标准先进性的原 则下,新版药典积极扩大收载品种,力求覆盖国家基本药物目录品 种的需要,并扩大了中药饮片和常用辅料的收载。对于多年无生产、 临床不良反应多,标准不完善的药品,加大调整力度。
2005版收载 3217 新增品种 1386(43%) 修订品种 2237(70%) 未收载 36 2010版收载 4567
2010版药药典二部化药增收15.4%,辅料增收86%
2005版收载 1970
其中(辅料) 72
新增品种 330
62
ห้องสมุดไป่ตู้
修订品种 1500
52
2010版收载 2271
132
《中国药典》发展与展望
2010版药药典三部(生物制品)增收29.7%
类别 预防类 制品 病毒 细菌 生物技术产品 治疗类 制品 血液制品 微生态活菌制品 抗毒素 收载总数 27 21 35 17 1 18 71 10 61 新增 修订
中国药典发展展望
坚持标准先进性,但必须兼顾国情、药情,不盲目追求不切合实际的 “高、精、尖”技术,引导和支持国产仪器的应用和发展; 推行规范的科研项目招标制度,加强管理与考核。多做雪中送炭,免 搞锦上添花,好钢用在刀刃上。 拟推行承担中国药典科研任务单位的资质评估、认证机制,药检所主 要承担复核验证工作; 药典科研工作进一步向高校、科研机构及有科研实力、重视标准工作 的企业开放; 加强中国药典的宣传、技术培训及执行监督,扩大社会影响力,提升 中国药典的作用和地位; 加强药品标准法规建设,规范和约束标准工作,维护法定药品标准的 权威性; 广泛加强国际间药典方面的交流与合作。
中国药典2010年版二部解析

附录IX 附录 C 不溶性微粒检查法
应用对象:静脉用注射剂(溶液型、注射用无菌 粉末、注射用浓溶液)及静脉注射用无菌原料药 【原:溶液型静脉用注射剂】{应用范围扩大} { } 光阻法仪器一般要求:测量粒径范围为“2~ 100µm”,检测微粒浓度为“0~10000个/ml” 【原:测量粒径范围为“2~50µm”,检测微 粒浓度为“0~5000个/ml”】
附录I 附录 A 片剂
分散均匀性(取供试品6片,置250ml烧杯中,加 15-25℃的水100ml,振摇3分钟,应全部崩解并通 过二号筛)【原:取供试品2片,置20℃±1℃的水 100ml中,振摇3分钟,应全部崩解并通过二号筛】 {明确操作细则,放宽不必要的温度控制,与实际情 况接近} 控释片是指在规定介质中缓慢地恒速释放药物的片 剂【原:在水中或规定介质中缓慢地恒速或接近恒 速释放】{严格要求} 删除“必要时,薄膜包衣片应检查残留溶剂”{实质 上是必须检}
附录V 附录 B 薄层色谱法
除另有规定外,比移值(Rf)应在0.2-0.8之间 高效薄层板粒径一般为5-7um{采购} 显色剂为“适宜溶剂”【原为“碘蒸汽”】 杂质检查方法选择:可采用供试品以适当降解方 法获得溶液来显示斑点{新技术要求}
附录V 附录 D 高效液相色谱法
除另有规定外,普通分析柱的填充剂粒径一般在310um之间,粒径更小(约2um)的填充剂常用于填 装微径柱(内径约2mm){超高效液相UPLC} 硅胶为载体的键合固定相使用温度通常不超过40℃, 最高不宜超过60℃。{XBridge TM} 流动相:反相首选甲醇-水系统(紫外末端吸收首选 乙腈-水系统),少用含缓冲液或降低缓冲液浓度 禁止改变:固定相种类、流动相组分、检测器类型 (对方法的耐用性要求增加)
附录VIII H 附录 重金属检查法
《中国药典》2010年版(二部)

《中国药典》2010年版(二部)概况河北省药品检验所2010年11月石家庄主要内容O 总体情况凡例的增修订情况© 各论的增修订情况举例附录增修订情况◎ y药典(药品标准)一点个人体含10年版与05年版二部增修订情况比较表10版二部各类品种的增修订情况标准中有较大变化的部分制剂品种(1)(主要是有关物质、含量测定项目)-乙酰半胱氨酸颗粒,乙酰哇胺片,二轻丙茶殓片、注射液,己烯雌酚注射液,己酮可可殓注射液,马来酸氯苯那敏注射液、片、滴丸,五氟利多片,贝诺酯片,牛磺酸颗粒,双氯芬酸钠肠溶片,双喀达莫片、注射液,丙戊酸钠片,甘露醇注射液,左氧氟沙星片,布美他尼注射液、片,丙谷氨片、胶囊,布洛芬片、胶囊,扑米酮片,标准中有较大变化的部分制剂品种(2)•卡马西平片、胶囊,卡托普利片,卡维地洛片、胶囊,甲芬那酸片、胶囊,甲氧氯普胺片,盐酸甲氧氯普胺注射液,甲氧节旋注射液,甲硝哇片、泡腾片、栓、胶囊、注射液,甲磺酸培氟沙星片、胶囊,甲磺酸酚妥拉明注射液,司坦哇醇片,尼莫地平片、分散片、胶囊,尼可刹米注射液,标准中有较大变化的部分制剂品种(3)•尼美舒利片,尼索地平片,对乙酰氨基酚片、胶囊、注射液,地高辛片,地西泮片, 达那异烟耕片、粉针,地塞米松磷酸钠注射液,西米替丁氯化钠注射液,达非哇胶囊,曲安奈德注射液,肌昔葡萄糖注射液,注射用肌昔,米非司酮片,安乃近片,异戊巴比妥片,异烟耕片,芬布芬片、胶囊,克霉哇乳膏、药膜、栓,咲喃妥因肠溶片,标准中有较大变化的部分制剂品种(4)-咲廛米注射液,毗哌酸胶囊、片,口引喙美辛肠溶片、乳膏,利福平注射液,谷氨酸钾注射液,泛酸钙片,阿司匹林肠溶片,阿普噪仑片,环扁桃酯胶囊,苯巴比妥钠片,注射用苯妥英钠,非诺贝特片、胶囊, 罗通定片,洛莫司汀胶囊,辛伐他汀片、胶囊,非诺贝特胶囊,标准中有较大变化的部分制剂品种(5) •复方十一烯酸复方磺胺唏喘片,盐酸依诺沙星片、胶苯海明片,苯殓缓释片,枸橡酸他莫昔芬片,枸椽酸芬太尼注射液,枸椽酸喷托维林片,氟康哇氯化钠注射液,氢化可的松注射液,氢氯廛嗪片,氢漠酸东萇君殓注射液,重酒石酸间轻胺注射液,复方卡托普利片,复方克霉噪乳膏,复方盐酸阿米洛利片,复方磺胺甲噁哇注射液,标准中有较大变化的部分制剂品种(6)•胆苯殓片,美洛昔康片、分散片、胶囊,洛莫司汀胶囊,盐酸乙胺丁醇片,枸椽酸喷托维林片,氢化可的松注射液,氢氟廛嗪片,氢漠酸东芨蓉殓片、注射液,水仙殓片,复方甘草片,复方卡托普利片,复方甲苯咪哇片,复方克霉哇乳膏,复方莪术油栓,复方铝酸钮胶囊、片,标准中有较大变化的部分制剂品种(7)•度米芬滴丸,盐酸马普替林片,盐酸布比卡因注射液,注射用盐酸甲氯芬酯,盐酸尼卡地平片,盐酸地芬尼多片,盐酸多巴胺注射液,盐酸多巴芬丁胺注射液,盐酸多塞平片,盐酸异丙肾上腺素注射液,盐酸异丙嗪片、注射液,盐酸利多卡因胶浆, 盐酸妥拉噪林片、注射液,盐酸阿米替林片,盐酸苯乙双肌片,盐酸苯海索片,盐酸奈福泮片、注射液,标准中有较大变化的部分制剂品种(8)•盐酸罗通定片,盐酸哌哇嗪片,盐酸哌替喘片、注射液,盐酸氟奋乃近片、注射液, 盐酸美沙酮片、注射液,盐酸倍他司汀片, 盐酸胺碘酮片、注射液、胶囊,盐酸麻黄碱注射液、滴鼻液,盐酸维拉帕米缓释片, 盐酸氯西那林片,盐酸氯米帕明片,盐酸氯胺酮注射液,盐酸普鲁卡因注射液,标准中有较大变化的部分制剂品种(9)•盐酸雷尼替丁注射液,盐酸漠己新片,格列齐特片(II),核黄素磷酸钠注射液,盐酸丁丙诺啡注射液,盐酸己氟拉嗪片,盐酸去氯轻嗪片,盐酸左氧氟沙星片、胶囊,盐酸布桂嗪片、注射液,盐酸甲氧明注射液,盐酸甲氯芬酯胶囊,盐酸曲吗多胶囊,盐酸伐昔洛韦片、胶囊,标准中有较大变化的部分制剂品种(10)•盐酸多沙普仑注射液,盐酸安他噪林片,盐酸利多卡因注射液,盐酸环丙沙星片、胶囊.滴眼液,盐酸帕罗西汀片,盐酸美西律注射液,盐酸莫雷西嗪帕酮注射液,氧氟沙星片、胶囊、滴眼液, 氨甲环酸片、注射液,烟酸占替诺注射液, 酒石酸美托洛米片、注射液、胶囊,标准中有较大变化的部分制剂品种(11)•盐酸消旋山萇蓉殓注射液,诺氟沙星软膏、滴眼剂,蔡普生片、栓、胶囊、颗粒,咖片,径基眼片,维A酸片,维生素B1片、注射液,维生素C 注射液(草酸检査),维生素E软胶囊,维生素K1注射液,联磺甲氧节旋片,葡萄糖酸亚铁片.胶囊、糖浆,硝西泮片,硝苯地平片、胶囊,标准中有较大变化的部分制剂品种(12)•硝酸甘油片、注射液,硝酸异山梨酯乳膏, 硝酸益康乳膏、栓、喷雾剂、溶液,硫酸亚铁片,氯硝西泮片、注射液,氯氮平片,氯氮片,氯磺径哇乳膏,奥沙西泮酮洛芬肠溶胶囊,酮康噪片、片* 9 bn m乳膏、胶囊,标准中有较大变化的部分制剂品种(13)•澳丙胺太林片,熊去氯胆酸片,醋酸甲径孕酮片,醋酸地塞米松片,醋酸曲安奈德注射液,磺胺咳呢片、混悬液,磷酸川茸嗪片、胶囊、注射液,磷酸可待因片,磷酸苯丙哌林颗粒、片、胶囊,磷酸氯唾片、注射液,螺内酯片、胶囊。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
涂家生,中国药科大学教授国家药典委员会委员国家药品审评中心专家2010.5中国药典附录《药用辅料》的解析主要内容前言2010年版中国药典收载药用辅料的过程展望1234我国药用辅料现状一、前言药用辅料也称为赋形剂,诚如药物离不开剂型,制剂同样离不开辅料。
目前,药物制剂正向以“定时、定量、定位”为目标的给药系统发展,新型给药系统的产生、发展、成熟无不与新型辅料的出现有关。
1、目前我国药用辅料的来源、生产、质量尚存在管理不理想的状况,药用辅料的质量影响和制约了我国制剂的水平。
2、另一方面,尽管辅料被认为应该生理惰性、化学惰性,但有很多药物不良事件是与药用辅料有关的,例如1930年的磺胺酏剂事件和我国广东去年的“齐二药”事件,皆因利益驱使假冒辅料(economic-motivated adulteration, EMA )二甘醇导致。
3、很多辅料具有生物活性,或会改变药物的作用,例如三聚氰胺等。
据不完全统计,我国制剂使用的药用辅料大约543种,但具有药用质量标准的占少数,尤其在药典中收载较少,表1为我国药用辅料的质量标准统计情况。
表1 我国药用辅料的质量标准统计情况标准品种数占总数的比例药典标准(2010年版)13224.31%部颁标准33 6.1%地方标准31 5.7%USP和EP标准27 5.0%国标、化工和企业标准34162.8%总计543可以看出,我国药用辅料质量标准符合药用标准的为少数,尤其收载于药典的仅为少数。
其它标准的材料作药用辅料的现象严重。
与之不同的是,美国大约有1500种辅料,大约50%已经收载于USP/NF,欧洲有药用辅料约3000种,在各种药典中收载也已经达到50%。
因此,加大药用辅料收载于中国药典具有重要意义。
国际上药用辅料的管理•防止EMA,确保供应链的安全:加强各国协调,防止跨国伪劣辅料的流入;加强药用辅料生产的自律(IPEC呼吁会员实行GMP );加强销售的管理(COA、GDP);加强用户审计。
•新辅料、注射用辅料实行注册管理•已有辅料DMF管理•质量标准加强安全性和功能性指标的设置为提高顺应性,儿童用药需更多辅料:矫味剂、口感改善(爽滑)、口崩片(针对吞咽困难)、体积应小、剂量应易于调整、防腐剂的问题儿童用制剂辅料的安全性应引起关注儿童用辅料常见问题•丙二醇、甘油造假•乙醇使用:6岁以下儿童<0.5% ;6-12岁<5% ;大于12岁儿童<10%•花生油毒性:过敏,谨慎使用•糖精:禁用(后味不佳、过敏、肝肾毒性等)•阿斯巴甜:慎用,可导致苯丙酮酸尿症、过敏•山梨醇:可致腹泻•乳糖:乳糖分解酶缺乏的患儿禁用•色素滥用:合成色素很多有毒,慎选•防腐剂超量中国药典2010年版有关药用辅料的修、增订目标、原则•目标:附录中增加药用辅料章节(以指导药用辅料的生产、应用、管理),正文增加药用辅料的收载(收载常用辅料)•品种收载原则:国内有生产和药用注册批文,有使用;国内有生产、应用,无注册批文,有国家标准、化工标准、食品标准,外药典收载;外药典收载,国内应用前景大的新辅料;等2010年版中国药典收载药用辅料的过程200多个候选品种药检所对其标准进行梳理、起草、复核召开专家会议,对上报品种逐一审评根据生产、使用、质量的成熟情况新增近40个品种收载这样2010年版药典共收载132个药用辅料!药用辅料具有一定的统一要求,因此,在发达国家的药典中有药用辅料通则,针对2005年版及之前中国药典缺乏药用辅料的通则,2010年版组织了药用辅料通则的增订工作,但因为第一次出现,暂定作为附录的一个章节,在适当时候修订后作为通则。
2010年版中国药典中药用辅料正文尽可能增加了对辅料来源的叙述,对杂质的要求有所提高。
三、中国药典附录《药用辅料》解析2010年版中国药典首次在附录收载了药用辅料,和制药用水一样成为独立的章节,该增订符合国际发达国家药典的体例。
药用辅料的概念药用辅料系指生产药品和调配处方时使用的赋形剂和附加剂;是除活性成分以外,在安全性方面已进行了合理的评估,并且包含在药物制剂中的物质。
药用辅料除了赋形、充当载体、提高稳定性外,还具有增溶、助溶、缓控释等重要功能,是可能会影响到药品的质量、安全性和有效性的重要成分。
药用辅料在《药品管理法》中的定义:除了主要药物活性成分以外一切物料的总称,是药物制剂的重要组成成分。
国际药用辅料协会(IPEC)将辅料定义:药物制剂中经过合理的安全评价的不包括有效成分或前体的组分,它的作用包括:在药物制剂制备过程中有利于成品的加工;提高药物制剂的稳定性,生物利用度和病人的顺应性;有助于从外观上鉴别药物制剂;改善药物制剂在贮藏或应用时的安全性和有效性。
“辅料”一词的来源辅料这个词汇来自于拉丁语excipiens,是动词excipere的现在分词,意为接受,结合,去除。
在1957年,辅料被定义为“一种用作给药媒介的物质”,这说明辅料的作用仅仅是主药的一种惰性载体。
在1974年,辅料被形容为“任何为了使药物达到合适的强度或形状而添加进入处方的惰性物质:一种载体”。
1994年美国药典定义辅料是除有效成分外所有有意加入的成分,或者说是处方中除有效成分外的所有物质。
副词“有意地”说明了辅料在现代药物剂型中必须起着多重作用,这些作用包括了保证药物稳定性、剂量的准确性、提高感官特性和病人顺应性等。
现代制剂技术要求研究制剂中辅料的物理状态,以便药物生产和控制药品质量、保证药物生物利用度、提高药效和对药物的耐受限度。
Technology 作为必需的赋形剂作为附加剂或填充剂药用辅料的作用例如片剂的粘合剂,乳剂的乳化剂,混悬剂的助悬剂,脂质体的磷脂,气雾剂的抛射剂等等,在药物制剂中是必需的,其在制剂中的存在是不可或缺的。
原则上不改变药物剂型的性能,可以选择的余地较大,但要充分考虑填充剂对药物的影响,例如,乳糖是一个常用的填充剂,在片剂(特别可溶片中应用广泛,但糖类特别是乳糖、甘露醇可以和伯氨药物发生Millard 反应,导致药物降解、变色),可以采用其他填充剂如甘露醇、微晶纤维素等替代;另外,着色剂作为旨在改善患者的顺应性的物质,在很多剂型中有广泛应用,同样一种颜色,可以采用天然色素、合成色素等,应根据用途选择色素。
例1:包衣的选择和材料的应用•药物制剂包衣:糖衣、薄膜衣(有机溶剂和水分散)、压制包衣糖衣6. Printing5. Polishing 4. Colouring3. Smoothing2. Sub coating1. Seal tablet core•传统包衣,逐渐被取代:使用的辅料蔗糖、滑石粉、石蜡等。
.薄膜包衣•科学:安全、有效、功能强大。
可用于片剂、胶囊、颗粒、微粉等。
•功能:隔离、定位释药•包衣材料:聚合物(如隔离衣HPMC;丙烯酸树脂可以用于胃溶、肠溶;缓释包衣可以选择乙基纤维素、醋酸纤维素等等)、溶剂(水、有机溶剂)、增塑剂(如DEP、三醋酯等)、致孔剂、遮光剂(二氧化钛)、着色剂(如氧化铁色素和铝色素)等薄膜衣应注意的问题•1、有机溶剂:如使用,必须检查残留。
生产应注意防火、防爆和劳动保护。
•2、聚合物和增塑剂:应注意有毒相关物质,如聚合物单体、以PEG为增塑剂时注意残留DEG等•3、老化:研究不同的增塑条件下老化的条件药用辅料对药物有效性、安全性的影响药用辅料可以影响药物的药效,例如,采用水溶性药用辅料聚乙二醇6000与灰黄霉素制备的固体分散体可以显著提高灰黄霉素的生物利用度和提高疗效。
同样,药用辅料还可以改变药物的安全性,例如紫杉醇是一种重要的抗癌药,其注射剂含增溶剂聚氧乙烯蓖麻油,该表面活性剂可以通过增溶提高紫杉醇的溶解度,但也极大增加了药品的过敏性。
因此,药用辅料的选择应充分考虑药品的安全性和有效性。
药用辅料的安全性不仅来自其本身,还可能来自其供应链。
以利益驱动的增加(Economic-motivated adulteration, EMA)已经威胁药用辅料安全性,较为典型的是二甘醇假冒甘油、丙二醇、聚乙二醇引发的多国药物事件(表2)。
表2 二甘醇(DEG)引发的药物(食物)事件国家年事件美国1937磺胺酏剂–107人死亡南非1969用DEG调配镇静药–7人死亡意大利1985用DEG调配从澳大利亚的酒–死亡数不详印度1986用DEG勾兑药用甘油–14人死亡尼日利亚1990扑热息痛糖浆含DEG–40至200人死亡孟加拉国1990-2扑热息痛糖浆含DEG–339人死亡海地1995/6镇咳药含DEG–85人死亡中国2005齐二药事件–7人死亡巴拿马2006镇咳药和抗过敏糖浆含–46至365人死亡美国2006/7牙膏含DEG–未报道死亡巴拿马2007牙膏含DEG–未报道死亡尼日利亚2008/9牙科药中的丙二醇受DEG污染–84人死亡例2 以环氧乙烷为起始原料的药用辅料•1、包括多种溶剂(如乙二醇、甘油、PEG )、表面活性剂(如吐温、司盘系列)•2、使用范围广、用量大•3、应关注EMA, DEG残留等例3:聚山梨酯80:四国药典质量标准和2010年版标准的比较检测项目CP2005 USP EP JP 拟定标准性状+ + + + +相对密度 1.06~1.09 1.06~1.09 1.10 1.065~1.0951.06~1.09黏度350~550mm2/s300~500mm2/s≈400mP a.S345~445mm2/s350~550mm2/s酸值≤2.2 ≤2.2 ≤2.0 ≤2.0 ≤2.2 皂化值45~60 45~55 45~55 45~55 45~60 羟值65~80 65~80 65~80 -65~80 碘值18~24 --19~24 18~24 过氧化值--≤10 -≤10一般鉴别 + + + + + 鉴别红外光谱 - - + - + 酸碱度 5.0~8.0 - - 5.5~7.5 5.5~8.0 颜色 + - - - + 冻结试验+ - - - + 水分 ≤3.0% ≤3.0% ≤3.0% ≤3.0% ≤3.0% 炽灼残渣 ≤0.2% ≤0.25% ≤0.25% ≤0.15% ≤0.2% 重金属 ≤0.001%≤0.001%≤10ppm ≤20ppm ≤0.001% 砷盐 - - - ≤2ppm ≤2ppm 环氧乙烷 - - ≤1ppm - ≤1ppm 二氧六环 - - ≤10ppm- ≤10ppm 检查游离脂肪酸--+--关注点:•1、未收录供注射用标准;•2、对安全性要求更高:环氧乙烷、二氧六环等•3、存在改进:游离脂肪酸、脂肪酸组成•4、注射用:增加细菌内毒素和无菌药用辅料对药物稳定性的影响一般来说药物经包合,由于隔离了水分、氧气、光线,其稳定性可以得到提高。
