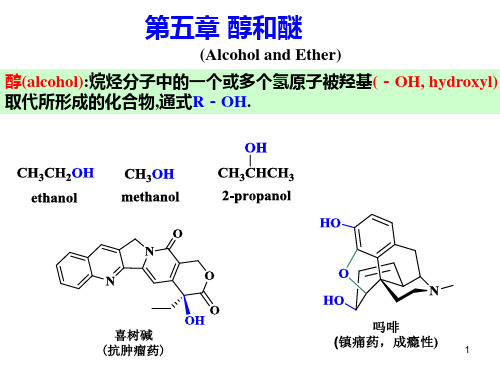
醇 和 醚(3)
大学化学《有机化学-醇和醚》课件

稀酸,反应条件温和, 不饱和键不受影响
反应式
ROH + HX 醇的活性比较: 苯甲型, 烯丙型 > 3oROH > 2oROH > 1oROH > CH3OH HX的活性比较: HI > HBr > HCl RX + H2O
浓盐酸和无水氯化锌的混合物称为卢卡斯试剂。
用卢卡斯试剂可鉴别六碳和六碳以下的一级、二级、三级醇。
将三种醇分别加入盛有卢卡斯试剂的试管中,经振荡后可发现: 三级醇立刻反应(烯丙型及苯甲型的醇也可以很快地发生反 应),生成油状氯代烷,它不溶于酸中,溶液呈混浊后分两层, 反应放热;
H3C CH3 + Br- + C O P Br Br H CH3
Br (CH3)3C OH + Br P Br
SN2
SN1
(CH3)3C+ + HOPBr2
Br -
(CH3)3CBr
10.6.3 与亚硫酰氯反应 (1) 反应方程式
ROH + SOCl2
b.p. 79oC
RCl + SO2
+ HCl
酸性条件
醇各类氧化反应的总结-2
氧化剂 新制 MnO2*1 沙瑞特试剂 CrO3吡啶 一级醇 醛 醛 二级醇 三级醇 酮 酮 特点和说明 中性 不饱和键不受影响 弱碱,反应条件温和, 不饱和键不受影响。
琼斯试剂
CrO3+稀H2SO4 费兹纳-莫发特试剂
醛(产率不高, 不用。)
醛(产率很高)
酮 酮
乙二醇二硝酸酯
2 磷酸酯的制备
3C4H9OH +
Cl Cl Cl P=O
C4H9O C4H9O C4H9O
鉴别醇和醚的化学方法

鉴别醇和醚的化学方法
鉴别醇和醚的常用化学方法有以下几种:
1. 酸碱反应法:将待鉴别化合物加入一定量的酸性或碱性溶液中,若产生气泡,则表明化合物中含有醇;若无反应,则可能为醚。
2. Lucas试剂法:向待鉴别化合物中加入Lucas试剂(浓盐酸和氯化亚铁的混合物),加热后若形成浑浊的混合物,则表明化合物中含有1、2或3度醇;若产生无色液体,则表明化合物为醚。
3. 碘液试验法:向待鉴别化合物中加入碘液(碘化钠溶液),若产生黄色颜色,则表明化合物中可能含有醇;若无反应,则可能为醚。
4. 嗅觉法:由于醇具有刺鼻的气味,而醚则无气味或轻微芳香味,因此可以通过嗅觉进行初步区分。
需要注意的是,使用化学方法进行鉴别时应注意条件的选择和控制,方法操作的正确性和准确性。
同时,这些方法虽然可以用来进行初步的区分,但不能确定化合物的具体结构和成分等信息,需要结合其他分析方法进行综合分析。
第九章 醇和醚

反应可逆,需采用一定措施以利于正向进行。
各类醇的鉴别-卢卡斯试剂
用浓盐酸与ZnCl2配置的溶液-卢卡斯(Lucas)试剂与各类醇 反应的活性如下:
叔醇
(CH3)3C-OH
ZnCl2-HCl
20oC,1min
ZnCl2-HCl
(CH3)3C-Cl + H2O
仲醇 (CH3)2CH-OH 20oC,10min (CH3)2CH-Cl + H2O 伯醇 CH3(CH2)3-OH
HO-(CH2)10-OH
O2N
-CH2OH
O CH3 CH3 OH ① LiAlH4,干醚 CH3C=CHCH2CH2CCH3 CH3C=CHCH2CH2CHCH3
② H2O
CH3CH=CHCHO 巴豆醛
Al[OCH(CH3)2]3 (CH3)2CHOH
CH3CH=CHCH2-OH 巴豆醇 -CH=CHCH2OH
C-H 0.110nm
O-H 0.096nm C-O 0.143nm
∠HCH=109◦
∠HCO=110◦ ∠COH=109◦
2、醇的分类
根据羟基所连的C的性质分为伯醇、仲醇、叔醇。 称为一级醇,二级醇…..,分别记为1°,2°,3°等。 如: RCH2OH R2CHOH R3COH
根据R的性质分为饱和醇、不饱和醇和芳香醇,如: CH3CH2CH2OH
CH2=CH-CH2OH
Ph-CH2OH
根据分子中含羟基的数目分为一元醇、二元醇和多 元醇。如:
CH3CH2OH CH2-CH2 OH OH CH2-CH-CH2 OH OH OH
一个碳原子上有两个或两个以上羟基就不稳定, 容易分子内脱水形成羰基。
3、醇的异构和命名
有机化学中的醇和醚

有机化学中的醇和醚醇和醚是有机化合物中常见的两类化合物,它们在化学性质和应用领域上具有一定的相似性和差别。
本文将对有机化学中的醇和醚进行详细的介绍和分析。
一、醇的概念和性质1.概念:醇是由一个或多个羟基(OH)取代碳原子而形成的有机化合物,通式一般为ROH,其中R代表烷基或芳基。
2.性质:醇具有以下几个特点:(1)醇分子中的羟基具有极性,导致醇具有较高的沸点、溶解度和比热容,同时也使醇能够与水分子形成氢键。
(2)醇可以和酸反应,形成醚、酯等化合物,这是醇的一个重要反应。
(3)醇可以进行氧化反应,形成醛、酮等化合物,这是醇的另一个重要反应。
二、醇的命名和分类1.命名:醇的命名遵循系统命名法,以确定主链和羟基的位置、取代基和官能团等因素,例如乙醇、异丙醇等。
2.分类:醇可以根据羟基所连接的碳原子个数进行分类,分为一元醇、二元醇等。
三、醇在有机合成中的应用1.醇的还原性:由于醇分子中含有极易离去的羟基,醇具有还原性,可以被氢化剂还原为饱和烃。
这一性质使得醇成为重要的还原试剂,在有机合成中用于还原醛、酮等化合物。
2.醇的亲核性:醇分子中的羟基具有较强的亲核性,可以与酰卤、烯烃等电子不足的化合物发生亲核取代反应,形成醚、酯等化合物。
这一反应在有机合成中十分常见。
3.醇的氧化性:醇可以通过氧化反应被氧化剂氧化为醛、酮等化合物,这一反应常用于有机合成中的氧化反应。
四、醚的概念和性质1.概念:醚是由两个有机基通过氧原子连接而成的化合物,通式一般为R-O-R'。
2.性质:醚具有以下特点:(1)醚是较稳定的化合物,具有较低的沸点和溶解度。
(2)醚分子中的氧原子不带电荷,因此醚没有和水分子形成氢键的能力。
(3)醚可以被酸催化下的水解反应,将醚分解为两个醇。
五、醚的命名和分类1.命名:醚的命名同样遵循系统命名法,以确定两个有机基的结构和官能团等因素,例如乙醚、二甲醚等。
2.分类:醚可以根据氧原子所连接的碳原子个数进行分类,分为二元醚、三元醚等。
醇和醚的沸点

醇和醚的沸点醇和醚是常见的有机化合物,它们的沸点是两种不同的物理性质。
本文将详细介绍醇和醚的沸点。
一、醇的沸点醇是一种含有羟基(-OH)官能团的有机化合物。
由于羟基与碳原子之间存在氢键,因此醇分子之间的相互作用力比较强,导致其沸点比相同分子量的烃要高。
另外,随着碳链长度增加,分子量也随之增加,因此其沸点也会随之升高。
例如,甲醇(CH3OH)和乙醇(C2H5OH)是两种常见的低级别醇。
甲醇的分子量为32.04 g/mol,其沸点为64.7℃;而乙醇的分子量为46.07 g/mol,其沸点为78.4℃。
可以看出,乙醇比甲醇分子大,因此其相互作用力更强,在室温下不易挥发。
二、醚的沸点与醛和羧酸等其他含氧官能团的有机化合物不同,由于缺少了氢键作用力,因此醚分子之间的相互作用力比较弱,导致其沸点比相同分子量的醇要低。
例如,二甲醚(CH3OCH3)和二乙醚(C2H5OC2H5)是两种常见的低级别醚。
二甲醚的分子量为46.07 g/mol,其沸点为-24.8℃;而二乙醚的分子量为74.12 g/mol,其沸点为34.6℃。
可以看出,由于缺少了氢键作用力,醚分子更容易挥发,在室温下就可以达到液态。
三、总结综上所述,由于醇和醚之间相互作用力不同,因此其沸点也有很大差异。
在实际应用中,我们可以利用这种差异来进行物质的分离和提纯等操作。
例如,在石油化工行业中,我们可以通过蒸馏等方法将原油中含有的不同碳链长度的烷烃、烯烃、芳香烃、酮类、羧酸等物质进行分离提纯。
总体来说,在化学领域中对于不同物质性质的认识是非常重要的。
对于有机化合物而言,了解其沸点等物理性质可以帮助我们更好地理解其分子结构和相互作用力,为后续的实验研究提供有力的支持。
第十章_醇和醚 共102页PPT资料

C H 3 C H 2 C H O H
b. 一取代环氧乙烷与格氏试剂反应
O M g B r + C H 3C H C H 2E t 2 O
O M g B r C H 2 C H C H 3H H 2 O +
在格氏试剂烃基上一次增加两个以上碳原子。
O H C H 2 C H C H 3
( 3 ) 制 3o 醇
C H 3 C (C H 3 )= C H C H 2 C H 2 O H
C H 3 C C C H O H C H 3
二、醇的物理性质
1、分子间氢键
R
O HH H
O R
醇与水分
R
子间也能
形成氢键
O
氢键20kJ/mol
2.沸点
1)比相应的烷烃的沸点高100~120℃(形成分子间氢 键的原因), 如乙烷的沸点为-88.6℃,而乙醇的 沸点为78.3℃。
在格氏试剂烃基上一次增加两个碳原子
(2)制 2°醇 (格氏试剂与醛反应)
O
R '
R '
a .R M g X + R '- C -H 无 水 乙 醚 R -C H -O M g X H H 2 O + R C H O H
C H 2 M g C l+ C H 3 C H O 无 水 乙 醚
H + H l
C H 3
SN2机理(直链伯醇):
X+R - O H 2
X R O H 2
X - R + H 2 O
H3C
CH3 C CHCH3 H+ H OH ZnCl2/HCl
H3C
CH3 C CHCH3 H
徐寿昌《有机化学》 课件 第十章 醇、醚

R CH CH R' OH OH
+
Pb(OAc)4
RCHO
+
R'CHO
+ Pb(OAc)2 +
HOAc
这个反应常定量完成,因此可用于乙二醇的定量测定,并可根 据氧化产物推断原醇的结构。 7、邻二醇的重排反应—频哪醇重排
CH3 CH 3 H3C C C CH3
H2SO4 (HCI)
△
CH3 H3C C O C CH3 CH3
M= b.p=
74 117.2
OH OH
频哪醇
频哪酮
CH3 CH3 H3C C C CH3
H2SO4
CH3 CH3 H3C C C CH3
+
OH OH CH3 CH 3 H3C C OH C
OH OH2
CH3 H3C C C CH3
-H
+
CH3 H3C C O C CH3 CH3
+CH3O Nhomakorabea CH3
第二节 醚(ethers)
325℃
5、与酸反应——酯化
醇可与有机酸、无机酸作用生成酯。
O H3C C OH + H
O
O CH2
H+ CH3
△
CH3 C O CH2 CH3
发生酯化反应时,羧酸的C – O键断裂,醇的O – H键断 裂。 CH3 – OH + H2SO4 (CH3)2SO4(硫酸二甲酯)
硫酸二甲酯剧毒,对皮肤的阀限值1ppm,空气中最 高限量5mg/m3。
CH3CH2Cl + H2O
通常用无水氯化锌与浓盐酸按1:1的比例配成溶液与醇反 应, 代替不易操作的氯化氢气体,这样的溶液称为卢卡斯 (Lucas)试剂。结构不同的醇与卢卡斯试剂反应的活性顺序 为:
醇与醚的合成与应用

醇与醚的合成与应用醇和醚是有机化学中常见的化合物,它们在生活和工业中有着广泛的应用。
本文将介绍醇和醚的合成方法以及其在各个领域中的应用。
一、醇的合成与应用1. 醇的合成方法醇的合成主要有以下几种方法:(1)醇的氢化:通过将醛、酮或酸等有氧基官能团还原为醇,常用还原剂有氢气/催化剂或金属碱金属醇。
(2)格氏试剂反应:将酰氯与铝醇反应得到酯,再经水解制备醇。
(3)溴代反应:利用亲电试剂溴代醇基或醚基。
(4)格氏反应:利用醇和酸进行酯交换反应,生成醇。
(5)卡宾重排反应:以环丁烷二酮为例,发生负离子卡宾重排,生成二甲基二氧杂环丁烷。
(6)格氏试剂与醛酮的反应,生成复杂的含氧杂环,再经水解获得醇。
2. 醇的应用醇在生活和工业中有着广泛的应用:(1)醇常被用于制药工业,作为溶剂和反应物。
(2)醇可用作燃料和燃料添加剂。
(3)甘露醇等某些醇类物质可用作食品添加剂,具有甜味。
(4)丙二醇可用于制备聚醚、聚酯等聚合物,用于制作塑料和纤维。
(5)醇具有良好的溶解性和挥发性,可用作清洁剂和溶剂。
二、醚的合成与应用1. 醚的合成方法醚的合成主要有以下几种方法:(1)Williamson合成:通过醇和卤代烷反应生成醚。
(2)Alkoxy化反应:利用溴代烷与金属醇反应,生成醚。
(3)重排反应:例如华格纳重排、负离子分子重排等。
2. 醚的应用醚在生活和工业中也有广泛的应用:(1)作为有机溶剂,醚具有较低的沸点和良好的挥发性,常被用作涂料和油漆中的溶剂。
(2)醚可用作燃料和燃料添加剂。
(3)醚可用作抗心律失常药物和全身麻醉药物的成分。
(4)醚可用作润滑剂和冷却剂。
(5)醚还可用作合成高分子材料的起始物料,如聚醚、聚酯等。
总结:醇和醚是有机化学中常见的化合物,在生活和工业中有着广泛的应用。
醇的合成可通过氢化、格氏试剂反应、溴代反应等方法实现,应用领域涵盖制药工业、燃料、食品添加剂、塑料等。
醚的合成则可通过Williamson合成、Alkoxy化反应、重排反应等方法实现,应用领域包括有机溶剂、药物、润滑剂等。
有机化学中的醇与醚的合成

有机化学中的醇与醚的合成有机化学作为化学的一个重要分支,研究的是碳氢化合物及其衍生物的结构、性质和反应。
其中,醇和醚是有机化合物中常见的两类官能团,它们在生物、药物、农药等领域具有重要的应用价值。
本文将重点讨论有机化学中醇与醚的合成方法。
一、醇的合成
醇是含有羟基(-OH)官能团的有机化合物,在合成中使用广泛。
下面介绍几种常见的醇合成方法:
1. 烷烃氧化法:烷烃氧化是醇的一种重要合成途径,其中最常见的是烷烃的氧化裂解反应。
例如,乙烷氧化可生成乙醇。
2. 烯烃水化法:烯烃通过水合反应可以生成醇。
例如,乙烯经过水合反应可以制备乙醇。
3. 羧酸还原法:羧酸的还原反应也是醇的常见合成方法。
例如,乙酸经过还原反应可以生成乙醇。
二、醚的合成
醚是含有氧桥(-O-)官能团的有机化合物,通常可以由醇和卤代烷基的缩合反应来合成。
下面介绍几种常见的醚合成方法:
1. 醇缩合法:醇和卤代烷基经过缩合反应可以生成醚。
例如,甲醇和溴乙烷经过缩合反应可以制备甲基乙基醚。
2. 醇脱水法:醇经过脱水反应也可以生成醚。
例如,乙醇在酸性条件下脱水反应可以生成乙醚。
3. 醇与醚之间转化法:醇可以通过醚化反应转化为醚。
例如,在酸催化条件下,乙醇可以与甲醇发生醚化反应生成乙基甲醚。
综上所述,有机化学中的醇与醚是重要的有机化合物,在实际合成中有着广泛的应用。
通过实验室合成或生物合成等方法,我们可以合成出各种类型的醇和醚化合物,为化学领域的发展和应用提供了有力支持。
希望本文对读者有所帮助,欢迎交流讨论。
醇 和 醚(3)b

CH3 CH3
CH3 CH3 − H2O ~ CH3 OH CH3 H3C C C CH3 CH3
脱水
~ CH3
CH3 CH3
迁移、脱水同步 迁移、
迁移
− H+ H3C O C CH3 C CH3 CH3
更稳定的正离子
•例:其它邻二醇的Pinacol重排 其它邻二醇的Pinacol重排
OH OH Ph C C H H
一.邻二醇及其性质
1. 邻二醇的制备
重点:邻二醇 重点:
• 烯烃加成
稀冷 KMnO4 or OsO4
R1
R2 C C OH cis R4
(± )
R3 HO
R1 C R3 C
R2 R4
O RCOOH
?
H2O OH or H
R1
OH C C R2 R4
(±) R3
HO
trans Cl2, H2O R3 R1 C OH C
4
oxirane
2−methyloxirane
O
O O O
3 2
5
O
1
6
1, 3-环氧丙烷 3- 氧杂环丁烷 oxetane
对二氧六环 1, 4-二氧六环 4- 1,4-dioxane 1,4-
四氢呋喃 THF tetrahydrofuran
二氢吡喃 DHP 3,4−dihydro−2H−pyran 3,4−dihydro−2H−
CH3 CH3C CH3 O CH2CH3
OCH3
芳基醚
CH2Cl ClCH2 C CH2Cl
NaOH ClCH2
CH2Cl C O
四元环醚
CH2OH
2. 醇脱水制备对称醚 醇脱水制备对称醚
本科有机化学 第五章 醇和醚
5
6
结构与化学性质
碳氧单键为极性键 (与碳卤单键类似) 亲核取代反应、消除反应
氢氧极共用电子对 碱性、亲核性 7
一元醇的化学性质
1. O-H键的断裂:酸性(acidity)
醇酸性的体现
酸性的度量 (酸解离常数)
8
9
• the acid-dissociation constants for alcohols vary according to their structures • the acidity decreases as the substitution on the alkyl group increases • substitution by electron-withdrawing halogen atoms enhances the acidity of alcohols
27
28
本反应的一个早期应用:Alcohol Breath Tester
用嘴吹气 玻璃管:内壁附着 涂有重铬酸钾和 硫酸的硅胶颗粒
气 球
29
(2)选择性氧化剂氧化: PCC(pyridinium chlorochromate)
特点:活性相对较低,故选择性强,适合由伯醇氧化制备醛和由仲 醇氧化制备酮,不影响碳碳重键
SN2
亲核试剂进攻质子 化的羟基,水离去, 形成产物
伯醇和仲醇与HCl的反应常需添加ZnCl2,以促进反应的进行 反应活性较低的原因:亲核性Cl- < Br- (如何解释?)
16
Lucas reagent (卢卡斯试剂) 浓盐酸+无水ZnCl2
活化的原因:Zn2+与羟 基配合能力较H+更强!
Lucas test:可粗略地通过醇与Lucas试剂反应的时间推测醇的 类型(伯、仲、叔醇)
醇 和 醚(3)

SN2
CH3 I + HO
CH3 H CH3
• SN1 机理
CH3 CH3 I H O C CH3 CH3
SN2,位阻 , 影响为主
CH3 CH3 CH3 O H C CH3 I CH3 I OH + CH3 C CH3 CH3
第九章
醇 和 醚(3)
主要内容
醚的制备(williamson醚合成法,烯烃的烷氧汞化-脱 醚合成法, 醚的制备(williamson醚合成法 烯烃的烷氧汞化- 汞反应) 汞反应) 醚类的化学性质,酸性条件下C-O键的开裂 醚类的化学性质,酸性条件下C 环氧乙烷衍生物的酸性和碱性开环 冠醚及其性质和应用
例:完成转变 合成路线
H2C CH3 HO Br H2SO4 H3C
HO Br HO
CH3 CH3 C O CH3 H2O H+ HO Br NaC CH
CH3 H3C C O CH3
4. 烯烃的烷氧汞化 —— 还原(脱汞)反应 还原(脱汞) (Alkoxymercuration(Alkoxymercuration-Demercuration)
2. 1, 2-环氧化合物的酸性开环 2-环氧化合物的酸性开环
OH H R X H OH H R CN HCN R R'OH H
+
OH H R HX O H2O H
+
•反应取向: 反应取向:
HO
在取代基多 的一端开环
OH
H R R'O
•立体化学: 立体化学:
反式开环
酸性开环机理
O H R H+
第九章醇和醚

电子基团(R)的影响,使氧原子上的电子云密度较低,O—H的氢受 到的束缚较小,所以易被取代。
醇钠(RONa)是有机合成中常用(chánɡ yònɡ)的碱性试剂。醇钠的用途:
1. 醇钠在有机合成中用作碱性试剂,其碱性比NaOH还强。 2. 醇钠也常作分子中引入烷氧基(RO-)的亲核试剂。 醇还可与其它活泼金属反应:如Mg,Al,生成醇镁、醇铝。
共五十九页
2、与氢卤酸反应(制卤代烃的重要(zhòngyào)方法)
1) 反应速度(fǎn yìng sù dù)与氢卤酸的活性和醇的结构有关。 HX的反应活性: HI > HBr > HCl
醇的活性次序: 烯丙式醇 > 叔醇 > 仲醇 > 伯醇 > CH3OH
共五十九页
醇与卢卡斯(Lucas)试剂(浓盐酸(yán suān)和无水氯化锌)的反应:
(1)加入还原剂5%的FeSO4于醚中振摇后蒸馏。 (2)贮藏时在醚中加入少许金属钠。
1. 醇脱水(tuō shuǐ)
四、醚的制备
此法只适用于制简单醚,且限于伯醇,仲醇产量低,叔醇在酸性
条件下主要生成烯烃。
共五十九页
2. 威廉姆逊合成(héchéng)法(A.W.Williamson)
威廉姆逊合成(héchéng)法是制备混合醚的一种好方法。是由卤代 烃与醇钠或酚钠作用而得。
脂肪醇、脂环醇和芳香醇(芳环侧链有羟基的化合物)。
3)根据分子中所含羟基的数目分为:
一元醇、二元醇和多元醇。 两个羟基连在同一碳上的化合物不稳定,这种结构会自发失水,
故同碳二醇不存在。另外,烯醇是不稳定的,容易互变成为比较稳
醇和醚知识点详解

醇和醚知识点详解醇和醚是有机化合物中常见的两类化合物。
它们在许多领域具有重要的应用,如有机合成、溶剂、药物和香料等。
本文将详细介绍醇和醚的定义、性质、制备方法和应用等知识点。
一、醇的定义和性质醇是一类含有氢氧基(-OH)的有机化合物。
根据氢氧基的位置,醇可以分为一次醇、二次醇和三次醇。
一次醇中,氢氧基连接在碳链上,如甲醇(CH3OH)和乙醇(C2H5OH)。
二次醇中,有两个氢氧基连接在碳原子上,如乙二醇(HOCH2CH2OH)。
三次醇则有三个氢氧基连接在碳原子上。
醇分子中的氢氧基使其具有一些特殊性质,如溶解性和酸碱性。
1. 溶解性:醇一般可溶于水。
较短的醇(一次醇和二次醇)溶解性较高,而较长的醇溶解性较差。
这是因为水分子能与醇分子的氢键形成氢键,使其能够相互溶解。
2. 酸碱性:醇可作为酸或碱。
在适当条件下,醇的氢氧基可以脱去质子成为负离子(醇的碱性),也可以接受质子成为正离子(醇的酸性)。
二、醇的制备方法1. 氢氧化物的还原:将醛或酮用还原剂(如氢气与催化剂)还原即可得到相应的醇。
2. 同分异构体的合成:对一些具有同分异构体的化合物,通过适当的反应条件,可以选择性地将其转化为某一种醇。
3. 环氧化合物的开环:将环氧化合物与酸或碱反应,使其开环而生成相应的醇。
4. 卤代烃的取代反应:醇也可以通过将卤代烃与水反应来获得。
三、醇的应用1. 溶剂:醇在许多化学反应中可以作为溶剂使用,如乙醇常用于制备药物和香料。
2. 酯的制备:醇与酸酐反应,通常可以生成酯。
酯在食品工业、香料工业和制药工业中有广泛的应用。
3. 脱水剂:由于醇分子中含有活泼的氢氧基,因此醇在一些有机合成反应中可以作为脱水剂使用。
四、醚的定义和性质醚是一类含有两个烷基或芳基团的有机化合物,其通式为R-O-R',其中R和R'可以是烷基或芳基团。
根据醚分子中氧原子在碳链上的位置,可以分为对称醚和非对称醚。
1. 对称醚:两个烷基或芳基团相同,例如乙醚(CH3OCH3),是最简单的醚。
8-1.醇和醚

2-甲基环戊醇
④ 芳香醇
CH2 CH CH3 OH 1-phenylpropan-2-ol
CH
CH CH2OH
3-phenylprop-2-en-1-ol
1-苯基-2-丙醇 ⑤ 多元醇
H3C CH CH2 OH HO propylene glycol
(1)常用催化剂:Pt、Pd、Ni
(2)分子中有碳碳重键同时被还原。
2、化学还原法 (1)LiAlH4
CH3 OH H3C C HC CH3 CH3 ( 1 )H
+
CH3 H3C C C H CH3 CH3
H3C C H3C C CH3 CH3
+
CH3 H3C C CH CH3 CH3
+
( 2 )--H2O
+
--H
但用Al2O3为催化剂时,醇在高温气相条件下脱水, 往往不发生重排。
H2SO4 CH3 CH2 CH2 CH2 OH Al 2O3 CH3 CH CH CH3 CH2
(1)O-H 键有极性,活性氢,有酸性。 (2)C-O 键有极性,-OH 被取代。 (3)α-H 有活性,发生氧化反应。 (4)β-H 有活性,消除反应。 .. .. (5)R-OH中氧的电子云密度高于H-OH ——作亲核试剂。
(一)酸性和与活泼金属的反应
与活泼金属(K、Na、Mg、Al)的反应
R OH
② 琼斯(Jones)试剂:三氧化铬溶于稀硫酸 (CrO3.H2SO4)
类似于沙瑞特试剂。 ③ 活性二氧化锰:新制备的二氧化锰 选择性地将烯丙位的醇氧化成相应的不饱和醛、酮。
H2C CH CH2OH 活性 MnO2 H2C CH CHO
有机化学基础知识点整理醇和醚的性质和反应

有机化学基础知识点整理醇和醚的性质和反应醇和醚是有机化合物中常见的官能团,它们在化学反应中起着重要的作用。
了解其性质和反应对于有机化学的学习和应用非常重要。
本文将对醇和醚的性质和反应进行整理和总结。
一、醇的性质和反应1. 醇的结构和命名醇是含有羟基(-OH)官能团的化合物。
根据羟基上所连接的碳原子数目,醇可以分为一元醇(含有一个羟基),二元醇(含有两个羟基),三元醇(含有三个羟基)等。
醇的命名通常采用将烷烃命名法中的“烷”改为“醇”,同时在碳原子前面标记羟基所连接的位置。
2. 醇的物理性质醇具有许多与羟基相关的物理性质。
由于羟基可以形成氢键,醇的沸点和溶解度通常较高。
此外,醇还具有较大的极性,使得它们具有良好的溶剂性,尤其对于极性化合物。
3. 醇的酸碱性醇既可以表现出酸性,也可以表现出碱性。
醇的酸性主要体现在羟基上,它可以失去氢原子形成羟基阴离子。
同时,醇中的氧原子也能形成键合氢,表现出碱性。
4. 醇的氧化反应醇可以发生氧化反应,其中最常见的就是醇的燃烧反应。
醇在氧气的存在下可以燃烧,并释放出大量的热能和水。
此外,醇还可以被氧化剂如酸性高锰酸钾(KMnO4)氧化成酮或醛。
5. 醇的酯化反应醇与酸酐发生酯化反应,生成酯。
酯是一类常见的醇的衍生物,具有良好的香味和挥发性。
酯化反应是众多有机合成中常用的一种方法。
二、醚的性质和反应1. 醚的结构和命名醚是由两个碳原子通过一个氧原子连接形成的化合物。
根据氧原子所连接的碳原子的数目和位置,醚可以分为对称醚和不对称醚。
醚的命名通常采用将两个碳原子团按字母顺序排列,并在后面加上“醚”字。
2. 醚的物理性质醚具有较低的沸点和较好的挥发性,这使得它们广泛应用于溶剂和非极性反应介质中。
醚的极性较小,不溶于水,但溶于大部分有机溶剂。
3. 醚的裂解反应醚可以通过热或酸性条件下的裂解反应进行分解,生成相应的醇。
这是由于氧原子的带负电荷引发了裂解反应。
4. 醚的醚化反应醚还可以通过醇的酸性氢进行醚化反应。
醇和醚

硫酸氢甲酯 CH3OH
O CH3OSOCH3 O
硫酸二甲酯
(酸性酯)
(中性酯)
• 硫酸与乙醇作用:硫酸氢乙酯和硫酸二乙酯 。 (烷基化剂:硫酸二甲(乙)酯,有剧毒)
• 高级醇的酸性硫酸酯钠盐 , 如 :C12H25OSO2ONa, 是一 种合成洗涤剂. • 甘油三硝酸酯是一种炸药;
烯丙醇 炔丙醇
• 芳醇
CH2-OH
苯甲醇 (苄醇)
醇的化学性质
•醇的性质主要是由它的官能团(—OH)决定的。 • 醇的化学反应中,根据键的断裂方式,主要有:
•氢氧键断裂和碳氧键断裂两种不同类型的反应。
• 烃基结构的不同也会影响反应性能,或导致反应历 程的改变:如分子重排反应。
一、 与活泼金属的反应
三烷基磷酸酯
四、 脱水反应 •按反应条件不同,可以发生分子内脱水而生成烯烃;也 可以发生分子间脱水而生成醚类: 例1:
乙烯
例2:
乙醚
• 温度的影响——低温有利于取代反应而生成醚;高 温有利于消除反应,即分子内脱水生成烯烃。
• 醇结构的影响——一般叔醇脱水不生成醚,而生 成烯烃。 • 醇脱水反应取向——符合查依采夫规则。 例 1: 66%H2SO4 CH3 CH3
•溴水过量,生成黄色 的四溴苯酚析出
黄色沉淀
•邻、对位上有磺酸基 团时,可同时被取代
• 一元取代物对
溴苯酚的生成
(低温,非极性溶剂)
•对氯苯酚、邻氯 苯 酚 和 2,4- 二 氯 苯酚的生成
2,4-二氯苯酚
(注意:温度和氯用量,不用溶剂)
•2,4,6 -三氯苯酚的 生成
(水溶液)
•三氯化铁存在下 2,4,6 -三氯苯酚能 进一步氯化成五 氯苯酚
有机化学 第5章醇和醚

(二)物理性质
1.性状:
2.沸点:
1)比烷烃的沸点高(形成分子间氢键的原因), 如 乙烷的沸点为-88.6℃,而乙醇的沸点为78.3℃。
2)含支链的醇比直链醇的沸点低,如正丁醇 (117.3 ℃ )、异丁醇(108.4 ℃ )、叔丁醇 (88.2 ℃ )。
3.溶解度:
✓ 甲、乙、丙醇与水以任意比混溶(与水形 成氢键的原因);
CH3CH2O- (乙醇钠)的碱性HO-(氢氧化钠)强, 所以醇钠极易水解。
CH3CH2ONa + H2O
较较强强键碱 较强较酸强酸
CH3CH2OH + NaOH
较弱酸 较较弱弱酸碱
较弱减
即:强酸置换弱酸盐!
工业上制备醇钠常用上述逆反应,但需将生 成的水及时移走。
醇与钠的反应活性:
CH3OH > 伯醇(乙醇) > 仲醇 > 叔醇
伯醇 仲醇 叔醇
Lucas试剂
(-) 5分钟内浑浊 立即浑浊
4)与卤化磷和亚硫酰氯反应p154
3ROH + PX3
3RX + P(OH)3
X=Br、I,制备溴代或碘代烃
( Cl的反应产率低于50%)
ROH + PCl5 ROH + SOCl2
RCl + POCl3 + HCl RCl + SO2 + HCl
OO O K+ O
OO
MnO4-
COOH COOH
六、环氧乙烷的部分化学性质
H
R Cδ
Oδ
δ H
H
酸性,生成酯
氧化反应 形成 C ,发生取代及消除反应
(一)O-H键断裂的反应 1.与活泼金属的反应
《有机化学》徐寿昌 第二版 第10章 醇和醚

顺-1,2-环戊二醇 环戊二醇
10.2 醇的制法
10.2.1 烯烃水合 (1)烯烃直接水合: )烯烃直接水合: 用于一些简单的醇制备,符合马氏规律。 用于一些简单的醇制备,符合马氏规律。
H3PO4-硅藻土 硅藻土 CH2=CH2 + HOH CH3CH2-OH 280~300℃,8MPa ℃
CH3-CH=CH2 + HOH
Na/C2H5OH
R—CH2OH OH R—CH—R’ R—CH2OH
伯醇
仲醇
O 羧酸 R—C—OH O 羧酸酯R—C—OR’
伯醇
R—CH2OH + R’OH 伯醇
例如: 例如:
(CH3)3CCOOH O R—C—OC2H5
1. LiAlH4 2.乙醚,H2O 乙醚, 乙醚
(CH3)3CCH2OH
烯丙基氯(易从丙烯高温氯化得到) 烯丙基氯(易从丙烯高温氯化得到)
烯丙醇
苄氯(甲苯高温氯化) 苄氯(甲苯高温氯化)
苄醇
10.3 醇的物理性质
◆低级醇为无色透明液体;C12以上的直链醇为固体 低级醇为无色透明液体; 以上的直链醇为固体. 沸点:直链饱和一元醇的沸点比相应烷烃的沸点高. ◆沸点:直链饱和一元醇的沸点比相应烷烃的沸点高
10.2.3 从醛、酮、羧酸及其酯还原*** 从醛、 催化加氢( ◆催化加氢(Ni/H2;Pd/H2;Pt/H2) 用还原剂还原( ◆用还原剂还原(NaBH4、LiAlH4、Na/C2H5OH) ) 、 O 醛 R—C—H O 酮 R—C—R’
[H] NaBH4 [H] NaBH4 [H] LiAlH4 [H]
① 按-OH数 数 目分类: 目分类:
二元醇: 二元醇:
CH2—CH2 OH OH CH2—CH—CH2 OH OH OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•分析:中性、碱性条件下 分析:中性、
δ+
R Nu
O
R'
SN2 Nu R + O R'
难进行
差离去基
•分析:弱酸性条件下 分析:弱酸性条件下
H+ R O R' Nu R O H R'
难进行
Nu R + HO R'
(亲核能力弱及浓度稀时) 亲核能力弱及浓度稀时)
可离去,离去 可离去, 能力比H 能力比H2O差
CH3 CH3C CH3 O CH2CH3
OCH3
芳基醚
CH2Cl ClCH2 C CH2Cl
NaOH ClCH2
CH2Cl C O
四元环醚
CH2OH
2. 醇脱水制备对称醚 醇脱水制备对称醚
H+ 2 R OH ∆ R O R + H2O
例
H2SO4 HO OH O + O 2 H2O O H2SO4 2 HO OH + H2O
冠醚的制备
Williamson醚合成法 醚合成法
OH O
Cl O
O KOH ∆ O O O O O O
+
O OH Cl
18−冠−6 18−
OH + OH O Cl Cl
O NaOH O O O O O
C. J. Pederson, 1960s
二苯并−18− 二苯并−18−冠−6
冠醚对金属离子的络合
H
OH
O
cis
H OH
Sharpless不对称环氧化反应 1980) 了解) Sharpless不对称环氧化反应(1980)(了解) 不对称环氧化反应(
t-BuOOH, Ti(O-iPr)4 R2 R1 R3 OH t-BuOOH, Ti(O-iPr)4 (−)−diethyl tartarate CH2Cl2, -20oC R3 R2 O R1 OH (+)−diethyl tartarate CH2Cl2, -20oC R3 R2 O R1 OH
CH3 CH3 I H O CH3 I H CH3 O H CH3 CH3 H
SN2
CH3 I + HO
CH3 H CH3
• SN1 机理
CH3 CH3 I H O C CH3 CH3
SN2,位阻 , 影响为主
CH3 CH3 CH3 O H C CH3 I CH3 I OH + CH3 C CH3 CH3
(−)−Triptolide 雷公藤内酯醇 免疫抑制剂
O
1. 1, 2-环氧化合物的制备 2-
R2 R1 R3 R4 O R2 R3 R4 HO R2 R1 R3 R4 X
PhCO3H
OH
立体专一
R1
分子内S 分子内SN2
Cl
H O
提示: 提示:
注意下列两 立体异构体 反应的区别
trans
Cl OH O H OH
一.醚的制法
1. Williamson醚合成法(制备醚的主要方法) Williamson醚合成法(制备醚的主要方法) 醚合成法
SN2
R
ONa +
R'
L
R
O
R'
+
NaL
L = X , TsO
•1o R’-L较好; 3o R’-L消除为主。 R’- 较好; R’- 消除为主。
例:
CH3 CH3C CH3 NaOH OH + CH3OTs ONa + X CH2CH3
O O
Li+
O O O O K+ O O O O MnO4−
O O
O O
Na+
O
合成上的应用举例
KMnO4 18-Crown-6 室温, 快
冠醚的作用
COOH COOH ~100% %
络合正离子,使 络合正离子, 负离子“裸露” 负离子“裸露” 相转移催化剂
The Nobel Prize in Chemistry 1987
SN1
SN1,中间体 , 稳定性为主
CH3 I C CH3
CH3
两类较易水解的醚类化合物
• 叔丁基醚
CH3 R O C CH3
H2 O / H+ H3 C
R
OH
+
H3C
C
CH2
CH3
用于醇的保护和脱保护
• 烯基醚
R' C R" CH OR R"
H2O/ H+
R' CH CH O + HOR
醛(或酮) 或酮) 总是在烯基醚键处开裂
R CH CH2 Hg OAc OAc NaBH4 HO R CH
OAc
CH2
Hg H
R CH
CH3 +
Hg
烯烃的烷氧汞化 —— 还原(脱汞)反应 还原(脱汞)
O Hg(OCCF3)2 R CH CH2 R'OH NaBH4 R CH OR' CH3
醚
炔烃的烷氧汞化 —— 还原反应制备烯基醚 还原反应制备 制备烯基醚
复习:烯烃的羟汞化-还原(脱汞) 009- 复习:烯烃的羟汞化-还原(脱汞)(ppt 009-1)
R CH CH 2 Hg(OAc)2 H 2O, THF NaBH 4 R CH OH CH 3 +
H2O
HOR
?
OH OR
Hg
机理: 机理:
δ
H2O R CH CH2 Hg
δ
H HO R CH CH2 Hg OAc HO − H+ HO R CH CH2 Hg OAc
Hg++ R C CH R'OH NaBH4 R C OR' CH2
烯基醚
•比较:炔烃的水合反应 比较:
HgSO4 R C CH H2 O R
OH
C CH2 R
O
C CH3
烯醇
二.醚类的化学性质
结构特点分析
α碳有亲电性, 碳有亲电性, 但难亲核取代
醚在中性、碱性和弱酸性 醚在中性、 条件下稳定, 条件下稳定,常用作溶剂
2. 1, 2-环氧化合物的酸性开环 2-环氧化合物的酸性开环
OH H R X H OH H R CN HCN R R'OH H
+
OH H R HX O H2O H
+
•反应取向: 反应取向:
HO
在取代基多 的一端开环
OH
H R R'O
•立体化学: 立体化学:
反式开环
酸性开环机理
O H R H+
与质子结合, 与质子结合, 亲电性增强
α碳有亲电性, 碳有亲电性, 可亲核取代
R'
C H
δ+
H+ O R R'
C H
δ+
H O
R
C上连有氧, 上连有氧, H易被氧化
氧有碱性, 氧有碱性, 可与酸结合
较好的 离去基
1. 醚的自氧化(α−氢的氧化) 醚的自氧化( 氢的氧化)
H R' C H O R O2 空 气 ) ( R' H C OOH O R
醚键可被 HI 和 HBr 在加热下断裂
HX R O R' R X + HO R'
∆
X = I, Br
HX过量时,生 HX过量时, 过量时 成2分子卤代烷
例:
H3C CH H3C O CH CH3 CH3
H
I
H3C CH H3C I +
H3C CH H3C H3C OH
∆
I (过量)
H
∆
48% HBr(过量) 过 O
局限性
•只适合1o醇制备对称醚,不适合制备非对称醚 只适合1 醇制备对称醚, •SN1或SN2机理,有消除、重排等副产物 机理,有消除、
3. 烯烃与醇反应制备叔烷基醚 烯烃与醇反应制备叔烷基醚
R C R' CH2 + HO R R HCl R' C CH3 O R
•合成上的应用:保护醇羟基(复习:ppt:009-2) 合成上的应用:保护醇羟基(复习:ppt:009-
Oxonium salt
R' Cl
Brönsted碱 碱
R' HSO4
R
O
R' + H2SO4
R
O H
O
+
BH3
O
BH3
Lewis碱 碱
Et O Et X Mg R O Et Et
3. 醚键的开裂(醚在酸性体系中的亲核取代) 醚键的开裂(醚在酸性体系中的亲核取代)
醚键在中性、碱性或弱酸性条件下不会断裂。 醚键在中性、碱性或弱酸性条件下不会断裂。
"for their work on chirally catalysed hydrogenation reactions" "for his work on chirally catalysed oxidation reactions"
William S. Knowles
Ryoji Noyori
K. Barry Sharpless
提示:醚类试剂(乙醚、THF等)久置使用时要当心 提示:醚类试剂(乙醚、THF等
• 先用淀粉-KI(2%的醋酸溶液)试验 先用淀粉-KI( 的醋酸溶液) • 蒸馏时勿蒸干 • 可用还原剂处理除去过氧化物(如FeSO4,LiAlH4,Na等) 可用还原剂处理除去过氧化物( Na等
2. 醚键氧的碱性
