外用脱色剂进展.
黄褐斑药物治疗新进展

黄褐斑药物治疗新进展作者:夏志宽张金侠杨蓉娅来源:《中国美容医学》2019年第05期[摘要]黄褐斑是一种常见的慢性色素增加性皮肤病,常见于Fitzpatrick Ⅲ~Ⅵ型皮肤的青中年女性,病因复杂且发病机制不清。
临床上目前治疗方法繁多,一般采用联合疗法,其中药物治疗是最主要的方法。
不管是外用药物还是口服药物,均以酪氨酸酶抑制剂为主,通过抑制酪氨酸酶合成及黑素小体转运等途径来达到治疗目的。
本文综述了近年来黄褐斑药物治疗的新进展,以期为相关的临床防治和学术研究提供参考。
[关键词]黄褐斑;药物治疗;新进展;色素沉着[中图分类号]R758.4+2 ; ;[文献标志码]A ; ;[文章编号]1008-6455(2019)05-0022-03New Progress of Drug Therapy For MelasmaXIA Zhi-kuan,ZHANG Jin-xia,YANG Rong-ya(Department of Dermatology,the Seventh Medical Center of PLA General Hospital,Beijing 100700, China)Abstract: Melasma is a common chronic pigmented skin disease in clinic.And it usually affects young and middle-aged women who are Fitzpatrick type III-VI skin. The etiology and nosogenesis of melasma are complex and its pathogenesy is unknown.At present, there are many treatments. In clinic, combined therapy which includes sunscreen and drug therapy as its important part is adopted through external and oral drugs.Tyrosinase inhibitors are mainly used to inhibit tyrosinase synthesis and melanosomes transport to achieve therapeutic purposes.This paper wants to summarize the new research progress with the aim to provide a road map to guide the relevant studies and prevention and treatment of melasma.Key words: melasma; chloasma; drug therapy; new progress;hyperpigmentation黃褐斑一种慢性色素增加性皮肤病,常见于FitzpatrickⅢ~Ⅵ型皮肤的亚裔及拉丁美洲孕龄女性,临床表现为面部对称分布的蝶状或不规则形的褐黄色斑片。
制糖生产糖液脱色方法研究进展

制糖生产糖液脱色方法研究进展沈石妍;郭家文;崔杰;张跃彬【摘要】综述了制糖生产中糖液的脱色除杂方法,主要的脱色剂性能及脱色效果研究进展情况,为制糖生产采用新的脱色分离技术提供参考.【期刊名称】《中国糖料》【年(卷),期】2015(037)005【总页数】4页(P68-71)【关键词】制糖生产;糖液脱色;研究进展【作者】沈石妍;郭家文;崔杰;张跃彬【作者单位】云南省农业科学院甘蔗研究所,开远661699;云南省甘蔗产业工程技术研究中心,开远661699;云南省农业科学院甘蔗研究所,开远661699;云南省甘蔗产业工程技术研究中心,开远661699;云南省农业科学院甘蔗研究所,开远661699;云南省甘蔗产业工程技术研究中心,开远661699;云南省农业科学院甘蔗研究所,开远661699【正文语种】中文【中图分类】TS244色值是影响白砂糖产品质量的一个重要指标,降低白砂糖产品的色值是制糖生产力求解决的难题之一。
制糖过程中的有色物质主要由原料本身带入和生产过程中生成两部分组成[1]。
原料本身含有的不溶于水的叶绿素、叶黄素、胡萝卜素等,以及溶于水的多酚类色素,如花色素等,此外甘蔗中含有的还原糖、氨基酸、带有氨基的酚类,它们本身没有颜色,在生产过程中遇到酸、碱、氧、酶、铁或物理条件的变化则会产生色素,可称为色源,这些是原料本身带入的[2]。
生产过程中还会产生一些色素物质,如还原糖分解物、还原糖与氨基酸发生美拉德反应生成的拟黑色素、蔗糖脱水焦化形成的焦糖色素等[3]。
色素物质在白砂糖中残留是造成白砂糖色值偏高的重要因素,由于色素物质性质的不同,有些色素较易被澄清处理除去,有些很难除去,有些色素不易进入蔗糖晶体中,有些则有较强的影响[1],只有尽可能地除去或控制它们的生成才能得到品质较好的产品。
白砂糖的生产过程就是一个提纯和脱色的过程,传统的制糖生产过程通常采用石灰法、亚硫酸法或碳酸法等不同的生产工艺,通过添加化学澄清剂将蔗汁所含的非糖物质尽可能地变成沉淀,然后用物理的方法将其与蔗汁分离,从而得到清汁,这种方法效率不高,一般只能除去非糖分的1/4~1/3[4]。
中国白癜风诊疗共识(2014版)

白癜风诊疗共识(2014版)中国中西医结合学会皮肤性病专业委员会色素病学组本指南以中国中西医结合学会皮肤性病专业委员会色素病学组制订的白癜风治疗共识(2009版)为基础,经色素病学组、中华医学会皮肤科分会白癜风研究中心部分专家及国内相关专家讨论制定。
参加起草及讨论的成员(按姓氏汉语拼音排序):傅雯雯、高天文、何黎、贾虹、李恒进、李铁男、李珊山、卢忠、鲁严、李春英、李强、刘清、马东来、乔树芳、秦万章、宋智琦、孙越、宋秀祖、涂彩霞、温海、王玮蓁、许爱娥、项蕾红、张学军、张建中、郑志忠、赵广、朱光斗。
白癜风治疗目的是控制皮损发展,促进白斑复色。
一、选择治疗方法时主要考虑因素:1.病期:分进展期和稳定期。
进展期判定参考白癜风疾病活动度评分(VIDA)积分、同形反应、Wood灯。
①VIDA积分:近6周内出现新皮损或原皮损扩大(+4分),近3个月出现新皮损或原皮损扩大(+3分),近6个月出现新皮损或原皮损扩大(+2分);近1年出现新皮损或原皮损扩大(+1分);至少稳定1年(0分);至少稳定1年且有自发色素再生(-1分)。
总分>1分即为进展期,≥4分为快速进展期;②同形反应:皮肤损伤1年内局部出现白斑。
损伤包括物理性(创伤、切割伤、抓伤)、机械性摩擦、化学性/热灼伤、过敏性(接触性皮炎)或刺激性反应(接种疫苗、纹身等)、慢性压力、炎症性皮肤病、治疗性(放射治疗、光疗)。
白斑发生于持续的压力或摩擦部位,或者是衣物,饰品的慢性摩擦部位,形状特殊,明显由损伤诱发;③Wood灯:皮损颜色呈灰白色,边界欠清,wood灯下皮损面积大于目测面积,提示是进展期。
皮损颜色是白色,边界清,wood灯下皮损面积≤目测面积,提示是稳定期。
以上3条符合任何一条即可考虑病情进展;④可同时参考激光共聚焦扫描显微镜(简称皮肤CT)和皮肤镜的图像改变,辅以诊断。
2.白斑面积(手掌面积约为体表面积1%):1级为轻度,<l%;2级为中度,l%~5%;3级为中重度,6%~50%;4级为重度,>50%。
白芷提取液活性研究

临床医药文献杂志Journal of Clinical Medical2018 年第 5 卷第 29 期2018 Vol.5 No.29173白芷提取液活性研究董 韬,廉 洁,孙丽慧,张 萌,姚宏波(齐齐哈尔医学院基础医学院组织学与胚胎学教研室,黑龙江 齐齐哈尔 161006)【摘要】目的 通过检测白芷提取液对酪氨酸酶活性的影响和对羟自由基的作用,以期将白芷作为外用脱色剂。
方法 分光光度计法测定白芷提取液对酪氨酸酶活性影响及其羟自由基清除能力。
结果 白芷提取液160 mg/mL 对酪氨酸酶活性抑制率达到43.15±2.64%,与阳性对照组比较差异不显著,随加入提取液浓度增加,羟自由基清除能力增强。
结论 白芷提取液可以作为体外脱色剂。
【关键词】白芷;酪氨酸酶;羟自由基【中图分类号】R28 【文献标识码】B 【文章编号】ISSN.2095-8242.2018.29.173.02白芷(Angelica dahurica )是当归属的一种植物,常以根入药,味辛,性温。
归肺、脾、胃、大肠经。
芳香升散,消肿排脓,润泽肌肤,增白生肌。
其提取物主要药理作用包括抗肿瘤[1]、抗炎[2]、扩血管[3]、镇痛等,但其脱色和羟自由基的清除作用所述甚少,本实验采用白芷水提醇沉法制成白芷提取液,测试其对黑色素合成的影响[4]及对羟自由基的清除能力,以期将白芷确定为体外美容药物。
1 材料方法1.1 试验材料1.1.1 试剂及药材蘑菇酪氨酸酶(sigma 货号T3824)、熊果苷(中国食品药品检定研究院,批号111951-201301)、L-酪氨酸(sigma 货号T8566)、磷酸二氢钾(分析纯)、磷酸氢二钾(分析纯)、FeSO 4•7H 2O (分析纯)、水杨酸(分析纯)、过氧化氢(分析纯)、白芷(浙江省安国市同義中药饮片公司 批号13080008)。
1.1.2 仪器UV5100紫外可见分光光度计(上海元析仪器有限公司);超净工作台(苏州净化SW-CJ-2D 型);电动移液器(eppendorf );恒温箱(天津市泰斯特仪器101-0AB );水域锅(上海宜昌仪器厂);高速离心机(湘仪TGL-16M )。
复方木尼孜其颗粒治疗炎症后色素沉着32例

复方木尼孜其颗粒治疗炎症后色素沉着32例赵爱杰;许成蓉;冯民【摘要】目的观察复方木尼孜其颗粒治疗炎症后色素沉着的疗效.方法炎症后色素沉着患者64例,随机分为治疗组和对照组各32例.治疗组口服复方木尼孜其颗粒6 g,tid;对照组口服维生素C0.2g,tid,维生素E0.1g,tid.两组均给予维生素E乳膏外用,治疗时间均为12周.结果治疗组和对照组的有效率分别为78.12%和46.88%( P<0.05),均无不良反应发生,结论复方木尼孜其颗粒治疗炎症后色素沉着安全有效.【期刊名称】《医药导报》【年(卷),期】2012(031)006【总页数】2页(P753-754)【关键词】复方木尼孜其颗粒;色素沉着,炎症后【作者】赵爱杰;许成蓉;冯民【作者单位】华中科技大学同济医学院附属同济医院皮肤与性病科,武汉430030;华中科技大学同济医学院附属同济医院皮肤与性病科,武汉430030;湖北省襄阳市保康县医院皮肤科,441600【正文语种】中文【中图分类】R986;R751炎症后色素沉着(postinflammatory hyperpigmentation,PIH)是指皮肤在急性或慢性炎症过程之后出现的皮肤色素沉着,可由皮肤创伤,包括外伤、激光术,以及多种皮肤病引起,不经治疗大多需要6~12个月才能消退,但仍约有30%半年后不能消退,最终成为永久性色素沉着[1],虽然不影响身体健康,但有碍于美容,给患者带来心理压力,影响社交、工作和生活。
目前临床上对此缺乏有效的治疗。
2010年6月~2011年10月,笔者采用复方木尼孜颗粒和维生素E乳膏联合治疗PIH患者,取得较好疗效,报道如下。
1 资料与方法1.1 临床资料颜面部PIH患者64例,女55例,男9例。
按随机抽样原则分为两组:治疗组32例,小斑型(皮损直径≤2 cm)19例,大斑型(皮损直径>2cm)13例,平均32.2岁,病程8~65个月,平均27个月;对照组32例,小斑型15例,大斑型17例,平均31.5岁,病程12~58个月,平均25.2个月。
激素依赖性皮炎的研究进展

激素依赖性皮炎的研究进展沈旭成1,2张怡1谢志敏1王艳芳1叶兴东11广州医科大学皮肤病研究所广州市皮肤病防治所皮肤科510095;2佛山市第二人民医院皮肤科528000通信作者:叶兴东,Email:【摘要】激素依赖性皮炎概念尚未统一,通常指不恰当的外用糖皮质激素制剂治疗皮肤疾病后原有皮损消退,但停药后复发或加重,患者不得不继续使用激素的一种亚急性皮肤炎症,临床典型表现为灼热、刺痒、局部干燥紧缩感,该病发病率逐渐增高,发病机制尚未十分明确,需进一步研究探讨;本文就激素依赖性皮炎概念、动物模型研究、发病机制、病理生理、临床特点及治疗进行综述。
【关键词】激素依赖性皮炎;动物模型;研究进展Research progress of corticosteroid dependent dermatitisShen Xucheng1,2,Zhang Yi1,Xie Zhimin1,Wang Yanfang1,Ye Xingdong11Department of Dermatology,Guangzhou Institute of Dermatology,Dermatology Institute of Guangzhou Medical University,Guangzhou510095,China;2Department of Dermatology,The Second People's Hospital of Foshan,Foshan528000,ChinaCorresponding author:Ye Xingdong,Email:【Abstract】The concept of corticosteroid dependent dermatitis has not been unified.The disease is subacute skin inflammation caused by the abuse of corticosteroids,usually refers to inappropriate topical glucocorticoid preparations for the treatment of skin diseases,which makes the original skin lesions temporarily subsided,but relapses or worsens after withdrawal,so that patients have to continue to use glucocorticoids.Its clinical manifestations are burning,itching,local dryness and tightness,the incidence of the disease is gradually increasing,its pathogenesis is not yet clear,which needs further research.This article reviews the concept of disease,animal model research,pathogenesis,pathophysiology,clinical features,and treatment.【Key words】Corticosteroid dependent dermatitis;Animal model;Research progress激素依赖性皮炎(corticosteroid dependent dermatitis,CDD),顾名思义,是指治疗炎症性皮肤病的过程中,为控制临床症状而不得不继续外用激素制剂的一种临床现象。
复方熊果苷制剂对中波紫外线照射所致豚鼠皮肤色素沉着的抑制作用

选用
熊果苷 、 曲酸 、 A酸 、 维 维生素 E 地塞米松及 氢醌 6种 成分制成不 同组合的乳 膏,制作棕黄 色豚 鼠经 U B照射 诱导皮肤 色素 沉 、 V 着的 实验动 物模 型 , 用苏木精 一 采 伊红 、cm r I o a a等 方法染 色, 察外 用复方制剂后 黑素细胞数 量和 形 态的 改变。结果 S h ol m kw 、 观
22 组 织学 观 察 .
U B 照 射 后 单 乳 膏组 黑 素 细胞 V
树 突 粗大 , 巴反应 显 著 增强 。3 多 %氢 醌 组 连 续 应 用 4周 后 , 镜下 观 察 黑 素 细 胞 数量 较单 乳 膏 组 减 少 . 光
量仪( 德国 C K公 司提供 ) 测量豚 鼠背部皮肤各区域
用单乳膏基质 , 阳性对照外用 3 %氢醌。上述成分按
实验所 需 浓度 制成 乳膏 制剂 ,一4℃冰 箱保存 。
13 U B照射 . V
用美 国 D agt 0 2 ulh1 — 高能紫外线 i 2
.
【 收稿 日期 】O 10 — 1 ¥ 2 1—3 2 基金项 目: 宁夏 自然科学基金资助课题 [ Z65 E a : p g 9 12 6 COB N 08 ] mi x i 1 @13 lu n 5 0
部 去毛 , 6个相离区域 . VB照射后外涂药物。 取 U 12 药 物 . p 熊果 苷 ( 一 熊果 苷 1号 ,% 3 熊果 苷 + 5 -
大 的副作用 大 大 降 低 了其 使 用 的 安 全 性 , 研 究 报 有 道 熊 果苷 可 以和 L 一多 巴竞争 结合 酪 氨 酸受 体 位 点 , 从 而 抑制黑 素 生 成 l , 此 本 实 验 配 制 了 以 熊果 苷 1为 ] 为 主联 合其 它美 白成 分 的复 方 制 剂 , 察 其 对 皮 肤 观 色 素沉 着 的抑 制 作 用 , 用 棕 黄 色 豚 鼠经 中波 紫 外 采 线( V 照射诱导皮肤色素沉着实验动物模 型 . U B) 应 用苏 木精 一伊 红染 色 ( E) Sh r、m kw H 、cmolI oa a等 多种 方 法染 色 , 察 了该 制 剂 对 黑 素 细 胞 和 黑 素 颗 粒 的 观
(医学)医学美容技术

西医学是最
近三四百年来建立在解剖学、生物学 及现代 科学技 术基础 上、发 展起来 的一门 以“解 剖人、 肉体人 ”为概 念的、 新兴的 现代医 学科学 理论体 系。主 要采用 科学实 验方法 ,从宏 观到微 观,直 至目前 的分子 基因层 次水平 ,发展 极为迅 速,超 过其它 任何一 门医学 科学, 成为世 界医学 史上的 主流。
中医即中国传统医药学,是形成于数 千年前 的中国 ,是建 立在人 们与疾 病长期 斗争的 经验总 结及阴 阳五行 、八纲 脏腑辨 证基础 上,运 用朴素 辩证法 及思辨 推理方 法,认 识机体 、自然 、疾病 三者关 系,发 展起来 的一门 以“功 能人” 包括功 能脏器 为概念 的独特 的医学 哲学理 论体系 。在治 疗上, 除了药 物外, 还有针 灸、推 拿气功 、耳针 等特殊 疗法, 它是世 界传统 医学中 最完善 的一种 医学理 论体系 。它为 人类尤 其为中 国人民 健康和 民族繁 衍做出 了巨大 贡献。
7.日晒因素阳光中的紫外线可引起 酪氨酸酶活性增高,从而促进酪氨酸 转变为黑色素。
பைடு நூலகம்8.黄褐班的发生与微量元素有关。 血清锌、维生素C、维生素A 、维 生素E的含量显著下降。
9.精神因素及睡眠 10.微生态失衡
(三) 黄褐斑的养护
1去除病因
(一)因药物诱发的应停用药物 (1) 对于症状性患者,应积极治疗原发病 (2) 由化状品引起的应停用该化妆品 (3) 合理饮食 (4) 患者应消除精神负担 (5) 防晒 (6) 保持面部清洁
2. 生理性反应 妊娠妇女常在怀孕 2─5月时发病,分娩后来月经时可逐渐 消退,这可能与体内雌激素、孕激素水 平增加有关。
3.药物因素 口服避孕药引起的最 常见。长期服用某些药物如苯妥因
中级卫生专业资格皮肤与性病学主治医师中级模拟题2021年(44)_真题-无答案

中级卫生专业资格皮肤与性病学主治医师(中级)模拟题2021年(44)(总分98.XX99,考试时间120分钟)不定项选择1. 患者,女性,18岁。
面部、手背部皮疹10余年,不痛不痒,日晒后加重。
查体:面部、手背部可见散在的米粒大的淡褐色的斑疹。
组织病理符合上述临床诊断的是A. 表皮基底层细胞表皮突中黑素含量轻度至中度增多B. 表皮角化过度C. 表皮黑素细胞增多D. 真皮上部血管周围嗜黑素细胞增多E. 真皮血管周淋巴细胞浸润2. 患者,女性,18岁。
面部、手背部皮疹10余年,不痛不痒,日晒后加重。
查体:面部、手背部可见散在的米粒大的淡褐色的斑疹。
目前不适当的处理是A. 避免日光照射B. 外用2%~3%氢醌霜C. 液氮冷冻D. Alex755nm激光E. 外用化学剥脱剂3. 患者,男性,20岁。
主因颈部白斑就诊。
在出生后3个月颈部即出现白斑,曾自用外用药治疗,无疗效。
查体:沿颈部点片状的色素减退斑上无鳞屑,边缘呈锯齿状,周围无色素增殖晕,局部刺激有红斑反应。
最可能的诊断是A. 花斑癣B. 单纯糠疹C. 无色素痣D. 贫血痣E. 白癜风4. 患者,男性,20岁。
主因颈部白斑就诊。
在出生后3个月颈部即出现白斑,曾自用外用药治疗,无疗效。
查体:沿颈部点片状的色素减退斑上无鳞屑,边缘呈锯齿状,周围无色素增殖晕,局部刺激有红斑反应。
可使用的治疗方法是A. 自体表皮移植B. 308nm准分子激光C. 外用糖皮质激素乳膏D. 窄波中波紫外线治疗E. 外用他克莫司软膏A1/A2题型1. 以下属于局限型白癜风类型的是( )A. 寻常型B. 泛发型C. 面肢端型D. 混合型E. 节段型2. 以下属于黑变病典型皮损发展期的是( )A. 进展期B. 色素沉着期C. 静止期D. 退行期E. 红斑期3. 下列哪项是错误的A. 皮肌炎可合并内脏恶性肿瘤B. 大疱性类天疱疮可合并内脏恶性肿瘤C. 假性黑棘皮病多合并内脏恶性肿瘤D. 巨大型兽皮痣可能发生癌变E. 着色性干皮病易发生恶性肿瘤4. 白癜风属于A. 多基因遗传B. 单基因遗传C. X连锁显性遗传D. 性连锁隐性遗传E. 与遗传无关5. 下列疾病需与雀斑鉴别,但除外A. 着色性干皮病B. 咖啡斑C. 雀斑样痣D. 蒙古斑E. 黄褐斑6. 黄褐斑的药物治疗疗程至少为A. 2周B. 4周C. 6周D. 8周E. 10周7. 下面白癜风最常见的类型是A. 全身型B. 节段型C. 黏膜型D. 散发型E. 泛发型8. 女性,出生1周,躯干两侧出现水疱、风团样损害,无发热。
2023皮肤科住院医师色素障碍性皮肤试卷(练习题库)

皮肤科住院医师色素障碍性皮肤试卷(练习题库)1、关于白瘢风的论述,错误的是()2、关于白瘢风临床表现描述,错误的是O3、临床上哪一种药物引起黄褐斑最常见O4、属于常染色体显性遗传色素沉着病的是O5、有关黑变病下列哪项不正确O6、关于雀斑下列哪一项不正确()7、白瘢风在我国人群的发病率约为O8、系统性应用糖皮质激素可用于以下哪种疾病的治疗O9、白瘢风的典型组织病理学表现为O10、以下关于白瘢风皮损的描述正确的是O11、关于白瘢风的描述错误的是()12、白瘢风的病程正确的是O13、决定皮肤颜色的主要因素是()14、白瘢风典型皮损为()15、以下关于雀斑的描述错误的是()16、可能属于常染色体显性遗传性色素沉着病为O17、白瘢风皮损处O18、以下因素与黄褐斑无关的是O19、以下关于黄褐斑的描述不正确的是O20、以下有关黑变病的描述正确的是O21、下列哪项不正确O22、黑变病典型皮损发展不含下列哪期O23、下列配对哪项正确O24、下列哪项正确()25、有关黑变病下列哪项正确()26、关于雀斑下列哪项不正确O27、下列哪项是有关白瘢风的描述()28、关于白瘢风发病机理的学说有O29、根据皮损范围和分布可将白瘢风分为O30、白瘢风的治疗包括O31、妊娠时特别出现色素增加的部位是O32、日晒可能加重病情的疾病有O33、黄褐斑的发病与哪些因素有关()34、白瘢风进展期可出现O35、色素性皮肤病包括O36、以下不属于色素障碍性皮肤病包括()37、下列哪些与白瘢风有关()38、关于白瘢风下列哪些学说是正确的()39、下列哪些与雀斑有关()40、白瘢风病因相关的有()41、日晒后可加重的疾病有O42、黑变病的发生和下列哪些有关O43、可以系统应用糖皮质激素治疗的疾病为O44、黑变病的发展分下列几期O45、白瘢风进展期可诱发同形反应的有()46、黑变病的病因可能为O47、白瘢风自体表皮移植方法包括()48、下列属于泛发性白瘢风的类型O49、同形反应可见于以下哪些疾病()50、试述何谓自体表皮移植。
温阳活血化水法治疗面部Riehl黑变病临证心得_闫雨荷

·762·温阳活血化水法治疗面部Riehl黑变病临证心得闫雨荷吴小红(中国中医科学院广安门医院皮肤科,北京100053)通信作者:吴小红,E-mail:wuxiaohongmail@【摘要】根据面部Riehl黑变病的临床表现,参考《金匮要略》中相关“黑疸”的病机及治则,认为此病的发病与肝、肾有关,病因病机除肝肾不足、气滞血瘀外,水湿痰浊蒙蔽清窍、清阳不升可能亦是其核心病机,临证中采用滋肾疏肝健脾、温阳活血化水法治疗收效明显。
【关键词】Riehl黑变病;面部;水湿痰浊证;温阳活血化水法;中医药疗法DOI:10.16025/j.1674-1307.2016.08.015Riehl黑变病由奥地利人Riehl于1917年首先报道[1],临床表现为面、颈、四肢暴露处淡褐色或紫褐色斑,排列成网点状,后逐渐融合成大小不一的斑片,上覆微细粉状鳞屑,呈粉尘样外观,与正常皮肤界限不明显,可伴有毛囊角化。
典型的皮肤损害病变过程分炎症期、色素沉着期及萎缩期3期。
临床中以Riehl面部黑变病多见,常发于中年女性,近年来,随着环境污染、精神压力大等因素,面部黑变病患病率逐渐增加,但无有效治疗方法[2],传统的中医辨证治疗有一定疗效,但疗程长。
笔者在临床中发现,面部黑变病病机除肝肾不足,气滞血瘀外,水湿痰浊蒙蔽清窍,清阳不升是其核心病机,采用滋肾疏肝健脾、温阳活血化水法治疗疗效显著。
分析如下。
1西医发病机制与治疗现状面部黑变病病因及发病机制不清[1],目前认为属中毒性黑皮病的一个病期,除烃类化合物(煤焦油和石油的衍生物)的毒性作用外,还与紫外线照射及个人因素有关,神经、内分泌系统机能障碍亦可能是导致本病的诱因。
研究认为,本病可能与饮食、环境及日用品污染有关,尤其是染发制品。
临床中本病需与其他色素沉着疾病鉴别,如黄褐斑、西瓦特皮肤异色病(Civatte poikiloderma)、血管萎缩性皮肤异色病、砷剂黑变床治疗的难题,也是发挥中医药治疗的优势所在。
木糖醇的生产工艺及应用研究进展

木糖醇的生产工艺及应用研究进展杨建翔(云南中医学院,11级食科班,食品科学与工程)摘要:综述了木糖醇的2种不同的生产工艺,分析了各种工艺的优缺点,并介绍了对传统工艺的改进,还阐述了木糖醇在医药、食品、塑料等领域中的应用研究进展。
关键词:木糖醇;合成;生物转化;发酵;应用木糖醇( Xylitol) 是一种白色粉末或白色晶体的五碳糖醇,热量低于蔗糖,甜度和溶解度与蔗糖相近[1],具有良好的热稳定性、吸湿性、不易发酵、不易发生美拉德反应等多种加工特性,同时还具有防龋齿、改善肝功能、抗酮体功能、促进肠道内双歧杆菌的增殖等多种保健功能[2]。
因此,木糖醇作为一种糖源常出现在功能食品中。
在人们日益注重健康、注重保健的今天,木糖醇在食品中的应用研究虽已有许多报道[3]。
在自然界中,其广泛存在于黄梅、覆盆子、草莓、莴苣、花椰菜等许多水果和蔬菜中,但含量很低,直接提取不仅困难而且经济性差,目前工业上主要用木糖催化加氢的方法生产。
商品木糖醇是用玉米芯、甘蔗渣等,经过深加工而制得的,是一种天然健康的甜味剂。
木糖醇有一定的吸湿性,并具有甜味,甜度相当于蔗糖,发热量相当于葡萄糖,且精制木糖醇可食用并易被人体吸收,故具有广泛的用途。
近年来,国内外科学工作者对木糖醇的生产工艺进行了坚持不懈的研究与开发,在工艺改进方面取得了不错的进展.1 木糖醇的生产工艺木糖醇的生产工艺大致可分成2种:化学合成法、生物转化法。
1.1化学合成法化学合成法其基本原理为多缩戊糖(如木聚糖)经酸(如HCl、H2SO4)水解可得D-木糖,D-木糖在镍催化剂的作用下加氢制得木糖醇,反应式如下:[C 5H 8O 4]n+nH 25H 10O 5] C 5H 10O 5+ HC 5H 12O 5多缩戊糖 水 木糖 木糖 氢气 木糖醇化学合成法有2条典型工艺,即:中和脱酸工艺和离子交换脱酸工艺[3]。
1.1 .1中和脱酸工艺中和脱酸工艺就是在净化水解液时采用中和法。
白癜风诊疗指南2014

白癜风诊疗指南2014本指南以中国中西医结合学会皮肤性病专业委员会色素病学组制订的白癜风治疗共识(2009版)为基础,经色素病学组、中华医学会皮肤科分会白癜风研究中心部分专家及国内相关专家讨论制定。
白癜风治疗目的是控制皮损发展,促进白斑复色。
一、选择治疗方法时主要考虑因素:1.病期:分进展期和稳定期。
进展期判定参考白癜风疾病活动度评分(VIDA)积分[1]、同形反应、Wood灯。
①VIDA积分:近6周内出现新皮损或原皮损扩大(+4分),近3个月出现新皮损或原皮损扩大(+3分),近6个月出现新皮损或原皮损扩大(+2分);近1年出现新皮损或原皮损扩大(+1分);至少稳定1年(0分);至少稳定1年且有自发色素再生(-1分)。
总分>1分即为进展期,≥4分为快速进展期;②同形反应:皮肤损伤1年内局部出现白斑。
损伤包括物理性(创伤、切割伤、抓伤)、机械性摩擦、化学性/热灼伤、过敏性(接触性皮炎)或刺激性反应(接种疫苗、纹身等)、慢性压力、炎症性皮肤病、治疗性(放射治疗、光疗)。
白斑发生于持续的压力或摩擦部位,或者是衣物,饰品的慢性摩擦部位,形状特殊,明显由损伤诱发;③Wood灯:皮损颜色呈灰白色,边界欠清,Wood灯下皮损面积大于目测面积,提示是进展期。
皮损颜色是白色,边界清,Wood灯下皮损面积≤目测面积,提示是稳定期。
以上3条符合任何一条即可考虑病情进展;④可同时参考激光共聚焦扫描显微镜(简称皮肤CT)[2]和皮肤镜的图像改变,辅以诊断。
2.白斑面积(手掌面积约为体表面积1%):1级为轻度,<1%;2级为中度,1%~5%;3级为中重度,6%~50%;4级为重度,>50%。
白斑面积也可按白癜风面积评分指数(vitiligo area scoring index,VASI)来判定。
VASI=Σ(身体各部占手掌单元数)×该区域色素脱失所占百分比,VASI值为0~100[3]。
3.型别:根据2012年白癜风全球问题共识大会(VGICC)及专家讨论,分为节段型、非节段型、混合型及未定类型白癜风。
黄褐斑的综合治疗-

黄褐斑的综合治疗-发布时间:2021-10-10T07:47:04.376Z 来源:《医师在线》2021年12期作者:杜垚森[导读]杜垚森 (成都市双流区中医医院皮肤性病科;四川成都610200) 黄褐斑也称肝斑,为面部的黄褐色色素沉着。
多对称蝶形分布于颊部。
主要出现在女性人群,主要是因为血液中雌激素升高所致,其发病与月经紊乱、长期口服避孕药、妊娠等因素相关。
面部黄褐斑会对女性的面容造成极大的影响,会引起女性极大的心理负担和精神负担。
疾病病因。
黄褐斑主要发生于女性,主要是因为血液中雌激素水平升高所致。
导致雌激素水平升高的因素为妊娠、长期使用避孕药、月经紊乱等。
此外与一些疾病相关如结核、慢性乙醇中毒等有关。
日光可促使发病。
男性发病占10%,研究发现,男性出现黄褐斑主要与遗传因素相关。
临床表现。
黄褐斑为黄褐色斑片,主要分布于双侧面颊,也可出现在其他部位比如眶周、前额、上唇等,以面颊部最集中、明显。
无主观症状和全身不适。
色斑可有浅黄和深黄之分,主要与日晒,内分泌因素有关。
长期熬夜、过度疲劳、生活作息不规律可加重皮损。
黄褐斑的危害。
黄褐斑的危害较多,可能导致身体内部出现问题。
比如黄褐斑患者可伴有面色萎黄、容易暴躁、食欲不振、精神不佳、月经失调等等问题,甚至一些患者可以出现肝胆方面的疾病以及子宫肌癌、囊肿等;黄褐斑会直接影响到女性的自信和心情,伴随而来的症状又可以直接、间接的影响到日常生活,给女性带来极大的心理负担;黄褐斑可能是代谢紊乱、体内废物淤积的一种表现,当出现黄褐斑的同时也可能是身体内部正在发生病理变化的过程中,可并发生殖器官、肝病等。
因此黄褐斑需要积极预防治疗。
黄褐斑的综合治疗1、系统用药。
(1)维生素c和维生素e。
维生素C可很大程度的降低酪氨酸酶活性,使黑色素的形成受阻,并且可以将已经形成的黑色素部分还原为无色物质和水溶性胶状物,降低黄褐斑颜色深度,逐渐改善黄褐斑。
适用于系统性治疗黄褐斑。
采用电离子透入法之用微生物C得到的效果最好。
白癜风诊疗方案

白癜风诊疗共识(2014版) ---- 文字完整版中国中西医结合学会皮肤性病专业委员会色素病学组本指南以中国中西医结合学会皮肤性病专业委员会色素病学组制订的白癜风治疗共识(2009版)为基础,经色素病学组、中华医学会皮肤科分会白癜风研究中心部分专家及国内相关专家讨论制定。
参加起草及讨论的成员(按姓氏汉语拼音排序):傅雯雯、高天文、何黎、贾虹、李恒进、李铁男、李珊山、卢忠、鲁严、李春英、李强、刘清、马东来、乔树芳、秦万章、宋智琦、孙越、宋秀祖、涂彩霞、温海、王玮蓁、许爱娥、项蕾红、张学军、张建中、郑志忠、赵广、朱光斗。
白癜风治疗目的是控制皮损发展,促进白斑复色。
一、选择治疗方法时主要考虑因素:1.病期:分进展期和稳定期。
进展期判定参考白癜风疾病活动度评分(VIDA)积分、同形反应、Wood灯。
①VIDA积分:近6周内出现新皮损或原皮损扩大(+4分),近3个月出现新皮损或原皮损扩大(+3分),近6个月出现新皮损或原皮损扩大(+2分);近1年出现新皮损或原皮损扩大(+1分);至少稳定1年(0分);至少稳定1年且有自发色素再生(一1分)。
总分>1分即为进展期,≥4分为快速进展期;②同形反应:皮肤损伤1年内局部出现白斑。
损伤包括物理性(创伤、切割伤、抓伤)、机械性摩擦、化学性/热灼伤、过敏性(接触性皮炎)或刺激性反应(接种疫苗、纹身等)、慢性压力、炎症性皮肤病、治疗性(放射治疗、光疗)。
白斑发生于持续的压力或摩擦部位,或者是衣物/饰品的慢性摩擦部位,形状特殊,明显由损伤诱发;③Wood灯:皮损颜色呈灰白色,边界欠清,Wood灯下皮损面积大于目测面积,提示是进展期。
皮损颜色是白色,边界清,Wood灯下皮损面积≤目测面积,提示是稳定期。
以上3条符合任何一条即可考虑病情进展;④可同时参考激光共聚焦扫描显微镜(简称皮肤CT)和皮肤镜的图像改变,辅以诊断。
2、白斑面积(手掌面积约为体表面积1%):1级为轻度,<1%;2级为中度,1%-5%;3级为中重度,6%-50%;4级为重度,>50%。
银杏果外种皮多糖的脱色工艺及抗氧化活性研究
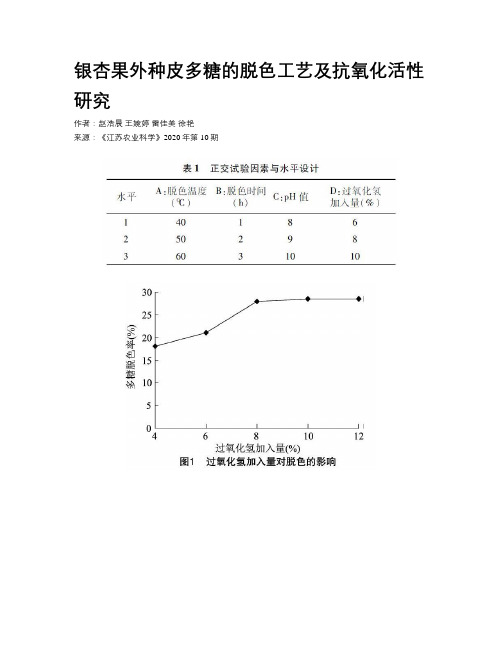
银杏果外种皮多糖的脱色工艺及抗氧化活性研究作者:赵浩晨王婉婷雷佳美徐艳来源:《江苏农业科学》2020年第10期摘要:以银杏果肉质外种皮为原料,采用水提醇沉法提取其水溶性多糖。
以过氧化氢为脱色剂,多糖脱色率和保留率为指标,脱色时间、脱色温度、pH值和过氧化氢体积分数为试验因素,进行单因素试验,以确定影响脱色的因素及其水平,采用L9(34)正交设计进行优化试验。
采用1,1-二苯基-2-三硝基苯肼(DPPH)法、还原力测定法对多糖进行抗氧化活性检测。
结果表明,脱色温度为 60 ℃,脱色时间为1 h,pH值为8,过氧化氢加入量为8%时脱色效果最佳。
抗氧化测定结果表明,银杏外种皮多糖具有良好的抗氧化活性,脱色后抗氧化活性略有降低。
关键词:银杏果;外种皮;过氧化氢;脱色;多糖;抗氧化活性中图分类号: R284.2 ;文献标志码: A ;文章编号:1002-1302(2020)10-0228-04收稿日期:2019-04-09基金项目:沈阳农业大学大学生科技创新項目(编号:201810157338)。
作者简介:赵浩晨(1996—),男,辽宁抚顺人,主要从事生物工程研究。
E-mail:99644880@。
通信作者:徐艳,博士,讲师,主要从事天然产物活性研究。
E-mail:1472105886@。
银杏(Ginkgo biloba L.)果,俗称白果,其营养非常丰富,在许多国家和地区均有大量分布,自古以来被当作营养丰富的高级滋补品[1]。
目前,对银杏叶和果的研究已取得了很多进展[2-4],但对银杏果果外种皮的研究还较少。
银杏果外种皮是银杏种子硬壳外面的肉质部分,长期以来被作为废物丢弃,既浪费了资源,又污染了环境[5]。
据统计,我国每年约有3万t外种皮作为废物被丢弃。
近几年的研究表明,银杏外种皮具有多方面药理活性,有较高的利用价值[6]。
银杏外种皮含有多种化合物,包括多糖、酚酸、黄酮、银杏内酯等[7-9]。
其中,多糖含量最高,且具有抗氧化、抑菌、增强免疫力等多种生物活性[10-11]。
药物水光注射治疗黄褐斑对患者CK10、SOD及MDA表达水平的影响

药物水光注射治疗黄褐斑对患者CK10、SOD及MDA表达水平的影响李卉;胡霜红;王娟;陈苇苇【摘要】目的:探讨药物水光注射治疗黄褐斑的疗效及对患者细胞角蛋白10(Cytokeratin 10,CK10)、超氧化物歧化酶(Superoxide dismutase,SOD)及丙二醛(Malondialdehyde,MDA)表达水平的影响.方法:选取笔者医院2016年5月-2017年5月收治的黄褐斑患者160例,随机分为传统组与药物组,每组80例.传统组采用传统穴位注射法治疗,药物组采用药物水光注射治疗.观察两组患者额部病损皮肤基底上层CK10表达程度、血清SOD、MDA水平并进行比较分析.结果:治疗后,药物组与传统组CK10表达程度明显减弱,药物组明显低于传统组,差异有统计学意义(P<0.05).药物组与传统组SOD表达水平均显著升高,药物组明显高于传统组,差异有统计学意义(P<0.05).药物组MDA水平明显低于治疗前,差异有统计学意义(P<0.05);传统组MDA下降不明显,差异无统计学意义(P>0.05).药物组总有效率为93.75%显著高于传统组的75.00%,差异有统计学意义(P<0.05).结论:应用药物水光注射治疗黄褐斑,可降低病损皮肤基底上层CK10表达程度,改善血清SOD和MDA水平,疗效较好.【期刊名称】《中国美容医学》【年(卷),期】2018(027)007【总页数】4页(P75-78)【关键词】水光注射;黄褐斑;细胞角蛋白10;超氧化物歧化酶;丙二醛【作者】李卉;胡霜红;王娟;陈苇苇【作者单位】湖北省中医院湖北省中医药研究院美容科湖北武汉 430061;湖北省中医院湖北省中医药研究院美容科湖北武汉 430061;湖北省中医院湖北省中医药研究院美容科湖北武汉 430061;湖北省中医院湖北省中医药研究院美容科湖北武汉 430061【正文语种】中文【中图分类】R758.4+2黄褐斑主要表现为黄褐色及淡黄色斑片,主要在两颊和前颊部分,属于获得性色素沉着皮肤病[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
外用脱色剂进展摘要: 随着对色素沉着机理研究的不断深入,外用脱色剂的研究越来越深入,一些新的天然产生和已知脱色剂的衍生物表现出广阔的发展前景。
临床上则倾向于联合使用多种脱色剂治疗色素增多性皮肤病。
对近年来皮肤外用脱色剂的研究进展进行了综述。
色素增多性皮肤病是遗传因素和环境因素作用的结果。
近年来随着对色素沉着机理研究的不断总结深入,外用脱色剂的研究也取得了重要的进展。
现按作用机理将外用脱色剂大致分类综述如下:一、酪氨酸酶(TYR)活性抑制剂TYR是黑素生成的关键酶,对TYR 活性的调节,可直接影响黑素的合成。
氢醌:氢醌是最常用的脱色剂,它对TYR活性具有抑制作用。
它能有效的治疗各种色素增多性皮肤病,常用浓度为1.5%-4%[4],但过度使用会产生褐黄病[2]。
Amer等[3]用4%的氢醌霜和广谱遮光剂联合治疗黄褐斑、炎症后色素沉着和雀斑(疗程12周),好转及显著好转分别为89.5%、75%和44.4%。
氢醌还可以与维A酸和(或)皮质类固醇联合治疗黄褐斑[4,5]。
值得注意的是,氢醌有高度诱发突变及细胞毒作用[1]。
Bolognia等[6]用黑素瘤细胞(melanoma cell)株研究发现DL-buthionine sulfoximine (BSO)或胱胺与氢醌合用增强醌对TYR活性或黑素形成的抑制作用。
5%的BSO与2%或4%的氢醌合用对C57BL鼠的痛部皮肤的毛发色素具有协同减退作用。
Bolognia等认为将来可能会用BSO/氢醌或胱胺/氢醌治疗黄褐斑、炎症后色素沉着等皮肤病。
熊果甙[7]:熊果甙是从植物熊果中提取的活性成分,它是一种安全而温和的外用脱色剂。
在非中毒浓度下它对TYR活性有可逆的抑制作用,但对TYR的mRNA的表达水平没有影响。
临床上用3%的熊果甙洗剂、霜剂等对28例黄褐斑患者进行了试验性治疗,每日2次。
3个月后皮损面积减少,着色变淡,好转及显著好转率为71.4%。
氢醌-α- 糖甙[8]:该化合物对TYR活性的抑制能力与熊果甙极相似。
外用氢醌-α-糖甙或熊果甙均能使豚鼠的黑素合成减少80%左右。
曲酸:曲酸是TYR活性抑制剂[2,9]。
Garcia等[2]用5%果酸/2%曲酸凝胶和5%果酸。
2%氢醌凝胶以脸部双侧作对比观察,治疗了39例黄褐斑患者,疗程为3个月。
结果色素强度平均减少了58%。
两种治疗方案的效果无统计学差异,均可用于治疗黄褐斑。
甲基龙胆酸盐[1]:甲基龙胆酸盐是植物龙胆的成分之一,它可选择性抑制TYR 活性。
尽管它的作用强度比氢醌弱,但它在浓度<60mg/ml时对活的黑素细胞的黑素的起始合成阶段即有抑制作用,而且无细胞毒及诱发突变作用。
它被认为是一种极可能替代氢醌的新的脱色剂。
目前甲基龙胆酸盐及其衍生物的药物开发和临床试验正在进一步研究中。
L-抗环血酸-2-磷酸镁(VC-PMG)[10]:研究表明,维生素C能通过减少邻醌类物质而抑制黑素的产生,可能黑素形成的多个氧化步骤有抑制作用。
由于维生素C水溶液状态中不稳定,后来合成出VC-PMG。
VC-PMG在肝或皮肤中被水解成维生素C而发挥药理作用,它直接或间接抑制黑素形成。
用KHm-1/4人黑素瘤细胞与1%VC-PMG培养3天,黑素形成被抑制约48%±5%,而对细胞的生长只有轻微的抑制作用。
临床上用10%的VC-PMG霜治疗了34例黄褐斑、雀斑等患者,结果表明、19例患者有效或较有效。
壬二酸[11]:实验室和临床试验表明、壬二酸对功能亢进的黑素细胞的TYR活性、线粒体酶和(或)DNA的合成均有抑制作用,对很多色素增多性疾病有治疗作用。
Graupe等治疗了50例黄褐斑患者,随机分成两组,1组单用20%的壬二酸霜,另1组将20%的壬二酸霜与0.05%维A酸霜联用,疗程6个月,治疗期间所有患者均使用广谱遮光剂。
结果表明,20%的壬二酸霜不管单用还是与0.05%维A酸霜联用,好转及显著好转率均达到73%左右,但联用,好转率(34.8%)明显优于单用组(5.3%),而且前3个月的色素沉着的减退作用也明显快于单用组。
患者对两种治疗方法的耐受性一般都很好,未出现明显的副作用。
皮质类固醇:Kanear等[12]用0.05%的丙酸氯倍他索霜与遮光剂联合治疗了19例黄褐斑患者。
其中3例因出现局部萎缩和毛细血管扩张于第4周终止治疗,另7例使用6-8周后色素清除率即达80%-90%。
但疗效不巩固,停药4-6个月后又恢复原状。
皮质类固醇的脱色机制不甚明了。
有人认为它能阻断TYR[13],Kanwar等则用皮质类固醇可能抑制黑素细胞的代谢产物的分泌而对黑素细胞无破坏作用的观点解释其疗效短暂的原因。
由于皮质类固醇具有见效快的优点,该作者提出先用皮质类固醇治疗8周。
再用其它脱色剂维持治疗的设想[12]。
Feldamycin[14]:这是从Streptomyces caluas 中分离出来的新的脱色剂。
Feldamycin对鼠B16黑素瘤细胞的黑素聚集有抑制作用,其IC50为5μFeldamycin对TYR活性无直接抑制作用,对TYR的基因表达的调节也无影响,但它能增加对TYR的糖基化修饰(该糖基化修饰程度越高,TYR活性就越低)。
Feldamycin是一种新型脱色剂的结构原型,由此合成出的系列类似物也具有类似的作用。
蔷薇科植物提取物: Matsuda等[15]对38种蔷薇科植物的叶的50%乙醇提取物进行了脱色剂筛选。
其中樱花和大叶佳樱对TYR 活性有很强的抑制作用,在浓度为500μg/ml时,其抑制率分别为80.6%和79.3%。
樱花和大叶桂樱对多巴色素自动氧化生成黑素的环节也具有抑制作用。
在浓度为1000μg/ml,樱花、大叶桂樱、曲酸(对照组)的抑制率分别为34.1%、30.1%、56.4。
另外,大叶桂樱对B16鼠黑素瘤细胞的TYR活性及黑素含量也有抑制作用。
结果提示大叶桂樱的提取物可用作皮肤增白剂。
另外,半胱氨酸、4-硫代雷琐辛、3-氨基酪氨酸、5-羟基-2-2羟甲基-γ-吡啶酮、长春花及甘草提取物等也具有抑制TYR活性的作用[8,9]。
二、兼有清除自由基作用的TYR活性抑制剂有些脱色剂除了能抑制TYR活性外,还具有清除自由基的作用。
黑素生成被自由基所驱动,所以自由基清除剂可能会抑制黑素生存,具有皮肤增白作用的生育酚和超氧化物岐化酶(SOD)就是公认的自由基清除剂[9]。
小构树素F[9,16]:小构树素F(Kazinol F)是从植物小构树根皮中提取出来的,其化学结构为5-[3-]2,4-二羟基苯基)丙基]-3,4-二(3-甲基-2-丁炊烯基)-1,2-苯二酚,它对TYR活性有很强的抑制作用,与维生素C、曲酸及氢醌作比较,其IC50分别为0.396、70、10和5.5μg/ml.小构树素F还有较强的清除自由基作用,与α生育酚、维生素C作比较,SC50(清除50%自由基所需的浓度)分别为6.7、9.5、3.3μg/ml。
小构树素F能减退豚鼠皮肤的色素,对人类皮肤无激惹现象,它是一种发展前景非常乐观的脱色剂。
杨梅提取物:Matsuda等[17]发现杨梅叶和皮的50%乙醇提取物在500μg/ml浓度下对TYR活性的抑制率分别为70%和73.7%,对照组曲酸(10μg/ml)的抑制率为98.5%。
从杨梅的叶中分离出3个黄酮醇化合物(槲皮素、杨梅树皮素及杨梅树素-3-O-鼠李糖甙),其中槲皮素抑制TYR活性的能力最强,浓度在50μg/ml时,其抑制TYR率达67.7%。
两种杨梅提取物还具有SOD样作用,在50μg/ml浓度时,对次黄嘌呤-黄嘌呤-氧化酶所产生的超阴离子的抑制率为70%-80%。
结果提示,杨梅叶和皮的提取物可以作为皮肤增白剂使用。
熊果属植物提取物:Matsuda等[18]对6种熊果属植物叶的50%乙醇提取物研究后发现它们均有抑制TYR活性的作用,其中Arctostaphylospatula和A.viscida提取物表现出很强的抑制作用,其IC50分别为132.9和144.2μg/ml,对照组熊果甙>5.0mM,曲酸为0.0207mM。
此外,该两种提取物还具有很强的SOD样作用,其IC50分别为15.8和16.0mg/ml,对照组熊果甙>l0.05mM,SOD为0.02U/ml。
结果表明,熊果属植物(尤其是A.patulat和A.uiscida)叶的提取物可用于皮肤增白。
; 三、遮光剂紫外线是引起黑素增加的因素之一,其中又以中波红外线(UVB)最为重要[1,19]。
UVB会使活性氧组分增加[13],黑素合成能力增加。
遮光剂具有吸收、散射及反射紫外线的能力,能减少上紫外线的有害影响[9,19],它常与其它脱色剂联合治疗色素增多性皮肤病[3,5,11,12,21]。
遮光剂包括物理遮光剂和化学遮光剂两大类。
近年来,遮光剂的研究主要集中在化学遮光剂方面。
对氨基苯甲酸(PABA)酯类[19]:PABA能选择性吸收UVB,其主要优点是能透过角质层和作用持久,但对衣物着色,且引起皮肤干燥、紧张、刺痛感甚至产生过敏等副作用。
通过对PABA的酯类衍生物的研究,筛选出Padimate o,该化合物对衣服不着色,很少发生接触性皮炎,而且制剂的相容性特别好,它是目前美国市场上销量最大的化学遮光剂。
肉桂酸酯类[19]:肉桂酸酯类能选择性吸收UVB。
2-乙基已基对-甲氧基因肉桂酸酯为欧洲最常用的肉桂酸酯,一般浓度为2%-2.5%. 邻氨基苯甲酸酯类[19]:能选择性吸收长波紫外线(UVA)。
主要包括邻氨基苯甲酸孟基酯和高孟基N-乙酰邻氨基苯甲酸酯等。
二苯甲酮类[19]:该类化合物主要有二羟苯甲酮、sulisobenzone和羟苯甲酮等。
它们主吸收UVA。
为了扩大波谱吸收范围,邻氨基苯甲酸酯类和二苯甲酮类化合物通常与肉桂酸酯类联合使用。
褪黑激素:最近,Dreher等[22]报道了褪黑激素,α生育酚、维生素C合用对人体皮肤具有保护作用,又有遮光作用,褪黑激素既有强的清除自由基的作用,又有遮光作用;α生育酚具有抗氧化、紫外线的作用;而维生素C则具有再生生育酚的功能。
据此褪黑激素(尤其是上述三者合用)可能会成为新的遮光剂。
四、黑素细胞毒类4-羟基苯甲醚:该化合物可能是通过选择性地引起黑素细胞中毒而引起脱色作用。
单用时需要较高浓度,对皮肤刺激较大。
Nair等通过两种Yucatan微型小猪色素过度沉着模型的研究,发现低浓度的4-羟基苯甲醚(4%)和维A酸(0.01%)在治疗皮肤色素过度沉着时有协同作用。
产生协同作用的机制尚不十分明了,很有可能不只是一种作用机制参与。
N-乙酰基-4-S半胱胺基酚(NASC)[4]:与氢醌相比,NASC具有性质稳定、疗效好、对皮肤刺激少等优点。
它对活动性黑素细胞具有毒性作用,但休眠期的黑素细胞及黑素细胞前体增色无此作用。
