聚乙二醇重组人生长激素 注射液的研制与开发
聚乙二醇化重组人生长激素的免疫原性、生物活性及药代动力学研究

安徽大学硕士学位论文聚乙二醇化重组人生长激素的免疫原性、生物活性及药代动力学研究姓名:陈金武申请学位级别:硕士专业:生物化学与分子生物学指导教师:宋礼华20070501一前言线状PEG分支状PEG图2分支:btPEG与线状PEG修饰蛋白质的比较分子量大于lkD的PEGEI服、静脉注射或是经皮肤给药时,无毒性。
过去,多肽和蛋白质只能从天然物质中提纯获得,随着基因工程的发展,这个障碍己基本克服。
但此类药物稳定性差、血浆半衰期短、具有免疫原性,使其在生产和应用方面受到极大限制.70年代末人们用聚乙二醇修饰牛肝过氧化氢酶,很好地改善了其免疫原性和循环时间。
目前,PEG修饰技术正成为大分子药物传递系统研究的热点之--119-20l。
3PEG修饰对蛋白质类药物的影响3.1降低免疫原性消除或降低蛋白质等高分子的抗原性效果明显【211.}天门冬酰胺酶用PEG修饰后可消除抗原性。
PEG化过程中对赖氨酸的修饰将部分或全部地掩盖表面抗原决定簇,从而降低免疫原性。
某些基因工程类药物疏水性强、缺少糖基,在中性pH值的环境中易凝集,而凝集物具有潜在的引起免疫应答的可能,PEG修饰增加蛋白质的亲水性,减少蛋白质凝集物的形成,从而降低免疫反应的发生1221.3.2延长半衰期许多蛋白等高分子经PEG修饰后,抗蛋白水解酶、抗抑制剂等失活因子的能力和热稳定性提高,其体内半衰期比天然蛋白质等高分子长,对提高蛋白质等高分子的药用疗效极具意义[231。
L-天门冬酰胺酶经PEG修饰后,体内半衰期可延长13倍。
被修饰药物半衰期延长的机制可能有以下原因:①在分子量为15.70kD的范围内,肾脏清除蛋白质的速率与分子量大小成负相关,蛋白质分子越大,肾脏清除减慢;②蛋白酶,如胃蛋白酶、胰蛋白酶等酶类,对修饰后蛋白质的水解作用减弱1241;@PEG修饰后的蛋白质对网状内皮系统有抗性,而网状内皮系统负责外源蛋白的清除【25】。
聚7.--醇化重组人生长激素的免疫原性、生物活性及药代动力学研究四实验结果l聚乙二醇化重组人生长激素免疫原性分析1.1免疫印迹Western-Blot免疫印迹(图1-1)结果显示,PEGm,trGH与两个阳性对照rhGH、PEGmrGH都显色,而阴性对照白蛋白并未显色,说明两种修饰物都能与rhGH单克隆抗体特异性地结合,具有相似的免疫反应性,两种mPEG的修饰都没有改变rhGH的抗原决定簇。
长春高新重磅新药——长效生长素二轮评审重新启动

以下两图是长春高新长效生长素(聚乙二醇重组人生长激素注射液)的新药申请最新进展,图片来自药监会官网。
结合下图,进行简要分析,和各位长春高新博友分享。
长春高新长效生长素(聚乙二醇重组人生长激素注射液)的新药上市申请,从2008年7月15日开始,截止目前,历时3年半有余,2月14日重新开始第二轮的第二次补充材料评审,正所谓,事不过三,相信这次是最后一次补充材料(即这次评审将会正式发放新药证书)。
那么,这次的评审会花费多长时间呢?可以结合历史和有关规定来预测。
1)悲观预期:与第一次补充材料的评审用一样的时间,即8个月(第一次2010.11.25日收到补充资料,2011.7.27日评审结束)。
根据常识,第二次补充的材料肯定比第一次要少,所以评审时间相比上次只会少不会多,因此悲观预期是8个月;
2)乐观预期:1个月。
根据药监会的有关规定,补充资料走特殊程序一般需要25个工作日。
而聚乙二醇重组人生长激素注射液正是走的特殊程序。
取整数,即乐观预期一个月。
若按乐观预期,长效生长素2012年即可贡献利润。
若按悲观预期,长效生长素真正贡献利润估计要到2013年。
但是股价一般会提前反应预期,结合目前的市场估值较低,估计近期长春高新会有一波比较可观的上扬。
以上分析,仅供参考!。
ELISA法研究聚乙二醇重组人生长激素注射液单次给药人体药代动力学

ELISA法研究聚乙二醇重组人生长激素注射液单次给药人体药代动力学和凡;钟国平;肖楚瑶;伍婉媚;何艳玲【期刊名称】《国际医药卫生导报》【年(卷),期】2017(023)011【摘要】目的建立ELISA方法研究聚乙二醇重组人生长激素(PEG-rhGH)注射液单次给药人体药代动力学.方法将30名健康受试者随机分成4组(其中两组为自身对照),分别单次皮下注射PEG-rhGH注射液(0.1 mg·kg-1、0.2 mg·kg-1、0.4 mg·kg-1)、注射用重组人生长激素(rhGH)(0.067mg· kg-1).ELISA法测定不同时间点PEG-rhGH、rhGH的血药浓度,并计算药代动力学参数.结果 PEG-rhGH、rhGH血药浓度分别在0.312 5~40.0000 ng·ml-1、0.312 5~10.0000 ng· ml-1范围内线性关系良好,最低检测性均为0.312 5ng· ml-1,批间、批内RSD均<15%. PEG-rhGH(0.1、0.2、0.4 mg·kg-1)、rhGH(0.067mg· kg-1)的t1/2分别为:(31.70±4.70)h、(32.19±4.58)h、(30.39±5.93)h、(1.95±0.44)h,Tmax为:(22.20±9.82)h、(29.40±10.75)h、(40.80±8.39)h、(3.20±1.10)h,Cmax:(105.24±45.37)ng·ml-1、(379.09±109.61)ng·m1-1、(920.69±293.21)ng·ml-1、(30.17±3.20)ng·m1-1,CL/F:(26.97±13.86) ml· kg-1· h-1、(9.21±4.05) ml· kg-1· h-1、(6.29±2.87) ml· kg-1· h-1、(284.26±43.47)ml· kg-1· h-1,AUC0→∞:(4657.70±2337.30) ng· m1-1·h、(25279.58±9407.63) ng· ml-1·h、(74438.89±29 007.81) ng·ml-1·h、(240.97±39.40) ng·ml-1·h.结论 PEG-rhGH体内过程符合线性动力学特征,与rhGH相比,明显推迟达峰时间、延长半衰期、减慢清除率,具有长效特征.%Objective To investigate the pharmacokinetics of PEGylated recombinant human growth hormone(PEG-rhGH) injection in healthy volunteers by ELISA.Methods 30 healthy male volunteers were subcutaneously injected PEG-rhGH 0.1 mg·kg-1,0.2 mg·kg-1,and 0.4 mg·kg-1 and rhGH 0.067 mg·kg-1,respectively,10 volunteers for each dose group.The serum concentrations of PEG-rhGH and rhGH were determined by ELISA method and the pharmacokinetic parameters calculated.Results The calibration curves were linear at the concentration range of PEG-rhGH from 0.312 5 to 40.000 0 ng·ml-1 and that of rhGH from 0.312 5 to 10.000 0 ng·ml-1,respectively,with both of intra-and inter-batch RSD < 15%.The lowest detectable limit was 0.312 5ng·ml-1 for both.The t1/2 of PEG-rhGH (0.1 mg·kg-1,0.2 m g·kg-1,and 0.4 mg·kg-1) and rhGH (0.067 mg·kg-1) were (31.70±4.70) h,(32.19±4.58) h,(30.39±5.93) h,and (1.95±0.44)h,respectively;Tmax were (22.20±9.82) h,(29.40±10.75) h,(40.80±8.39)h,and (3.20±1.10) h;Cmax were (105.24±45.37) ng·ml-1,(379.09±109.61)ng·m l-1,(920.69±293.21) ng·ml-1,and (30.17±3.20) ng·ml-1;CL/F were (26.97±13.86) ml·kg-1·h-1,(9.21±4.05) ml·kg-1·h-1,(6.29±2.87) ml·kg-11·h-1,and (284.26±43.47) ml·kg-1·h-1;and AUC0→∞ were (4 657.70±2 337.30) ng·ml-1·h,(25 279.58±9 407.63) ng·ml-1·h,(74 438.89±29 007.81) ng·ml-1·h,and (240.97±39.40) ng·ml-1·h.Conclusions PEG-rhGH is linear pharmacokinetics;compared with rhGH,it delays peak time,prolongs half-time,decrease clearance,and shows prolonged action.【总页数】4页(P1699-1702)【作者】和凡;钟国平;肖楚瑶;伍婉媚;何艳玲【作者单位】510120 广州市妇女儿童医疗中心药学部;510080 广州,中山大学药学院;510120 广州市妇女儿童医疗中心药学部;510120 广州市妇女儿童医疗中心药学部;510120 广州市妇女儿童医疗中心药学部【正文语种】中文【相关文献】1.甲磺酸帕珠沙星注射液健康人体单次给药的药动学研究 [J], 王进;肖永红;吕媛;康子胜;张明;刘燕;夏亚红;李天云2.放射免疫法研究乳糖基重组人生长激素和重组人生长激素的药代动力学 [J], 陈泽莲;李铜玲;庞其捷;何菊英;彭永富;李云春;管昌田3.健康人体内伐昔洛韦缓释片单次给药的药代动力学研究 [J], 黄恩;石萍;蒋玲;李治4.卡倍特二钠颗粒在健康人体中的单次给药药代动力学研究 [J], 邱枫;何晓静;肇丽梅;孙亚欣;郭启勇5.ELISA法研究聚乙二醇化重组人生长激素小鼠体内的药动学 [J], 陈金武;王荣海;戎隆富;宋礼华因版权原因,仅展示原文概要,查看原文内容请购买。
重组人生长激素生长工艺流程

重组人生长激素生长工艺流程一、引言。
二、基因工程构建。
咱先来说说这基因工程构建的部分。
这就像是搭积木一样,不过是超级高科技的那种。
科学家们要先找到人生长激素的基因序列,这可不容易呢,就像在一个超级大的宝藏堆里找一颗特别的宝石。
找到之后呢,把这个基因序列提取出来,然后要把它和一些特殊的载体连接起来。
这个载体就像是一辆小货车,专门负责把人生长激素的基因运到合适的地方去。
比如说,这个载体可能是一种细菌或者酵母里的小结构。
这时候的细菌或者酵母就像是一个个小小的工厂,准备开始生产我们需要的重组人生长激素啦。
三、发酵过程。
接着就是发酵过程啦。
把那些带着人生长激素基因的细菌或者酵母放到发酵罐里。
这个发酵罐就像是它们的豪华大宿舍,里面有吃有喝的。
吃的喝的呢,就是各种营养物质,像糖啊、氮源啊之类的。
这些小细菌或者酵母就在里面欢快地生长繁殖。
它们一边生长,一边按照我们之前送进去的基因指令,开始生产重组人生长激素。
这个过程就像是一场热闹的派对,每个小细菌或者酵母都在努力干活,为了生产出我们想要的东西。
而且啊,在发酵的过程中,要特别小心地控制环境条件呢。
温度啊、pH 值啊都得刚刚好,就像我们照顾小婴儿一样细心。
要是温度高一点或者低一点,pH值偏酸或者偏碱,这些小细菌或者酵母可能就会不高兴,生产效率就会降低啦。
四、分离纯化。
好啦,发酵完了之后呢,就到了分离纯化这一步。
这时候发酵罐里可是乱糟糟的一团,有我们想要的重组人生长激素,还有很多其他的杂质,像细菌或者酵母的残渣啊、没吃完的营养物质啊之类的。
我们得把重组人生长激素从这些杂质里分离出来。
这就像是从一堆沙子里找金子一样。
科学家们会用各种各样的方法,比如说过滤,就像用一个超级细密的筛子,把大的杂质先筛掉。
然后还有层析的方法,这个可就有点复杂啦。
简单来说,就是利用重组人生长激素和杂质在不同物质里的溶解度或者吸附性的不同,把它们分开。
这个过程要重复好几次呢,就像我们洗衣服,要多洗几遍才能洗得干净。
聚乙二醇化重组人生长激素质控难点探讨

聚乙二醇化重组人生长激素质控难点探讨李晶中检院生化及基因工程药物室正文重组人生长激素(Recombinant human growth hormone, rhGH)是由大肠杆菌或酵母菌表达的一种重要的非糖基化蛋白质激素,由191个氨基酸残基组成,相对分子量为22,125,等电点为5.2。
临床上,rhGH主要用于治疗因内源性hGH缺乏而导致的儿童侏儒症、成人生长激素缺乏症等[1]。
由于其体内半衰期仅为0.5~2hr左右,故需要每天、长期注射才能发挥疗效,治疗周期往往为一年以上[2]。
聚乙二醇(Polyethylene glycols, PEG)是一种毒性极低的线性大分子聚合物,具有水溶性和免疫惰性。
蛋白类药物经PEG修饰后,可延长半衰期,增加稳定性,同时降低免疫原性和抗原性[3]。
2008年,第一个N端被枝杈型PEG修饰的rhGH进入临床试验[4]。
虽然未发现严重不良反应且无抗PEG-rhGH的特异抗体产生,该产品却因为在二期临床试验中观察到注射部位出现皮下脂肪萎缩而被终止临床研究。
目前,国内已有3家企业申报了3种PEG-rhGH注射液,其中一家企业已取得了临床批件。
虽然PEG-rhGH是在已收载于中国药典2010年版的比较成熟的重组人生长激素基础上进行研发的,但是,其质量标准中各项目及限度的制定不应简单地照搬rhGH的标准,还应结合其自身独特的理化结构性质及生物学活性,着重考虑PEG有关的质控项目。
1996年,美国Genentech公司的Clark等人利用分子量为5kDa的聚乙二醇(PEG),对重组人生长激素进行了长效改构研究[5]。
研究结果表明,偶联后的重组人生长激素随着PEG 偶联数目的增多,其体内半衰期也相应延长,但其与受体结合的活性及体内刺激大鼠胫骨增殖的活性却随着偶联数目的增加而急剧下降。
同时,rhGH上可发生PEG修饰的10个位点中,有4个位点处于rhGH与受体的结合部位,直接影响着rhGH的活性。
新药的开发流程及周期
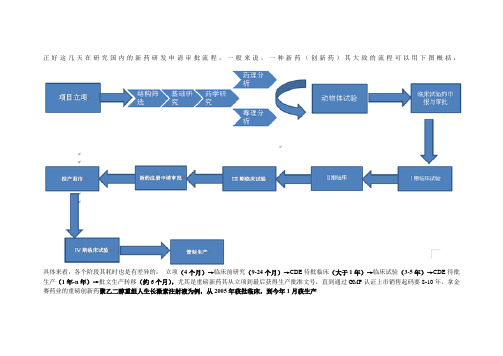
正好这几天在研究国内的新药研发申请审批流程,一般来说,一种新药(创新药)其大致的流程可以用下图概括:具体来看,各个阶段其耗时也是有差异的:立项(4个月)→临床前研究(9-24个月)→CDE待批临床(大于1年)→临床试验(3-5年)→CDE待批生产(1年-n年)→批文生产转移(约6个月),尤其是重磅新药其从立项到最后获得生产批准文号,直到通过GMP认证上市销售起码要8-10年。
拿金赛药业的重磅创新药聚乙二醇重组人生长激素注射液为例,从2005年获批临床,到今年1月获生产这份流程图和这篇文章给出了药物研发的成功率以及每个步骤所花费的时间。
总体来看,每5种进入临床的药物中只有1种能进行所有的试验和批准过程。
新药开发阶段如下:临床前试验:由制药公司进行的实验室和动物研究,以观察化合物针对目标疾病的生物活性,同时对化合物进行安全性评估。
这些试验大概需要3.5年的时间。
研发中新药申请(Investigational New Application, IND):在临床前试验完成后,公司要向FDA提请一份IND,之后才能开始进行药物的人体试验。
如果30天内FDA没有发出不予批准的申明,此IND即为有效。
提出的IND需包括以下内容:先期的试验结果,后续研究的方式、地点以及研究对象;化合物的化学结构;在体内的作用机制;动物研究中发现的任何毒副作用以及化合物的生产工艺。
另外,IND必须得到制度审核部门(the Institutional Review Board)的审核和批准。
同时,后续的临床研究需至少每年向F DA提交一份进展报告并得到准许。
临床试验,Ⅰ期:此阶段大概需要1年时间,由20~80例正常健康志愿者参加。
这些试验研究了药物的安全性方面,包括安全剂量范围。
此阶段的研究同时确定了药物在体内的吸收、分布、代谢和排泄、以及药物的作用持续时间等项目。
临床试验,Ⅱ期:此阶段需要约100到300名志愿患者参与进行一些控制研究,以评价药物的疗效。
ELISA法研究聚乙二醇化重组人生长激素小鼠体内的药动学

ELISA法研究聚乙二醇化重组人生长激素小鼠体内的药动学陈金武;王荣海;戎隆富;宋礼华
【期刊名称】《中国医药工业杂志》
【年(卷),期】2007(38)5
【摘要】建立了双抗夹心ELISA法检测小鼠血清中聚乙二醇化重组人生长激素(PEG-GH)的浓度。
结果表明,PEG-GH和重组人生长激素(rhGH)浓度均在1~150ng/ml范围内呈良好的线性关系。
PEG-GH以静脉注射与皮下注射两种途径给药,所得t1/2β分别为静注rhGH的34.8倍和39.8倍,清除率明显下降。
表明PEG-GH具有长效作用。
【总页数】4页(P357-360)
【关键词】聚乙二醇化重组人生长激素;药物动力学;酶联免疫吸附分析法
【作者】陈金武;王荣海;戎隆富;宋礼华
【作者单位】安徽大学生命科学学院;安徽省生物研究所
【正文语种】中文
【中图分类】R945.1
【相关文献】
1.ELISA法研究聚乙二醇重组人生长激素注射液单次给药人体药代动力学 [J], 和凡;钟国平;肖楚瑶;伍婉媚;何艳玲
2.ELISA法研究重组水蛭素在比格犬体内的药动学 [J], 杨辉;周远大;何海霞
3.载紫杉醇的聚乙二醇-聚乳酸-聚-β-氨基酯纳米胶束药动学及其在小鼠体内分布
研究 [J], 岳巧欣;杜林娇;李真真;梁英喜;易红;臧琛;陈燕军;赵庆贺
4.聚乙二醇化重组人生长激素的免疫原性及药动学研究 [J], 陈金武;王荣海;戎隆富;宋礼华
5.甲氧基聚乙二醇白蛋白5-氟尿嘧啶在小鼠体内的药动学 [J], 罗晓琴;戴会群;朱颖杰;朱亮;王成蹊
因版权原因,仅展示原文概要,查看原文内容请购买。
聚乙二醇化生长激素释放激素的研究进展 (8)

2012年5月第19卷第14期·综述·生长激素释放激素(growth hormone-releasing hormone,GHRH)又称生长激素释放因子(growth hormone-releasing factor,GRF),它是由下丘脑分泌的一种肽类激素,具有促进垂体促生长素细胞合成和释放生长激素(growth hormone,GH)的作用。
临床上可以用来治疗矮小症、HIV相关的脂肪营养不良、创伤等疾病。
然而GHRH应用到临床上的最大不足就是体内半衰期比较短(一般10~20min)[1]。
为了延长GHRH在体内的半衰期,减少频繁用药给患者带来的不适,须对GHRH进行修饰,以期达到半衰期显著延长,免疫原性有所降低同时副作用相对较小。
为此,本文主要综述了GHRH 以及GHRH长效修饰的研究进展,尤其是PEG修饰GHRH 的最新进展。
1生长激素释放激素的研究概况GHRH是由下丘脑分泌的一种肽类激素,具有促进垂体促生长素细胞合成和释放GH、IGF-1的作用,目前已被广泛应用到临床。
1.1GHRH的发现早在20世纪60年代,人们就已经注意到人体内GHRH 的存在,由于技术限制,一直没有得到证实。
直到1982年Rivier J等[2]及Guillemin R等[3]分别从引起肢端肥大症的胰腺肿瘤组织中分离提纯出3种GHRH,同时鉴定了相应氨基酸数目分别为44、40及37,分别命名为GHRH1-44NH2、GHRH1-40OH、GHRH1-37NH2。
其中GHRH1-44NH2的分子结构见图1。
51015Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Gly-202530 Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Met-Ser-Arg-Gln-3540Gln-Gly-Glu-Ser-Asn-Gln-Glu-Arg-Gly-Ala-Arg-Ala-Arg-Leu-NH2图1GHRH1-44NH2的分子结构1.2GHRH结构与活性的关系目前已经证实体内GHRH主要有3种形式,即GHRH1-44NH2、GHRH1-40OH、GHRH1-37NH2,其中以GHRH1-40OH大量存在,它聚乙二醇化生长激素释放激素的研究进展王永1刘沐荣2万海同11.浙江中医药大学生物工程学院,浙江杭州310053;2.杭州北斗生物技术有限公司,浙江杭州310011[摘要]生长激素释放激素(growth hormone-releasing hormone,GHRH)又称生长激素释放因子(growth hormone-releas-ing factor,GRF),是由下丘脑分泌的一种肽类激素,具有促进垂体促生长素细胞合成和释放生长激素(growth hor-mone,GH)的作用,临床上可以用来治疗矮小症、HIV相关的脂肪营养不良、代谢综合征、艾滋病、创伤等疾病。
一种新型聚乙二醇化重组人生长激素的制备及性质考察

2 方法与结果
2 1 PEG ( ALD) 2 对 rhGH 的修饰反应 将 rhGH 经凝 胶色谱柱 Sephadex G 25 置换 到 p H 值 为 6 2 的 5 mm o l ∀ L 磷 酸盐 缓 冲 液
-1
( PBS)中。 Low ry 法测定蛋白质量浓度 。调整 - 1 蛋白质 量 浓 度 至 4 g∀ L , 先 加 入 终 浓 度 为 20 mm o ∀ l L 的 NaCNBH 3, 再按 PEG 与蛋白质的
和
100 mmo ∀ l L NaC l 的 5 mm ol∀ L PBS 水 溶 液 -1 (p H 值 7 2) 洗脱 , 其中 50 mm o ∀ l L 梯度洗脱的 是 PEG rhGH, 100 mm ol ∀ L 梯度洗脱的是目的蛋
-1
白 PEG ( rhGH ) 2 ( 图 1 的第 4、 3 道条带 )。
- 1
[ 9]
M
P ro te in m arker ; 1 R eaction m ix ture ; 2 Sa m ples after Sa m ples e lu ted fro m Q Sepharose FF
Sephacry l S 200; 3
物质的量比 1#2 加入 PEG, 混合均匀。 4 ∃ 搅拌 反应 16 h 后, 加入过量甘氨酸终止反应。 2 2 修饰混合物分离 将修饰混合物 上样 Sephacry l S 200 凝胶 色 谱 柱 , 流 动 相 是 含 0 15 m o l∀ L
第 10 期
郭
凝等 : 一种 新型聚乙二醇化重组人生长激素的制备及性质考察
845
聚乙二醇 二丙 醛 ( PEG ( ALD ) 2, 分 子质 量 2 10 u , 北京键凯科技有 限公司 ) , 重组人生长
重组人生长激素工艺流程

重组人生长激素工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!重组人生长激素(rhGH)是通过基因工程技术制备的一种药物,用于治疗生长激素缺乏症等疾病。
聚乙二醇修饰重组人生长激素的研究

关键词 : 重组人生长激素 ; 聚乙二 醇; 化学修 饰
d o i : 1 0 . 1 6 0 8 3  ̄. c n k i . 1 6 7 1 —1 5 8 0 . 2 0 1 7 . 1 2 . 0 5 2
疫原 性 。 …
二、 重组人生长激素 ( r h GH ) 人生长激素 ( h G H) 是由人脑下垂体前 叶嗜酸性 细胞分泌 的一种肽类激素 , 是一种具有广泛生理功 能的生长调节素 。 _ 8 目 前, 临床上使用 的h G H 是 由生 物技术生产的重组人生长激素( r h G H ) , 其主要用于 治疗各种生长激素缺乏症( G H D) 、 先天性卵巢发育 不全( T u r n e r 氏综合症 ) 、 艾滋病消瘦 、 大面积创伤恢
聚乙二醇修饰Βιβλιοθήκη 组人生长激素的研究 马妍春 , 杨 秀云 , 李磊姣 , 李 云辉 , 高 莹。
( 1 . 吉林省教育学院, 吉林 长春 1 3 0 0 2 2 ; 2 . 长春理工大学 化 学与环境 工程 学院, 吉林 长春 1 3 0 0 2 2 )
摘要 : 化学修饰是蛋 白质 药物 的一种有 效修饰 方法。 使 用聚 乙 二 醇( P E G ) 修 饰人生长激素( r h G H) , 是提 高r h G H半衰期 的
2 0 1 7 年第 1 2 期 第3 3 卷 ( 总第 4 4 4 期)
吉林省教育学 院学报
J0URNAL 0F EDUCATI oNAL I NS TI TUTE 0F J I LI N PRoVI NCE
No . 1 2, 2 01 7 Vo l _ 3 3 T o t a 1 No . 4 4 4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
安全性指标
所有观察到的或受试者自发报告的不良事件,包括主观 症状的异常改变、异常的临床症状和生命体征、实验室
及影像学等检查结果
研究人群基线临床资料
PEG-rhGH 0.2mg/kg.wk (n=228) Sex (M/F) Age (years) Weight (kg) Height (cm) Growth velocity (cm/year) 187/41 11.3±3.5 23.22±6.41 116.6±12.8 2.26±0.87 rhGH 0.25mg/kg.wk (n=115) 93/22 11.8 ±3.6 24.73±7.91 119.0±12.7 2.25±0.82 P
0.796 0.247 0.078 0.104 0.928
疗 效 评 价
GHD 患者治疗后身高年生长速率变化
24
**
Grwoth velocity (cm/yr) 20 16 12 8 4 0
**
** ** ** **
PEG-rhGH 0.2mg/kg.wk
Daily rhGH 0.25mg/kg.wk
为主,临床使用存在的缺陷: 需每天注射一次 rhGH 治疗疗程长 粉剂药品溶解过程复杂,有潜在二次污染危险 ——导致依从性差,临床疗效不佳
短效生长激素依从性差
对rhGH 治疗的患者进行长期随访发现1
23%接受rhGH注射治疗的儿童患者每月会漏打至少三针 在两年的治疗期里,13%的儿童患者会漏打一半以上的处方剂量
PEG-rhGH PK/PD 研究数据
分子量和分子结构式
在rhGH N-末端氨基上共价结合1分子的分子量约为 45kDa 的分支型PEG 分子 PEG-rhGH 分子式:(CH2CH2O)nC1000H1544N264O305 (其 中n=904-909 ) PEG-rhGH 分子量为64.9kDa
217(100.00 )
0 (0.00 )
0 (0.00 )
0 (0.00 )
3
111(100.00 )
0 (0.00 )
0 (0.00 )
1 (100.00 )
安 全 性 评 价
治疗前后甲状腺功能指标变化的组间比较
指标 组别 Missing 正常 异常 P
血T3
试验组 对照组
14 4 14 4
13 4
212(99.07) 110(99.10) 178(83.18) 94(84.68)
201(93.49) 104(93.69)
2(0.93) 1(0.90) 35(16.82) 17(15.32)
14(6.51) 7(6.31)
1.000
血T4
试验组 对照组
0.7277
FSH
试验组 对照组
0.943
AUCSS
PEG-rhGH 的临床疗效
PEG-rhGH III 期临床试验
在儿童GHD 患者中进行的一项随机、多中心、开放、以rhGH 注射 液 (赛增®水剂) 为阳性对照药的平行对照Ⅲ期临床试验 根据II期研究结果选择PEG-rhGH 0.2 mg/kg· wk 作为治疗组剂量 分2 组:试验组(A)、阳性对照组 (B) ,总疗程6个月
分组 A组
剂量 PEG-rhGH 0.2 mg/kg· wk 赛增®水剂 0.25 mg/kg· wk
用药方式 每周皮下注射一次
病人例数 228
B组
每天皮下注射一次
115
临床疗效评价指标
有效性指标
治疗结束时的年生长速率
治疗结束时实际年龄的身高标准差积分、骨成熟情况和 IGF-I、IGFBP-3
200
100
0 0 4 Time (week)
**: P<0.001, compared with baseline
13
25
疗 效 评 价
GHD 患者治疗后IGFBP-3 的变化
5000
Serum IGFBP-3 (ng/ml)
** 4000 3000 2000 1000 0 ** ** **
** பைடு நூலகம்*
0.2mg/kg
29.40 ±10.75 379.09 ±109.61 32.19 ±4.58 25085±9389 49.90 ±7.53 439.44 ±237.36 9.21 ±4.05
0.4mg/kg
40.80 ±8.39 920.69 ±293.21 30.39 ±5.93 74062±28915 60.92 ±7.29 268.85 ±116.80 6.31 ±2.93
0.067mg/kg
3.2 ±1.1 30.17 ±3.20 1.95 ±0.44 233±37 6.20 ±0.39 787.59 ±155.71 284.26 ±43.47
受试者为健康男性 ,每组10例
PEG-rhGH 药代动力学参数
受试者儿童GHD患者10例 方案:rhGH-LA 0.2mg/kg.wk,连续8次
每周注射1次
1990年
美国
Enzon
Oncaspar® (PEGaspargase)5 PEG-growth hormone receptor antagonist (Pegvisomant, Somavert ®)6
5KD的mPEG连接
每周注射1次
1994年
美国
Enzon
在GH拮抗物上连接 5个5KD的mPEG
例次
110 62
发生率 (%)
36.4 21.05
例数
43 22
例次
53 25
发生率 (%)
37.39 19.13
P
0.8580 0.6771
安 全 性 评 价
治疗前后抗rhGH抗体指标变化
组别 治疗前后正、异常改变例数(%) Missing 正 /正 正 /异 异 /正 异 /异
试验组
对照组
11
PEG-rhGH 0.2mg/kg.wk
-4 -5 -6
** ** ** ** ** **
-7
**: P<0.001, compared with baseline
疗 效 评 价
GHD 患者治疗后IGF-I 的变化
400 ** Serum IGF-I (ng/ml) 300 ** ** ** ** ** PEG-rhGH 0.2mg/kg.wk Daily rhGH 0.25mg/kg.wk
300
250 血清GH 浓度 (ng/ml) 200 150
100
50 0
1
2
4
8 12 18 24 36 48 72 96 120144168
第8次注射后时间 (小时)
PEG-rhGH 药代动力学参数
0.2mg/kg.wk 第8次皮下注射后主要药代参数
参数 半衰期 Tmax Cmax Cmin Ke CLF 均值±标准差 27.11±6.30 49.2±16.4 303.9±160.8 25.9±11.6 0.027±0.006 0.009±0.003 23603±12829
2. Ira M. et al. Hepatology. October, 2007. 46(4): 971-981 4. Bory C, et al. Adv Exp Med Biol 1991,309A:173-176 6. Trainer PJ, et al. N. Engl. J. Med. 2000,342:1171-1177
金赛聚乙二醇化rhGH 注射液 (PEG-rhGH)
只需每周注射一次,从而改善患者用药依从性,提 高药物长期疗效 临床适应症 用于内源性生长激素缺乏所引起的儿童生长缓慢 给药方法与疗程 每周皮下注射一次,疗程3月-3年
聚乙二醇化学修饰介绍
聚乙二醇 (Polyethylene Glycol,PEG)
基因工程使多种多肽和蛋白质成为新的药物制剂 水溶性显著改善 性质不稳定 易被蛋白水解酶降解 体内半衰期短 潜在的免疫原性 PEG 化学修饰
免疫原性降低
稳定性增加 循环中滞留时间延长 蛋白水解作用减少
肾脏的清除率降低
药代动力学改变
PEG化药物上市情况
产品名称/代号 Pegasys ® ( PEGinterferon alfa-2a)1 PEG-Intron® (PEGinterferon alfa-2b)2 制剂形式 在IFNa-2a上连接1 个40KD的mPEG 在IFNa-2b上连接1 个12KD的mPEG的 一组组合物,其中 HIS34位点≥50% 在G-CSF的N末端 连接1个20KD的 mPEG 5KD的mPEG连接 适应症 丙型肝炎 使用方法 每周注射1次 上市时间 2002年 上市国家 瑞士 制造公司 Roche
PEG-rhGH 0.2mg/kg.wk Daily rhGH 0.25mg/kg.wk
0
4 Time (week)
13
25
**: P<0.001, compared with baseline
安 全 性 评 价
治疗前后实验室指标正/异常总结表
试验组 (N=228) 对照组 (N=115)
例数
全部的正/异常变化 与研究药物有关的正/异 常变化 83 48
安 全 性 评 价
GHD 患者治疗后FPG 的变化
5.2 Serum FPG (mmol/L) 5.0 4.8 4.6 4.4 4.2 4.0 0 13 Time (week) 25 ** **
** ** PEG-rhGH 0.2mg/kg.wk
Daily rhGH 0.25mg/kg.wk
试验组和对照组FPG水平在治疗第13周、25周均显著高于基线水平(P<0.01) FPG无均在正常范围,无空腹血糖受损事件发生 试验组和对照组之间在3个时点均未见显著差异
