化工原理讲稿4(第七章)
合集下载
化工原理7章液液萃取

形成新的混合物mM, ( zA, zB, zs) :
mM mR mE 物料衡算 mMzA mRxA mE yA
mMzs mRxs mE ys
将方程整理成如下形式:
mE xAzAzSxS mR zAyA ySzS
此式说明,三个组成点M、R、E在一条直线上, 即M点位 于RE 点的连接线上。
m E RM m R ME
理论萃取级:即无论进入该级的两股液流(原料、溶剂或前 一级的萃余相和后一级的萃取相)的组成如何,经过萃取后, 从该级流出的萃取相和萃余相为互成平衡的两个相。
7.3.1 单级萃取计算 (1) 流程
mF, xF mS
混合器
xE, y
mM, z
澄清槽
mR, x
单级萃取流程示意图
(2)特点 ◇ 原料液与溶剂一次性接触。 ◇ 萃取相与萃余相达到平衡。
m E MR
mM
ER
A
mR M E
mM
RE
mE M R
mM
RE
mE M R mR M E
S B
7.2.2 三角形相图 萃取相、萃余相的相平衡关系是萃取设计、计算的基本条件,相 平衡数据来自实验或由热力学关系推算。 讨论的前提: 各组分不发生化学反应。 (1)溶解度曲线及平衡联结线
① 相平衡数据的测定:
yB xB
越大,分离效果越 应好 选, 择 1的溶剂
与分k配 A 有系 关 kA 越 数 , 大 越, 大
kA1 ,则 一定 1 ; 大 kA1 于 , 可能 1 , 大也 于可1 。 能
(2)溶剂萃取容量 定义:部分互溶物系的褶点处或第二类物系溶解度最大时,
萃取相中单位溶剂可能达到的最大溶质负荷。
(6)稳定性,腐蚀性,价格 良好的稳定性,腐蚀性小,毒性低,资源充足,价格适宜等。
mM mR mE 物料衡算 mMzA mRxA mE yA
mMzs mRxs mE ys
将方程整理成如下形式:
mE xAzAzSxS mR zAyA ySzS
此式说明,三个组成点M、R、E在一条直线上, 即M点位 于RE 点的连接线上。
m E RM m R ME
理论萃取级:即无论进入该级的两股液流(原料、溶剂或前 一级的萃余相和后一级的萃取相)的组成如何,经过萃取后, 从该级流出的萃取相和萃余相为互成平衡的两个相。
7.3.1 单级萃取计算 (1) 流程
mF, xF mS
混合器
xE, y
mM, z
澄清槽
mR, x
单级萃取流程示意图
(2)特点 ◇ 原料液与溶剂一次性接触。 ◇ 萃取相与萃余相达到平衡。
m E MR
mM
ER
A
mR M E
mM
RE
mE M R
mM
RE
mE M R mR M E
S B
7.2.2 三角形相图 萃取相、萃余相的相平衡关系是萃取设计、计算的基本条件,相 平衡数据来自实验或由热力学关系推算。 讨论的前提: 各组分不发生化学反应。 (1)溶解度曲线及平衡联结线
① 相平衡数据的测定:
yB xB
越大,分离效果越 应好 选, 择 1的溶剂
与分k配 A 有系 关 kA 越 数 , 大 越, 大
kA1 ,则 一定 1 ; 大 kA1 于 , 可能 1 , 大也 于可1 。 能
(2)溶剂萃取容量 定义:部分互溶物系的褶点处或第二类物系溶解度最大时,
萃取相中单位溶剂可能达到的最大溶质负荷。
(6)稳定性,腐蚀性,价格 良好的稳定性,腐蚀性小,毒性低,资源充足,价格适宜等。
化工原理-1-第七章-质量传递基础.ppt

解:以A——NH3,B——H2O
对气相:yApPA1.08103105 00.0079
C A R p A T 8 .3 1 8 2 4 0 2 00 7 0 .3 32 m m 8 3 o4 l
0.01
对液相:
xA
17 0.01
1
0.01048
17 18
由于氨水很稀,可假设其密度与水相同, 100k0gm3 ,则:
1、组分A的质量浓度ρA
A
mA V
kg m3
式中:V为均相混合物的体积。
混合物的总质量浓度(即混合物的密度):
m kg
V
m3
上两式相除,则: A
mA m
wA
故:A wA
2、组分A的量浓度(摩尔浓度)CA
CA
nA V
kmol m3
混合物的总物质的量浓度(总摩尔浓度)C:
C n V
kmol m3
为:
A
uAuAdum
两边同时乘以CA,则:
C A uAC A uA dC A um
显然,上式第一项为A通过固定点(静止参照物或地球)的总通量,以 NA表示;第二项为A相对于运动流体的扩散通量,即为JA;第三项则是 由于主体流动所引起的相对于固定点的通量,常称为主体流动通量。则 上式可写成:
NAJACAum
C为A和B组分的总浓度,kmol/m3;
xA为A在混合物中的摩尔分数; dxA/dz为组分A的浓度梯度; “-”表示扩散通量与浓度梯度方向相反;
DAB为比例系数,称为组分A在组分B中的扩散系数,m2/s。
当C为常数时,上式转换为:
JA,z DABddCZA
CA为A组分的浓度,kmol/m3; dCA/dz为组分A的浓度梯度;
化工原理 第四版 第7章 液体精馏

液体精馏是化工生产中重要的分离操作,广泛应用于石油、炼油等工业生产中。精馏操作利用液体混合物中各组分挥发性的差异,通过气、液两相间的ቤተ መጻሕፍቲ ባይዱ接接触,实现易挥发组分向气相、难挥发组分向液相的传递。根据操作方式、物系中组分数目、分离难易及操作压强,精馏操作有不同的分类。双组分溶液的气液相平衡关系是精馏过程的基础,理想溶液遵循拉乌尔定律,而非理想溶液则存在正偏差或负偏差。相对挥发度是衡量混合液中组分挥发难易程度的重要指标。精馏原理可通过气液平衡相图进行说明,多次部分气化和部分冷凝是实现混合物分离的关键步骤。通过加热混合液使其部分气化,然后分离气相和液相,可逐步提纯得到更纯净的组分。
化工原理第七章章末复习总结

一、概述
(1)热传导干燥法 (2)对流传热干燥法 (3)红外线辐射干燥法 (4)微波加热干燥法 (5)冷冻干燥法 二、湿空气的性质及湿度图 1、湿空气的性质 (1)水汽分压 p v 对于湿空气有:p p p (2)相对湿度φ
pv py
pv ps
第七章 干燥
一、概述
1.干燥的原理及目的
原理:气体以对流方式向固体物料传热,使湿份汽化;在 分压差的作用下,湿份由物料表面向气流主体扩散,并 被气流带走。 目的:使物料便于运输、加工处理、储藏和使用。
2.固体物料的去湿方法
(1)机械去湿法:利用沉降、过滤或者离心分离机等机械 分离法,除去湿物料中的大部分水分。 (2)加热去湿法:对湿物料加热,使其所含的湿分汽化, 并及时移走所生成的蒸汽。 3.湿物料的干燥方法
三、干燥过程的物料衡算和热量衡算
1.干燥过程的物料衡算 1 物料含水量的表示方法
(1)湿基含水量
(2)干基含水量 2.物料衡算
X
湿物料中水分的质量 kg水分 kg干料 湿物料绝干物料的质量
w
湿物料中水份的质量 kg水分 kg湿料 湿物料的总质量
Lc L1 (1 1 ) L2 (1 2 )
(一)自由水与平衡水 X* 物料的含水量大于平衡含水量 的那一部分水称为自由水 分。自由水在一定的干燥条件下可除去。
四、物料的平衡含水量与干燥速率
(二)结合水与非结合水 结合水指借化学和物理学力与固体相结合的水分。非结合水是 指机械的附着于固体表面或颗粒堆层中的大空隙中的水分。 是表观的平衡蒸汽压不同。 自由水指所有能够被指定状态 的空气带走的水分。平衡水是指在指定空气条件下不能被干 燥依然存在于物料之中的一部分结合水。两者与空气的状态 和物料性质有关。
化工原理-1-第七章-质量传递基础

1 V A 0.285VC .048
其中VC为物质的临界体积(属于基本物性),单位为cm3/mol,可查有关 数据表格,书中表7-4为常见物质的临界体积。 对液体:
同样可由一状态下的D推算出另一状态下的D,即:
T D2 D1 2 1 T 1 2
三、生物物质的扩散系数 常见的一些生物溶质在水溶液中的扩散系数见表7-5。对于水溶液中 生物物质的扩散系数的估算,当溶质相对分子质量小于1000或其分 子体积小于500 cm3/mol时,可用“二”中溶液的扩散系数估算式进 行估算;否则,可用下式进行估算:
解:以A——NH3,B——H2O p 800 y 0.0079 对气相: A A 5 P 1.013 10 pA 800 CA 0.3284 mol 3 m RT 8.314 20 273 0.01 17 对液相: x A 0.01 1 0.01048 17 18
原子扩散体积 v/cm3/mol
S 22.9
分子扩散体积 Σ v/cm3/mol
CO CO2 N2O NH3 H2O SF6 Cl2 Br2 SO2 18.0 26.9 35.9 20.7 13.1 71.3 38.4 69.0 41.8
注:已列出分子扩散体积的,以分子扩散体积为准;若表中未列分子,对一般有机化合物分 子可按分子式由相应的原子扩散体积加和得到。
1 1 MA MB
2
v 13 v 13 P A B
式中:D为A、B二元气体的扩散系数,m2/s;
P为气体的总压,Pa;T为气体的温度,K; MA、MB分别为组分A、B的摩尔质量,kg/kmol; Σ vA、Σ vB分别为组分A、B的分子扩散体积,cm3/mol。 由该式获得的扩散系数,其相对误差一般小于10%。
其中VC为物质的临界体积(属于基本物性),单位为cm3/mol,可查有关 数据表格,书中表7-4为常见物质的临界体积。 对液体:
同样可由一状态下的D推算出另一状态下的D,即:
T D2 D1 2 1 T 1 2
三、生物物质的扩散系数 常见的一些生物溶质在水溶液中的扩散系数见表7-5。对于水溶液中 生物物质的扩散系数的估算,当溶质相对分子质量小于1000或其分 子体积小于500 cm3/mol时,可用“二”中溶液的扩散系数估算式进 行估算;否则,可用下式进行估算:
解:以A——NH3,B——H2O p 800 y 0.0079 对气相: A A 5 P 1.013 10 pA 800 CA 0.3284 mol 3 m RT 8.314 20 273 0.01 17 对液相: x A 0.01 1 0.01048 17 18
原子扩散体积 v/cm3/mol
S 22.9
分子扩散体积 Σ v/cm3/mol
CO CO2 N2O NH3 H2O SF6 Cl2 Br2 SO2 18.0 26.9 35.9 20.7 13.1 71.3 38.4 69.0 41.8
注:已列出分子扩散体积的,以分子扩散体积为准;若表中未列分子,对一般有机化合物分 子可按分子式由相应的原子扩散体积加和得到。
1 1 MA MB
2
v 13 v 13 P A B
式中:D为A、B二元气体的扩散系数,m2/s;
P为气体的总压,Pa;T为气体的温度,K; MA、MB分别为组分A、B的摩尔质量,kg/kmol; Σ vA、Σ vB分别为组分A、B的分子扩散体积,cm3/mol。 由该式获得的扩散系数,其相对误差一般小于10%。
天津大学版 化工原理 第七章 干燥 ppt 课件

w w w w 1 2 1 2 W G G 1 2 1 w 1 w 2 1
物料衡算(Mass balance)
2、水分蒸发量
湿废气体 L , H2 湿物料 G1 , w1 干 燥 产 品 G2 , w2 热空气 L , H1
c c 1 c H H g v
,
cv=1.88
c 1 . 01 1 . 88 H H
4.焓I (Total enthalpy)
焓:1kg 绝干空气的焓与相应水汽的焓之和。
I Ig HI v
一般以0℃为基准,且规定在0℃时绝干空气和水汽的 焓值均为零,则
I ( c Hc ) t r H c t r H g v 0 H 0
2、确定空气的状态点,查找其它参数 两个参数在曲线上能相交于一点,即这两 个参数是独立参数,这些参数才能确定空气的 状态点。
湿度图的使用 ① 空气状态的确定:已知空气的任何两个参数即可 确定其状态。
② 空气的加热与冷却过程
加热:空气的φ减小,表明空气接收水汽的能力加强
② 空气的加热与冷却过程 冷却:t<td时,空气的H不变;t=td时,有水冷凝
q
液滴 表面 tw , Hw源自b、计算Q S ( t t ) w
气体 t, H
液滴 kH 对流传质 N
S ( t t) k S ( H H ) r
w H s , t
w
Q k S ( H H ) r H s , t t w w
k H t t r ( H H ) w t s , t w w
5 t 273 1 . 0133 10 1 H v 22 . 4 H 273 P 29 18 5 t 273 1 . 0133 10 ( 0 . 772 1 . 244 H ) 273 P
物料衡算(Mass balance)
2、水分蒸发量
湿废气体 L , H2 湿物料 G1 , w1 干 燥 产 品 G2 , w2 热空气 L , H1
c c 1 c H H g v
,
cv=1.88
c 1 . 01 1 . 88 H H
4.焓I (Total enthalpy)
焓:1kg 绝干空气的焓与相应水汽的焓之和。
I Ig HI v
一般以0℃为基准,且规定在0℃时绝干空气和水汽的 焓值均为零,则
I ( c Hc ) t r H c t r H g v 0 H 0
2、确定空气的状态点,查找其它参数 两个参数在曲线上能相交于一点,即这两 个参数是独立参数,这些参数才能确定空气的 状态点。
湿度图的使用 ① 空气状态的确定:已知空气的任何两个参数即可 确定其状态。
② 空气的加热与冷却过程
加热:空气的φ减小,表明空气接收水汽的能力加强
② 空气的加热与冷却过程 冷却:t<td时,空气的H不变;t=td时,有水冷凝
q
液滴 表面 tw , Hw源自b、计算Q S ( t t ) w
气体 t, H
液滴 kH 对流传质 N
S ( t t) k S ( H H ) r
w H s , t
w
Q k S ( H H ) r H s , t t w w
k H t t r ( H H ) w t s , t w w
5 t 273 1 . 0133 10 1 H v 22 . 4 H 273 P 29 18 5 t 273 1 . 0133 10 ( 0 . 772 1 . 244 H ) 273 P
化工原理-7传质PPT课件

1.质量分数
质量分数定义式
wA
mA m
混合物的总质量分数
N
wi 1
i 1
二、质量分数与摩尔分数
2.摩尔分数 摩尔分数定义式
xA
nA n
液相
yA
nA n
气相
混合物的总摩尔分数
N
xi 1
i 1
N
yi 1
i1
二、质量分数与摩尔分数
质量分数与摩尔分数的关系
由质量分数 求摩尔分数
xA
wA / M A
一、分子扩散现象与费克定律
1.分子扩散现象 由于分子的无规则热运动而形成的物质传递
现象—分子传质。
❖ 分子传质又称为分子扩散,简称为扩散 ❖分子传质在气相、液相和固相中均能发生
播放动画31:分子扩散现象
一、分子扩散现象与费克定律
2.费克(Fick)定律
描述分子扩散过程的基本定律—费克第一定律。
及
边界条件
(1) z = z1 cA = cA1 ( pA= pA1 ) (2) z = z2 c A= cA2 ( pA= pA2 )
一组分通过另一 停滞组分的扩散
二、气体中的稳态分子扩散
求解可得
NA
Dc
AB 总
z
ln
c
总
cA2
c
总
c A1
或
NA
Dp
AB 总
RTz
ln
p
总
p
总
pA2 p A1
二、气体中的稳态分子扩散
简单分子的扩散体积
v
/(cm3/mol)
7.07
物质
CO
v /(cm3/mol)
化工原理课件第七章
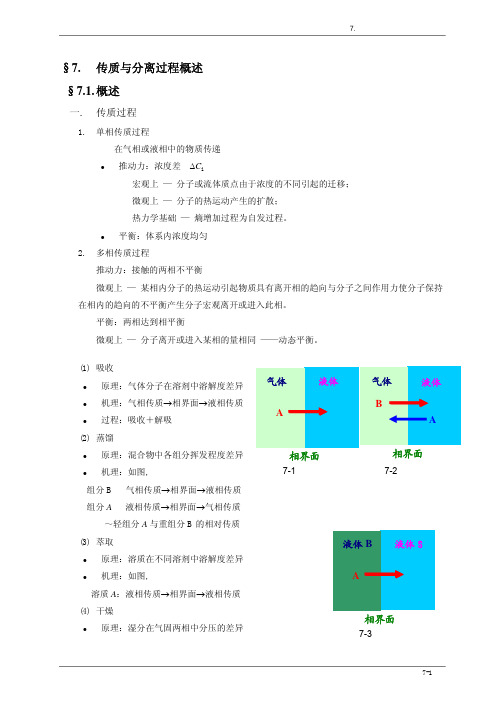
化工原理授课提纲
7. 传质与分离过程概述
§7.
传质与分离过程概述
§7.1. 概述
一.
1.
传质过程
单相传质过程 在气相或液相中的物质传递
z
推动力:浓度差 ∆Ci 宏观上 — 分子或流体质点由于浓度的不同引起的迁移; 微观上 — 分子的热运动产生的扩散; 热力学基础 — 熵增加过程为自发过程。
z
平衡:体系内浓度均匀
2.
液体中的扩散系数 对于很稀的非电解质溶液,有半经验式:(P14 页 7-43 式) D~溶质的体积、溶剂的粘度及分子量、溶剂的缔合参数、T 有关。由于液体压缩性小,故 忽略 P 的影响。
3.
固体中的扩散系数 z 正常扩散(或体积扩散):单相扩散 z 努森扩散:分子在孔道中的碰撞扩散+体积扩散 z 结构扩散:分子在孔道中的碰撞扩散 z 表面扩散:分子在孔道表面上吸附扩散 方程形式(略)
p DP ln B 2 RT Z p B 1 p A1 − p A 2 =1 pB 2 − pB 1
因为:P= pA1+pB1= pA2+pB2 则:pA1- pA2= pB2 -pB1 →
那么:NA=
p DP DP p − p A2 DP p A1 − p A 2 ln B 2 A1 = = (pA1-pA2) RT Z p B 1 p B 2 − p B 1 RT Z p B 2 − p B 1 RT Z p Bm p ln B 2 p B1 DC (CA1–CA2) ZCBm
液相
NA=
z
质量浓度: ci=
mi V ni V
kg/m3 kmol/m3
z
摩尔浓度: Ci = 浓度换算:
z
ρ = m/V = ∑ci ( i =A、B、…) ci = mi/V =aim/V = aiρ Ci=ni/V=xin/V=xiC (C=n/V→混合物的总摩尔浓度,kmol/m3) 对于气体混合物: Ci= ni/V=pi/RT ci= mi/V =Mini/V =Mi pi/RT …… 见 P5 页。
7. 传质与分离过程概述
§7.
传质与分离过程概述
§7.1. 概述
一.
1.
传质过程
单相传质过程 在气相或液相中的物质传递
z
推动力:浓度差 ∆Ci 宏观上 — 分子或流体质点由于浓度的不同引起的迁移; 微观上 — 分子的热运动产生的扩散; 热力学基础 — 熵增加过程为自发过程。
z
平衡:体系内浓度均匀
2.
液体中的扩散系数 对于很稀的非电解质溶液,有半经验式:(P14 页 7-43 式) D~溶质的体积、溶剂的粘度及分子量、溶剂的缔合参数、T 有关。由于液体压缩性小,故 忽略 P 的影响。
3.
固体中的扩散系数 z 正常扩散(或体积扩散):单相扩散 z 努森扩散:分子在孔道中的碰撞扩散+体积扩散 z 结构扩散:分子在孔道中的碰撞扩散 z 表面扩散:分子在孔道表面上吸附扩散 方程形式(略)
p DP ln B 2 RT Z p B 1 p A1 − p A 2 =1 pB 2 − pB 1
因为:P= pA1+pB1= pA2+pB2 则:pA1- pA2= pB2 -pB1 →
那么:NA=
p DP DP p − p A2 DP p A1 − p A 2 ln B 2 A1 = = (pA1-pA2) RT Z p B 1 p B 2 − p B 1 RT Z p B 2 − p B 1 RT Z p Bm p ln B 2 p B1 DC (CA1–CA2) ZCBm
液相
NA=
z
质量浓度: ci=
mi V ni V
kg/m3 kmol/m3
z
摩尔浓度: Ci = 浓度换算:
z
ρ = m/V = ∑ci ( i =A、B、…) ci = mi/V =aim/V = aiρ Ci=ni/V=xin/V=xiC (C=n/V→混合物的总摩尔浓度,kmol/m3) 对于气体混合物: Ci= ni/V=pi/RT ci= mi/V =Mini/V =Mi pi/RT …… 见 P5 页。
化工原理-蒸发

30
循环型蒸发器
列文式蒸发器
加热室上增设沸腾室, 溶液的沸腾传热有加热 室转移到沸腾室.
过 程 原
优点:避免加热管表面 结晶和结垢,适于粘度
理 大的溶液,传热系数大
与 装
缺点:液柱静压头引起
备 的温差损失大。
31
单程型蒸发器
升
膜
式
蒸
过 程 原
发 器
理
与
装
备
降 膜 式 蒸 发 器
33
单程型蒸发器
E1 E2
W1
W2
则 W1=D W2=W1-E1=D-E1
D t1
t2
过 程
W3=W2-E2=D-E1-E2
原 水蒸发总量:W= W1 + W2 + W3=3D-2E1-E2
理 与
D W 2 E1 1 E2
装
33 3
备 推广至n效: D W n 1 E1 n 2 E2 1 En 1
5
单效蒸发 物料衡算
水分蒸发量W
总物料衡算: F = L +W
过 溶质不变: F x0 Lx F W x
程
原 理
水分蒸发量:
W
F
1
x0 x
与
装 备
完成液浓度:
x F x0 F W
F x0 t0 h0 c0
D, Ts , Hs
W, T, H
蒸发室
加 热 L , x, 室 t , c, h
D, Ts, hs
装
备
35
单程型蒸发器 刮板式冷凝器
过 程 原 理 与 装 备
36
浸没燃烧式蒸发器
过 程 原 理 与 装 备
37
除沫器、冷凝器和真空装置 除沫器
循环型蒸发器
列文式蒸发器
加热室上增设沸腾室, 溶液的沸腾传热有加热 室转移到沸腾室.
过 程 原
优点:避免加热管表面 结晶和结垢,适于粘度
理 大的溶液,传热系数大
与 装
缺点:液柱静压头引起
备 的温差损失大。
31
单程型蒸发器
升
膜
式
蒸
过 程 原
发 器
理
与
装
备
降 膜 式 蒸 发 器
33
单程型蒸发器
E1 E2
W1
W2
则 W1=D W2=W1-E1=D-E1
D t1
t2
过 程
W3=W2-E2=D-E1-E2
原 水蒸发总量:W= W1 + W2 + W3=3D-2E1-E2
理 与
D W 2 E1 1 E2
装
33 3
备 推广至n效: D W n 1 E1 n 2 E2 1 En 1
5
单效蒸发 物料衡算
水分蒸发量W
总物料衡算: F = L +W
过 溶质不变: F x0 Lx F W x
程
原 理
水分蒸发量:
W
F
1
x0 x
与
装 备
完成液浓度:
x F x0 F W
F x0 t0 h0 c0
D, Ts , Hs
W, T, H
蒸发室
加 热 L , x, 室 t , c, h
D, Ts, hs
装
备
35
单程型蒸发器 刮板式冷凝器
过 程 原 理 与 装 备
36
浸没燃烧式蒸发器
过 程 原 理 与 装 备
37
除沫器、冷凝器和真空装置 除沫器
化工原理 第七章传质过程导论 讲义

3. 单向扩散传质速率方程
Dc dc A NA = − c − c A dz
在气相扩散
pA cA = RT
c = p
——微分式 微分式
RT
dp A Dp NA = − RT ( p − pA ) dz
∫
z
0
Dp dpA N A dz = ∫ − pA1 RT ( p - pA )
pA2
化工与材料工程学院---Department of Chemical and Materials Engineering
第七章 传质过程导论
化工与材料工程学院---Department of Chemical and Materials Engineering
第七章 传质过程导论
目的: 了解传质的重要性; 目的:1、了解传质的重要性; 2、掌握相组成的多种表示方法; 掌握相组成的多种表示方法; 3、掌握扩散原理; 掌握扩散原理; 4、掌握三种传递之类比; 掌握三种传递之类比; 5、了解传质设备。 了解传质设备。 重点:扩散原理(分子扩散,稳定、不稳定扩散, 重点:扩散原理(分子扩散,稳定、不稳定扩散,等摩 尔相互扩散,单向扩散,涡流扩散,对流扩散) 尔相互扩散,单向扩散,涡流扩散,对流扩散) 的理解,掌握相互间之差别。 的理解,掌握相互间之差别。 难点:相组成的表示;扩散原理。 难点:相组成的表示;扩散原理。
(1)因分子本身扩散引起的宏观流动。 )因分子本身扩散引起的宏观流动。 在总体流动中方向相同, (2)A、B在总体流动中方向相同,流动速度正比于 ) 、 在总体流动中方向相同 cB 摩尔分数。 摩尔分数。 N = N c A N MB = N M MA M c c
化工与材料工程学院---Department of Chemical and Materials Engineering
化工原理课件(天大版)第七章 萃取

Ys XF 1 K) n ln( YS ln( 1 Am ) Xn K
2013-5-19
33
3、多级逆流萃取的流程与计算
1、多级逆流萃取的流程
2013-5-19
34
2、多级逆流萃取的计算
1)萃取剂与稀释剂部分互溶的体系
E1 F R1 R2 M
E2 E3
△
RN
2013-5-19
35
F S M E1 R N
Yn Yo B S N ( X N X N 1 )
——错流萃取每一级的操作线方程
2013-5-19
31
E
Y1 Y2 Y0 O
E1 E2
-B/S2
-B/S3 X2 U X1
-B/S1
V XF
2013-5-19
32
b)解析法 分配曲线: 设: A m
Y KX
KS B
——萃取因子
R
MR ME
S MF F MS
萃余液
2013-5-19
R
萃余相
最小溶剂比
S M'F = F min M ' S
18
7.1.6 、萃取剂的选择
1、萃取剂的选择性和选择性系数
1)萃取剂的选择性
A在萃取相中的质量分率 B在萃取相中的质量分率
A在萃余相中的质量分率 B在萃余相中的质量分率
(X R X F )
——单级萃取的操作线方程
Y
Y1 E1
B S
X1
2013-5-19
XF X
27
(1) 设计型问题。 已知原料液处理量 和组成,给定溶剂 用量和组成 , 在图中 可确定C(XF,Y0), 按斜率(-B/S) 作操作 线, 与分配曲 线的交点D即为该 过程获得的萃取相 和萃余相的组成点 。 (2) 操作型问题。规定单级萃取的分离要求,如萃余相 组成X,求所需溶剂用量,可在图中根据X确定D(X,Y), 连接C、D得到操作线CD,根据操作线斜率即可求出所需 的溶剂用量。
化工原理-干燥

的,即在一定的气-固接触方式下,固定气体的温度、湿 度和流过物料表面的速度进行实验。 ➢ 为保证恒定干燥条件,采用大量空气干燥少量物料,以使 气体的温度、湿度和流速在干燥器中恒定不变。实验为间 歇操作,物料的温度和湿含量随时间连续变化。
干燥曲线和干燥速率曲线
干燥曲线:物料湿含量 X 与干燥时间 的关系曲线。
ps
19.92
湿比容H (Humid volume) 或干基湿比容 (m3/kg绝干气体)
1kg 绝干气体及所含湿份蒸汽所具有的体积
vH
1 29
H 18
22.4
t
273 101.325
273
P
(0.287 0.462H ) t
273 P
常压下(P=1013.25kN/m2) : vH (0.002835 0.004557 H )(t 273)
显热项
汽化潜热项
对于空气-水系统: IH (1.005 1.884 H )t 2491 .27H
干燥过程的基本规律
物料湿分的表示方法
湿物料是绝干固体与液态湿分的混合物。
湿基湿含量 w:单位质量的湿物料中所含液态湿分的质量。
w
物料所含液态湿份的质量 湿物料的质量
WT Gc WT
干基湿含量 X:单位质量的绝干物料中所含液态湿分的质量。
对于空气-水系统:
H 0.622 ps P ps
H 0.622 pv P pv
相对湿度(Relative humidity)
➢ 若 t < 总压下湿份的沸点,0 100%;
➢ 若 t >总压下湿份的沸点,湿份 ps> P,最大 (气体全为湿
份蒸汽) < 100%。故工业上常用过热蒸汽做干燥介质;
干燥曲线和干燥速率曲线
干燥曲线:物料湿含量 X 与干燥时间 的关系曲线。
ps
19.92
湿比容H (Humid volume) 或干基湿比容 (m3/kg绝干气体)
1kg 绝干气体及所含湿份蒸汽所具有的体积
vH
1 29
H 18
22.4
t
273 101.325
273
P
(0.287 0.462H ) t
273 P
常压下(P=1013.25kN/m2) : vH (0.002835 0.004557 H )(t 273)
显热项
汽化潜热项
对于空气-水系统: IH (1.005 1.884 H )t 2491 .27H
干燥过程的基本规律
物料湿分的表示方法
湿物料是绝干固体与液态湿分的混合物。
湿基湿含量 w:单位质量的湿物料中所含液态湿分的质量。
w
物料所含液态湿份的质量 湿物料的质量
WT Gc WT
干基湿含量 X:单位质量的绝干物料中所含液态湿分的质量。
对于空气-水系统:
H 0.622 ps P ps
H 0.622 pv P pv
相对湿度(Relative humidity)
➢ 若 t < 总压下湿份的沸点,0 100%;
➢ 若 t >总压下湿份的沸点,湿份 ps> P,最大 (气体全为湿
份蒸汽) < 100%。故工业上常用过热蒸汽做干燥介质;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
mV Y mX 2 ( f 、1 ) L Y2 mX 2
② Y1 mX 2 的意义:反映了A吸收率的高低;
Y2 mX 2
Y1 mX 2 Y2 NOG Y2 mX 2
③当采用纯溶剂X2=0时,若已知B=L/Lmin、;
Y1 / m X 2 Y1 L L /V B Lmin (L / V) X1 X 2 mX 1 min X1 X 2 mX 1 Y1 / B 1 mV L m Y Y Y Y Y Y B 1 2 1 2 1 2 其中: Y1 Y1 Y2 Y1 1 ) ( 1 1 B 1 N OG ln 1 1 B 1
① HOG、HOL:反映塔设备条件()、填料性能
及润湿情况,反映设备性能高低; ② NOG、NOL: 反映与相平衡条件(m)、气液 进出塔浓度的关系,反映吸收过程 的难易程度;
③ V/ : kmol(B)/(m2· s);
L/ : kmol(S)/(m2· s);
3.传质单元数的计算
填料层高度的计算关键在于传质单元数NOG、NOL 的计算; ① 图解积分法 当平衡线为曲线时,图解积分法步骤如下:
H OG
V 47.7 / 3600 0.30m KY a 0.088 0.5
Z NOG H OG 14.24 0.30 4.27m
=
【例】空气中含丙酮2%(体积百分数)的混合气以
0.024kmol/(m2· s)的流率进入一填料塔,今用流率为
0.065kmol/(m2· s)的清水逆流吸收混合气中的丙酮, 要求丙酮的回收率为98.8%。已知操作压力为100 kPa,操作温度下的亨利系数为177 kPa,气相总体 积吸收系数为0.0231 kmol/(m3· s)。
得:N OG N OG
Y1 Y2 Y1 ln Y1 Y2 Y2
Y2 Y2 Y2* Y1 Y2 、其中: Y1 Y2 Y1 Y1 Y1* Y1 ln Y2 Y1 Y2 Y1 Y2 、其中:Ym Y1 Ym ln Y2
c.体积总传质系数与传质单元高度的关系:
1 1 H OG K a V 0.8 Y H OG V 0.2; H V OG 同理:H OL L0.2;
② 传质单元数 a.气相总传质单元数 :
NOG
Y1 Y2
Y1 Y2 dY 气相组成变化 * * Y Y (Y Y024kmol / m2 s 因此时为低浓度吸收,故: Ω Ω
mV 1.77 0.024 0.654 S L 0.065 Y mX Y1 1 1 2 1 83.3 Y2 1 1 0.988 Y2 mX 2 Y1 mX 2 1 ln 1 S S 1 S Y2 mX 2
【例】在一塔径为0.8m的填料塔内,用清水逆流 吸收空气中的氨,要求氨的吸收率为99.5%。 已知:空气和氨的混合气质量流量为1400kg/h, 气体总压为101.3kPa,其中氨的分压为1.333 kPa。 若实际吸收剂用量为最小用量的1.4倍,操作温度 293K下的气液相平衡关系为Y*=0.75X,气相总体 积吸收系数为0.088kmol/(m3· s);试求: (1)每小时用水量; (2)用平均推动力法求出所需填料层高度。
③气液相平衡关系: Y * mX
VdY V dY dZ N(a) dZ K a (Y Y *) A Y 整理: L dX dZ LdX dZ N(a) K X a (X * X) A
Y1 V dY Z K a Y2 Y Y * Y 积分: X1 L dX Z K X a X 2 X * X
mV Y1 mX 2 mV 1 N OG ln 1 mV L Y2 mX 2 L 1 L mV 令:S 、称为脱吸因数(解吸因数) L m (S :表示相平衡线与操作线的斜率之比) LV N OG Y1 mX 2 1 ln 1 S S 1 S Y2 mX 2
Y1 Y1 Y1* 0.0134 0.00953 0.00387 Y2 Y2 Y2* 0.0000669 0 0.0000669 Y1 Y2 0.00387 0.0000669 Ym 0.000936 Y1 0.00387 ln ln 0.0000669 Y2 N OG Y1 Y2 0.0134 0.0000669 14.24 Ym 0.000936
其中:NOG 1 的意义
指气体流经一段填料层,溶质组成变化(Y1 - Y2) 等于该段填料平均吸收推动力(Y-Y *)m时, 该段填料为一个传质单元;
b.液相总传质单元数 :
NOL
X1 X2
dX X* X
③填料层高度
填料层高度:Z NOG HOG NOL HOL
讨论:
解: y1 1.333 0.0132 (1) y1 0.0132 Y1 0.0134
101.3 1 y1 1 0.0132 Y2 Y1 (1 ) 0.0134(1 0.995) 0.0000669 X2 0
因混合气中氨含量很少,故:
1400 M 29kg/kmol V (1 0.0132) 47.7kmol/h; 29 Ω 0.785 0.82 0.5m2;
kmol s m a.传质单元高度单位: 3 2 (kmol m s)m
b.传质单元高度的意义: 完成一个传质单元效果分离所需的填料层高度;
Y1 Y2 Y1 dY Y2 Y Y * Y 1 m 当: X X1 X 2 1 dX X 2 X * X X m 1
单位填料层dZ内吸收溶质A的量;
:塔截面积、m2;
GA:溶质A的流率、kmol/s ; ② 吸收速率方程: dGA N AdA N A (adZ ) a:单位体积填料的有效传质面积、 单位: m2传质面积/m3填料;
N A KY (Y Y * ) 其中: * NA K X ( X X )
Y1 Y2 (Y Y )1 (Y Y )2 d (Y ) A dY Y1 Y2 Y1 Y2
* *
NOG
Y1 dY Y1 Y Y dY d Y 1 2 * Y2 Y Y Y2 Y Y2 Y Y Y 1 2 Y1
a.操作线上任取一点(X、Y),推动力为 (Y - Y*);
1 b.系列Y~ Y Y * 作图得曲线;
c.积分计算Y2至Y1范围内的阴影面积;
N OG
Y1 Y2
dY Y Y*
Y
Y1
E
1 Y Y*
Y2
o
dY Y2 Y Y *
Y1
X2
X1 X
Y2
Y1
② 对数平均推动力法
汽液平衡线为直线:Y * mX b 条件: L L 吸收操作线为直线:Y X (Y1 X 1 ) V V 吸收推动力为直线:Y Y Y * AY B
Y1 mX 2 Y2 mX 2
NOG ( f
mV Y mX 2 、1 ) L Y2 mX 2
NOG 讨论: ①S=mV/L的意义: 反映了吸收过程推动力的大小,为平衡线斜率 与吸收操作线斜率的比值;
V Y1 mX 2 L L 一定,S 推动力 、NOG Y2 mX 2 mV m
Y1 Y2 47.7(0.0134 0.0000669) 得:Lmin V * 35.6kmol / h 0.0134 X1 X 2 0 0.75 实际吸收剂用量:L 1.4 Lmin 1.4 35.4 49.8kmol / h
(2)用平均推动力法:
47.7 (0.0134 0.0000669) X1 X 2 V Y1 Y2) L 0 ( / 0.0128; 49.8 Y1* 0.75 X1 0.75 0.0128 0.00953、Y2* 0;
•平均推动力法适用: a. 平衡线为直线时:逆流、并流吸收皆可;
b.当
Y1 2 Y2
NOG
Y1 Y2 X1 X 2 、NOL ; Ym X m
X 1 、 2 时:可用算术平均推动力 ; X 2
c.平衡线与操作线平行时:
Ym Y Y1 Y2 Y1 Y1 Y1* Y2 Y2 Y2* Y1 Y2 Y1 Y2 Y1 Y2 N OG Ym Y1 Y2 当Y * mX N OG Y1 Y2 Y1 Y2 Y1 mX 2 1 Y1 mX 1 Y2 mX 2 Y2 mX 2 Y1 1 ) Y2 1
N OG
X1 X 2 X1 X 2 同理:N OL= N OL= X 1 X 2 X m X 1 ln X 2 其中:X m
* X 1 X 2 X 1 X 1 X 1 、 ; * X 1 X 2 X 2 X 2 ln X 2
注意:
① 稳态操作中V、L、均为常量;
② KYa与KXa:称为气相与液相总体积传质系数;
物理意义:在单位推动力下,单位时间单位
体积填料层内吸收的溶质量; 单位:kmol/(m3· s);
③ a:反映吸收设备的大小和填料特性、
也反映流体物性和流动状态的影响; 注:KY的单位:kmol/(m2· s);
2.传质单元高度与传质单元数
填料层高度: Y1 X1 V dY L dX Z Y2 Y Y * K X a X 2 X * X KY a
