第三节沉淀溶解平衡
第3节 沉淀溶解平衡

利用沉淀转化原理,在工业废水的处理过程中,常 用FeS(s) 、MnS(s)等难溶物作为沉淀剂除去废水中的 Cu2+、Hg2+、Pb2+等重金属离子。 Ksp(FeS)=6.3×10-18mol2•L-2
Ksp(PbS)=3.4×10-28mol2•L-2 Ksp(CuS)=1.3×10-36mol2•L-2
1
4
解:
1.0 10 mol • L K sp
2 -2
5
∴
有BaSO4沉淀生成
思考
为什么医学上常用BaSO4做内服造影剂“钡餐”, 而不用BaCO3做内服造影剂?请从沉淀溶解平衡角度 解释:
学以致用
BaSO4 和BaCO3的沉淀溶解平衡分别为: BaSO4(s) BaCO3(s) BaCO3(s) Ba2+ (aq) + SO42-(aq) Ba2+(aq) + CO32- (aq) Ba2+ + CO32+ Ksp=1.1×10-10mol2L-2 Ksp=5.1×10-9mol2L-2 所以,不能用BaCO3作 为内服造影剂“钡餐”。
尽管PbI2固体难溶于水, 但仍有部分Pb2+和 I-
Pb2+ l-
溶解
PbI2s)
Pb2+
沉淀
离开固体表面进入溶液, 同时进入溶液的Pb2+和 I-又会在固体表面沉淀 下来,当这两个过程速 率相等时, Pb2+和 I的沉淀与PbI2固体的溶 解达到平衡状态即达到 沉淀溶解平衡状态. PbI2固体在水中的沉淀 aq) + 2l (aq) 溶解平衡可表示为:
沉淀溶解平衡方程式:AmBn(s)
mAn+(aq) + nBm-(aq)
3.3.1沉淀溶解平衡

①溶度积(Ksp )的大小与难溶电解质性质和温度 有关,与沉淀的量无关.
②离子浓度的改变可使平衡发生移动,而不能改 变溶度积.
写出下列物质的沉淀溶解平衡 表达式和KSP表达式:
AgCl、Ag2CO3 Ag2SO4、Mg(OH)2
Fe(OH)3、Ag2CrO4
二、溶度积常数或溶度积(Ksp ): 4)意义:反映了难溶电解质描述正确的是( B) A.反应开始时,溶液中各离子浓度相等 B.沉淀溶解达到平衡时,沉淀的速率与溶解 的速率相等 C.沉淀溶解达到平衡时,溶液中离子的浓度 相等且保持不变 D.沉淀溶解达到平衡时,如果再加入该沉淀 物,将促进溶解
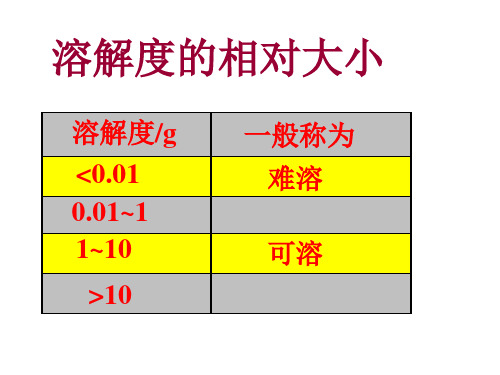
2.难溶等于不溶吗?
习惯上,将溶解度小于0.01克的电解质称为难 溶电解质。难溶电解质的溶解度尽管很小,但不 会等于0 ,没有绝对不溶的物质。
1滴加PbI2溶液
PbI2在水中溶解平衡 尽管PbI2固体难溶于水, 但仍有部分Pb2+和 I-
Pb2+ l-
PbI2(s)
溶解
沉淀
Pb2+ (aq) + 2l-(aq)
离开固体表面进入溶液, 同时进入溶液的Pb2+和 I-又会在固体表面沉淀 下来,当这两个过程速 率相等时, Pb2+和 I的沉淀与PbI2固体的溶 解达到平衡状态即达到 沉淀溶解平衡状态. PbI2固体在水中的沉淀 溶解平衡可表示为:
一、沉淀溶解平衡 1)概念: 一定温度下,当沉淀溶解的速率和沉淀生成的 速率相等时,形成电解质的饱和溶液,达到平衡 状态,我们把这种平衡称为沉淀溶解平衡 。
2)表达式: Mg(OH)2 (s)
Mg2+ (aq) +2OH- (aq)
沉淀溶解平衡和 化学平衡、电离 + 2 2CaCO (s) Ca +CO 练:书写碳酸钙溶解平衡的表达式 3 3 平衡一样,符合 平衡的基本特征、 逆、等、动、定、变 3)特征: 满足平衡的变化 基本规律。
第三章沉淀溶解平衡

第二节 沉淀的生成 第三节 分步沉淀和沉淀的转化 第四节 沉淀的溶解 沉淀溶解平衡的移动 例: AgCI(s) 溶度积规则 溶解 是平衡移动 Ag+ + CI- 规律的总结
沉淀
(production of precipitation)
第二节 沉淀的生成
沉淀的生成
●沉淀生成的必要条件: 增大离子浓度,使 IP>KSP ●采用方法: ①加入沉淀剂 ②控制溶液 pH(对难溶弱酸盐和难溶 氢氧化物).
积、同浓度的NH3· H2O相混合,①有无Mg(OH)2沉 淀析出?②如果要阻止沉淀析出,至少应加多少克 NH4CI(s)?已知 Ksp(Mg(OH)2)=5.61×10-12, Kb(NH3)=1.79×10-5
=1.79×10-5×0.05/1.06×10-5 =8.44×10-2(mol· L-1) ∴需加NH4CI(s): 8.44×10-2×0.020×53.5 =9.03×10-2(g)
√ 5.61×10-12/0.05 = =1.06×10-5(mol· L-1) 采用方法:利用同离子效应,加NH4CI(s)来 抑制NH · H O离解.
【例3-7】试分析10ml 0.10mol· L-1MgCI2与等体
解:②NH3· H2O NH4+ + OH0.05 x 1.06×10-5 [NH4+]=Kb [NH3· H2O]/ [OH-]
[H+ ]=
√
Ka1Ka2 [M2+][H2S] KSP(MS)
1 KSP
式中 [H2S]饱和= 0.1(mol· L-1)
结论: 使MS(s)溶解所需
[H+ ]∝
沉淀的溶解
小结 多种离子平衡共存时的处理方法
第三节 沉淀溶解平衡

淀剂。
据此,可加入沉淀剂而析出沉淀,是分离、除杂常用的方
法。如以Na2S、H2S等作沉淀剂,使某些金属离子如Cu2+、Hg2
+等生成极难溶的硫化物CuS、HgS等沉淀。
自主探究 精要解读 实验探究 活页规范训练
正、逆向反应同 正、逆向反应 正、逆向反 时进行 同时进行 应同时进行 平 v(离子化)= v(水解)=v( v(正)=v(逆) 衡 等 v(分子化) 中和) 状 反应混合物中各 溶液中各离 溶液中各离子 态 定 组分物质的量保 子浓度保持 浓度保持不变 特 持不变 不变 点 动 处于动态平衡中 变
的浓度。 4.沉淀的转化
该难溶盐饱和溶液中某一离子
(1)在含有沉淀的溶液中,加入适当试剂,与某一离子结合 成为 更难溶 的物质。 (2)沉淀转化的实质是沉淀溶解平衡的 移动 。
自主探究
精要解读
实验探究
活页规范训练
【慎思1】 Ksp越小,对应物质的溶解度则越小,此说法正
确吗?
提示 不正确。 【慎思2】 请思考所有难溶电解质的Ksp都一定会随温度的
2.沉淀的生成 (1)欲使某物质析出沉淀必须使其浓度商大于 溶度积(填 “大于”“小于”或“等于”),这就要增大 离子浓度 ,使反 应向生成沉淀的方向进行。 (2)控制溶液的 pH ,可使某些难溶的弱酸盐和氢氧化物 沉淀或溶解。
自主探究 精要解读 实验探究 活页规范训练
3.沉淀的溶解
要使沉淀溶解,必须 降低
升高而变大吗?并说明原因。
提示 不一定。Ksp升高表示难溶电解质的溶解能力增强, 只有那些随温度升高溶解度增大的难溶电解质的Ksp才变大,如 Ca(OH)2就不是。
鲁科版高中化学选择性必修1第3章第3节第1课时沉淀溶解平衡与溶度积课件

)
A.T ℃时,图中 X 点对应的是不饱和溶液
B.向饱和 Ag2CrO4 溶液中加入固体 K2CrO4 不能使溶液由 Y 点变为 X 点
C.T ℃时,在 Y 点和 Z 点,Ag2CrO4 的 Ksp 相等
D.图中 a= ×10-4
解析:X 点位于 Z 点上方,则 T ℃时,图中 X 点对应的是过饱和溶液,A 项不正确;向饱
。
微点拨:一般沉淀溶解平衡的研究对象是难溶或微溶电解质,但实际上易溶
电解质也存在沉淀溶解平衡。
3.难溶电解质溶解平衡的影响因素
(1)内因:难溶电解质本身的性质。
(2)外因。
外因
温度
绝大多数难溶盐的溶解过程是吸热过程,升高温度,平衡
向 溶解 的方向移动
浓度
加水稀释,平衡向 溶解 的方向移动
同离子
效应
水也增多了,折算成100 g 水溶解的固体质量(即溶解度)仍然不变。
学科素养测评
溴化银是一种淡黄色难溶物,见光可以分解,化学方程式为 2AgBr
2Ag+Br2,这个反
应既可以用于黑白相片的显影,又可以用于制作变色眼镜。
A.CaCO3 的电离方程式:CaCO3
-
-
-
-
B.HC 的电离方程式:HC +H2O
C.C 的水解方程式:Cห้องสมุดไป่ตู้ +2H2O
)
-
Ca2++C
+
-
H3O +C
H2CO3+2OH-
D.CaCO3 的沉淀溶解平衡表达式:CaCO3(s)
-
Ca2+(aq)+C (aq)
沉淀溶解平衡

第三节沉淀溶解平衡一.沉淀溶解平衡与溶度积1.沉淀溶解平衡也是一种动态平衡,指的是在一定条件下,难溶电解质溶于水形成饱和溶液, 的速率与的速率相等的平衡状态。
2.沉淀溶解平衡的表示方法:写出PbI2的沉淀溶解平衡方程式3.沉淀溶解平衡的平衡常数为,符号为,上述PbI2的溶度积表达式为。
K SP反应了难溶电解质在水中的,当化学式所表示的组成中阴离子与阳离子个数比相同时,K SP数值越的难溶电解质在水中的溶液能力越。
二.沉淀溶解平衡的应用1.沉淀的溶解与生成对于难溶电解质AmBn(s) ≒mA n+(aq.)+nB m-(aq.),其浓度商Q= ,通过比较Q 和K SP的相对大小,可以判断沉淀的溶解与生成:(1)Q<K SP时,沉淀;(2)Q>K SP时,沉淀;(3)Q=K SP时达到沉淀溶解平衡状态。
2.沉淀的转化(1)在试管中加入ZnSO4溶液,再滴入Na2S溶液,可以观察到的现象是离子方程式为;静置后倾去上层清液,并用蒸馏水洗涤沉淀2到3次,向沉淀中滴加CuSO4溶液,可以观察到的现象是,离子方程式为。
(2)工业用FeS除去废水中的Cu2+、Hg2+、、Pb2+等重金属离子。
写出离子方程式:【课中导学案】学习目标:⑴知道难溶电解质在水中存在溶解情况,并能结合实例进行描述。
⑵能够运用平衡移动的观点对沉淀的溶解与生成进行分析。
⑶能写出溶度积的表达式,知道溶度积的含义及可以反映难溶电解质在水中的溶解能力。
⑷培养知识迁移能力、动手实验的能力和逻辑推理能力。
重难点:沉淀溶解平衡的应用教学过程:【引入】我们使用的自来水中往往含有碳酸氢钙、碳酸氢镁,因此水壶、输送热水的管道内壁常常积有水垢,你知道水垢的成分是什么吗?如何形成的?一、沉淀溶解平衡【思考】硫酸钡、氯化银等物质都难溶于水,所以称为难溶电解质。
难溶电解质在水中是否绝对不溶解?【知识支持】物质的溶解性规定如下:(硫酸钡的溶解度:2.4×10-4g;氯化银的溶解度:1.5×10-4g)【观察思考】教材P90页---------PbI2固体的溶解平衡:1.解释现象并讨论出现该现象的原因:2.写出PbI2的沉淀溶解平衡方程式:【思考】沉淀溶解平衡和化学平衡一样,都是动态平衡。
沉淀溶解平衡

实验现象: 实验现象:
在上层清液中滴 KI溶液后 溶液后, 加KI溶液后,有 黄色沉淀产生。 黄色沉淀产生。
静置, 静置,待上层 液体变澄清
结论解释: 结论解释:
结论:说明上层清液中有 结论:说明上层清液中有Pb2+. + Pb2+(aq) + 2I-(aq) 解释:上层清液中存在平衡 上层清液中存在平衡, 解释 上层清液中存在平衡, PbI2(s) 当加入KI溶液后, 浓度增大,平衡向逆方向移动, 当加入 溶液后,I- 浓度增大,平衡向逆方向移动,从 溶液后 而有黄色沉淀PbI2产生 而有黄色沉淀 实验结论:难溶物也有部分溶解,也存在溶解平衡。 实验结论:难溶物也有部分溶解,也存在溶解平衡。
BaCO3 Ba2+ + CO32- Ksp=5.1×10-9mol2•L-2 × 由于人体内胃酸的酸性较强(pH0.9-1.5),如果服下 由于人体内胃酸的酸性较强 ,如果服下BaCO3,胃 胃 酸会与CO32-反应生成CO2和水,使CO32-离子浓度降低,使 酸会与 反应生成 和水, 离子浓度降低, Qc < Ksp,使BaCO3的沉淀溶解平衡向右移动,使体内的 2+ 的沉淀溶解平衡向右移动,使体内的Ba 浓度增大而引起人体中毒。 浓度增大而引起人体中毒。 BaCO3 Ba2+ + CO32+ 所以,不能用BaCO3作 所以,不能用 不与H 而SO42-不与 +结合生成硫 H+ 胃酸中的H 酸,胃酸中的 +对BaSO4的 为内服造影剂“钡餐” 为内服造影剂“钡餐”。 2+浓 溶解平衡没有影响, 溶解平衡没有影响,Ba 度保持在安全浓度标准下, 度保持在安全浓度标准下, 钡餐” 所以用BaSO4 作“钡餐”。 CO2+H2O 所以用
18-19 第3章 第3节 沉淀溶解平衡

当 堂 达 标 • 固 双 基
合 作 探 究 • 攻 重 难
A [①利用的是水解原理, ⑤利用两种离子水解的相互促进作用, ②③④ 体现的均是沉淀溶解平衡原理。]
课 时 分 层 作 业
返 首 页
自 主 预 习 • 探 新 知
3.沉淀的转化 (1)实质:是 沉淀溶解平衡 的移动。 (2)特点
当 堂 达 标 • 固 双 基
合 作 探 究 • 攻 重 难
①通常一种沉淀可以转化为另一种更难溶的沉淀。 ②两种难溶物的 溶解能力差别越大,越容易转化。
课 时 分 层 作 业
课 时 分 层 作 业
返 首 页
自 主 预 习 • 探 新 知
2.下列应用或现象主要体现的是沉淀溶解平衡原理的是( ①热纯碱溶液洗涤油污的能力强
)
②误将钡盐[BaCl2、Ba(NO3)2]当作食
盐食用后,常用 0.5%的 Na2SO4 溶液解毒 ③溶洞的形成 ④碳酸钡不能作 “钡餐”而硫酸钡能 ⑤泡沫灭火器灭火 A.②③④ C.③④⑤ B.①②③ D.全部
合 作 探 究 • 攻 重 难
②表达式:当难溶强电解质 AmBn 溶于水形成饱和溶液时,建立沉淀溶解 平衡:AmBn(s) m A n + ( a q) + n B m - ( a q) , 其 溶 度 积 的 表 达 式 为 K s p =
[An+]m[Bm-]n 。
课 时 分 层 作 业
返 首 页
返 首 页
自 主 预 习 • 探 新 知
(3)应用 除去废水中的 Cu2+、 Hg2+、 Pb2+等, 常用 FeS、MnS 等难溶物作沉淀剂。
合 作 探 究 • 攻 重 难
如可用 FeS 等难溶杂质作为沉淀剂除去废水中的重金属离子 Cu2+,沉淀转化 + + FeS(s)+Cu2 (aq)===Fe2 (aq)+CuS(s) 反应为 。
第三节沉淀溶解平衡

例3(2009山东卷28)运用化学反应原理研究氮、氧等单质及 其化合物的反应有重要意义。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合
溶液中逐滴加入氨水,先生成C__u_(_O__H__)_2沉淀(填化学式)。
练习(08山东卷)某温度时,BaSO4在水中的沉淀溶解
平A.衡加曲入线N如a2图SO所4可示以。使下溶列液说由法a正点确变的到是b点( C )
B.通过蒸发可以使溶液由d点变到c点 C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
总结:
⑴在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度 只能在曲线上变化,不会出现在曲线外的点 ⑵溶液在蒸发时,离子浓度的变化分两种情况: ①原溶液不饱和时,离子浓度要增大都增大; ②原溶液饱和时,离子浓度都不变。 ⑶溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关, 在同一曲线上的点,溶度积常数相同。
FeS(s) + Hg2+=HgS(s) + Fe2+ FeS(s) + Pb2+=PbS(s) + Fe2+
除FeS之外,难溶物MnS也可以做沉淀剂。常见的 沉淀剂还有H2S、Na2S、NaHS、(NH4)2S等都可以 除去废水中的Cu2+、Hg2+、Pb2+等重金属离子。
课堂小结 沉淀的溶解、生成与转化都是通
练习 (2010·山东高考)某温度下,Fe(OH)3(s)、Cu(OH)2(s) 分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳 离子浓度的变化如图所示.据图分析,下列判断错误的是
第3节 沉淀溶解平衡

第3节沉淀溶解平衡一.沉淀溶解平衡与溶度积20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:1.溶解平衡状态(1)定义:在一定温度下的水溶液里,沉淀溶解速率和离子生成沉淀速率相等,固体的量和溶液中各离子浓度不再改变时的状态。
(2)表示方法:如PbI 2的沉淀溶解平衡可表示为PbI2(s)Pb2+(aq)+2I-(aq)。
(沉淀溶解平衡是溶解平衡,因为PbI2是强电解质,不存在电离平衡。
)(3)特点:沉淀溶解平衡符合化学平衡的特点。
“动”——动态平衡。
“等”——离子生成沉淀速率和沉淀溶解速率相等。
“定”——沉淀的量及溶液中离子浓度保持不变。
“变”——条件改变,平衡发生移动。
2.溶度积(1)定义:沉淀溶解平衡的平衡常数叫溶度积常数或溶度积,通常用符号K sp来表示。
(2)表达式:当难溶强电解质A m B n溶于水形成饱和溶液时,建立沉淀溶解平衡:A mB n(s)m A n+(aq)+n B m-(aq),其溶度积的表达式为K sp=c m平(A n+)·c n平(B m-)。
(3)影响因素:K sp只与难溶电解质的性质和温度有关,而与沉淀的量无关。
(4)意义:K sp反映了难溶电解质在水中的溶解程度。
通常,对于相同类型的难溶电解质(如AgCl、AgBr 和AgI),K sp越大,难溶电解质在水中的溶解程度就越高。
[K sp(AgCl)>K SP(AgBr)>K SP(AgI)]3.影响沉淀溶解平衡的因素(1)内因:难溶电解质本身的性质。
(2)外因:①浓度:加水稀释,平衡向沉淀溶解的方向移动;②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向沉淀溶解的方向移动;③同离子效应:向平衡体系中加入难溶物溶解产生的离子,平衡向生成沉淀的方向移动;④其他:向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向沉淀溶解的方向移动。
以AgCl(s)Ag+(aq)+Cl-(aq)ΔH>0为例,填写外因对溶解平衡的影响外界条件移动方向C平(Ag+)C平(Cl-)K sp升高温度正向增大增大增大加水稀释正向不变不变不变加入少量AgNO3逆向增大减小不变通入HCl 逆向减小增大不变通入H2S 正向减小增大不变1.已知溶液中存在平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)ΔH<0,下列有关该平衡体系的说法正确的是()①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下,向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入Na2CO3溶液,其中固体质量增加⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A.①⑥ B.①⑥⑦ C.②③④⑥D.①②⑥⑦答案 A2.溶度积(K sp)的应用(1)利用K sp比较难溶电解质的溶解度的大小:相同温度下,同种类型的难溶电解质,K sp越大,溶解程度就越高。
第三节__沉淀溶解平衡

课下练习:
导学练: 变式练习2 1.2.3.12.13
作业:例2
第3节 沉淀溶解平衡
(第二课时)
联想质疑
(1)加热可以使天然水中的Ca(HCO3)2与 Mg(HCO3)2分别分解为CaCO3与MgCO3,你知道水垢 的成分是什么吗?它们是怎样生成的?
(2)在处理污水时,可以向其中加入FeS固体, 以除去Cu2+、Hg2+、Pb2+等重金属离子。在此过 程中发生了哪些化学反应? CaCO3、FeS、Mg(OH)2等盐或碱为难溶电解质, 尽管难溶电解质难溶于水,但在水中也会建 立一动态平衡————沉淀溶解平衡。
第3节 沉淀溶解平衡
(第一课时)
高二化学组 2008.12
一、沉淀溶解平衡与溶度积
观察思考
阅读课本90页的观察·思考,回答以下 问题:
取有PbI2沉淀的饱和溶液中上层清液,即PbI2的饱和溶液滴 加几滴KI溶液,观察到什么现象?你能解释观察到的现象
吗?
1、沉淀溶解平衡:
尽管PbI2固体难溶于水,但仍有部分Pb2+和I-离开固体表面进 入溶液,同时进入溶液的Pb2+和I-又会在固体表面沉淀下来。
K=Q,___处__于__平__衡__状__态________;
K<Q,__平__衡__逆__向__移__动__,__直__到__平__衡__状__态____.
预习检测 知识储备
1.PbI2固体的颜色是___黄__色______. 2. AgCl AgBr AgI沉淀的颜色分别是 _白_色____浅__黄__色____黄__色___,
B.Ksp只与难溶电解质的性质和温度有关,而与沉淀的 量和溶液中离子的浓度无关
第3节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用-2024-2025学年高中化学选择性必修1 化学

第2课时 沉淀溶解平衡的应用【课程标准要求】1.能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
2.学会用沉淀溶解平衡的移动解决生产、生活中的实际问题。
一、沉淀的溶解与生成1.溶度积规则利用浓度商(Q )与平衡常数(K sp )的相对大小判断沉淀的溶解和生成:(1)Q >K sp ,溶液中的离子生成沉淀,直至平衡; (2)Q =K sp ,沉淀溶解与离子生成沉淀处于平衡状态;(3)Q <K sp ,若体系中有足量固体,则固体溶解,直至平衡。
2.应用(1)常使用BaSO 4作为内服造影剂,这种透视技术俗称钡餐透视,但BaCO 3不可用作钡餐,如果误服可溶性钡盐,中毒者应尽快使用5%的Na 2SO 4洗胃。
(2)石笋、钟乳石和石柱的形成,涉及的化学反应有:CaCO 3+CO 2+H 2O===Ca(HCO 3)2、Ca(HCO 3)2=====△CaCO 3↓+H 2O +CO 2↑。
(3)珊瑚虫可以从周围的海水中获取Ca 2+和HCO -3,经反应Ca 2++2HCO -3CaCO 3+CO 2+H 2O 形成珊瑚。
【微自测】1.下列描述中,正确的画“√”,错误的画“×”。
(1)为了减少BaSO 4的损失,洗涤BaSO 4沉淀时可用稀硫酸代替水(√)(2)CaCO 3溶解时常用盐酸而不用稀硫酸,是因为稀硫酸不与CaCO 3反应(×)(3)温度不变,向AgCl 悬浊液中加入少量NaCl 粉末,平衡向左移动,K sp 减小(×)二、沉淀的转化1.ZnS 沉淀转化为CuS 沉淀(1)当向ZnS 沉淀上滴加CuSO 4溶液时,ZnS 沉淀逐渐转化为CuS ,这种转化的总反应为ZnS(s)+Cu 2+(aq)===CuS(s)+Zn 2+(aq)。
(2)沉淀转化实质是沉淀溶解平衡的移动,一种沉淀可以转化为更难溶的沉淀;两种难溶物的溶解能力差别越大,这种转化的趋势就越大。
第三节 沉淀溶解平衡

第三节沉淀溶解平衡第一课时沉淀溶解平衡与溶度积【学习目标】(1)知道难溶电解质的沉淀溶解平衡,并能结合实例进行描述。
(2)能描述溶解平衡,能写出溶度各的表达式,知道溶度积常数(溶度积)的含义。
(3)知道溶度积是沉淀溶解平衡的平衡常数、溶度积可以反映难溶电解质在水中的溶解能力。
【学习重难点】平衡常数(溶度积、溶度积与溶解能力的关系)【课前预习区】1、化学平衡常数与什么有关?2、难溶物在水中是否是完全不能溶解?3、你认为的天然水中的Ca(HCO3)2和Mg(HCO3)2在加热时是如何反应的?天然水加热形成的水垢的成分是。
【预习达标区】1:下列对沉淀溶解平衡的描述正确的是()A、反应开始时,溶液中各离子浓度相等。
B、沉淀溶解平衡达到平衡时,沉淀的速率和溶解的速率相等C、沉淀溶解平衡达到平衡时,溶液中溶质的离子浓度相等,且保持不变。
D、沉淀溶解平衡达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解。
2:下列说法中正确的是()A、物质的溶解性为难溶,则该物质完全不溶于水B、不溶于水的物质溶解度为0克C、绝对不溶解的物质是不存在的D、某离子被沉淀完全是指该离子在溶液中的浓度为零3:在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀后。
若以Ksp表示BaSO4的溶度积,则平衡后溶液中()A.[Ba2+]=[SO42-]= K½spB. [Ba2+]·[SO42-]>Ksp [Ba2+] = [SO42-]C. [Ba2+]·[SO42-] =Ksp [Ba2+]>[SO42-]D. [Ba2+]·[SO42-]≠Ksp [Ba2+]<[SO42-]【课堂互动区】“高露洁高钙牙膏护牙大揭秘”,请阅读以下资料成人每天需摄入钙0.7g,需摄入磷1.4g。
钙离子和磷酸根进入人体后,形成不同形式的钙的磷酸盐,其中以难溶物羟基磷酸钙[Ca5(PO4)3OH]最稳定。
人体内99%以上的钙和85%左右的磷以羟基磷酸钙的形式存在于骨骼和牙齿中。
第三节沉淀溶解平衡
Pb2+ + 2I-
25℃时,Ksp=[Pb2+][I-]2 = 7.1×10-9 mol3·L-3
溶度积(Ksp): 在一定温度下,在难溶电解质的饱和溶液
中,各离子浓度幂之乘积为一常数. MmAn的饱和溶液:
Ksp=[Mn+]m ·[Am-]n
Ksp反映了难溶电解质在水中的溶解能力。
(2)、溶度积(Ksp )的性质
相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶。 如: Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI) 溶解度:AgCl) > Ksp (AgBr) > Ksp (AgI)
练一练
完成难溶物CaCO3、Ag2CrO4、 Mg(OH)2在水中的沉淀溶解平衡 的关系式和溶度积。
S=0.0553g
③、溶度积与离子浓度的换算:
例:已知AgCl 298K时在水中溶解了1.92×10-3 g·L-1,计算其Ksp。
解:AgCl的摩尔质量= 143.5 g ·mol-1 c = 1.92×10-3/143.5 = 1.34 ×10-5 (mol·L-1)
Ksp = c2 = 1.8×10-10
(2) 沉淀的生成
例. 用5%的Na2SO4溶液能否有效除去误食的Ba2+?已知: Ksp(BaSO4)=1.1×10-10mol2•L-2 解:5% 的Na2SO4溶液中的[SO42-]≈0.352mol/L,
[Ba2+]=(1.1×10-10mol2•L-2)/ (0.352mol/L) =2.9×10-10mol•L-1
=8×10-9 > Ksp(PbI2) 所以有PbI2沉淀析出。
范例精析
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节沉淀溶解平衡一、学习点拨1.目标要求(1)了解难溶电解质在水中的溶解情况。
(2)理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积K SP的概念。
(3)掌握运用浓度商和平衡常数来分析沉淀的溶解、生成和沉淀的转化。
(4)掌握简单的利用K SP的表达式,计算溶液中相关离子的浓度。
2.知识要点(1)难溶电解质在水中的沉淀溶解平衡特点,运用溶度积K SP简单计算溶液中相关离子的浓度(2)运用浓度商和平衡常数来分析沉淀的溶解、生成和沉淀的转化。
3.学习方法难溶电解质在水中也会建立一种动态平衡,这种动态平衡和化学平衡、电离平衡一样合乎平衡的基本特征、满足平衡的变化基本规律。
难溶电解质溶解程度大小可以用沉淀溶解平衡常数--溶度积K SP来进行判断,因此我们就可以运用溶度积K SP计算溶液中相关离子的浓度。
对难溶电解质的溶解平衡常数的正确的理解,一方面要运用前面的影响化学平衡、电离平衡的因素知识进行牵移和类比以达到强化和内化的目标;另一方面要用溶度积K SP知识来分析沉淀的溶解、生成和沉淀的转化。
本节内容的核心知识点就是溶度积K SP二、学习训练材料第一课时[知识技能]1.一些电解质如BaSO4在水中只能溶解很少、可以说是难以溶解,所以称为______________。
尽管这些电解质难以溶解于水中,但在水中也会建立一种________ _____。
2.难溶电解质在水中的沉淀溶解平衡和化学平衡、电离平衡一样,合乎平衡的基本特征、满足平衡的变化基本规律,其基本特征为:(1)________ ____(2)__ ______ ____ (3)________ ____(4)________ ____3.难溶电解质在水中存在沉淀溶解平衡,其平衡常数称为_______ __,简称_______ __。
请写出PbI2Cu(OH)2 BaSO4 CaCO3 Al(OH)3 CuS的沉淀溶解平衡与溶度积K SP表达式4.溶度积K SP反映了难溶电解质在水中的__ ______ ___,K SP的大小和溶质的溶解度不同,它只与__ ______ 有关,与__ ______ 无关。
利用溶度积K SP可以判断__ ______ __、__ ______ __以及__ _____ _ __。
5.沉淀的转化是__ _____ _ __的过程,其实质是__ _____ _ __。
当Qc 大于Ksp时,情况为:__ _____ _ __ 当Qc 等于Ksp时,情况为:__ _____ _ __ 当Qc 小于Ksp时,情况为:__ _____ _ __ 6.将AgNO3溶液依次加入氯化钠溶液、溴化钠溶液、碘化钾溶液中都会出现不同颜色的沉淀,沉淀的颜色变化是_ ____ →_ _ ___ →____ _。
出现这种颜色变化的原因是:_ _____ _ 7.将足量BaCO3分别加入:①30mL 水②10mL 0.2mol/LNa2CO3溶液③50mL 0.01mol/L 氯化钡溶液④100mL 0.01mol/L盐酸中溶解至溶液饱和。
请确定各溶液中Ba2+的浓度由大到小的顺序为:_____8.已知在室温时,Cu(OH)2的溶度积Ksp=2.2×10-20mol3·L-3,求室温下Cu(OH)2饱和溶液中Cu2+和OH-的物质的量浓度。
[能力方法]1.铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。
在自然界镓常以极少量分散于铝矿,如Al2O3中。
用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。
发生后一步反应是因为A、镓酸酸性强于铝酸B、铝酸酸性强于镓酸C、镓浓度小,所以不沉淀D、Al(OH)3是难溶物2.己知碳酸钙和氢氧化钙在水中存在下列溶解平衡Ca(OH)2(固)Ca2++2OH-,CaCO 3(固) Ca2++CO32-。
在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写山上述两个反应的化学方程式:①S02与CaCO3悬浊液反应②S02与Ca(OH)2悬浊液反应(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由3.以BaS为原料制备Ba(OH)2·8H2O的过程是:BaS与HCl 反应,所得溶液在70℃~90C时与过量NaOH溶液作用,除杂,冷却后得到Ba(OH)2·8H2O晶体。
据最新报道,生产效率高、成本低的Ba(OH)2·8H2O晶体的新方法是使BaS与CuO反应……1.新方法的反应方程式为:2.该反应反应物CuO是不溶物,为什么该反应还能进行:3.简述新方法生产效率高、成本低的原因。
4.牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:Ca5(PO4)3OH(固)5Ca2++3PO43-+OH-进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是已知Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。
主动脉用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:根据以上原理,请你提出一种其它促进矿化的方法:[拓展体验]一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp 表示。
即:AmBn(s)mA n+(aq)+nB m -(aq) [A n+]m ·[B m -]n =Ksp已知:某温度时,Ksp(AgCl)=[Ag +][Cl -] =1.8×10-10Ksp(Ag 2CrO 4)=[Ag +]2[CrO 2- 4] =1.1×10-12 试求:(1)此温度下AgCl 饱和溶液和Ag 2CrO 4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010mo1·L -1的AgNO 3溶液中,AgCl 与Ag 2CrO 4分别能达到的最大物质的量浓度,并比较两者的大小。
[学习小结]参考答案[知识技能]1.难溶电解质 动态平衡2.可逆过程 沉积和溶解速率相等 各离子浓度不变 改变温度、浓度等条件平衡移动3.溶度积常数 溶度积 (略)4.溶解能力 温度 浓度 沉淀的生成 溶解情况 沉淀溶解平衡移动方向5.一种难溶电解质转化为另一种难溶电解质 沉淀溶解平衡的移动 此时有沉淀析出 直至沉积与溶解达到平衡 沉积与溶解处于平衡状态 若溶液中存在难溶电解质,则难溶电解质会溶解,直至沉积与溶解达到平衡状态6.白→淡黄→黄色 AgCl AgBr AgI 的Ksp 逐渐减小,白色AgCl 沉淀转化成难溶的淡黄色的AgBr ,然后淡黄色的AgBr 再转变成更难溶的黄色AgI 沉淀。
7.③④①②8. 略[能力方法]1.A2.(1)①2SO 2+O 2+2CaCO 3+4H 2O=2(CaSO 4·H 2O)+2CO 2或2SO 2+O 2+2CaCO 3+4H 2O=2(CaSO 4·H 2O)+2CO 2②2SO 2+O 2+2Ca(OH)2+2H 2O=2(CaSO 4·2H 2O)或2SO 2+O 2+2Ca(OH)2=2CaSO 4+2H 2O(2) Ca(OH)2微溶于水,石灰水中Ca(OH)2浓度小,不利于吸收SO 23.(1)BaS +CuO +9H 2O =Ba(OH)2·8H 2O +CuS [也可写Ba(OH)2](2)CuS 的溶度积比CuO 小得多(更难溶),有利于该反应正向进行。
(3)CuS 为难溶物(未反应的CuO 也不溶),过滤后,将滤液浓缩、冷却,就可在溶液中析出Ba(OH)2·8H 2O 晶体,故生产效率高;CuS 在空气中焙烧氧化可得CuO 与SO 2,故CuO 可反复使用(SO 2可用于制硫的化合物),因而成本低。
4..H ++OH -=H 2O ,使平衡向脱矿方向移动 5Ca 2++3PO -34+F -=Ca 5(PO 4)3F ↓ 加Ca 2+(或加PO -34等)[拓展体验]①AgCl(s)Ag +(aq)+Cl -(aq)1510sp L mol 103.1108.1)AgCl (K )AgCl (c ---⋅⨯=⨯==Ag 2CrO 4(s) 2Ag +(aq)+CrO 42-(aq)2xx (2x)2·x=Ksp1531234242105.64101.14)()(---⋅⨯=⨯==L mol CrO Ag K CrO Ag c sp ∴ c(AgCl)<c(Ag2CrO4)②在0.010 mol ·L-1 AgNO 3溶液中,c(Ag+)=0.010 mol ·L-1AgCl(s) Ag +(aq) + Cl -(aq) 溶解平衡时: 0.010+x x(0.010+x)·x =1.8×10-10 ∵ x 很小,∴ 0.010+x ≈0.010x =1.8×10-8(mol ·L -1)c(AgCl)= 1.8×10-8(mol ·L -1)Ag 2CrO 4(s)2Ag +(aq) + CrO 2-4(aq)溶解平衡时:0.010+x x(0.010+2x)2·x =1.1×10-12∵ x 很小,∴ 0.010+2x ≈0.010 x =1.1×10-8(mol ·L -1)∴ c(Ag 2CrO 4)=1.1×10-8 (mol ·L -1) ∴ c(AgCl)>c(Ag 2CrO 4)。
