02热力学第一定律z
02热力学第一定律

压缩机工作时,速率很快,来不及进行热交换
Q0
W U 2731J
3. 摩尔恒压热容与摩尔恒容热容的关系
C p ,m CV ,m
H m T U m T
T2 T1
U QV n CV ,mdT
2.4.2
应用——计算单纯pVT 过程的U 恒容过程:
U QV n CV ,mdT
T2 T1
非恒容过程: U QV n
T2
T1
CV ,mdT
(理想气体)
nCV ,m (T2 T1 )
2. 摩尔定压热容
C p ,m
•自由膨胀过程
∵pamb=0 • 恒容过程 dV=0 W=0 ∴W=0
热力学能U:系统内部储存的能量,是广度量的状态函数。
分子平动能 动能 分子转动能 系统总能量 势能 分子振动能 热力学能 分子间作用能 电子运动能 核运动能
符号规定: 若热力学能增加+,若热力学能减小U 的绝对值无法求,但U可求
T,p 2HCl(aq)+Zn(s) ZnCl 2 (aq)+H2 (g)
这是什么体系?界面在什么位置?
如果上述反应是在恒容、绝热,不透光、不导 电的容器中进行,它又是什么体系?
作业:以电解水为例确定界面使系统分别为隔离系统、 封闭系统、敞开系统
2. 状态与状态函数 (1)状态与状态函数 系统的性质:决定系统状态的物理量(如p,V,T,Cp,m)
系统的状态:热力学用系统所有的性质来描述它所处 的状态,当系统所有性质都有确定值时,则系统处于一 定的状态
物理化学讲义02 热力学第一定律

第二章 热力学第一定律一.基本要求1.掌握热力学的一些基本概念,如:各种系统、环境、热力学状态、系统性质、功、热、状态函数、可逆过程、过程和途径等。
2.能熟练运用热力学第一定律,掌握功与热的取号,会计算常见过程中的和的值。
3.了解为什么要定义焓,记住公式的适用条件。
4.掌握理想气体的热力学能和焓仅是温度的函数,能熟练地运用热力学第一定律计算理想气体在可逆或不可逆的等温、等压和绝热等过程中,的计算。
5.掌握等压热与等容热之间的关系,掌握使用标准摩尔生成焓和标准摩尔燃烧焓计算化学反应的摩尔焓变,掌握与之间的关系。
6.了解Hess定律的含义和应用,学会用Kirchhoff定律计算不同温度下的反应摩尔焓变。
二.把握学习要点的建议学好热力学第一定律是学好化学热力学的基础。
热力学第一定律解决了在恒定组成的封闭系统中,能量守恒与转换的问题,所以一开始就要掌握热力学的一些基本概念。
这不是一蹴而就的事,要通过听老师讲解、看例题、做选择题和做习题等反反复复地加深印象,才能建立热力学的概念,并能准确运用这些概念。
例如,功和热,它们都是系统与环境之间被传递的能量,要强调“传递”这个概念,还要强调是系统与环境之间发生的传递过程。
功和热的计算一定要与变化的过程联系在一起。
譬如,什么叫雨?雨就是从天而降的水,水在天上称为云,降到地上称为雨水,水只有在从天上降落到地面的过程中才被称为雨,也就是说,“雨”是一个与过程联系的名词。
在自然界中,还可以列举出其他与过程有关的名词,如风、瀑布等。
功和热都只是能量的一种形式,但是,它们一定要与传递的过程相联系。
在系统与环境之间因温度不同而被传递的能量称为热,除热以外,其余在系统与环境之间被传递的能量称为功。
传递过程必须发生在系统与环境之间,系统内部传递的能量既不能称为功,也不能称为热,仅仅是热力学能从一种形式变为另一种形式。
同样,在环境内部传递的能量,也是不能称为功(或热)的。
例如在不考虑非膨胀功的前提下,在一个绝热、刚性容器中发生化学反应、燃烧甚至爆炸等剧烈变化,由于与环境之间没有热的交换,也没有功的交换,所以。
工程热力学 第二章 热力学第一定律

wt
1 2
cf22
cf21
gz2
z1 ws
(2-11)
将轴功的表达式代入上式,即有:
2
1 d ( pv)
2
2
1 pdv 1 vdp
wt 12 pdv p2v2 p1v1 12 vdp (2-11a)
由上式可知,准静态过程的 技术功的大小可用过程线左边的 面积来表示。
准静态 pdv d( pv) wt
wt pdv d( pv) pdv ( pdv vdp) vdp
wt vdp wt vdp
准静态
q du pdv
q dh vdp
热一律解析式之一 热一律解析式之二
技术功在示功图上的表示
q12 (u2 u1) w12
Q dU pdV (2-4)
2
Q12
(U2
U1)
pdV
1
(2-4a)
q du pdv (2-4b)
2
q12
(u2 u1)
pdv
1
(2-4c)
2-3 开口系统能量方程 Energy balance for open system
式中各项的正负号规定为:系统吸热为正,放热为负; 系统对外作功为正,外界对系统作功为负。
上式既适用于准静态过程,也适用于非准静态过程。
对于无耗散的准静态过程, w pdv
因此上述诸式可写为:
Q dU W
Q12 (U2 U1) W12
对1kg工质,有:
q du w
所以有:
h1 h2
1 2
02章 热力学第一定律

We' ,2 = − ∫ p e dV = − p1 (V1 − V2 )
V1 V2
We' ,3 = − p" (V " −V2 ) − p' (V ' −V " ) − p1 (V1 − V ' ) We' ,4 = − ∫ ( p i + dp )dV ≈ − ∫ p i dp = − nRT ln
V2 V2 V1 V1
V1 = −We ,4 V2
We ,4 = We' ,4
ΔU = Q + W
(W = We, Wf = 0)
一、等容过程(isochoric process) ΔV = 0
适用条件:封闭体系平衡态,不做非体积功的等容过程。 二、等压过程(isobaric process) p1 = p2 = pe
热力学概论
程
Su
n
2.3
热力学的一些基本概念 P67
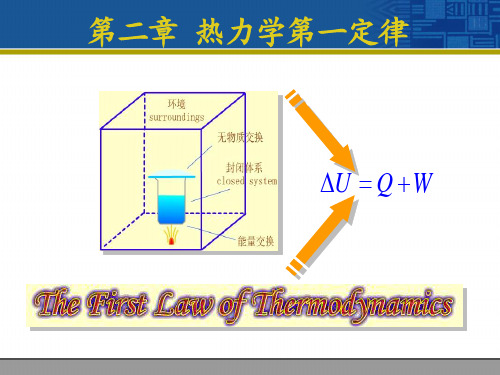
一.系统(体系 System)与环境(surroundings) (1)定义: (2)体系的分类:① 敞开体系(open system)② 封闭体系(closed system) ③ 孤立体系(isolated system) 二.体系的性质(状态性质、热力学性质、热力学变量) 分类 广度性质(extensive properties) : 其数值与体系的物质的量成正比, 具加和性, 是 n 的一次齐函数。 如体积、 又称为容量性质, 质量、熵等。 强度性质(intensive properties) : 其数值取决于体系自身的特点,不具加和性,是 n 的零次齐函数。如温度、压力等。
02第二章 热一律2-1热力学第一定律的实质及表达式

吸热膨胀作功(参看图2-3c) 吸热膨胀作功 外界供给热量 –Q 膨胀功 –W 热力学能 –U2
排气过程中(参看图2-3d) 排气过程中 外界消耗排气功 外界获得推动功 排气后(参看图2-3a) 排气后 质量 m = 0 总能量 E2 = 0
开口系在一个工作周期中的能量进出情况
Q=Q ∆E = 0
1 2 2 w = ( p2 v2 − p1v1 ) + (c2 − c1 ) + g ( z 2 − z1 ) + wsh 2
(2-16)
总功(Wtot )、膨胀功(W )、技术功( W t )和轴功 (W sh )之间的区别和内在联系 膨胀功、技术功、轴功孰大孰小取决于 ( p 2 v2 − p1v1 ) 1 2 2 (c2 − c1 ) 、 g ( z 2 − z1 ) 的大小和正负。
二、热力学第一定律表达式
1、一般热力系能量方程
- 热力学第一定律基本表达式
热力系总能量(total stored energy of system)为E(图2-1a)。它是 热力学能(U)、宏观动能(EK)和重力位能(EP)的总和: 热力学能,内部储存能 热力学能,
E =U+Ek +Ep
宏观动能 总能 宏ቤተ መጻሕፍቲ ባይዱ位能 外部储存能
e =u+ek +ep
根据质量守恒定律可知:热力系质量的变化等于流进和流出 质量的差:
dm = δm1 − δm2
根据热力学第一定律可知:
热力系输出的能量的总和= 加入热力系的能量的总和 - 热力系输出的能量的总和=热力系总能量的增量
(δQ + e1δm1) (δW总 + e2δm2 ) = ( E + dE ) − E −
热力学课后习题02答案

第2章 热力学第一定律2-1 定量工质,经历了下表所列的4个过程组成的循环,根据热力学第一定律和状态参数的特性填充表中空缺的数据。
过程 Q/ kJ W/ kJ△U/ kJ1-2 0 100 -1002-3-11080 -1903-4 300 90 210 4-1 20 -60802-2 一闭口系统从状态1沿过程123到状态3,对外放出47.5 kJ 的热量,对外作功为30 kJ ,如图2-11所示。
(1) 若沿途径143变化时,系统对外作功为6 kJ ,求过程中系统与外界交换的热量; (2) 若系统由状态3沿351途径到达状态1,外界对系统作功为15 kJ ,求该过程与外界交换的热量;(3) 若U 2=175 kJ ,U 3=87.5 kJ ,求过程2-3传递的热量,及状态1的热力学能U 1。
图2-11 习题2-2解:(1)根据闭口系能量方程,从状态1沿途径123变化到状态3时,12313123Q U W −=∆+,得1347.5kJ 30kJ 77.5kJ U −∆=−−=−从状态1沿途径143变化到状态3时,热力学能变化量13U −∆保持不变,由闭口系能量方程14313143Q U W −=∆+,得14377.5kJ 6kJ 71.5kJ Q =−+=−,即过程中系统向外界放热71.5kJ(2)从状态3变化到状态1时,()31133113U U U U U U −−∆=−=−−=−∆,由闭口系能量方程35131351Q U W −=∆+,得35177.5kJ 15kJ 62.5kJ Q =−=,即过程中系统从外界吸热92.5kJ(3)从状态2变化到状态3体积不变,323232323232Q U W U pdV U −−−=∆+=∆+=∆∫,因此23233287.5kJ 175kJ 87.5kJ Q U U U −=∆=−=−=−由1331187.577.5kJ U U U U −∆=−=−=−,得1165kJ U =2-3 某电站锅炉省煤器每小时把670t 水从230℃加热到330℃,每小时流过省煤器的烟气的量为710t ,烟气流经省煤器后的温度为310℃,已知水的质量定压热容为 4.1868 kJ/(kg ·K),烟气的质量定压热容为1.034 kJ/(kg ·K),求烟气流经省煤器前的温度。
热力学第02章 第一定律

推动工质移动所作的功;或因工
质在开口系统中流动而传递的功。
pAx pV mpv
推动功作用在质量m上。m被推入系统内,所以推动功随质量 m一起进入系统。 推动功的意义:工质m流入系统所带入的功(外界对系统作功);
工质m流出系统所带出的功(系统对外界作功)。
2.推动功(flow work; flow energy): p,v ⊿x 如果工质在传递推动功的时候没有热力状态的变化,当然也不 会有能量形态的变化。此时工质所起的作用只是单纯的运输能 量,就像传送带一样,把这部分推动功传递到其他地方。 p
热力学第一定律:
进入系统的能量 —
离开系统的能量 = 系统内部能量的增量
第一定律定第一表达式 第一定律定第二表达式
Q dU W
Q dH Wt
上节课内容回顾
第一定律第一解析式 —— 热 功的基本表达式
Q U W q u w
1)对于可逆过程
δQ dU δW δq du δw
第二章 热力学第一定律
the first law of thermodynamics
§2-1 热力学第一定律的实质
实质:能量传递和形态转化以及总量的守恒。(在工程
热力学的研究范围内,主要考虑的是热能和机械能之间的 相互转化和守恒的规律) 热力学第一定律是实践经验的总结。第一类永动机迄今都 不存在,而且由第一定律所得出的一切推论都和实际经验 相符,可以充分说明它的正确性。 第一类永动机(不消耗能量而作功)是不可能造出来的。
出口2 假如工质从状态1到状态2做膨胀功是w。那么在不考虑工质宏 观动能和位能变化时,开口系和外界交换的功量是膨胀功与流 动功的差值: 注:如需要考虑工质的动能和位能变化,还应该计算动能差 和位能差
02第二章 热力学第一定律 重点和难点

系统内部储能增量: ΔECV
考虑到稳流特征: ΔECV=0 qm1=qm2=qm; 及h=u+pv 有
2 2 cf2 cf1 Q H 2 H1 qm qm g z2 z1 WS 2 2 1 2 q h2 h1 cf2 cf21 g z2 z1 ws 2
3)第一定律第二解析式 把wt的概念代入(B)式,可得第一定律第二解析式
1 2 q h2 h1 cf 2 cf21 g z2 z1 ws 2 ( B)
2
q h wt δq dh δwt
可逆 q h 1 vdp
δq dh vdp
几种功及相互之间的关系
名称 含义 说明
1)当系统可逆时δw=pdv 2)膨胀功是简单可压缩系热变功的源泉 3)膨胀功往往对应闭口系所求的功 1)轴功是开口系所求的功 W 2) 当工质进出口间的动、位能差被忽略时, pdV Wt=Ws此时开口系统所求的功也是技术功
2 1
体积变化 系统体积变化 功W 所完成的功
轴功Ws 流动功 Wf. 系统通过轴与 外界交换的功
开口系付诸于质 量迁移所作的功
流动功是进出口推动功之差, 即Wf=Δ(pV)=p2V2-p1V1
技术功Wt 技术上可资利 用的功
1)Wt与Ws的关系 Wt=m Δ cf2/2+mg Δz+Ws 2) Wt与W,Wf的关系 Wt=W-Wf 3)当过程可逆时, δ W=-Vdp,这也是动、 位能差不计时的最大轴功
2)技术功(technical work)—技术上可资利用的功 wt 1 2 wt ws cf g z 2 由(C)
q u wt p2v2 p1v1 (D)
02章 热力学第一定律

无物质交换
孤立系统(2)
无能量交换
Siso Ssys Ssur
系统的性质
用宏观可测性质来描述系统的热力学状态,
故这些性质又称为热力学变量。可分为两类: 广度性质(extensive properties) 又称为容量性质,它的数值与系统的物质的量成
正比,如体积、质量、熵等。这种性质有加和性, 在数学上是一次齐函数。 强度性质(intensive properties) 它的数值取决于系统自身的特点,与系统的数量无 关,不具有加和性,如温度、压力等。它在数学上
§ 2.1 热力学概论
热力学方法和局限性 局限性 不知道反应的机理和反应速率
不研究系统的宏观性质与微观结构之间的关系
可以指出进行实验和改进工作的方向,讨 论变化的可能性,但无法指出如何将可能性变 为现实的方法和途径
§2.2 热力学的一些基本概念
系统与环境 系统(system) 在科学研究时必须先确定 研究对象,把一部分物质与其 余分开,这种分离可以是实际 的,也可以是想象的。 这种被划定的研究对象称 为系统,亦称为体系或物系。 环境(surroundings) 与系统密切相关、有相互作用或 影响所能及的部分称为环境。
•研究宏观系统的热与其他形式能量之间的相互 转换关系及其转换过程中所遵循的规律;
•热力学共有四个基本定律:第零、第一、第二、 第三定律,都是人类经验的总结。第一、第二定 律是热力学的主要基础。 •化学热力学是用热力学基本原理研究化学现象 和相关的物理现象
•根据第一定律计算变化过程中的能量变化,根 据第二定律判断变化的方向和限度。
3, 在298.15K ,p0下1mol C2H6 完全燃烧时, 过程所作的功是多少?
解:反应方程式 C2H6 (g) + 3.5O2 (g) == 2CO2 (g) + 3H2O (l) 在等温(298.15K)、等压(p0)条件下发生单 位反应时,若将反应系统中的气体视为理 想气体,则 W = - (2 - 3.5 - 1)×8.314×298.15 = 4.534 kJ 结果表明1mol C2H6(g) 完全燃烧时,由于反 应系统体积减小,环境对系统作功。
第二章 热力学第一定律

进入系统的能量-离开系统的能量=系统能量的增加 (2-9) 进入系统的能量-离开系统的能量= - )
1 2 Q = m2 (u2 + cf 2 + gz2 ) + m2 p2 v2 2 1 2 − m1 (u1 + cf 1 + gz1 ) − m1 p1v1 + Wi 2
1 2 wt = (cf 2 − cf21 ) + g ( z 2 − z1 ) + wi 2
比较式(2-10b)和(2-16) 比较式( - 和 - )
(2 − 19)
q = ∆u + w q = ∆h + wt = ∆u + ∆( pv) + wt 1 2 w = ∆( pv) + wt = ∆( pv) + ∆cf + g∆z + wi 2
由于m 由于 1=m2=m, 整理上式得
1 2 Q = m(u2 + p2 v2 + cf 2 + gz2 ) 2 1 2 − m(u1 + p1v1 + cf 1 + gz1 ) + Wi 2 令 H = U + pV 代入上式得
1 Q = ∆H + m∆cf2 + mg∆z + Wi 2 1 2 δQ = dH + mdcf + mgdz + δWi 2
m1 = m2 = m
∆ECV = 0
稳定系统的能量分析: 稳定系统的能量分析: 进入系统的能量: 进入系统的能量:
1 2 Q + E1 + p1V1 = Q + m1 (u1 + cf 1 + gz1 ) + m1 p1v1 2 离开系统的能量: 离开系统的能量: 1 2 E2 + p2V2 + Wi = m2 (u 2 + cf 2 + gz 2 ) + m2 p2 v2 + Wi 2
第2章热力学第一定律
1、热力学的研究内容
经典热力学基本定律:
① 热力学第零定律: 热平衡定律(开尔文定律) ② 热力学第一定律: 能量转化与守恒定律 ③ 热力学第二定律: 判断过程的方向与限度 ④ 热力学第三定律: 计算规定熵
2、热力学研究方法及局限性
热力学研究方法:
以含有大量质点的宏观体系为研究对象,以两 个经典热力学定律为基础,用一系列热力学函数及
本堂课学习内容
§2.2
热力学第一定律
§2.3
恒容热、恒压热及焓
§2.2 热力学第一定律
1、热力学能(U) 2、热力学第一定律 3、焦耳实验
1、热力学能(thermodynamic energy)
•系统的总能量由以下三部分组成: ① 整体运动的动能;
② 在外力场中的势能;
③ 系统内部一切能量。 热力学研究对象为宏观静止体系,无整体运动; 并且一般没有特殊的外力场存在(电磁场、离心力场 等),因此只考虑系统内部能量。
4、热与功
•体积功(膨胀功)的计算:
W pamb dV
W PambdV
V1
V2
( 向真空膨胀: W 0 pamb 0)
恒容过程: W 0 dV 0) ( 恒外压过程: W Pamb (V2 V1 )
4、热与功
[例题] 300K下:
pamb p2 50kPa
第二章热力学第一定律

W=We(体积功)+Wf(非体积功)
体积功
自由膨胀(真空膨胀)
pe=0 We=-pedV=0
计算公式
一次等外压膨胀 多次等外压膨胀
pe 保持恒定 We=-pe(V2-V1) 膨胀分两步第一步外压p1.第二步p2 We=-p1(V2-V1)-P2(V3-V2)
外压pe总是比内压pi小衣柜无限小的膨胀
pe=pi-dp We=-nRTln(V2/V1)
Qp=U+pV
dU=δQ+δW=δQ+δWe+δWf
没有相边和和化学变化且不做非体积功的均相封 闭系统,系统升高单位热力学温度时所吸收的热 成该系统的热容
等压热和焓
符号C
影响因素:系统的质量或者物质的量,以及升温条件有关
<Cp>(T)=Qp/(T2-T1) 升温会导致热容发生变化所以一般T2-T1→0
Qp=Qv+△nRT
两者的关系
等压下为等压热 等容下为等容热
化学反应热
溶解热:将一定量溶质溶于溶剂中的热效应
稀释热:将一定量的纯溶剂假如溶液中的热效应
溶解热和稀释热(等压)
混合热:将两种不同物质混合是的热效应
△H(相变)=Qp(相变)
△U=△H-p△V=△H-pVg(有气体参与)
纯净物的相变实在等温等压下进行的
宏观性质
广延性质
是系统物质的量n的一次齐函数
具有加和性,整个系统的某个广度性质等于该系 统中各部分该种广度性质的加和
其数值仅取件与系统自身的特性,与系统的数量 无关
强度性质
是系统物质的量n的零次齐函数
不具有加和性
平衡:系统的各性质不再随时间而改变,也没有 可以使系统和环境之间或系统内部发生物质交 换,能量交换和化学反应力的存在
热工基础-2-(2)热力学第一定律

节流的特点: 节流的特点:
①绝热: 绝热: 在节流过程中,工质与 在节流过程中 工质与
外界交换的热量可以忽 略不计,故节流又称 故节流又称绝热 略不计 故节流又称绝热 节流。 节流。 ②简化为稳定流动 : 进、出口截面必须取在离节流孔一定距离的稳 定状态处。 定状态处。
③不可逆:缩孔附近的工质有摩擦和涡流。 不可逆:缩孔附近的工质有摩擦和涡流。 动能差、位能差忽略。 ④无功量交换 ,动能差、位能差忽略。 用能量方程得: 机): 叶轮式机械(动力机、压气机):
在工质流经叶轮式动力机时,压力降低, 在工质流经叶轮式动力机时,压力降低,体积 膨胀,对外作功。 膨胀,对外作功。 通常工质进、出口的动能差 位能差、 动能差、 通常工质进、出口的动能差、位能差、系统向 外散热量(绝热)均可忽略不计 不计。 外散热量(绝热)均可忽略不计。
h1 = h2
结论: 结论: 节流前后工质的焓相等。 节流前后工质的焓相等。
例题:空气在活塞式压气机(包括进气、 例题:空气在活塞式压气机(包括进气、压缩和 排气三个工作过程)中被压缩,压缩前: 排气三个工作过程)中被压缩,压缩前: /kg;压缩后: p1=0.1MPa,v1=0.86m3/kg;压缩后: /kg;设压缩中每kg kg空气的 p2=0.8MPa, v2=0.18m3/kg;设压缩中每kg空气的 热力学能增加150kJ 同时放出热50kJ, 150kJ, 50kJ,求 热力学能增加150kJ,同时放出热50kJ,求: (1)压缩过程中对每kg空气所作的功; (1)压缩过程中对每kg空气所作的功; 压缩过程中对每kg空气所作的功 (2)每生产1kg压缩空气所需的功; (2)每生产1kg压缩空气所需的功; 每生产1kg压缩空气所需的功 (3)若该机每分钟生产15kg压缩空气, (3)若该机每分钟生产15kg压缩空气,问用多大 若该机每分钟生产15kg压缩空气 功率的电动机带动该机? 功率的电动机带动该机?
02 热力学第一定律

1第二章热力学第一定律2.1 热力学概论2.2 热力学的一些基本概念2.3 热力学第一定律2.4 焓和热容2.5 理想气体的热力学能和焓2.6 几种热效应2.7 化学反应的焓变22.1 热力学概论1. 热力学的研究对象2. 热力学的研究方法和局限性化学热力学是用热力学基本原理研究化学过程或与化学有关的物理过程。
热力学是研究宏观系统的热与其他形式能量之间的相互转换关系及其转换过程中所遵循的规律。
32.1.1 热力学的研究对象1. 研究化学过程及其与化学密切相关的物理过程中的能量转换关系。
2. 判断某条件下指定的热力学过程如相变、化学变化等的变化方向以及可能达到的最大限度。
根据第一定律计算变化过程中的能量变化,根据第二定律判断变化的方向和限度。
42. 1.2 热力学的研究方法和局限性研究方法•研究对象是大数量分子的集合体,研究宏观性质,所得结论具有统计意义。
•只考虑变化前后的净结果,不考虑物质的微观结构和反应机理。
•不研究系统的宏观性质与微观结构之间的关系局限性•不知道反应的机理、速率和微观性质•只讲可能性,不讲现实性•能判断变化能否发生以及进行到什么程度,但不考虑变化所需要的时间。
52.2 热力学的一些基本概念1. 系统和环境2. 系统的宏观性质3. 热力学平衡态4. 状态函数5. 过程和途径62.2.1 系统和环境系统(system )在科学研究中,把被划定的研究对象称为系统,亦称为物系或体系。
环境(surroundings)与系统密切相关、有相互作用或影响所能及的部分称为环境。
系统环境系统与环境72.2.1 系统和环境根据系统与环境之间的关系,把系统分为三类:(1)敞开系统(open system )系统与环境之间既有物质交换,又有能量交换。
环境有物质交换有能量交换敞开系统经典热力学不研究敞开系统82.2.1 系统和环境(2)封闭系统(closed system )系统与环境之间无物质交换,但有能量交换。
【物理化学】2-02热力学第一定律

结论: 当始, 终态确定的条件下, 不 同途径有不同大小的热量.
热是途径函数!
2功 系统与环境间除热量外的另一种能量交换形式 (由微观粒子的有序运动所引起的) 环境对系统作功取“ + ”, 反之取“ - ”
体积功(本节) 功
电功(电化学章) 非体积功
表面功(表面现象章)
dl F (环) = p (环) A
•又要马儿跑, 又要马儿不吃草是不可能的. •将欲取之, 必先与之. •天上不会掉下馅饼. •一份耕耘, 一份收获.
的热“量”(Q), 而不是象状态函数那样的始, 终态
之间的“增量” ( T =T2-T1, Q=Q2-Q1 );
• 一个微小途径对应微小热“量”(dQ), 同时对应
各状态函数的微小“增量”(如 dT, T2 = T1 + dT );
• 上述提醒对“功”同样有效!
我们拥有一个家 名字叫状态函数 兄弟姐妹都很多 但是没有功和热
式中U是状态函数, Q和W是途径函数. 当系统从状态1
变化到状态2, 不同途径Q和W的不同, 但Q + W却与途径无
关.
状态1 U1
QW Q W
状态2 U2 U = U2-U1
Q + W = Q + W = U
5. 热力学第一定律的其它叙述方式
第一类永动机是不能创造的. 内能是系统的状态函数.
…………
T
V
n
p
一定状态的系统 Cp
U
A
HS
G
WQ
H2 1mol, 0℃ 101325Pa
Q=0
Q = 1135J
恒温 热源 0℃
11m01oH3l2,25H0P2℃5a, 15m66o真3lP,空a0℃p环, =0
第二章 热力学第一定律

思考
定量气体在等温过程中热力学能不变?
错误。气体的热力学能是温度和比体积的函
数,等温过程中虽然温度不变,但比体积可
能会发生改变,故热力学能也会改变。
思考
理想气体的热力学能只与温度有关。
正确。对于理想气体,因为分子间不存在相
互作用力,因此没有内位能。其热力学能仅 包括分子内动能。因此,理想气体热力学能 只是温度的单值函数。
二、外部储存能
需要用在系统外的参考坐标系测量的
参数来表示的能量,称为外部储存能,
它包括系统的宏观动能和重力位能。
质量为m的物体相对于系统外的参考坐 标以速度c运动时,其具有的宏观动能为:
1 2 Ek mc 2
重力场中质量为m的物体相对于系统外的 参考坐标系的高度为z时,其具有的重力位 能为:
滚球永动机
软臂永动机
19世纪有人设计了一种特殊机 构,它的臂可以弯曲。臂上有 槽,小球沿凹槽滚向伸长的臂 端,使力矩增大。转到另一侧, 软臂开始弯曲,向轴心靠拢。 设计者认为这样可以使机器获 得转矩。然而,他没有想到力 臂虽然缩短了,阻力却增大了, 转轮只能停止在原地。
软臂永动机
阿基米得螺旋永动机
分子热运动形成的内动能。它是温度的函数。
分子间相互作用形成的内位能。它是比体积的函 数。
维持一定分子结构的化学能、原子核内部的原子 能及电磁场作用下的电磁能等。
1、内动能
根据分子运动学说,组成气体的分子是处于不 断运动的状态中,不仅分子本身作直线运动、 旋转运动和相对于其它分子的振动,构成分子 的内部原子也在不断地振动,这些运动着的分 子与原子都具有动能,称为气体的内动能。 气体的内动能与气体的温度有关。气体的温 度越高,内动能越大。
热力学第二章第一定律

对于式:
q
h
1 2
cf2
gz
wi
注意:q和wi分别是1kg工质进入系统后,系统从外界吸入的
热量和在系统内部所作的功。除的m不是系统的质量。
对于微元过程 ,稳定流动能量方程写成
δQ
dH
1 2
mdcf2
mgdz
δWi
δq
dh
1 2
dcf2
gdz
δwi
焓
焓:H=U+pV ,单位:J或kJ
注意:区分各截面间参数可不同。
设在τ时间段内有m1千克工质流进系统,同时 m2千克的工质流出系统。
mCV 0 qm1 qm2 m1 m2 m
在 时间段内进入系统的能量
在 时间段内离开系统的能量
Wi
m
u2
1 2
cf22
gz2
mp 2 v2
Wi
m
分析开口系统时,除了能量平衡外,还必须考虑质量平衡:
进入系统的质量-离开系统的质量=系统质量的变化
推动功
因工质出、入开口系统而 传递的功,叫推动功(推进 功) 。
W推 = p A l = pV w推= pv
A p pV
l
对推动功的说明
1、与宏观流动有关,流动停止,推动功不存在;
2、作用过程中,工质仅发生位置变化,无状态变化;
δQ δW
7. 热力学第一定律解析式的适用条件:
q u w
①闭口系统;②任何工质;③任何过程
δq δw
第二章 热力学第一定律

2 1
v d p (适用于可逆过程)
对于微元可逆过程,
q dh vdp
技术功的图形表示
wt
2
vdp
1
20
2-5 稳定流动能量方程式的应用
工程上,除了喷管、扩压管外,常见热工设备 的进出口动、位能的变化一般都可以忽略不计。
q h ws
wt
ws
1. 热交换器
ws
0
q h 2 h1
2. 动力机械
q
0
w s h1 h 2
21
3. 绝热节流
( q = 0 , ws = 0 )
h1 h 2 0
注意:绝热节流过程不是定焓过程。
22
门窗紧闭房间用电冰箱降温
以房间为系统 闭口系能量方程
Q U W Q 0
绝热闭口系
Q H
1 2
m cf m g z W s
2
13
对于单位质量工质, 1 2 q h cf g z ws 2 以上两式称为开口系统的稳定流动能量方程。 对于微元过程 ,稳定流动能量方程写成
Q dH
1 2 1
m d cf m g d z W s
在热能与其它形式能的互相转换过程中, 能的总量始终不变。 不花费能量就可以产生功的第一类永动机 是不可能制造成功的。 进入系统的能量-离开系统的能量 = 系统储存能量的变化
5
2-3 闭口系统的热力学第一定律表达式 Q
ΔU
W
Q W U U 2 U1
Q U W
对于微元过程,
17
可以假定质量为m的工质从进口截面处的 状态1变化到出口截面处的状态2,从外界吸收 了热量Q,作了膨胀功W 。
02第二章 热力学第一定律

LY
J Z _ O A ZH J Z _ O A ZH
A与B热平衡
U N
§2.1.3 热力学方法的局限性
热力学方法是一种演绎的方法,研究对象为大 均行为,不适用于个别分子的行为。
数量分子的集合体,结论具有统计意义,只反映平
不考虑物质的微观结构和反应进行的机理。 “知其然不知其所以然”
Y L
J Z _ O A ZH
第零定律和第三定律的提出,使得热力学理论更加严密。
第零定律:热平衡的互通性,并为温度建立了严格的科学定义。 第一定律:计算变化中的热效应。 第二定律:解决变化的方向及限度,以及相平衡和化学平衡问题。 第三定律:低温定律,阐明了规定熵的数值
LY
用热力学基本原理来研究化学现象以及与化学有关的 物理现象,称为化学热力学。
We.2 pe V pe (V2 V1 )
⑶. 多次等外压膨胀,设为2步
We.3 p V1 pe V2
We Fe dl Fe dl cos
F Fe dl e Adl pe dV A
⑴. 自由膨胀
p1V2
V2
p
p1
p1V1
J Z
p2
V
p
V1
U N
p2V2
V2 V
§2.5.3 可逆过程(reversible process)
某一系统经某一过程,由状态(1)变到状态(2)之后, 如果能使系统和环境都完全复原,即不留校任何痕迹, 这样的过程称为可逆过程,否则为不可逆过程。(p78)
⑴. We.4和W'e,3:可逆过程;
Y L
强度因素的大小决定了能量的传递方向,而广度因素变化 量则决定了功值的大小。通常系统抵抗外力所作的功可以 表示为:
第二章__热力学第一定律(2)

T2 T1
适用条件:理想气体恒压pVT变化过程
H n C p ,m dT nC p ,m T2 T1
T2 T1
适用条件:理想气体单纯pVT变化的一切过程;或 真实气体恒压变温过程;或纯的液、固态物质恒压 或压力变化不大的变温过程。
3、热容的一般定义
热容是计算物质变温过程中热量传递的基础热数据,属于 物质的特性之一。 定义:没有相变化、化学变化,无非体积功过程,物质温度升
高一度所需吸收的热。
Q C dT
C (T1 T2 ) Q T1 T2
真热容 平均热容
Q CdT
T1
T2
Q C (T1 T2 )
实例: 正丁烷(液态)
4 2 C 7 . 9 0 . 330 T 1 . 0 10 T p ,m
/ J K 2 mol 1
§2.5 理想气体的热力学 1. 焦耳实验
纯物质单相系统 一定量 U=f ( n,T,V ) U=f ( T,V )
U U dU ( )V dT ( )T dV T V
3、热力学可逆过程
(1)定义: 能够通过过程的反方向变化
而使系统恢复到原来状态,同时环境也 恢复到原来状态的过程,即系统和环境 均没有热、功和物质的得失。 “能从原路返回的过程”
(2)特点:
a. 准静态过程;在整个过程中,系统内部无限 接近于平衡,或说整个过程是由无限多个准 静态组成。
b. 推动力与阻力的差值无限小;
(m)恒外压压缩
p1’=202.65kPa T1’=298K (n)恒外压膨胀 V1’=12.23dm3
p2=50.663kPa T2=298K V1=48.90dm3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Wi dV2 uout 1 2 cout 2 gzout
Q
基准面
进入系统的能量
离开系统的能量 控制容积系统储存能 量的增加量
dE1 p1dV1 Q
dE2 p2 dV2 Wi
dECV
进入系统 离开系统 系统储存能 - = 的能量 的能量 量的增加量
工质经历循环:
Q W
热力学第一定律表述:
热是能的一种,机械能变热能,或热能变机械
能的时候,它们之间的比值是一定的。
热可以变为功,功也可以变为热;一定量的热
消失时必定产生相应量的功;消耗一定量的功时, 必出现与之相应量的热。
02\thermo_live.asf
2-2
热力学能和总能
一、热力学能
定义:储存在系统内部的能量。 Uch
U
Unu Uth
平移动能 Uk 转动动能 f1 T 振动动能 Up— f T , v 2
U U (T , v)
热力学能U : 法定计量单位:焦耳(J) 比热力学能u :(1kg物质的热力学能) 单位:J/kg
说明:
热力学能是状态参数 U : 广延参数 [ kJ ] u : 比参数 [kJ/kg] 热力学能是两个独立状态参数的函数:
微分形式:
wt vdp
准静态
q du pdv 热一律解析式之一 热一律解析式之二 q dh vdp
以技术功的形式表达稳定流能量方程
一般形式 过程可逆
q h wt
q h vdp
1
2
q dh wt
Q H Wt
q dh vdp
能量方程式的应用
火力发电
核电
飞机发动机 蒸汽轮机 轮船发动机 燃气轮机 steam turbine gas turbine 移动电站
1 2 q h c f gz wi 2
流进系统:
u1 p1v1 h1
流出系统:
u 2 p 2 v2 h2 , wS
wi h1 h2 wt
第二章 热力学第一定律
基本要求
深入理解热一律实质,熟练掌握热一律及其表
达式。能灵活应用热一律表达式来分析计算工 程实际问题。
掌握热力学能的概念
掌握体积变化功、推动功、流动功、内部功、
轴功和技术功的概念及计算式。
理解焓的定义。
2-1
热力学第一定律的实质
能量转换与守恒定律
自然界一切物质都具有能量,能量不可能 被创造,也不可能被消灭,但可以从一种形式 转变为另一种形式,并且在转换过程中能量的 总量保持不变。
二、压气机 火力发电 核电 飞机发动机 轮船发动机 移动电站
水泵
pump
压气机
制冷 空调
压缩机compressor
1 2 q h c f gz wi 2
u f (T , v) 或 u f (T , p)
;
u f ( p, v )
二、外部储存能
定义:用系统外参考坐标系所测量的参 数来表示的能量。 包括:
1 2 宏观动能:Ek mc f 2
重力位能:E p
机械能
mgz
三、系统的总能E
1 2 E U mc f mgz 2
Q W E2 E1 E
或
Q E W
——闭口系的能量方程式
Q
W
若忽略不计宏观动能与位能的变化,能量方程:
Q U W
对于一个微元过程,则能量方程的微分形式:
Q dU W
对于1kg工质,能量方程式为:
q u w
及
q du w
1909年,C. Caratheodory(喀喇氏)最后 完善热一律。
焦耳实验
1、重物下降,输 入功,绝热容 器内气体 T
2、绝热去掉,气 体 T ,放出热给水, T 恢复原温。
焦耳实验
水温升高可测得热量, 重物下降可测得功
Mechanical equivalent of heat 热功当量 1 cal = 4.1868J
2 f
q m ,out
out
c h gz q m ,in Pi 2 in
二、稳定流动能量方程
定义:流动过程中开口系内部及其边界 上各点工质的热力参数及运动参数都不 随时间而变。
dECV 0, dt
q
m ,in
q m,out
注意:区分各截面间参数可不同。
简单可压缩系准静态过程 w = pdv q = du + pdv 热一律解析式之一 q = u + pdv 简单可压缩系可逆过程 q = Tds Tds = du + pdv 热力学恒等式 Tds = u + pdv
二、闭口系能量方程的应用
例1: 自由膨胀
抽去隔板,求 U 如图, 解:取气体为热力系 —闭口系?开口系?
第二章\例3.ppt
第二章\例4.ppt
归纳热力学解题思路
1)取好热力系
2)计算初、终态
3)两种解题思路
从已知条件逐步推向目标
从目标反过来缺什么补什么
4)不可逆过程的功可尝试从外部参数着手
2-6 开口系统能量方程式
假设:工质在设备内流动时,同一截面上 各点参数是均匀的、各点流速相同。
一、开口系能量方程
2、工质仅发生位置变化,无状态变化 3、推动功pv与所处状态有关,是状态量
4、并非工质本身的能量(动能、位能)变化引 起,而由外界做出,流动工质所携带的能量。
可理解为:由于工质的进出,外界与系统之
间所传递的一种机械功,表现为流动工质进 出系统使所携带和所传递的一种能量。
2-4
一、焓的定义: uin pvin min gz in 1 2 cin 2
c h gz mout 2 j out
2 f 2 f
c h gz min Wi 2 i in
以流率表示的开口系能量方程:
2 f
c dECV h gz dt 2 j
q u w
q du w
1
kg工质经过微元过程
以上各能量方程式的适用条件: 1)闭口系各种过程; 2)各种工质。
闭口系能量方程的通式
q = de + w 若在地球上研究飞行器
q = de + w = du + dek + dep + w
准静态和可逆闭口系能量方程
1 2 q h c f gz wi 2
wt
q h wt
wt q h q u ( pv) w ( pv)
对于准静态过程:
wt
2
1 2
pdv ( pv) pdv d ( pv)
1 2
1 2
1
vdp
W f p2V2 p1V1 ( pV ) w f p2v2 p1v1 ( pv)
开口系与外界交换的功 量为膨胀功与流动功之差
w - ( pv )
注意:热能和机械能可逆转化总是与工质的 膨胀和压缩联系在一起的。
对推动功的说明
1、与宏观流动有关,流动停止,推动功不存在
推动功来自外部功源。
工质在传递推动功时, 能量的形态不发生变化。
注意:推动功只有在工质移动位置时才起作用。
V
过热器
汽轮机
锅 炉
发电机
凝 汽 器 给水泵
推动功的表达式
W推 = p AΔl = pV = mpv
w推= pv
p A
注意:
不是 pdv v 没有变化
p V
dl
流动功:系统为维持工质流动所需的功。
焓
Wnet
H U pV h u pv
Q
焓的单位:J,比焓的单位:J/kg
mout uout pvout 1 2 cout gzout 2
二、焓是状态参数
h f ( p, v), h f ( p, T ), h f (T , v) h1 a 2 h1b 2 dh h2 h1
热力学第一定律
在任何发生能量传递和转换的热力过程中, 传递和转换前后能量的总量维持恒定。 本质:能量转换及守恒定律在热现象中的应用。
1842年,德国医生罗伯特· 迈尔Robert Mager第一个发表论文阐述热一律。
1840-1849年,焦耳用多种实验的一致性 证明热一律,于1950年发表并得到公认, 他证明了热功相当,得出了热功当量。
2 cf dECV h gz qm ,out dt 2 j out
c h gz qm ,in Pi 2 in 1 2 q h c f gz wi 2
2 f
——流过开口系1kg流体的稳定流动能量方程
1 2
dh 0
三、焓的意义
p
1 a 2 V
b
焓是工质进出开口系统时带入 或带出的热力学能与推动功之和, 是随工质移动而一起转移的能量。
2-5
热力学第一定律的基本能量方程式
进入系统 离开系统 = 系统中储存 - 的能量 的能量 能量的增加
适用范围:任何系统、任何过程
一、闭口系统能量方程式
——热力学第一定律的基本能量方程式 设闭口系中工质从外界吸热Q,从状态1变化 到状态2,对外作功W,则:
Q U W Q 0
U 0
W 0 ? 即U1 U 2
