第三节 β—消除反应
消除反应

H
C
H2 C
H
卡宾的反应
(2) 与碳碳双键的加成
CH3CH = CHCH3 + CH2N2
光
CH3CH
CHCH3 ( 80%)
CH2 + CH2
二环 4,1,0 庚烷
在烯烃存在下的卡宾,可与双键加成得到环丙烷的衍生物。
HCCl3 + (CH3)3COK CCl2 + (CH3)3C-OH + KCl
CH2N2 重氮甲烷
紫外光 或加热
CH2 + N2
卡宾的结构
R
'
R
三线态
卡宾的反应
(1) 插入反应(insertion) 卡宾能把自身插入到大多数分子的C-H键中去。
C H+ CH2 C H2 C H
C
H+
CH2
C C H2
E1CB反应:生成Hofmann烯
N(CH3)3OH CH3 CH2 CH CH3 CH3 CH2 N(CH3)3 CH CH2
CH3
CH2
CH
CH2 95%
E2:大多数消除遵守Saytzess规则,但也有例 外(即趋向与Hofmann规则)
几个特殊例子:
CH 3(CH 2)3CHCH 3 L
CH3CH=C(CH3)2 + CH3CH2 90%
C CH3
CH2 10%
• Hofmann法则:季铵碱分解时,生成双键碳 原子上烷基最少的烯烃。
CH3CH2CHCH3 HO N(CH3)3 △ CH3CH2CH=CH2 + CH3CH=CHCH3 + N(CH3)3 95% 5%
E1:主要是生成Saytzess烯
β消除反应机理

β消除反应机理引言β消除反应是一种有机化学反应,通过使C-H键与邻位的C-C键形成新的π键来引入双键。
本文将详细探讨β消除反应的机理、影响因素和应用。
β消除反应的机理β消除反应主要涉及两个步骤:质子转移和π键形成。
下面将详细介绍这两个步骤的机理。
质子转移质子转移是β消除反应的第一步,它涉及从碱性位点(通常是碳原子)上的氢原子到邻位的碳原子的转移。
这个转移可以通过两种方式实现:E1cB和E2机理。
1.E1cB机理在E1cB机理中,质子转移是一个单独的步骤,不需要离去基团的参与。
这种机理通常发生在碱性条件下,其中负电荷在质子转移之前已经形成。
2.E2机理在E2机理中,质子转移与离去基团的消失同时发生。
这种机理通常发生在中性或微酸性条件下,其中负电荷在质子转移之后形成。
π键形成在质子转移之后,π键形成是β消除反应的第二步。
π键形成通常涉及两个邻位的碳原子之间的反应。
这个过程可以通过两种方式实现:反应性碳原子的亲电性和负离子的亲核性。
1.反应性碳原子的亲电性当反应性碳原子具有较强的亲电性时,它可以吸引邻位碳原子上的电子,从而形成新的π键。
这种情况下,反应性碳原子通常是一个具有正电荷的离子或含有较强电子吸引基团的中性分子。
2.负离子的亲核性当负离子具有较强的亲核性时,它可以攻击邻位碳原子上的正电荷,从而形成新的π键。
这种情况下,负离子通常是一个具有负电荷的离子或含有较强亲核基团的中性分子。
影响β消除反应的因素β消除反应的速率和选择性受到多种因素的影响。
下面将介绍一些主要因素。
反应物的结构反应物的结构对β消除反应的速率和选择性起着重要作用。
以下是一些常见的结构因素:•β位的取代基:取代基的种类和位置会影响反应的速率和选择性。
通常,较大的取代基会降低反应速率,而较小的取代基则会提高反应速率。
•邻位的取代基:邻位的取代基可以影响质子转移和π键形成的步骤。
一些取代基可以通过增加邻位碳原子上的电荷密度来加速反应,而其他取代基则可能阻碍反应的进行。
消除反应

N
HO H CH3 N N
H+ - H2O
CH3
CH3I
CH3
IN CH3
1) Ag2O 2) △
CH3 CH3 N
HO
H N(CH3)3I
-
C8H13N
C9H16NI
C9H15N
CH3I
1) Ag2O 2) △
C10H18NI
6 E1cb历程 历程
第一步 B + H C C X k1 k-1 第二步 C C X k2 C C + X C C X + BH
CH2
-BrC (CO2H5)2
CO2C2H5 CO2C2H5
消除反应的机理——E2,E1,E1CB及热消除 反应
2.双分子消除反应机理(E2机理)
在双分子消除反应中,碱进攻反应物的β-H的同时, 离去基团L带着一对电子从分子中离去,在两个碳原 子之间形成新的π键:
H —C—C— + :BL H —C—C— L B C=C + BH + L-
通过用重氢同位素标记实验证明,这些热消除反 应为顺式消除。例如:
CH3 Ph H O C O H LiAlD 4 Ph HO Ph H H Ph D O Ph H CH3 Ph H O C O Ph LiAlD 4 H HO Ph H Ph H D O Ph H D H Ph Ph H H Ph H D Ph Ph H D Ph
—C—C— H L 慢 L—C—C— + H 快 C=C +H+
反应速率:υ = k —C—C— H L
反应活性:对于烷基 3o>2o>1o>CH3
按E1机理进行反应的实例: (1)
β消除反应机理

β消除反应机理β消除反应是一种经典的有机化学反应,它指的是烷基化合物中的第二个顺式氢原子和一个临近的碳原子直接形成双键的消除反应。
这种反应的机理涉及到β碳原子上的氢离子和相邻的碳原子之间的反应。
本文将会详细阐述β消除反应的机理、特点和应用。
β消除反应机理β消除反应是通过β碳上的氢被带走形成双键而进行的,这种反应的机理可以分为两步。
首先,氢离开,形成碳阳离子中间体。
其次,碳-碳双键通过质子或电子的攻击而形成。
总的来说,β消除反应机理是一个经典的酸碱反应。
在β碳形成碳阳离子的过程中,β碳上的氢原子通过酸碱反应被猝灭。
在第二步反应中,碳-碳双键的形成是通过质子攻击或电子攻击进行的。
这些步骤通常是在酸性催化剂的存在下发生的。
β消除反应特点β消除反应有几个独特的特点。
首先,它是一种以氢试剂为主要反应物的变化。
其次,β消除反应是一种库仑三角的消除反应,反应在一个面内进行。
因为它只需要一个面内的碳-碳单键参与,所以它是一个立体选择性反应。
最后,β消除反应是一种舒子反应。
在β碳原子上导致改变的共价键的存在下,芳香化合物可以通过β消除反应手段发生脱芳香化。
β消除反应应用β消除反应和别的消除反应有很多的不同,因此它可以被应用于各种不同的有机化学领域。
在合成有机化合物的过程中,它可以被用于合成具有特殊功能的化学物质。
例如,它可以被用于合成环状化合物、富勒烯及富勒烯化合物。
此外,β消除反应可以被用于合成各种类型的化学物质,例如酸性物质、碱性物质、含氮化合物及含硫化合物等。
综上所述,β消除反应机理相对简单,但它具有很多独特的特点,这使得它可在有机化学领域广泛应用。
β消除反应有望在未来的研究中发挥重要作用,并有望被用于制备新型有机材料和其他化学品。
有机化学中的消除反应的应用

有机化学中的消除反应的应用有机化学中的消除反应是一种常见的有机合成方法,通常指的是通过消除反应制备双键或环化合物的方法。
消除反应具有广泛的应用,不仅可以用于合成特定的有机化合物,还可以用于合成药物、农药等重要的有机化学品。
本文将介绍消除反应的原理、应用和实际操作。
一、消除反应的原理消除反应是指通过去除某个分子中的一个或多个官能团来形成双键或环化合物的反应。
常见的消除反应包括β-消除、醇酸消除和酰胺消除等。
这些反应的共同特点是生成的产物中至少存在一个双键或环。
1. β-消除反应β-消除反应是指通过去除β位上的氢原子来生成双键或环化合物的反应。
这种反应通常需要在碱性条件下进行,碱可以提供一个负电荷,与β位上的氢原子形成一个共轭碱。
然后,共轭碱会进一步脱去β位上的氢原子,形成双键或环。
2. 醇酸消除反应醇酸消除反应是指通过去除醇或酸中的一个分子来生成双键或环化合物的反应。
这种反应需要在酸性或碱性条件下进行,酸或碱可以促进溶剂中水分子或其他原子团的离去。
3. 酰胺消除反应酰胺消除反应是指通过去除酰胺中的一个分子来生成双键或环化合物的反应。
这种反应通常需要在酸性条件下进行,酸可以促进酰胺分子中的氮原子上的负电荷的形成,然后离去产生双键或环。
二、消除反应的应用消除反应在有机化学中有着广泛的应用,特别是在有机合成中。
它可以用于构建特定的碳骨架、合成具有生物活性的目标分子以及制备高效的药物和农药等。
1. 构建碳骨架消除反应可以通过构建碳骨架来实现有机化合物的合成。
通过选择不同的反应条件和底物,可以得到不同种类的有机分子。
例如,利用β-消除反应,可以合成具有双键或环的芳香化合物,从而扩展化合物的化学结构。
2. 合成生物活性化合物消除反应可以用于合成具有生物活性的化合物,如药物和天然产物。
通过有机合成中的消除反应,可以选择性地引入特定的官能团,从而获得具有特定生物活性的化合物。
这在药物研发和生物活性研究中具有重要的意义。
有机化学基础知识点整理消除反应的类型与机理

有机化学基础知识点整理消除反应的类型与机理有机化学基础知识点整理:消除反应的类型与机理消除反应是有机化学中常见的一类反应,指的是有机化合物中某些官能团的原子能够从分子中脱离,形成双键或多键的过程。
本文将对消除反应的类型与机理进行整理和讨论。
一、消除反应的类型1. β-消除反应(β-elimination):在这类反应中,反应物中被消除的官能团的碳原子位于其它一个官能团的邻近位置(称为α-位置)。
β-消除反应包括酸催化的酮和醇之间的酸催化脱水反应、亲电或自由基卤代烷的脱氢反应等。
2. 酸碱消除反应(acid-base elimination):这类反应是指在有机化合物中,碱(底)与酸(质子)之间的相互作用,形成共价键的过程。
酸碱消除反应通常伴随着质子转移过程,形成共轭碱和共轭酸。
3. 位阻消除反应(steric elimination):当有机化合物中的某些基团因空间位阻而难以共存时,会发生位阻消除反应。
此类反应通常伴随着碳-碳键的形成和氢原子的消失。
二、消除反应的机理1. β-消除反应机理:在β-消除反应中,一般需要通过两个步骤实现。
首先是进行质子转移,形成双质子化物种(dioprotonated species)。
接下来,发生临近的亲核取代,生成亚胺离子(carbanion)。
最后,质子转移再次发生,从而得到产物。
2. 酸碱消除反应机理:酸碱消除反应的机理可以分为两类,即E1机理和E2机理。
E1机理主要发生在溶液中,其中步骤一是质子转移,形成共轭碱。
随后,发生β-消除,生成亚胺离子和产品。
E2机理则是在碱性条件下发生,过程包括质子转移和立即的消除反应,直接得到产物。
3. 位阻消除反应机理:位阻消除反应的机理与β-消除反应较为相似。
首先,发生质子转移,生成炔基离子。
接着,发生脱氢反应,生成亚胺离子。
最后,质子转移再次发生,从而获得产物。
三、应用与举例1. β-消除反应的应用:β-消除反应在有机合成中具有重要的应用价值。
第6章 脂肪族饱和碳原子上的亲核取代反应 消除反应

烷基结构对SN1的影响
V3 o RX > V2 RX > V1 RX > VCH X
o o 3
R-Br + H2O R: CH3 1
甲酸
R-OH + HBr (CH3)2 CH 45 R2CHX S N1 , S N2 (CH3)3 C 108 R3CX S N1
CH3CH2 1.7 RCH2X S N2
C C C O
特点 1 只能在共轭体系中传递。
2 不管共轭体系有多大,共轭效应能贯穿于整个共轭体系中。
6.1.3 超共轭效应
定义:当C-H 键与键(或p电子轨道)处于共轭位置时,也会 产生电子的离域现象,这种C-H键 电子的离域现象叫
做超共轭效应。
H H C H
H
+
R R
CH
CH2
H H
C
C
C2H5OH SN1
CH3
C2H5ONa, C 2H5OH SN2
CH3CCH2OC2H5 + Br
CH3 CH3 + CH3C=CHCH3
CH3CCH2CH3 OC2H5 (2)
(3)
重排产物
消除产物
重排反应
当化学键的断裂和形成发生在同一分子中时, 引起组成分子的原子的连接方式发生改变, 从而形成组成相同,结构不同的新分子,这 种反应称为重排反应。
V=K1[ CH3Br] 一级反应
R1 R2 R3
-Br -
R1 C Br + :Nu
R2 R1
R2 R3
R3 :Nu
C
Nu + Br-
(+) -
定义:只有一种分子参与了决定反应速度关键步骤 的亲核取代反应称为SN1 反应。
β消除反应

按此反应机理进行的反应应具备的条件:1.离去基团不易离去,即C-L键不易断裂2.β-碳原子上连有强吸电子基如:COCH3,、NO2、Me3N+等,从而使β-氢具有较强的酸性,容易离去,且碳负离子很稳定;
二.立体化学:
E2反应的立体化学:在发生消除反应时,所涉及消除的两个基团H和L在C—C键的两侧或同一侧,分别称为反式消除或顺式消除。
物时,必须把被消除的二个基团(L, H)放在反平行的位置(即反式共平面关系),通常进行反式消除。
环卤代烷问题:1.卤代环己烷进行E2消除,卤原子总是优先与反式β-H消除。在有两种β-H的情况下,优势产
物再由Saytzeff规律决定,即得遵循反式共平面原则。此时消除基团必须在a键上才能满足反式共平面。
一级卤代烃倾向与发生取代反应,只有在强碱条件下才以消除为主。反应常按双分子反应(SN2E2)进行。但是:某些含活泼β-H的一级卤代烃以消除为主,此时往往有共轭结构生成。β-C上连有支链的伯卤代烃消除倾向增大。三级卤代烃倾向于发生消除,即使在弱碱条件下(如Na2C03水溶液),也以消除为主。只有在纯水或乙醇中发生溶剂解,才以取代为主。二级卤代烃的情况介于三级和一级之间。在一般条件下,有较大的取代倾向,但消除程度比一级卤代烃大得多。究竟以哪种反应为主,主要决定具体的卤代烃结构和反应条件。在强碱(如乙醇钠)作用下主要发生消除。与伯卤一样,R -c上连有支链的仲卤代烃消除倾向增大。卤代烷α一碳或β一碳上侧链的增加,由于空间阻碍,不利于试剂从卤素的背面进攻α一碳,SN2反应较慢,而试剂进攻β一氢不存在位阻问题,因而E2反应逐渐增多。随支链增多(空间位阻增大),取代反应产物逐渐减少,而消除反应产物逐渐增加。在单分子反应中,SN1和E1反应混合物之比,主要决定于烷基的结构。因为反应过程中,首先是与卤原子相连的碳原子由四面体的结构(键角约109. 5度)变成正碳离子的平面结构(键角约120度),如果取代基很大,倾向于形成正碳离子,可以减少空间张力。如果形成的正碳离子发生SN1反应,键角又从120回到109. 5,张力又增加;而如果发生E1反应,烯烃也是一个平面结构,空间张力比四面体的小。因此,取代基的空间体积越大,越有助于进行消除反应。试剂的影响主要表现在双分子反应中,试剂的碱性越强,浓度越高,越有利于消除。反之,碱性越弱,浓度较低则有利于取代,这是由于在消除反应中,除去β-H需要强碱试剂。一般的碱性试剂都有一定的亲核性,但试剂的碱性和亲核性之间没有完全的平行关系。有些试剂碱性虽弱,
有机合成中的 β-消除反应

有机合成中的β-消除反应摘要:本文阐述了消除反应的类型和各类型反应的机理和历程,并讨论了其影响因素。
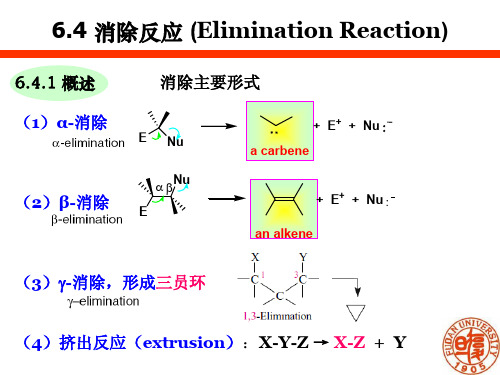
关键字:β—消除、立体选择、过渡态、碳正离子消除反应是从一个分子中消除两个原子或基团而不被其它原子或基团所置换的反应。
它可以分为三类,若消去的2个原子连在同一个碳原子上,则称为α—消除反应,若2个消去的原子连在相邻的2个碳原子上,则称为β—消除反应,若2个消去的原子连在1,3位碳原子上,则称为γ—消除反应,其中β—消除反应最为重要。
其实质是从相邻的两个原子上消除两个原子或基团,形成一个新的双键或叁键。
β—消除反应包括的反应多,而该类反应涉及的反应条件、反应产物都比较复杂,且消除反应和取代反应常常相伴而行,反应历程也时有变化,因而比较复杂[1]。
但其在实际中有广泛的应用,如卤代烃的消除反应、磺酸酯的消除反应、季铵碱的消除反应[2].接下来本文将对β—消去反应的反应历程和影响因素作简要介绍。
1反应历程分类β—消去反应的历程有三种,即:单分子消除反应机理(E1)、双分子消除反应机理(E2)和碳负离子反应机理(E1cb)[4]。
1.1E1机理单分子消除为2步过程,第一步是离去基团带着一对电子离去,底物成为碳正离子;第二步是碳正离子从β位脱去一个质子,给予碱或溶剂,生成烯键,第一步速率较慢,是决定反应速率的步骤,E1机理中C—X键断裂在前,C(β)一H 键断裂在后,故常伴随碳正离子重排。
单分子消除反应的动力学特征是:速率=K[RX]影响反应快慢的因素有:第二步中生成碳正离子的稳定性,介质是否容易电离和是否易于使离子溶剂化,不同结构的卤代烷烃反应活性难易为1。
RX<2。
RX<3。
RX。
消除反应按E1历程进行时,中间体正碳离子的稳定性决定反应速度,产物的生成发生在第2步,产物的稳定性是决定消除反应择向的主要因素。
在E1反应里,不论作用物性质如何,总是形成双键碳上带有最多烷基的烯烃主产物;所以消除反应按E1历程进行时一般服从规则,但Saytzaff消除反应产物由于空间作用变得不稳定时,消除反应将遵Hoffmann规则1.2E2机理1.2.1双分子消除反应为一步反应,当碱进攻β—H时,β—C—H和α—C—H 同时均等协同地断裂,在过渡状态中5个原子团在同一个平面上,随后在α—碳和β—碳上生成π键。
化学反应中的消除反应机理

化学反应中的消除反应机理化学反应是物质之间发生变化的过程,消除反应是其中一种常见的反应类型。
本文将重点探讨化学反应中的消除反应机理,以揭示其原理和特点。
一、什么是消除反应消除反应是指在化学反应中,一种或多种原子、离子、分子等从一个有机化合物中脱离,形成新的化合物或产物的过程。
消除反应通常伴随着反应物分子间碳-碳或碳-氢键的断裂和新键的形成。
消除反应在有机合成中具有重要的意义,可用于合成具有特定结构和功能的化合物。
二、消除反应的机理1. β-消除反应β-消除反应是指从有机化合物分子的β位(碳原子相对于一个键的对应位置)上的原子或基团被脱离,而得到新的化合物或产物。
这种反应可以通过热、酸、碱、金属等催化剂促进。
例如,考虑一个简单的β-消除反应机理:在这个反应中,亲电试剂(如酸、碱等)促使邻位上的氢原子离去,同时β位上的溴原子与亲电试剂结合,形成新的化合物。
2. α-消除反应α-消除反应是指从有机化合物分子的α位(碳原子相对于一个或多个键的对应位置)上的原子或基团被脱离。
相较于β-消除反应,α-消除反应具有更高的反应性。
例如,考虑一个简单的α-消除反应机理:在这个反应中,亲电试剂(如酸、碱等)促使氢离子与有机化合物分子结合,形成新的化合物。
三、消除反应的应用消除反应在有机合成中有着广泛的应用。
以下是一些常见的例子:1. 制备烯烃消除反应可用于制备烯烃。
通过适当的反应条件,如高温、碱性条件下,某些有机化合物经过消除反应可以生成烯烃产物。
2. 合成药物消除反应在合成药物中有着重要的应用。
通过选择合适的消除反应条件,可以高效、高选择性地合成目标化合物,从而用于药物研发和制造。
3. 反应机理研究研究消除反应的机理对于揭示有机反应的本质和规律具有重要的意义。
通过探索消除反应的机理,可以为有机合成化学提供新的思路和方法。
四、总结化学反应中的消除反应机理是一种重要的反应类型,它常常在有机合成和化学研究中发挥重要作用。
高等有机化学之消除反应机理

H
BH
B-H
B
X
X
X
解释事实:
CH(CH3)2 Cl fast
- HCl CH3
CH(CH3)2
+
CH3 75%
CH(CH3)2
CH3 25%
CH(CH3)2
解释事实: Cl slow
CH(CH3)2 Cl
- HCl CH3
CH3
H
CH(CH3)2 H
Cl
CH3
CHMe2 H
H Cl
CH(CH3)2
0
64
36
0.02
54
46
0.08
44
56
1.0
2
98
思考:试剂体积增加有利于取代还是消除反应?
CH3
CH3
SN1 (CH3)3C OH + H
83%
(2) 重排产物的生成:
Wanger-Meerwein 重排
H3C
CH3 C CH2Br EtOH H3C
Br
CH3
CH3 C CH2 CH3
H3C C CHCH3 CH3H
H3C C C CH3
H H3C
H
按E1机理反应的底物结构特: 形成稳定正碳离子的体系。
Br
(CH3)3CO
D HH
(94%)
H
氢化原菠烷基溴
由于环的刚性,Br-Cα-Cβ-H不能同处一个平面, 但Br-Cα-Cβ-D共平面。是顺叠构象,所以进行顺 式消除。
b. β-H的活泼性 活泼性的β-H处于顺位,则顺式占优势;处于反位,则反 式占优势
Hb H Ar (CH3)3COK H OTHs a
遵守Hofmann 规律 E1CB 类似E1CB 协同E2 类似E1 E1
β消除反应名词解释

β消除反应名词解释
β消除反应是有机化学中的一种常见的消除反应,它是一种亲核性消除反应,常见于β-卤代基与氢氧化物、醇、胺、硫醇等亲核试剂发生反应时。
在反应中,β-卤代基先发生脱卤反应,生成一个碱性的碳负离子,然后碳负离子与亲核试剂发生亲核加成反应,最终生成烯烃和相应的盐。
β消除反应的反应机理通常包括两个步骤:脱卤和亲核加成。
脱卤反应是由于卤代基与碱性试剂作用而发生的,卤离子离去后,剩余的负离子称为碳离子。
亲核加成是指碳离子与亲核试剂发生反应,亲核试剂中的亲核性原子(如氧、氮、硫等)攻击碳离子中的空轨道,形成新的化学键。
整个反应过程中生成的烯烃可以是单烯、二烯或者环烯烃,取决于反应底物的结构。
β消除反应在有机合成中具有广泛的应用。
例如,利用β消除反应可以将卤代烃转化为双键或环烯烃,这种转化常用于合成药物、天然产物等目标化合物。
此外,β消除反应还可以用于合成聚合物、高性能材料等领域。
因此,深入理解β消除反应的机理和应用对于有机化学领域的研究和发展具有重要的意义。
- 1 -。
高等有机化学:6.4 消除反应 (Elimination Reaction)
+
HD
H Me
H Me
Me D
syn-elim. Me
Me Me +
D
TsO H
HH
H Me
29
30
31
3. E1cb
An acid-strengthening group on the β-carbon (a -R
type such as -COR, -SO2R, -NO2) and a rather difficult leaving group, e.g. -OR or -CN, will favor this route.
+ δ
Br δ-
(←) solv
H
+
B
H
+
Br- intimate
ion-pairs
k2
O Br- H S solvent separated
B
H
+
+ BH+
+ Br-
Solv
28
erythro-3-d-2-butyl tosylate
MeH H
anti-elim. Me Me Me H
TsO DMe
H
KOH ethanol heat
有机合成中的 β-消除反应

有机合成中的β-消除反应摘要:本文阐述了消除反应的类型和各类型反应的机理和历程,并讨论了其影响因素。
关键字:β—消除、立体选择、过渡态、碳正离子消除反应是从一个分子中消除两个原子或基团而不被其它原子或基团所置换的反应。
它可以分为三类,若消去的2个原子连在同一个碳原子上,则称为α—消除反应,若2个消去的原子连在相邻的2个碳原子上,则称为β—消除反应,若2个消去的原子连在1,3位碳原子上,则称为γ—消除反应,其中β—消除反应最为重要。
其实质是从相邻的两个原子上消除两个原子或基团,形成一个新的双键或叁键。
β—消除反应包括的反应多,而该类反应涉及的反应条件、反应产物都比较复杂,且消除反应和取代反应常常相伴而行,反应历程也时有变化,因而比较复杂[1]。
但其在实际中有广泛的应用,如卤代烃的消除反应、磺酸酯的消除反应、季铵碱的消除反应[2].接下来本文将对β—消去反应的反应历程和影响因素作简要介绍。
1反应历程分类β—消去反应的历程有三种,即:单分子消除反应机理(E1)、双分子消除反应机理(E2)和碳负离子反应机理(E1cb)[4]。
1.1E1机理单分子消除为2步过程,第一步是离去基团带着一对电子离去,底物成为碳正离子;第二步是碳正离子从β位脱去一个质子,给予碱或溶剂,生成烯键,第一步速率较慢,是决定反应速率的步骤,E1机理中C—X键断裂在前,C(β)一H 键断裂在后,故常伴随碳正离子重排。
单分子消除反应的动力学特征是:速率=K[RX]影响反应快慢的因素有:第二步中生成碳正离子的稳定性,介质是否容易电离和是否易于使离子溶剂化,不同结构的卤代烷烃反应活性难易为1。
RX<2。
RX<3。
RX。
消除反应按E1历程进行时,中间体正碳离子的稳定性决定反应速度,产物的生成发生在第2步,产物的稳定性是决定消除反应择向的主要因素。
在E1反应里,不论作用物性质如何,总是形成双键碳上带有最多烷基的烯烃主产物;所以消除反应按E1历程进行时一般服从规则,但Saytzaff消除反应产物由于空间作用变得不稳定时,消除反应将遵Hoffmann规则1.2E2机理1.2.1双分子消除反应为一步反应,当碱进攻β—H时,β—C—H和α—C—H 同时均等协同地断裂,在过渡状态中5个原子团在同一个平面上,随后在α—碳和β—碳上生成π键。
β消除反应机理

β消除反应机理
β消除反应是一种分子内消除反应,其中反应物中的beta位点(也称为β-碳)与相邻的α位点上的氢原子形成键,消除出α-β不饱和烯(也称为烯丙基化合物)和水或其他小分子。
β消除反应机理可以分为两种类型:酸性条件下的β消除和碱性条件下的β消除。
以下是对这两种机理的详细解释:
1. 酸性条件下的β消除
酸性条件下的β消除反应涉及的反应物是酸性溶液和具有β位点的化合物(如醇,酮,酯等)。
酸性条件下的β消除通常是三步反应。
首先,质子从酸中传递到β位点上的氢原子上,使它们形成β-碳阳离子。
这一步是速率决定步骤。
第二步是α位点上的氢原子从β-碳阳离子中捐献到β位点上,生成
α-β不饱和烯和质子。
第三步是质子再次从酸中捕获,生成水分子。
此反应的最终结果是醇被转化为烯丙基醚,酮被转化为α,β不饱和酮和酯被转化为α,β不饱和酯等。
首先,碱中的氢氧离子从水中解离形成氢氧根离子。
然后,氢氧根离子进攻β位点上的氢原子形成β-碳负离子。
第二步是α位点上的碳原子从β-碳负离子中捐献出它的一个电子对,形成α-β不饱和烯和氢氧根离子。
最后一步是碱中的氢氧离子把氢氧根离子脱去,生成水分子和碳负离子。
总之,β消除反应是一种常见的化学反应,可以通过在不同的条件下使用酸或碱来实现。
不同反应物的选择和不同条件下的实现可以影响反应的速率和效果。
第三章消除反应

CHMe2 HH 100% 1 2 3 (IV) 4
氯化萜
Me
CHMe2
1 2 3 (V)
4
CHMe2
(3)通常反式消除占优势,但碱的状态(即以游离状态或是
以离子对存在)能影响顺式与反式作用。 (I)弱电离的溶剂促进不带电荷的离去原子团的顺式消除。
C H R O M X
R O H + M +X C +
第三章
1、消除反应的分类
消除反应
消除反应(Elimination Reaction) 是指从有机分子中排 除去一个小分子或两个原子或基团,生成双键、叁键或环状 结构化合物的反应。 (1)α-消除(或1,1-消除)反应
H R C X R
R C R
(2)β-消除(或1,2-消除)反应
HX R C HC H R H X + R C C R
又如氯代反丁烯二酸脱氯化氢的反应速度比顺式二酸快48倍, 反式消除作用比顺式消除作用占优势。
C l C C H O C 2 H C O H 2 碱 C O H 2 C C +H C l C l C ; C C O H 2 C O H 2 碱 C O H 2 C C C O H 2 +H C l
H C O H 2 反 式 比 顺 式 快 4 8 倍
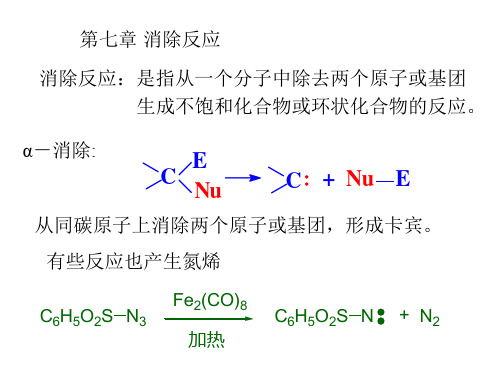
2、 E1消除反应的立体化学
与E2历程相比, E1历程的反应立体选择性较差。
因为在E1反应中,首先生成具有平面构型的碳正离
子,此时反式消除和顺式消除的几率应该一样。但 是,与SN1反应的立体化学类似,假如,离去基团 尚未充分远离,即碳正离子尚未能形成平面构型之 前,而消除反应已经完成,则优先生成反式消除产
有机化学基础知识点消除反应的机理和规律

有机化学基础知识点消除反应的机理和规律有机化学中,消除反应(Elimination Reaction)是指一个或多个原子、离子或分子从一化合物中脱离,形成一个或多个化合物的过程。
消除反应是有机合成中的一种重要反应类型,其在有机化学的理论和实践中有着广泛的应用。
本文将介绍有机化学基础知识点消除反应的机理和规律。
一、消除反应的机理消除反应的机理通常可以分为两种常见类型:β消除和α消除。
1. β消除在β消除反应中,反应物中的一个氢原子和与其相邻的一个β位碳原子一起被去除,产生一个双键。
β消除反应一般分为E2和E1两种机理。
E2机理是指消除反应中发生过程化学步骤同时进行。
它是一个一步反应,反应速率受到底物中碱性位点浓度和反应化学步骤的速率常数的影响。
E1机理是指消除反应中发生过程在两个步骤中进行。
首先,底物发生醒目或离子化,生成一个中间的碳正离子(或是碳正离子的共轭碱)和一个阴离子。
然后,中间体和阴离子相互反应,生成产物。
2. α消除在α消除反应中,反应物中的一个氢原子和相邻的一个α位碳原子一起被去除,产生一个双键。
简单来说,α消除反应是通过α位碳上一个相邻的碳-氢键断裂和产生一个新的双键。
二、消除反应的规律消除反应的规律可以从多个方面进行解释:1. 反应底物的结构消除反应通常发生在有机化合物的饱和键上,如碳氢化合物、卤代烃和醇等。
饱和碳原子上的氢原子可以通过消除反应被去除,形成一个新的双键。
2. 反应条件消除反应的进行需要适当的反应条件。
例如,在使用碱性条件下进行β消除反应时,碱性溶液可以提供足够的负电荷来帮助氢原子离去,进而促进消除反应的进行。
3. 消除反应类型的选择消除反应的类型选择主要取决于底物的结构以及反应条件。
在选择反应类型时,需要考虑底物的性质、产物稳定性、反应速率等因素。
4. 反应机理的理解理解消除反应的机理可以帮助我们准确预测和控制反应过程。
通过了解反应机理,我们可以选择合适的反应条件,优化反应过程,并预测产物的结构。
第七章消除反应(完)
B
H
X
BH
消去的 H 和 X 必须在
同一平面上,才能满足
逐渐生成的 p轨道最大
X
限度的交叠。
交叉式构象 H与X为反式共平面
负电荷相距较远
考虑顺式共平面消除(顺式消除)
B
H
X
CC
BH
X
CC
负电荷相距较近, 有排斥作用
CC
X
B
H
BH
X
H与X为顺式共平面
重叠式构象, 较不稳定。
结论:顺式消 除比反式消除 难发生
1、E1历程 遵从Saytyeff规则,形成热力学稳定的烯烃, 如果空阻过大时则遵从Hofmann消除
(CH3)3CCH2
CH3 C Cl NaOH
H2O CH3
(CH3)3CCH2
C CH2+CH3 CH3
CH3 C CH=CMe2 CH3
2、E1cb历程
遵从Hofmannn规则
H R' R CH2 C CH B-
B: 中性或带负电荷,如:OR-, OH-, H2O等。 L: X,SO2R, NO2, CN, NR3+,SR2+等。
动力学为二级动力学,反应速度与反应物的 浓度有关,也与碱浓度有关。
V=k[反应物] [B]
* *反反应应为为协协同同反反应应,,氢氢提提取取和和离离去去基基团团的的脱脱掉掉发发生生在在同同一 一步步骤骤,,从从来来没没有有鉴鉴定定到到过过中中间间体体。。
-E2可变过渡态理论 协同的一步反应,无任何中间体,而E1和E1cb均为
二步反应。多数情况下E2键的断裂和形成并非协 同的,而且有先有后,为此提出了可变过渡理论。
过渡态中C-H键断裂程度增加
消除反应的历程

C2H5ONa C2H5OH
CH2=CH-CH=CH-CH2CH3
原因: 、 酸性比β 酸性强 反应活性大; 酸性强, 原因:1、β-H酸性比 ‘-H酸性强,反应活性大; 酸性比 2、生成的共轭烯烃更稳定。 、生成的共轭烯烃更稳定。
2、当碱的空间位阻特别大时,反应的取向也会发生改变,生成反查依 、当碱的空间位阻特别大时,反应的取向也会发生改变, 采夫取向的烯烃,这种烯烃也称为霍夫曼取向的烯烃。 采夫取向的烯烃,这种烯烃也称为霍夫曼取向的烯烃。P281
双分子消除) ⑵、 E2(双分子消除)反应
CH3CH2CH2Br C2H5ONa C2H5OH CH3CH = CH2
动力学上为二级反应: v = k [CH3CH2CH2Br][C2H5O- ]
反应机理: 反应机理:
C2H5O
-
H
β
CH3— CH — CH2 Br
α
δC2H5O
H
β α
CH3— CH — CH2 反应的过渡态
E2 C H 3X 1O 2O 3O SN2
离去基对消除反应取向的影响P281 离去基对消除反应取向的影响
x
I Br Cl F
H H C3H7 X
2己烯% 81 72 67 30
CH3 H
1己烯 19 28 33 70
X H C4H9 H H H
X不易离去时,优势构象在反应中起较大作用 不易离去时, 不易离去时
Β— H的位阻对消除取向的影响 的位阻对消除取向的影响
1丁烯%
CH3-CH-CH2-CH3 Br 19
2 丁 烯 %
81
CH3 Br
CH3 86 14 CH3
(试剂:C2H5ONa / C2H5OH) 试剂:
第三节 β—消除反应

例如:25℃叔丁基氯溶于80%含水乙醇中,
同时发生E1和SN1
CH3
CH3
CH3 C Cl H2O CH3 C+
慢
CH3
CH3
E1
CH3 CH3 C=CH2 H3+O
SN1
CH3 CH3 C OH
H+
CH3
E1和SN1反应都经由碳正离子这一步,只是 第二步反应中,E1历程是碱进攻β-H生成烯烃, 而SN1是碱进攻αL-碳生成取代产物。L
CH3
H
CH CH2 Br
CH3 CH3CH2OH Br-
反应的定速步骤和两种分子(反应物分子和 碱分子)有关,故为双分子消除历程。
E2反应中所形成的过渡态和反应的动力学特 点与SN2相似,其区别在于亲核试剂在 E2反应中 进攻β-氢原子,而在SN2反应中则进攻α-碳原子。
L
L
CC
CC
H
¨B E2
例如:
产物%
CH3CH2CH2CH2Br
C2 H5ONa C2 H5OH
55 C
SN2 90 2
E 98
CH3 2 CHCH2Br
〃
〃
40 5
59 5
CH2CH2Br
〃
(β-H 酸性大) 〃
44
94 6
(二) 试剂的碱性
试剂的碱性越强,越有利于E2历程,不利于SN2 反应。由于碱性越强,越易进攻β-H,(碱性是 亲质子的性能)不易进攻α-碳。
C
C
C
C
实验证¨BH明,叔E卤1 代烷和醇SHN失1 水的¨B-消除反应常
按E1历程进行。由于羟基碱性很强,不是很好 的离去基团,所以在通常情况下醇不易发生失
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例如:
产物%
CH3CH2CH2CH2Br
C2 H5ONa C2 H5OH
55 C
SN2 90 2
E 98
CH3 2 CHCH2Br
〃
〃
40 5
59 5
CH2CH2Br
〃
(β-H 酸性大) 〃
44
94 6
(二) 试剂的碱性
试剂的碱性越强,越有利于E2历程,不利于SN2 反应。由于碱性越强,越易进攻β-H,(碱性是 亲质子的性能)不易进攻α-碳。
有些消除反应的反应速度只与反应物浓度 有关,而与试剂的碱性浓度无关,这些反应叫 E1反应。
E1与SN1 反应有相似的历程,都是通过生成 碳正离子 进行的。所不同的是E1反应的第二步 碱夺取碳正离子中的一个β-H而形成烯烃。故E1 和SN1也常一起发生(由于E1和SN1都经历碳正离 子中间体一步,而这一步骤为定速步骤,所以E1 和SN1同时发生)
CH3 CH3 C+ CHCH3
H+ CH3
CH3 CH3
C
+
CHCH3
2,3-二甲基-2-丁烯
H
所以E1历程常伴随着重排反应,重排反应 为E1历程的标志,当然也是SN1历程的标志。
碳正离子的重排规律是:1°>2 °>3 °
(三)碳负离子历程( E1CB )
在 E1历程中是离去基团首先离去;E2历程 中两个被消除原子或原子团同时离去。消除 反应的第三种历程是强碱B作用下,β-H 原子 以质子形式离去,然后离去基团带着一对电 子以负离子的形式离去。
I-
亲核最多
RCH2CH2I
OH-为三者中最强的碱,进攻β-氢几率多, 使消除为主,CH3COO-碱性较弱,E2消除产物 较少,亲核产物较多。而I-为最弱的碱,主要进 攻α-碳 ,以亲核产物为主。所以常用这个道理, 以卤代烃间接水解法制备醇。因为第一个反应, 卤代烃直接水解法,消除产物与亲核取代产物 并存。而第二个反应则主要以亲核产物为主, 成酯,然后酯水解得醇。
CH3
H
CH CH2 Br
CH3 CH3CH2OH Br-
反应的定速步骤和两种分子(反应物分子和 碱分子)有关,故为双分子消除历程。
E2反应中所形成的过渡态和反应的动力学特 点与SN2相似,其区别在于亲核试剂在 E2反应中 进攻β-氢原子,而在SN2反应中则进攻α-碳原子。
L
L
CC
CC
H
¨B E2
常见亲核试剂碱性大小顺序:
> > > NH2- RO- CH3COO-
I-
在E1历程中,定速步骤是和反应物的浓度有 关,试剂的碱性对反应影响不大。
水为弱酸,其共轭碱为强碱,羧酸为较强的 酸,其共轭碱较弱,HI为无机较强的酸,其共 轭碱为弱碱。
RCH2CH2X RCH2CH2X RCH2CH2X
OH- 消除多 RCH=CH2 CH3COO-亲核多 RCH2CH2COOCH3
CH3 O+H2
CH3 CH3 CCHC3+HCH3
CH3
H
CH3 CH C+H CH2
H+
CH3
CH3 C CH=CH2
CH3 α β
CH3
3,3-二甲基-1-丁烯
有重排发生:
CH3 CH3 C CH CH3
CH3 OH2
CH3 2 C=C CH3 2
CH3
CCH3C+HCH重3 排CH3 CH3
如:
CH3 3c x
另外伯到叔碳正离子也越稳定,增加E1消除机 会.所以卤代烷消除反应顺序是:叔>仲>伯,亲 核取代反应的顺序是:伯>仲>叔。
例如:
制备乙基叔丁基醚时,不能以叔卤代完为反 应物与试剂乙醇钠作用,而要以叔丁基醇钠为 试剂,以伯卤代烷(乙基卤)为反应物。
CH3 CH3 C X NaOC2H5
Br-
CH3
CH3 C C+ H2
甲基迁移
CH3
CH3 重排
CH3 C CH2CH3
+
CH3 CH3
αC
+
βCHCH3 H
H+
CH3 CH3
C=CHCH3
又如:3,3-二甲基-2-丁醇用硫酸处理时主要生
成2,3-二甲基-2-丁烯。正常产物是:
CH3
CH3 C CH CH3
H+
CH3OHБайду номын сангаас
快
CH3 CH3 C CH CH3
(二)进攻试剂的碱性
E1历程在反应的定速步骤中和碱的浓度 无关,而E2和E1CB要借助碱才能完成。因此 增加碱的浓度,反应历程可由E1转变为E2特 别强的碱有利于夺取β-H,因而有利于E1CB
历程。
(三) 溶剂的极性
极性大的溶剂有利于E1,E1历程生成 的中间体为碳正离子,可以通过溶剂化效 应使正负电核分散而稳定了碳正离子。而 E2历程经过的过渡态只带有部分电荷,不 需要极性溶剂给予稳定作用,好像电荷已 经很分散了,不需要外界帮助。所以极性 溶剂有利于E1,不利于E2。
这个反应和E1历程相似的地方是:决速步 骤仅有一分子,由于生成的中间体是碳负离 子,又称碳负离子历程,又由于碳负离子是 反应物的共轭碱故也叫共轭碱历程E1CB (C 为共轭字头,b为碱的字头)。
历程:
¨B H L
L
C
C快
C
C 慢 C=C
X-
HX
H
X
例如:
F
FC F
Cl
F
C H C2H5O- 快 F C
(三) 溶剂的极性
增加溶剂的极性有利于SN反应,而不利于E反应, 这可以从反应的过渡态电荷分散程度不同找到 答案。
SN
δNu- - H C H Lδ -
SN2
C δ +Nu-δ -
SN1
E
Bδ - H C
E2
δB - H C
E1
Cδ
-
L
Cδ +
注:
SN1和E1中按定速步骤应写出碳正离子 生成的过渡态,但第一步一步生成碳正离 子过渡态E1和SN1无区别。而第二步Nu-进 攻α-碳,碱夺取β-H时的电荷分散程度是 有区别的,SN1分散在两原子之间,E1分 散在四个原子之间。
另外,在经E1历程进行消除时,由于中间 体碳正离子的生成,E1就有可能发生碳正离子 的重排。由不稳定的碳正离子重排成更稳定的 碳正离子,然后再 消去氢进行E1反应,或者 与亲核试剂作用进行SN1反应。
例如:新戊基溴和乙醇作用主要生成2-甲基-2-丁烯。
CH3
CH3 C CH2Br CH3
C 2H 5O H
② CH3 和3cO- 反C2应H5变X 为了按SN2历程. 这是工
业上制混醚的方法,叫威廉姆逊合成。前者 是亲核试剂,反应物是伯卤代烷,伯卤代烷 进行的亲核取代反应按SN2历程进行。
2、β-碳上无支链的伯卤代烷易发生SN2。
β-碳增加支链不利于SN2反应,而有利于 E2。β-碳上支链增加,使亲核试剂不易进攻 α-碳,SN2反应对空间效应很敏感,使SN2 反应变得困难,β-H酸性大,对E2有利。
例如:25℃叔丁基氯溶于80%含水乙醇中,
同时发生E1和SN1
CH3
CH3
CH3 C Cl H2O CH3 C+
慢
CH3
CH3
E1
CH3 CH3 C=CH2 H3+O
SN1
CH3 CH3 C OH
H+
CH3
E1和SN1反应都经由碳正离子这一步,只是 第二步反应中,E1历程是碱进攻β-H生成烯烃, 而SN1是碱进攻αL-碳生成取代产物。L
H
¨B-
SN2
因此消除反应和取代反应是相互竞争的,
如下面的例子就是同时发生SN2和E2反应。
E2
C2H5O- + H CH CH2Br SN2
CH3
CH3CH=CH2
HOC2H5 Br-
CH3CH2OCH2CH3 Br-
实验表明,伯卤代烷、季铵盐等在强碱作用 下所发生的消除以E2历程进行。
(二)单分子消除历程( E1 )
(2) 试剂碱的强度—碱性越强越倾向 于E1CB。 (3)反应物的立体因素—碳正离子稳定性。
碳正离子越稳定越有利于E1,同时必须满 足溶剂的极性强。
二 、影响消除反应历程的因素
(一)反应物的结构
E1和E1CB反应中间体是碳正离子和碳负离 子,有助于稳定这种中间体的因素,当然也 有助于稳定形成中间体的过渡态。 α-碳连的 给电子基越多,越有利于E1,给电子基使碳 正离子稳定。相反β-碳连的吸电子基越多, 越有利于E1CB历程,吸电子基使碳负离子稳 定,且容易将β-氢转移给碱。
三、E反应和SN反应相互竞争
消除反应和亲核取代反应都是由同一 亲核试剂进攻而引起的,进攻α-C原子 就引起取代反应,进攻β-H原子就引起 消除,所以这两种反应都是同时发生和 相互竞争的。
(一)反应物的结构
1、伯卤代烷有利于SN2反应。
但当伯卤代烷α-碳上支链增多不利于SN2, 而有利于E2。
α-C支链增多,增加了亲核试剂对反应中碳 进攻的阻碍,而提高了β-H的个数,而使E2 反应变得容易。
CH3
CH3
C2H5X CH3 C ONa
CH3
CH3 CH3 C OC2H5
CH3
前者是行不通的α-C支链增多,增加了β-H的 个数,而有利于E2消除反应。
CH3 CH3 C X
CH3
- OC2H5
CH3 CH3 C=CH2
C2H5OH
X-
消除产物
而后者亲核试剂 CH3 3进CO攻- 支链不太多的 CH3CH有2X利于SN2反应进行。
