消除反应ppt课件
合集下载
消除反应

消除反应
化学术语
01 内容简介
03 反应速率 05 反应机理
目录
02 分类 04 消除规则
消除反应又称脱去反应或是消去反应,是指一种有机化合物分子和其他物质反应,失去部分原子或官能基 (称为离去基)的有机反应。消除反应发生后,生成反应的分子会产生多键,为不饱和有机化合物。消除反应可 使反应物分子失去两个基团(见基)或原子,从而提高其不饱和度。
内容简介
消除反应 (elimination reaction)又称脱去反应或消去反应,是一种有机反应,一般为一有机化合物分子 和其他物质反应,失去部分原子或官能团(称为离去基)。反应后的分子会产生多键,为不饱和有机化合物。消 除反应分为下列两种:β消除反应:较常见,一般生成烯类。α消除反应:生成卡宾类化合物。离去基所接的碳 为α碳,其上的氢为α氢,而隔壁相邻接的碳及氢则为β碳及β氢。化合物会失去β氢原子的称为 β消除反应, 会失去α氢原子的称为α消除反应。
有些反应物在 β碳原子上连有比氢更容易被路易斯碱(见酸碱理论)作用的基团或者根本没有 β氢,它们 就有可能发生不涉及失去 β氢的消除。连二卤代烷在碘离子或锌的作用下发生的脱卤反应和 α,α-二烷基β -卤代酸的脱羧反应都属于这种情况。
谢谢观看
在E1C和E1CB中,反应均分两步进行,各自的活性中间体碳正离子和碳负离子都具平面结构,一般不存在立 体选择性问题。但在E2中,只有离去基团、α和β碳及β氢四者处于共平面的空间位置,才有利于协同反应的进 行,而符合这种要求的空间排列有两种:离去基团和β氢在α、β碳同一边时,发生顺式消除;离去基团和β氢在 α、β碳的两边时,发生反式消除。在大多数情况下,E2为反式消除,但不排除顺式消除的可能性,甚至有些反 应物由于结构的限制,只能发生顺式消除。
化学术语
01 内容简介
03 反应速率 05 反应机理
目录
02 分类 04 消除规则
消除反应又称脱去反应或是消去反应,是指一种有机化合物分子和其他物质反应,失去部分原子或官能基 (称为离去基)的有机反应。消除反应发生后,生成反应的分子会产生多键,为不饱和有机化合物。消除反应可 使反应物分子失去两个基团(见基)或原子,从而提高其不饱和度。
内容简介
消除反应 (elimination reaction)又称脱去反应或消去反应,是一种有机反应,一般为一有机化合物分子 和其他物质反应,失去部分原子或官能团(称为离去基)。反应后的分子会产生多键,为不饱和有机化合物。消 除反应分为下列两种:β消除反应:较常见,一般生成烯类。α消除反应:生成卡宾类化合物。离去基所接的碳 为α碳,其上的氢为α氢,而隔壁相邻接的碳及氢则为β碳及β氢。化合物会失去β氢原子的称为 β消除反应, 会失去α氢原子的称为α消除反应。
有些反应物在 β碳原子上连有比氢更容易被路易斯碱(见酸碱理论)作用的基团或者根本没有 β氢,它们 就有可能发生不涉及失去 β氢的消除。连二卤代烷在碘离子或锌的作用下发生的脱卤反应和 α,α-二烷基β -卤代酸的脱羧反应都属于这种情况。
谢谢观看
在E1C和E1CB中,反应均分两步进行,各自的活性中间体碳正离子和碳负离子都具平面结构,一般不存在立 体选择性问题。但在E2中,只有离去基团、α和β碳及β氢四者处于共平面的空间位置,才有利于协同反应的进 行,而符合这种要求的空间排列有两种:离去基团和β氢在α、β碳同一边时,发生顺式消除;离去基团和β氢在 α、β碳的两边时,发生反式消除。在大多数情况下,E2为反式消除,但不排除顺式消除的可能性,甚至有些反 应物由于结构的限制,只能发生顺式消除。
消除反应 Elimination Reactions.ppt

C C 慢 C C +L
L
按E1cb机理进行反应底物结构特征:
① 当β-氢被吸电子基团活化时,如:COCH3、
NO2、Me3N+等; ② L是难离去基团。
O
O
OCCH3 H CH3O
NO2 H
OCCH3 H
NO2
NO2
H CF3
CF3
E1cb机理证明
同位素交换
CF2
CCl2
CF2 OH
CCl2
CF2
(CH3)2C CH2 (CH3)3COH
k = 89.7× 105 mol.L-1 s-1 (CH3)3C
底物不同 产物相同 反应速率不同
80%EtOH
-H2O (CH3)3CS(CH3)3
k = 11.8× 105 mol.L-1 s-1
经过相同的中间体
(2) 重排产物的生成:
Wanger-Meerwein 重排
E1
- LG
H B:
LG
E2
H
H
LG
E1cB
B:
-H LG
-HH -LG
一、双分子消除E2反应 历程(Bimolecular Elimination Reactions )
按E2历程消除的前提条件:β—H酸性不太大; L也不 太容易离去。
δ
H
HB
CC B L
CC Lδ
C C + HB + L
在双分子消除反应中,碱进攻反应物的β—H的同 时,离去基团L带着一对电子从分子中离去,在两 个碳原子之间形成新的π键:
D Ph O PhCH赤C型HOCCH3
CH3
O
C O
H
第十二章 消除反应

1、脱溴化氢:亲核试剂必须从Cα -X键反平行位置进攻β -H
Br H H meso Ph H H dl 对 Br Br Ph Br Ph H Ph Br trans H Ph Br Ph H Ph H Br Ph Ph Br H Ph ≡ Ph H cis Ph Br Ph
Br ≡ Ph
Br Ph
H H
不符合消去
Br H H 3C H OEt CH3 H H 3C H 3C
Br H H H OEt
对于环状化合物 相邻两个取代基只有处于a键位置才有利于消除
OTs
OTs
E2
H
OTs
具有反式氢
OTs H
E1 (慢)
处于反式的氢在e键上,与OTs不在一个平面上,反 应按E1机理进行。
例:消去反应,vCis = 500 vtrans, Why?
β
CH3 N CH2CH2CH3 CH3
β '
OH
H2C CH2 + CH3CH CH2
(98%) (2%)
从过渡态中的β-氢的活性考虑,失去β-氢,生成 伯碳负离子,失去β’-氢,生成仲碳负离子。 伯C-稳定性 > 仲C-稳定性,所以乙烯是主要产 物。
CH3 OH PhCH CH2 + CH3CH2N(CH3)2 CH CH PhCH2CH2 N 2 3 β ' β CH3
L首先 离去
4、影响反应机理的因素:
1) 底物
E1机理
利于C+的 生成
Ar
R
稳定C- 的作用
C L
H C
减弱β-氢 的酸性
R'
除此之外 均按E2 机理
Ar (Y)
EICB机理
Br H H meso Ph H H dl 对 Br Br Ph Br Ph H Ph Br trans H Ph Br Ph H Ph H Br Ph Ph Br H Ph ≡ Ph H cis Ph Br Ph
Br ≡ Ph
Br Ph
H H
不符合消去
Br H H 3C H OEt CH3 H H 3C H 3C
Br H H H OEt
对于环状化合物 相邻两个取代基只有处于a键位置才有利于消除
OTs
OTs
E2
H
OTs
具有反式氢
OTs H
E1 (慢)
处于反式的氢在e键上,与OTs不在一个平面上,反 应按E1机理进行。
例:消去反应,vCis = 500 vtrans, Why?
β
CH3 N CH2CH2CH3 CH3
β '
OH
H2C CH2 + CH3CH CH2
(98%) (2%)
从过渡态中的β-氢的活性考虑,失去β-氢,生成 伯碳负离子,失去β’-氢,生成仲碳负离子。 伯C-稳定性 > 仲C-稳定性,所以乙烯是主要产 物。
CH3 OH PhCH CH2 + CH3CH2N(CH3)2 CH CH PhCH2CH2 N 2 3 β ' β CH3
L首先 离去
4、影响反应机理的因素:
1) 底物
E1机理
利于C+的 生成
Ar
R
稳定C- 的作用
C L
H C
减弱β-氢 的酸性
R'
除此之外 均按E2 机理
Ar (Y)
EICB机理
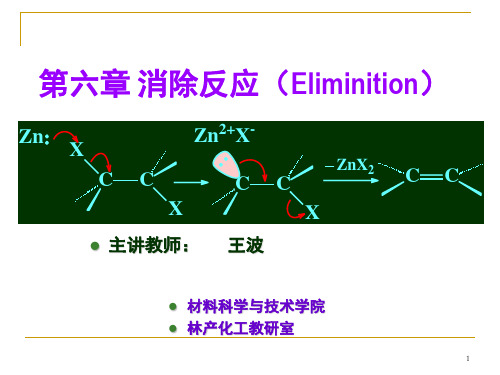
第六章 消除反应
13
(二)共轭碱单分子消除 (E1cb)(碳负离子)
2、有利于E1cb消除反应的因素:
① 当β-氢被强吸电子基团活化,具有酸性,如: COCH3,、NO2、Me3N+等;同时稳定负碳离子; ② L是难离去基团。 ③ 试剂的碱性强,浓度大
O OCCH3 CH3O H NO2 H
O OCCH3 H NO2
C 6H 5
H + NaBr + H2O H
C N + CH3COOH
5
CH3 Br H H
C6H5 CH N O C CH3 O
3、其他
C6H5 CH CH2 H CH2 F
OHCH2 CH CH CH2 + Br2
C2H5ONa
C6H5 CH
CH2
+ HF
CH2
1,3消除
CH2 CH Br
C C B
C A
C
C B
3
1,4-消除
1,3-消除
1、-消除,1,1-消除
1) 定义:从同一原子上除去两个原子或者基团产 生一个活性中间体碳烯或氮烯的过程 2) 机理:
C E Nu
H C Cl O Cl
△
ENu
Cl C Cl
C
+
Nu
E
3)举例:
Cl
+
HCl
CF3C ONa
CF2 + CO2 + NaF
CH CH2 Br
1,4消除
H
2
4 3 5
O
1
Cl O
+ HCl
1,5消除
大多数消除反应为1,2消除(-消除)。
(二)共轭碱单分子消除 (E1cb)(碳负离子)
2、有利于E1cb消除反应的因素:
① 当β-氢被强吸电子基团活化,具有酸性,如: COCH3,、NO2、Me3N+等;同时稳定负碳离子; ② L是难离去基团。 ③ 试剂的碱性强,浓度大
O OCCH3 CH3O H NO2 H
O OCCH3 H NO2
C 6H 5
H + NaBr + H2O H
C N + CH3COOH
5
CH3 Br H H
C6H5 CH N O C CH3 O
3、其他
C6H5 CH CH2 H CH2 F
OHCH2 CH CH CH2 + Br2
C2H5ONa
C6H5 CH
CH2
+ HF
CH2
1,3消除
CH2 CH Br
C C B
C A
C
C B
3
1,4-消除
1,3-消除
1、-消除,1,1-消除
1) 定义:从同一原子上除去两个原子或者基团产 生一个活性中间体碳烯或氮烯的过程 2) 机理:
C E Nu
H C Cl O Cl
△
ENu
Cl C Cl
C
+
Nu
E
3)举例:
Cl
+
HCl
CF3C ONa
CF2 + CO2 + NaF
CH CH2 Br
1,4消除
H
2
4 3 5
O
1
Cl O
+ HCl
1,5消除
大多数消除反应为1,2消除(-消除)。
消除反应 (2) ppt课件

E 2
5.3 影响反应机理的因素:
5.3.1 底物
1、对El及E2活性的影响
• 当反应底物中连有芳基(Ar)或C =C时,无论 其位于α-碳还是β-碳,对El和E2反应都有利。
• 当β-碳上连有Br , Cl , Ts , NO2 , CN , SR等吸 电子原子或基团时,将使β-H的酸性增强, 因而对E2反应有利,但其位于a-碳时则影响 不大。
第五章 消除反应 Elimination Reactions
5.1消除反应类型
消除反应: 是从一个化合物分子中消除两个原子或原 子团的反应。
5.1.1 β-消除:
在相邻的两个碳原子上的原子或基团被消除, 形成双键或叁键。
CC NuE
C C +Nu E
R C β H 2C α H 2 XO H - R C H = C H 2 + X -+ H 2 O
1)、不带电荷的反应底物,如卤代烃、磺酸醋等在 进行E2反应时,无论反应底物的结构如何,其消除 取向在大多数情况下都遵循Saytzeff规则。
当X=F时,因F是很强的吸电子基团,致使β-H的酸性增强,在 碱的作用下,反应机理将由E2移向“类似Elcb”的E2,且甲基上 H的酸性优于亚甲基上的H,故Hofmann产物成为主要产物。
80% E tO H
(C H 3)3C C l - H 2O
产物相同
(C H 3)2CC H 2 (C H 3)3C O H
反应速率不同
k = 8 9 .7 × 1 0 5 m o l.L - 1 s - 1 ( C H 3 ) 3 C 经过相同的中间体
k = 1 1 .8 × 1 0 5 m o l.L - 1 s - 1
过 渡 态 中 C - H 键 断 裂 程 度 增 加
第七章 消除反应

在碱的作用下,C - L 键的断裂与C - H 键的断 裂同时进行,这是一个协同的双分子反应。
υ=k[RX][B:-]
双分子消除历程,二级反应
2. 反应活性(Reaction activity )
离去基团:RI > RBr > RCl
(与SN2反应相同)
进攻试剂的碱性越强,则反应活性越高。 如:HO﹣ > CH3COO﹣ (与SN2反应有所不同) 反应底物卤代烃的活性: 3º >1º >2º
1. 羧酸酯的热消除:
在无外加试剂存在下,通过加热,失去β-氢和羧 酸根,生成烯烃。
H O H O C H R R H H O + H O C R
R
H
H O
H C R
R
H
H
H O
反应特点:1) 高温,不需碱作催化剂 2) 环状过渡态机理 3) 通常是顺式消除。
环状化合物(Ⅰ)的热消除,只得化合 物(Ⅱ),为顺式消除。
(I) (II)
L
(2)
L: S(CH3)2 I / II 6.7
底物结构的影响
N(CH3)3 ~50
(CH3)3CCH2C(CH3)2 Br
EtO
(CH3)3CCH2C CH2 CH3
4.立体化学( Stereochemistry)
消除反应立体化学的确立:
(1)反应物中H和L 的空间关系:H和L可 在C-C键的两侧或同一侧,分别称为反式消 除和顺式消除。 (2)产物中取代基的空间关系:反应产物 是以顺式还是反式异构体为主
第七章 消除反应
Elimination Reaction
定义: 消除反应:是指从有机分子中消除去一个 小分子或两个原子或基团,生成双键、叁 键或环状结构化合物的反应。 分类: (1)α-消除(或1,1-消除)反应 H
υ=k[RX][B:-]
双分子消除历程,二级反应
2. 反应活性(Reaction activity )
离去基团:RI > RBr > RCl
(与SN2反应相同)
进攻试剂的碱性越强,则反应活性越高。 如:HO﹣ > CH3COO﹣ (与SN2反应有所不同) 反应底物卤代烃的活性: 3º >1º >2º
1. 羧酸酯的热消除:
在无外加试剂存在下,通过加热,失去β-氢和羧 酸根,生成烯烃。
H O H O C H R R H H O + H O C R
R
H
H O
H C R
R
H
H
H O
反应特点:1) 高温,不需碱作催化剂 2) 环状过渡态机理 3) 通常是顺式消除。
环状化合物(Ⅰ)的热消除,只得化合 物(Ⅱ),为顺式消除。
(I) (II)
L
(2)
L: S(CH3)2 I / II 6.7
底物结构的影响
N(CH3)3 ~50
(CH3)3CCH2C(CH3)2 Br
EtO
(CH3)3CCH2C CH2 CH3
4.立体化学( Stereochemistry)
消除反应立体化学的确立:
(1)反应物中H和L 的空间关系:H和L可 在C-C键的两侧或同一侧,分别称为反式消 除和顺式消除。 (2)产物中取代基的空间关系:反应产物 是以顺式还是反式异构体为主
第七章 消除反应
Elimination Reaction
定义: 消除反应:是指从有机分子中消除去一个 小分子或两个原子或基团,生成双键、叁 键或环状结构化合物的反应。 分类: (1)α-消除(或1,1-消除)反应 H
第10章 消去反应

化学
卤代烃对E1和E2消去反应的活性顺序: 3 ° > 2 ° > 1° 如果b-H酸性加大,有利于碱的进攻,有利于E2反应。
叔卤代烃以及仲、叔醇有利于E1反应。
(二) 进攻试剂的影响
E1与SN1历程中,决定反应速度的步骤是碳正离子的生 成,进攻试剂的影响不大 试剂的碱性对E2的影响较大,碱性越强,越容易夺取 b-H ,有利于E2反应。
化学
有利于 E1 反应的因素: 有叔烃基或a-C连有芳基的仲烃基
b-C上没有吸电子基团
离去基团容易离去 试剂的碱性不强 溶剂极性强
化学
有利于 E2 反应的因素:
含伯烃基或含仲烃基的作用物
β位上有活泼氢 离去基团离去倾向不大 试剂的碱性强 溶剂极性弱
化学
有利于 E1CB 反应的因素:
β位上的氢特别活泼 β位上有强吸电子基 离去基团离去倾向较小 试剂的亲核性特别强
相应氢的酸性次序: H-CH3 > H-CH2R > H-CHR2 > H-CR3
化学
3. E2历程 在E2反应的择向与其过渡态紧密相关。 在完全协同的E2反应中,过渡态已具有双键的性质, 烯烃的稳定性大,则过渡态的位能低,反应所需活 化能小,反应速度快。 遵从Saytzeff规则 若过渡态具有更多的E1CB特征时,产物符合 Hofmann规则 。 若过渡态具有更多的E1特征时,产物符合Saytzeff规 则
化学
(四) 温度的影响
(五) 离去基团的影响
较好的离去基团有利于离子化作用,对E1或E2反应 有利。较差的离去基团或带正电荷的离去基团使反 应按E1CB进行:强的吸电子基团使b-H酸性增加。
化学
离去基团与E1和SN1间的竞争无关。 在双分子反应中,好的离去基团有利于取代反应。 离去能力顺序:OTs >I>Br>Cl>+S(CH3)2 >+N(CH3)3 , 消去产物的产率按此顺序增高。 带正电荷的离去基团,由于具有强的-I效应, b-H酸 性增加,易被碱进攻,得到消去产物。
8. 消除反应

Zaitsev’s Rule —从含氢较少的β -碳上消去得到取代 基较多的烯烃。
CH3CHCH2CH3 Br CH3CHCH2CH2CH3 Cl CH3 CH3CCH2CH3 Cl - OH - OH - OCH3 CH3CH=CHCH3 + CH2=CHCH2CH3 20% 80% CH3CH=CHCH2CH3 + 67% CH3 CH3C=CHCH3 70% + CH2=CHCH2CH2CH3 33% CH3 CH2=CCH2CH3 30%
Energy Diagram
影响E2反应区域选择性的因素:
1) Base Structure(碱的结构)
CH3 CH3CH-CCH3 CH3 Br Base CH3CH2O (CH3)3CO CH3CH2(CH3)2CO (CH3CH2)3CO + RO CH3 CH3C=CCH3 CH3 More substituted product 79% 27% 19% 8% + CH3 CH3CHC=CH2 CH3 Less substituted product 21% 73% 81% 92%
H+
CH3CH=CHCH3
OH CH3CH=CHCH3
消去反应的E1, E2, and E1cB机理
H
E1
-LG
-H
B:
H
LG
E2
H
LG
E1cB
-H
B:
-LG
LG
1. E2 Reaction Mechanism: (一步反应)
在碱的作用下,C — LG 键的断裂与C — H 键 的断裂同时进行,是协同的双分子反应。
example 1:
CH3CHCH2CH2CH3 Br X H3CH2C H H X H H H CH2CH3 CH3 :B -X H CH3 :B -X H C C H3C H ( E ) 41% H C C H3C CH2CH3 ( Z ) 14% H CH2CH3 - OEt HOEt CH3CH=CHCH2CH3 + CH2=CHCH2CH2CH3 minor product major product
CH3CHCH2CH3 Br CH3CHCH2CH2CH3 Cl CH3 CH3CCH2CH3 Cl - OH - OH - OCH3 CH3CH=CHCH3 + CH2=CHCH2CH3 20% 80% CH3CH=CHCH2CH3 + 67% CH3 CH3C=CHCH3 70% + CH2=CHCH2CH2CH3 33% CH3 CH2=CCH2CH3 30%
Energy Diagram
影响E2反应区域选择性的因素:
1) Base Structure(碱的结构)
CH3 CH3CH-CCH3 CH3 Br Base CH3CH2O (CH3)3CO CH3CH2(CH3)2CO (CH3CH2)3CO + RO CH3 CH3C=CCH3 CH3 More substituted product 79% 27% 19% 8% + CH3 CH3CHC=CH2 CH3 Less substituted product 21% 73% 81% 92%
H+
CH3CH=CHCH3
OH CH3CH=CHCH3
消去反应的E1, E2, and E1cB机理
H
E1
-LG
-H
B:
H
LG
E2
H
LG
E1cB
-H
B:
-LG
LG
1. E2 Reaction Mechanism: (一步反应)
在碱的作用下,C — LG 键的断裂与C — H 键 的断裂同时进行,是协同的双分子反应。
example 1:
CH3CHCH2CH2CH3 Br X H3CH2C H H X H H H CH2CH3 CH3 :B -X H CH3 :B -X H C C H3C H ( E ) 41% H C C H3C CH2CH3 ( Z ) 14% H CH2CH3 - OEt HOEt CH3CH=CHCH2CH3 + CH2=CHCH2CH2CH3 minor product major product
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
快
—C=C—
v=k[RX]
只有当形成的碳正离子比较稳定时,反应才能优 先按照E1历程进行。在高极性介质中有利于E1历程。
在E1反应中溶剂分子在反应中起很大作用,它即 可作β-质子的接受体,也可向碳正离子作SN1亲 核取代,所以亲核取代和消除常同时发生,并随溶剂 极性和反应温度不同而有不同程度发生。
醇在强酸作用下的脱水反应是按E1消除历程进行:
NO2 H
O
OCCH3 H
NO2
NO2
E1CB机理证明 同位素交换(在碱的水溶液中消除DF)
C C l2C F 2O HC C l2C F 2慢 H 2O C ,l2CC F 2(I)
DF
F快 C H C l2C F 3(II)
当反应进行一半时测定,产物中有(II)生成,表明 H与D的交换发生,说明中间体C -的存在。
第一节 反应机理和定位法则 一、反应机理
β-消除反应是制备烯烃的主要反应之一。由于 亲核取代反应的反应条件与其相似。因此,两种反
应相伴发生。
例如:
E R C H = C H 2+H 2 O +H X
RCH2CH2X + OH
S N
R C H 2C H 2O H+X
一、β—消除反应
CC HL
根据离去基团和β-氢从分子中离去 的顺序,分为三种机理:
CCC+Nu E
饱和碳原子进行亲核取代反应时,常伴随消除反应 的发生:
R C H 2 C H 2 O H +H X
R C H 2 C H 2 X + H 2 O R C H C H 2+ H 2 O + H X
β—消除最为常见,应用最广。
根据被消除的基团(或原子)又可分为脱氢、 脱卤化氢、脱水、脱胺、脱卤素、脱氨等反应。
k = 8 9 .7 × 1 0 5 m o l.L - 1 s - 1 ( C H 3 ) 3 C
k = 1 1 .8 × 1 0 5 m o l.L - 1 s - 1
底物不同 产物相同 反应速率不同 经过相同的中间体
按E1机理进行反应的实例:
(2) 重排产物的生成:
C H 3
C H 3
H 3 CCC H 2 B rE tO HH 3 CCC H 2 H 3 CCC H C H 3
按E1CB机理进行反应底物结构特征:
简单的卤代烷和磺酸烷基酯不起Elcb反应,1)
当离去基团L不易离去,即C-L键不易断裂(如季
铵),2)β-H又有较强酸性时,即在β-上有硝基、
羰基、氰基等强吸电子时,如:COCH3,、 NO2、Me3N+等,反应才可能按Elcb历程进行
O
OCCH3 H CH3O
R C H 2 C H 2 O H + H 2 S O 4 快R C H 2 C H 2 O H 2+ H S O 4 R C H 2 C H 2 O H 2 慢 R C H 2 C H 2+H 2 O
R C H 2 C H 2 快 R C H = C H 2+H
由于E1反应首先生成具有平面构型的碳正离子, 它可以自由转动成最稳定的构象,所以缺乏立体选 择性。
△ R 2C =C =O或 hv R 2C+ C O C H C l3 + N a O H C C l2 + N a C l+ H 2 O
RNO S O 2A r+ B - B H RN+ A rS O 3-
H
氮 宾 ( 6e)
△
RN N N -
RN + N 2
或 hv
1,3-消除:
CC C Nu E
C H 3
B r
C H 3
C H 3 H
H3C C C CH3 Wanger-Meerwein 重排
H H3C
H
按E1机理反应的底物结构特征: 形成稳定正碳离子的体系。
3、E1cB—单分子共轭碱消除反应历程:
—C—C—X H
—C—C—X
+B
快
慢
—C—C—X + HB C C +X
V=k[RX]
在碱的进攻下,β—H首先离去,从生成的碳负离子 (反应物的共轭碱)中离去基团带着一对电子离开, 同时生成π键:
醇在酸的催化下脱水和第三卤代烷在碱的作用下 脱卤化氢等属于E1反应。E1反应常伴有SN1的竞 争和重排产物的生成。
按E1机理进行反应的实例:
(1()1)
80% E tO H
(C H 3)3C C l - H 2O
(C H 3)2CC H 2 (C H 3)3C O H
80% EtO H
- H 2O (C H 3)3C S(C H 3)3
消除反应类型
2.α-消除(1,1-消除):
从同碳原子上消除两个原子或基团,形成卡宾: 卡宾为6电子结构
E C Nu
C +Nu E
O C F 3CO N a △ C F+C O 2+N aF
1. -消去反应 又叫1,1-消去反应, 得卡宾(碳烯)或氮宾(乃春、氮烯)
C H 2NN或 △ h v C H 2+ N 2
第15章 消除反应 (Elimination Reactions)
消除反应: 是从一个化 合物分子中消除两个原 子或原子团的反应。
一. 反应的类型 二. 反应机理
1. E1机理 2. 单分子共轭碱消除 (E1CB) 机理 3. E2机理
三.影响反应机理的因素
1. 底物 2. 碱 3. 离去基团 4. 溶剂
3、E1cB—单分子共轭碱消除反应历程:
B
CC LH
共轭酸
CC +HB L
共轭碱
CC 慢 C C +L L
消除反应究竟按何种机理进行,不仅与反应物的 结构有关,还与进攻试剂与介质的性质有关。
一般说来,有利于形成碳正离子者,有利于 E1机理进行;而有利于形成碳负离子者,有利于 按E1cB机理进行;中间的情况为E2机制。
3种消除机制---- E1, E1cb,E2
(一)消除反应的历程
1. E1 反应
一、β—消除反应
1. 单分子消除反应 (E1)机理
CC 慢 CC HL L H
ห้องสมุดไป่ตู้
CC +H
υ =k C C HL
反应活性:
对于烷基: 3°> 2°> 1°> CH3
1、单分子消除反应(E1)历程
慢
C—C—X H
C—C H
四. 反应的定向
1. 一般规则 2. 反应机理与定向的关系
五. 反应的立体化学 六. 其它1, 2消除反应 七. 热消除反应
反应特点 1. 羧酸酯的热消除反应 2. Cope 反应
消除反应类型
1.β-消除(1,2-消除) :
在相邻的两个碳原子上的原子或基团 被消除,形成双键或叁键。
CC NuE
C C +Nu E
