酶组织化学概论.ppt
合集下载
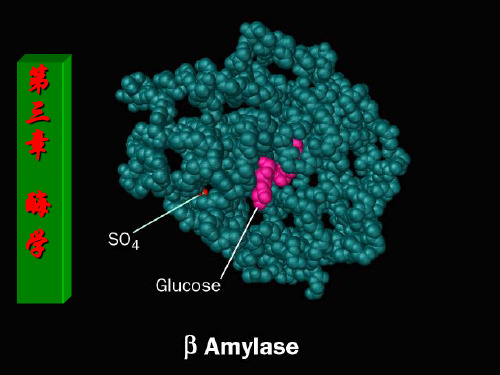
酶的概念及其化学性质优秀PPT
抑制剂与酶的结合为一可逆反应,可以用透析 等方法除去抑制剂。
分为两种主要类型:
竞争性抑制作用
非竞争性抑制作用
调节酶:本身的活性受到严格的调节 控制,可以在多酶体系中对代谢反应 起调节作用。
调节酶分类:
别构效应调控; 可逆共价修饰调控; 酶原的激活调控; 同工酶调控
别构酶调控:
1.别构酶:具有别构效应的调节酶,一般是由两 个或两个以上亚基构成的寡聚酶,有别构中心 和活性中心两个中心。
(3)在酶分子表面呈裂缝 状。
(4)酶活性中心的催化位 点和结合位点可以不止一个。
(5)酶活性中心的基团都 是必需基团,但必需基团还 包括活性中心以外的基团。
木瓜蛋白酶活性中心氨基酸残基
❖ 4.诱导契合学说
(1)锁钥学说
1890年,Emil Fischer提出。优点,缺点。
(2)诱导契合学说
1958年,提出。
Vmax 100%
50%
A
[S]90%V [S]10%V =81
B [S]90%V [S]10%V =3
1 2 3 4 5 6 7 8 [S]
A为非调节酶的曲线;B为别构酶的S形曲线
同工酶调节
同工酶:能催化相同的化学反应,但酶的分子 结构与理化性质不完全相同的一组酶。
乳酸脱氢酶:
亚基:心肌型(H);骨 骼肌型(M)
七、影响酶促反应速度的因素
1、底物浓度对酶促反应速度的影响 (1)[S] 与V关系曲线 (2)米氏方程 (3)Km值的意义 (4) Km值的求法
2、PH对酶促反应速度的影响 (1)PH与V关系曲线 (2)最适PH (3)PH影响酶活力的因素:
PH影响酶和底物 的解离状态,只有它 们处于最佳解离状态 时,才容易形成中间 产物,使反应顺利进 行。
分为两种主要类型:
竞争性抑制作用
非竞争性抑制作用
调节酶:本身的活性受到严格的调节 控制,可以在多酶体系中对代谢反应 起调节作用。
调节酶分类:
别构效应调控; 可逆共价修饰调控; 酶原的激活调控; 同工酶调控
别构酶调控:
1.别构酶:具有别构效应的调节酶,一般是由两 个或两个以上亚基构成的寡聚酶,有别构中心 和活性中心两个中心。
(3)在酶分子表面呈裂缝 状。
(4)酶活性中心的催化位 点和结合位点可以不止一个。
(5)酶活性中心的基团都 是必需基团,但必需基团还 包括活性中心以外的基团。
木瓜蛋白酶活性中心氨基酸残基
❖ 4.诱导契合学说
(1)锁钥学说
1890年,Emil Fischer提出。优点,缺点。
(2)诱导契合学说
1958年,提出。
Vmax 100%
50%
A
[S]90%V [S]10%V =81
B [S]90%V [S]10%V =3
1 2 3 4 5 6 7 8 [S]
A为非调节酶的曲线;B为别构酶的S形曲线
同工酶调节
同工酶:能催化相同的化学反应,但酶的分子 结构与理化性质不完全相同的一组酶。
乳酸脱氢酶:
亚基:心肌型(H);骨 骼肌型(M)
七、影响酶促反应速度的因素
1、底物浓度对酶促反应速度的影响 (1)[S] 与V关系曲线 (2)米氏方程 (3)Km值的意义 (4) Km值的求法
2、PH对酶促反应速度的影响 (1)PH与V关系曲线 (2)最适PH (3)PH影响酶活力的因素:
PH影响酶和底物 的解离状态,只有它 们处于最佳解离状态 时,才容易形成中间 产物,使反应顺利进 行。
生物化学之酶ppt课件

非竞争性抑制剂
与酶活性中心以外的部位结合,改变酶的空间构象,使酶活性降低或 丧失,如磺胺类药物对二氢叶酸合成酶的抑制。
酶抑制剂的应用
医学领域
用于治疗疾病,如酶抑制剂作为抗病毒药 物、抗肿瘤药物和抗菌药物等。
生物工程领域
用于改造和优化生物催化剂的性能,提高 生物催化过程的效率和选择性。
农业领域
用于研发新型农药和除草剂,提高农作物 产量和品质。
来调节细胞内酶的含量。
酶抑制剂的分类与作用
不可逆抑制剂
与酶共价结合,使酶永久失活,如有机磷农药对乙酰胆碱酯酶的抑制 。
可逆抑制剂
与酶非共价结合,可通过物理或化学方法去除抑制剂而恢复酶活性, 包括竞争性抑制剂、非竞争性抑制剂和反竞争性抑制剂。
竞争性抑制剂
与底物竞争酶的活性中心,降低酶对底物的亲和力,如丙二酸对琥珀 酸脱氢酶的抑制。
环境领域
用于治理环境污染,如利用酶抑制剂降解 有毒有害物质。
04
酶在生物体内的代谢
酶与生物氧化
酶催化生物氧化反应
生物氧化是在生物体内进行的氧化反 应,酶作为生物催化剂能够加速这些 反应的进行。
酶与抗氧化系统
生物体内存在抗氧化系统以抵抗氧化 应激,酶如超氧化物歧化酶(SOD) 等在此系统中发挥重要作用。
酶的结构与功能
结构
酶分子通常具有复杂的四级结构,包括一级结构(氨基酸序列)、二级结构( α-螺旋、β-折叠等)、三级结构(整体折叠形态)和四级结构(亚基组成)。
功能
酶通过降低化学反应的活化能来加速反应速率,具有高效性、专一性和可调节 性等特点。此外,酶还能参与信号传导、物质运输和能量转换等生物过程。
酶抑制剂筛选方法
基于活性的筛选
与酶活性中心以外的部位结合,改变酶的空间构象,使酶活性降低或 丧失,如磺胺类药物对二氢叶酸合成酶的抑制。
酶抑制剂的应用
医学领域
用于治疗疾病,如酶抑制剂作为抗病毒药 物、抗肿瘤药物和抗菌药物等。
生物工程领域
用于改造和优化生物催化剂的性能,提高 生物催化过程的效率和选择性。
农业领域
用于研发新型农药和除草剂,提高农作物 产量和品质。
来调节细胞内酶的含量。
酶抑制剂的分类与作用
不可逆抑制剂
与酶共价结合,使酶永久失活,如有机磷农药对乙酰胆碱酯酶的抑制 。
可逆抑制剂
与酶非共价结合,可通过物理或化学方法去除抑制剂而恢复酶活性, 包括竞争性抑制剂、非竞争性抑制剂和反竞争性抑制剂。
竞争性抑制剂
与底物竞争酶的活性中心,降低酶对底物的亲和力,如丙二酸对琥珀 酸脱氢酶的抑制。
环境领域
用于治理环境污染,如利用酶抑制剂降解 有毒有害物质。
04
酶在生物体内的代谢
酶与生物氧化
酶催化生物氧化反应
生物氧化是在生物体内进行的氧化反 应,酶作为生物催化剂能够加速这些 反应的进行。
酶与抗氧化系统
生物体内存在抗氧化系统以抵抗氧化 应激,酶如超氧化物歧化酶(SOD) 等在此系统中发挥重要作用。
酶的结构与功能
结构
酶分子通常具有复杂的四级结构,包括一级结构(氨基酸序列)、二级结构( α-螺旋、β-折叠等)、三级结构(整体折叠形态)和四级结构(亚基组成)。
功能
酶通过降低化学反应的活化能来加速反应速率,具有高效性、专一性和可调节 性等特点。此外,酶还能参与信号传导、物质运输和能量转换等生物过程。
酶抑制剂筛选方法
基于活性的筛选
生物化学之酶化学 教学课件(共103张PPT)
多 种
R=P03+
重 要
二者都是维生素烟酰胺的衍生物,烟酰
胺环上的4位碳具有正碳离子的作用,容
(zhòngyào)
易从底物中夺取电子和质子,所以反应中
脱
传递电子和质子,P89
氢
酶
的
辅
酶
。
可自身合成(héchéng),不缺乏
第二十七页,共一百零三页。
(2) 核黄素(VB2)与辅酶FAD和FMN
化学(huàxué)结构
重要的作用
第三十二页,共一百零三页。
(4) 四氢叶酸(yè suān)
其前体是叶酸VB9(广泛(guǎngfàn)存在于绿叶中,造血维生素)
H2N N N
O
21
87
9
10
N3 4
56 C N
C
N
H2 H
OH
2-氨基(ānjī)-4-羟基-6-亚甲基蝶呤
对氨基苯甲酸
COOH
N CH H
CH2 CH2 COOH
酶催化的反应: 谷氨酸 + 丙酮酸 -酮戊二酸 + 丙氨酸
第六页,共一百零三页。
2. 酶的分类(fēn
lèi)
(1) 水解酶 hydrolase
水解酶催化底物(dǐ wù)的加水分解反应。
主要包括淀粉酶、蛋白酶、核酸酶及脂酶等。
例如,脂肪酶(Lipase)催化的脂的水解反应:
A—B +H2O ←→ AOH + BH
第二十页,共一百零三页。
羧肽酶
Zn 离子
第二十一页,共一百零三页。
3、辅助因子
辅酶(维生素、ATP ,结合松散)
辅基(金属离子,结合紧密)
4、辅酶
酶组织化学刘学光PPT课件

(2)二步显示法(孵育后偶联法) 酶与底物作用产生的PRP沉积于原位,随后行显色反应 适用于:PH反应差别大;底物/辅助物易分解 局 限:要求PRP弥散度低
(3)底物自身显示法 可溶有色底物 → 不溶有色底物 底物分子重组
第16页/共35页
(1) 金属离子沉积法 — 酸性磷酸酶 Gomori反应(1941年)
5. 酶显示方法 (1)同步显示法 (2)二步显示法(孵育后偶联法) (3)底物自身显示法
第13页/共35页
6. 酶特异性对照实验
• 用酶活性抑制剂 • 激活剂 • 采用无底物的孵育液 • 过固定或加热 • 改变孵育液 • 选择PH值 • 细胞内的定位差异
第14页/共35页
对结果分析要考虑的问题
染色前的预固定 — 保持组织良好形态 丙酮:氯仿=1 : 1 4oC,5~10 分钟 多聚甲醛,甲醛,戊二醛
Note: 含有抑制酶活性/细胞化学成分活性的重金属盐Hg/Cr/Pb等 不用做固定剂
固定方法:浸泡固定 灌流固定 细胞涂片、培养细胞: 干燥、密封、低温
第11页/共35页
2.切片制作: 一般8-12μm 3.缓冲液:
第5页/共35页
(二)酶的定位
在细胞内或超微结构中存在于特定部位 浆膜 — 5’-核苷酸酶 细胞膜— ATPase 线粒体 ……
第6页/共35页
酶组织化学的基本原理
1. 酶促反应 细胞内的酶催化分解合适的底物,生成中间产 物,即:初反应物(primary reaction product, PRP)。
第9页/共35页
主要步骤
1.组织处理:不固定(冷冻切片,新鲜) 固 定(特殊固定剂,低温包埋)
2.孵育 3.显色 4.显微镜下观察
各步骤需要注意的问题:
(3)底物自身显示法 可溶有色底物 → 不溶有色底物 底物分子重组
第16页/共35页
(1) 金属离子沉积法 — 酸性磷酸酶 Gomori反应(1941年)
5. 酶显示方法 (1)同步显示法 (2)二步显示法(孵育后偶联法) (3)底物自身显示法
第13页/共35页
6. 酶特异性对照实验
• 用酶活性抑制剂 • 激活剂 • 采用无底物的孵育液 • 过固定或加热 • 改变孵育液 • 选择PH值 • 细胞内的定位差异
第14页/共35页
对结果分析要考虑的问题
染色前的预固定 — 保持组织良好形态 丙酮:氯仿=1 : 1 4oC,5~10 分钟 多聚甲醛,甲醛,戊二醛
Note: 含有抑制酶活性/细胞化学成分活性的重金属盐Hg/Cr/Pb等 不用做固定剂
固定方法:浸泡固定 灌流固定 细胞涂片、培养细胞: 干燥、密封、低温
第11页/共35页
2.切片制作: 一般8-12μm 3.缓冲液:
第5页/共35页
(二)酶的定位
在细胞内或超微结构中存在于特定部位 浆膜 — 5’-核苷酸酶 细胞膜— ATPase 线粒体 ……
第6页/共35页
酶组织化学的基本原理
1. 酶促反应 细胞内的酶催化分解合适的底物,生成中间产 物,即:初反应物(primary reaction product, PRP)。
第9页/共35页
主要步骤
1.组织处理:不固定(冷冻切片,新鲜) 固 定(特殊固定剂,低温包埋)
2.孵育 3.显色 4.显微镜下观察
各步骤需要注意的问题:
酶的组织化学

靛蓝
(蓝色沉淀)
酶组化的应用
• 了解组织、细胞的代谢活动,并显示病变 所在部位以帮助诊断 • 帮助确定细胞类型 • 细胞定位和作为某些细胞分化标志 • 用于肿瘤的研究及帮助诊断 • 用于免疫组化和原位杂交的显示手段
酶
α- 萘酚磷酸钠+水 ――→磷酸氢二钠+ α萘酚
α-萘酚+坚牢蓝――→偶氮染料沉淀
联苯胺色素法
酶 无色联苯胺 脱 氢 有色联苯胺 联苯胺褐
• 用于检测过氧化物酶 eg:DAB法
四唑盐法
• 底物被氧化酶或脱氢酶作用,使底物氧化并释放 出氢,产生的氢离子被传递给受氢体(无色的四 唑盐),受氢体被还原为有色不溶性沉淀物(双 甲 formazane ) • 用于单胺氧化酶和脱氢酶 • 常用的四唑盐
• 第一反应(酶促反应)
– 细胞内的酶催化分解合适的底物,生成中间产 物,即初级反应产物(Primary reaction product, PRP)
• 第二反应(捕捉反应)
– 初级反应产物与辅助物(捕捉剂)经一步或二 步反应,生成有色不溶性的终反应产物(Final reaction product, FRP)
• 作用特点
– 高度催化效率 – 高度专一性(底物特异性)
酶的定位
• • • • 细胞核内:DNA核苷酸转移酶 细胞质内:乳酸脱氢酶 细胞膜内:碱性磷酸酶 细胞器内
– 线粒体:琥珀酸脱氢酶 – 内质网:葡萄糖-6-磷酸酶 – 溶酶体:酸性磷酸酶
酶组织化学基本原理
酶 底物 PRP(无色) 捕捉剂 FRP(有色)
转移酶 Transferases
酶的分类
水解酶 Hydrolases 裂合酶 Lyases
异构酶 Isomerases 合成酶 Ligases
生物化学-第四章酶PPT课件

O H
O
2.转移酶 Transferase
转移酶催化基团转移反应,即将一个底物分子的基团或原子转移 到另一个底物的分子上。 例如, 谷丙转氨酶催化的氨基转移反应。
CH3CHCOOH HOOCCH2CH2CCOOH
NH2
O
CH3CCOOH HOOCCH2CH2CHCOOH
O
NH2
3.水解酶 Hydrolase
2.“张力”和“形变”
底物与酶结合诱导酶的分子构象变化,变化的酶分子又使底物分 子的敏感键产生“张力”甚至“形变” ,从而促使酶-底物中间产 物进入过渡态。
3.酸碱催化
酸-碱催化可分为狭义的酸-碱催化和广义的酸-碱催化。酶参 与的酸-碱催化反应一般都是广义的酸-碱催化方式。
广义酸-碱催化是指通过质子酸提供部分质子,或是通过质子 碱接受部分质子的作用,达到降低反应活化能的过程。
丙酮酸 + CO2 草酰乙酸
三. 酶的命名
1.习惯命名法
(1)根据其催化底物来命名; (2)根据所催化反应的性质来命名; (3)结合上述两个原则来命名; (4)有时在这些命名基础上加上酶的来源或其它特点。
2.国际系统命名法
系统名称包括底物名称、构型、反应性质,2个底物,底物 之间“ :”,水解酶水解2字可省略,最后加一个酶字。 例如:(习惯名称:谷丙转氨酶)
第四节 酶分子结构与其生物活性的关系
一.酶分子结构
根据结构不同酶可分为
单体酶:只有单一的三级结构蛋白质构成。 寡聚酶:由多个(两个以上)具有三级结构的亚基聚合而成。 多酶复合体:由几个功能相关的酶嵌合而成的复合体。
二.活性中心
活性中心:酶分子中直接和底物结合 并起催化反应的空间局限(部位)。
食品化学第八章酶ppt课件

食品化学第八章 酶教学
第八章
8.1 8.2 8.3 8.4 8.5 8.6 8.7 8.8
酶
酶的化学性质和作用特点 酶的命名和分类 酶的作用机制 温度和PH对酶促反应的影响 酶浓度和底物浓度对酶促反应的影响 抑制剂和激活剂对酶促反应的影响 食品加工中的重要的酶 固定化酶
8.1 酶的化学性质和作用特点
这些离子可与酶分子上的氨基酸侧链基团结合, 可能是酶活性部位的组成部分,也可能作为辅酶 或辅基的一个组成部分起作用; 一般情况下,一种激活剂对某种酶是激活剂,而 对另一种酶则起抑制作用; 对于同一种酶,不同激活剂浓度会产生不同的作 用。
8.7 食品加工中的重要的酶 商品食用酶的特点: 纯度要求高 常渗有无机盐、抑菌剂、 稳定剂、食盐、蔗糖、淀粉等。 卫生要求高 必须对人无害。 来源要求高 可食的无毒的动植物材料 和无病理、毒理的微生物。
高效性:反应速度与不加催化剂相比可提高 108~1020,与加普通催化剂相比可提高107~ 1013; 不稳定性:易受各种因素的影响,在活细胞 内受到精密严格的调节控制。 条件温和:常温、常压、中性pH。
8.2 酶的命名和分类
1.习惯命名法 根据以下5个原则决定的: (1)根据酶的催化反应的性质来命名 (2)根据被作用的底物来命名 (3)将酶的作用底物与催化反应的性质结 合起来命名 (4)将酶的来源与作用底物结合起来命名 (5)将酶作用的最后PH和作用底物结合起 来命名
20
0 10 20 30 40 50 60
O
70
80
90
T e m p e ra tu re C
2.pH对酶促反 应的影响
在一定的pH下, 酶 具有最大的催化活 性,通常称此pH为 最适pH。
第八章
8.1 8.2 8.3 8.4 8.5 8.6 8.7 8.8
酶
酶的化学性质和作用特点 酶的命名和分类 酶的作用机制 温度和PH对酶促反应的影响 酶浓度和底物浓度对酶促反应的影响 抑制剂和激活剂对酶促反应的影响 食品加工中的重要的酶 固定化酶
8.1 酶的化学性质和作用特点
这些离子可与酶分子上的氨基酸侧链基团结合, 可能是酶活性部位的组成部分,也可能作为辅酶 或辅基的一个组成部分起作用; 一般情况下,一种激活剂对某种酶是激活剂,而 对另一种酶则起抑制作用; 对于同一种酶,不同激活剂浓度会产生不同的作 用。
8.7 食品加工中的重要的酶 商品食用酶的特点: 纯度要求高 常渗有无机盐、抑菌剂、 稳定剂、食盐、蔗糖、淀粉等。 卫生要求高 必须对人无害。 来源要求高 可食的无毒的动植物材料 和无病理、毒理的微生物。
高效性:反应速度与不加催化剂相比可提高 108~1020,与加普通催化剂相比可提高107~ 1013; 不稳定性:易受各种因素的影响,在活细胞 内受到精密严格的调节控制。 条件温和:常温、常压、中性pH。
8.2 酶的命名和分类
1.习惯命名法 根据以下5个原则决定的: (1)根据酶的催化反应的性质来命名 (2)根据被作用的底物来命名 (3)将酶的作用底物与催化反应的性质结 合起来命名 (4)将酶的来源与作用底物结合起来命名 (5)将酶作用的最后PH和作用底物结合起 来命名
20
0 10 20 30 40 50 60
O
70
80
90
T e m p e ra tu re C
2.pH对酶促反 应的影响
在一定的pH下, 酶 具有最大的催化活 性,通常称此pH为 最适pH。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、光镜酶组织化学证明法 1.金属-金属盐法 金属盐法一般是指金、银、铜、铁、
铝、钴等金属。金属、金属盐及其化合物 都具有颜色,容易发生呈色反应。而且酶 的分解产物和金属多半可以结合。因此, 捕捉酶反应的分解产物,使其与金属结合, 利用其呈色反应,再显现出酶反应的部位, 就可以证明某种酶的存在。
酶作用于底物后生成的分解产物与底 物孵育液中的金属离子相结合,直接沉着 于酶的反应局部,然后使其显色。其反应 式如下:
(2)靛酚蓝法 靛酚蓝法用于检测 氧化酶的方法,把二甲基-对-苯二胺和 α- 萘酚加入底物混合液中,由酶作用 而释放的氧与此二者发生结合,形成把酶底物在载物片上涂 成膜,然后再将含酶的组织切片贴附其上, 给以条件让酶发生反应,使底物分解。接 着剥离贴附的切片,对膜进行特殊染色, 只有底物被分解的部位不着色,而未被分 解的部位被染色,故未着色部位就是酶的 定位。
3.酶活性丧失对照 实验用过长时间固定或恒温60℃处理 60min的方法,使酶活性丧失后进行孵育 反应。 4.阳性对照 事先不知某种组织细胞是否存在某种 酶的活性,可用已知有活性的组织或细胞 做对照,以确定待测组织或细胞内有该酶 活性的存在。
三、电镜酶组织化学证明法 1.氧化还原酶 (1)四唑盐法 四唑盐是水溶性
的,在水溶液中几乎无色,还原后则 难溶于水和脂质,变成有色的高电子 密度的甲 。现在最常用的四唑盐有 NBT和TNBT等。
(2)高铁氰化物还原法 本法是金 属盐法的一种,高铁氰化物作为人工受 氢体而被使用。高铁氰化物接受由酶作 用而游离出来的氢,从而变成亚铁氰化 物,此物质不溶于水,并以电子密度高 的亚铁氰化铜的形式在酶活性部位被捕 捉而沉着。
酶组织化学概论
酶是一种具有催化活性的特殊蛋白 质。人体的各种机能活动都与酶的活性 有密切关系。
国际生物化学酶学委员会已登记的 酶有2200多种。但当前组织化学技术所 能显示的酶仅200多种。
酶组织化学是用组织化学的方法证 明酶的存在,它的基础是组织化学,目 的在于阐明组织细胞内的化学反应、功 能及其生物学意义。
Pb2+
(NH4)2S
R-PO4Na2 + H2O ――→ ROH + PbHPO4↓――→ PbS
酶反应
显色
这种方法在底物溶液中的H+浓度为中 胜或弱酸性,常常可利用易获得的硝酸铅 或醋酸铅。因此,本法常被应用于酸性磷 酸酶和在中性附近起作用的磷酸酯酶类。 通常称本法为硫化铅法。
证明碱性磷酸酶时,通过形成可见的 黑色硫化钴,称为硫化钴法。
琥珀酸 ――――――→延胡索酸
琥珀酸脱氢酶
Fe(CN)63- ――――――→ Fe(CN)64-
高铁氰化物
亚铁氰化物
Cu2+
――――→ Cu2Fe(CN)6·XH2O 亚铁氰化物
(3)二氨基联苯胺法 二氨基联苯 胺法(diaminobenzidine method,DAB) 法主要用在直接证明细胞色素氧化酶、 过氧化物酶(内源性)、过氧化氢酶活 性检测。DAB还用于形成嗜锇性多聚体。
目前,可用这种方法证明的酶有: 碱性磷酸酶、酸性磷酸酶、酯酶、β-葡 苷酸酶、β-半乳糖苷酶、β-葡糖苷酶、 N-乙酰基β-氨基葡糖酶、氨基肽酶、硫 酸酯酶等等。
3.色素形成法 (1)四唑盐法 四唑盐法是指含有 四唑盐或双四唑盐的底物混合液,在脱 氢酶的作用下,从底物分离出来的氢原 子与无色的四唑盐或双四唑盐相结合, 形成红色或蓝色的甲 (formazan)或 二甲 (diformazan)色素。该法主要 证明各种脱氢酶。
一、酶的分类 1.氧化还原酶 是催化氧化还原反应
的酶。包括脱氢酶、氧化酶、过氧化物酶 和加单氧酶。如苹果酸脱氢酶、黄嘌呤氧 化酶、谷胱甘肽过氧化物酶与羟化酶或混 合功能氧化酶。
5.异构酶 催化同分异构体的相互转 化。磷酸葡萄糖异构酶,磷酸丙糖异构酶 等。
6.合成酶(又称连接酶) 系指能将 两种物质合成为一种物质,并必须与ATP 分解相偶联的酶。
基于重氮盐种类不同,其偶氮颜色也 各有差异,可显示出蓝色、紫色、红色、 褐色、黑色、棕色等各种颜色。
根据偶联的时间不同,将偶氮色素法 分为两种。
1)同时偶联法 同时偶联法是在底 物混合液中,通过酶的分解作用所得到的 沉着物,立即形成重氮化合物和偶氮色素。
2)后偶联法 后偶联法是为了防止 重氮盐对酶的抑制作用,先使酶在底物内 发生作用,使分解产物沉着,然后再浸渍 于重氮盐溶液中,使其形成偶氮色素。
Ca2+ R-PO4Na2 + H2O ―――→ ROH + CaHPO4↓
酶反应
Co2+
(NH4)2S
―――→ CoHPO4 ―――→ CoS
金属置换
显色
用这些金属盐法能够证明的酶多半是 水解酶。其中有碱性磷酸酶、酸性磷酸酶、 脲酶、酯酶、硫酸酶、碳酸酐酶、胆碱酯 酶等。此外,根据磷酸酶的理论,利用组 织化学的鉴别法能证明的酶还有磷酰胺酶、 5’-核苷酸酶、ATP酶、葡萄糖-6-磷酸酶 等。
2.水解酶
(1)胆碱酯酶活性检查法
1)乙硫羧酸法根据使用的捕捉金属种类
的不同可有铅-乙硫羟酸法等,在酶的作用下,
游离的硫化氢与铅反应,形成硫化铅沉着于酶
的活性部位。
酯酶
Pb(NO3)2
CH3COSH ――→ CH3COOH + H2S ――→ PbS↓
2)嗜锇性硫酯法 是以嗜锇性硫 酯作为底物,用坚牢蓝BBN做偶联剂的 方法。
四、对照实验 1.抑制剂对照 用酶活性的抑制剂确认酶活性受到抑制。
环化酶
cATP 磷酸二酯酶 腺苷 + Pi
茶碱
ATP 四氧嘧啶 PPi ATP酶 ADP + Pi
特异性底物:5’-腺苷酰-亚氨二磷酸
ATP-PNP
环化酶 cATP + PNP(亚氨二磷酸) ATP酶 无水解作用
2.去底物对照 用去底物的无底物孵育液进行反 应,确认反应的消失或明显减弱。
2.偶联偶氮色素法 偶联偶氮色素法,此法又称偶氮色素 法,是指用人工合成的酶底物,在酶的作 用下,产生分解产物,后者与重氮盐结合, 引起偶联偶氮反应,使其形成不溶性的偶 氮色素,以此证明酶的定位。
在这种方法中,最常用的分解产物是 茶酚系列的化合物,如2-萘酚、1-萘酚、 萘酚AS、萘酚AS衍生物等。但这些化合物 本身也有一定的溶解性,因而其分解产物 有扩散的缺点。
