金属电化学腐蚀热力学
第二章 金属腐蚀电化学理论基础

(Pt (镀铂黑)H2(1atm), H+(aH+=1)) 标准氢电极的电极反应为 (Pt) H2 = 2H+ + 2e 规定标准氢电极的电位为零。以 标准氢电极为参考电极测出的电位值 称为氢标电位,记为E(vs SHE) 。 SHE是最基准的参考电极,但使用 不方便,实验室中常用的参考电极有:
1.宏观腐蚀电池
铜铆钉
1. 异种金属相接触 如 电偶腐蚀。 2. 浓差电池 (1)金属离子浓度不同, 浓度低电位低,容易腐蚀。 (2)氧浓度不同 氧浓度低电位低,更容易腐蚀。 3. 温差电池 如金属所处环境温度不同, 高温电位低,更容易腐蚀。
铝板
粘 土
沙 土
2. 微观腐蚀电池 (1)材料本身的不均匀性
也可以简单地说,绝对电极电位是电子导体和离子导体接 触时的界面电位差。
双电层:
由于金属和溶液的内电位不同,在电极系统的金属相和
溶液相之间存在电位差,因此,两相之间有一个相界区,叫做
双电层。 电极系统中发生电极反应,两相之间有电荷转移,是形成 双电层的一个重要原因。 例如:Zn/Zn2+,Cu/Cu2+ 。
腐蚀原电池产生的电流是由于它的两个电极在电解质中的 电位不同产生的电位差引起的,该电位差是电池反应的推动力。 构成腐蚀原电池的基本要素(*) • • • • 阳极 阴极 电解质溶液(*) 电池反应的推动力-电池两个电极的电位差
电流流动:在金属中靠电子从阳极流向阴极;在溶液中靠离 子迁移;在阳、阴极区界面上分别发生氧化还原反应,实现电子 的传递。 从金属腐蚀历程也可看出化学腐蚀与电化学腐蚀的区别。
盐水滴实验
3%NaCl+铁氰化钾+酚酞
电化学腐蚀的原理PPT课件

当金属与电解质溶液接触后,溶液中的一部分已水化了的金属离子将解脱水 化作用向金属表面沉积,使金属表面带正电。同时由于水化等作用,已沉积 到金属表面上的金属离子亦可重新返回到溶液中去。当上述两种过程达到动 态平衡时,结果就形成了金属表面带正电,紧靠金属表面的液层带负电的双 电层,见1-2(b)。
割的部分。
(1)阳极过程:金属溶解,以离子形式进入溶 液,并把等量电子留在金属上;
(2)电子转移过程:电子通过电路从阳极转移 到阴极;
(3)阴极过程:溶液中的氧化剂接受从阳极流 过来的电子后本身被还原。
由此可见,一个遭受腐蚀的金属的表面上至 少要同时进行两个电极反应,其中一个是金属阳 极溶解的氧化反应,另一个是氧化剂的还原反应 。
E(R/O)E0R nF TLn[[O R]]ba
特殊 E (R 条 /O ) E 件 0 0 .0: 5 L g [O 9 ]a n
注意事项
1、a 、b的值半反应式中相应的系数,一般来说,对 于稀溶液,可以直接用浓度代替活度进行计算
2、若组成氧化还原电极的某物质是固体或纯液体, 则不列入方程式,若为气体,则用分压表示,溶液 中的物质用相对浓度表示
0.7618v,带入能斯特方程得
(Zn2/Zn)(Zn2/Zn)0.05n917Vlg{{cc((氧 还化 原态 态))}}ba
0.7615V
0.05917V 2
lg
c(Zn) c
0.7615V 0.05917V lg 0.001 2
0.81V
例1.3讨论中性溶液中H+/H2的电极电势(298.15K, p(H2)=100.0kPa) pH=-lg[H+]
正电性的金属铂上能吸附氧分子或氢分子
材料腐蚀与防护-金属的电化学腐蚀原理(2)

此时,两电极的稳定电位差0.05+0.83=0.88V,
铜-锌腐蚀原电池示意图
电池刚接通时,毫安表指示的起始瞬间电流 值
电流变化
瞬间电流很快下降,经过一段时间 后,达到一个比较稳定的电流值, I2=0.15mA ???
腐蚀极化图
+E EeC
β
假定任何电流下,阴极阳极的极 化率为常数,称为Evans图(U. R. Evans)。 S所对应的电位Emix,称为混合电 位。由于Emix电位下的金属处于 腐蚀状态,故混合电位就是金属 的自腐蚀电位Ecorr,对应的电流 称为腐蚀电流,用Icorr表示。 I 腐蚀电位是一种不可逆非平 衡电位,需由实验测得,腐蚀 电流表示金属腐蚀的速率,对 于均匀腐蚀和局部腐蚀都适用。
CA
PA E A E A 100% 100% 100% e e PC PA PR EC E A ER EC E A
PR ER ER 100% 100% 100% e e PC PA PR EC E A ER EC E A
S2O62 +2e 2SO42
3.溶液中中性分子的还原反应 吸氧反应 氯的还原反应
如:
O2 +H2O+4e 4OH Cl2 2e 2Cl
4.不溶性化合物的还原反应
如:
Fe(OH)3 +e Fe(OH)2 OH
电路接通
腐蚀电池接通前后电位变化
过电位
电极电位的偏离值称为极化值。 通常引入一新术语--过电位或超电位(取正值)来表征电 极极化的程度。
电化学腐蚀热力学

电极组成电池,所测得相对平衡电位。 标准氢电极电位定义为0。
3.非平衡电极电位
非平衡电极电位— 电极反应达到电荷交换平衡可逆,物质交 换不平衡可逆:
阳极反应 Fe Fe 2+ + 2 e ( ia)
阴极反应 2H+ + 2e H2 ( ic)
质中易腐蚀;
+1.229 < Eϴ M ,贵金属,热力学完全稳定;(但有络合剂氧化物也会腐蚀)
根据 pH=7时,: E H/H+ = -0.414 V, E O2/ OH = +0.815 V pH=0时,: E H/H+ = 0.00 V, E O2/ OH = +1.229 V
分组判断金属材料的腐蚀热力学稳定性
iI > 0
腐蚀不可能发生。
例1:Zn在酸性溶液中: Zn + 2H+ = Zn2+ + H2
0 0 -35184 0 G = iI = -35184 Cal
例2: Ni在酸性溶液中 Ni + 2H+ Ni2+ + H2
0 0 -11530 0 G = -11530 Cal
例3:Au在酸性溶液中: Au + 3H+ Au3+ + 3/2H2
金属在电解质溶液中的腐蚀是电化学过程,这是绝大多数金 属腐蚀过程的本质。
如Fe在HCl中,可观察到铁的腐蚀溶解,并析出氢气:
阳极反应:Fe Fe2+ +2e 阴极反应:2H+ +2e H2
金属腐蚀破坏的短路原电池
腐蚀 第2章 腐蚀热力学
Fe Fe2++2e
i corr
lg i
平衡电位 – 热力学, E0 H2/H+ , E0 Fe/Fe2+ …. 非平衡电位 – 动力学/测量, 腐蚀电位,混合电位或偶合电位
2.2 金属在介质中的腐蚀倾向
2.2.1 腐蚀倾向热力学判断
从热力学可知,判断化学变化的方向和限度,对于不同 的条件,有不同的热力学判据。 对于孤立体系可用熵变判据; 对于等温等容下的体系,可用亥姆霍兹自由能判据; 在等温等压条件下,可用吉布斯自由能判据: 自发过程
+
i — i 组分内电位 i — i 组分外电位 I — i 组分表面电位
i= i + i 电功 i
相
当两相电化学位相等,电化学平衡建立:
Me Men+ + ne 对应电位差为平衡电极电位
Fe Fe 2+ + 2e Fe 2+ + 2e Fe
电荷平衡: ia = ic 物质平衡: M = Mn+
化学热力学- 化学位不同 相间粒子转移,粒子自发地从高化学位相转入低化学 位相,直到两相化学位相等。 iI = 0 在电场作用下,两相电化学位不同 相间粒子转移,带电粒子自发的从高电化 学位相转入低电化学位相,直到两相的电化学位相等。 iI = 0 电化学位与化学位关系: i= I + nFI = 化学功 + 电功
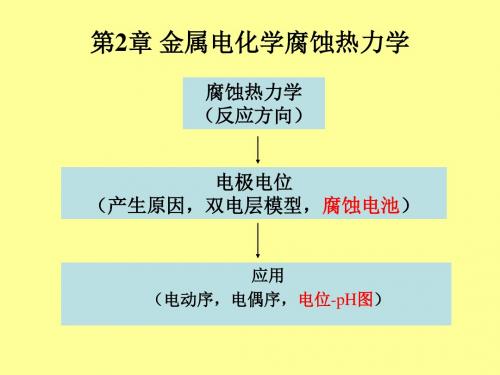
腐蚀热力学 (反应方向) 电极电位 (产生原因,双电层模型,腐蚀电池)
应用 (电动序,电偶序,电位-pH图)
2.1 电极体系和电极电位
2.1.1 双电层
腐蚀总是发生在相间界面,重要概念-电极电位,即电极各 相间电位差之和。双电层普遍存在-相间电位差本质原因
金属腐蚀的热力学和动力学

•
Zn + 2H+ → Zn2+ + H2
μ (kJ/mol) 0 0 -147.40 0
(△G) T,P = - 147.40 kJ <0 (反应自发进行)
•
Fe + 2H+ → Fe2+ + H2
μ (kJ/mol) 0 0 -89.94 0
(△G)T,P = - 89.94 kJ < 0 (反应自发进行) Zn 比Fe反应剧烈
•
Cu + 1/2 O2 + 2H+ → Cu2+ + H2O
μ (kJ/mol) 0 -1.94 0 65.06 -237.19
(△G) T,P = -170.19 kJ < 0 (反应可自发进行) 这就解释了为什么同种金属在不同的腐蚀介质中表现出不同的腐蚀行为。
注意事项
• (ΔG)T,P值的大小只表示金属腐蚀倾向的大小,并不表示腐蚀速度的大小。 也就是说,具有较高负值的(ΔG)T, P也并不一定表示具有较高的腐蚀速度。 因为反应速度问题属于动力学范畴,它还取决于各种因素对反应过程的影响。
μ (kJ/mol):
0 -3.86 -237.19Fra bibliotek- 483.54 ΔG<0
• 3. 与空气接触的碱溶液,pH=14 ,pO2=0.21atm
Fe+1/2O2+ OH- → HFeO2 μ (kJ/mol): 0 -3.86 -158.28 -397.18 ΔG<0
• 例如,在25℃,105 Pa下,把Zn、Fe金属片分别浸入无氧的盐酸水溶液中,其腐蚀反应的自由能 变化为
这就提示我们:可以不计算△G ,根据电位数值大小,也可以判断腐蚀 反应的倾向。
金属腐蚀电化学热力学

金属腐蚀电化学热力学1 介绍金属腐蚀是制约金属材料使用寿命的一个主要因素。
它会导致金属物质的质量和性能损失、破坏金属结构的完整性和功能等问题。
解决金属腐蚀问题,对于约束生产和军事用途等领域的安全和可靠性具有重要意义。
电化学热力学是研究金属腐蚀和防护的基础理论,它提供了热力学和动力学方面的基本概念和方法。
2 金属腐蚀金属腐蚀是一种从金属材料表面开始发生的化学反应。
根据腐蚀介质的种类不同,可以分为很多种腐蚀类型,例如在酸性或碱性环境中发生的化学腐蚀、在高温环境下发生的热腐蚀、在海水中发生的海洋腐蚀等等。
3 电化学热力学基础电化学热力学研究了在电化学反应中发生的能量转化和物质转化,研究对象包括纯物质和混合介质。
电化学反应既包括氧化还原反应,也包括非氧化还原反应。
例如,金属在水溶液中发生腐蚀就是非氧化还原反应,而重金属的还原则属于氧化还原反应。
根据能量守恒的原则,电化学反应必须满足能量自由度平衡和物质计量平衡两个条件,这些条件可以通过电动势(电化学电流)和吉布斯自由能来表达。
吉布斯自由能的变化可以用来描述反应的驱动力和平衡状态。
4 符号约定为了方便处理涉及电化学热力学的问题,约定如下的符号:- E:电势(电位)- G:吉布斯自由能(或被称为“自由焓”)- S:熵(系统的随机程度)- H:焓(能量加上压强的乘积)- T:温度- F:法拉第常数(电子和离子的相互作用参量)- n:反应中电子的数目- Q:电化学电量(电荷量)5 电化学反应驱动力发生在电化学反应中的物质转化和能量转化是由自由能的变化所驱动的。
该变化可通过称为“电电势差”(电势差、电位差或电压)的物理量来测量,其单位为“伏特(V)”。
电电势差可以表示为如下的方程式:E = (G_final - G_initial)/nF其中,G_final表示反应结束时的吉布斯自由能,G_initial则表示反应开始时的自由能,n是电子数,F则是法拉第常数。
该式子描述了反应的驱动力的大小和方向,反应是自发的,当E>0时则有外部电源参与。
第2章1腐蚀的电化学基础电化学腐蚀热力学ppt课件

4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
第二章 腐蚀的电化学基础电化学腐蚀热力学
§2.1 腐蚀原电池
蓝色、阳极
氧化反应; 正极(Anode): 电势高,电子流入,发生
还原反应。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
例2. 原电池 锌锰干电池结构
NH4Cl, ZnCl2和MnO2 浆状物 正极:石墨 (带铜帽) 负极:锌(外壳)
棕色、铁锈
蓝色、阳极 红色、阴极
第二章 腐蚀的电化学基础电化学腐蚀热力学
§2.1 腐蚀原电池
使用的指示剂的浓度应尽可能低,否则会干扰上述的电极过程。
2Fe - 4e → Fe2+ 阴极过程:4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
例如,过多的K3[Fe(CN)6],可能发生Fe(CN)63-的还原,消耗 电子,提供阴极过程,而K3[Fe(CN)6]2的沉淀在阳极区,也可能使氧更 难于进入,加速阳极过程。因此K3[Fe(CN)6]的浓度应尽可能低,最好 只显示兰色而无沉淀。
溶解 氧化反应、阳极
氢气析出 还原反应、阴极
将Zn和Cu放入稀硫酸中并用导线相互连接,
就构成Zn-Cu原电池。于是在Zn电极上发生Zn
的溶解,而在Cu电极上析出氢气,两电极间有
电流流动。在电池作用中发生金属氧化反应的
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cu+ 2H+ →Cu 2++H2
ΔG0 = 64.89kJ
Ag+3/2H2O (液)+3/4O2(气)→Ag(OH)3(固) ΔG0 = +66kJ
第2页/共39页
电化学腐蚀倾向的判断
GT ,P nFE
在忽略液界电位和金属接触电位的情况下,电池的电动 势等于正极的电位减去负极的电位;亦即等于阴极(发生还 原反应)的电位减去阳极(发生氧化反应)的电位:
E
第3页/共39页
金属电化学腐蚀倾向的判断:
_ _ _
金属自发进行腐蚀 平衡状态 金属不会自发腐蚀
注意:浓度变化对电极电位的影响小; 极化对电极电位的影响大,不可忽视; 金属所处的状态对判断的影响。
第4页/共39页
2.2 腐蚀电池
电化学腐蚀的实质,就是浸在电解质溶液中的金属表面 上,形成了以金属阳极溶解,腐蚀剂发生阴极还原的腐蚀 电池。绝大多数情况下,这种腐蚀电池是短路了的原电池。
第32页/共39页
电位-pH图原理
由Nernst方程
2H++2e→H2↑
E E 0 RT ln a还原态 nF a氧化态
0
RT nF
ln
pH2 / po [H ]
由此可以看出电极电位与溶液的浓度和酸度存在一定
平衡状态 非自发ΔG小于零时,热力学上具有发生的可能性,其值越小发生 的倾向越大。
在25℃时,金属镁、铜、金在水溶液中:
Mg+H2O (液)+1/2O2(气) →Mg(OH)2(固) ΔG0 = -596kJ
Cu+ H2O (液)+1/2O2(气) →Cu (OH)2(固) ΔG0 = -120kJ
腐蚀电池:只能导致还原电极电位较负的金属材料破坏 而不对外界作有用功的短路的原电池。(曹楚南)
腐蚀电池的特点: 1. 腐蚀电池的反应所释放出来的化学能都是以热能的形式耗
散掉而不能利用的; 2. 腐蚀电池中相应的电极反应都是以最大程度的不可逆过程
的方式进行的。(直到电位较负的金属腐蚀完为止)
第5页/共39页
2.1 腐蚀倾向的热力学判据
从热力学可知,判断化学变化的方向和限度,对于不 同的条件,有不同的热力学判据。
对于孤立体系可用熵变判据; 对于等温等容下的体系,可用亥姆霍兹自由能判据; 在等温等压条件下,可用吉布斯自由能判据:
(G)T ,P 0 自发过程
(G)T ,P 0 (G)T ,P 0
D ne [D ne]
阴极还原反应中能够吸收电子的氧化性物质D,在腐蚀学中通常 称为去极化剂(Depolarizer)。
第7页/共39页
Cu Zn2+
锌片与铜片连结在硫酸溶液中腐蚀
第8页/共39页
3. 电子的传输过程 需要电子导体将阳极累积的电子传输到阴极,
这类导体包括金属、石墨、过渡元素的碳化物、 氮化物、氧化物和硫化物。 4. 离子的传输过程
G = iI 可判断: Zn在酸中可能腐蚀
Ni在酸中可能腐蚀
Zn 腐蚀倾向性 > Ni腐 蚀倾向性
Au在酸中不会腐蚀。
Au + 3H+ Au3+ + 3/2H2 0 0 103600 0
G = 103600 Cal
第29页/共39页
第30页/共39页
第31页/共39页
这类导体包括水溶液、离解的熔融盐和碱。
阳极过程和阴极过程在不同区域同时进行是电 化学腐蚀的标志性特征。
腐蚀电池工作时包括的上述四个基本过程中的 任何一个被阻断,腐蚀都不能进行。这也是腐蚀 防护的基本思路之一。
第9页/共39页
腐蚀电池的分类
宏观腐蚀电池
异种电极电池 温差电池 浓差电池
微观腐蚀电池
化学成分不均匀 组织结构不均匀 物理状态不均匀 表面膜不均匀
第23页/共39页
第24页/共39页
第25页/共39页
第26页/共39页
第27页/共39页
第28页/共39页
例1:Zn在酸性溶液中: Zn + 2H+ = Zn2+ + H2
0 0 -35184 0 G = iI = -35184 Cal 例2: Ni在酸性溶液中
Ni + 2H+ Ni2+ + H2 0 0 -11530 0 G = -11530 Cal 例3:Au在酸性溶液中:
第10页/共39页
Cu Zn2+
锌片与铜片连结在硫酸溶液中腐蚀
第11页/共39页
浓差腐蚀电池
浓差电池
稀CuSO4
浓CuSO4
第12页/共39页
微观腐蚀电池
金属表面化学成分的不均匀性 金属组织不均匀性 金属物理状态的不均匀第性13页/共39页金属表面膜不完整
第14页/共39页
M.(Metal):金属相
2.4 电位-pH图
电位-pH平衡图:是以电位(相对氢标)为纵坐标, 以pH值为横坐标的电化学相图。将表征体系中组元 的电位与pH关系的方程式绘制其上而得到的图。
电位-pH图是基于化学热力学原理建立起来的一种 电化学的平衡图,它最先用于研究金属腐蚀和防护的 问题,后来在无机分析、湿法冶金和地质等20门学科 领域接受并采用电位- pH图来指导工作。
AgCl
Sol. Sol. M.
第15页/共39页
第16页/共39页
第17页/共39页
第18页/共39页
第19页/共39页
第20页/共39页
Standard Hydrogen Electrode
第21页/共39页
第22页/共39页
E E 0 RT ln a还原态 nF a氧化态
第6页/共39页
电化学腐蚀的历程
电化学腐蚀是一个电化学过程,它包括阴极、阳极、电解 质溶液和连接阴阳极的电子导体四个不可分割的部分。
1. 阳极过程:金属溶解,以离子形式进入溶液,并把当量的电子 留在金属上:
[M n ne] M n ne
2. 阴极过程: 从阳极流过来的电子被阴极表面溶液中能够接受电 子的物质所吸收,发生阴极还原反应:
Sol.(Solution):溶液相
S.(Solid):固体化合物
M. Sol. M.
G.(Gas):气体
2H2O O2(Pt) 4H 4e L.(Liquid):液体
L.
G. M. Sol. M.
M. Sol. S. M.
Ag Ag e
A
g
Sol. M.
Cl
G. M.
