融合标签蛋白亲和纯化填料
His-Tag表达蛋白纯化原理、方法和问题分析

组氨酸标签蛋白的纯化His-Tag融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而且基本不影响蛋白的活性,无论是表达的蛋白是可溶性的或者包涵体都可以用固定金属离子亲和色谱去(IMAC)纯化。
2.1IMAC(ImmobilizedMetal-ionaffinitychromatography)是Porathetal.1975年用固定IDA作为配基的填料螯合过渡金属铜、镍、钴或锌离子,可以吸附纯化表面带组氨酸、色氨酸或半胱氨酸残基的蛋白,1987年Smithetal.发现带有几个组氨酸或色氨酸小肽和螯合金属离子的IDA-sephadexG-25作用力更强,此前在1986年他和他的合作者用Ni2+-IDA-sephadexG-25亲和纯化在氨基端带组氨酸和色氨酸的胰岛素原。
同年1987年Hochulietal.发现带有相连组氨酸的多肽和Ni2+-NTA填料作用力更强于普通的肽,1988年他第一次用这样的方法纯化了带六个组氨酸标签的多肽,无论是在天然还是变性条件下一次亲和纯化都得到很好效果,此后表达带六个组氨酸标签的蛋白配合IMAC变得非常普遍,相对而言,不带标签的蛋白纯化就非常困难,所以表达带六个组氨酸标签的蛋白配合IMAC纯化变成最常用而且最有效的研究蛋白结构和功能的有力手段。
1986年Porathetal.还发现Fe3+-IDA-sephadexG-25可以用于磷酸化蛋白的纯化,而后发现Ga3+-IDA也有同样的效果,这样螯合这两种金属离子的填料就有效用于磷酸化多肽的富集和纯化,同时IMAC也可以用于纯化各种和金属离子结合的多肽,应用非常广泛。
市面常见的商品化IMAC用于带六个组氨酸标签蛋白的配基有以下几种:2.2影响IMAC纯化结果的因素:2.2.1填料的种类:不同填料厂家的填料有差别,所以使用过程最好能得到厂家的技术支持,因为不同的厂家填料不同,此外蛋白纯化个性很强,没有哪一个填料是能适合所有带六个组氨酸标签蛋白的纯化,载量高和特异性好本身就是矛盾。
融合标签蛋白亲和纯化填料

随着基因工程下游的技术的日益发展。基因重组蛋白的分离纯化技术越来越显 示出其重要性,在重组蛋白的纯化过程中,研究人员常常利用各种融合表达的亲 和标签来纯化所表达的蛋白质,这样纯化相对比较容易,即便如此,由于蛋白的 多样性,重组蛋白的的纯化还是比较复杂而专业的工作,尤其对于不熟悉的研究 者来说,它还有可能成为一个瓶颈。
735565094@ order@ (2)技术咨询: immunechem@ 4.通信地址: 广西壮族自治区南宁市高新技术开发区科园大道 68 号东盟慧谷 11 栋 203 室
实验结果:
1) 蛋白浓度:
标准品浓度 (mg/mL)
0 0.625 1.25
OD 值 0
0.05 0.152
稀释后浓度 (mg/mL)
实际浓度 (mg/mL)
总蛋白量(mg)
2.5 5
样品名称 1/10 His 原 液 1/10 His 滤 液 His 洗脱液
0.29 0.61
0.012 0.099667774 0.996677741 9.96677741
His 融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而 且基本不影响蛋白的活性,现在通用的做法是用镍柱亲和纯化,虽然是通用的方 法,但是不可避免的是它也有缺点,使用过镍柱纯化的研究者应该都遇到过蛋白 不溶解,蛋白不挂柱,蛋白难洗脱,电泳杂带多,特异性差等问题,并为此焦头 烂额,荒废不少的时间与精力,所以开发一种新的高效高质量的纯化介质是大家 一直以来的追求。
抗体
HRP
1:2000
洗脱液稀释度
His 洗脱 液
1/3 2.511
1/9 2.593
1/27 2.439
1/81 1.997
FLAG标签融合蛋白纯化试剂盒使用说明书
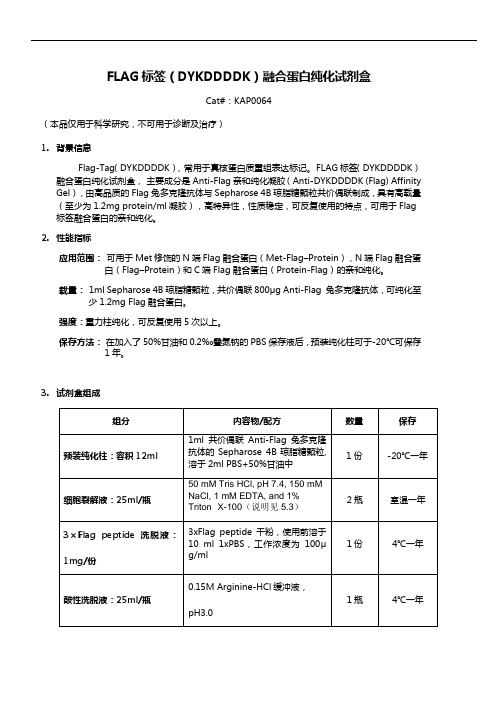
FLAG标签(DYKDDDDK)融合蛋白纯化试剂盒Cat#:KAP0064(本品仅用于科学研究,不可用于诊断及治疗)1.背景信息Flag-Tag(DYKDDDDK),常用于真核蛋白质重组表达标记。
FLAG标签(DYKDDDDK)融合蛋白纯化试剂盒,主要成分是Anti-Flag亲和纯化凝胶(Anti-DYKDDDDK (Flag) Affinity Gel),由高品质的Flag兔多克隆抗体与Sepharose 4B琼脂糖颗粒共价偶联制成,具有高载量(至少为1.2mg protein/ml凝胶),高特异性,性质稳定,可反复使用的特点,可用于Flag 标签融合蛋白的亲和纯化。
2.性能指标应用范围:可用于Met修饰的N端Flag融合蛋白(Met-Flag–Protein),N端Flag融合蛋白(Flag–Protein)和C端Flag融合蛋白(Protein-Flag)的亲和纯化。
载量:1ml Sepharose 4B琼脂糖颗粒,共价偶联800μg Anti-Flag 兔多克隆抗体,可纯化至少1.2mg Flag融合蛋白。
强度:重力柱纯化,可反复使用5次以上。
保存方法:在加入了50%甘油和0.2‰叠氮钠的PBS保存液后,预装纯化柱可于-20℃可保存1年。
3.试剂盒组成50 mM Tris HCl, pH 7.4, 150 mMNaCl, 1 mM EDTA, and 1%Triton X-100(说明见5.3)4.使用方法4.1细胞裂解液制备4.1.1悬浮细胞和半贴壁细胞从细胞培养瓶上吹下来后放入离心管中,1000rpm离心5分钟。
贴壁细胞用细胞刮子轻轻从瓶壁上刮下来,放入离心管中1000rpm离心5分钟。
4.1.2预冷的PBS工作液重悬细胞,1000rpm离心3min,弃上清。
重复一次。
4.1.3根据细胞的量加入相应体积的细胞裂解液,反复吹打后冰上放置10-20min,让细胞充分裂解。
4.1.4用超声破碎仪将细胞裂解液超声,直至细胞裂解液透明,不再粘稠。
融合蛋白标签与纯化

蛋白标签蛋白标签蛋白标签(proteintag)是指利用DNA体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和纯化等。
随着技术的不断发展,研究人员相继开发出了具有各种不同功能的蛋白标签。
目前,这些蛋白标签已在基础研究和商业化产品生产等方面得到了广泛的应用。
美国GeneCopoeia(复能基因)为客户提供50多种蛋白标签,可以满足客户的不同需求,包括各种最新型的标签,如:SNAP-Tag?、Halo Tag?、AviTag?、Sumo等;也提供齐全的各种常用标签,如eGFP、His、Flag等等标签。
以下是部分蛋白标签的特性介绍,更加详细的介绍可在查询克隆产品的结果列表里面看到各种推荐的蛋白标签和载体。
标签纯化促进溶解度抗体效价细胞标记His6 + +/- +/-Flag + +/- +GST + + +MBP + ++ +His-MBP ++ + +HA +eGFP/CFP/YFP +++Myc +His-Myc + +His-AviTag? ++ ++ ++Sumo +++ +His-Sumo ++ ++ +SNAP-Tag? ++ + +++Halo Tag? ++ + +++TrxHISHis6是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
使用His-tag有下面优点:∙标签的分子量小,只有~0.84KD,而GST和蛋白A分别为~26KD和~30KD,一般不影响目标蛋白的功能;∙His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;∙His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;∙His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫并制备抗体。
亲和层析预装柱和填料选择指南

亲和层析预装柱和填料选择指南亲和层析是一种常用的生物分离技术,其基本原理是利用靶分子与具有特殊亲和性的固定相相互作用,实现目标分子的分离纯化。
该技术被广泛应用于蛋白质纯化、分析、制备以及药物研发中。
本文将为您介绍亲和层析预装柱和填料选择的指南。
首先,亲和层析的预装柱种类繁多,如Ni-NTA、GST、MBP、Protein A、Protein G、Protein L等。
选择合适的预装柱主要取决于目标蛋白的性质和亲和配体的选择。
以下是几种常见的亲和层析预装柱及其适用性。
1. Ni-NTA柱:适用于His标记蛋白的纯化。
该柱上的Ni2+离子与His标记相互作用,实现蛋白的选择性吸附。
Ni-NTA柱广泛应用于蛋白质纯化和表达系统中。
2. GST柱:适用于GST标记蛋白的纯化。
GST标记用于表达系统和蛋白质亲和纯化,其独特的亲和性可与谷胱甘肽S转移酶 (glutathione S-transferase,GST)结合。
3. MBP柱:适用于MBP标记蛋白的纯化。
麦芽糖结合蛋白(maltose-binding protein,MBP)可通过特异性辅助蛋白结合一些亲和配体,实现蛋白的纯化和表达。
4. Protein A/G/L柱:适用于免疫球蛋白 (IgG) 的富集。
Protein A/G/L分别与IgG的不同部位结合,用于IgG的富集和纯化,常用于抗体生产和医学诊断。
其次,填料选择也是亲和层析中一项重要的技术选择。
填料是用于填充柱体的固体介质,其性能直接影响到层析分离的效果。
以下是一些常见的填料种类及其特点:1.球形填料:球形填料具有均一的颗粒尺寸和良好的柱层分离性能。
常见的球形填料有琼脂糖凝胶、聚丙烯酰胺凝胶等。
2.凝胶填料:凝胶填料通常用于分离较大分子,如蛋白质、核酸等。
常见的凝胶填料有琼脂糖凝胶、聚丙烯酰胺凝胶等。
3.磁性填料:磁性填料具有较高的分离效率和灵敏度,常用于磁性亲和层析。
磁性填料结合预装柱可以实现高通量的自动化分离和纯化。
融合蛋白标签

在蛋白质功能及结构研究过程中,研究的首要任务就是利用多种方法获得纯化的具有完整结构及生物学功能并能够正确折叠的高度纯化蛋白质。
除了蛋白质的研究,具有特定生物活性的高价值蛋白质的生产也需要对蛋白质产品进行纯化。
因此,科研人员和工业生产往往大量采用多种多样的表达系统来获得高表达的蛋白质,对其纯化后进行研究或加工,这些表达系统包括原核表达系统、酵母菌表达系统、昆虫动物细胞表达系统、真核细胞表达系统等。
如何将系统中表达的目标蛋白质与其他蛋白分离,一直是表达纯化中的一个重点。
为了克服从复杂样品中纯化单一蛋白质这种困难,科学家利用生物物质,特别是酶和抗体等蛋白质,具有识别某种特定物质并与该物质分子特异性结合的能力,利用生物分子间的这种特异性结合能力而形成的亲和纯化技术。
亲和标签纯化技术已广泛应用于蛋白质,特别是重组蛋白的分离纯化中。
在重组蛋白的亲和纯化中,利用基因工程技术,将经过改造优化的亲和标签与目标蛋白融合表达,通过一步简单快速的亲和层析,直接获得纯度较高的重组融合蛋白,已成为重组蛋白纯化的一个通用方法,具有结合特异性高、纯化步骤简便、纯化条件温和、适用性广泛等优点,为蛋白质的有效纯化提供了一条解决的途径,广泛应用于蛋白质结构与功能的研究及重组蛋白纯化工艺的开发中。
自从20世纪70年代中期融合标签技术出现以来,亲和标签已成为一种重组蛋白纯化十分有效的工具,具有结合特异性高、纯化条件温和、纯化步骤简便、适用性广泛等显著优势。
通常,亲和标签定义为对特定的生物或化学配基具有高度亲和力的一段氨基酸序列。
到目前为止,已经出现了种类众多、功能各异、用途多样的亲和标签,极促进了对重组蛋白的有效纯化。
根据自身分子量大小的不同,亲和标签可以分为两大类:一类是结合固定化配基的短肽标签,如His-tag、FLAG-tag、Strep-tagⅡ等;另一类是识别小分子配基的蛋白标签,如GST、MBP等。
短肽标签:His-tag:His标签是目前高通量蛋白纯化最普遍使用的亲和标签,广泛用于多种重组蛋白在各种表达系统的表达与纯化中。
HA标签融合蛋白纯化试剂盒

HA标签(YPYDVPDYA)融合蛋白纯化试剂盒Cat#:KAP0063(本品仅用于科学研究,不可用于诊断及治疗)1.背景信息HA-Tag(YPYDVPDYA),常用于真核蛋白质重组表达标记。
HA标签(YPYDVPDYA)融合蛋白纯化试剂盒,主要成分是Anti-HA亲和纯化凝胶(Anti-YPYDVPDYA (HA) Affinity Gel),由高品质的HA兔多克隆抗体与Sepharose 4B琼脂糖颗粒共价偶联制成,具有高载量(至少为1.2mg protein/ml 凝胶),高特异性,性质稳定,可反复使用的特点,可用于HA标签融合蛋白的亲和纯化。
2.性能指标应用范围:可用于Met修饰的N端HA融合蛋白(Met-HA–Protein),N端HA融合蛋白(HA–Protein),C端HA融合蛋白(Protein-HA)及中部HA融合蛋白的亲和纯化。
载量:1ml Sepharose 4B琼脂糖颗粒,共价偶联800μg Anti-HA 兔多克隆抗体,可结合至少1.2mg HA融合蛋白。
强度:重力柱纯化,可反复使用5次以上。
保存方法:在加入了50%甘油和0.2‰叠氮钠的PBS保存液后,预装纯化柱可于-20℃可保存1年。
3.试剂盒组成-100(说明见5.3)注意事项(开箱前必读)3.1本试剂盒冷藏条件下运输,如果暂时不用,请将纯化柱(空柱)取出,室温保存;亲和凝胶于-20℃保存;试剂盒及其它成分保存于4℃。
3.2HA peptide溶解方法:该多肽为轻质粉末,开盖前应离心。
建议将40ul 10xPBS溶液加至1mg多肽粉末中,彻底溶解后,加入160ul双蒸水,制成5mg/ml储存液,-20℃保存。
使用时用1xPBS稀释至需要的浓度。
按需求浓度稀释至工作浓度。
3.3有文献显示,与传统的Glycine-HCl洗脱液相比,本试剂盒提供的pH3.0的Arginine-HCl做为洗脱液,可以减少蛋白质变性,延长抗体亲和纯化柱的使用寿命。
融合蛋白分离纯化 (2)

融合蛋白分离纯化融合蛋白分离纯化是一种常用的生物技术方法,用于从混合系统中分离和纯化融合蛋白。
融合蛋白是由两个或更多蛋白质序列合并而成的人工重组蛋白,通常用于生物研究和工业生产中。
分离纯化融合蛋白可以帮助研究人员获得高纯度的蛋白样品,以便进行后续的生化实验和功能研究。
融合蛋白的构建和表达融合蛋白的构建通常通过基因工程技术实现。
研究人员将感兴趣的目标基因与表达载体连接,形成融合蛋白的表达构建。
融合蛋白的表达构建可以在细菌、酵母、昆虫细胞或哺乳动物细胞等宿主系统中表达。
在表达宿主中,融合蛋白通过宿主细胞的生物合成机制得以表达。
融合蛋白通常包括一个标签序列和一个目标蛋白的序列。
标签序列通常用于融合蛋白的检测和纯化。
常见的标签序列包括His标签、GST标签等。
分离纯化融合蛋白的步骤步骤一:打破细胞和蛋白提取融合蛋白通常表达在宿主细胞内。
首先需要打破细胞壁,将宿主细胞内的融合蛋白释放出来。
常用的方法是利用超声波破碎仪、球磨仪或冷冻-解冻破碎等物理方法打破细胞。
提取蛋白需要使用合适的缓冲液,用于维持蛋白的稳定性和活性。
缓冲液中通常含有保护蛋白的脯氨酸,以及抑制蛋白降解的蛋白酶抑制剂。
步骤二:蛋白纯化蛋白纯化是将目标蛋白从蛋白混合物中分离出来的过程。
常见的蛋白纯化方法包括亲和层析、离子交换层析、凝胶过滤、透析等。
根据需要选择合适的纯化方法,以实现目标蛋白的纯化和浓缩。
亲和层析亲和层析是一种常用的蛋白纯化方法,通过特定配体与目标蛋白的结合来实现分离纯化。
在融合蛋白中,常常利用标签序列与亲和树脂结合,以实现目标蛋白的富集。
离子交换层析离子交换层析是根据蛋白质的电荷特性进行分离纯化的方法。
通过控制pH和离子浓度,使得目标蛋白与固定在层析介质上的离子交换基团发生相互作用,实现目标蛋白的分离。
凝胶过滤凝胶过滤是利用孔隙大小的差异将蛋白分离的方法。
目标蛋白的分子量与凝胶孔隙的大小相似时,目标蛋白将无法通过凝胶,从而被分离出来。
亲和纯化糖蛋白常用填料

亲和纯化糖蛋白常用填料好啦,今天咱们聊一聊“亲和纯化糖蛋白常用填料”这个话题,虽然听起来像是科研实验室里的难题,但其实它并不难懂,咱们一起轻松愉快地聊聊。
你看,糖蛋白这种东西,其实是咱们人体里非常重要的一类分子,它们参与了很多生物过程,比如免疫反应、信号传递这些,跟咱们的健康息息相关。
所以,如何提纯这些糖蛋白,变得超级重要了。
而要从复杂的生物混合物中把糖蛋白分离出来,亲和纯化就成了一个好帮手。
你可以想象,亲和纯化就像是一个超级有眼力的“猎人”,它能一眼就识别出糖蛋白,然后把它们从“人海”中抓出来。
它有一个特别厉害的地方,就是“专一性”极强,能“锁定”目标蛋白,而不管其他杂七杂八的东西。
好了,说回填料。
其实这就是亲和纯化过程中的“筛子”或“钓饵”。
填料在亲和纯化中起着决定性作用,它们能帮助你将糖蛋白准确地“捕获”住。
你想啊,如果“钓饵”不对,怎么能钓到想要的“大鱼”呢?所以,亲和纯化糖蛋白常用的填料就是一系列能和糖蛋白亲和结合的物质。
常见的填料有很多种,不同的填料有不同的“特点”,就像不同的工具,各有所长。
亲和纯化的填料中最常见的一种,就是用“凝血酶”这种物质做填料了。
你想象一下,凝血酶就像是糖蛋白的好朋友,能够准确地和目标蛋白结合,把它“锁”住不放。
而这个过程中,其他杂质什么的就像是被“甩掉”的,剩下的就是纯净的糖蛋白。
这种填料的好处就是,它能够在非常温和的条件下进行分离和纯化,不会损伤糖蛋白本身。
你想,谁不想在不伤害“珍宝”的情况下,得到它呢?这种方法既能保护糖蛋白,又能提高产率,简直是科研人员的心头好。
有些填料是专门针对糖分子设计的。
这种就像是糖蛋白的“糖尿病治疗师”,专门去吸附那些含糖的蛋白。
通过设计一些糖基配体,它们能够巧妙地捕捉到糖蛋白,进行分离。
你能想象吗,就像是找到了糖蛋白的“专属收信人”,给它送去了“情书”。
这种填料不仅效率高,而且相对简单,不需要过多复杂的操作,适合大规模的应用。
His标签融合蛋白纯化步骤

His标签融合蛋白纯化步骤(ni-nta琼脂糖凝胶亲和层析纯化法)1.缓冲液配制◆lysisbuffer1(undernativecondition)0.5mmtris.hcl0.5mnacl5%(w/v)glycerol10mmimidazol100mg(1mg/ml)lysozyme(purificationof6xhis-taggedproteinsfrome.coli)1%nonidetp40(np40=igepalca-630)0.25%tween20(ortriton100)0.02%nan3(optional)200µg(2µg/ml)rnasea(optional)1mg(10µg/ml)dnase1(optional)50mmnaf(optional)1mmn a3vo4(optional)+ddh2oto100ml,adjustphto8.0usingnaoh此lysisbuffer适用于于从e.coli、哺乳动物细胞和昆虫细胞中提纯拎his标签的蛋白质。
仅在用作水解e.coli细菌时,重新加入溶菌酶。
na3vo4是磷酸酶抑制剂,保护磷酸化的蛋白不被磷酸酶还原。
naf是酯酶抑制剂,保护脂蛋白不被酯酶降解。
特别注意:当采用镍琼脂糖凝胶提纯拎his标签的蛋白时,缓冲液中无法提edta,因edta能够并使镍从螯合物上瓦解,从而并使拆分介质丧失效果。
◆lysisbuffer2(underdenaturecondition)50mmtris-cl8murea(or6mgu-hcl)10mmimidazole0.05%tween20adjustphto8.0usingnaoh◆dialysis/tevcleavagebuffer50mmtris-cl,ph8.0100mmnacl(dependsonsolubilityofprotein)2.5%glycerol0.5mmedta0.5mmdttortcep◆缓冲液a:50mmtris.hcl0.5mnacl5%glycerol0.05%tween20用高浓度hcl调节ph值至8.0。
亲合层析原理及标签蛋白纯化

特异性
支链甘露糖, 终端甘露糖或葡萄糖 通过α(1,6) 糖苷键连接与海澡糖上 的N-乙酰基-葡萄糖胺的支链甘露糖
亲和层析柱和平衡
重点 • 柱体积:
– 依据目标物的数量和填料的载量确定,Hitrap 1ml and 5ml.
样品准备
重点 • 过滤或离心以去除颗粒性物质 • 用脱盐柱校正样品的pH、盐浓度和添加剂来 提高结合的效率 • 确保已知的能影响结合的物质不存在
• 柱高:
– 无严格要求,一般是短而粗
• 平衡:
– 无严格要求, 对于 HiTrap™柱可以用注射器平衡
上样
重点 • 按照标准程序作 • 上样前充分平衡柱子 • 结合缓冲液一般采用中性 pH • 确保平衡:
– 亲和作用较强或比较容易平衡: 高流速 – 亲和作用较弱或比较难平衡: 慢流速
Troubleshooting
为什么选择亲和层析?
offers high selectivity, hence high resolution, and usually high capacity for the protein(s) of interest • 亲和层析能够完成一般方法很难完成的分离
– 如变性和非变性的,功能不同的蛋白
任何规模纯化都比较简单-Ni Sepharose
预装柱/填料 一次可纯化组氨酸融合蛋 白的量 注意
•筛选参数更方便和可再生的优化;预 装柱,上未澄清样品;用机械手自动操 作或使用离心机/抽真空等手动方式操 作 简化流程:预装柱,上未澄清样品, 离心 预装柱,重力,上未澄清样品 可直接上未澄清的样品,同HisTrap 预装柱,可用注射器、蠕动泵,层析 系统,样品必须澄清 适合大规模样品纯化,简化流程:无 需装柱可用蠕动泵,层析系统操作 •不同包装的凝胶,需要自行装填,客 户需自备空柱 •可用蠕动泵,层析系统(如ÄKTA) 或者批量操作
蛋白纯化试剂的原理及蛋白纯化实验问题分析

蛋白纯化试剂的原理及蛋白纯化实验问题分析蛋白纯化试剂盒主要是利用蛋白与亲和介质的亲和能力不同达到蛋白分离纯化的目的。
蛋白纯化试剂常见的蛋白标签有GST标签、HIS 标签等,本文主要介绍了蛋白纯化试剂盒的原理、His Tag 蛋白纯化方法试剂选择的方法、GST 标签融合蛋白纯化问题分析等。
蛋白抽提试剂盒和蛋白纯化试剂盒用途有什么不同?蛋白抽提试剂盒是从细菌、真菌、新鲜动植物组织或细胞蛋白、培养动植物组织将全细胞蛋白、核蛋白、胞浆蛋白、带化学修饰基团的天然蛋白(例如磷酸化蛋白)中的一种或两种以上作为目标从样品中分离收集的一套试剂。
用于液体样品中蛋白浓缩、提取、或脱盐、脱去垢剂、脱还原剂等目的。
蛋白纯化试剂盒用于将连接有Flag标签GST HIS 标签的重组蛋白、包涵体蛋白、抗体从重组蛋白表达系统中高效浓缩分离出来。
主要原理是利用蛋白A或蛋白G与抗体的不变区有多个结合位点或Ni- Sepharose与HIS标签蛋白在不同缓冲液条件下亲和能力多得多差异分离目标蛋白。
将蛋白A与Sepharose共价交联制备的层析介质,可以用于纯化抗体。
抗体与蛋白A或蛋白G在高盐高pH值条件下结合,在低盐低pH值条件下解离。
蛋白纯化试剂盒广泛的应用于蛋白表达、纯化、鉴定、功能研究及其蛋白相互作用等相关领域。
GST常见问题解答集锦纯化方法的问题解决以下解决问题的指南指出了对于大多数纯化方法的普遍问题,对于特别的纯化方法的问题也有提及,这种情况下会指出相应的纯化方法.问题可能原因解决方法G S T 标签蛋白GST标签蛋白被机械裂解的方法在裂解过程中,用温和的机械/化学裂解条件.裂解的条件不结合柱子或变性(比如超声).过分的裂解必须依照经验来决定. 结合非常弱会使标签蛋白变性,阻止其结合. GST标签蛋白在样品中有聚集, 在细胞裂解前加入DTT,在缓冲液中也加入DTT.1-20mM 导致沉淀标签蛋白的浓度过低的DTT会显著增加某些GST蛋白的结合. 浓缩样品.结合能力是浓度依赖的.低表达量的蛋白可能不会像高表达量蛋白那样有效地结合柱子.因此,浓缩样品会提高结合. 标签蛋白可能改变了G S T 的构检测所使用的pGEX载体中GST的结合.准备带有所使用的象,因此降低了GST标签蛋白的pGEX的细胞超声裂解物,检测其与柱材的结合.如果结合结合能力. 的很好,则可能是标签蛋白改变了GST的构象,因此降低了GST标签蛋白的亲和力.可以通过降低结合的温度到4°C限制洗涤来改善结果. 平衡时间太短确认柱材至少用5倍柱体积的pH6.5到8.0的缓冲液平衡过(比如PBS). GST标签蛋白在pH值低于6.5和高在净化好的样品上样前用pH6.5到8.0的缓冲液平衡过(比如于8时结合效率低GSTrap柱:柱子需要清洗PBS). 根据标准的清洗步骤清洗柱子(见附录2).如果GSTrap柱已经用过几次了,可能需要换用新柱. Glutathione Sepharose柱材使用使用新的Glutathione Sepharose柱材(清洗过程请见附录次数过多样品上样过程中的流速过高2) 降低在上样时的流速.影响GST标签蛋白结合的一个重要参数就是流速.由于GST与谷胱甘肽相对慢的结合,在样品上样过程中保持低流速以获得最大结合能力很重要. 在KTAprime plus上的GSTrap 柱子堵住了:根据说明书清洁柱子,确认样品已经离心或柱:柱子或系统被堵住了,导致用0.45m的滤膜过滤过了. 高压力和无结合. 系统堵住了:将柱子换成一段管子.如果压力高于0.3MPa,根据手册清洗系统在KTAprime plus上的GSTrap 检测是否使用了正确的柱子. 柱:样品不结合检测流入管是否接入了正确的流入端口. 检测缓冲液的组成和pH值是否正确.检测样品是否已经被调节到适合结合缓冲液的条件.1G S T 标签蛋白洗脱缓冲液的体积不够不能被高效的洗脱洗脱的时间不够增加洗脱缓冲液的体积.有些情况下,尤其是柱上酶切有标签蛋白时,需要更大体积的缓冲液来洗脱标签蛋白. 通过降低洗脱过程中的流速来增加洗脱时间. 对于GSTrap柱,为了获得最好的结果,在样品上样时,用0.2到1ml/min的流速(1ml HiTrap柱),0.5到5ml/min的流速(5ml HiTrap柱).对于离心方法,降低洗脱过程中的离心速度.谷胱甘肽的浓度不够增加洗脱缓冲液中谷胱甘肽的浓度:本方案中建议的10mM 浓度对于大多数应用来说足够了,但是也存在例外.尝试使用50mM Tris-HCl,20-40mM 还原型谷胱甘肽,pH8.0作为洗脱缓冲液.洗脱缓冲液的pH过低增加洗脱缓冲液的pH值:将pH增加到8-9会增强洗脱而不用提高洗脱所用谷胱甘肽的浓度.洗脱缓冲液的离子强度过低.增加洗脱缓冲液中的离子强度,在洗脱缓冲液中加入0.10.2M的氯化钠也会使结果变好.洗脱缓冲也中的谷胱甘肽被氧化使用新鲜的洗脱缓冲液. 了加入DTT.非特异的疏水相互作用导致蛋白向洗脱缓冲液中加入非离子去垢剂.加入1%的TritonX-100 和柱材非特异的结合或聚集,从或2%的n-octylglucoside可以显著提高某些GST标签蛋白的而阻止了标签蛋白的溶解和洗洗脱. 脱. 电泳或蛋白质分子量为70 000 的蛋白与GST标分子量为70 000 的蛋白可能是大肠杆菌dnaK基因的产物. 免疫印迹检测签蛋白共纯化发现多条条带该蛋白参与大肠杆菌中蛋白质折叠.有报道这种相互作用可以通过上样前在50mM Tris-HCl,2mM ATP,10mM MgSO4,pH7.4中37°C温浴10分钟而破坏.或者把有标签蛋白通过A TP-agarose或相似的纯化介质或进行离子交换层析来除去. 标签蛋白被蛋白酶部分降解加入蛋白酶抑制剂.多条条带可能是由于目的蛋白被蛋白酶部分降解的结果.在裂解溶液中加入1mM PMSF可能会使结果变好.一种无毒的水溶性的PMSF替代物是AEBSF, Roche Biochemicals的商品名为Pefabloc SC.注:丝氨酸蛋白酶抑制剂必须在使用凝血酶或凝血因子Xa前除去. Prescission Protease不是一种经典的丝氨酸蛋白酶.经GE Healthcare检测,它对很多蛋白酶抑制剂不敏感. PMSF有毒,有急性作用.如果可能的话使用Pefabloc SC.2在宿主细菌中的蛋白降解用一种蛋白酶缺失型宿主:多条带可能是在宿主细菌中蛋白酶切造成的.如果是这种情况,或许需要蛋白酶缺陷型菌株(比如lon-或ompT).大肠杆菌BL21随pGEX载体提供. 这种菌株是ompT和lon缺陷型菌株.在机械裂解过程中细胞破碎降低裂解时间:细胞裂解表面上是使悬浊液部分澄清,可以通过镜检检测.机械裂解前加入溶菌酶(0.1倍体积的10 毫克/毫升溶菌酶溶液,溶菌酶保存在25mM Tris-HCl,pH8.0 )可能会使结果变好.避免发泡,因为这可能使标签蛋白变性.过分裂解也会导致宿主细胞蛋白和GST标签蛋白共纯化.分子伴侣可能被共纯化了包括额外的纯化步骤:多余的条带可能由于共纯化一些分子伴侣所造成.这些分子伴侣参与大肠杆菌中新生成的蛋白的正确折叠.这些包括,但不仅仅是:DnaK(分子量70 000)DnaJ(分子量37 000)GrpE(分子量40 000)GroEL (分子量57 000)GroES(分子量10 000).一些从这些共纯化的蛋白中分离GST标签蛋白的方法已经发表.抗体和很多种大肠杆菌中的蛋白抗体和大肠杆菌蛋白交叉反应:取决于抗GST抗体的来源. 反应它可能包含一些抗体,这些抗体与标签蛋白样品中的大肠杆菌蛋白能够反应.通过和大肠杆菌的超声裂解物反应来除掉那些能够交叉反应的抗体.GE Healthcare的GST抗体已经和大肠杆菌蛋白进行过交叉吸附,并检测证明其在蛋白质免疫印迹中没有非特异条带. 目的蛋白酶切蛋白酶切发生在宿主细菌内后电泳检测发现多条条带检测条带何时出现:确定多余的条带在Precission Protease,凝血酶,凝血因子Xa切割前不存在.这些条带可能是在宿主细菌中降解的结果. 目的蛋白可能含有Precission Protease,凝血酶,凝血因子Xa 的切割位点,检查序列.细节请参见《GST基因融合系统手册》.His Tag 蛋白纯化方法之选择全攻略HisTag 蛋白纯化篇:用基因工程的方法来表达蛋白质,必须经过纯化才能实现最终目的。
优质原创总结 NusA标签 MBP标签 融合标签蛋白纯化原理及优缺点

融合MBP蛋白的纯化(双标签:MBP-His6)
更多蛋白表达/蛋白纯化相关原理/实验流程及FAQ请访问: /topics/dan-bai-biao-da.html 我们会不断的更新补充最全面、专业的蛋白表达相关知识, 欢迎收藏!
谢谢大家
融合NusA 和 MBP蛋白纯化
融合NusA和MBP蛋白纯化
定义
A
B
原理
方法
C
D
问题
NusA
NusA(antitermination protein
残基数:495
分子量: 54.87KDa
不具有独立的纯化标签功能,所以要与其它标签如His标签联用
关于NusA
NusA的 氨基酸序列
NusA的运用的优点和缺点
NusA标签的去除
NusA标签的去除 (TEV)
双标签融合蛋白NusA与His 6的纯化(试剂)
双标签融合蛋白NusA与His 6的纯化(流程)
双标签融合蛋白NusA与His 的纯化(分析)
6
MBP
麦芽糖结合蛋白(maltose binding protein. MBP)
关于MBP
关于MBP
MBP标签运用的优缺点
融合MBP蛋白的纯化(流程)
融合MBP蛋白的纯化(试剂)
融合MBP蛋白的纯化(MBP-RACK1蛋白多步纯化-亲和)
融合MBP蛋白的纯化(MBP-RACK1蛋白多步纯化-离子)
融合MBP蛋白的纯化(MBP-RACK1蛋白多步纯化-分子筛)
融合MBP蛋白的纯化(双标签:MBP-His6)
HisTag 融合蛋白纯化(IDA)

His·Tag 融合蛋白纯化操作手册
采用 pET 系统进行原核蛋白表达,蛋白的表达量达到 20mg/100ml 培养物并不是困难的事。 在大肠杆菌中表达的目的蛋白,其可溶性(可溶蛋白或包涵体)、细胞定位(细胞质、细胞周 质、培养基上清),都会对后续的纯化策略造成影响。我们建议研究者在蛋白表达后,首先进 行目的蛋白的细胞定位(请参考 pET 系统操作手册);在进行大量纯化之前,小量纯化蛋 白,摸索确定适合于具体蛋白的纯化条件,也是值得推荐的好方法。外源蛋白在大肠杆菌中表 达,可能以可溶形式存在,也可能以包涵体形式存在。尤其在高水平表达的条件下,更容易形 成包涵体。包涵体的形成与外源蛋白本身性质、载体、宿主菌、以及表达水平都有关系,可以 通过选择不同表达载体和 E.coli 宿主菌组合,摸索生长条件和适宜诱导条件,达到优化蛋白表 达的目的。His·Tag®融合蛋白,可以在天然条件或变性条件下用 NTA His·Bind 树脂或 IDA His·Bind 树脂进行纯化。
2. 其它常见 IDA 树脂产品形式的纯化
3. 洗脱之后的样品处理
附录:补充背景知识
• • • • • • •
NTA 和 IDA 化学基团 His·Bind 基质选择指南 在确定裂解方法前的考虑 蛋白可溶性及细胞定位 天然或变性条件下目的蛋白的纯化 批次小量纯化或柱层析纯化方法 目的蛋白的结合
• • • • • • •
(在 1ml 溶液中裂解后)
40% 8% 1.6% 0.4% 0.8% >1% <1%
3ml 10ml 25ml 50ml 100ml 50ml 100ml
3× 10× 25× 50× 100× 50× 100×
与其它亲和纯化介质一样,His·Bind 树脂在接近其结合载量时使用,可以获得最好蛋白分离效果。所以在蛋白纯化前估计细菌 抽提物中目的蛋白的含量,有利于确定上样量、选择合适体积的亲和树脂或预装柱。SDS-PAGE,Western blot,S·TagTM Rapid Assay,FRETWorksTM S·Tag Assay 等方法都可用于确定抽提物中目的蛋白的含量。
实验八 亲和纯化GST融合蛋白

实验八单柱亲和纯化GST融合蛋白Single Column Purification of GST Fusion ProteinsN末端或C末端GST融合蛋白纯化方法运用谷胱甘肽琼脂糖凝胶(0.5-2 ml) 谷胱甘肽树脂预装柱(0.5-1 ml) 进行GST融合蛋白纯化的方法,适用于25-100 ml的诱导培养菌(纯化2.5-10 mg GST融合蛋白)1. 细菌培养:直接挑取表达质粒新转化的单菌落, 加入25-100 ml LB+Amp液体培养基中(含氨苄100 μg/ml),37℃振荡培养至OD600nm达0.5。
2. 诱导蛋白表达:加入终浓度为0.3 mM 的IPTG,30-37℃振荡培养3 h,诱导蛋白表达。
设立阴性对照。
取样10-20 μl进行SDS-PAGE电泳, 取样1-2 μl进行Western blot鉴定。
表达的时间和温度根据表达量, 可溶性和稳定性进行调整, 对于37℃不稳定或不溶的蛋白, 0.1 mM 的IPTG 20-25℃诱导培养6-20 h; 10-16℃振荡培养12-24 h.3.细胞收集:5000×g离心10分钟(4℃), 弃上清。
-20/-80℃贮存。
细胞冻融利于破碎。
4.破碎细胞:用5-10 ml的裂解缓冲液(10 mM Tris-HCl, pH8.0, 0.1 NaCl) 将菌体重悬,超声破碎细胞(冰浴),使融合蛋白释放。
15000-19000×g离心30分钟,上清即为可溶性蛋白的细胞粗提物。
上样5 μl进行SDS-PAGE电泳鉴定(Western:: 1∶10稀释, 上样5 μl)。
5.谷胱甘肽树脂预装柱的平衡: 20 ml的缓冲液4℃进行柱平衡。
每毫升谷胱甘肽树脂大约能够结合5-10 mg GST融合蛋白。
6.结合融合蛋白:用柱帽堵上,将澄清的细胞粗提物加入谷胱甘肽树脂预装柱(0.5 ml, # ;1 ml, # ),4℃放置15-30 min。
融合标签技术在蛋白质研究中的应用

融合标签技术在蛋白质研究中的应用摘要近年来,越来越多的科学家开始运用一种被称为融合标签的技术来研究蛋白质。
融合标签技术的快速发展给蛋白的快速纯化带来了福音。
本文主要介绍一些常用融合标签的原理、优缺点以及它们在蛋白质研究中的应用,并讨论了融合标签对蛋白研究产生的深远影响。
关键词蛋白质融合标签蛋白纯化前言蛋白质相互作用存在于每个细胞的新陈代谢过程中。
围绕着中心法则,我们可以发现,DNA复制、转录、逆转录、翻译等少不了蛋白质的参与,而且在细胞的信号转导,细胞死亡和凋亡等生命活动中,蛋白质的相互作用也都发挥了核心作用。
对蛋白质的研究,催生了结构生物学的蓬勃发展,而且,蛋白质相互作用的研究也成为了蛋白质研究不可或缺的一部分[1]。
利用蛋白质表达技术,快速、简便地进行有关活性代谢产物的高效表达而研究蛋白质生物学功能和理化性质成为一种很好的研究方法。
其中融合蛋白表达技术由于容易实现高效表达、纯化,兼有步骤简便、产物多以活性形式存在等优点,在蛋白质研究中得到了广泛的应用[2]。
蛋白融合即在蛋白序列上加上蛋白标签。
蛋白标签是指利用DNA重组技术与目的蛋白一起融合表达的一种多肽或蛋白质,以便于目的蛋白的表达、检测以及纯化[3]。
该技术的原理是通过基因操作技术,将目的基因片段与某些特定的蛋白标签串联,插入适当的载体中进行表达。
这些特定的基因因为带有标签,能够与特殊的介质进行亲和层析,使特定的蛋白能够纯化出来。
得到的融合蛋白还可以通过使用化学物质或者酶类的特定反应切除标签,从而得到纯化的目的蛋白,用于结晶或者特定功能研究。
常用的融合蛋白主要包括多聚组氨酸标记、硫氧还原蛋白、谷胱甘肽S-硫转移酶(GST)、融合了八个氨基酸的亲水性多肽、麦芽糖结合蛋白等。
根据其分子量大小,可将之分为两类:小的多肽标签,包括FLAG、His6(六聚组氨酸)、c-myc(人c-myc蛋白表位)、HA(流感病毒血凝素表面抗原决定簇)等;大的蛋白标签,包括SPA(葡萄球菌蛋白A)、GST(谷胱甘肽巯基转移酶)和GFP (绿色荧光蛋白)等。
优质原创总结 NusA标签 MBP标签 融合标签蛋白纯化原理及优缺点

融合NusA 和 MBP蛋白纯化
融合NusA和MBP蛋白纯化定义AB原理方法C
D
问题
NusA
NusA(转录终止/抗终止蛋白)Transcription termination/antitermination protein
残基数:495
分子量: 54.87KDa
不具有独立的纯化标签功能,所以要与其它标签如His标签联用
融合MBP蛋白的纯化(双标签:MBP-His6)
更多蛋白表达/蛋白纯化相关原理/实验流程及FAQ请访问: /topics/dan-bai-biao-da.html 我们会不断的更新补充最全面、专业的蛋白表达相关知识, 欢迎收藏!
谢谢大家
关于NusA
NusA的 氨基酸序列
NusA的运用的优点和缺点
NusA标签的去除
NusA标签的去除 (TEV)
双标签融合蛋白NusA与His 6的纯化(试剂)
双标签融合蛋白NusA与His 6的纯化(流程)
双标签融合蛋白NusA与His 的纯化(分析)
6
MBP
麦芽糖结合蛋白(maltose binding protein. MBP)
关于MBP
关于MBP
MBP标签运用的优缺点
融合MBP蛋白的纯化(流程)
融合MBP蛋白的纯化(试剂)
蛋白的亲和纯化

Bio-Rad Mini Profinity IMAC Cartridges 5x 1 ml 1x 5 ml 5x 5 ml
Ni-MAC Cartridges 2x 1 ml 5x 1 ml Kit with 5x 1ml and IMAC buffers
wet ice 4 Outlet: 10-32 male to 1032 male Outlet: M6 male to M6 male > 1 year exp on box and cart 2-3 several IDA
5 x 1 ml columns
Novagen Ni-MAC
5 x 1 ml cartridges
5 ml cartridges/ columns
(Sigma 6.4 ml)
Qiagen Ni-NTA Superflow
5 x 1 ml cartridges
20 / GE /
3.3 竞争
填料和重力柱的竞争
19 / GE /
3.3 竞争
HisTrap competitors
Sigma HIS-Select High Flow
5 x 1.25 ml cartridges
Bio-Rad Bio-Scale Mini Profinity IMAC
5 x 1 ml cartridges
GE HisTrap HP , FF and FF crude
no
no
Shelf life / Expiery date
> 2.5 years exp date on box
CoA 0.5 years from shippment no exp date 3 3 (10 if stripped /recharged every third) IDA crosslinked polymethacrylate yes 30 4 20 50 300 10 10 (10 CV) + 20 (6CV) 250
FLAG标签融合蛋白纯化试剂盒使用说明书

FLAG标签融合蛋白纯化试剂盒使用说明书FLAG标签(DYKDDDDK)融合蛋白纯化试剂盒Cat#:KAP0064(本品仅用于科学研究,不可用于诊断及治疗)1.背景信息Flag-Tag(DYKDDDDK),常用于真核蛋白质重组表达标记。
FLAG标签(DYKDDDDK)融合蛋白纯化试剂盒,主要成分是Anti-Flag亲和纯化凝胶(Anti-DYKDDDDK (Flag) Affinity Gel),由高品质的Flag兔多克隆抗体与Sepharose 4B琼脂糖颗粒共价偶联制成,具有高载量(至少为1.2mg protein/ml凝胶),高特异性,性质稳定,可反复使用的特点,可用于Flag 标签融合蛋白的亲和纯化。
2.性能指标应用范围:可用于Met修饰的N端Flag融合蛋白(Met-Flag–Protein),N端Flag融合蛋白(Flag–Protein)和C端Flag融合蛋白(Protein-Flag)的亲和纯化。
载量:1ml Sepharose 4B琼脂糖颗粒,共价偶联800μg Anti-Flag 兔多克隆抗体,可纯化至少1.2mg Flag融合蛋白。
强度:重力柱纯化,可反复使用5次以上。
保存方法:在加入了50%甘油和0.2‰叠氮钠的PBS保存液后,预装纯化柱可于-20℃可保存1年。
3.试剂盒组成50 mM Tris HCl, pH 7.4, 150 mMNaCl, 1 mM EDTA, and 1%Triton X-100(说明见5.3)4.使用方法4.1细胞裂解液制备4.1.1悬浮细胞和半贴壁细胞从细胞培养瓶上吹下来后放入离心管中,1000rpm离心5分钟。
贴壁细胞用细胞刮子轻轻从瓶壁上刮下来,放入离心管中1000rpm离心5分钟。
4.1.2预冷的PBS工作液重悬细胞,1000rpm离心3min,弃上清。
重复一次。
4.1.3根据细胞的量加入相应体积的细胞裂解液,反复吹打后冰上放置10-20min,让细胞充分裂解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吸附能力: >2 mg/Ml 应用范围: IP
本产品将亲和纯化的抗 His 标签抗体通过共价键定向偶联到琼脂糖珠,利用抗 原抗体高度专一特异性结合力,快速的从样品液中俘获 His 标签蛋白,然后使用 平衡缓冲液将不结合的杂志清洗掉,再用洗脱液洗脱结合在填料上的 His 标签蛋 白,洗脱结束后,用平衡缓冲液平衡亲和柱即可重复使用。
使用本品可以高效快速的分离,纯化,浓缩含 His 标签的蛋白和残基,纯化的 蛋白浓度高,特异性好,纯化过程简便易操作,一步纯化,节省试验时间、、、
实验步骤: 1. Anti-His Agarose 装柱 100uL,0.05M Hcl 洗柱子,PBSt 洗至中性; 2. Tag 重组细菌裂解液离心取上清,用蒸馏水稀释 5 倍,过 His Agarose; 3. PBSt 洗柱子 3mL,蒸馏水洗柱子 3mL,300uL 0.05M Hcl PBSt 溶液洗脱,收集 300uL 洗脱液,10uL 饱和碳酸钠中和,洗脱液测 ELISA; 4. 取原液、滤液及洗脱液加入 5*loading buffer,煮沸 5 分钟,离心上样电泳。
实验结果:
1) 蛋白浓度:
标准品浓度 (mg/mL)
0 0.625 1.25
OD 值 0
0.05 0.152
稀释后浓度 (mg/mL)
实际浓度 (mg/mL)
总蛋白量(mg)
2.5 5
样品名称 1/10 His 原 液 1/10 His 滤 液 His 洗脱液
0.29 0.61
0.012 0.099667774 0.996677741 9.96677741
加拿大 Immunechem(ICP)公司开发了一种高质量高效的亲和纯化介质(抗 His/ HA /DYKDDDDK Tag 亲和色谱填料)、
例如: 抗 His tag 亲和填料(His-tag Antibody, Agarose) 产品描述:
保存条件: Store product at –20 oC. Three years from date of shipping
2)DYKDDDDK-tag Antibody, Agarose(ICP1315)
3)HA-tag Antibody, Agarose(ICP1305)
您可以通过以下方式和我们蓝光生物取得联系: 1.电话: 0771-2310996
传真:0771-2310995 手机:18176507576 2.公司网址: /(加拿大 ImmuneChem(ICP)免疫化学药剂公司) (南宁市蓝光生物技术有限公司) 3.电子邮箱: (1)产品订购:
标签蛋白亲和纯化介质
随着基因工程下游的技术的日益发展。基因重组蛋白的分离纯化技术越来越显 示出其重要性,在重组蛋白的纯化过程中,研究人员常常利用各种融合表达的亲 和标签来纯化所表达的蛋白质,这样纯化相对比较容易,即便如此,由于蛋白的 多样性,重组蛋白的的纯化还是比较复杂而专业的工作,尤其对于不熟悉的研究 者来说,它还有可能成为一个瓶颈。
3) 染胶结果: 上样顺序: 1—分子量标记; 2—重组蛋白细菌裂解液原液 10uL; 3—重组蛋白细菌裂解液滤液 10uL; 4—重组蛋白细菌裂解液 His 洗脱液(8.31)15uL 5—重组蛋白细菌裂解液 His 洗脱液(9.3) 15uL
其他:
1)His-tag Antibody, Agarose(ICP1310)
735565094@ order@ (2)技术咨询: immunechem@ 4.通信地址: 广西壮族自治区南宁市高新技术开发区科园大道 68 号东盟慧谷 11 栋 203 室
0.013 0.107973422 1.079734219 1.079734219
0.035 0.290697674
0.09011627894
0.7
y = 0.1204x
0.6
R2 = 0.9965
0.5
0.4
系列1
0.3
线性 (系列1)
0.2
0.1
0
0
1
2
3
4
5
6
1) ELISA 实验结果:
Anti-His
抗体
HRP
1:2000
洗脱液稀释度
His 洗脱 液
1/3 2.511
1/9 2.593
1/27 2.439
1/81 1.997
1/243 1.175
1/729 0.604
1/2187 0.335
0 0.108
2) WB 实验结果:
SDS-PAGE: 12%
跑胶: 70 伏,145 分钟
半干转膜:90mA, 45 分钟
上样:
1:分子量标记;
2:重组细菌裂解液原液 10uL;
3:重组细菌裂解液滤液 10uL;
4:重组细菌裂解液洗脱液 5uL;
5:重组细菌裂解液洗脱液 15uL; 6:重组细菌裂解液洗脱液 25uL。.
抗体:Anti-His HRP 1:2000 in 0.5%脱脂奶+TBSt, 室温孵育 2h; 曝光 30 分钟,显影 10 秒。
His 融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而 且基本不影响蛋白的活性,现在通用的做法是用镍柱亲和纯化,虽然是通用的方 法,但是不可避免的是它也有缺点,使用过镍柱纯化的研究者应该都遇到过蛋白 不溶解,蛋白不挂柱,蛋白难洗脱,电泳杂带多,特异性差等问题,并为此焦头 烂额,荒废不少的时间与精力,所以开发一种新的高效高质量的纯化介质是大家 一直以来的追求。
