高一化学离子方程式书写练习含答案
高一化学第二章离子反应方程式知识点及练习题(含答案)
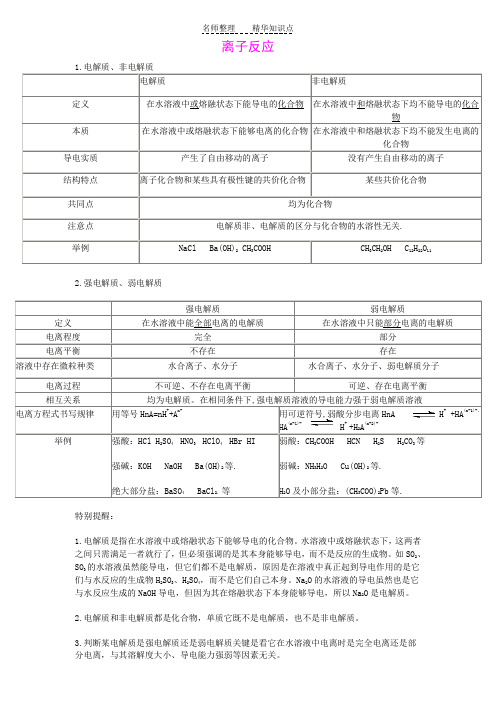
离子反应2.强电解质、弱电解质特别提醒:1.电解质是指在水溶液中或熔融状态下能够导电的化合物。
水溶液中或熔融状态下,这两者之间只需满足一者就行了,但必须强调的是其本身能够导电,而不是反应的生成物。
如SO2、SO3的水溶液虽然能导电,但它们都不是电解质,原因是在溶液中真正起到导电作用的是它们与水反应的生成物H2SO3、H2SO4,而不是它们自己本身。
Na2O的水溶液的导电虽然也是它与水反应生成的NaOH导电,但因为其在熔融状态下本身能够导电,所以Na2O是电解质。
2.电解质和非电解质都是化合物,单质它既不是电解质,也不是非电解质。
3.判断某电解质是强电解质还是弱电解质关键是看它在水溶液中电离时是完全电离还是部分电离,与其溶解度大小、导电能力强弱等因素无关。
离子方程式的书写1.离子反应:指在溶液中(或熔化状态下)有离子参加或离子生成的反应。
2.离子方程式:用实际参加反应的离子符号表示化学反应的式子。
3.离子方程式的书写: (1)书写规则:①单质、氧化物、不溶物、难电离的物质(弱酸、弱碱及水等)不能拆开来写。
如Cl 2、Na 2O等不可以拆开写成Cl -、Na +、O 2-;BaSO 4不可以拆开写成Ba 2+、SO 42-形式。
②易溶于水,易电离的物质的离子符号的改写同电离方程式中的离子形式。
如NaHCO 3改写Na +、HCO 3-;NaHSO 4应改写Na +,H +,SO 42-③微溶物,若出现在反应物中一般改写成离子符号(悬浊液除外);若出现在生成物中一般不改写。
④固体与固体物质反应不写离子方程式。
如实验室制取NH 3的离子方程式为: 2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+2H 2O⑤浓H 2SO 4、浓H 3PO 4一般不拆开写成离子形式;HCl 、HNO 3无论浓稀,均应改写成离子符号。
如Cu 片与浓H 2SO 4反应的离子方程式为:Cu+2H 2SO 4(浓)CuSO 4+SO 2↑+2H 2O(2)书写步骤(以CuSO 4溶液与BaCl 2 溶液反应为) ①写出反应的化学方程式:CuSO 4+BaCl 2==CuCl 2+BaSO 4↓ ②把易溶于水、易电离的物质拆开写成离子形式,难溶的物质或难电离的物质以及气体等仍用化学式来表示。
高一化学离子方程式的书写练习题

湖南省株洲市第四中学高一化学离子方程式正误的判断练习1、写出下列典型反应的离子方程式:(1) 氯化铝溶液中加入过量氨水____________________________________________________(2) 小苏打与乙酸溶液混合_______________________________________________________ 。
(3) 氧化镁溶于稀硫酸____________________________________________________________ 。
(4) 澄清石灰水中加入盐酸_______________________________________________________ 。
通过上述练习试归纳离子方程式的一般书写方法与步骤:一写:________________________________________________________________________ 。
二改:把_________________ 改写成离子形式,而把___________________ 等用化学式表示。
三删:删去____________________ 。
四查:查___________________ 是否守恒。
2、写出下列典型反应的离子方程式:(1) 钠与水反应______________________________________________________________ 。
(2) 大理石与乙酸溶液混合__________________________________________________________(3) 少量二氧化碳通入苯酚钠溶液中_________________________________________________(4) 铁与硫酸铜溶液反应___________________________________________________________ 。
高一化学离子方程式的书写及正误判断试题

高一化学离子方程式的书写及正误判断试题1. 能用离子方程式H + + OH - = H 2O 表示的是 A .Ba(OH)2溶液和H 2SO 4溶液混合 B .NaOH 溶液和盐酸混合 C .Cu(OH)2和稀H 2SO 4反应 D .CO 2通入NaOH 溶液中【答案】B【解析】A 、Ba(OH)2溶液和H 2SO 4溶液反应除水外还有硫酸钡生成,错误;B 、NaOH 溶液和盐酸反应的实质就是氢离子与氢氧根离子结合生成水,正确;C 、Cu(OH)2和稀H 2SO 4反应的离子方程式中Cu(OH)2不能拆开,错误;D 、CO 2是非金属氧化物,在书写离子方程式时不能拆开,错误,答案选B 。
【考点】考查离子方程式的意义2. 有4种钠的化合物W 、X 、Y 、Z ,它们之间存在如下关系: ①W X +H 2O +CO 2↑ ②Z +CO 2―→X +O 2 ③Z +H 2O―→Y +O 2↑④X +Ca(OH)2―→Y +CaCO 3↓ 试回答下列问题:(1)W 、X 、Y 、Z 的化学式分别是:W :________、X :________、Y :________、Z :________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:①离子方程式:__________________________。
②化学方程式:_______________________。
【答案】(1)NaHCO 3 Na 2CO 3 NaOH Na 2O 2 (2)②③ Na 2O 2 Na 2O 2 (3)Ca 2++CO 32-=CaCO 3↓Ca(OH)2+K 2CO 3=2KOH +CaCO 3↓(其他合理答案也给分) 【解析】W X +H 2O +CO 2↑,则W 是碳酸氢钠,X 是碳酸钠;Z +CO 2―→X +O 2,则Z 是过氧化钠;Z +H 2O―→Y +O 2↑,则Y 是氢氧化钠。
高一离子方程式书写专题训练及答案

高一离子方程式书写专题训练写出下列化学反应的离子方程式(写离子方程式先写化学方程式然后拆、删、整理,注意一定要写完之后马上看看电荷守恒原子守恒是否符合)1. 盐酸与氢氧化钠溶液的反应2. 氢氧化钡溶液与硝酸溶液的反应3. 氢氧化钠溶液与硫酸溶液的反应4. 氢氧化钡溶液与硫酸溶液的反应5. 醋酸与氢氧化钠溶液的反应6. 盐酸与氨水的反应7. 氢氧化镁与盐酸的反应8. 醋酸与氨水溶液的反应9. 硫酸铜溶液与氢氧化钡的反应10. 氯化镁与氢氧化钠溶液的反应11. 氯化铝与氨水的反应12.. 氯化镁溶液和硝酸银溶液的反应13. 盐酸溶液和硝酸银溶液的反应14. 硫酸溶液与氯化钡溶液的反应15. 硫酸钠溶液与氯化钡溶液的反应16.碳酸钠溶液与氯化钡溶液的反应17.亚硫酸钠溶液与氯化钡溶液的反应18.氢氧化钠中通入少量二氧化碳19澄清石灰水中通入少量二氧化碳20.铁片投入盐酸溶液中 21.铝片投入盐酸溶液中21.碳酸钠溶液与氢氧化钡溶液反应23. 钠和水的反应(2Na + 2H2O == 2NaOH + H2↑)24. 钠和硫酸的反应25.碳酸氢钠溶液和稀盐酸26. 碳酸氢钙溶液和稀盐酸27. 硫酸氢钠溶液和氢氧化钠溶液28. 碳酸钙中加入稀盐酸29. 碳酸钠溶液中加稀盐酸30. 碳酸钠溶液和石灰水的反应31.碳酸钙中加入醋酸32.碳酸氢钙溶液和氢氧化钙溶液33. 氧化铜中加稀硫酸溶液34. 氧化钠中加稀硫酸溶液35. 铁加入CuSO4溶液中36 碳酸氢钠溶液与氢氧化钠溶液:NaHCO3+NaOH=Na2CO3+H2O37. 亚硫酸钠与盐酸反应38. 铜片插入硝酸银溶液中39. 石灰石与硝酸反应40. MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O41. 2Na2O2+ 2H2O = 4NaOH + O2↑42 Cl2+SO2+2H2O=H2SO4+2HCl43. Cl2+ H2O = HCl + HClO44. SiO2+ 2NaOH = Na2SiO3+ H2O45. 3NO2+ H2O 错误!未找到引用源。
高一化学离子方程式的书写及正误判断试题答案及解析

高一化学离子方程式的书写及正误判断试题答案及解析1.某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的一种或几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。
回答下列问题:(1)溶液中一定含有的溶质是,一定不含有的溶质是(填化学式)。
(2)溶液中可能含有的溶质是(填名称),判断该物质是否存在的实验方法是,现象是。
(3)分别写出AB段、BC段发生反应的离子方程式:①AB段为;②BC段为。
【答案】(1)HCl、AlCl3、NH4Cl MgCl2、Na2CO3(2)氯化钾焰色反应透过蓝色钴玻璃观察焰色反应为紫色(3)①Al3++3OH-====Al(OH)3↓②N+OH-====NH3·H2O【解析】首先分析图像中的拐点、斜线及水平线所表示的化学意义。
OA段是NaOH溶液中和HCl;加入过量NaOH溶液,沉淀全部溶解,说明无MgCl2,所以沉淀只有Al(OH)3;BC段是NaOH溶液与NH4Cl反应,故原溶液中一定含有HCl、AlCl3、NH4Cl,一定无MgCl2;又因为AlCl3、HCl与Na2CO3不能大量共存,所以一定无Na2CO3;可能含有KCl,可用焰色反应进行确定。
【考点】铝的氧化物与氢氧化物从铝土矿中提取铝2.与离子方程式H++OH-====H2O相对应的化学方程式是()A.Ba(OH)2+2HCl====BaCl2+2H2OB.NaOH+NaHSO4====Na2SO4+H2OC.Ba(OH)2+H2SO4====BaSO4↓+2H2OD.NaOH+CH3COOH====CH3COONa+H2O【答案】A、B【解析】离子方程式H++OH-====H2O所表示的含义是可溶性强碱和强酸反应生成可溶性盐和水的反应。
NaHSO4是强酸的酸式盐,在水溶液中完全电离出H+,相当于强酸,A和B选项都正确;Ba(OH)2溶液和H2SO4溶液反应生成的BaSO4是难溶性物质,C选项错误;醋酸属于弱酸,不能拆成离子的形式,D选项错误。
高一化学《离子反应、离子方程式》分层练习含答案解析

第二节 离子反应第2课时 离子反应(分层练习)1.下列不属于离子反应的是A .氢气在氧气中燃烧B .盐酸和氢氧化钠溶液反应C .铁和硫酸铜溶液反应D .大理石和稀盐酸反应2.下列反应中,不属于离子反应的是A .H 2和O 2的反应B .铁与CuSO 4溶液的反应C .Ba(OH)2溶液和H 2SO 4溶液的反应D .Zn 和稀H 2SO 4反应3.下列物质间的反应不属于离子反应的是A .BaCO 3+ HClB .HCl + AgNO 3C .CO+ Fe 2O 3D .BaCl 2+ H 2SO 44.下列各组物质间的反应不属于离子反应的是A .盐酸+NaOH 溶液B .CaCl 2溶液+AgNO 3溶液C .Fe+CuSO 4溶液D .C+O 25.能用H + + OH - = H 2O 表示的是A .Ba(OH)2溶液和稀硫酸的反应B .NaOH 溶液和稀硫酸的反应C .Cu(OH)2和稀HNO 3的反应D .Ba(OH)2溶液NaHSO 4溶液的反应6.能用+2H +OH H O 表示的反应是A .氢氧化钡溶液与硫酸反应B .氢氧化铜与稀硝酸反应C .氢氧化钾与硫酸反应D .氢氧化钠与醋酸反应7.在离子方程式2Fe 3++Fe=3Fe 2+中,Fe 3 +可能代表的物质是A .FeSO 4B .FeCl 3C .Fe 2O 3D .Fe(OH)38.离子方程式CO 32-+2H +=H 2O+CO 2↑中CO 32-的代表的物质可以是A .CaCO 3B .NaHCO 3C .Na 2CO 3D .BaCO 39.关于离子方程式Cu 2++2OH -=Cu(OH)2↓的说法正确的是A .可表示所有铜盐和强碱的反应B .可表示某一个具体的反应,也可以表示一类反应C .离子方程式中的OH -可代表弱碱或强碱D .该反应可看到Cu(OH)2白色沉淀10.下列选项中的两个反应可用同一离子方程式表示的是A .HCl+Na 2CO 3,HCl+CaCO 3B .HNO 3(足量)+Na 2CO 3,NaHSO 4(足量)+K 2CO 3C .HCl+NH 3·H 2O ,H 2S+KOHD .BaCl 2+CuSO 4,Ba(OH)+NaHSO 4(足量)11.下列离子方程式正确的是A .在稀硝酸中滴加少量Na 2SO 3溶液:SO 32-+2H +=SO 2↑+H 2OB .在NH 4HSO 4溶液中滴加少量的Ba(OH)2,溶液:SO 42-+Ba 2+=BaSO 4↓C .磁性氧化铁溶于稀盐酸:Fe 3O 4+8H +=2Fe 3++Fe 2++4H 2OD .在FeCl 3溶液中滴加几滴KSCN 溶液:Fe 3++3SCN -=Fe(SCN)3↓12.下列指定反应的离子方程式书写正确的是A .硫化氢气体通入氯化铁溶液:2Fe 3++S 2-=S↓+2Fe 2+B .向碳酸氢铵溶液中加入足量石灰水:Ca 2++HCO 3-+OH -=CaCO 3↓+H 2OC .向稀硝酸中加入过量铁粉:Fe+NO 3-+4H +=Fe 3++NO↑+2H 2OD .用氨水吸收少量SO 2:2NH 3•H 2O+SO 2=2NH 4++SO 32-+H 2O13.下列离子方程式书写错误的是A .锌与稀硝酸溶液反应:22Zn 2H Zn H +++=+↑B .向氨水中加入盐酸:3242NH H O H NH H O++⋅+=+C .氯气与水反应:22Cl H O H Cl HClO+-+++ D .44NH HSO 溶液和NaOH 溶液(溶质物质的量)1:1反应:2H OH H O+-+=14.下列反应能用离子方程式CO 32-+2H +=CO 2↑+H 2O 表示的是①Na 2CO 3+2HCl=2NaCl+CO 2↑+H 2O②K2CO3+H2SO4=K2SO4+CO2↑+H2O③CaCO3+2HCl=CaCl2+CO2↑+H2O④2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2OA.①②B.①②③C.①③④D.②④15.下列离子方程式改写成化学方程式正确的是A.Mg2++2OH-=Mg(OH)2↓,MgCO3+2NaOH=Mg(OH)2↓+Na2CO3B.CO32-+2H+=CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2OC.Fe2O3+6H+=2Fe3++3H2O,Fe2O3+2H2SO4=2FeSO4+2H2OD.H++OH-=H2O,2NaOH+H2SO4=Na2SO4+2H2O16.下列离子方程式改写为化学方程式正确的是选项离子方程式化学方程式A2H++Zn=Zn2++H2↑2CH3COOH+Zn=Zn(CH3COO)2+H2↑B Ba2++SO42-=BaSO4↓H2SO4+Ba(OH)2=BaSO4↓+2H2OC Ag++Cl-=AgCl↓AgNO3+HCl=AgCl↓+HNO3D Ca2++CO32-=CaCO3↓Ca(OH)2+CO2=CaCO3↓+H2O17.下列四组物质,从左至右都能发生化学反应的是(如:a+b-反应 b+c-反应 c+d-反应)a b c d①CO2NaOH溶液CuSO4溶液Fe②稀盐酸Na2CO3溶液CaCl2溶液CO2③AgNO3溶液BaCl2溶液稀硫酸Fe2O3④Zn稀盐酸NH4NO3溶液Ca(OH)2溶液A.①②③B.①③④C.①③D.①②③④18.写出下列指定反应的离子方程式(1)铜与稀硝酸反应________________________________;(2)NaAlO2溶液中通入足量CO2________________________________;(3)NaHSO4加入到Ba(OH)2溶液中至溶液呈中性____________________________________;(4)向NH4Al(SO4)2溶液中加入过量NaOH溶液______________________________________;(5)向一定量的FeBr2溶液中通入等物质的量的Cl2__________________________________________。
高一化学离子方程式书写

1. 实验室用MnO 2与浓盐酸制Cl 2 : MnO 2+2Cl -+4H +Mn 2++Cl 2↑+2H 2O2. 实验室制Cl 2时,用NaOH 溶液处理尾气:Cl 2+2OH -═Cl -+ClO -+H 2O3. 向FeBr 2溶液中通入少量Cl 2: 2Fe 2++Cl 2═2Fe 3++2Cl -4. 向FeBr 2溶液中通入足量Cl 2: 3Cl 2+2Fe 2++4Br -═6Cl -+2Fe 3++2Br 2 5.向FeI 2溶液中通入少量Cl 2: Cl 2+2I -═2Cl -+I 26. 用湿润的淀粉碘化钾试纸检验Cl 2的原理: Cl 2+2I -═2Cl -+I 27.氯气与水反应:Cl 2 + H 2O ═ H + + Cl - +HClO8.稀硫酸与过量Ba(OH)2溶液反应:Ba 2++2OH -+SO 42-+2H +═BaSO 4+2H 2O 9.向小苏打溶液中加入少量的澄清石灰水: Ca 2+ +2OH -+2HCO 3-=CaCO 3↓+CO 32- +2H 2O 10.向澄清石灰水中滴加少量Ca(HCO 3)2溶液: Ca 2+ +OH -+HCO 3-=CaCO 3↓+H 2O11.等物质的量的KHCO 3和Ba(OH)2的溶液混合:HCO 3- +Ba 2++OH - ═ BaCO 3↓+H 2O 12.醋酸溶液与水垢中的CaCO 3反应:CaCO 3+2CH 3COOH =Ca 2++2CH 3COO - +H 2O +CO 2↑ 13.将Na 2O 2投入水中:2Na 2O 2+2H 2O ═ 4Na ++4OH -+O 2↑14.Ca(ClO)2溶液中通入过量CO 2: ClO - + CO 2 + H 2O ═HCO 3- + HClO 15. 小苏打溶液中加入烧碱: HCO 3-+OH -=CO 32-+H 2O 16.用KIO 3氧化酸性溶液中的KI :5I -+IO 3-+6H +═ 3I 2+3H 2O17.蓝色的淀粉溶液中通入足量SO2后变成无色溶液:I2 + SO2+ 2H2O ═ 2I- + SO42- + 4H+18.淀粉KI溶液在空气中变蓝: 4I-+O2+2H2O ═ 2I2+4OH-19.FeSO4溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2═2 Fe3++2H2O20.KMnO4溶液不能用盐酸酸化的原因:2MnO4− + 10 Cl-+16H+= 2Mn2+ + 5Cl2↑ + 8H2O21.铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2中加入,铜屑可以逐渐溶解,该反应的离子方程式:Cu+H2O2+2H+═Cu2++2H2O。
高一化学离子方程式的书写及正误判断试题答案及解析

高一化学离子方程式的书写及正误判断试题答案及解析1.胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是;此时最好用含氢氧化铝的胃药(如胃舒平),写出其反应的离子方程式:。
【答案】HCO3-+H+=CO2↑+H2O;因产生CO2压力增大而加剧胃壁穿孔;Al(OH)3+3H+=Al3++3H2O。
【解析】小苏打NaHCO3与胃酸HCl反应的化学方程式为NaHCO3+HCl=NaCl+H2O+ CO2↑,离子方程式为HCO3-+H+=CO2↑+H2O。
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打是因为小苏打与胃酸反应产生的CO2压力增大,导致胃壁变大、变薄而加剧胃壁穿孔,使胃穿孔加剧。
此时最好用含氢氧化铝的胃药。
该反应的离子方程式Al(OH)3+3H+=Al3++3H2O。
【考点】考查治疗胃酸过多的药物的选择及应用的知识。
2.下列离子方程式正确的是A.碳酸氢钠与稀盐酸反应:HCO3—+H+=CO2↑+H2OB.铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑C.碳酸镁中滴加稀盐酸:CO32—+2H+=CO2↑+H2OD.硫酸铜溶液中滴加氢氧化钡溶液:Cu2++2OH—=Cu(OH)2↓【答案】A【解析】A、碳酸是弱酸,碳酸氢根离子不能改写,正确;B、电子、电荷不守恒,正确的是2Al+2OH—+2H2O=2AlO2—+3H2↑,错误;C、MgCO3难溶于水,不能拆写,正确的是MgCO3+2H+=Mg2++CO2↑+H2O,错误;D、漏写SO42—和Ba2+的离子反应,正确的是Cu2++SO42—+Ba2++2OH—=Cu(OH)2↓+BaSO4↓,错误。
【考点】考查离子方程式的书写等相关知识。
3.表示下列反应的离子方程式正确的是()A.金属钠加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+B.金属铝加入到NaOH溶液中:Al+2OH-+H2O=AlO2—+2H2↑C.铁粉加入到FeCl3溶液中:Fe+2Fe3+=3Fe2+D.铜片插入到AgNO3溶液中:Cu+Ag+=Cu2++Ag 【答案】C【解析】A、金属钠加入到CuSO4溶液中:2Na+2H2O+ Cu2+═2Na++Cu(OH)2↓+H2↑;B、金属铝加入到NaOH溶液中: 2Al+2OH-+2H2O=2AlO2— +3H2↑;C、铁粉加入到FeCl3溶液中:Fe+2Fe3+=3Fe2+;D、铜片插入到AgNO3溶液中:Cu+2Ag+=Cu2++2Ag。
高一化学离子方程式的书写.doc

专题一、离子方程式的书写和正误判断【例1】(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式。
答案(1)SO2-4+2H++2OH-+Ba2+===BaSO4↓+2H2O(2)Ba2++SO2-4===BaSO4↓解析(1)Na+不参加反应,溶液呈中性时,HSO-4中的H+与Ba(OH)2中的OH-皆无剩余:2H++SO2-4+Ba2++2OH-===2H2O+BaSO4↓。
(2)上面所得中性溶液,实为Na2SO4(aq),继续滴加Ba(OH)2(aq)发生以下反应:Ba2++SO2-4===BaSO4↓。
该题类型为给定条件的离子方程式的书写,NaHSO4===Na++H++SO2-4、Ba(OH)2===Ba2++2OH-。
欲使NaHSO4溶液呈中性,只需将其中H+恰好中和即可。
而此时溶液中SO2-4显然过量,反应的离子方程式为:2H++SO2-4+Ba2++2OH-===BaSO4↓+2H2O。
由这一离子方程式可见,溶液中的SO2-4只反应了一半,当继续滴加Ba(OH)2时,发生以下反应:SO2-4+Ba2+===BaSO4↓。
【变式训练】(1)思考下列反应的离子方程式:①在NaHSO4溶液中加过量的Ba(OH)2溶液②Ba(OH)2溶液中加入过量的NaHSO4溶液提示①两溶液混合后,H+与OH-、SO2-4与Ba2+反应,由于NaHSO4少量,所以参与反应的H+与SO2-4的化学计量数之比为1∶1,故参与反应的OH-与Ba2+个数比也为1∶1:H++SO2-4+OH-+Ba2+===H2O+BaSO4↓。
②Ba(OH)2溶液不足时,Ba2+与OH-按物质的量之比为1∶2参加反应:Ba2++2OH-+2H++SO2-4===BaSO4↓+2H2O。
(2)①NaHCO3和Ba(OH)2两种固体中,________属于盐类,________属于碱类,将二者分别溶于水,其电离方程式分别为____________________,____________________。
离子方程式的书写---练习题----完整

一.选择题.1.下列反应的离子方程式书写正确的是()A.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++CuB.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑C.氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42—=BaSO4↓D.碳酸钙与盐酸反应:CO32—+2H+=H2O+CO2↑2.下列反应的离子方程式错误的是()A、碳酸铵和稀硝酸:CO32— + 2H+ == H2O + CO2↑B、AlCl3溶液和过量的氨水:Al3+ + 3NH3•H2O = Al(OH)3↓+ 3NH4+C、铁粉和稀硫酸:Fe + 2H+== Fe3+ + H2↑D.碳酸钠和稀硫酸反应:CO32-+2H+=CO2↑+H2O3.下列反应的离子方程式书写正确的是()A.钠和冷水反应Na+2H2O=Na++2OH-+H2↑B.金属铝溶于氢氧化钠溶液Al+2OH--=AlO2-+H2↑C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑D.水与三氧化硫反应: H2O+SO3=HSO4-+H+4.能用离子方程式H++OH-=H2O表示的反应是()A.稀醋酸和稀氨水反应B.稀硫酸和烧碱溶液反应C.稀盐酸和氢氧化铜反应D.稀硫酸和氢氧化钡溶液反应5.下列离子方程式书写正确的是()A.碳酸钙溶于醋酸中23222CaCO H Ca H O CO+++===++↑B.二氧化硅与氢氧化钠溶液反应:SiO2+2OH- =H2SiO4C.氢氧化亚铁溶于稀硝酸222 ()22Fe OH H Fe H O+++===+D.氯化铁溶液中加过量氨水33243 33()N H H O F e N H F e O H++⋅+===+↓6.下列离子方程式正确的是()A、亚硫酸钠与盐酸反应:Na2SO3+2H+===2Na++SO2↑+ H2O B.氢氧化亚铁与稀硫酸反应2OH-+2H+=H20C、稀硫酸与锌反应:H2SO4+Zn=Zn2+ +SO42-+H2↑D、硫酸溶液与氢氧化钠溶液反应:H++ OH-===H2O7 .下列离子方程式正确的是( A )A .实验室用大理石和稀盐酸制取CO 2:2H + + CO 32- = CO 2↑+ H 2OB .铁和稀硝酸反应:Fe + 2H + = H 2↑+ Fe 2+C .向AlCl 3溶液中加入过量的NaOH 溶液:Al 3+ + 3OH - = Al(OH)3↓D .NaHCO 3溶液与NaOH 溶液反应: OH - + HCO 3- = CO 32- + H 2O9.能正确表示下列化学反应的离子方程式的是 ( )A .氢氧化钡溶液与硫酸的反应 OH -+H + = H 2OB .澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H + = Ca 2+ + 2H 2OC .铜片插入硝酸银溶液中 Cu + Ag + = Cu 2+ + AgD .碳酸钙溶于稀盐酸中 CaCO 3+2H +=Ca 2++H 2O +CO 2↑10.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是 ( )A .氢氧化钠与盐酸,氢氧化钠与碳酸B .BaCl 2溶液与Na 2SO 4溶液;Ba(OH)2溶液与H 2SO 4溶液C .Na 2CO 3溶液与硝酸溶液;CaCO 3溶液与硝酸溶液D .石灰石与硝酸反应;石灰石与盐酸11.下列离子方程式正确的是 ( )A .铁和盐酸反应:2Fe+6H +=2Fe 3++3H 2↑B .氯化铁和铜反应:Fe 3++Cu=Fe 2++Cu 2+C .石灰水与碳酸钠溶液混合:Ca 2++CO 32-=CaCO 3↓D .硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H ++SO 42-+Ba 2++2OH -=BaSO 4↓+2H 2O12.下列离子方程式正确的是 ( )A .次氯酸钙溶液中通入过量二氧化碳:2HClO CaCO CO O H 2ClO Ca 3222+↓=+++-+B .氯化铁溶液中通入硫化氢气体: ++++↓+=+2H S 2Fe S H 2Fe 223C. 氯气通入水中: Cl 2 + H 2O = 2H + + Cl - + ClO -D.硫酸氢钠溶液中加入氢氧化钡溶液至硫酸根沉淀完全:2H ++SO 42-+Ba 2++2OH -=BaSO 4↓+2H 2O13. 下列化学方程式中,不能用H ++OH -=H 2O 表示的是 ( )A 2NaOH +H 2SO 4=Na 2SO 4+2H 2OB Ba(OH)2+2HCl =BaCl 2+2H 2OC Cu(OH)2+2HNO 3=Cu(NO 3)2+2H 2OD KOH +HCl =KCl +H 2O14.下列离子方程式书写正确的是 ( )A .FeCl 2溶液中通入Cl 2:Fe 2++Cl 2 = Fe 3++2Cl -B .氢氧化镁与稀硫酸反应:H ++OH -=H 2OC .澄清石灰水与少量小苏打溶液混合:Ca 2+十OH -+HCO 3-= CaCO 3↓+H 2OD .AlCl 3溶液中加入过量氨水:Al 3++4OH -= AlO 2-+2H 2OA .硫酸与氨水混合 H ++OH -=H 2OB .氢氧化亚铁与稀硫酸反应 2OH -+2H +=H 20C .氢氧化钡溶液与稀硫酸反应 H ++OH -=H 2OD .硫酸氢钠溶液与碳酸钠溶液混和CO 32-+2H +=CO 2↑+H 2O16.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是 ( )A .氢氧化钠与盐酸,;氢氧化钠与硫酸氢钠B .石灰石与硝酸反应;生石灰与盐酸C .BaCl 2与Na 2SO 4溶液;Ba(OH)2与H 2SO 4溶液D .Na 2CO 3溶液与硝酸溶液;CaCO 3与硝酸溶液17.表示下列变化的化学用语正确的是 ( )A .溴化亚铁溶液中通入过量氯气:2Fe 2++2Br -+3Cl 2==2Fe 3++Br 2+6Cl -B .实验室用MnO 2和浓盐酸制取Cl 2:MnO 2+4HCl(浓)Mn 2++Cl 2↑+2Cl -+2H 2OC .用FeS 除去工业废水中含有的Cu 2+:S 2-(aq)+Cu 2+(aq)=CuS(s)↓D .1L0.5mol ·L -1稀硫酸与1L 1mol ·L -1氢氧化钠溶液反应放出57.3kJ 的热量:H 2SO 4(aq)+2NaOH(aq)=Na 2SO 4(aq)+2H 2O(1);△H =-114.6 kJ·mol -118、下列离子方程式书写正确的是 ( )A 、等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混Ba 2++OH 一+HCO 3一=BaCO 3↓+H 2OB .氯化铝溶液中加入过量的氨水 A13++4NH 3·H 2O=4NH 4++A1O 2-+2H 2OC. 向次氯酸钙溶液中通人过量的二氧化硫 Ca 2++2C1O 一+SO 2+H 2O=CaSO 3↓+2HC lOD. 碳酸钠溶液中加入过量的苯酚+CO 32-→ +HCO 3-19.下列离子方程式中正确的是 ( )A .向苯酚钠溶液中通入CO 2 : 2-O -+CO 2+H 2O =2-OH +CO 32-B .氨水中加入明矾溶液:3NH 3·H 2O + Al 3+ === Al(OH)3↓ + 3NH 4+C .石墨做电极,电解硫酸铜溶液:Cu 2+ + 2H 2O === Cu + O 2↑+ 4H +D .氯气溶于水:Cl 2 + H 2O === Cl - + ClO - + 2H +20.下列离子反应方程式正确的是 ( )A .澄清石灰水来吸收氯气:Cl 2+OH -=Cl -+ClO -+H +B .将金属Na 加入冷水中:2Na +2H 2O =2Na ++2OH -+H 2↑C .向稀硝酸中加入少量铁粉:3Fe +8H ++2NO 3-=3Fe 2++2NO↑+4H 2OD .在碳酸氢钙溶液中加入少量苛性钾溶液:Ca 2++2HCO 3-+2OH -=CaCO 3↓+CO 32-+2H 2OOH通电 O -A.铝粉加入稀硫酸中:Al + 6H+ = Al3+ + 3H2↑B.乙酸和碳酸钠溶液的反应:2H+ + CO32- = CO2↑+ H2OC.将Cl2通入碘化亚铁溶液:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-D.Cl2通入NaOH溶液:Cl2 + 2OH— == Cl— + ClO— + H2O22. 下列离子方程式的书写不正确的是()A.碳酸氢钙溶液和氢氧化钠溶液混合HCO3—+OH—==CO32—+H2OB.醋酸钠溶液和盐酸混合CH3COO-+H+ =CH3COOHC.铜片插入硝酸银溶液中Cu + Ag+ === Cu2+ + AgD.大理石溶于醋酸的反应CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+ H2O23.下列离子方程式中书写正确的是()A.用小苏打治疗胃酸过多:HCO3- + H+ == CO2↑+ H2OB.氢氧化钡溶液与稀硫酸反应:Ba2+ + SO42- + H+ + OH- == BaSO4↓+ H2OC.AlO2-的水解:AlO2- +2H2O Al(OH)3 + OH-D.HCO3-的水解:HCO3- + H2O H3O+ + CO32-24.下列反应的离子方程式书写正确的是()A.硫酸镁溶液与氢氧化钡溶液反应:SO42-+ Ba2+== BaSO4↓B.用FeCl3溶液腐蚀印刷电路铜板:Cu + Fe3+ == Cu 2+ + Fe2+C.金属铜与稀硝酸反应:Cu + 4H+ + 2NO3-== Cu2+ + 2NO2↑ +2H2OD.金属铝与氢氧化钠溶液反应:2Al + 2OH-+ 2H2O == 2AlO2-+ 3H2↑25.下列离子方程式书写正确的是()A.在蓝色的淀粉溶液中通入足量SO2后成无色溶液:I2+SO2+2H2O=2I-+SO32-+4H+B.过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-==Al(OH)3↓+HCO3-C.等物质的量的亚硫酸氢铵与氢氧化钠溶液混合NH4++HSO3-+2OH—==SO32-+NH3↑+2H2O D.碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-==CaCO3↓+2H2O+MgCO326.下列反应的离子方程式错误的是()A等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2OC.足量的CO2通入饱和碳酸钠溶液中:CO2+2Na++CO32—+H2O=2NaHCO3↓D.向碳酸氢钠溶液中滴入少量澄清石灰水:Ca2++2OH—+2HCO3—=CaCO3↓+CO32—+2H2O27.下列反应的离子方程式正确的是()A 氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3-B 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2OC 盐酸滴入氨水中:H++OH-=H2OD 碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2OA.少量氢氧化钙溶液与碳酸氢钠溶液反应:---+=+2323COOHHCOOHB.金属铝溶于氢氧化钠溶液:Al+2OH-== AlO2—+ H2↑C.氨水中滴加稀盐酸:NH3+H+==NH4+D.亚硫酰氯(SOCl2)剧烈水解生成两种酸:SOCl2+2H2O==H2SO3+2H++2Cl—29、下列化学反应的离子方程式正确的是()A、用小苏打治疗胃酸过多:HCO3- + H+ == CO2↑+ H2OB、往碳酸镁中滴加稀盐酸:CO32- + 2H+ == CO2↑+ H2OC、往氨水中滴加氯化铝:Al3+ + 4OH- == AlO2- + 2H2OD、氢氧化钡溶液与稀硫酸反应:Ba2+ + SO42- + H+ + OH- == BaSO4↓+ H2O30.下列离子方程式书写正确的是()A.过量的SO2通入NaOH溶液中:SO2+2OH-= SO32 -+H2OB.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-= 2Fe2++I2C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+= 2Mn2++5NO3-+3H2OD.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-= BaCO3↓+2H2O+CO32 -31.对于反应①KHCO3溶液与石灰水反应;②Na2SO3溶液与稀盐酸反应;③Si与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量,不能用同一个离子方程式表示的是()A.①②③B.①②④C.①③④D.②③④32. 下列离子方程式中正确的是()A.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+ ==BaSO4↓B.重铬酸钾溶液和过氧化氢溶液:Cr2O72-+2H2O2+14H+=2Cr3++O2↑+9H2OC.FeBr2溶液中加入过量的氯水:2Fe2++2Br - +2Cl2 ==Br2+4Cl-+2Fe3+D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3- + Ba2+ + OH-== BaCO3↓+ H2O33.能正确表示下列反应的离子方程式是()A.醋酸钠的水解反应CH3COO—+H3O+=CH3COOH+ H2OB.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3—+2OH—=CaCO3↓+ 2H2O+ CO32—C.苯酚钠溶液与二氧化碳反应C6H5O—+ CO2+ H2O=C6H5OH+CO32—D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3—=3Fe3++2NO↑+4 H2OA .碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液Ca 2+ + 2HCO 3- + 2OH - = CaCO 3↓ + 2H 2O + CO 32-B .碳酸氢钠溶液中加入少量烧碱:O H CO OH HCO 2233+=+--- C .氯化亚铁溶液中通入氯气 Fe 2+ + Cl 2 = Fe 3+ + 2Cl -D .浓盐酸跟二氧化锰混合共热 ↑+++++-+22222Cl O 2H Mn Δ4Cl 4H MnO35. 下列离子方程式正确的是( )A. 石灰石与盐酸反应:CaCO H CO H O 3222+=++B. 氢氧化镁与稀硫酸反应:H OH H O +-+=2C. 二氧化锰与浓盐酸共热:MnO H Cl Mn Cl H O 2222422+++↑++-+∆D. 一小块钠投入硫酸铜溶液中:222Na CuNa Cu +=+++二:书写下列离子方程式:(1)Cl 2通入NaOH 溶液中: ;(2)CuSO 4溶液与K 2S 溶液混合: ;(3)Al 2O 3与NaOH 溶液: ;(4)Fe 3O 4溶于硝酸: ;(5)Na 2SiO 3溶液中通入过量的CO 2: ;(6)小苏打与醋酸反应: ;(7)3mL0.4mol/L 的Ba(OH)2溶液中滴入12mL0.2mol/L 的H 3PO 4:;(8)硫酸亚铁溶液中加入用硫酸酸化的过氧化氢: ;(9)CuSO 4中通H 2S : ;(10) 向NaHSO 4溶液中,逐滴加入Ba(OH)2溶液至中性,再向中性溶液中继续滴加Ba(OH)2溶液,请写出这两步反应的离子方程I :_____________________________________________________;II :_________________________________________________;答案.一. 1-5 ACCBD 6-10 DADDD 11-15 DBCCC 16 -20 ADDBB 21 -25 DCADB 26-30 ABDAC 31-35 BDBBC二:1. 2OH-+CI2=ClO-+CI-+H2O2. Cu2++S2-=Cu S↓3. Al2O3+2OH-=2AlO2-+H2O4.Fe3O4+10 H++NO3-=3Fe3++NO2↑+5H2O或:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O5.. SiO32-+2CO2+2H2O=H2SiO3 ↓+2HCO3-6. CH3COOH+HCO3-=CH3COO-+CO2↑+H2O7. OH-+H3PO4=H2PO4-+H2O8. 2Fe2++2H++H2O2=2Fe3++2H2O9. Cu2++H2S=CuS ↓+2H+10. i:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2Oii: Ba2++SO42-=BaSO4↓。
高一化学离子方程式的书写及正误判断试题答案及解析

高一化学离子方程式的书写及正误判断试题答案及解析1.下列离子方程式书写错误的是()A.Na投入到水中:2Na+2H2O====2Na++2OH-+H2↑B.Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-====Al+2H2OC.NaAlO2溶液中通入足量的CO2:2Al+CO2+3H2O====2Al(OH)3↓+CD.Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-====2Al+H2O【答案】C【解析】 NaAlO2溶液中通入足量的CO2应该生成碳酸氢钠。
【考点】铝的氧化物与氢氧化物从铝土矿中提取铝2.下列有关镁及其化合物的离子方程式书写正确的是A.MgCO3与盐酸反应:C+2H+====CO2↑+H2OB.Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++S====MgSO4↓+2H2OC.镁与醋酸反应:Mg+2H+====Mg2++H2↑D.工业上以海水为原料制取Mg(OH)2:Ca(OH)2+Mg2+====Mg(OH)2↓+Ca2+【答案】D【解析】 MgCO3和Mg(OH)2都是难溶性物质,醋酸为弱电解质,在写离子方程式时不能拆成离子形式,MgSO4是可溶性的盐,在写离子方程式时要拆成Mg2+和S的形式,A、B、C选项中的方程式都错误;工业上以海水为原料制取Mg(OH)2时,要在海水中加入石灰乳,而不是石灰水,所以Ca(OH)2不能拆成离子的形式。
【考点】镁的提取及应用3.(12分)我国有广阔的海岸线,海水综合利用大有可为。
海水中溴含量为65 mg·L-1,从海水中提取溴的工业流程如下:(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:________________________________________________________________________。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
高一化学离子方程式书写专项练习题

高一化学离子方程式书写专项练习题1. 氯化铁和氢氧化钠反应的离子方程式是什么?FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl2. 硝酸钾和氢氧化铵反应的离子方程式是什么?KNO3 + NH4OH → KOH + NH4NO33. 硫酸铜和氢氧化钠反应的离子方程式是什么?CuSO4 + 2NaOH → Cu(OH)2 + Na2SO44. 硝酸银和氯化钠反应的离子方程式是什么?AgNO3 + NaCl → AgCl + NaNO35. 硝酸铜和氯化铵反应的离子方程式是什么?Cu(NO3)2 + 2NH4Cl → CuCl2 + 2NH4NO36. 氧化铁和盐酸反应的离子方程式是什么?Fe2O3 + 6HCl → 2FeCl3 + 3H2O7. 碳酸钙和盐酸反应的离子方程式是什么?CaCO3 + 2HCl → CaCl2 + CO2 + H2O8. 硝酸铜和氨水反应的离子方程式是什么?Cu(NO3)2 + 4NH3 → Cu(NH3)4(NO3)29. 硝酸铅和氢氧化钠反应的离子方程式是什么?Pb(NO3)2 + 2NaOH → Pb(OH)2 + 2NaNO310. 碘化钠和硝酸银反应的离子方程式是什么?NaI + AgNO3 → AgI + NaNO311.CaSO4 + 2Al(OH)3 → Al2(SO4)3 + 3H2O + Ca(OH)2 12. 碳酸钠和盐酸反应的离子方程式是什么?Na2CO3 + 2H Cl → 2NaCl + CO2 + H2O13. 碳酸钙和硝酸银反应的离子方程式是什么?CaCO3 + 2AgNO3 → Ca(NO3)2 + 2AgCl + CO2 + H2O 14. 硝酸铜和氢氧化铝反应的离子方程式是什么?Cu(NO3)2 + 2Al(OH)3 → Cu(OH)2 + 2Al(NO3)315. 碳酸铜和盐酸反应的离子方程式是什么?CuCO3 + 2HCl → CuCl2 + CO2 + H2O16. 碳酸铵和硫酸铜反应的离子方程式是什么?(NH4)2CO3 + CuSO4 → CuCO3 + (NH4)2SO417. 碳酸钙和氢氧化铜反应的离子方程式是什么?CaCO3 + Cu(OH)2 → CuCO3 + Ca(OH)218. 碘化钾和硫酸铜反应的离子方程式是什么?KI + CuSO4 → CuI + K2SO419. 碳酸铜和氢氧化钠反应的离子方程式是什么?CuCO3 + 2NaOH → Cu(OH)2 + Na2CO320. 硫酸铜和氮气反应的离子方程式是什么?CuSO4 + N2 → Cu + N2O4 + SO221. 碳酸钠和硫酸铜反应的离子方程式是什么?Na2CO3 + CuSO4 → CuCO3 + Na2SO422.(NH4)2CO3 + Cu(OH)2 → CuCO3 + 2NH3 + 2H2O 23. 碘化银和氯化钠反应的离子方程式是什么?AgI + NaCl → AgCl + NaI24. 碳酸铵和盐酸反应的离子方程式是什么?(NH4)2CO3 + 2HCl → 2NH4Cl + CO2 + H2O25. 硫酸铜和氯化钠反应的离子方程式是什么?CuSO4 + 2NaCl → CuCl2 + Na2SO426. 硫酸铜和氢氧化铵反应的离子方程式是什么?CuSO4 + 2NH4OH → Cu(OH)2 + (NH4)2SO427. 硝酸钾和氢氧化铝反应的离子方程式是什么?KNO3 + Al(OH)3 → Al(NO3)3 + KOH28. 硝酸铜和氧气反应的离子方程式是什么?2Cu(NO3)2 + O2 → 2CuO + 4NO229. 硝酸银和氢氧化铜反应的离子方程式是什么?AgNO3 + Cu(OH)2 → Cu(NO3)2 + AgOH30. 碳酸钠和氯化铜反应的离子方程式是什么?Na2CO3 + CuCl2 → CuCO3 + 2NaCl31. 碳酸钙和氯化铜反应的离子方程式是什么?CaCO3 + CuCl2 → CuCO3 + CaCl232. 碳酸铜和硝酸银反应的离子方程式是什么?CuCO3 + 2AgNO3 → Cu(NO3)2 + 2AgCO333.(NH4)2CO3 + 3O2 → 2CO2 + 2H2O + 2N234. 碳酸铜和氢氧化铝反应的离子方程式是什么?CuCO3 + 2Al(OH)3 → Cu(OH)2 + Al2(CO3)335. 碳酸钠和硝酸银反应的离子方程式是什么?Na2CO3 + 2AgNO3 → 2NaNO3 + Ag2CO336. 碳酸钾和氯化镁反应的离子方程式是什么?K2CO3 + MgCl2 → MgCO3 + 2KCl37. 碳酸钙和碘化钠反应的离子方程式是什么?CaCO3 + 2NaI → CaI2 + Na2CO338. 碳酸铜和氯化钾反应的离子方程式是什么?CuCO3 + 2KCl → CuCl2 + K2CO339. 碳酸铵和氯化铵反应的离子方程式是什么?(NH4)2CO3 + 2NH4Cl → 2NH3 + 2H2O + 2CO2 + 2NH4Cl 40. 硫酸铜和氧气反应的离子方程式是什么?2CuSO4 + O2 → 2CuO + 2SO2 + 2O241. 碳酸铜和氢氧化钙反应的离子方程式是什么?CuCO3 + Ca(OH)2 → Cu(OH)2 + CaCO342. 碳酸铵和氯化铜反应的离子方程式是什么?(NH4)2CO3 + CuCl2 → CuCO3 + 2NH4Cl43. 碳酸铜和盐酸反应的离子方程式是什么?CuCO3 + 2HCl → CuCl2 + CO2 + H2O44.2CuCO3 + O2 → 2CuO + 2CO245. 硫酸铜和氢氧化钠反应的离子方程式是什么?CuSO4 + 2NaOH → Cu(OH)2 + Na2SO446. 碳酸钙和碘化铵反应的离子方程式是什么?CaCO3 + 2NH4I → CaI2 + (NH4)2CO347. 碳酸铜和硫酸钠反应的离子方程式是什么?CuCO3 + Na2SO4 → CuSO4 + Na2CO348. 硝酸银和氢氧化铝反应的离子方程式是什么?AgNO3 + Al(OH)3 → AgOH + Al(NO3)349. 碳酸钾和硝酸铜反应的离子方程式是什么?K2CO3 + Cu(NO3)2 → CuCO3 + 2KNO350. 碳酸钙和氯化钾反应的离子方程式是什么?CaCO3 + 2KCl → CaCl2 + K2CO351. 碳酸铵和氢氧化铜反应的离子方程式是什么?(NH4)2CO3 + Cu(OH)2 → CuCO3 + 2NH3 + 2H2O 52. 碳酸钠和硫酸铝反应的离子方程式是什么?Na2CO3 + Al2(SO4)3 → Al2(CO3)3 + 3Na2SO4 53. 碳酸铜和氢氧化镁反应的离子方程式是什么?CuCO3 + Mg(OH)2 → Cu(OH)2 + MgCO354. 碳酸铜和氯化铜反应的离子方程式是什么?CuCO3 + CuCl2 → Cu2CO3Cl255.CuCO3 + Fe(OH)3 → Cu(OH)2 + Fe2(CO3)356. 硫酸铜和氢氧化铁反应的离子方程式是什么?CuSO4 + Fe(OH)3 → Cu(OH)2 + Fe2(SO4)357. 碳酸铵和氧气反应的离子方程式是什么?2(NH4)2CO3 + 3O2 → 2CO2 + 2H2O + 4NH3 58. 碳酸铜和氯化铁反应的离子方程式是什么?CuCO3 + 2FeCl3 → CuCl2 + Fe2(CO3)359. 硝酸铜和氢氧化镁反应的离子方程式是什么?Cu(NO3)2 + Mg(OH)2 → Cu(OH)2 + Mg(NO3)2 60. 碳酸钠和硫酸铁反应的离子方程式是什么?Na2CO3 + FeSO4 → FeCO3 + Na2SO461. 碳酸铜和氢氧化铜反应的离子方程式是什么?CuCO3 + Cu(OH)2 → Cu2CO3(OH)262. 碳酸钠和硫酸铜反应的离子方程式是什么?Na2CO3 + CuSO4 → CuCO3 + Na2SO463. 碳酸铜和氯化汞反应的离子方程式是什么?CuCO3 + 2HgCl2 → CuCl2 + Hg2(CO3)264. 碳酸钾和氢氧化铝反应的离子方程式是什么?K2CO3 + 2Al(OH)3 → Al2(CO3)3 + 6H2O + 2KOH 65. 碳酸铜和氢氧化钡反应的离子方程式是什么?CuCO3 + Ba(OH)2 → Cu(OH)2 + BaCO366.67. 硝酸铜和氢氧化钾反应的离子方程式是什么?Cu(NO3)2 + 2KOH → Cu(OH)2 + 2KNO368. 碳酸铜和氢氧化银反应的离子方程式是什么?CuCO3 + 2AgOH → Cu(OH)2 + Ag2CO369. 碳酸铜和氯化铝反应的离子方程式是什么?CuCO3 + 2AlCl3 → CuCl2 + Al2(CO3)370. 碳酸钠和氯化汞反应的离子方程式是什么?Na2CO3 + HgCl2 → HgCO3 + 2NaCl71. 碳酸铜和氢氧化铁反应的离子方程式是什么?CuCO3 + 2Fe(OH)3 → Cu(OH)2 + Fe2(CO3)372. 碳酸钾和氢氧化钠反应的离子方程式是什么?K2CO3 + 2NaOH → 2KOH + Na2CO373. 碳酸铜和氯化铁反应的离子方程式是什么?CuCO3 + 2FeCl2 → CuCl2 + Fe2(CO3)374. 碳酸铜和氢氧化镁反应的离子方程式是什么?CuCO3 + Mg(OH)2 → Cu(OH)2 + MgCO375. 碳酸铜和氯化铜反应的离子方程式是什么?CuCO3 + CuCl2 → Cu2CO3Cl276. 碳酸铵和氢氧化铝反应的离子方程式是什么?(NH4)2CO3 + 2Al(OH)3 → Al2(CO3)3 + 6H2O + 2NH3 77.。
高中化学离子反应及其练习

高中化学离子反应及其练习核心知识点一、离子反应与离子方程式1.离子反应(1)电解质在溶液中反应的实验探究按下图所示完成实验,并回答问题:①图甲实验的现象是无明显变化,因为溶液K+、Cl-、Na +、SO42—相互之间不发生化学反应。
②图乙实验的现象是有白色沉淀生成,其原因是溶液中Ba2+与SO42—结合生成硫酸钡。
③结论:电解质在溶液中的反应实质是离子之间的反应。
(2)离子反应:离子参与或产生的化学反应。
2.离子反应方程式(1)离子反应通常用离子方程式表示。
离子方程式是用实际参与反应的离子符号来表示反应的公式。
(2)离子方程式的书写步骤以氯化钡和硫酸钠在溶液中反应为例:①写:化学方程式(必须根据实验事实)BaCl2+Na2SO4===BaSO4↓+2NaCl;②拆:把易溶于水、易电离的物质拆成离子的形式2Na++SO42—+Ba2++2Cl-===BaSO4↓+2Na++2Cl-;③删:删去方程式两边不参加反应的离子SO42—+Ba2+===BaSO4↓;④查:检查方程式两边各元素的原子个数和电荷总数是否相等、反应条件、沉淀符号、气体符号等。
(3)书写下列反应的离子方程式:①NaOH溶液与稀硫酸:OH-+H+===H2O;②KOH溶液与稀盐酸:OH-+H+===H2O;③BaCl2溶液与稀硫酸溶液:Ba2++SO42—===BaSO4↓;④Ba(NO3)2溶液与硫酸钠溶液:Ba2++SO42—===BaSO4↓;⑤碳酸钠与稀硫酸:CO32—+2H+===CO2↑+H2O⑥碳酸钙与稀盐酸:CaCO3+2H+===Ca2++CO2↑+H2O。
【归纳总结】(1)书写步骤:“写(基础)→拆(关键)→删(途径)→查(保证)”。
(2)书写关键:①要将易溶于水、易电离的电解质写成离子的形式;②单质、沉淀、气体、难电离的物质(如水、弱酸、弱碱)等写成化学式。
【深度思考】(1)以H++OH-===H2O为例说明离子方程式表示的意义是什么?提示①表示某一个具体的化学反应,如NaOH+HCl===NaCl +H2O。
高一化学离子方程式的书写及正误判断试题

高一化学离子方程式的书写及正误判断试题1.能正确表示下列反应的离子方程式的是()A.向澄清的石灰水中通入SO2气体:Ca2++SO2====CaSO3↓B.过量SO2气体通入氢氧化钠溶液中:SO2+OH-====HSC.SO2气体通入溴水中:SO2+Br2+H2O====2H++2Br-+SD.氢硫酸中通入氯气:S2-+Cl2====S↓+2Cl-【答案】B【解析】向澄清的石灰水中通入SO2气体,反应的化学方程式是SO2(少量)+Ca(OH)2====CaSO3↓+H2O,对应的离子方程式是Ca2++2OH-+SO2====CaSO3↓+H2O,A不正确;过量SO2气体通入氢氧化钠溶液中,反应的化学方程式是SO2+NaOH====NaHSO3,对应的离子方程式是SO2+OH-====HS,B正确;SO2气体通入溴水中,反应的化学方程式是SO2+Br2+2H2O====2HBr+H2SO4,对应的离子方程式是SO2+Br2+2H2O====4H++2Br-+S,C不正确;氢硫酸中通入氯气,反应的化学方程式是H2S+Cl2====S↓+2HCl,对应的离子方程式是H2S+Cl2====S↓+2H++2Cl-,D不正确。
【考点】二氧化硫的性质和作用2.(10分)已知反应:3NO2+H2O==2HNO3+NO,回答下列问题:(1)该反应的离子方程式为。
(2)氧化剂与还原剂的质量比为,氧化产物与还原产物的物质的量之比为。
(3)在标准状况下,3.36L NO2与H2O完全反应转移的电子数目为。
(4)写出HNO3与石灰水反应的离子方程式。
【答案】(10分,每空2分)(1)3NO2+H2O==2H++2NO3-+NO (2分)(2)1:2 2:1 (4分) (3)0.1mol (2分)(4)(5)H++OH-=H2O (2分)【解析】(1)NO2和H2O和NO均为氧化物,不能改写成离子形式,硝酸是强酸,要改写成离子形式,故为:3NO2+H2O==2H++2NO3-+NO ;(2)NO2中的氮元素有的变成了+5,有的变成了+2,故二氧化氮既做氧化剂,又做还原剂,3mol的NO2中有2mol化合价升高,被氧化,做还原剂,1mol化合价降低,做氧化剂,故氧化剂和还原剂的质量比为1:2,氧化产物是2mol硝酸时,生成1mol的还原产物NO,故物质的量之比为:2:1;(3)标准状况下的体积除以22,4mol/L得物质的量为0.15mol,其中有0,1mol化合价升高成+5价,失去0.1mol电子,故转移电子数目为0.1mol;(4)硝酸和石灰水反应的实质是强酸与强碱发生的酸碱中和反应,故为:H++OH-=H2O。
高一必修1期中化学方程式以及离子方程式书写试题及答案

高一必修1期中化学方程式以及离子方程式书写试题及答案化学方程式以及离子方程式班级____ _ 姓名 _________ 注意:第一步、写出各化学方程式第二步、标出氧化还原反应的化合价变化,并指出氧化剂、还原剂第三步、能写出离子方程式的请写出。
1、铜丝在氯气中剧烈燃烧(棕色烟)之后加水,可得蓝色溶液 2、Cl2 通入溴化钠溶液3、Cl2 通入碘化钠溶液4、Cl2 与金属钠反应8、次氯酸见光分解(次氯酸:强氧化剂、杀菌消毒,漂白剂)9、工业制漂白粉的原理及漂白粉的失效10、氯气的实验室制法:(仪器:分液漏斗,圆底烧瓶)11、钠在空气中燃烧(黄色的火焰)12、钠块在空气中变暗Na2O在空气中加热(变黄)5、铁在氯气中剧烈燃烧(棕红色烟)13、钠与水反应(浮、熔、游、响、红)6、氢气在氯气中燃烧(苍白色火焰瓶口有白雾)14、过氧化钠与水的反应7、氯气溶于水(放热反应、Na2O2是强氧化剂,用于漂白)新制氯水中含+离子:H 、Cl 、ClO 、OH---15、碱性氧化物Na2O与水的反应第 1 页共 4 页分子:Cl2、HClO、H2O16、过氧化钠可用在呼吸面具和潜水艇中供氧 25、锌和稀硫酸17、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液②纯碱溶液中滴加盐酸,至过量18、小苏打受热分解19、铁在氯气中加热反应26、镁和稀硫酸27、锌和硫酸铜溶液反应:28、硫酸和氢氧化钾反应:29、澄清石灰水变浑浊应用CO2检验20、镁在二氧化碳中燃烧21、铁与盐酸反应22、氧化铁溶于盐酸中23、氯化铁中滴入氢氧化钠溶液(红褐色沉淀)24、一氧化碳还原氧化铜:31、硝酸银与氯化钠32、碳酸钙与盐酸反应,反应产生的气体通入澄清石灰水 30、氯化钡与硫酸钠第 2 页共 4 页化学方程式以及离子方程式班级____ _ 姓名 _________ 注意:第一步、写出各化学方程式第二步、标出氧化还原反应的化合价变化,并指出氧化剂、还原剂第三步、能写出离子方程式的请写出。
高一化学离子方程式书写练习含答案2015-10

高一化学离子方程式书写练习2015/10/16 1.硝酸银与盐酸及可溶性盐酸盐溶液Ag++Cl-=AgCl↓2.碳酸氢盐溶液与强酸溶液混合HCO3-+H+=CO2↑+H2O3.碳酸氢盐溶液与醋酸溶液混合HCO3-+CH3COOH=CO2↑+H2O+CH3COO-4.过量氢氧化钙溶液与碳酸氢镁2Ca2++4OH-+2HCO3-+Mg2+=Mg(OH)2↓+2CaCO3↓+2H2O5.向碳酸氢钙溶液中加入过量的氢氧化钠2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–6.向碳酸氢钙溶液中加入少量的氢氧化钠Ca2++HCO3-+OH–=CaCO3↓+H2O7.澄清石灰水与少量小苏打溶液混合Ca2++OH–+HCO3-=CaCO3↓+H2O8.澄清石灰水通入少量CO2Ca2++2OH–+CO3=CaCO3↓+H2O9.澄清石灰水通入过量CO2OH–+CO2=HCO3-10.碳酸氢钠溶液与少量石灰水反应Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O11.碳酸氢钠溶液与过量石灰水反应HCO3-+OH–+Ca2+=CaCO3↓+H2O12.碳酸钠溶液与盐酸(少量或过量)反应CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O13.向氢氧化钠溶液中通入少量的CO2CO2+2OH–=CO32–+H2O14.过量的CO2通入氢氧化钠溶液中CO2+OH–=HCO3-15.碳酸氢铵溶液中加入过量氢氧化钠溶液NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O16.碳酸钙与盐酸反应CaCO3+2H+=Ca2++CO2↑+H2O17.碳酸钙与醋酸反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O 18.澄清石灰水与稀盐酸反应H++OH–=H2O19.磷酸溶液与少量澄清石灰水H3PO4+OH–=H2O+H2PO4–20.磷酸溶液与过量澄清石灰水2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O21.碳酸镁溶于强酸MgCO3+2H+=Mg2++CO2↑+H2O22.硫酸溶液跟氢氧化钡溶液反应Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O23.硫酸氢钠溶液与氢氧化钡反应至中性2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓24.硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀H++SO42–+OH–+Ba2+=BaSO4↓+H2O25.氢氧化镁与稀硫酸反应Mg(OH)2+2H+=Mg2++2H2O26.氯化铝溶液中加入过量氨水Al3++3NH3·H2O=Al(OH)3↓+3NH4+27.氧化铝溶于强酸溶液Al2O3+6H+=2Al3++3H2O28.金属铁溶于盐酸中Fe+2H+=Fe2++H2↑29.硫化亚铁与盐酸反应FeS+H+=Fe2++H2S↑30.硫化钠与盐酸反应S2–+2H+=H2S↑31.氯化铁溶液与氢氧化钠溶液反应Fe3++3OH–=Fe(OH)3↓32.氯化铁溶液跟过量氨水反应Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+33.锌与稀硫酸Zn+2H+=Zn2++H2↑34.锌与醋酸Zn+2CH3COOH=CH3COO–+Zn2++H2↑35.四氧化三铁溶于浓盐酸Fe3O4+8H+=2Fe3++Fe2++4H2O36.氧化铁溶于盐酸Fe2O3+6H+=2Fe3++3H2O37.用氨水吸收少量SO2SO2+2NH3+H2O=2NH4++SO32-38.用氨水吸收过量的SO2SO2+NH3+H2O=NH4++HSO3-39.氯化铵与氢氧化钠两种浓溶液混合加热NH4++OH-NH3↑+H2O40.用碳酸钠溶液吸收过量SO2CO32-+H2O+2SO2=CO2↑+2HSO3-41.硫酸铜溶液中通入硫化氢H2S+Cu2+=CuS↓+2H+42.硫酸铜溶液中加入硫化钠溶液S2-+Cu2+=CuS↓溶于水3NO2+H2O=2H++NO3-+NO↑44.醋酸钡溶液与硫酸反应Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH45.醋酸与氢氧化钾溶液反应CH3COOH+OH-=CH3COO-+H2O46.醋酸与氨水反应CH3COOH+NH3·H2O=CH3COO-+NH4++2H2O47.硫酸铜溶液中加入氢氧化钠溶液Cu2++2OH-=Cu(OH)2↓48.硫酸铜溶液中加入少量氨水Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+49.等物质的量氢氧化钡溶液与碳酸氢铵溶液混合Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3·H2O50.相同物质的量浓度的硫酸铝钾和氢氧化钡溶液按体积比2:3混合反应2Al3++3SO42-+6OH-+3Ba2+=2Al(OH)3 ↓+ 3BaSO4↓。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学离子方程式书写
练习含答案
The Standardization Office was revised on the afternoon of December 13, 2020
高一化学离子方程式书写练习2015/10/16
1.硝酸银与盐酸及可溶性盐酸盐溶液
Ag++Cl-=AgCl↓
2.碳酸氢盐溶液与强酸溶液混合
HCO
3-+H+=CO
2
↑+H
2
O
3.碳酸氢盐溶液与醋酸溶液混合
HCO
3-+CH
3
COOH=CO
2
↑+H
2
O+CH
3
COO-
4.过量氢氧化钙溶液与碳酸氢镁
2Ca2++4OH-+2HCO
3-+Mg2+=Mg(OH)
2
↓+2CaCO
3
↓+2H
2
O
5.向碳酸氢钙溶液中加入过量的氢氧化钠
2HCO
3-+Ca2++2OH–=CaCO
3
↓+2H
2
O+CO
3
2–
6.向碳酸氢钙溶液中加入少量的氢氧化钠
Ca2++HCO
3-+OH–=CaCO
3
↓+H
2
O
7.澄清石灰水与少量小苏打溶液混合
Ca2++OH–+HCO
3-=CaCO
3
↓+H
2
O
8.澄清石灰水通入少量CO
2
Ca2++2OH–+CO
3=CaCO
3
↓+H
2
O
9.澄清石灰水通入过量CO
2
OH–+CO
2=HCO
3
-
10.碳酸氢钠溶液与少量石灰水反应
Ca2++2OH–+2HCO
3-=CaCO
3
↓+CO
3
2–+2H
2
O
11.碳酸氢钠溶液与过量石灰水反应
HCO
3-+OH–+Ca2+=CaCO
3
↓+H
2
O
12.碳酸钠溶液与盐酸(少量或过量)反应
CO
32–+H+=HCO
3
-或CO
3
2–+2H+=CO
2
↑+H
2
O
13.向氢氧化钠溶液中通入少量的CO
2
CO
2+2OH–=CO
3
2–+H
2
O
14.过量的CO
2
通入氢氧化钠溶液中
CO
2+OH–=HCO
3
-
15.碳酸氢铵溶液中加入过量氢氧化钠溶液
NH
4++HCO
3
-+2OH–=NH
3
↑+CO
3
2–+2H
2
O
16.碳酸钙与盐酸反应
CaCO
3+2H+=Ca2++CO
2
↑+H
2
O
17.碳酸钙与醋酸反应
CaCO
3+2CH
3
COOH=Ca2++2CH
3
COO-+CO
2
↑+H
2
O
18.澄清石灰水与稀盐酸反应
H++OH–=H
2
O
19.磷酸溶液与少量澄清石灰水
H
3PO
4
+OH–=H
2
O+H
2
PO
4
–
20.磷酸溶液与过量澄清石灰水
2H
3PO
4
+3Ca2++6OH–=Ca
3
(PO
4
)
2
↓+6H
2
O
21.碳酸镁溶于强酸
MgCO
3+2H+=Mg2++CO
2
↑+H
2
O
22.硫酸溶液跟氢氧化钡溶液反应
Ba2++2OH–+2H++SO
42–=BaSO
4
↓+2H
2
O
23.硫酸氢钠溶液与氢氧化钡反应至中性
2H++SO
42–+2OH–+Ba2+=2H
2
O+BaSO
4
↓
24.硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀
H++SO
42–+OH–+Ba2+=BaSO
4
↓+H
2
O
25.氢氧化镁与稀硫酸反应
Mg(OH)
2+2H+=Mg2++2H
2
O
26.氯化铝溶液中加入过量氨水
Al3++3NH
3·H
2
O=Al(OH)
3
↓+3NH
4
+
27.氧化铝溶于强酸溶液
Al
2O
3
+6H+=2Al3++3H
2
O
28.金属铁溶于盐酸中
Fe+2H+=Fe2++H
2
↑
29.硫化亚铁与盐酸反应
FeS+H+=Fe2++H
2
S↑
30.硫化钠与盐酸反应
S2–+2H+=H
2
S↑
31.氯化铁溶液与氢氧化钠溶液反应
Fe3++3OH–=Fe(OH)
3
↓
32.氯化铁溶液跟过量氨水反应
Fe3++3NH
3·H
2
O=Fe(OH)
3
↓+3NH
4
+
33.锌与稀硫酸Zn+2H+=Zn2++H
2
↑34.锌与醋酸
Zn+2CH
3COOH=CH
3
COO–+Zn2++H
2
↑
35.四氧化三铁溶于浓盐酸
Fe
3O
4
+8H+=2Fe3++Fe2++4H
2
O
36.氧化铁溶于盐酸
Fe
2O
3
+6H+=2Fe3++3H
2
O
37.用氨水吸收少量SO
2
SO
2+2NH
3
+H
2
O=2NH
4
++SO
3
2-
38.用氨水吸收过量的SO
2
SO
2+NH
3
+H
2
O=NH
4
++HSO
3
-
39.氯化铵与氢氧化钠两种浓溶液混合加热
NH
4++OH-NH
3
↑+H
2
O
40.用碳酸钠溶液吸收过量SO
2
CO
32-+H
2
O+2SO
2
=CO
2
↑+2HSO
3
-
41.硫酸铜溶液中通入硫化氢
H
2
S+Cu2+=CuS↓+2H+
42.硫酸铜溶液中加入硫化钠溶液S2-+Cu2+=CuS↓
溶于水
3NO
2+H
2
O=2H++NO
3
-+NO↑
44.醋酸钡溶液与硫酸反应
Ba2++2CH
3COO-+2H++SO
4
2-=BaSO
4
↓+2CH
3
COOH
45.醋酸与氢氧化钾溶液反应
CH
3COOH+OH-=CH
3
COO-+H
2
O
46.醋酸与氨水反应
CH
3COOH+NH
3
·H
2
O=CH
3
COO-+NH
4
++2H
2
O
47.硫酸铜溶液中加入氢氧化钠溶液Cu2++2OH-=Cu(OH)
2
↓
48.硫酸铜溶液中加入少量氨水
Cu2++2NH
3·H
2
O=Cu(OH)
2
↓+2NH
4
+
49.等物质的量氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH–+NH
4++HCO
3
-=BaCO
3
↓+H
2
O+NH
3
·H
2
O
50.相同物质的量浓度的硫酸铝钾和氢氧化钡溶液按体积比2:3混合反应
2Al3++3SO
42-+6OH-+3Ba2+=2Al(OH)
3
↓+3BaSO
4
↓。
