乙炔1(PPT)4-4
有机化学 第四章 炔烃
R-C
C-Na + NH3↑
R-C≡C-Na + R/X R/X/
6、聚合反应
Cu2Cl2 2 CH CH NH Cl H2O CH2 CH 4
CH CH CH2 CH Cu2Cl2 NH 4Cl H 2O
C CH
C
C CH CH2
增碳
例: 以乙炔为原料合成下列化合物: (1)Z-3-己烯; (3)醋酸乙烯脂; (2)E-3-己烯;
2) 和卤化氢加成
RC
注:
CH
HX
HgCl2
R
C X
CH2 HX
HgCl2
R
X C X
CH3
① 反应可以停留在卤代烯烃阶段; ② 在催化剂汞盐或铜盐存在时,叁键与HX反应 活性比双键大; ③ 不对称炔烃与HX加成符合马氏规则,对于HBr 有过氧化物效应。
3) 和水加成
RC CH + H2O
HgSO4 H 2SO4 ) (稀
5 4 3 2 1
CH3-CH = CH-C
CH
3-戊烯-1-炔
(不叫 2-戊烯-4-炔)
如对称,优先考虑双键。
HC CCHCH=CH 2 CH 3
6 5 4 3 2 1
3-甲基-1-戊烯-4-炔
HC C-CH2-CH2-CH=CH2
1-己烯-5-炔
§4.3 物理性质(自学) §4.4 化学性质 1、氢化反应 1)催化氢化
RC CR' + H2
催化加氢反应活性:炔烃>烯烃
Ni(Pt , Pd)
RCH
CHR'
Ni(Pt, Pd)
H2
RCH2CH2R'
RC
乙炔_乙炔
化学 性质
二、乙炔的性质
物理性质
乙炔为无色、无味的气体, 密度比空气略小,微溶于水,易 溶于有机溶剂。
化学性质
(A)氧化反应:
(1)被氧气氧化:
甲烷、乙烯、乙炔的燃烧
淡蓝色火焰
火焰明亮 带有黑烟
火焰很明亮带 有浓烈黑烟
实验现象:火焰很明亮,带有浓烈黑烟 完全燃烧方程式:
2C2H2+5O2 点燃 4CO2+2H2O
观察分析上面的热化学方程式,并思考生产中 为什么常用氧炔焰来切割或焊接金属,而不用 氧烷焰或氧烯焰呢?
乙炔完全燃烧所需氧的物质的量最少,生成水的 物质的量也最少,因此燃烧时用以提高氧温度以 及水气化所消耗的反应热也最少,所以乙炔火焰 温度最高。
(2)被酸性KMnO4溶液氧化。
2KMnO4 + 3H2SO4 + C2H2 → 2MnSO4 + K2SO4 + 2CO2 + 4H2O
b.与H2加成
催化剂
CHCH + H2
CH2=CH2 + H2
催化剂
CH2=CH2
CH3CH3
c.与HCl加成
CHCH + HCl nCH2 = CHCl
催化剂
CH2= CHCl
氯乙烯
催化剂
加温、加压
CH2CH
n
Cl
聚氯乙烯
聚乙烯:用聚乙烯薄膜做成塑料袋是无毒的,可
以用来盛装食物,只是强度差些,且不能经受80℃ 以上的高温,并有一定的透气性,不宜长期用来盛 装茶叶、香料等。
四、乙炔的用途
1、乙炔燃烧时产生的氧炔焰可用来切割或 焊接金属。 2、 乙炔是一种重要的基本有机原料,可 以用来制备氯乙烯、 聚氯乙烯和乙醛等。
第4章 炔烃

O
HC
CH + CH3C
OH
Zn(OAc)2/活性炭 170~230 °C
O H2C CH O CCH3
乙酸乙烯酯
二、聚合反应 乙炔也能聚合。在不同条件下乙炔可生成链状的二聚
物或三聚物,也可生成环状的三聚物或四聚物。
乙炔的二聚物与氯化氢加成,得到2-氯-1,3-丁二烯 。是合成氯丁橡胶的单体。
三、氧化反应 与C=C双键相似,C≡C三键也被高锰酸钾烟花。
最终的产物是二氧化碳(C≡C三键断裂),高锰酸钾被 乙炔还原生成棕色的二氧化锰沉淀。
如果是非末端炔烃,氧化的最终产物是羧酸(C≡C三键 断裂)。如:
“十二五”职业教育国家规划教材修订版
有机化学
(第六版)
高职高专化学教材编写组 编
Organic Chemistry
第四章 炔 烃
“十二五”职业教育国家规划教材修订版
主要内容
炔烃的通式、同分异构和命名; 炔烃的结构; 炔烃的物理性质; 炔烃的化学性质; 炔烃的制法。
学习目标
了解炔烃的制备方法及炔烃的物理性质; 了解不同杂化状态碳原子电负性的比较; 理解碳原子sp杂化及直线形的空间构型; 理解炔烃的结构; 掌握炔烃的同分异构现象; 掌握炔烃的命名、烯炔的命名; 掌握炔烃的化学性质及其应用。
CH3-CH=CH-C CH
3-戊烯-1-炔 (不叫2-戊烯-4-炔)
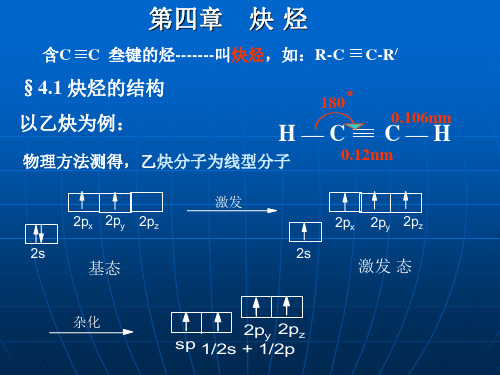
第二节 炔烃的结构
一、乙炔的结构 乙炔(CH≡CH)分子是一个直线形结构,四个原子
都排布在同一直线上。X-光衍射和电子衍射等物理方法 测定,分子中各键的键长与键角如下式所示:
人教版(2019)高中化学选择性必修3第二章烃第二节烯烃第2课时 炔烃

鉴别
溴的四氯化碳溶液褪色;酸性 KMnO4 溶液褪色
目录
1.下列关于炔烃的描述正确的是
( A)
A.分子里含有碳碳三键的不饱和链烃叫炔烃
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色
解析:B中,例如1-丁炔中所有碳原子就不在同一直线上,是折线形;C中,
目录
2.如图中的实验装置可用于制取乙炔。请填空:
(1)图中A管的作用是__调__节__水__面__高__度__以__控__制__反__应__ 的__发__生__和__停__止___,制取乙炔的化学方程式是_____ __C_a_C_2_+__2_H__2O__―__→__C_a_(_O__H_)_2+__C__2_H_2_↑______,为避 免反应太迅速,可采取的措施为_把__水__换__成__饱__和__ _食__盐__水__。
目录
3.此实验中CuSO4溶液的作用是什么?写出反应的化学方程式。 提示:CuSO4溶液的作用是除去H2S等杂质。反应的化学方程式为CuSO4 +H2S===CuS↓+H2SO4。
4.乙炔通入酸性KMnO4溶液和溴的CCl4溶液发生反应的类型分别是什么? 提示:氧化反应、加成反应。
目录
实验室制取乙炔的注意事项 (1)用试管作反应容器制取乙炔时,由于CaC2和水反应剧烈并产生泡沫,为防
炔烃易发生加成反应难发生取代反应;D中,炔烃既能使溴水褪色,也可
以使酸性高锰酸钾溶液褪色。
目录
2.含有一个碳碳三键的炔烃,氢化后得到的烷烃结构式为
,此炔烃可能有的结构简式有 ( B )
A.1种
B.2种
C.3种
必修乙炔炔烃

3)可用简易装置代替,但在导管口应放一团棉 花,避免泡沫从导管中喷出。
Ca2+
C C
2
5、除杂 电石中含有少量硫化钙、砷化钙、磷化钙等杂 质,与水作用时生成H2S、PH3、AsH3等气体 使乙炔有恶臭味。 方法:通常将气体通过CuSO4溶液除去H2S和 PH3,再通过碱石灰除去水蒸气。 了解:电石工业制法-生石灰和焦炭在电炉中高 温反应 高温 CaCO3 CaO + CO2
CaO + 3C
电炉
CaC2 + CO
反应原理: CaC2+2H—OH C2H2↑+Ca(OH)2 +127KJ
练:CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都 同属离子型碳化物,请通过对CaC2制C2H2的 反应进行思考,从中得到必要的启示,写出下 列反应的产物:
A.ZnC2水解生成: C2H2
△
(低聚)
烃 烷 烃
结构特点
通
式
不饱和度
仅含“C—C” 链状
CnH2n+2 (n≥1) CnH2n (n≥2) 1
烯 烃
含一个“C= C” 单烯烃 链状 二烯烃 环烷烃 炔 烃 含二个“C= C” 链状 仅含“C—C” 环状 含“C≡ C” 链状
CnH2n -2 (n≥3) CnH2n (n≥3)
(3)一定条件下与HX加成
催化剂 CH CH HCl CH 2 CHCl
nCH 2 CHCl — CH 2 — CH — n 聚氯乙烯 加压 | Cl (4)与HCN加成生成丙烯腈
催化剂
催化剂 CH CH HCN CH 2 CH — CN (丙烯腈)
高二化学第四节 乙炔炔烃1

嘴哆市安排阳光实验学校高二化学第四节 乙炔 炔烃人教版【本讲教育信息】 一. 教学内容:第四节 乙炔 炔烃 二. 教学目标:1. 了解乙炔的重要化学性质和主要用途2. 了解炔烃的结构特征、通式和主要性质 三. 教学重点、难点:乙炔的重要性质 四. 知识分析: 1. 乙炔的结构分子式为22H C 、结构式为H C C H -≡-、结构简式为CH HC ≡、电子式为C H :⋅⋅⋅⋅⋅⋅H C :。
乙炔是直线型分子,键角为︒180,属非极性分子。
2. 乙炔的物理性质纯的乙炔是无色、无味的气体,密度比空气略小,微溶于水,易溶于有机溶剂。
3. 乙炔的化学性质(1)氧化反应:−−→−+点燃22252O H C O H CO 2224+,还可使酸性4KMnO 溶液褪色。
(2)加成反应:CHCl nCH =2−−−→−催化剂---n CHCl CH ][2。
(3)加聚反应:−→−≡FeCH CH3,CH nCH ≡−−−→−催化剂---=n CH CH ][。
4. 乙炔的实验室制法(1)药品:电石与饱和食盐水(2)原理:↑≡+−→−+CH CH OH Ca O H CaC 222)(2 (3)装置:固+液−→−气(有别于制氢气的装置) (4)收集:排水集气法 5. 炔烃(1)概念:分子里含有碳碳叁键的一类链烃,其通式为22-n n H C (2≥n )。
(2)物理性质:炔烃的物理性质一般随着分子里碳原子数的增多而呈现规律性的变化,如沸点随碳原子数的增加而升高,相对密度逐渐增大。
(3)化学性质:与乙炔相似。
能发生:① 氧化反应;② 加成反应;③ 加聚反应。
(4)完全燃烧的化学方程式:222213O n H C n n -+-−−→−点燃O H n nCO 22)1(-+ 6. 烷烃、烯烃、炔烃含碳质量分数的计算及变化规律7. 甲烷、乙烯、乙炔燃烧的对比 (1)化学方程式(完全燃烧) (2)燃烧现象甲烷、乙烯、乙炔的燃烧现象甲烷乙烯乙炔含碳质量分数75%85.7%92.3%火焰亮度淡蓝色火焰,不明亮明亮更明亮火焰伴烟量无烟有黑烟有浓烈的黑烟8. 乙烷、乙烯、乙炔分子结构和化学性质的比较乙烷乙烯乙炔分子式62H C 42H C 22H C结构式H HH C C H HH ---||H C HC H H -=-H C C H -≡-电子式:H ..H C ......H C H :C H :⋅⋅⋅⋅⋅⋅H C :结构特点C C -(单键)碳原子的化合价达“饱和”C C =(双键)碳原子的化合价未达“饱和”C C ≡(叁键)碳原子的化合价未达“饱和”含碳质量分数 %80%1003024=⨯ %7.85%1002824=⨯ %2.92%1002624=⨯化学活动性稳定活泼活泼取代反应卤代乙烷乙烯 乙炔加成反应—溴水或溴的四氯化碳溶液褪色等溴水或溴的四氯化碳溶液褪色等加聚反应不能发生能发生能发生 氧化反应4KMnO 溶液)(+H 不褪色4KMnO 溶液)(+H 褪色4KMnO 溶液)(+H 褪色 燃烧火焰 较明亮 燃烧火焰明亮,带黑烟 燃烧火焰很明亮, 带浓烈的黑烟鉴别溴水不褪色或4KMnO 酸性溶液不褪色溴水褪色或4KMnO 酸性溶液褪色溴水褪色或4KMnO 酸性溶液褪色9. 气态烃完全燃烧的两个公式及妙用气态烃的分子式为n m H C ,{}4,3,2,1∈m ,则有:1体积气态烃完全燃烧生成液态水,总体积减少量必为:14+=∆-nV ① 1体积气态烃完全燃烧生成气态水,总体积增加量必为:14-=∆+nV ② (注:燃烧前后气体的温度、压强相同) 妙用一:由气态烃的体积,根据①,②式可得:-∆V=⎪⎭⎫⎝⎛+14n V 烃……①'+∆V ⎪⎭⎫⎝⎛-=14n V 烃……②'求完全燃烧前后总体积变化量。
第4章炔烃
HCl
CuCl NH4Cl HCl
CH2 CH C CH2 Cl
2-氯-1,3-丁二烯
16
三聚 四聚
3 CH CH Ni(CO)2 [Ph3P]2 苯
4 CH
CH
50
C
Ni(CO)2 ,1.5~2.0MPa
环己四烯
生成聚乙炔
催化剂
nCH CH
—CH=CH— n
聚乙炔
17
三、氧化
与烯烃相似,炔烃也可被氧化剂氧化,往往可以使叁键断裂, 最后得到完全氧化的产物——羧酸或二氧化碳。例如:
3CH CH + 10KMnO4 + 2H2O
6CO2+ 10KOH + 10MnO2
R—C
C—R' KMnO4
过量
R—COOH + R'—COOH
RCCR’
KMnO4(冷,稀,H2O,PH7-5)
OO RC CR
KMnO4(H2O,过量)
RCOOH + R’COOH
(1) O3 (2) H2O, Zn
炔烃的物理性质和烷烃、烯烃相似。低级的炔烃在常温常 压下是气体,但沸点比相同原子数的烯烃略高些。随着碳原子 数的增多,它们的沸点也升高。
炔烃不溶于水,但易溶于极性小的有机溶剂,如石油醚、 苯、乙醚、四氯化碳等。
纯的乙炔是无色、无臭味的气体。 液态乙炔受到震动会发生爆炸,所以在乙炔钢瓶中既要填 入多孔性物质,如硅藻土、石棉等,又要加入丙酮作为溶剂, 这样储存、运输、使用可以避免危险。 乙炔与空气组成的爆炸气体的组成范围比其他烃类要大的 多。在生产、使用时必须注意。
RCOOH + R’COOH
18
乙炔危害告知牌ppt

密闭空间使用需谨慎
在密闭空间内使用乙炔容易引发爆炸和火灾事故。
如需在密闭空间内使用乙炔,必须制定专门的安全措施,并 确保空间内通风良好,乙炔浓度得到有效控制。
05
乙炔泄漏应急处理
立即报警
发现乙炔泄漏后,立即拨打紧急电话报警。 提供泄漏地点、泄漏情况以及事故可能的影响,以便救援人员迅速采取行动。
切勿触动任何开关和按钮
发现乙炔泄漏后,不要试图通过触动任何开关或按钮来控制 泄漏。
避免产生火花或高温,以免引起燃烧或爆炸。
ቤተ መጻሕፍቲ ባይዱ
尽快离开现场
在确保安全的前提下,尽快离开泄漏现场。 不要使用电梯等通道,以免阻碍救援人员进入现场。
06
安全意识与培训
加强员工安全意识教育
定期开展安全意识教育活动, 向员工传达安全知识和法规要
加强个人防护
配备专门的防护用品,如防毒面具、防护手套、防护服等。 加强员工安全意识,正确使用个人防护用品。
定期检查和维护设备
对设备进行定期检查,确保其正常运转。
及时维修和更换损坏的设备,确保其性能良好。
使用安全的替代品
在可能的情况下,使用低毒或无毒的替代品代替乙炔。 选用更加环保、安全的工艺流程,减少乙炔的使用和产生。
其他应用
乙炔还可以用作消毒剂、麻醉剂、 制冷剂等。
02
乙炔的危害
对人体的危害
眼睛接触
可能导致眼睛刺激和化学性灼伤。
吸入
可能导致头晕、头痛、恶心、呕吐 、食欲不振、胸痛、咳嗽等症状。
皮肤接触
可能导致皮肤刺激和化学性灼伤。
吞食
可能导致消化系统损伤和中毒症状 。
对环境的危害
排放到空气中
可能导致温室效应和破坏臭氧 层。
炔烃ppt

目的: 目的:为防止产生的泡沫涌入导管。 纯净的乙炔气体是无色无味的气体。 ②纯净的乙炔气体是无色无味的气体。用电石 和水反应制取的乙炔,常闻到有恶臭气味, 和水反应制取的乙炔,常闻到有恶臭气味, 原因:电石中含有少量硫化钙、砷化钙、 原因:电石中含有少量硫化钙、砷化钙、磷化钙等
要点二
乙烯、 乙烯、乙炔的实验室制法
乙烯和乙炔实验室制法的比较 乙烯 CH3CH2OH 原理 CH2 反应装置 CH2↑+H2O 乙炔 CaC2+2H2O Ca(OH) Ca(OH)2+ HC≡CH↑
收集方法
排水集气法
排水集气法或向下 排空气法
①酒精与浓硫酸的体积比为1∶3; 酒精与浓硫酸的体积比为1∶3; 酒精与浓硫酸的混合方法: ②酒精与浓硫酸的混合方法:先 ①因反应放热且电石 易变成粉末, 在容器中加入酒精, 在容器中加入酒精,再沿器壁慢 易变成粉末,所以不 慢加入浓硫酸, 慢加入浓硫酸,边加边冷却边搅 能使用启普发生器或 其他简易装置; 其他简易装置; 拌; 实验注意 ③温度计的水银球应插入反应混 ②为了得到比较平缓 的乙炔气流,可用饱 的乙炔气流, 事项 合液的液面下; 合液的液面下; 和食盐水代替水; ④应在混合液中加几片碎瓷片防 和食盐水代替水; 止暴沸; 因反应太剧烈, 止暴沸; ③因反应太剧烈,可 应使温度迅速升至170℃; ⑤应使温度迅速升至170℃; 用分液漏斗控制滴水 的作用: ⑥浓H2SO4的作用:催化剂和脱 速度来控制反应速度 水剂 因电石中含有磷和硫 因酒精会被炭化, 因酒精会被炭化,且碳与浓硫酸 元素, 元素,与水反应会生 反应,则乙烯中会混有CO2、SO2 反应,则乙烯中会混有CO 等杂质, 成PH3和H2S等杂质, 等杂质,可用盛有NaOH NaOH溶液的洗 等杂质,可用盛有NaOH溶液的洗 可用硫酸铜溶液将其 气瓶将其除去 除去
炔烃的知识点总结

第四节 乙炔 炔烃●教学目的:1、 使学生了解乙炔的重要化学性质和主要用途。
2、 使学生了解乙炔的结构特征、通式和主要的性质。
3、培养学生的辨证唯物主义观。
●教学方法:探索推理法●教学重点:乙炔的化学性质。
●教学难点:乙炔的结构以及与化学性质的关系。
教学过程:[提问]对比乙烷、乙烯的结构,乙烯有一个双键,则氢原子数比乙烷少2个H 。
假设比C 2H 4再少2个H ,结构会怎样?应有一根三键。
(H —C ≡C —H )[结论]和烷烃相比,每有一个双键,氢原子就减少2个,每有一个三键,氢原子就减少4。
[提问] 设C n H m 分子中只有单双键,则该有多少个双键? 不饱和度: 222mn -+ == C 数+1—H 数/2, 如C 12H 12中最多有多少个双键?(7)一、乙炔的组成和结构:分子式:C 2H 2电子式:结构式:H —C ≡C —H 结构简式:CH ≡CH [展示]乙炔的球棍模型:直线型,键角180°[例题] CH 3—CH==CH —C ≡C —CF 3分子结构的下列叙述中,正确的是( B C ) A 、6个碳原子有可能都在一条直线上B 、6个碳原子不可能都在一条直线上C 、6个碳原子都在同一平面上D 、6解析:该物质空间结构可表示为:注:该物质并不是所有原子均共面,如—CH 3中的3个氢原子,—CF 3中的3个氟原子均类CH 4中氢原子,是空间的。
甲烷、乙烯、乙炔结构的比较C 中有两个键易断裂。
三键中一个为C —C δ键,两个为π键。
[提问]推测乙炔的性质和哪类物质类似?易发生哪些反应? [回答]类似烯烃,易发生加成、加聚、氧化反应。
[验证实验]1、乙炔通入酸性KMnO 4溶液中2、乙炔通入溴的CCl 4溶液中3、乙炔通入溴水中4、点燃乙炔气流二、乙炔的实验室制法:1、原料:电石(CaC 2中常含CaS 、Ca 3P 2)、饱和食盐水电石来源:CaCO 3==CaO + CO 2↑ CaO + 3C==CaC 2 + CO ↑(电炉中进行)2、反应原理:CaC 2 + 2H 2OCa(OH)2 + C 2H 2↑ 离子型碳化物,与水的反应相当于水解[解释]乙炔为无色、无味气体,常因含有H 2S 、PH 3等杂质而有特殊难闻的臭味。
有机化学课件(李景宁主编)第4章_炔烃和二烯烃

CH3 C CH
Br2
CH3 C CH Br Br
Br2
CH3
Br Br C CH Br Br
现象:溴的红棕色消失,用于检验烯烃、炔烃及其他含有碳碳 重键的化合物。
C
C
CH3 + Br2
C
Br +
C
CH3
Br-
C Br
C
Br CH3
反式加成
CH2 CH CH2 C CH + Br2
-20 C CCl4
其过程为自由基加成得反马式加成产物与水的加成烯醇式不稳定酮式稳定互变异构两种构造异构体处于相互转化的平衡中在转化tomerizm
作业
P98 2(1)(2)(3); 8; 14(6); 19. 11;
第四章 炔烃和二烯烃
alkyne and diene
AgNO3
6、聚合
TiCl4 Al(C2H5)3 聚乙炔类导电聚合物由日本化学家白川英树研 n HC CH CH CH 制成功,2000年获诺贝尔化学奖。顺式和反式 n
乙炔生产过程

1.清理除尘器 2.清理烟囱 3.检查吸入风管 4.处理系统漏点
5
粗破可逆皮带机下料口堆 料
下料口挡料皮带坏
及时更换挡料皮带
2.3.2 乙炔发生 2.3.2.1 生产原理
电石遇水发生如下反应: CaC2 + 2H2O —→ Ca(OH)2 + C2H2 + 130 kJ / mol 由于工业品电石含有不少杂质,在发生器水相中也同时进行一些副反应,生 成相应的pH3、H2S、NH3等杂质气体,其反应式如下: CaO + H2O —→ Ca(OH)2 CaS + 2H2O —→ Ca(OH)2 + H2S↑ Ca3P2 + 6H2O —→ 3Ca(OH)2 + 2pH3↑
爆炸极限:在空气中 2.3—81%(体积) 2.1.2.2 化学性质 化学性质活泼,极易燃烧和爆炸,易与多种物质发生化学反应。加热可 能聚合。是强还原剂,在光的作用下,与氧化剂、氟或氯猛烈反应,造成火 灾和爆炸危险。与铜、银和汞及它们的盐类反应,生成冲击敏感的乙炔化物。 2.1.2.3 物理危险性 与空气充分混合,容易生成爆炸性混合物。由于流动、搅动可产生静电 电荷。
和发生器底部间歇排出的浓渣混合后,由渣浆输送泵打至渣场浓缩沉淀并回
收清液。 从发生器顶部溢流的乙炔气通过渣浆分离器进入水洗塔用废次氯酸钠预
清净洗涤,然后经冷却塔用清水冷却后去水环压缩机压缩至约50KPa。压缩
后的乙炔气依次经过第一、第二清净塔,在清净塔内与0.08%—0.12%的次 氯酸钠溶液逆流接触除去硫、磷等杂质后再进入中和塔,用稀氢氧化钠溶液 中和清净过程中产生的酸性物质。中和后的乙炔气用5℃水冷却除水后,送至 混合脱水工序。
外观无色透明液体。NaOH最高允许浓度(大气中的):0.5
炔烃

步再与一个氢分子加成,生成烷烃。化学反应式如下:
下一页 返回
4.3 炔烃的化学性质
• 因此,炔烃氢化时,如选择适当的试剂,可以使产物停留在烯烃阶段。 工业上常用此方法来制造烯烃。例如:
• 这种炔烃氢化停留在烯烃阶段的反应称为部分氢化。选择一定的催化 剂,部分氢化还可以控制产物的构型。例如,用附在碳酸钙上的钯作 催化剂,并用醋酸铅进行处理使钯钝化(称为Lindlar催化剂), 可以获得顺式烯烃。
下一页 返回
4.3 炔烃的化学性质
• 炔烃的碳碳三键(C≡C)是由一个σ键和两个π键组成,因此,炔烃也 有烯烃中π键的化学性质,也有加成、氧化和聚合等反应。这些反应 都发生在三键上,所以三键是炔烃的官能团。但是由于三键和双键有 所不同,所以炔烃有些化学反应与烯烃是有差别的。
• 4.3.1 加成反应
• 如果是烯炔,部分氢化时首先三键氢化而成烯烃:
• 2. 加卤素
上一页 下一页 返回
4.3 炔烃的化学性质
• 炔烃与卤素的加成也是分两步进行的。先加一分子氯或溴,生成二卤 代烯,在过量的氯或溴的存在下,再进一步与一分子卤素加成,生成 四卤代烷:
• 虽然炔烃比烯烃更不饱和,但炔烃进行亲电加成却比烯烃困难。例如 烯烃可使溴的四氯化碳溶液很快褪色,而炔烃却需要一两分钟才能使 之褪色。故当分子中同时存在双键和三键时,与溴的加成首先发生在 双键上:
上一页 下一页 返回
4.3 炔烃的化学性质
• 3. 加卤化氢 • 在汞盐的催化作用下,乙炔与氯化氢在气相发生加成反应,可以停留
在与一分子氯化氢的加成产物阶段,生成的氯乙烯是合成氯乙烯塑料 的单体。化学反应式如下:
《乙炔实验室制取》课件

实验室制取乙炔的安全措施
在进行乙炔制备实验时,需确保实验室通风良好,避免乙炔泄漏引发危险。 同时,操作人员要遵循实验室安全指南,正确佩戴个人防炔气体制备完成后,需通过适当的收集装置进行收集,同时对产生的废气 进行处理,以确保实验室环境的安全和卫生。
乙炔的实验用途
实验室制取乙炔的步骤
1
制备乙炔溶液
通过酸碱反应生成乙炔溶液。
分解脱水
2
将乙炔溶液加热,使其分解脱水产
生乙炔气体。
3
收集乙炔气体
将乙炔气体通过气体收集装置收集 起来。
实验室制取乙炔的注意事项
安全性
操作时需佩戴防护眼镜和手套,注意防止 乙炔泄漏引起火灾或爆炸。
设备操作
要熟悉操作装置的使用方法,并掌握乙炔 制备的操作步骤。
乙炔的实验室制取原理
乙炔可以通过酸碱中和反应生成乙炔溶液,并通过加热使溶液分解脱水产生乙炔气体。
实验室制取乙炔的装置
酸碱反应器
用于进行酸碱中和反应,生成乙炔溶液。
加热设备
用于加热乙炔溶液,使其分解脱水生成乙炔气 体。
实验室制取乙炔的材料和试剂
1 材料
石灰石、熟石灰、金属片等。
2 试剂
浓盐酸、稀硫酸、炭酸氢钠等。
1 焊接和切割
乙炔是常用的焊接和 切割气体,可提供高 温火焰,适用于金属 加工。
2 分析和检测
乙炔可以用于气体分 析、火焰光谱法等化 学分析和检测方法。
3 燃料和照明
乙炔可作为燃料用于 燃烧和提供照明。
《乙炔实验室制取》PPT 课件
在这个PPT课件中,我们将深入学习乙炔的实验室制取方法及其性质,探讨乙 炔在化学实验和工业生产中的广泛应用。
乙炔的定义和性质
《基础化学》第4章 二烯烃和炔烃---课程思政

个未杂化的P轨道。两个sp杂化轨道成180分布,两个未杂化
的P轨道互相垂直,且都垂直于sp杂化轨道轴所在的直线
py
pz
sp
sp
180°
两个sp 的空间分布
三键碳原子的轨道分布图
《基础化学》
第四章 炔烃和二烯烃
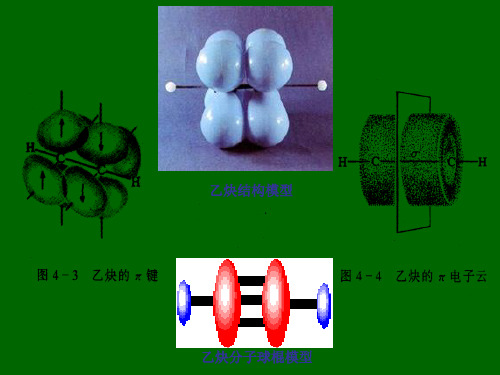
❖ 三键的形成σ
π
π
π
H σ C σ C σH π
乙烯分子的成键情况
乙炔分子的π电子分布模型图
交替。
例如:1,3-丁二烯
CH2 CH C CH
乙烯基乙炔 O
CH2 CH C H 乙烯基乙醛
1,3,5-己三烯
CH2 CH C N 丙烯腈
《基础化学》
第四章 炔烃和二烯烃
A、π-π共轭体系的特点
• 电子离域:π电子不是固定在双键的2个
C原子之间,而是分布在共轭 体系中的几个C原子上。 • 键长趋于平均化
HCCH
Kekulè模型
Stuart 模型
《基础化学》
第四章 炔烃和二烯烃
(1)碳原子的sp杂化
基态
激发态
sp杂化态
2p
2p
2p
2s
2s
sp
1s
1s
1s
每个sp杂化轨道含1/2 s 成分和 1/2 p成分。
《基础化学》
第四章 炔烃和二烯烃
图4-5
一个2s轨道和一 个2p轨道形成二 个sp杂化轨道
1,2-丁二烯
碳架异构
官能团位次
(2)命名
异构
(A)只含C C的化合物
官能团异构
与烯相似,只将“烯”改为“炔”。
《基础化学》
第四章 炔烃和二烯烃
5
炔 烃

• 用适线法估计频率曲线的统计参数分为初步估
计参数、用适线法调整初估值以及对比分析三
个步骤。
上一页 下一页 返回
学习情境一 大中桥设计流量的推算
• 矩法是一种简单的经典参数估计方法,它无需 事先选定频率曲线线型,因而是洪水频率分析 中 由广 此泛求使得用的Cs 的频一率种 曲方 线法 总。 是由 系矩 数法 偏估 小计,的其参中数尤及以 偏小更为明显。
上一页 下一页 返回
4.3 炔烃的化学性质
• 3. 加卤化氢 • 在汞盐的催化作用下,乙炔与氯化氢在气相发生加成反应,可以停留
在与一分子氯化氢的加成产物阶段,生成的氯乙烯是合成氯乙烯塑料 的单体。化学反应式如下:
• 炔烃与卤化氢的加成,加碘化氢容易进行,加氯化氢则难进行,一般 要在催化剂存在下才能进行。不对称炔烃加卤化氢时,服从马氏规则。 例如:
• (1)当调查的历史洪水位处于比降均一、河道顺
学习情境一 大中桥设计流量的推算
• 二、频率曲线参数估计
• 在洪水频率计算中,我国规范统一规定采用适 线法。适线法有两种:一种是经验适线法(或称目 估适线法),另一种是优化适线法。
• 经验适线法是在经验频率点据和频率曲线线型 确定之后,通过调整参数使曲线与经验频率点 据配合得最好,此时的参数就是所求的曲线线 型的参数,从而可以计算设计洪水值。
• 若分子中既含有双键又含有三键时,则应选择含有双键和三键的最长 碳链为主链,并将其命名为烯炔(烯在前、炔在后)。编号时,应使烯、 炔所在位次的和为最小。例如:
上一页 下一页 返回
4.1 炔烃的结构和命名
• 但是,当双键和三键处在相同的位次时,即烯、炔两碳原子编号之和 相等时,则从靠近双键一端开始编号。例如:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、制取:
收集一集气瓶乙炔气体,观察色及燃烧情况 ②将乙炔气体通入溴水中 ③将乙炔气体通入酸性高锰酸钾中
一、乙炔的实验室制法:
1、反应原理:
CaC2+2H—OH
C2H2↑+Ca(OH)2 +127KJ
练:CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属 离子型碳化物,请通过对CaC2制C2H2的反应进行思 考,从中得到必要的启示,写出下列反应的产物:
A.ZnC2水解生成 ( C2H2) B.Al4C3水解生成( CH4 ) C.Mg2C3水解生成( C3H4) D.Li2C2水解生成 ( C2H2)
āpó〈方〉名①丈夫的母亲。②祖母。③尊称老年妇女。 【阿Q】āQ名鲁迅小说《阿Q正传》的主人公,是“精神胜利者”的典型,受了屈辱,不敢正视,反 而用自我安慰的办法,说自己是“胜利者”。 【阿是穴】āshìxué名中医在针灸上把没有固定名称的穴位,以酸、麻、胀、痛等感觉最明显的部位或病痛处作 为穴位,叫做阿是穴。 【阿嚏】ātì拟声形容打喷嚏的声音。 【阿姨】āyí名①〈方〉母亲的姐妹。②称呼跟母亲辈分相同、年纪差不多的无亲属关系的妇女: 王~|售票员~。③对保育员或保姆的称呼。 【啊】(呵)ā叹表示惊异或赞叹:~,出虹了!|~,今年的庄稼长得真好哇! 【锕】(錒)ā名金属元素, 符号Ac(actinium)。银白色,有放射性。锕-227用作航天器的热源。 【腌】ā[腌臜](ā?zā)〈方〉①形脏;不干净;房子里太~了,快打扫打扫吧。 ②形(心里)别扭;不痛快:晚到一步,事没办成,~透了。③动糟践;使难堪:算了,别~人了。 【啊】(呵)á叹表示追问:~?你明天到底去不去 呀?|~?你说什么? 【嗄】á同“啊”(á)。 【啊】(呵)ǎ叹表示惊疑:~?怎么会有这种事? 【啊】(呵)à叹①表示应诺
德罗常量】āfújiādéluóchánɡliànɡ指1摩任何物质所含的分子数,约等于6。022×1023。因纪念意大利化学家阿伏伽德罗(AmdeoAvogadro)而得名。旧称 阿伏伽德罗常数。 【阿公】āɡōnɡ〈方〉名①丈夫的父亲。②祖父。③尊称老年男子。 【阿訇】āhōnɡ名我国伊斯兰教称主持清真寺教务和讲授经典的人。 [波斯ākhūnd] 【阿拉伯人】ālābórén名亚洲西;网址导航 https:/// 网址导航 ;南部和非洲北部的主要居民。原住阿拉伯半岛,多信伊斯兰 教。[阿拉伯,阿拉伯语Arab] 【阿拉伯数字】ālābóshùzì国际通用的数字,就是0,1,2,3,4,5,6,7,8,9。最初由印度人发明、使用,因后经阿拉 伯人传入欧洲,所以叫阿拉伯数字。 【阿兰若】ālánrě名见809页〖兰若〗。 【阿罗汉】āluóhàn名见899页〖罗汉〗。 【阿猫阿狗】āmāoāɡǒu〈方〉泛指 某类人或随便什么人(含轻蔑意)。 【阿门】āmén古代犹太教、基督教祈祷时常用的结束语,“但愿如此”的意思。[希伯来āmēn] 【阿片】āpiàn名从 尚未成熟的罂粟果里取出的乳状液体,干燥后变成淡黄色或棕色固体,味苦。医上用作止泻和镇痛。常用成瘾,是一种度品。用作度品时,叫鸦片。 【阿婆】
