酪氨酸磷酸酶抗体(IA-2A)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求北京中航赛维
抗核抗体谱检测试剂盒(磁微粒化学发光法)产品技术要求华晟源
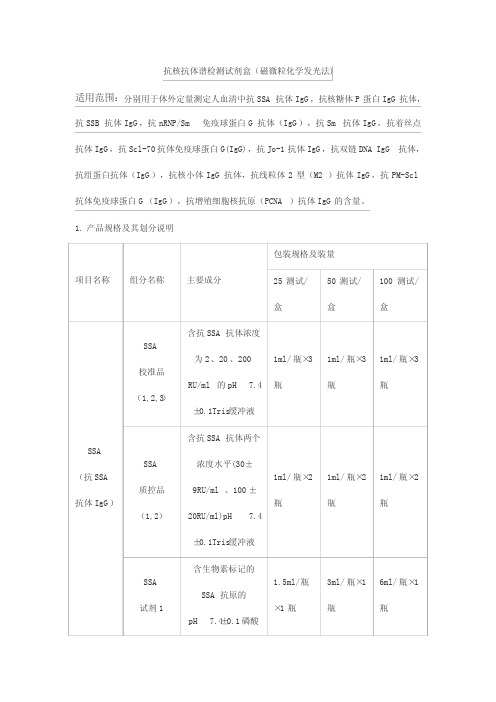
抗核抗体谱检测试剂盒(磁微粒化学发光法)适用范围:分别用于体外定量测定人血清中抗SSA抗体IgG,抗核糖体P蛋白IgG抗体,抗SSB抗体IgG,抗nRNP/Sm免疫球蛋白G抗体(IgG),抗Sm抗体IgG,抗着丝点抗体IgG,抗Scl-70抗体免疫球蛋白G(IgG),抗Jo-1抗体IgG,抗双链DNA IgG抗体,抗组蛋白抗体(IgG),抗核小体IgG抗体,抗线粒体2型(M2)抗体IgG ,抗PM-Scl 抗体免疫球蛋白G(IgG),抗增殖细胞核抗原(PCNA)抗体IgG的含量。
1. 产品规格及其划分说明项目名称 组分名称 主要成分 包装规格及装量25测试/盒50测试/盒100测试/盒SSA (抗SSA抗体IgG)SSA校准品(1,2,3)含抗SSA抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶SSA质控品(1,2)含抗SSA抗体两个浓度水平(30±9RU/ml、100±20RU/ml)pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶SSA试剂1含生物素标记的SSA抗原的pH 7.4±0.1磷酸1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶盐缓冲液SSA 试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶SSA 试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶P0(抗核糖体P蛋白IgG抗体)) P0校准品(1,2,3)含抗核糖体P蛋白抗体浓度为g 、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶P0质控品(1,2)含抗核糖体P蛋白抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶P0试剂1生物素标记的P0抗原的pH 7.4±0.11.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶磷酸盐缓冲液P0试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶P0试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶SSB(抗SSB抗体IgG) SSB校准品(1,2,3)含抗SSB抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶SSB质控品(1,2)含抗SSB抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶SSB试剂1生物素标记的SSB抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶SSB试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶SSB试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶nRNP/Sm (抗nRNP/Sm免疫球蛋白G抗体(IgG)) nRNP/Sm校准品(1,2,3)含抗nRNP/Sm抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶nRNP/Sm质控品(1,2)含抗nRNP/Sm抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶nRNP/Sm试剂1生物素标记的nRNP/Sm抗原的pH 7.4±0.1磷酸1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶盐缓冲液nRNP/Sm 试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶nRNP/Sm 试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Sm(抗Sm 抗体IgG)Sm校准品(1,2,3)含抗Sm抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶Sm质控品(1,2)含抗Sm抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶Sm试剂1生物素标记的Sm抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Sm试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶Sm试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶着丝点(CENP-B)(抗着丝点抗体IgG)着丝点(CENP-B校准品(1,2,3)含抗着丝点(CENP-B)抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶着丝点(CENP-B质控品(1,2)含抗着丝点(CENP-B)抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶着丝点(CENP-B生物素标记的着丝点(CENP-B)抗原的1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶试剂1 pH 7.4±0.1磷酸盐缓冲液着丝点(CENP-B 试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶着丝点(CENP-B 试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Scl-70(抗Scl-70抗体免疫球蛋白G(IgG)) Scl-70校准品(1,2,3)含抗Scl-70抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶Scl-70质控品(1,2)含抗Scl-70抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶Scl-70试剂1生物素标记的Scl-70抗原的1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶pH 7.4±0.1磷酸盐缓冲液Scl-70试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶Scl-70试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Jo-1(抗Jo-1抗体IgG)Jo-1校准品(1,2,3)含抗Jo-1抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶Jo-1质控品(1,2)含抗Jo-1抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶Jo-1试剂1生物素标记的Jo-1抗原的pH 7.4±1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶0.1磷酸盐缓冲液Jo-1试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶Jo-1试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶dsDNA (抗双链DNA IgG 抗体 dsDNA校准品(1,2,3)含抗dsDNA抗体浓度为10、100、800 IU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶dsDNA质控品(1,2)含抗dsDNA抗体两个浓度水平(300±30IU/ml、600±60IU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶dsDNA试剂1生物素标记的dsDNA抗原的1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶pH 7.4±0.1磷酸盐缓冲液dsDNA试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶dsDNA试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶组蛋白(His)(抗组蛋白抗体(IgG)组蛋白(His)校准品(1,2,3)含抗组蛋白(His)抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶组蛋白(His)质控品(1,2)含抗组蛋白(His)抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶 组蛋白生物素标记的组蛋 1.5ml/瓶3ml/瓶×16ml/瓶×1(His)试剂1白(His)抗原的pH 7.4±0.1磷酸盐缓冲液×1瓶 瓶 瓶组蛋白(His)试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶组蛋白(His)试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶核小体(Nuc)(抗核小体IgG抗体)核小体(Nuc)校准品(1,2,3)含抗核小体(Nuc)抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶核小体(Nuc)质控品(1,2)含抗核小体(Nuc)dsDNA抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶缓冲液核小体(Nuc)试剂1 生物素标记的核小体(Nuc)抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶核小体(Nuc)试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶核小体(Nuc)试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶线粒体2型(M2)(抗线粒体2型(M2)抗体IgG) 线粒体2型(M2)校准品(1,2,3)含抗线粒体2型(M2)抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶线粒体2型(M2)质控品(1,2)含抗线粒体2型(M2)抗体两个浓度水平(30±9RU/ml、100±1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶pH 7.4±0.1Tris缓冲液线粒体2型(M2)试剂1 生物素标记的线粒体2型(M2)抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶线粒体2型(M2)试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶线粒体2型(M2)试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PM-Scl(抗PM-Scl抗体免疫球蛋白G (IgG)) PM-Scl校准品(1,2,3)含抗PM-Scl抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶PM-Scl质控品(1,2)含抗PM-Scl抗体两个浓度水平(30±9RU/ml、100±1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶pH 7.4±0.1Tris缓冲液PM-Scl试剂1生物素标记的PM-Scl抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PM-Scl试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶PM-Scl试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PCNA(抗增殖细胞核抗原(PCNA)抗体IgG)PCNA校准品(1,2,3)含抗PCNA抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶PCNA质控品(1,2)含抗PCNA抗体两个浓度水平(30±9RU/ml、100±1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶pH 7.4±0.1Tris缓冲液PCNA试剂1生物素标记的PCNA抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PCNA试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶PCNA试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶2. 性能指标2.1外观试剂盒各组分应齐全、完整、液体无渗漏;磁分离试剂摇匀后为均匀悬浊液,无明显凝集;液体组分应澄清,无沉淀或絮状物;包装标签应清晰,易识别。
一种磁微粒化学发光检测试剂盒及其检测方法与流程

标题:一种磁微粒化学发光检测试剂盒及其检测方法与流程随着生物医学技术的发展和进步,磁微粒化学发光检测试剂盒作为一种新型的检测方法,被广泛应用于临床诊断、医学研究及生物制药等领域。
本文将介绍一种磁微粒化学发光检测试剂盒及其检测方法与流程。
一、磁微粒化学发光检测试剂盒的构成1. 磁性微粒:采用高纯度的磁性微粒作为检测载体,具有良好的磁性和生物相容性。
2. 生物分子标记物:使用具有特异性的生物分子标记物对待检物质进行标记,如抗体、抗原等。
3. 化学发光底物:采用稳定的化学发光底物,能够在一定条件下产生强化学发光信号。
4. 其他辅助试剂:包括稳定剂、缓冲液等,用于维持试剂盒的稳定性和灵敏度。
二、磁微粒化学发光检测试剂盒的检测方法1. 标本处理:对待检标本进行预处理,如离心、稀释等,以获得适合的检测样品。
2. 标本反应:将标本样品与试剂盒中的磁性微粒、生物分子标记物等混合反应,使目标物质与生物标记物结合。
3. 磁性分离:利用外加磁场,将标记物结合的磁性微粒从混合物中分离出来,从而去除未结合的物质。
4. 化学发光检测:将磁性微粒沉淀后,加入化学发光底物,产生化学发光信号。
5. 信号检测:利用化学发光检测仪器对产生的化学发光信号进行检测和记录。
三、磁微粒化学发光检测试剂盒的检测流程1. 样品接收:接收待检标本,并进行必要的标本信息登记和样本保存。
2. 样品预处理:对样品进行洗涤、离心、稀释等处理,以获得适合的检测样品。
3. 试剂配置:将试剂盒中的各种试剂按照规定的比例和步骤进行配置。
4. 样品处理:将样品与试剂盒中的试剂混合反应,按照检测方法进行处理。
5. 信号检测:将反应产生的信号经化学发光检测仪进行检测,记录并分析检测结果。
6. 结果判读:根据化学发光检测仪器的指示,进行检测结果的判读,判断样品是否阳性或阴性。
四、结语磁微粒化学发光检测试剂盒作为一种新型的检测方法,在生物医学领域具有广阔的应用前景。
其构成简单、操作便捷、灵敏度高等特点,使其成为当前生物医学检测领域的热门研究方向。
了解蛋白酪氨酸磷酸酶抗体(IA—2A)与谷氨酸脱羧酶抗体(GADA)在1型糖尿病(DM)中的检出率及
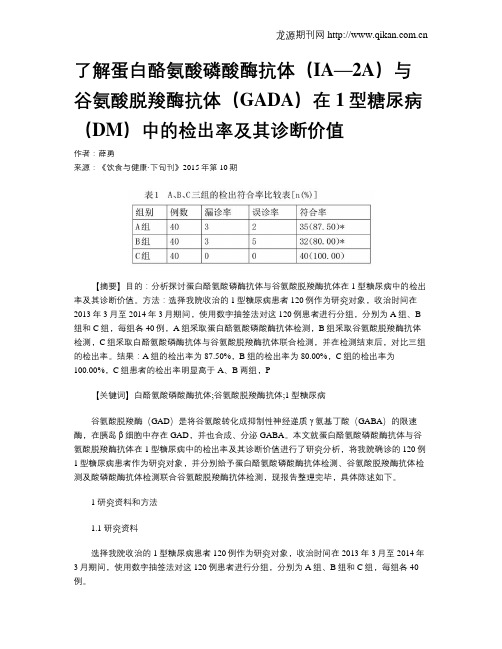
龙源期刊网 了解蛋白酪氨酸磷酸酶抗体(IA—2A)与谷氨酸脱羧酶抗体(GADA)在1型糖尿病(DM)中的检出率及其诊断价值
作者:薛勇
来源:《饮食与健康·下旬刊》2015年第10期
【摘要】目的:分析探讨蛋白酪氨酸磷酶抗体与谷氨酸脱羧酶抗体在1型糖尿病中的检出率及其诊断价值。
方法:选择我院收治的1型糖尿病患者120例作为研究对象,收治时间在2013年3月至2014年3月期间,使用数字抽签法对这120例患者进行分组,分别为A组、B 组和C组,每组各40例,A组采取蛋白酪氨酸磷酸酶抗体检测,B组采取谷氨酸脱羧酶抗体检测,C组采取白酪氨酸磷酶抗体与谷氨酸脱羧酶抗体联合检测,并在检测结束后,对比三组的检出率。
结果:A组的检出率为87.50%,B组的检出率为80.00%,C组的检出率为
100.00%,C组患者的检出率明显高于A、B两组,P
【关键词】白酪氨酸磷酸酶抗体;谷氨酸脱羧酶抗体;1型糖尿病
谷氨酸脱羧酶(GAD)是将谷氨酸转化成抑制性神经递质γ氨基丁酸(GABA)的限速酶,在胰岛β细胞中存在GAD,并也合成、分泌GABA。
本文就蛋白酪氨酸磷酸酶抗体与谷氨酸脱羧酶抗体在1型糖尿病中的检出率及其诊断价值进行了研究分析,将我院确诊的120例1型糖尿病患者作为研究对象,并分别给予蛋白酪氨酸磷酸酶抗体检测、谷氨酸脱羧酶抗体检测及酸磷酸酶抗体检测联合谷氨酸脱羧酶抗体检测,现报告整理完毕,具体陈述如下。
1 研究资料和方法
1.1 研究资料
选择我院收治的1型糖尿病患者120例作为研究对象,收治时间在2013年3月至2014年3月期间,使用数字抽签法对这120例患者进行分组,分别为A组、B组和C组,每组各40例。
化学发光免疫类体外诊断试剂(盒)产品技术审评要求规范(2017版)1204(可编辑修改word版)

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017 版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第 5 号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242 号)化学发光免疫类体外诊断试剂(盒)产品分类代号为 6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告 2014 年第44 号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
人胰岛细胞抗原2抗体蛋白酪氨酸磷酸酶抗体(IA-2A)elisa

人胰岛细胞抗原2抗体/蛋白酪氨酸磷酸酶抗体(IA-2A)elisa试剂盒使用说明书Elisa kit规格:48孔配置/96孔配置标准品稀释液:1.5ml×1瓶酶标试剂:3 ml×1瓶(48)/6 ml×1瓶(96)【人胰岛细胞抗原2抗体/蛋白酪氨酸磷酸酶抗体(IA-2A)试剂盒】本试剂仅供研究使用计算:以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
试剂盒组成:封板膜:2片(48)/2片(96)说明书:1份密封袋:1个标准品:2700ng/L 0.5ml×1瓶0.5ml×1瓶2-8℃保存酶标包被板: 1×48 1×96 2-8℃保存样品稀释液: 3ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液: 3ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液: 3ml×1瓶 6 ml×1瓶2-8℃保存终止液: 3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液:(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存实验原理:本试剂盒应用双抗体夹心法测定标本中人胰岛细胞抗原2抗体/蛋白酪氨酸磷酸酶抗体(IA-2A)水平。
用纯化的人胰岛细胞抗原2抗体/蛋白酪氨酸磷酸酶抗体(IA-2A)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入胰岛细胞抗原2抗体/蛋白酪氨酸磷酸酶抗体(IA-2A),再与HRP标记的胰岛细胞抗原2抗体/蛋白酪氨酸磷酸酶抗体(IA-2A)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
达科为IL-2 ELISA试剂盒说明书

1、 产品简介:
达优®小鼠 IL-2 ELISA 试剂盒是通过酶联免疫吸附技术,定量 检测细胞培养上清液和小鼠血清、血浆和其他体液中天然和重组 IL-2 的浓度。本试剂盒为预包被板,“夹心一步”完成,整个过程 孵育时间不超过 2.5 小时,洗涤 8 次,操作时间大大减少。本试剂 盒专用于科研,而非用于诊断。
1513预包被elisa试剂盒系列产品小鼠elisa试剂盒dkw12200004848tdkw122000096mouseifnelisakit预包被减步法96tdkw12201104848tdkw122011096mouseil1elisakit预包被减步法96tdkw12201204848tdkw122012096mouseil1elisakit预包被减步法96tdkw12202004848tdkw122020096mouseil2elisakit预包被减步法96tdkw12204004848tdkw122040096mouseil4elisakit预包被减步法96tdkw12205004848tdkw122050096mouseil5elisakit预包被减步法96tdkw12206004848tdkw122060096mouseil6elisakit预包被减步法96tdkw12210004848tdkw122100096mouseil10elisakit预包被减步法96tdkw12212004848tdkw122120096mouseil12p70elisakit预包被减步法96tdkw12212304848tdkw122123096mouseil12il23p40elisakit预包被减步法96tdkw12217004848tdkw122170096mouseil17aelisakit预包被减步法96tdkw12222004848tdkw122220096mouseil22elisakit预包被96tdkw12271004848tdkw122710096mousetgf1elisakit预包被96tdkw12272004848tdkw122720096mousetnfelisakit预包被减步法96tdkw12273404848tdkw122734096mousevegfaelisakit预包被96tdkw12282004848tdkw122820096mouseigeelisakit预包被96tdkw12273904848tdkw122739096mousemcp1elisakit预包被96t16人elisa试剂盒dkw12100004848tdkw121000096humanifnelisakit预包被减步法96tdkw12101204848tdkw121012096humanil1elisakit
检测自身免疫性糖尿病抗体谱GADA,ICA,IA-2A,IAA,ZnT-8A在诊断Ⅰ型糖尿病中的应用

检测自身免疫性糖尿病抗体谱GADA,ICA,IA-2A,IAA,ZnT-8A在诊断Ⅰ型糖尿病中的应用价值发布时间:2021-06-30T06:25:43.308Z 来源:《中国医学人文》(学术版)2021年第3期作者:杨晓芳郭炜[导读] 目的探析在Ⅰ型糖尿病的诊断中自身免疫性糖尿病抗体谱的检测是否具有推广应用的价值。
方法随机选取Ⅰ型糖尿病患者和健康体检者作为观察组和对照组,对照两组的检测指标。
结果观察组在GADA、ICA、IA-2A、IAA、ZnT-8A上的检出率比对照组高,且存在统计学差异(P<0.05)。
结论在Ⅰ型糖尿病的诊断中加强联合测定GADA、ICA、IA-2A、IAA、ZnT-8A这样的自身免疫性糖尿病抗体谱,有助于诊断准确率的提高,有应用推广的价值。
杨晓芳郭炜新疆昌吉州人民医院新疆昌吉 831100【摘要】目的探析在Ⅰ型糖尿病的诊断中自身免疫性糖尿病抗体谱的检测是否具有推广应用的价值。
方法随机选取Ⅰ型糖尿病患者和健康体检者作为观察组和对照组,对照两组的检测指标。
结果观察组在GADA、ICA、IA-2A、IAA、ZnT-8A上的检出率比对照组高,且存在统计学差异(P<0.05)。
结论在Ⅰ型糖尿病的诊断中加强联合测定GADA、ICA、IA-2A、IAA、ZnT-8A这样的自身免疫性糖尿病抗体谱,有助于诊断准确率的提高,有应用推广的价值。
【关键词】糖尿病;抗体;诊断;应用在诸多常见病中糖尿病发生率越来越高,且患者也不仅限于老年人,患病年龄日趋年轻化,因此,及早诊断、及早治疗、科学用药等对控制糖尿病患者血糖、提高其生存质量等极其重要[1]。
基于提高Ⅰ型糖尿病的诊断率,促使此类患者及早得到准确诊断结果,及早治疗的目的,本研究通过分组对照的方式研究GADA、ICA、IA-2A、IAA、ZnT-8A的检测在Ⅰ型糖尿病的诊断中是否具有应用推广的价值,下面具体介绍如下。
1一般资料和方法1.1一般资料从2019年1月至2020年1月在本院确诊的Ⅰ型糖尿病患者中随机选取210例作为观察组(男125例,女85例,年龄20-57岁,糖尿病初发),随机从2019年1月至2020年1月期间来院体检的正常体检者中选取210例作为对照组(男120例,女90例,年龄22-56岁,肝胆脾胃肾功能正常,无内分泌疾病,家族病史不包括糖尿病),在年龄、性别上两组没有统计学差异(P>0.05)。
C肽(C-P)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求豪迈

C肽(C-P)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中C肽(C-P)的含量。
1.1型号/包装规格
规格A:100人份/盒
规格B:100人份/盒
1.2主要组成成分
定标液和质控品的浓度具有批差异性,详见标签。
2.1 外观
试剂盒中的组分应澄清,应无沉淀和絮状物;磁分离试剂摇匀后,应为均匀悬浊液,无明显凝集。
2.2 空白限
应不大于0.03ng/ml。
2.3 准确度
用国家标准品(编号:1815)作为样本进行检测,其测量结果的相对偏差应在±10%。
2.4 线性
在[0.03,20]ng /ml测量范围内,剂量-反应曲线线性相关系数R≥0.9900。
2.5 重复性
用不同浓度的两个样本进行检测,各重复检测10次,其变异系数CV应不大于10%。
2.6 批间差
用三个批号试剂盒检测同一份样本,则三批试剂盒之间的批间变异系数CV应不大于15%。
2.7 特异性
用测定试剂盒测定相应浓度的交叉反应物质,应满足下表要求:
2.8溯源性
根据GB/T 21415-2008及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源至国家校准品(编号:1815)。
2.9 稳定性
试剂盒在规定的2℃~8℃下保存,有效期为12个月。
取到效期后的产品进行检测,结果应符合2.1、2.2、2.3、2.4、2.5、2.7项的要求。
人生长激素测定试剂盒(化学发光免疫分析法)产品技术要求mairui

1 性能指标2.1外观和性状试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物;校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
分装瓶应为透明塑料管,盖有塑料外盖。
2.2装量应不少于试剂的标示装量值。
2.3准确度2.3.1将hGH 国家标准品配成两个浓度水平的样品,用待检试剂盒进行检测,其检测结果与标定靶值的相对偏差在±10%范围内。
2.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.4最低检测限应不大于0.02 ng/mL。
2.5线性试剂盒在0.03 ng/mL~50 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性变异系数CV 应≤ 5%。
2.7批间差变异系数CV 应≤ 10%。
2.8校准品均一性2.8.1校准品瓶内均一性C0的标准差(SD)应不大于0.024ng/mL,C1和C2的变异系数(CV)应不大于8.0%。
2.8.2校准品瓶间均一性C0 的标准差(SD)应不大于0.02 ng/mL,C1 和C2 的变异系数(CV)应不大于5.0%。
2.9生物安全性使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II1型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
2.10稳定性2~8℃避光保存,试剂盒有效期为365 天。
到有效期后90 天内的试剂盒应符合2.1、2.3、2.4、2.5、2.6、2.8 的要求。
2。
抗酪氨酸磷酸酶抗体IgG测定试剂盒(化学发光免疫分析法)产品技术要求新产业

抗酪氨酸磷酸酶抗体IgG 测定试剂盒
(化学发光免疫分析法)
2.性能指标
2.1外观和性状
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固。
2.1.2试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2净含量
试剂盒各组分净含量应不少于额定装量(见表1)。
表1 各组分额定装量
2.3批内精密度
批内变异系数(CV)应≤8%。
2.4批间精密度
批间变异系数(CV)应≤15%。
2.5准确度
回收率应在(90.0%~110.0%)范围内。
2.6空白限
空白限应≤ 2.5 U/mL。
2.7线性
在(3.5~280.0)U/mL 浓度范围内,线性相关性系数(r)绝对值应大于0.9900。
2.8校准品
2.8.1校准品准确度
相对偏差应在±10% 范围内。
2.8.2校准品瓶内重复性
校准品瓶内重复性(CV)应≤8%。
2.8.3校准品瓶间均一性
校准品瓶间均一性(CV)应≤10%。
2.9质控品
2.9.1质控品准确度
质控品1 每次测定结果均应在[14.1~26.1] U/mL 浓度范围内,质控品2 每次测定结果均应在[36.9~68.5] U/mL 浓度范围内。
2.9.2质控品瓶内重复性
质控品瓶内重复性(CV)应≤8%。
2.9.3质控品瓶间均一性
质控品瓶间均一性(CV)应≤10%。
IA试剂盒操作手册
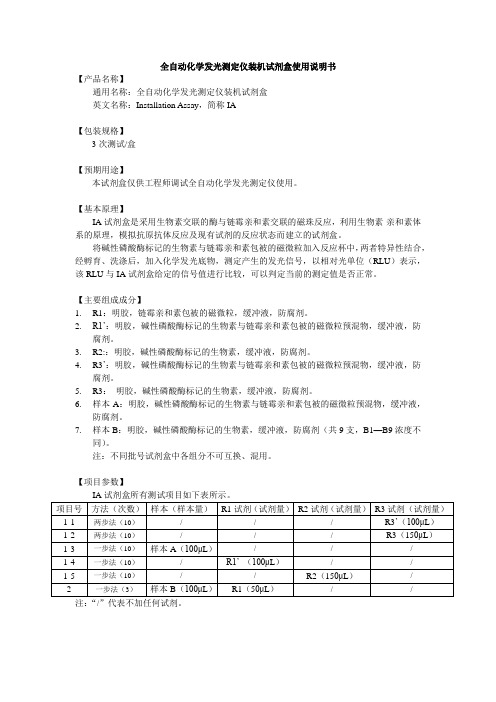
全自动化学发光测定仪装机试剂盒使用说明书【产品名称】通用名称:全自动化学发光测定仪装机试剂盒英文名称:Installation Assay,简称IA【包装规格】3次测试/盒【预期用途】本试剂盒仅供工程师调试全自动化学发光测定仪使用。
【基本原理】IA试剂盒是采用生物素交联的酶与链霉亲和素交联的磁珠反应,利用生物素-亲和素体系的原理,模拟抗原抗体反应及现有试剂的反应状态而建立的试剂盒。
将碱性磷酸酶标记的生物素与链霉亲和素包被的磁微粒加入反应杯中,两者特异性结合,经孵育、洗涤后,加入化学发光底物,测定产生的发光信号,以相对光单位(RLU)表示,该RLU与IA试剂盒给定的信号值进行比较,可以判定当前的测定值是否正常。
【主要组成成分】1.R1:明胶,链霉亲和素包被的磁微粒,缓冲液,防腐剂。
2.R1’:明胶,碱性磷酸酶标记的生物素与链霉亲和素包被的磁微粒预混物,缓冲液,防腐剂。
3.R2::明胶,碱性磷酸酶标记的生物素,缓冲液,防腐剂。
4.R3’:明胶,碱性磷酸酶标记的生物素与链霉亲和素包被的磁微粒预混物,缓冲液,防腐剂。
5.R3:明胶,碱性磷酸酶标记的生物素,缓冲液,防腐剂。
6.样本A:明胶,碱性磷酸酶标记的生物素与链霉亲和素包被的磁微粒预混物,缓冲液,防腐剂。
7.样本B:明胶,碱性磷酸酶标记的生物素,缓冲液,防腐剂(共9支,B1—B9浓度不同)。
注:不同批号试剂盒中各组分不可互换、混用。
【项目参数】注:“/”代表不加任何试剂。
【操作方法】 ● 项目参数设置按照上表中所列出项目参数在仪器软件中新增相关项目。
● 试剂准备1. 试剂R1和R1’使用前摇晃混匀,目测确认磁微粒完全悬浮后即放入R1试剂盘。
建议缓慢混匀。
2. 试剂R3’ 使用前摇晃混匀,目测确认磁微粒完全悬浮后即放入R3试剂盘。
建议缓慢混匀。
3. 其余试剂放入对应的试剂盘。
4. 不加任何试剂的试剂位勿放置试剂。
● 样本准备1. 样本A 使用前摇晃混匀,目测确认磁微粒完全悬浮后即放入样本加对应位置。
浩欧博纳米磁微粒全自动化学发光自身抗体检测平台产品手册说明书

——纳米磁微粒全自动化学发光自身抗体检测平台产品手册苏州浩欧博生物医药有限公司(内部资料,请勿直呈客户)目录一、化学发光免疫分析技术 (3)1.原理和类型 (3)2.方法学优越性 (7)二、纳米磁微粒全自动化学发光自身抗体检测平台 (8)1.研发背景及拟解决的实际问题 (8)2.检测原理 (9)3.仪器设备 (10)4.试剂菜单及检测项目 (12)5.检测步骤和注意事项 (16)6.纳博克平台的优势 (18)三、纳博克市场定位及竞品对比 (19)1.自身抗体检测市场概况 (19)2.客户定位 (19)3.主要竞品对比 (22)四、相关发表论文 (23)五.苏州浩欧博生物医药有限公司简介 (26)六.常见问题解答 (27)一、化学发光免疫分析技术1.原理和类型1.1技术简介化学发光免疫分析技术(Chemiluminescence Immunoassay,CLIA),是将具有高灵敏度的化学发光测定技术与高特异性的抗原抗体免疫反应相结合,用于各种抗原、半抗原、抗体、激素、酶、脂肪酸、维生素和药物等的检测分析技术。
该技术是继放射免疫分析、酶联免疫分析、荧光免疫分析和时间分辨荧光免疫分析之后发展起来的一项最新免疫测定技术。
化学发光免疫分析技术完美整合了化学发光系统和抗原抗体反应系统,其原理是利用化学反应释放的自由能激发中间体(常用碱性磷酸酶-金刚烷胺),使其从激发态回到基态,当中间体从激发态回到基态时会释放等能级的光子,对光子进行测定而进行定量分析。
该技术具有荧光的特异性,同时不需要激发光,避免了免疫荧光分析中激发光杂散光的影响,同时具有良好的敏感度,并且不像放射免疫分析那样存在强烈的放射性物质沾染的危害,是一种非常优秀的定量免疫分析技术。
Halman在1977年基于放射免疫分析的基本原理,将酶的化学发光与免疫反应结合起来,建立了化学发光免疫分析方法。
发展至今已经成为一种成熟的、先进的超微量活性物质检测技术,应用范围广泛,近10年发展迅猛,是目前发展和推广应用最快的免疫分析方法,也是目前最先进的标记免疫测定技术,灵敏度和精确度比酶免法、荧光法高几个数量级,可以完全替代放射免疫分析、彻底淘汰酶联免疫分析。
化学发光免疫类体外诊断试剂(盒)产品技术审评要求规范(2017版)1204

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
1型糖尿病抗体标准

1型糖尿病抗体标准一、概述1型糖尿病是一种自身免疫性疾病,患者的免疫系统攻击并破坏了胰腺中的胰岛细胞,导致胰岛素分泌不足。
在1型糖尿病的诊断和预测中,检测相关抗体是一项重要的辅助手段。
本文将介绍1型糖尿病的常见抗体标准,包括谷氨酸脱羧酶抗体(GAD65)、胰岛素自身抗体(IAA)、胰岛细胞抗体(ICA)、酪氨酸磷酸酶抗体(IA-2A)和锌转运体8抗体(ZnT8A)。
二、谷氨酸脱羧酶抗体(GAD65)谷氨酸脱羧酶是糖代谢过程中的重要酶,GAD65抗体是1型糖尿病的重要标志之一。
在1型糖尿病患者中,约80%可检测到GAD65抗体。
该抗体的阳性预测值和阴性预测值均较高,因此对于1型糖尿病的诊断和预测具有重要意义。
三、胰岛素自身抗体(IAA)胰岛素自身抗体是针对胰岛素的自身抗体,可在1型糖尿病患者中被检测到。
IAA的出现与胰岛素治疗相关,但在1型糖尿病的自然病程中,IAA也可自行消失。
IAA的存在可以影响胰岛素治疗的效果,因此对于1型糖尿病患者的治疗管理具有指导意义。
四、胰岛细胞抗体(ICA)胰岛细胞抗体是针对胰岛细胞的自身抗体,可在1型糖尿病患者中被检测到。
ICA的阳性预测值较高,但阴性预测值较低,因此对于1型糖尿病的诊断具有一定的参考价值。
ICA的存在提示免疫系统攻击胰岛细胞,导致胰岛素分泌不足。
五、酪氨酸磷酸酶抗体(IA-2A)酪氨酸磷酸酶是调节细胞信号转导的重要蛋白激酶,IA-2A抗体是针对该蛋白的自身抗体。
在1型糖尿病患者中,约50%可检测到IA-2A抗体。
该抗体与GAD65抗体有一定的重叠,但IA-2A抗体的阳性预测值和阴性预测值略低于GAD65抗体。
六、锌转运体8抗体(ZnT8A)锌转运体8是调节细胞内锌离子平衡的重要蛋白,ZnT8A抗体是针对该蛋白的自身抗体。
在1型糖尿病患者中,约60%可检测到ZnT8A 抗体。
该抗体在1型糖尿病的诊断和预测中的价值还在研究中,但其与1型糖尿病发病的关联性较强。
抗酪氨酸磷酸酶抗体IgG测定试剂盒(直接化学发光法)产品技术要求北京乐普医疗科技
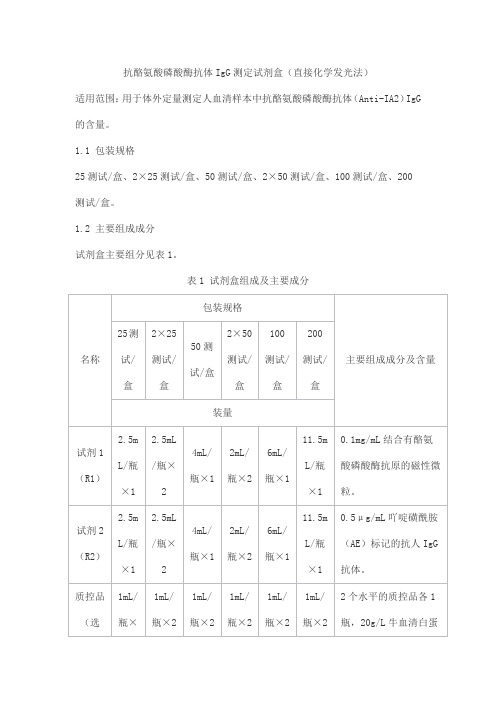
抗酪氨酸磷酸酶抗体IgG测定试剂盒(直接化学发光法)适用范围:用于体外定量测定人血清样本中抗酪氨酸磷酸酶抗体(Anti-IA2)IgG 的含量。
1.1 包装规格25测试/盒、2×25测试/盒、50测试/盒、2×50测试/盒、100测试/盒、200测试/盒。
1.2 主要组成成分试剂盒主要组分见表1。
表1 试剂盒组成及主要成分批特异性:各批校准品浓度、质控品的质控范围具有特异性,详见瓶签。
以上校准品(选配1)、校准品(选配2)须选择一项获取校准信息。
2.1 物理性状2.1.1外观本试剂盒中的组分齐全、完整,液体试剂澄清,无异物、沉淀物、絮状物和无渗漏;磁分离试剂摇匀后,应为均匀悬浊液,无明显凝集;各组分标签字迹清晰、无破损。
校准品、质控品应为淡黄色至无色液体。
2.1.2 装量液体装量应不少于标示值。
2.2 检出限检出限应不大于2 IU/mL。
2.3线性在[2,100]IU/mL范围内,线性相关系数(r)应不低于0.9900。
2.4 准确度用抗酪氨酸磷酸酶抗体国际标准品(编号:NIBSC 97/550)作为样本进行检测,测定结果与靶值的相对偏差应在±15.0%范围内。
2.5 重复性检测高、低两个浓度的样本,每个样本各重复检测10次,变异系数(CV)应不大于10.0%。
2.6批间差用3个批号试剂盒分别检测高、低两个浓度的样本,则3个批号试剂盒之间的变异系数(CV)应不大于15.0%。
2.7 特异性检测如表2中相应浓度的交叉反应物,抗酪氨酸磷酸酶抗体测定浓度应小于 2 IU/mL。
表2 交叉反应物浓度2.8 校准品、质控品重复性2.8.1 校准品变异系数(CV)应不高于10%。
2.8.2 质控品变异系数(CV)应不高于10%。
2.9 质控品赋值有效性质控品测定结果应在本试剂盒规定的范围内。
2.10 溯源性应根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所用校准品的来源、赋值过程以及测量不确定度等内容,本产品校准品溯源至抗酪氨酸磷酸酶抗体国际标准品(编号:NIBSC 97/550)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酪氨酸磷酸酶抗体(IA-2A)测定试剂盒(磁微粒化学发光免疫分析法)
适用范围:该产品用于体外定量测定人血清中的酪氨酸磷酸酶抗体(IA-2A)含量。
1.1产品规格
50测试/盒,100测试/盒,200测试/盒
1.2主要组成成分
2.1外观
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;
2.1.3液体组分应澄清,无沉淀或絮状物;
2.1.4包装标签应清晰,易识别。
2.2溯源性
应根据GB/T21415-2008及有关规定提供校准品的来源、溯源的赋值方法和相应指标、以及不确定度等内容。
本试剂盒校准品可溯源至企业工作校准品。
并与已上市产品比对赋值。
2.3准确度
回收率应在85%-115%范围内。
2.4 空白限
应不大于1 IU/mL。
2.5线性
在[5,4000]IU/mL的测量范围内,相关系数r应≥0.9900。
2.6重复性
变异系数(CV)应不大于8%。
2.7质控品的赋值有效性
质控品的测量值应在质控范围内。
2.8批间差
变异系数(CV)应不大于15.0%。
2.9稳定性
试剂盒在2~8℃贮存,有效期为12个月,取到效期后的试剂盒样品进行检测,检测结果应符合2.3、2.4、2.5、2.6和2.7的要求。
