石灰氧化钙镁含量及灰剂量的测定
灰剂量及钙镁含量
试验次数 1 2
氧化镁含量(%) 12.6 12.1
试样 编号
试验次数 1 2
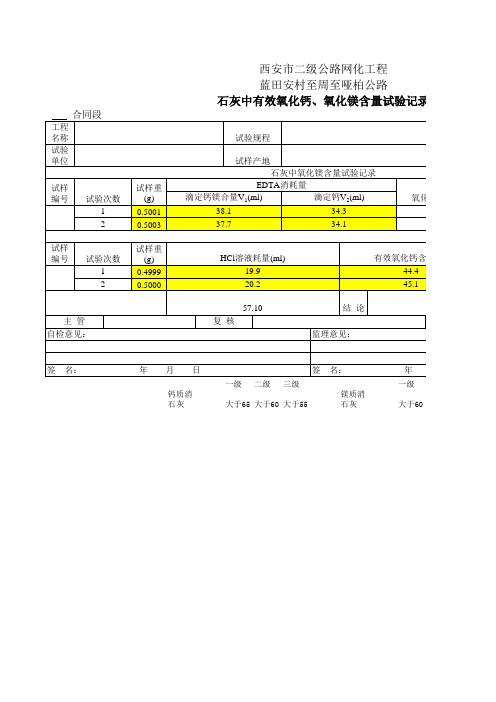
HCl溶液耗量(ml) 19.9 20.2 57.10 结 论 监理意见:
有效氧化钙含量(%) 44.4 45.1
主 管 自检意见:
复 核
签
名:
年
月
日பைடு நூலகம்
一级 二级 三级 大于65 大于60 大于55
签 名:
镁质消石灰
年
一级 大于60
西安市二级公路网化工程 蓝田安村至周至哑柏公路 石灰中有效氧化钙、氧化镁含量试验记录
合同段
工程 名称 试验 单位 试样 编号 试样重 (g) 0.5001 0.5003 试样重 (g) 0.4999 0.5000 试验规程 试样产地 石灰中氧化镁含量试验记录 EDTA消耗量 滴定钙镁合量V1(ml) 滴定钙V2(ml) 38.1 37.7 34.3 34.1
月
日
钙质消石灰
程 路 量试验记录
试验编号 试验日期
氧化镁含量(%) 12.6 12.1
平均值 12.35
备 注 1.674
12.7 12 12.35
有效氧化钙含量(%) 44.4 45.1
平均值 44.75
备 注 0.3988
试 验
年
月
日
二级 三级 大于55 大于50
石灰石、白云石中钙(氧化钙)和镁(氧化镁)的测定

常规化学分析中,对于石灰石、白云石中钙(氧化钙)和镁(氧化镁)的测定,一般先用酸溶解样品,再控制pH值为10的条件下测定钙镁合量,在pH值12~13的条件下测定氧化钙含量,然后用差减法求得氧化镁的含量。
笔者经过试验,拟定了首先将pH值控制在12~13的条件下,测出氧化钙含量,再改变pH值到10,测定氧化镁含量的钙镁连续滴定方法。
本法与常规方法相比,其最大特点就是能将2种离子连续滴定,且其精密度和准确度与常规方法基本一致。
1 试验部分1.1 主要试剂钙标准溶液:用基准碳酸钙配成浓度为2.0mg/ml的标准溶液;镁标准溶液:用经过EDTA标定的硫酸镁配成浓度1.0mg/ml的标准溶液;三乙醇胺(TEA)溶液:1∶1;孔雀绿(MG)溶液:0.1%;钙指示剂(NN):MNN∶MNaCl=1∶100;酸性铬蓝K-奈酚绿B(K-B):MK∶MB∶MNaCl=1∶2∶50;EDTA标准溶液:0.02mol/L。
1.2 试验原理吸取钙、镁标准溶液各5.00ml,置于250ml锥形瓶中,加入蒸馏水至溶液体积约为100ml,然后加入TEA溶液5ml,摇匀,再加孔雀绿溶液(MG)1~2滴,在摇动下滴加10% NaOH溶液至溶液的绿色刚好消失为止。
加适量的固体NN 指示剂,用EDTA标准溶液滴定至溶液由紫红色突变为纯蓝色即为终点(以消耗的EDTA溶液的体积计算CaO的含量)。
向滴定完钙的上述溶液中滴加盐酸溶液(1∶1)至溶液由蓝色变为紫红色并过量约1ml,摇匀。
然后用氨水溶液回滴至溶液呈蓝色,加入pH为10的氨缓冲溶液10ml,加适量K-B固体指示剂,摇匀,用EDTA标准溶液滴定至溶液由紫红色变为蓝色即为终点(以消耗的EDTA溶液体积计算MgO的含量)。
1.3 试样分析称取试样(于105℃左右烘干水分)0.5000g置于100ml烧杯中,加少量水湿润,分数次从烧杯嘴边加入1∶1 HCl 10ml左右(加盖表面皿),小心加热使试样完全溶解。
石灰石中钙镁含量的测定实验报告

石灰石中钙镁含量的测定实验报告一、实验目的:本实验旨在通过化学分析方法测定石灰石中钙镁含量。
二、实验原理:石灰石主要由碳酸钙(CaCO3)和少量的碳酸镁(MgCO3)组成。
钙和镁都是碱土金属元素,因此可以采用EDTA配合物滴定法来测定石灰石中钙镁含量。
三、实验步骤:1.取一定量的石灰石样品,粉碎并筛选出粒度在60目以下的颗粒。
2.将粉末样品称取0.2g,加入100ml锥形瓶中,加入10ml0.1mol/L盐酸,加热至完全溶解。
3.在溶液中加入几滴甲基红指示剂,然后用0.1mol/L氢氧化钠溶液滴定至颜色由红变黄。
4.加入10ml NH4Cl/NH4OH缓冲液和10ml 0.01mol/L EDTA溶液,用0.01mol/L MgCl2标准溶液滴定至颜色变化,记录所需的EDTA溶液用量V1。
5.再加入10ml NH4Cl/NH4OH缓冲液和10ml 0.01mol/L EDTA溶液,用0.01mol/L CaCl2标准溶液滴定至颜色变化,记录所需的EDTA 溶液用量V2。
四、实验结果:根据EDTA配合物滴定法的原理,钙和镁的摩尔比为1:1,因此可以计算出石灰石中钙和镁的含量。
计算公式如下:钙含量(%)=(V2-V1)×0.01×40.08×1000/m镁含量(%)=V1×0.01×24.31×1000/m其中,V1为EDTA溶液用量(mL),V2为EDTA溶液用量(mL),m为样品质量(g),40.08和24.31分别为钙和镁的摩尔质量。
五、实验结论:通过本实验,成功测定了石灰石中钙镁含量。
实验结果表明,该石灰石样品中钙含量为XX%,镁含量为XX%。
石灰石中钙镁含量的测定

石灰石中钙镁含量的测定石灰石是一种含有高含量钙(carbonate)和镁的沉积性岩石。
测定石灰石中钙和镁的含量对于确定岩石矿物组成、矿石品质评估和工业应用都非常重要。
下面将介绍一种测定石灰石中钙镁含量的方法。
测定方法:目前常用的测定方法有两种:酸解法和复合指标法。
1.酸解法:这种方法主要通过用稀盐酸溶解石灰石中的钙与镁,然后通过络合滴定法测定被酸溶解出来的钙和镁的含量。
a.样品准备:首先,需要将石灰石样品研磨成粉末,取适量的样品放入烧杯中,并将其干燥至恒定质量,以确定样品中的水含量。
b.酸解:取一定量的干燥样品放入烧杯中,加入足量浓盐酸(约5-10倍样品质量)。
用玻璃棒搅拌均匀,然后将烧杯放入石化橱或消化器中,并加热至酸溶液完全挥发,得到溶解的金属离子。
c.滴定:用其中一种络合剂(例如:酞菁络合剂)作为指示剂,并用其中一种标准的金属络合滴定剂(例如:EDTA溶液)进行滴定。
在滴定过程中,络合剂会与溶解出的钙和镁形成稳定的络合物,从而起到指示的作用。
在滴定过程中,溶液的颜色会发生明显的变化,从而判断滴定的终点。
d.计算:通过反应的化学方程式和滴定的体积,可以计算出石灰石中钙和镁的含量。
2.复合指标法:这种方法是通过测定石灰石样品中的酸可溶性镁和酸不可溶性镁的含量,然后结合石灰石中钙和镁之间的比例关系,计算出总的钙镁含量。
a.样品准备:首先,需要将石灰石样品研磨成粉末,取适量的样品放入烧杯中,并将其干燥至恒定质量,以确定样品中的水含量。
b.酸溶:将一定量的干燥样品放入烧杯中,加入足量稀盐酸(约5-10倍样品质量),用玻璃棒搅拌均匀,并加热约30分钟至1小时,使得样品中的酸可溶性镁得以溶解。
c.滤液处理:将溶解样品过滤,将过滤后的固体洗净,并将其干燥至恒定质量。
此固体为酸不可溶性镁。
d.计算:通过测定溶解样品中的酸可溶性镁和酸不可溶性镁的含量,并结合钙镁之间的比例关系,可以计算出石灰石中钙和镁的含量。
试验11石灰石中钙镁含量的测定

试验11石灰石中钙镁含量的测定在化学分析领域,准确测定石灰石中钙镁的含量具有重要意义。
石灰石作为一种常见的矿物质,其钙镁含量的测定对于评估其质量、确定其用途以及在工业生产中的合理应用都起着关键作用。
接下来,让我们详细探讨一下石灰石中钙镁含量的测定方法。
测定石灰石中钙镁含量的方法有多种,常见的包括络合滴定法和原子吸收光谱法等。
络合滴定法是一种经典且应用广泛的方法,其原理基于钙、镁离子与特定的络合剂发生定量反应。
首先,我们来了解一下实验所需要的试剂和仪器。
试剂方面,需要准备盐酸溶液、三乙醇胺溶液、氢氧化钾溶液、钙指示剂、EDTA 标准溶液等。
仪器则包括分析天平、移液管、容量瓶、滴定管等。
实验前的准备工作至关重要。
要将石灰石样品研磨至细小均匀的粉末,以确保样品的代表性和反应的充分性。
称取一定量的样品置于烧杯中,加入适量的盐酸溶液使其溶解。
溶解过程中要注意搅拌均匀,并适当加热以加速溶解。
溶解完成后,将溶液冷却至室温,转移至容量瓶中定容。
然后,吸取一定量的溶液置于锥形瓶中,加入三乙醇胺溶液以掩蔽干扰离子。
接着,加入氢氧化钾溶液调节溶液的 pH 值,使钙镁离子能够与络合剂更好地反应。
对于钙含量的测定,加入钙指示剂,用 EDTA 标准溶液进行滴定。
滴定过程中,溶液颜色由红色变为蓝色即为终点。
记录消耗的 EDTA标准溶液的体积,通过计算得出钙的含量。
测定镁含量时,在上述测定钙后的溶液中,再加入一定量的缓冲溶液,然后继续用 EDTA 标准溶液滴定至终点,计算出镁的含量。
在实验过程中,需要注意一些操作要点和误差控制。
例如,试剂的配制要准确,移液和滴定操作要规范,以减少误差。
同时,要对实验结果进行多次平行测定,以提高数据的准确性和可靠性。
实验数据的处理也非常重要。
通过计算得出钙镁的含量后,要对数据进行合理的分析和评估。
如果数据存在较大偏差,需要检查实验操作是否存在问题,或者重新进行测定。
此外,为了确保测定结果的准确性,还需要对实验所用的仪器进行定期校准和维护。
市政工程—石灰有效钙和镁含量试验报告
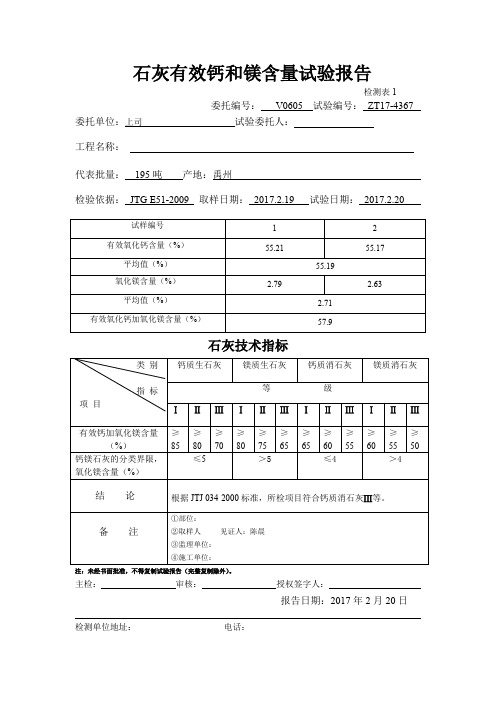
≤4
>4
结论
根据JTJ 034-2000标准,所检项目符合钙质消石灰Ⅲ等。
备注
①部位:
②取样人 见证人:陈晨
③监理单位:
④施工单位:
注:未经书面批准,不得复制试验报告(完整复制除外)。
主检:审核:授权签字人:
报告日期:2017年2月20日
检测单位地址:电话:
2.79
2.63
平均值(%)
2.71
有效氧化钙加氧化镁含量(%)
57.9
石灰技术指标
类别
指标
项目
钙质生石灰
镁质生石灰
钙质消石灰
镁质消石灰
等级
Ⅰ
Ⅱ
Ⅲ
Ⅰ
Ⅱ
Ⅲ
Ⅰ
Ⅱ
Ⅲ
Ⅰ
Ⅱ
Ⅲ
有效钙加氧化镁含量(%)
≥85
≥80
≥70
≥80
≥75
≥65
≥65
≥60
≥55
≥60
≥55
≥50
钙镁石灰的分类界限,氧化镁含量(%)
≤5
石灰有效钙和镁含量试验报告
检测表1
委托编号:V0605试验编号:ZT17-4367
委托单位:上司试验委托人:
工程名称:
代表批量:195吨地:禹州
检验依据:JTG E51-2009取样日期:2017.2.19试验日期:2017.2.20
试样编号
1
2
有效氧化钙含量(%)
55.21
55.17
55.19
氧化镁含量(%)
2017220试样编号12有效氧化钙含量55215517平均值5519氧化镁含量279263平均值271有效氧化钙加氧化镁含量579石灰技术指标类别指标项目钙质生石灰镁质生石灰钙质消石灰镁质消石灰等级有效钙加氧化镁含量858070807565656055605550钙镁石灰的分类界限氧化镁含量5544结论根据jtj0342000标准所检项目符合钙质消石灰等
市政工程—石灰有效钙和镁含量试验报告

市政工程—石灰有效钙和镁含量试验报告一、试验目的本次试验的目的是测定市政工程中所使用的石灰中的有效钙和镁含量,为市政工程的施工质量提供参考数据。
二、试验方法和原理1.试验方法本次试验采用自制反应液法。
首先将一定质量的石灰样品与浓度已知的盐酸反应,形成反应产物。
然后,以乙腈为溶剂稀释反应产物溶液,并使用酸铝石(Alizarin S)和硝酸钡溶液作为指示剂和沉淀剂。
最后,通过滴定法测定剩余的酸量,由此计算出石灰中有效钙和镁含量。
2.试验原理石灰的主要成分是钙和镁的氧化物或碳酸盐。
试验原理基于石灰与盐酸反应生成的产物,其中钙和镁与盐酸反应主要是生成氯化物。
通过对剩余酸的滴定,可以得到钙和镁含量。
酸铝石反应溶液的颜色变化可以作为滴定终点的指示剂,硝酸钡溶液用于沉淀剩余的钙和镁。
三、试验操作步骤1.将待测石灰样品称取0.1g,并加入250ml锥形瓶中。
2.向锥形瓶中加入30ml浓盐酸,盖上瓶盖并摇匀,同时注意安全。
3.待反应停止后,再向锥形瓶中加入150ml乙腈,并摇匀,使反应产物溶解。
4.待溶液彻底混合后,过滤溶液,收集滤液。
5.将滤液用试管移至试验架上,使用滴定管滴加酸铝石溶液,持续滴加直至溶液出现红色。
6.观察滴定过程中溶液颜色变化,当滴加酸铝石溶液使溶液颜色变为红色,即为滴定结束。
7.记录滴加酸铝石溶液的体积,计算滴定所需的盐酸体积。
8.使用滴定管滴加硝酸钡溶液,直至产生沉淀。
9.持续滴加硝酸钡溶液直至沉淀消失,记录滴加的体积。
10.根据滴定数据,计算出石灰样品中有效钙和镁的含量。
四、试验结果和数据分析本次试验共进行了3次独立重复实验,结果如下所示:试验1:滴定所需盐酸体积:25.0ml,滴加硝酸钡溶液体积:12.0ml试验2:滴定所需盐酸体积:24.5ml试验3:滴定所需盐酸体积:25.2ml,滴加硝酸钡溶液体积:11.9ml根据上述数据,每次实验所消耗的盐酸体积和硝酸钡溶液体积的平均值分别为24.9ml和11.9ml。
石灰石中氧化钙和氧化镁的分析方法

石灰石中氧化钙和氧化镁的分析方法【摘要】本方法在国标化工用石灰石中氧化钙和氧化镁含量测定基础上,通过长期试验积累,探索出简便快速测定石灰石中氧化钙和氧化镁的方法。
本方法利用盐酸和硝酸对石灰石样品进行分解,在PH大于12.5的溶液中以钙羧酸作为指示剂,用EDTA标准溶液滴定钙,在PH=10的溶液中以酸性铬蓝K-萘酚绿B 做混合指示剂,用EDTA标准滴定溶液滴定钙镁总量,由差减法求得氧化镁含量。
【关键词】石灰石;氧化钙;氧化镁1 样品制备制样方法:将采集的石灰石样品经颚式破碎机破碎、混匀、缩分,按上述方法重复几次操作后,将样量缩分至500g左右,用少量样品将磨样盘清洗三次,然后将样品放在磨样机中研磨至通过120目(0.13mm)标准筛即可供分析用。
2 分析方法2.1试剂和溶液2.1.1 PH=10氨性缓冲溶液:称取54g氯化铵溶于200水中,加350mL氨水,稀释至1L。
2.1.2 2%钙指示剂:称取2g钙指示剂与98g硫酸钾或氯化钠研细,在105- 110℃烘干,保存于干燥器内备用。
2.1.3铬黑T指示剂:称取0.5g铬黑T和2g盐酸羟胺溶于100mL乙醇。
2.1.4 1:1盐酸、20%氯化铵、1:1氨水、0.1%甲基橙、10%氢氧化钠、10%三乙醇胺、0.02mol/LEDTA标准溶液。
2.2试液的制备准确称取0.5- 0.7g石灰石样品于250mL烧杯中(同时做空白试验),先以少量水润湿,盖上表面皿,用滴管沿烧杯壁滴加1:1盐酸至不冒气泡后再加1:1盐酸10mL,加热至完全溶解后,加入蒸馏水50mL,加入20%氯化铵10mL及1滴甲基橙,以1:1氨水滴加至溶液刚变黄色或橙色,加热煮沸2min,滤去沉淀,滤液置于250mL容量瓶,用水洗涤至无氯离子后,用水稀释至刻度,并充分摇匀,沉淀弃去,滤液作钙镁滴定。
2.3氧化钙测定用移液管吸取25mL试液于250mL三角瓶,加水65mL,10%氢氧化钠10mL、10%三乙醇胺10mL和少许钙指示剂,以0.02mol/ L EDTA标准溶液滴定至蓝色出现为终点,消耗EDTA溶液为V1mL。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
测定石灰有效氧化钙镁含量及灰剂量
1、概述
众所周知,石灰能改善土的工程性质,便于施工,也易达到规范要求,并且成本低,故越来越广泛地被应用于公路工程中。
掺灰后土的工程性能大大改观,土的塑性降低,含水量降低,提高了土的强度和稳定性,并大大地缩短了施工周期。
为了有效地控制灰土的质量,就必须能准确地对石灰的有效钙、镁含量和灰剂量进行测定。
2、测试原理及方法
由于测定石灰有效钙镁含量和灰剂量的试验方法很多,现仅对《公路工程无机结合料稳定材料试验规程》中的几个常用试验加以剖析。
2.1 有效氧化钙的测定(T08011-94)
2.1.1 测试原理:利用石灰中的氧化钙能溶于蔗糖中,并能与盐酸反应生成蔗糖钙,而氧化镁则与蔗糖反应缓慢的原理,来测定氧化钙的含量。
2.1.2 测试的关键点:对0.5N的盐酸标准溶液的配制和标定
1)其标定过程可用以下化学反应式表示
NaCO3+2HCL—2NaCL+H2O+CO2↑
2)盐酸标准溶液的当量浓度的计算公式的由来:
由以上化学方程式可知:1摩尔的碳酸钠要消耗2摩尔的盐酸,而碳酸钠的麾尔数为Q/0.106,故盐酸的麾尔数Q/0.053,则其当量也为:Q/0.053。
故其当量浓度N=Q/0.053V (V—为盐酸的消耗的体积)
3)若计算后N>0.5,则需添加蒸馏水,其量可按下式计算:
△V水=V(N/0.5-1)
1.将石灰试样粉碎,通过1毫米筛孔,用四分法缩分为200克,再用研钵磨细通过0.15毫米筛孔,用四分法缩分为10克左右。
2.将试样在105~110℃的烘箱中烘干1小时然后移于干燥器中冷却。
3.用称量瓶按减量法称取试样约0.2克(准确至1毫克)置于锥形瓶中,迅即加入蔗糖约5在盖于试样表面(以减少试样与空气接触)同时加入玻璃珠约10粒。
接着即加入新煮沸并已冷却的蒸馏水50毫升,立即加盖瓶塞,并强烈摇荡15分钟(注意时间不宜过短)。
4.播荡后开启瓶塞,加入酚酞指示剂2~3滴,溶液即呈现粉红色,然后用盐酸标准溶液滴定。
在滴定时应读出滴定管初读数,然后以2~3滴燉秒的速度滴定,直至粉红色消失。
如在30秒钟内仍出现红色,应再滴盐酸以中和最后记录盐酸耗量(毫升)。
