大学有机化学第十章醇酚醚
10章醇酚醚习题
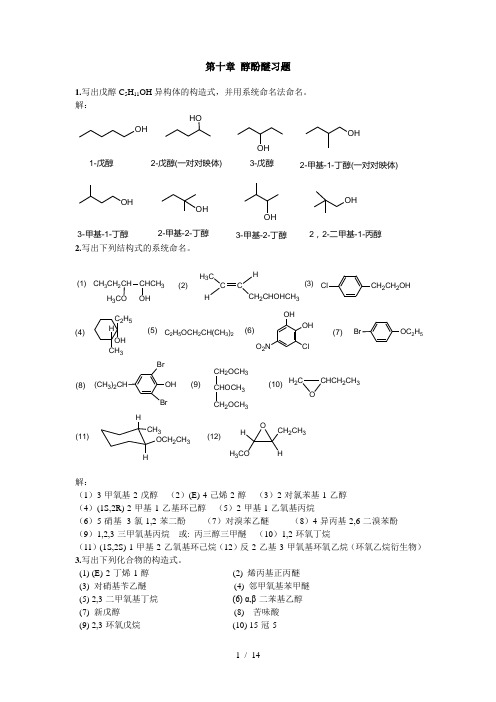
第十章 醇酚醚习题1.写出戊醇C 5H 11OH 异构体的构造式,并用系统命名法命名。
解:OHHOOHOHOHOHOHOH1-戊醇2-戊醇(一对对映体)3-戊醇2-甲基-1-丁醇(一对对映体)2-甲基-2-丁醇3-甲基-1-丁醇3-甲基-2-丁醇2,2-二甲基-1-丙醇2.写出下列结构式的系统命名。
(1)(2)(3)H 3CO CH 3CH 2CH CHCH 3OHCCHH 3C H2CHOHCH 3(11)(12)(4)(5)(6)(7)(8)(9)(10)C 2H 5OCH 2CH(CH 3)2ClCH 2CH 2OHOC 2H 5C 2H 5OH CH 3H OHOH ClO 2NBr OH(CH 3)2CHBrBrCH 2OCH 3CHOCH 3CH 2OCH 3H 2CCHCH 2CH 3OHCH 3HOCH 2CH 3OH H 3COCH 2CH 3H解:(1)3-甲氧基-2-戊醇 (2)(E)-4-己烯-2-醇 (3)2-对氯苯基-1-乙醇 (4)(1S,2R)-2-甲基-1-乙基环己醇 (5)2-甲基1-乙氧基丙烷(6)5-硝基- 3-氯-1,2-苯二酚 (7)对溴苯乙醚 (8)4-异丙基-2,6-二溴苯酚 (9)1,2,3-三甲氧基丙烷 或: 丙三醇三甲醚 (10)1,2-环氧丁烷(11)(1S,2S)-1-甲基-2-乙氧基环己烷(12)反-2-乙基-3-甲氧基环氧乙烷(环氧乙烷衍生物) 3.写出下列化合物的构造式。
(1) (E)-2-丁烯-1-醇 (2) 烯丙基正丙醚 (3) 对硝基苄乙醚 (4) 邻甲氧基苯甲醚 (5) 2,3-二甲氧基丁烷 (6) α,β-二苯基乙醇 (7) 新戊醇 (8) 苦味酸 (9) 2,3-环氧戊烷 (10) 15-冠-5解:H H 3CH CH 2OH (1)(2)(3)(4)(5)(6)(7)(8)(9)(10)H 2CCHCH 2OCH 2CH 2CH 3NO 2CH 2OCH 2CH 3OCH 3OCH 3OCH 3OCH 3PhCH 2CHOHPhOHOO O O O OOHNO 2O 2NNO 24.(1) 2,4-dimethyl-1-hexanol (2) 4-penten-2-ol(3) 3-bromo-4-methylphenol (4) 5-nitro-2-naphthol (5) tert-butyl phenyl ether (6) 1,2-dimethoxyethane 解:(1)(2)(3)(4)(5)(6)H 2CCHCH 2CHCH 3OPhHOOHOHBrCH 3OHNO 2OO5.写出异丙醇与下列试剂作用的反应式:(1) Na (2) Al(3) 冷浓H2SO4 (4) H2SO4 ,>160℃ (5) H2SO4 ,<140℃ (6) NaBr + H2SO4 (7) 红磷+碘 (8) SOCl2(9) CH3C6H4SO2Cl (10) (1)的产物+C2H5Br (11) (1)的产物+叔丁基氯 (12) (5)的产物+HI(过量) 解:(1)(2)(3)(4)(5)(6)OH +Na +++3AlONa OHOOH NaBr BrOSO 2OHH 2SO 4(浓)H 2SO 4(浓)H 2SO 4OH OH OH H 2SO 4(浓)O +Br 2(7)(8)(9)(11)(12)(10)OH ++++OOHONa OHClHI(过量)OO S I 2+ P I SOCl 2OHONa Cl O IH 3C SO2Cl 3CO6.在叔丁醇中加入金属钠,当钠被消耗后,在反应混合物中加入溴乙烷,这时可得到C6H14O ;如在乙醇与金属钠反应的混合物中加入2-甲基-2-溴丙烷,则有气体产生,在留下的混合物中仅有乙醇一种有机物,试写出所有的反应式,并解释这两个实验为什么不同? 解:第一个反应是亲核取代反应,得到的产物为醚:OHNaONaOBr第二个反应是消除反应,得到的产物是烯烃(气体):+OHNa ONaOH第一个实验是亲核取代反应,第二个实验以消除反应为主,生成烯烃,有气体放出,过量的乙醇没参加反应而留下。
有机化学-醇酚醚

醇※结晶醇—>利用氯化钙等除去混合物中的醇利用Mg、Al制取无水乙醇醇的酸性:水>醇>丙酮>炔>胺>烷烃液相:※苯酚的酸性:邻位效应使邻位取代基的酸性最大(邻o>对p>间m)给电子基团越强,酸性越弱在间位略是吸电子醇被卤素取代:SN1(只有1°伯醇SN2:活性最弱)(也是脱水活性)—>鉴别:根据不同的醇被卤素取代的活性区别:氢卤酸反应容易发生重排,SOCl2、PBr3不会碳正离子重排SOCl2构型保持※邻基参与:SN2构型保持和翻转的均有位阻影响小TsO-、BsO-:分子内脱水反应:碳正离子中间体:重排;Al2O3不重排取代为卤代烃也可减少重排(1°):※对甲苯磺酸甲酯:双分子反应,不会发生重排:TsCl-TsOH-TsOR例:分子间脱水反应成醚:1°:SN22°、3°:SN1氧化:(Sarrett试剂)不影响双键:一边丙酮、一边异丙醇新制MnO2:烯丙位羟基氧化为醛基或羰基;甲苯变成苯甲醛脱氢;(催化氧化)Pd、Cu、Ag or CuCrO4。
加热高碘酸或四醋酸铅(几个碳碳键消耗几摩尔氧化剂)也会反应中间体:环状高碘酸酯或脱醋酸形成五元环—>邻二醇四醋酸铅反式也可反应(速度慢):邻二醇还与氢氧化铜反应:二醇的脱水:频哪醇重排(羟基邻位卤素也可):动力:由碳正离子转化成稳定的(氧正离子)八隅体掉羟基:先掉碳正离子稳定的那个羟基;基团迁移(给、提供较多电子的优先):Ar- > 烷基环类:酯的热消除:顺势消除(六元环过渡态)烯烃加水(H2O,H+):易重排,马氏规则羟汞化还原(Hg(OCOCH3)2,H2O;NaBH4):不重排,马氏规则,反式加成硼氢化氧化(B2H6;H2O2,OH-):反马氏规则,顺式加成反式顺式(OsO4/H2O2)酚类:酚分子间脱水条件苛刻:ThO2,450℃酚醚制备:酚钠(强碱)与卤代烃(最好用以及卤代烃,防止发生消除反应)SN2反应有吸电子基团的活化苯环从而活化O—H键※酚类可以和酸酐、酰卤(活性更高)成酯※酚的羟基和苯环均能与卤代烃、酰卤、酸酐反应:①louis酸(或HF、磷酸):苯环②H+或碱(主要):羟基:甲基化试剂:碘甲烷,硫酸二甲酯,重氮甲烷芳环亲电取代:极性溶剂三取代;邻对位产物一般可通过水蒸气蒸馏分离亚硝基化:与重氮盐形成偶氮化食物与羰基的缩合:碱性形成氧负离子,形成共振式再加成:酸性:形成碳正离子对苯环加成:缩聚:碱性形成氧负离子,形成共振式再加成酸性形成碳正离子对苯环加成:特殊重排:Fries重排(不能有强吸电子基团):类似克莱森重排Claisen重排:邻位反,对位直接接Kolbe反应酚钾在对位取代异丙苯氧化制苯酚:醚:自动氧化:形成氧正离子:溶于酸;与louis酸形成络合物醚键的断裂:断的C-O的碳:连卤原子有甲基的断甲基(SN2甲基位阻小)有叔丁基的断叔丁基(SN1碳正离子稳定)※酚醚得酚和卤代烃应用:脱氧得氢:小环醚:立体化学:SN2(酸性带有SN1性质,但不会形成完全的碳正离子,不是外消旋体):反式开环产物。
醇酚醚jppt课件.ppt

OH | CHCHCH3
—OH
—OH
芳香醇:
—CH2OH
饱和一元醇的通式:CnH2n+1OH
病 原体侵 入机体 ,消弱 机体防 御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
一、醇的分类
按羟基数目分类:
一元醇: 二元醇:
多元醇:
CH3CH2OH
② 疏水基:非极性的,不易溶于水而易溶于非极性物 质的基团,如:—R
③ 一元醇:低级醇(CH3—OH,C2H5—OH等)能与水互 溶,随着碳链的增大,在水中溶解度显著降低。
H
R
R—O O—H····O
H
H
④ 多元醇一般可与水混溶。
H·····O H
病 原体侵 入机体 ,消弱 机体防 御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
化学性质。
似水性。 与酸反应。 醇的脱水。 氧化反应。
病 原体侵 入机体 ,消弱 机体防 御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
一、醇的分类
1. 按烃基不同分类:
饱和醇: 不饱和醇: 脂环醇:
CH3OH、CH3CH2OH CH2 CHCH2OH、CH2
四、化学性质—似水性
反应活性:
① 烷基增大,活性降低:叔醇 < 仲醇 < 伯醇﹤甲醇 ② 碱性:叔醇钠 > 仲醇钠 > 伯醇钠 > 甲醇钠 > NaOH
醇钠的水解:
CH3ONa + H2O
较强的碱 较强的酸
有机化学第十章醇酚醚

B、脱水过程可能重排。
(CH3)3CCHCH3 OH
85%
H3PO4
(CH3)2C=C(CH3)2 80%
+ 0.4%
+ (CH3)2CHC=CH2 20%
CH3
(CH3)3CCH=CH2
2019/1/16
CH3 CH3CH2CHCH2OH
H
CH3 CH3CH2CHCH2 伯碳正离子 -H CH3 CH3CH2-C=CH2
3)在制备叔丁醇钾时常用KH。
2019/1/16
2、与Mg、Al作用
C2H5OH
+Mg
Mg(C2H5O)2 H2O
+ H2 +
Mg(OH)2
C2H5OH
在实验室常用醇镁来除去乙醇中的水分制备 无水乙醇。
(CH3)2CHOH (CH3)3COH
+ Al +Al
(CH3)2CHO 3 Al (CH3)3CO
3Al +H2
+
H2
异丙醇铝、叔丁醇铝在有机合成中常作催 化剂、还原剂。
2019/1/16
二、与卤化试剂作用 1、与HX作用
ROH +HX RX
+ H2O
注意:A、HX的活性:HI>HBr>HCl。 B、醇的活性:烯丙式、苄卤式>3°ROH >2°ROH>1°ROH。
ZnCl2 (CH3)3CCl +H2O r.t 2 CH3CH2CHCH3 + HCl(n) ZnCl CH3CH2CHCH3 +H2O r.t OH Cl 2 X¼¸ С ʱ Ò² ² » » ë × Ç CH3CH2CH2CH2OH + HCl(n) ZnCl r.t (CH3)3COH
有机化学 醇酚醚

H C 3 C C H 3 H C C H 3H O 2 H C 3 C C H 3 H C +C H 3
HO H
HO + H 2
H
C H 3H
重 排
H 3 CC + CC H 3 H
C H 3H
C l
H 3 CC CC H 3
C l H
上页 下页 返回 退出
C H 3
C H 3
C H 3
+ HB r
上页 下页 返回 退出
有些醇〔除大多数伯醇〕与氢卤酸 反响,常有重排产物生成。
C H 3 H
C H 3 H
C H 3 H
H C 3 C
HC l
C C H 3 H C 3 C
C C H 3 不 是 H C 3 C
C C H 3
HO H
C lO H
H C l
机理:
+ C H 3 H +
H C 3 C C C H 3H
三元醇(丙三醇)
上页 下页 返回 退出
8.1.1 醇的构造、分类和命名
〔3〕 醇的命名 结构简单的一元醇可用习惯命名法命名。
方法是在相应的烃基名称的后面加上“醇〞 字来命名,“基〞字一般可忽略。如:
H3 CC H2C H2 O H
正丙醇
H2 CC H C H2 O H
烯丙醇
H3C CH CH3 OH
+ C H 3 C H 2 C H C H 3
H CZ ln C l2
20℃
C H 3 C H 2 C H C H 3
H O 2
O H
Cl10分钟变浑浊
+ C H C 3 H C 2 H C 2 H O 2 H H 2C 0℃Z - ln (C 不2 l 反C 应H )C 3 H C 2 H C 2 H C 2lH O 2 加热后才反应
醇酚醚

3) 用Al2O3代替质子酸时,碳骨架不会发生重排。
CH3 H3C C CHCH3 CH3OH
Al2O3 CH3 H 3C C CH3 CH CH2
H H2O
CH3 H3C C
+
CH3 H 3C C CHCH3
CH3
H
+
CH3
CHCH3 CH3
H3C C C CH3 CH3
5、醇的氧化与脱氢:
常用氧化剂:K2Cr2O7-H2SO4, CrO3-HOAc, KMnO4
第十章 醇、酚、醚
(ALCOHOLS .PHNOL. ETHERS)
醇、酚、醚都是烃的含氧衍生物。 醇与酚还有相同的官能团:羟基(-OH)。 相同分子式的醇与醚互为同分异构体。
第一节、醇
一. 醇的分类与命名 二. 醇的结构 三. 醇的制备 四. 醇的物理性质 五. 醇的化学性质 1. 醇的酸性 2. 卤代烃的生成 3. 脱水反应 4. 氧化与脱氢反应
第二节、酚
1.酚的结构和命名 2.酚的制备 3.酚的物理性质 4.酚的化学性质
第三节 、醚
一. 醚的命名
二. 醚的制备 三. 醚的化学性质
四. 环氧化合物ቤተ መጻሕፍቲ ባይዱ性质
第一节 醇ALCOHOLS)
一、醇的分类和命名 R-OH
CH2-CH2-CH2 OH OH OH 丙三醇 (甘油) (Glycerin) CH3CH2OH CH2-CH2 OH OH 乙醇 乙二醇 (甘醇) (Glycol)
1) 与氢卤酸反应
R OH + HX
反应活性顺序:
HI > HBr > HCl
R X + H2O
RCH=CH-CH- > 3 > 2 > 1 < CH3OH
有机化学(第五版)第十章 醇、酚、醚

2) 根据分子中烃基的类别分为:脂肪醇、脂环醇、 和芳香醇(芳环侧链有羟基的化合物,羟基直接连在 芳环上的不是醇而是酚)。
3) 根据分子中所含羟基的数目分为:一元醇、二元 醇和多元醇。 两个羟基连在同一碳上的化合物不稳定,这种结 构会自发失水,故同碳二醇不存在。另外,烯醇是不 稳定的,容易互变成为比较稳定的醛和酮。 井冈山大学化学化工学院
井冈山大学化学化工学院
关于频哪醇重排需要注意的问题
3.某些环状结构的频哪醇,重排后可得环扩大产物
井冈山大学化学化工学院
五、Preparation of Alcohols
1.由烯烃制备 1) 烯烃的水合 2) 硼氢化-氧化反应
硼氢化反应操作简单,产率高,是制备伯醇的好办法。
井冈山大学化学化工学院
3)羟汞化-脱汞反应
井冈山大学化学化工学院
乙醇液膜
乙醇(CCl4)
四、Chemical Properties of Alcohols
醇的化学性质主要由羟基官能团所决定,同时也受到烃 基的一定影响,从化学键来看,反应的部位有 C—OH、 O—H、和C—H。
分子中的C—O键和O—H键都是极性键,因而醇分子中有 两个反应中心。 又由于受C—O键极性的影响,使得α—H具 有一定的活性,所以醇的反应都发生在这三个部位上。 井冈山大学化学化工学院
(2)双分子消除反应(E2)
一步反应:
E2反应的特点: 1)一步反应,与SN2的不同在于B:进攻β-H。 E2与SN2是互相竟争的反应。 2)反应要在浓的强碱条件下进行。 3)通过过渡态形成产物,无重排产物。 井冈山大学化学化工学院
2. 消除反应的取向
A. Saytzeff规则:优先生成具有较多烷基取代的(也是较稳定的)烯烃。
大学有机化学第十章醇酚醚

(80%) Saytzeff 产物
C. 用Al2O3为催化剂时,醇在高温气相条件下脱水,
往往不发生重排反应。
C H3 C H3 C C H C H3
Al2O3 气 相
C H3 C H3 C C H3 (主要产物 ) C H= C H2 + H2O
C H3 O H
2. 分子间脱水
醇的分子间脱水生成醚(反应是SN反应)
CH3CH2CH2CH2I + H2O
H2SO4 ZnCl2
+ HBr (48%) + HCl
CH3CH2CH2CH2Br + H2O CH3CH2CH2CH2Cl + H2O
特别地:
Lucas试剂(无水ZnCl2与浓HCl配制的溶液)鉴别 六个碳以下的伯、仲、叔醇(烯丙式醇)
现象 R3C-OH
R3C-Cl
反应的立体化学特征:醇的α- 碳原子的构型保持。
R'
α
Cl C OH + Cl S O
R'
R'
δ
R H
SOCl2 α C HCl
R
O
δ
α
S O
SO2
R H
C
Cl
H Cl
ii. 与PX3 , PX5反应
ROH
+
PX 3
RX + H3PO 3
(X=Cl 、 Br、I)
优点:不发生重排
因为反应是按SN2历程进行,不生成碳正离子中间体。
3. 醛、酮还原制醇
C O [H] CH OH
[H]: 催化氢化、NaBH4、LiAlH4、 Al[OCH(CH3)2]3等
CH3CH2CH2CHO O CH3CH2-C-CH3 NaBH4 H2O NaBH4 H2O CH3CH2CH2CH2OH 85% CH3CH2-CH-CH3 OH 87%
有机化学10醇酚醚

CH2=CH
OH
6
5
4-丙基-5-己烯-1-醇
3 21
-CH=CHCH2-OH 3-苯基-2-丙烯醇
如果为多元醇-----选择含尽可能多-OH的最长碳 链为母体。
CH3 CH3 CH3 — C — C—CH3
OH OH
2,3-二甲基-2,3-丁二醇
1CH2OH CH3CH2 -2C-CH2OH
3CH2OH
H
反应实质是SN2取代历程
醇分子间脱水和分子内脱水是两种互相竞争的反应。
较低温度——取代-----有利于生成醚(~140℃) 较高温度—消---除--—有利于生成烯烃(~170 ℃ )
4. 酯的生成
醇和无机酸、有机酸作用,生成相应的酯
与有机酸反应: O
C2H5OH + CH3-C-OH
O
H+
CH3-C-O-C2H5 + H2O
酸性
HOH pka:
>
CH3OH
> CH3CH2OH
> (CH3)2CHOH
> (CH3)3COH
15.7
16
18
18
19
碱性 -OH < CH3O ˉ < CH3CH2Oˉ < (CH3)2CHOˉ < (CH3)3COˉ
钠与其他活泼金属如镁、铝、铝汞齐(Al-Hg)、镁 汞齐(Mg-Hg)等在较高温度下作用生成醇镁、醇铝。
原因------主要是 分子间形成氢键。
CH3CH2OH
b.P. 78.5℃
HOCH2CH2OH b.P. 198℃
3. 水溶性
① 低级醇(C1 ~ C3)能与水混溶
② 从C4开始,随C 溶解度
H
R
基础有机化学醇酚醚

Alcohols Phenols Ethers
有机化学
主要内容
醇的结构、命名、性质和制备; 酚的结构、命名、性质和制备; 醚的结构、命名、性质和制备; 消除反应历程及与亲核取代反应的竞争;
重点难点
醇、酚、醚的化学性质和制备; 消除反应历程及与亲核取代反应的竞争。
10-1 醇
1结构、分类和命名
CH3CHCH2CHCH3 CH3 OH 4-甲基-2-戊醇
4-methyl-2-pentanol
CH2CH2OH
2-苯基乙醇 2-phenylethanol
❖不饱和醇:选择含不饱和键并连有羟基的最长碳链作主链, 编号从离羟基最近的一端开始。
❖名称中羟基在1-位的可以省略。
C H 2 C H C H 2O H
CH3
C H 3C O H HC H 2C H 3H C 室 l 温 Z nC l2
CH3
CH CH2CH3
C(l 几分钟混浊)
C H 3C H 2 C H 2C H 2O H H C l△ Z n C l2 CH3CH2CH2CH2Cl (室温无变化,加热后反应)
❖乙醇的核磁共振氢谱:
a. b.
c.
a. b. c. CH3CH2OH
a:1.1; b:3.7; c:2.6
3 醇的化学性质
结构与性质
醇的官能团是羟基,各原子的电负性为:C(2.5)、 O(3.5)、H(2.1),形成极性的C-O键和O-H键。
亲核试剂进 攻带正电C, 断C-O键,
OH被取代 R
β-氢消除
HH
C
δC
δ
O
弱酸性, 断O-H键, H被取代.
作亲核试剂
第十章 醇酚醚 10-2

20℃
OH +
13%
OH
NO2
40%
NO2
邻硝基苯酚和对硝基苯酚可以用水蒸气蒸馏方法进行分离。 邻硝基苯酚可以在分子内形成氢键。 对硝基苯酚则只能在分子间形成氢键。 在水溶液中: 邻硝基苯酚不能与水分子形成氢键。 对硝基苯酚能与水分子形成氢键。 这就决定了它们在沸点和水溶性方面的差别。 O H O-N + O
邻硝基苯酚(形成分 子内氢键容易挥发)
O H O N+ O O
-
N
-
+
O
O
N
+
O
- H
H
O
O H
对硝基苯酚(形成分 子间氢键不易挥发)
O H O
H
H
④ Friedel-Crafts反应 酚的烷基化反应一般用质子酸或酸性阳离子树脂催化:
OH OH OH
H2SO 4 or HF
+ (CH3)2C=CH2
R-O-R′
R = R′—— 简单醚 R = R′—— 混合醚
C—O—C -----醚键
不等性SP3杂化
如:CH3-O-CH3 如:CH3CH2-O-CH3、Ar-O-CH3
脂环烃的环上碳原子被一个或多个氧原子取代后所形成 的化合物,称为环醚。其中三元环的环醚称为环氧化物。
§ 10.2 酚 § 10.3 醚
R-OH -OH R-O-R/
§ 10.2 酚 ■ 一、 酚的分类和命名 ■ 二、 酚的结构 ■ 三、 酚的制法
■ 四、 酚的物理性质和波谱性质
■ 五、 酚的化学性质
一、 酚的分类和命名
酚:羟基直接与芳环的碳原子相连。 OH OH 酚: 苯酚 酚的构造异构 ——由于烃基与羟基在芳环上的相对位次不同而引起的。
第十章醇酚醚

3. 相对密度 一元醇的相对密度大于烷烃,但小于1,多元醇、芳香 醇的相对密度大于1。 4. 与某些无机盐形成结晶醇化合物 MgCl2· 6CH3OH CaCl2· 2H5OH 4C
① 有机物中有少量醇时,可加无机盐提纯。 如:工业乙醚常杂有少量乙醇,加入CaCl2可使醇从
乙醚中沉淀下来。
②不能用无水MgCl2、CaCl2、CuSO4 等无机盐干燥醇。
R Cl
反应生成的卤代烃不溶于Lucas试剂,溶液出现混浊或分层。 ①叔醇在室温下很快出现浑浊,并分层; ②仲醇要5~10分钟后出现浑浊; ③伯醇在室温下不发生反应,加热才出现浑浊。 适用范围:六个碳以下的醇。大于6个碳的醇(苄醇除外) 不溶于卢卡斯试剂,易混淆实验现象。
烯丙式醇、叔醇、大多数仲醇,反应是按SN1历程进行的。
§10-1 醇
一、分类、命名和结构
1. 分类 (1)根据和羟基相连的碳原子的类型:
CH3
CH3CH2CH2OH
伯醇 一级醇(1º 醇)
CH3CH2CHCH3 OH
仲醇 二级醇(2º 醇)
CH3
C OH
叔醇
CH 3
三级醇(3º 醇)
(2)根据分子中烃基的类别:
CH3CH2OH
脂肪醇 脂环醇
OH
芳香醇
C6H5 C6H5 C OH C 6 H5
三苯甲醇
triphenyl carbinol
主官能团的优先次序为:羧酸、磺酸、酯、酰卤、酰
胺、腈、醛、酮、醇、酚、胺、醚。
OH
CH3CHCH2CHO OH
3-羟基丁醛 3-hydroxylbutanal
CH2OH
邻羟基苯甲醇 o-hydroxyl benzyl alcohol
有机化学第十章 酚醚

Me O OAlCl3 + O C CH3
OH O CH3 OH
AlCl3
4).Claisen 重排
O CH2CHCH2 190-220C 6h O CH2CHCH2 CH3 CH2CH CH2 H3C OH CH3 OH CH2CH CH2
O CH3
H3C
NO2 (苦 味 酸 )
产率低
沸点相差较大!
H
• 分子内氢键 • 分子间氢键
O
O N O
O
H
O N
O
O
H O
H H H
N O O O H
O N O O H
⑶ 亚硝化
酚还可磺化、烷基化、酰基化。
⑷ 缩合
OH H OH O H C H CH2OH
+
• 用于制备酚醛树脂(电木、胶黏剂等)
3. 氧化
二、物理性质与光谱性质
沸点低,易挥发,良溶剂,可与水形成氢键;故部分醚能溶 于水,如(四氢呋喃、1,4-二氧六环等环醚) IR: C-O伸缩振动 1300-1100 cm-1; 1H-NMR:与氧相连的碳原子上的氢的化学位移在4附近。
三、化学性质
1. ������盐的生成
ROR
ROR
+ H+
+ BF3
+
FeCl3
H3[Fe(OC6H5)6]
+
3 HCl
C
C
OH
⑶ 醚的生成
OH NaOH ONa RX OR
或 (CH3O)2SO2
• 用途:保护酚羟基
O C H
1.NaOH 2.CH3I O C H
OMe
HI
OH
有机化学C第10章 醇酚醚问题参考答案
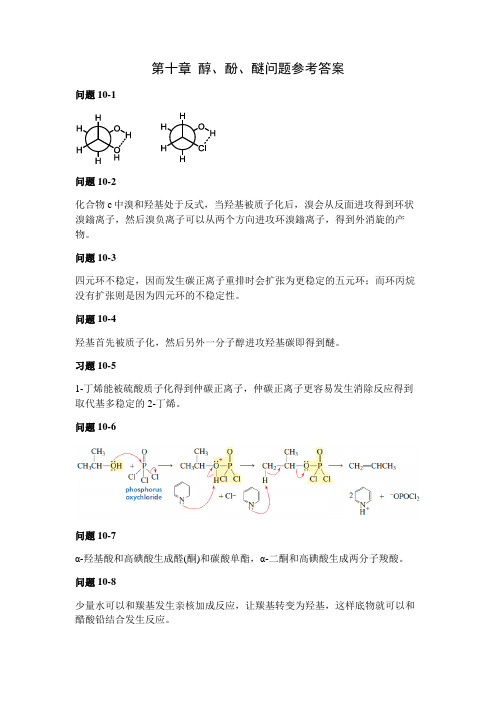
第十章醇、酚、醚问题参考答案问题10-1问题 10-2化合物c中溴和羟基处于反式,当羟基被质子化后,溴会从反面进攻得到环状溴鎓离子,然后溴负离子可以从两个方向进攻环溴鎓离子,得到外消旋的产物。
问题10-3四元环不稳定,因而发生碳正离子重排时会扩张为更稳定的五元环;而环丙烷没有扩张则是因为四元环的不稳定性。
问题10-4羟基首先被质子化,然后另外一分子醇进攻羟基碳即得到醚。
习题10-51-丁烯能被硫酸质子化得到仲碳正离子,仲碳正离子更容易发生消除反应得到取代基多稳定的2-丁烯。
问题10-6问题10-7α-羟基酸和高碘酸生成醛(酮)和碳酸单酯,α-二酮和高碘酸生成两分子羧酸。
问题10-8少量水可以和羰基发生亲核加成反应,让羰基转变为羟基,这样底物就可以和醋酸铅结合发生反应。
问题10-9乙醇中氧的电负性强,分子间形成氢键的作用比较强;而硫的电负性比氧弱,因而分子间氢键没有乙醇强,所以沸点比乙醇低。
问题10-10问题10-11二价镁具有Lewis酸性,能和羰基氧络合,然后碳负离子进攻羰基碳。
问题10-12邻硝基苯酚酸性最强,间硝基苯酚酸性最弱。
邻对位硝基苯酚由于共轭效应具有比间硝基苯酚强的酸性;而且邻硝基苯酚的诱导效应比对硝基苯酚强,同时还可以形成分子内氢键。
问题10-13邻位产物会形成分子内氢键,具有较低的沸点,因而可以将邻位产物的对位产物分开。
问题10-14硝基越多芳环的亲电性越强,反应条件越温和。
问题10-15苯酚与NaOH反应生成盐后具有更强的亲核性,可以与醛发生亲核加成反应。
问题10-16四氢呋喃为环状结构,氧更加裸露,因而更容易与水形成氢键相互作用,因而可以与水互溶。
问题10-17因为在该反应中没有进攻手性中心,所以手性构型不发生变化。
问题10-18问题10-19伯醇为S N2反应,羟基先被质子化,然后另外一分子醇进攻羰基碳得到醚。
仲醇可能会发生S N2反应和S N1反应。
问题10-20。
有机化学课件10-醇酚醚

如:乙醚中的少量乙醇,加入 CaCl2便可除去少量乙醇。
三、醇的光谱性质 IR:-OH 未缔合的在3640-3610cm-1有尖峰 缔合的在3600-3200cm-1宽峰
ROH的活泼次序:CH2=CH-CH2OH > R3C-OH > R2CH-OH > RCH2OH
当一级醇与氢碘酸(47%)一起加热就可生成碘代烃。
RCH2OH + HI
RCH2I + H2O
与氢溴酸(48%)作用是必须在H2SO4存在下加热才能生成溴代烃。
RCH2OH + HBr H2SO4 RCH2Br + H2O
与浓盐酸作用必须有氯化锌存在并加热才能产生氯代烃。
RCH2OH + HC l ZnCl2 RCH2C l + H2O
烯丙式醇(CH2=CHCH2OH或C6H5CH2OH)和三级醇在室温下和浓盐酸 一起震荡就有氯代烃生成。
(2) Lucas试剂(ZnCl2+浓HCl): 利用醇和盐酸作用的快慢,可以区别一、二、三级醇,所用试剂
1.与活泼金属作用
醇中O-H 越易断裂,反应速度越快。醇的酸性越强,O -H越易断。
2 CH3CH2OH + 2Na
2 CH3CH2ONa + H2
(CH3)3C OH + KH
(CH3)3C OK + H2
2.与氢卤酸反应
ROH + HX
RX + H2O
(1)HX的活泼次序:HI > HBr > HCl.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH OH 2
烯丙醇
环己醇
苄醇
②系统命名法
4 32 1 CH2=CHCHCH2OH
CH3
2-甲基-3-丁烯-1-醇
4 32 C6H5CH=CHCHOH
1 CH3
4-苯基-3-丁烯-2-醇
C6H5 H 1 OH
C2H5
1
OH
2 3
3C l 2 1
(R)-1-苯基-1-丙醇 2-环己烯醇 3-氯环己烯
OH
R'
OH
R
30 叔醇( R' C O H ): (CH3)3COH
R''
② 按羟基所连的烃基分:
饱和醇:
OH
CH3CH2OH (CH3)3COH
不饱和醇:
OH
CH2=CHCH2OH CH3C≡ CCH2OH
芳香醇:
CH OH 2
CHOH 2
③ 按羟基的数目分类:
一元醇: CH3CH2CH2OH
注意: 反应的第一步要绝对无水,因此两步一定要分开,制备 格式试剂的卤代烃或者与格式试剂反应的化合物都不能含有活 波氢(-OH,-NH2,-COOH,-CHO)
3. 醛、酮还原制醇
C O [H]
C HO H
[H]: 催化氢化、NaBH4、LiAlH4、 Al[OCH(CH3)2]3等
CH3CH2CH2CHO
结晶醇 (溶于水\不溶于有机溶剂)
因此:
不能用无水CaCl2干燥ROH
2. 醇与活泼金属的反应 ——弱酸性
+ + C3 C H2 O HHNa C3 C H2 O HNH a 2
+ (C 3 )3 C HOH K
+ (C 3 )3 C HOH K 2
醇金属: 强碱性试剂和强亲核性试剂
酸性: H2O > ROH > RCCH
孤对电子
::
碱性 α RCOH
涉及α H的反应
H
酸性
羟基被取代
1. 氧孤对电子导致的化学性质——Lewis碱
① 溶于强酸
浓H2SO4 ROH
ROH 稀释或受热 ROH H
钼羊盐
应用:
▪除去烷烃或卤代烃中的少量醇 ▪区分醇与烷烃、卤代烃
② 与金属离子的络合
MgCl2•6ROH CaCl2•4ROH
酸催化可使羟基质子化,减弱C-O键,然 后以水的形式离去。
a) SN1: 烯丙醇、苄醇、叔醇、仲醇。
R R C OH
R
H+
+
R C OH 2
H2O
R R C+ X
R RC X
R
R
R
R
C 3H
C 3H
C 3H
C 3C HC HC H 3H HB C 3r C HC HC H 3H +C 3C H C 2C H 3
第十章 醇醚
Alcohols & Ethers
(一) 醇
一、分类和命名
RC R H C 2 H O 2O H H
R R C C H H R R 2 2
O H
O H
R R 22 R RC CR R 33
O H
O H
① 按羟基所连碳原子的类型分:
10 伯醇( RCH2OH ): CH3CH2OH
20 仲醇( R CH OH ): CH3CHCH2CH3
NaBH4 H2O
O CH3CH2-C-CH3
NaBH4 H2O
CH3CH2CH2CH2OH 85%
CH3CH2-CH-CH3 OH 87%
三. 醇的物理性质
1. 常温下性状 直链饱和一元醇中:
▪C4以下的醇为具有酒味的流动液体 ▪C5~C11的醇为具有不愉快气味的油状液体 ▪C12以上的醇为无味的蜡状固体
R
C OMgX
H2O
H
H
H
甲醛
H R C OH
H 伯醇
H
R' 无水乙醚
RMgX + R'
CO
R C OMgX
H2O H
H
醛
R'' RMgX +
R'
R' C O 无水乙醚 R C OMgX
H2O H
R''
酮
1)格式试剂与甲醛反应制伯醇 2)格式试剂与一般醛反应制仲醇 3)格式试剂与酮反应得叔醇
R' R C OH
2. 由Grignard 试剂制醇
①与环氧乙烷反应 ——制多两个碳的伯醇
+ H 2C C H 2
干醚 RMgX RC2HCH2OMgX
O
H 2O
RC2HCH 2OH
② 与醛、酮反应
+ C O
干醚 RM gX
C
R
*源自羰基碳
OMgX
H 2O
R C OH
*源自格式试剂
H
H RMgX +
C O 无水乙醚
OH (游3离 6~ 5) 306c0m ( 0 1 较 变 强,锐峰
OH (缔合 35) 0~0320cm 0( 1 强 中强,宽、钝
2.C-O伸缩振动: CO 125~0100c0m( 1 强)
四. 醇的化学性质
H
H H
C O
sp3
H
:
:
+ -
C-O键断裂 取代或消除
极性键
弱 酸 性
+
碱性
H 仲醇
R' R C OH
R'' 叔醇
a
CH3 b
C CH2CH3
b
c OHa
c
O C CH3 O C CH2CH3 +CHMgI
MgBr +CH3CCH2CH3
O
O
O
C 2 H 5 M g B r+ H O C H 2 C H 2 C C H 3 C2H 6 +BrM gO CH 2CH 2CCH 3
二. 醇的制备
1. 由烯烃制醇
①直接水合法
RCHCH2
H2O H+
②间接水合法
RCH C3 H OH
RC C H H 2 H 2 S4O R CC H 3H H 2 O R CC H 3H
O3 S HO
O H
③ 硼氢化-氧化反应 ——制反马氏醇
RCH C H 2 1) 2 B H 6 RC 2CH 2H OH 2) 2 H O 2/ OH-
OH
二元醇: H2C CH CH3
OH
OH OH
OH
三元醇: H2C CH CH2
OH OH OH
2. 命名
① 普通命名法(先叫烃基,后叫醇)
CH3CH2CH2OH 正丙醇
CH 3CHOH CH 3
异丙醇
CH3CHCH2OH
CH3 异丁醇
CH3CHCH2CH3 OH
仲丁醇
CH2=CHCH2OH
(CH3)3COH 叔丁醇
2. 氢键对低级醇物理性质的影响
氢键
沸点:
水溶性:
氢键
R
R
R
O
O
O
HH HH HH
O
O
O
H
H
H
低级醇与水混溶,随着醇相对分子质量的 增大,醇在水中的溶解度逐渐减小。
波谱性质:
羟基特征频率: OH伸缩振动,C-O伸缩振动和OH的弯曲振动。
1.O-H伸缩振动: OH 365~0320c0m( 1 强)
EtONa + H2O
EtOH + NaOH
3. 醇羟基的卤代(碳氧键断裂的反应)
1)亲核取代反应 ① 与HX反应
CH3CH2CH2CH2OH + HBr
i. 反应机理
CH3CH2CH2CH2Br + H2O
亲核取代反应
R X + H RO X H δR + δO - + H ·H · X
醇的亲核取代反应一般在酸性条件下进行
