全胃切除术后肠道营养吸收功能障碍和调节
手术后出现食欲下降的原因及处理

手术后出现食欲下降的原因及处理手术对于身体来说是一种重大的应激事件,无论是大手术还是小手术,术后都可能出现食欲下降的情况。
这不仅会影响身体的恢复,还可能导致营养摄入不足,延缓康复进程。
了解手术后食欲下降的原因,并采取适当的处理方法,对于患者的康复至关重要。
一、手术后食欲下降的原因1、身体的应激反应手术会引起身体的应激反应,导致体内激素水平的变化。
例如,皮质醇等应激激素的分泌增加,会影响胃肠道的功能,使消化液分泌减少、胃肠蠕动减慢,从而导致食欲下降。
2、疼痛术后的疼痛是常见的症状,疼痛会刺激神经,引起身体的不适和紧张感,进而影响食欲。
患者可能因为害怕进食会加重疼痛,或者在疼痛的状态下无法集中精力进食。
3、药物副作用手术后通常会使用多种药物,如抗生素、镇痛药、麻醉药等。
这些药物可能会对胃肠道产生副作用,引起恶心、呕吐、腹胀、消化不良等症状,从而导致食欲下降。
4、心理因素手术带来的心理压力、焦虑和恐惧等情绪问题,可能会影响食欲。
对手术结果的担忧、对康复过程的不确定性以及住院环境的不适应等,都可能导致食欲减退。
5、术后活动减少手术后患者往往需要卧床休息,活动量减少。
这会使胃肠蠕动减慢,消化功能减弱,导致食欲下降。
6、手术部位和类型不同部位和类型的手术对食欲的影响也不同。
例如,胃肠道手术可能会直接影响消化功能,导致食欲下降;而胸部或骨科手术可能会因为疼痛和活动受限间接影响食欲。
7、营养状况如果患者在手术前就存在营养不良的情况,术后身体的恢复能力会受到影响,食欲也可能更难以恢复。
二、手术后食欲下降的处理方法1、控制疼痛有效的疼痛管理是提高食欲的关键。
医生会根据患者的情况,选择合适的镇痛药物和方法,如口服止痛药、静脉输注镇痛药或使用镇痛泵等。
同时,可以结合物理治疗,如冷敷、热敷、按摩等,缓解疼痛。
2、调整饮食(1)少量多餐:避免一次进食过多,增加进食的次数,减轻胃肠道的负担。
(2)选择易消化的食物:如米粥、面条、蒸蛋、鱼肉等,避免油腻、辛辣、刺激性食物。
全胃切除术后肠道营养吸收功能障碍和调节

手术后出现营养代谢紊乱的原因及处理

手术后出现营养代谢紊乱的原因及处理手术对于患者的身体来说是一次重大的创伤,术后患者的身体需要消耗大量的能量和营养物质来进行修复和恢复。
然而,在这个过程中,部分患者可能会出现营养代谢紊乱的情况,这不仅会影响患者的康复速度,还可能导致一系列并发症的发生。
那么,手术后出现营养代谢紊乱的原因究竟有哪些?又该如何进行处理呢?一、手术后出现营养代谢紊乱的原因1、手术应激反应手术作为一种强烈的应激源,会导致患者体内的神经内分泌系统发生一系列变化。
例如,交感神经系统兴奋,使得肾上腺素、去甲肾上腺素等激素分泌增加,进而引起代谢率升高、蛋白质分解加速、糖原分解和糖异生增加等。
同时,应激反应还会导致胰岛素抵抗,使得细胞对葡萄糖的摄取和利用减少,进一步加重了能量代谢的紊乱。
2、消化吸收功能障碍手术后,患者的胃肠道功能可能会受到不同程度的影响。
例如,腹部手术可能会导致胃肠道蠕动减慢、麻痹,甚至出现肠梗阻等情况,从而影响食物的消化和吸收。
此外,手术引起的胃肠道黏膜损伤、炎症反应等也会导致消化酶分泌减少、吸收面积减小,进一步影响营养物质的吸收。
3、营养物质摄入不足手术后,患者往往会因为疼痛、恶心、呕吐、食欲不振等原因而减少饮食摄入。
尤其是在术后早期,患者可能需要禁食一段时间,这就导致了营养物质的供应不足。
此外,部分患者由于对术后饮食的认识不足,可能会选择不合理的饮食,导致营养不均衡,也容易引起营养代谢紊乱。
4、代谢需求增加手术创伤会导致机体处于高代谢状态,蛋白质、脂肪和碳水化合物的代谢都发生了改变。
蛋白质分解增加,用于合成急性期蛋白和修复受损组织;脂肪动员加速,以提供更多的能量;碳水化合物代谢紊乱,出现血糖升高或降低等情况。
如果营养供给不能满足这种高代谢的需求,就容易出现营养代谢紊乱。
5、基础疾病的影响一些患者在手术前就存在慢性疾病,如糖尿病、慢性肾病、肝病等,这些疾病本身就可能存在营养代谢的异常。
手术后,由于身体的应激反应和代谢改变,这些基础疾病可能会进一步加重,从而导致营养代谢紊乱更加复杂。
胃全切术后护理问题与措施

胃全切术后护理问题与措施
胃全切术是一种严重的手术,需要术后精心的护理。
以下是一些胃全切术后护理问题及相应措施:
1. 术后恶心和呕吐:胃切除手术后,由于胃的消化功能减弱,患者可能会感到恶心和呕吐。
医护人员应该及时给予患者止吐药,并调整饮食,避免过度进食或进食过快。
2. 饮食问题:由于胃被切除,患者需要调整饮食,避免进食过多或过少,同时需要注意饮食的质量和营养成分。
医护人员应该给予患者合理的饮食建议,并定期进行饮食评估。
3. 伤口护理:术后伤口护理非常重要,必须保持清洁和干燥。
医护人员应该定期更换敷料,观察伤口情况,及时处理并预防感染。
4. 呼吸问题:术后患者可能会出现呼吸困难的情况,特别是在仰卧位时。
护士应该帮助患者调整体位,保持呼吸通畅,并及时处理呼吸窘迫的情况。
5. 动脉血氧饱和度问题:术后患者可能会出现动脉血氧饱和度下降的情况,尤其是在麻醉后。
医护人员应该及时监测血氧饱和度,给予氧疗等必要的护理措施。
总之,胃全切术后护理问题和措施非常复杂,需要医护人员及时发现和处理相关问题,确保患者顺利恢复。
- 1 -。
全胃切除术后的病人肠内营养的应用及护理

全胃切除术后的病人肠内营养的应用及护理【摘要】目的探讨全胃切除术后早期肠内营养的护理方法,保证病人足够的营养摄入,降低病人的住院费用,早日痊愈。
方法自2004年1月~2005年3月我科28例因胃癌行全胃切除术后病人,经鼻胃空肠营养给予肠内营养。
肠内营养液主要选用费森尤斯公司的能全力。
结果 27例病例治愈出院,1例因心肌梗死死亡。
结论全胃切除后经鼻胃空肠营养管实施肠内营养主要是让病人快速恢复体力,患者平均体重较术前相比无减少,降低了患者的经济负担,平均住院费降低20%~30%。
所以说全胃切除术后实施肠内营养是使患者早日达到康复的一种有效的途径。
【关键词】全胃切除术;肠内营养营养是促进生长发育,保证身体进行各种生理活动的重要条件,细心照料病人的饮食,保证患者充足的营养对全胃切除术后病人的恢复起着至关重要的作用。
以前对于全胃切除术病人,一般均采用肠外营养,也就是静脉输入营养液,但是长期禁食或肠外营养支持会使肠道处于无负荷的休眠状态,缺乏食物刺激会使肠蠕动受到抑制,影响消化液的分泌,从而易发生肠道菌群失调,导致并发症的发生。
而且肠外营养一般费用都较高,加重了患者的经济负担,所以,为避免肠外营养的不足,我们采用术后早期肠内营养,以帮助病人尽早康复。
1 资料与方法1.1 一般资料选择我科2004年1月~2005年3月28例在全胃切除术后的患者。
1.2 方法所有患者采用早期肠内营养。
患者在手术当日术前留置胃肠减压同时留置胃空肠营养管1枚,这样既避免了反复留置胃管给病人造成的痛苦,又方便了医生在手术过程中,调整胃空肠营养管的位置,使其放置至蔡氏(Treitz)韧带下20cm,然后用胶布在病人面颊部固定好。
肠内营养输注开始时间一般在术后12h,首先给予5%葡萄糖盐溶液,开始时缓慢滴注,每小时20~40ml,24h维持输注,术后24~36h 如病人肠道得以适应,无腹泻、腹胀、恶心呕吐等消化道症状后,给予要素饮食能全力(能全力为500ml/瓶,费森尤斯公司生产),采用一次性输液器,经鼻胃营养管缓慢滴注,速度为由20ml/h逐渐增至100ml/h,滴入量由每日500ml逐渐增至每日1500ml,维持5~7日。
胃癌术后饮食禁忌

胃癌术后饮食禁忌
胃癌术后饮食禁忌手术治疗后的胃癌患者由于切除了大部分胃或者全胃,可出现一系列因食物消化不良或营养吸收障碍导致的并发症比如食物摄取不足,体重减少;倾倒综合征;维生素B12缺乏;缺钙、骨骼疾病;缺铁、贫血。
因此,患者术后的饮食调理非常重要。
因为患者手术后要渐渐恢复正常饮食,所以平时一定要注意少吃多餐。
可以天天进食5-8次,每5-100克;并且从流食、半流食、软食,过渡到普通饮食要3-6个月。
一般情况下,患者应遵循以下原则。
1、少食多餐:因胃癌根治性切除术后仅残留小部分胃或全胃切除后空肠代胃,进食容受量比原来明显减少,只有增加餐数,才能弥补食量不足,满足机体对营养物质的需求。
因此患者应养成良好的饮食习惯,进食时间规律,定时定量进餐,坚持少食多餐,以每天5至6餐为宜。
主食与配菜应选稀、软且易于消化的食物,千万不可暴饮暴食。
2、多食蛋白质丰富的食物:术后初期应按照清流、流食、半流、软食、普食顺序进食。
流质饮食以米汤、蛋汤、菜汤、藕粉为宜。
半流质饮食应选择高蛋白、高热量、高维生素、低脂肪、新鲜易消化的食物。
动物性蛋白最好的来源是鱼类,鱼类蛋白质质量高且易为人体消化吸收,所以我们鼓励多食鱼类,如黄花鱼、鲫鱼等。
进普通饮食后,应多食蔬菜、水果等含纤维素高的食物,以保持大便通畅。
3、少食甜食和脂肪:糖摄入过多,会出现进餐后的不适症状,因此,应避免摄入过甜食物。
脂肪供能不超过总能量的35%,避免食用畜肉脂肪,应选择易消化吸收的脂肪,如植物油、奶油、蛋黄等。
4、食物禁忌:忌食生冷、过热、粗硬食物;忌吃辛辣刺激性强的调味品,。
胃癌全胃切除术后肠内营养支持的护理体会

胃癌全胃切除术后肠内营养支持的护理体会发布时间:2022-10-20T06:40:26.148Z 来源:《医师在线》2022年15期作者:罗雪玲[导读] 目的:探讨胃癌全胃切除术后肠内营养支持的护理效果,罗雪玲梓潼县人民医院四川绵阳 622150[摘要]目的:探讨胃癌全胃切除术后肠内营养支持的护理效果,总结护理经验。
方法:选取本院2020年2月-2022年1月期间诊治的胃癌患者62例作为本次研究对象,所有患者均实施全胃切除术,并且术后实施肠内营养支持治疗,对患者采用随机数字表方式分组,采用常规护理患者为对照组,31例,采用综合护理干预患者为观察组,31例,对比两组患者术后并发症发生率以及生活质量评分情况,明确综合护理干预的临床应用价值。
结果:经过不同护理,观察组术后并发症发生率明显低于对照组,生活质量各项评分均明显高于对照组,两组比较有统计学意义(P<0.05)。
结论:对胃癌全胃切除术后肠内营养支持患者实施综合护理干预,效果好,值得推荐患者使用。
关键词:胃癌全胃切除术;肠内营养支持;综合护理;生活质量胃癌是临床上常见的一种恶性肿瘤疾病,其发病率在近年来逐年升高,严重危及患者的生命健康安全[1]。
目前,临床上对胃癌患者主要采用手术方式治疗,常用术式为胃癌全胃切除术,由于术后患者无法在短时间内恢复正常饮食,易出现营养不良状况,一般需要在术后实施肠内营养支持治疗[2]。
为提高治疗效果,做好护理干预至关重要。
本文对部分患者实施综合护理干预,取得不错效果,详细如下:1资料与方法1.1一般资料此次研究共选取患者62例,选取时间为2020年2月-2022年1月,采用随机数字表方式分组,各31例。
对照组:男性17例,女性14例,年龄42-80岁,平均(59.65±8.57)岁;观察组:男性16例,女性15例,年龄40-79岁,平均(59.45±8.44)岁。
2组患者在一般资料上均衡分布,无显著差异(P>0.05),具有可比性。
肠内营养对全胃切除术后患者的影响及护理

作为异物被 自然地排斥至 胃腔 , 在静脉腔未闭塞前固化 胶排 出可再出血 [。术后应注 意卧床休息及加强病情 4 J
观察, 定期复查及 时追加 治疗 可以预防再 出血 。 2 5 2 异位栓塞术前讲解 ,指 导患者术 中配合 , .. 并适 当镇 静止咳 ,防止躁动 诱发粘合 剂异位栓塞 。
3 讨 论
( t a r ) i j C O : o g t r e f — Hi o c y1 n e t n 1 n — e m f i S i
c c a d a e Y[ ] G t o nt S E d s , a y n S f t J . a i e t n o C Sr
20 :5 :1 —16 00 0 2 6 7
[ ] 张澍 田. 2 消化 内科患者 的治疗与保健 [ ] 科学 M.
出版社 ,2 6 2 — 1 0 : 0 2 0 2 2
[ ] 王艳梅 . 3 内镜 下组 织胶 治疗 胃静 脉 曲张及其进
食管 胃底静脉 曲张破裂 出血是肝硬化最主要 的死
S o C r a m nt f 1 e n g s ri v i c pi t e t e o b e di g a t c ar — C O Se bY n—bu tY 1 2一C Ya nO aC ry 1 . _ a te
的地 方穿破血管 ,排入 胃腔 ( 俗称 :排胶 ) ,从而使血
拌菜和粗纤维蔬菜及刺激 性食物及饮料 。出血停止后 管完全塌 陷、闭塞 、消失【 。在本组病例 中,通过护
士对患者术前针对性的指导, 术中娴熟 的操作技能, 掌 握粘合剂 的性能用量及操作方法 , 术后严 密监N T P U, , 加强休息和饮食指导, 获得了满意 的治疗效果。 由此可
术后营养失调主要护理措施

术后营养失调是指患者在手术后由于消化系统功能受损、食欲下降、摄入不足等原因,导致营养摄入与身体需求失衡,从而影响患者的康复。
针对术后营养失调,护理人员应采取一系列的护理措施,以促进患者的营养恢复和康复进程。
以下为术后营养失调的主要护理措施:一、病情评估1. 评估患者的营养状况,包括体重、身高、体重指数(BMI)、营养摄入量、实验室检查指标等。
2. 了解患者的饮食习惯、食物喜好、饮食禁忌等。
3. 评估患者的消化功能,如胃排空、肠道吸收等。
二、饮食指导1. 根据患者的营养状况和消化功能,制定合理的饮食计划。
2. 饮食应以清淡、易消化、营养丰富为原则,避免油腻、辛辣、生冷等刺激性食物。
3. 鼓励患者多饮水,保持肠道通畅。
4. 根据患者的口味和喜好,适当调整食物的口味和形态。
三、营养支持1. 鼓励患者尽早开始进食,如术后6-8小时可进食流质食物,逐渐过渡到半流质、软食,最后恢复正常饮食。
2. 对于消化功能较差的患者,可给予营养支持,如肠内营养、肠外营养等。
3. 根据患者的营养需求,合理搭配膳食,保证蛋白质、脂肪、碳水化合物、维生素、矿物质等营养素的摄入。
四、心理护理1. 耐心倾听患者的心理需求,了解患者的焦虑、恐惧等情绪。
2. 加强与患者的沟通,帮助患者树立信心,积极配合治疗。
3. 鼓励患者参加康复活动,提高生活质量。
五、并发症预防及护理1. 预防和治疗营养不良引起的并发症,如感染、伤口愈合不良、免疫力下降等。
2. 加强患者的口腔护理,预防口腔溃疡等并发症。
3. 观察患者的消化系统症状,如恶心、呕吐、腹泻等,及时处理。
六、健康教育1. 向患者及家属讲解术后营养失调的危害及预防措施。
2. 指导患者如何合理安排饮食,保持良好的饮食习惯。
3. 强调康复期间保持乐观心态的重要性。
七、监测与评估1. 定期监测患者的营养状况,包括体重、BMI、实验室检查指标等。
2. 评估患者的饮食摄入量、消化功能、康复进程等。
3. 根据患者的实际情况,及时调整护理措施。
手术后如何调理肠道功能恢复正常

手术后如何调理肠道功能恢复正常手术对于身体来说是一种较大的创伤,不仅会影响身体的正常生理功能,还可能对肠道功能造成一定的影响。
肠道功能的正常与否对于身体的恢复和健康至关重要。
那么,手术后应该如何调理肠道功能,使其尽快恢复正常呢?首先,饮食的调整是关键。
在手术后的初期,由于肠道功能尚未完全恢复,饮食需要特别注意。
通常,术后的1 2 天内,可能需要禁食,依靠静脉输液来提供身体所需的营养和水分。
当肠道开始恢复蠕动,出现排气(俗称“放屁”)后,可以逐渐开始进食。
刚开始进食时,应选择清淡、易消化的流食,比如米汤、稀藕粉等。
这些食物不会给肠道带来太大的负担,有助于肠道逐渐适应。
随着肠道功能的进一步恢复,可以逐渐过渡到半流食,如米粥、面条汤等。
此时,食物可以稍微浓稠一些,但仍要避免油腻、辛辣和刺激性的食物。
在术后的恢复阶段,要增加膳食纤维的摄入。
膳食纤维可以促进肠道蠕动,有助于预防便秘。
可以选择一些富含膳食纤维的食物,如蔬菜(如青菜、胡萝卜等)、水果(如苹果、香蕉等)、全谷物(如糙米、全麦面包等)等。
但需要注意的是,在肠道功能还比较脆弱的时候,要将这些食物煮得软烂一些,以便于消化吸收。
此外,蛋白质的补充也不能忽视。
蛋白质是身体修复和恢复的重要营养物质。
可以选择优质蛋白质来源,如鸡肉、鱼肉、豆腐、鸡蛋等。
这些食物不仅富含蛋白质,而且相对容易消化。
除了饮食,适量的运动对于肠道功能的恢复也非常重要。
手术后,在身体条件允许的情况下,应尽早下床活动。
哪怕只是在病房内缓慢地走动几步,也有助于促进肠道的蠕动。
随着身体的逐渐恢复,可以逐渐增加运动量,如散步、慢跑等。
但要注意运动的强度和时间,避免过度劳累。
水分的摄入同样重要。
充足的水分可以使肠道内的食物残渣变得湿润,更容易通过肠道。
建议每天饮用足够的白开水,一般来说,每天至少要喝 1500 2000 毫升的水。
另外,养成良好的排便习惯也有助于肠道功能的恢复。
每天尽量在固定的时间去厕所,即使没有便意,也可以在马桶上坐一会儿,培养肠道的定时排便反射。
胃肠切除术后的生理变化

胃肠切除术后的生理变化1. 引言胃肠切除术是一种常见的手术方法,用于治疗各种胃肠道疾病,如胃癌、胃溃疡、结肠癌等。
该手术能有效地去除病变组织,延长患者生命。
然而,手术后,患者的生理功能会受到一定程度的影响,需要一定时间恢复。
本文档将详细阐述胃肠切除术后的生理变化,以帮助患者和家属了解手术后可能出现的生理现象,为患者术后恢复提供指导。
2. 术后早期生理变化2.1 消化系统2.1.1 胃肠道功能减退:术后短期内,患者胃肠道功能可能受到抑制,表现为食欲不振、恶心、呕吐、腹胀等症状。
这是由于手术创伤、应激反应及胃肠道神经支配功能暂时性紊乱所致。
2.1.2 吸收功能受损:胃肠切除术后,患者消化吸收面积减少,可能导致营养吸收不良、电解质失衡等问题。
特别是全部胃切除术后的患者,需注意补充维生素和矿物质。
2.2 营养状况2.2.1 体重下降:术后短期内,患者可能出现体重下降,这是由于食欲减退、消化吸收功能受损及手术应激等因素导致的。
2.2.2 蛋白质代谢紊乱:胃肠切除术后,患者蛋白质代谢可能出现紊乱,表现为蛋白质分解加速、合成减慢,从而导致营养不良。
2.3 水分和电解质平衡2.3.1 水分丢失:术后患者可能出现脱水现象,这是由于食欲减退、口渴感降低及恶心呕吐等症状导致的。
2.3.2 电解质失衡:胃肠切除术后,患者可能出现电解质失衡,如低钾、低钠、低氯等,需注意监测和及时调整。
3. 术后晚期生理变化3.1 消化系统3.1.1 胃肠道功能逐渐恢复:术后一段时间,患者胃肠道功能逐渐恢复,食欲、消化和吸收能力逐步提高。
3.1.2 营养状况改善:随着胃肠道功能的恢复,患者营养状况逐渐改善,体重逐渐恢复至正常范围。
3.2 营养支持3.2.1 饮食调整:术后患者需遵循医嘱,调整饮食结构,以高蛋白、高热量、易消化的食物为主,逐步恢复正常饮食。
3.2.2 营养补充:根据患者具体情况,可给予口服或静脉营养支持,以满足术后康复需求。
胃切除后吸收不良综合征
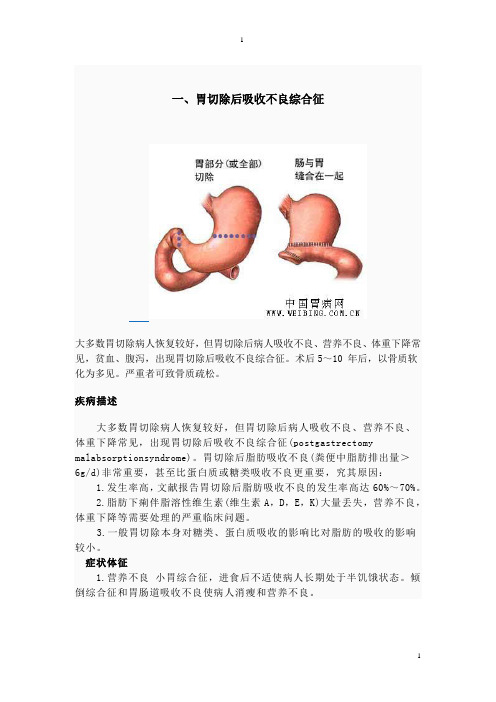
一、胃切除后吸收不良综合征大多数胃切除病人恢复较好,但胃切除后病人吸收不良、营养不良、体重下降常见,贫血、腹泻,出现胃切除后吸收不良综合征。
术后5~10 年后,以骨质软化为多见。
严重者可致骨质疏松。
疾病描述大多数胃切除病人恢复较好,但胃切除后病人吸收不良、营养不良、体重下降常见,出现胃切除后吸收不良综合征(postgastrectomy malabsorptionsyndrome)。
胃切除后脂肪吸收不良(粪便中脂肪排出量>6g/d)非常重要,甚至比蛋白质或糖类吸收不良更重要,究其原因:1.发生率高,文献报告胃切除后脂肪吸收不良的发生率高达60%~70%。
2.脂肪下痢伴脂溶性维生素(维生素A,D,E,K)大量丢失,营养不良,体重下降等需要处理的严重临床问题。
3.一般胃切除本身对糖类、蛋白质吸收的影响比对脂肪的吸收的影响较小。
症状体征1.营养不良小胃综合征,进食后不适使病人长期处于半饥饿状态。
倾倒综合征和胃肠道吸收不良使病人消瘦和营养不良。
2.贫血由于术后胃酸减少,影响铁质的吸收,导致缺铁性贫血。
由于胃切除后抗贫血内因子缺乏,造成维生素B12 吸收障碍,导致巨幼红细胞性贫血。
3.腹泻多因毕Ⅱ式吻合后胃排空过快,小肠蠕动增强,消化与吸收不良所致。
另外食物和胆汁、胰液不能很好地混合,丧失了胰液分解脂肪和胆盐的乳化脂肪作用,影响脂肪吸收,导致脂肪泻。
4.骨病发生在术后5~10 年后,以骨质软化为多见。
严重者可致骨质疏松。
主要症状有骨骼疼痛,下肢无力,容易骨折等。
毕Ⅱ式术后食物不再经过十二指肠,钙吸收减少。
脂肪吸收不良也影响脂溶性维生素D 的吸收。
疾病病因胃切除后影响消化道吸收的病因:1.胃技能受损与胃排空加快。
2.餐后胆胰分泌不同步。
3.胃切除后小肠腔内若干因素改变可以导致吸收不良综合征。
病理生理1.胃功能受损与胃排空加快胃切除后胃酸、胃蛋白酶分泌减少、胃排空快,引起食物消化作用减弱,十二指肠旁路,食物直接进入小肠,胰胆分泌刺激缺乏或减弱,CCK 释放减少,在近端小肠内容物中胆盐、脂肪酶、胰蛋白酶浓度降低,食糜与胆盐、胰酶混合不全,脂肪乳化不足,导致吸收不良。
胃癌切除术后患者肠内外营养支持的护理对策与分析

胃癌切除术后患者肠内外营养支持的护理对策与分析摘要:目的:本文针对胃癌切除术后的患者进行肠内外营养护理开展了详细的分析与探究。
方法:根据本院的胃癌切除术后所有的病例,并分析术后肠内外的营养护理资料。
结果:在进行统计的病例当中,其中42例的胃癌患者第一阶段的营养护理中,有5例病患出现了代谢性的并发症,3例患者则出现了高血糖的症状,2例患者发生了低血糖的症状。
在营养支持的第二时期行肠内营养(TEN)治疗期间,36例患者当中的4个患者发生了胃肠道的多种反应。
57例患者治愈出院,8例患者在病情好转之后出院,无死亡病例。
结论:良好的肠内外营养支持的护理工作,可以大大地改善胃癌患者的身体现状,使其得到更好的恢复。
关键词:胃癌切除;营养支持;护理前言胃癌患者在临床过程中主要的表现为营养不良,因为手术之后的患者不能进行正常的饮食,这就导致了众多患者营养不良的现状,使其日益严重。
所以,相关医护人员针对手术后的患者应该采用营养支持的护理手段,以更好地改善他们营养缺乏的现象。
单纯使用肠内营养(EN)通常会造成患者能量的无法供给,而单纯的给予肠外营养(PN)则会出现胃肠道粘膜的萎缩,最终导致胃癌病患胃肠功能的衰竭。
对胃癌患者使用营养支持的关键作用在于提升其体内细胞、各个器官的代谢功能,从而发挥其正常的功效,保障患者的及时康复。
一、资料与方法(一)一般资料根据我院的胃癌切除术后病例,着重分析患者术后肠内营养支持的护理资料,并将患者随机地分为研究组与对照组,二组的人数相同,性别比例、年龄差异也一致,共计患者病例为65例,其中男为52例,女为13例,年龄均在25~76岁之间,胃癌根治术28例,胃空肠吻合术13例,胃大部分切除24例。
最后65例病患的营养支持得到了有效的改善,治愈了57例,有所好转的病患为8例【1】。
(二)方法结合所有患者病情的不同阶段以及胃肠功能的恢复现状,采用术后营养支持的方法可分成:术后早期经过周围静脉实行TPN;在手术完成后的第2天,在空肠造瘘管中实施TEN;最终使得患者得到良好的恢复与饮食。
手术后出现营养不良的原因及改善措施

手术后出现营养不良的原因及改善措施手术对于患者的身体来说是一次重大的创伤,无论是大手术还是小手术,术后的身体恢复都至关重要。
然而,不少患者在手术后会出现营养不良的情况,这不仅会影响伤口的愈合和身体的康复,还可能导致一系列并发症,延长住院时间,增加医疗费用。
那么,手术后为什么会出现营养不良?又该如何改善呢?一、手术后出现营养不良的原因1、手术创伤导致代谢紊乱手术会引起身体的应激反应,导致激素水平的改变,如皮质醇、儿茶酚胺等分泌增加,这些激素会促进蛋白质分解、糖异生增加,从而导致身体代谢率升高。
同时,手术创伤还会引起炎症反应,释放炎症介质,进一步影响代谢平衡,使得营养物质的消耗增加。
2、术后食欲减退手术后,患者常常会因为疼痛、恶心、呕吐、腹胀等不适症状而食欲减退。
尤其是腹部手术,由于胃肠道受到刺激和干扰,消化功能会暂时下降,导致患者对食物的兴趣降低。
此外,术后患者需要卧床休息,活动量减少,也会影响胃肠道的蠕动和消化液的分泌,进而影响食欲。
3、营养摄入不足手术后,患者可能由于身体虚弱、吞咽困难、口腔或胃肠道疾病等原因,无法正常进食或进食量不足。
如果术后没有及时给予足够的营养支持,如静脉输注营养液或通过鼻饲管给予营养,就容易导致营养摄入不足。
4、营养吸收障碍某些手术,如胃肠道手术,可能会切除部分胃肠道组织,或者改变胃肠道的解剖结构和生理功能,从而影响营养物质的吸收。
例如,胃切除手术后,胃酸分泌减少,铁和维生素 B12 的吸收会受到影响;小肠切除手术后,脂肪、蛋白质、碳水化合物等营养物质的吸收能力会下降。
5、营养流失增加手术后,患者可能会出现伤口渗血、渗液,以及发热、出汗等情况,导致蛋白质、矿物质和水分等营养物质的流失增加。
如果没有及时补充,就容易出现营养不良。
6、心理因素手术对于患者来说是一种心理应激,患者可能会因为焦虑、恐惧、抑郁等情绪而影响食欲和消化功能。
此外,对疾病的担忧、对手术效果的不确定等心理因素也可能导致患者不愿意进食,从而影响营养状况。
胃癌全胃切除能吃糖吗,治疗方法

胃癌全胃切除能吃糖吗,治疗方法胃癌全胃切除后的糖的摄入需要注意,因为糖含量较高,过多的摄入会导致胰岛素释放过多,引起低血糖等问题。
因此,在饮食中应注意合理摄取糖分,并且需要控制每次摄入的量。
治疗方法:1.外科治疗:手术治疗是目前最常见的治疗方法,包括胃癌全胃切除等手术。
手术后需要注意饮食和清淡饮食,避免饮食过于刺激性,影响术后消化功能恢复。
2.化疗:化疗可以通过药物的方式杀灭癌细胞,但是也存在一些副作用,比如恶心、呕吐、脱发等。
3.放疗:通过放射来杀死癌细胞,但是该方法也存在一定的副作用,如发烧、恶心等。
注意事项:1.监测血糖水平,避免低血糖的发生。
2.餐次间隔时间应不少于2~3小时,不要让血糖过高或过低。
3.多吃含有维生素和膳食纤维的食物,如蔬菜、水果、全麦面包等。
4.避免饮食过于刺激性,尽量选择清淡饮食,避免油炸、高脂肪食物等。
5.注意口腔卫生,定期检查和治疗口腔疾病。
6.定期复查,监测疾病的状况。
胃癌化疗期间怎样解决便秘,治疗方法胃癌化疗期间出现便秘是常见的现象,与化疗副作用及患者的饮食习惯有关。
便秘不仅会引起腹胀、腹痛等不适症状,还会加重患者的身体负担,影响化疗的疗效。
因此,采取适当的治疗方法和护理措施,有助于缓解便秘问题,提高患者的生活质量。
一、治疗方法1.药物治疗胃癌化疗期间的便秘,可以通过药物治疗来缓解。
常见的药物有泻药类、润肠剂、肠道刺激剂以及激动性肠道药物。
其中,泻药类药物通过增加肠蠕动,促进粪便的排泄;润肠剂通过软化粪便,使其更容易排泄;肠道刺激剂可通过刺激肠道壁的收缩来促进肠道蠕动,促进粪便的排泄。
激动性肠道药物则可促进肠道的分泌和蠕动,可缓解轻中度的便秘症状。
2.改变饮食饮食调整对于缓解便秘也具有重要作用。
应多吃富含膳食纤维的食物,如果蔬、全谷类、豆类等。
同时,食用含高钾水果,如香蕉、苹果等,有助于促进肠道蠕动,预防便秘。
另外,增加水分的摄入也很重要,可以选择低渗透压的饮料,如淡盐水、淡糖水、清汤等。
肠胃功能紊乱的术后并发症及处理

肠胃功能紊乱的术后并发症及处理肠胃功能紊乱是一种常见的消化系统问题,当病情严重且保守治疗无效时,可能需要进行手术治疗。
然而,手术后可能会出现一些并发症,需要我们密切关注并妥善处理。
一、术后并发症1、消化吸收不良手术可能会影响肠胃的正常消化和吸收功能。
例如,切除部分胃肠道组织后,消化酶的分泌可能减少,食物在胃肠道内的停留时间也可能改变,从而导致营养物质不能被充分吸收,患者可能出现消瘦、乏力、贫血等症状。
2、肠梗阻术后肠粘连是导致肠梗阻的常见原因之一。
手术过程中的创伤和炎症反应可能引起肠管之间或肠管与腹壁之间的粘连,使肠内容物通过受阻。
患者会表现为腹痛、腹胀、呕吐、停止排气排便等。
3、腹泻与便秘交替肠胃手术后,肠道的神经调节和蠕动功能可能受到影响,导致肠道运动紊乱。
有时会出现腹泻,大便次数增多、不成形;有时又会出现便秘,排便困难,大便干结。
4、倾倒综合征多见于胃切除手术后。
当患者进食后,尤其是进食大量高糖食物后,短期内大量食物快速进入小肠,引起一系列症状,如心悸、头晕、出汗、面色苍白、腹胀、腹泻等。
5、胃食管反流如果手术涉及到胃食管连接部位,可能会破坏其正常的抗反流机制,导致胃酸和胃内容物反流至食管,引起烧心、反酸、胸骨后疼痛等症状。
6、肠道菌群失调手术及术后使用抗生素等因素可能破坏肠道内正常的菌群平衡,有益菌减少,有害菌增多。
这可能导致肠道炎症、腹泻、腹胀等问题。
7、吻合口瘘这是一种比较严重的并发症。
手术吻合部位愈合不良,形成瘘管,使肠内容物或消化液漏入腹腔,引起腹膜炎,患者会出现剧烈腹痛、发热等症状。
8、术后出血包括胃肠道腔内出血和腹腔内出血。
腔内出血表现为呕血、黑便;腹腔内出血则可能表现为腹痛、腹胀、血压下降等。
二、并发症的处理1、消化吸收不良的处理首先,饮食调整非常重要。
建议患者少食多餐,选择易消化、富含营养的食物,如鱼肉、鸡肉、蛋类、蔬菜泥等。
必要时,可以补充维生素、矿物质和蛋白质等营养素。
手术后出现营养不良的原因及补充建议

手术后出现营养不良的原因及补充建议手术对于患者的身体来说是一次重大的挑战,无论手术的大小,都会在一定程度上影响身体的正常机能。
其中,手术后出现营养不良是一个较为常见但又容易被忽视的问题。
这不仅会影响患者的康复速度,还可能增加并发症的风险,延长住院时间,甚至对患者的长期健康产生不利影响。
一、手术后出现营养不良的原因1、手术创伤和应激反应手术本身会造成身体的创伤,激活应激反应。
在应激状态下,身体会释放大量的激素,如皮质醇和儿茶酚胺等,这些激素会促使蛋白质分解加速、糖异生增加,导致机体处于高代谢状态。
这种高代谢状态会消耗大量的能量和营养物质,如果摄入不足,就容易出现营养不良。
2、消化和吸收功能障碍手术后,尤其是腹部手术,可能会影响胃肠道的正常解剖结构和生理功能。
例如,胃肠道的切除、吻合或改道可能导致消化液分泌减少、胃肠道蠕动减慢、食物通过时间改变等,从而影响食物的消化和吸收。
此外,麻醉药物的使用也可能会抑制胃肠道的蠕动和消化液分泌,进一步加重消化和吸收功能障碍。
3、饮食摄入不足手术后,患者往往会因为疼痛、恶心、呕吐、食欲不振等原因而减少饮食摄入。
特别是在术后的早期,患者可能需要禁食一段时间,只能通过静脉输注营养物质来维持生命。
即使在恢复饮食后,由于身体尚未完全恢复,患者可能仍然无法摄入足够的营养来满足身体的需求。
4、营养物质丢失增加手术过程中,患者可能会出现大量的失血、渗液等情况,导致蛋白质、矿物质和维生素等营养物质的丢失增加。
此外,术后如果出现伤口感染、发热等并发症,也会进一步增加身体的代谢消耗和营养物质的丢失。
5、基础疾病的影响患者在手术前可能就存在一些基础疾病,如糖尿病、慢性肾病、肝病等,这些疾病本身就可能影响营养物质的代谢和利用。
手术后,由于身体的应激反应和代谢变化,这些基础疾病可能会进一步加重,从而导致营养不良的发生。
二、手术后营养不良的补充建议1、早期营养支持对于手术后无法正常进食或饮食摄入不足的患者,应尽早给予营养支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全胃切除术后肠道营养吸收功能障碍和调节摘要:全胃切除(TG)是手术治疗胃中上部及全胃癌的重要方法之一。
因TG后消化道结构的重大改变,病人的饮食、消化液分泌,以及营养吸收功能均受到极大影响,如何改善TG 病人术后的营养状况是消化外科医生长期以来努力解决的难题。
本文主要从TG后消化管重建方法对肠道功能的调节、消化道生理功能的改变和调节,以及营养物质的补充方法等几方面回顾性总结TG术后肠道营养吸收功能的障碍和调节方法。
在消化管重建术调节方面,共70余种消化管重建术式中,基本术式离不开以下三种方式:(1)空肠与食管吻合的Roux-en-Y 及其改良术式;(2)为保留十二指肠通道行空肠间置的各种术式;(3)为保证空肠电生理完整性而保留空肠连续性的各种襻式手术。
术式种类虽然多种多样,仍均不能同时解决TG术后三大疑难问题,即食物贮袋、十二指肠生理通道和食物返流。
TG后由于贲门周围迷走神经的离断导致神经调节和体液调节的失调,是消化器官运动、分泌和营养吸收功能障碍的主要原因。
消化酶的异常代谢和分泌失调,并不能因为局部外源性酶的调节而改善。
调节TG 后的肠内营养制剂种类繁多,基本分为五类(1)口服补充性饮食,在肠功能疾病恢复条件下使用;(2)部分预消化多聚体性饮食,多在管饲喂养条件下进行EN支持;(3)预消化的化学成分明确的要素饮食,主要适用于胃肠功能障碍的病人;(4)特殊疾病营养物,合并糖尿病、肝功能不全等疾病时的营养液;(5)特殊营养制剂,如添加谷氨酰胺、精氨酸、ω23脂肪酸等特殊物质的营养剂。
全胃切除后病人早期营养不宜选择高热量营养物质,选择要素饮食更容易被肠道消化和吸收。
总之,全胃切除引起的一系列肠道动力和分泌失调是导致术后营养状况不能快速恢复的主要原因。
各种消化道重建术都有其合理性和不能避免的缺陷,药物的调节作用非常有限,合理应用营养支持治疗能帮助病人安全度过围手术期、减少并发症。
长期生存病人有可能完全恢复肠道的营养吸收功能。
全胃切除(TG)是手术治疗胃中上部及全胃癌的重要方法之一。
因TG后消化道结构的重大改变,病人的饮食、消化液分泌,以及营养吸收功能均受到极大影响,病人手术后长时间内营养状况低下,严重影响病人术后的快速康复和生存质量。
如何改善TG病人术后的营养状况是消化外科医生长期以来努力解决的难题,但众多的研究结果仍然得不到令人满意的结果。
本文主要从TG后消化管重建方法对肠道功能的调节、TG后消化道生理功能的改变和调节,以及TG后营养物质的补充方法等几方面阐述TG术后肠道营养吸收功能的障碍和调节。
1 消化管重建术式对肠道消化功能的调节全胃切除后争取在消化管重建方面恢复肠道的消化和吸收功能是外科医生最先采用的方法。
自1897年Schlatter行第一例全胃切除食管空肠端侧吻合术开始到上世纪80年代各种襻式空肠代胃术式的问世,外科医生发明创造70余种消化管重建术式,但基本术式离不开以下三种方式:(1)空肠与食管吻合的Roux-en-Y及其改良术式;(2)为保留十二指肠通道行空肠间置的各种术式;(3)为保证空肠电生理完整性而保留空肠连续性的各种襻式手术。
术式种类虽然多种多样,仍均不能同时解决TG术后三大疑难问题,即食物贮袋、十二指肠生理通道和食物返流。
在上述三方面问题中,食物贮袋问题相对容易解决。
通过各种方式空肠与空肠的吻合和襻式重叠,显著增加了病人的饮食量[1,2]。
但多数食物贮袋使用了具有重要营养吸收功能的上段空肠,而且贮袋多建立在消化液与食物混合之前,这无疑减少了上端空肠有效消化吸收功能的长度,使其手术后短期内仍不能有效改善病人的营养不良状态。
通过间置空肠的方法保持十二指肠通道的连续性,达到食物与十二指肠充分接触的目的[3,4],但由于神经分泌调节和胃泌素调节的缺失,该术式不能达到充分刺激胆汁和胰液分泌的目的,而术式的相对繁琐也令许多外科医生不愿选择。
空肠与食管吻合的Roux-en-Y及其改良术式由于操作简单、减少手术时间、手术并发症少,容易被多数外科医生接受[5,6]。
食物返流是该术式易出现的问题,但若能保证食管空肠吻合口与空肠空肠吻合口之间的距离保持在40cm以上,即可有效地防止食物返流的发生。
我们改良后的Roux-en-Y术式在增加贮袋功能的同时,并没有增加返流等并发症[7],在经过两年左右的饮食调节后,部分病人可恢复到手术前的体重和营养状态,但多数病人因病情的发展,很难生存两年以上。
可见,各种手术术式均有其优势和弊端所在,理想的完美术式并不存在。
在不增加并发症的前提下,熟练地掌握一种术式显得更为重要。
2 全胃切除术后消化道生理功能的改变与调节生理条件下,胃主要通过神经调节和体液调节两方面调节消化消化器官的运动和分泌[8]。
在神经调节方面,发自迷走神经的副交感神经是调节胃肠、胆、胰等消化器官运动和分泌的主要神经。
该神经通过胃的容受性舒张和消化液的分泌,为食物即将进入胃和小肠继续进行消化创造条件。
同时,通过胃和中枢之间的迷走神经长反射,以及局部胃壁内神经丛的局部反射,促进胃液和小肠液分泌和胃肠运动。
全胃切除后由于贲门周围迷走神经的离断,上述神经反射和调节的丧失,势必出现消化器官运动和分泌功能的失调[9]。
在体液调节方面,主要通过胃肠激素和局部体液激素调节消化器官的运动、分泌和吸收功能。
胃泌素是重要的体液调节激素之一,其分泌主要是在迷走神经和胃壁内神经丛的反射性调解下通过胃窦和十二指肠粘膜的G细胞释放。
胃泌素的主要作用是促进胃酸和胰酶的分泌;其次,可促进胰液、胆汁、小肠液的分泌和胃肠运动。
全胃切除的结果是胃泌素分泌器官及其调节胰液、胆汁和肠液功能的丢失,致使食物消化过程的连续性和完整性被破坏,最终导致营养代谢障碍的发生。
动物实验表明TG后胰腺发育延迟,淀粉酶和脂肪酶分泌不足[10]。
临床研究结果也证实TG后因胃泌素缺乏导致胰腺外分泌功能障碍和胆囊收缩素的异常升高,而胰酶的替代治疗并不能明显改善肠道的消化功能和脂肪的异常代谢[11]。
可见TG后导致的神经和体液共同调节的消化器官运动、分泌和营养吸收功能障碍,并不能通过一两个局部因素的调节而得到整体的改善。
全胃切除后消化管运动、分泌和吸收功能的自我恢复和调节可能是改善病人营养状况的最佳途径。
3 TG手术后营养物质的补充与调节近60%的胃癌病人在接受治疗时存在一定程度的营养不良[12]。
全胃肠外营养(TPN)不利于肠道功能的恢复,相关并发症较多,因此,不主张在TG 后使用TPN。
全胃切除后短期内胃肠外营养(PN)的支持可减少病人体内蛋白和脂肪组织的异常代谢,改善病人营养不良状况,补充肠道动力恢复初期肠内营养支持的不足[13]。
由于TG后短期内小肠功能的迅速恢复,早期的肠内营养(EN) 可以保持肠道粘膜的完整性、维护其免疫功能[14],TG后尽早恢复EN愈来愈受到关注。
众多的研究表明TG手术后早期EN不仅能够促进肠道功能恢复、减少ICU监护时间、降低住院费用[15],还是治疗吻合口瘘的良好方法[16]。
我们的研究还表明,对于老年TG病人,早期的EN还有助于减少胃肠减压所导致的肠源性呼吸道感染[17]。
肠内营养制剂种类繁多,按其在体外预消化的程度和功能,基本分为五类(1)口服补充性饮食,有高氮和高热量型,可作为餐间补充性营养,在肠功能疾病恢复条件下使用;(2)部分预消化多聚体性饮食,由整蛋白,碳水化合物,脂肪等合成,多在管饲喂养条件下进行EN支持;(3)预消化的化学成分明确的要素饮食(主要为单体营养素):主要适用于胃肠功能障碍的病人,其氮源为水解蛋白短肽或游离氨基酸单体,碳水化合物由酶部分水解淀粉后的麦芽糖糊精或双糖或单糖提供,脂肪由长链脂肪酸及中链脂肪酸共同提供,以及必须的电解质及微量元素,如百普素、百普力;(4)特殊疾病营养物,合并糖尿病、肝功能不全等疾病时的营养液,如适合糖尿病病人的瑞代营养液;(5)特殊营养制剂,如添加谷氨酰胺、精氨酸、ω23脂肪酸、核苷酸、膳食纤维等特殊物质的营养剂。
全胃切除后病人早期营养不宜选择高热量营养物质,选择要素饮食更容易被肠道消化和吸收。
有研究认为甲地孕酮和饥饿激素可以调节TG后病人的食欲,其疗效有待于更多的临床观察[18]。
国内有研究认为TG 术后早期EN联合生长激素,能迅速改善病人的营养不良状态[19],但对于肿瘤病人使用生长激素的适应证还缺乏统一标准。
总之,全胃切除引起的一系列肠道动力和分泌失调是导致术后营养状况不能快速恢复的主要原因。
各种消化道重建术都有其合理性和不能避免的缺陷,药物的调节作用非常有限,合理应用营养支持治疗能帮助病人安全度过围手术期、减少并发症。
长期生存病人有可能完全恢复肠道的营养吸收功能。
参考文献[1] Yang K, Chen XZ, Hu JK . Pouch vs. no pouch following total gastrectomy: meta-analysis andsystematic review. Am J Gastroenterol. 2010,105(5):1208- 1209.[2] Shibata C, Ueno T, Kakyou M,et al. Results of reconstruction with jejunal pouchafter gastrectomy: correlation with gastrointestinal motor activity. Dig Surg.2009;26(3): 177 - 86.[3] Pan Y, Li Q, Wang DC, Wang JC, et al. Beneficial effects of jejunal continuityand duodenal food passage after total gastrectomy: a retrospective study of 704 patients. Eur J Surg Oncol. 2008,34(1):17-22.[4] Zherlov G, Koshel A, Orlova Y,et al. New type of jejunal interposition methodafter gastrectomy. World J Surg. 2006, 30(8):1475-80.[5] Fein M, Fuchs KH, Thalheimer A, et al. Long-term benefits of Roux-en-Y pouchreconstruction after total gastrectomy: a randomized trial. Ann Surg. 2008, 247(5): 759-65.[6] Ishigami S, Aridome K, Nakajo A, et al. Roux-en-Y reconstruction with stapleddistal jejunal pouch after total gastrectomy. Am Surg. 2010,76(5):526-528. [7] 孙立波, 李永超, 冯野等. 全胃切除术后改良Orr式Roux-en-Y 食管空肠吻合术的临。
