第十二 章 羧酸及其衍生物
第十二章羧酸衍生物-文档资料

2)醇解:酰氯和酸酐与醇或酚作用,生成相 应的酯。
O
O O S O C l C H O H 2 2 5 N ( C H ) C C C l ( C H ) C C O H + 3 3 ( C H ) C C O C H 3 3 3 3 2 5
γ -内酰胺
青霉素 ( penicillin )
H C C 3 H C C 3
“酸酐” 顺丁烯二酸酐 O 乙酸酐 O 邻苯二甲酸酐
O O O C O C O C C O O
酸酐:“酸”
H3C H3CH2C
C C
O O O
乙丙酐
酯:用相应的酸和醇命名;
C H O O C 3C 2H 5 C O O C 2H 5
35%H C l 回 流
O N 2
+ H C H C N O N 2 2
C H C O O H 2
羧酸衍生物亲核取代反应的活性顺序:
酰卤>酸酐>酯>酰胺≈腈
酯水解反应,键的断裂发生在酰氧键还是烷氧键?
O R CO R ' O R COR '
大多数2o和 1o醇的羧酸酯的水解发生酰氧键断裂; 3o醇的羧酸酯的水解发生烷氧键断裂。 酸催化:
O C C l
2-溴丁酰溴
4-氯甲酰基苯甲酸
酰胺:根据相应的酰基命名;
O C H C N H 3 2
乙酰胺 O CN H 2 环己烷甲酰胺
N-乙基丁 二酰亚胺
O CN H 2 O H N C 2
羧酸及其衍生物

12.1 羧酸的分类和命名法
• 羧酸分子中的羧基除去羟基后的基团
按原来酸的名称
而称为某酰基。对于除去氢原子后的基团,则称为某酰氧基。例如:
上一页 返回
12.2 羧酸的制备方法
• 在自然界中,羧酸常以游离态、羧酸盐或其衍生物形式广泛存在于动 植物中。许多羧酸及其衍生物是动植物代谢的中间产物;有些参与动 植物的生命过程;有些具有强烈的生物活性,能防病治病;有些是工 农业和医药工业的重要原料。羧酸可以通过如下途径来制备。
(CH3)3CCOOH (CH3)2CHCOOH CH3CH2COOH CH3COOH
pKa 5.05
4.87
4.86
4.76
• 芳环是吸电子基,所以芳香羧酸的酸性比一般饱和一元酸的酸性强。 但大多数芳香羧酸的酸性比甲酸弱(苯甲酸的pKa=4.17,甲酸 pKa=3.77)。虽然苯环是吸电子基团,但苯环的大π键与羧基可以 形成π-π共轭体系,使环上的电子云向羧基方向转移。其结果是苯甲 酸羧基上的O—H 键极性减弱,氢的离解能力降低,
性药物制成盐,以增大其溶解度。例如常用的抗生素——青霉素C就 是制成它的钾盐和钠盐。
• 12.4.2 羟基被取代的反应
• 羧酸分子中羧基中的羟基被其他原子或基团取代后的产物,称为羧酸 衍生物。羧酸分子中除去羟基后剩余的基团(RCO-)称为酰基,因此, 羧酸的衍生物又称为酰基化合物。常见的羧酸衍生物有酰卤、酸酐、 酯和酰胺。例如:
上一页 下一页 返回
12.4 羧酸的化学性质
• 失水生成酰胺。很多药物的分子结构中都含有酰胺的结构。所以酰胺 是一类很重要的有机化合物。这是一个可逆反应,反应过程中不断蒸 出所生成的水使平衡右移,产率很高。例如:
课件有机化学第12章 羧酸及衍生物

O H3C C O
H H
O C O
6
CH3
乙酸的二缔合体
12.2 羧酸的化学性质
7
12.2 羧酸的化学性质
1. 酸性
R C O R C O
• 酸性比醇强得多 O O • 仍是一种弱酸 • 一元饱和脂肪族羧酸的pKa值一般在3~5之间
pKa
HCl -7
CH3COOH CH3CH2OH 4.72 16
H+
-H 2O
OH C OCH 2 CH 3
-H +
O C OCH 2 CH 3
14
加成-消除机理
Example
O C OH H2SO4 O C OC2 H5
+ C2H5OH
+ H2O
CH3 CH2 CH2 CH3COCl 或 (CH3CO)2O
O C ONa
+ CH3I
CH3 CH2 CH2 O C OC2 H5
酸性
8
取代基对羧酸酸性的影响
Structure pKa 1.26 2.85 4.72
• 吸电子取代基使酸性增强 • 给电子取代基使酸性减弱
Cl2CHCOOH ClCH2COOH CH3COOH
O
吸电子基
O
给电子基
C O
C O
吸电子取代基 提高羧酸盐稳定性
给电子取代基 降低羧酸盐稳定性
9
羧酸的酸性反应
H2SO4
CH3CO2CH2CH3 + H2O
O HOCH2CH2CH2COH
O O
13
反应机理(掌握)
O C OH H+ OH C OH 慢 OH C H OH 2 C OH OCH 2 CH 3 OH O CH 2 CH 3 CH 3 CH 2 OH
华中科技大学有机化学第十二章 羧酸及其衍生物

Kochi反应便宜,对一级,二级,三级卤化烷的产率均好。
10.3 羧酸的合成反应
1. 烯或炔烃的氧化。
2. 醇或醛的氧化。 3. 烷基苯的侧链氧化。 4. 甲基酮的氧化(卤仿反应)。 5. 腈化合物的水解。 6. 格氏试剂与二氧化碳反应。 7. 苯酚钠盐与二氧化碳反应。
9.4 羧酸衍生物的结构与命名 1.羧酸衍生物的结构 羧酸衍生物的结构通式为RCOL (L= OR , NH2, NHR , NR2, X, OCOR等).这些化合物都具有酰基(RCO),因此又称酰基化合物.它们的 结构与羧酸相似,都具有羰基的键。并与L的一对未共用电子共扼.其电 子共轭与共振式如下:
丁二酸和戊二酸在单独加热或与乙酐共热时脱水生成环酐己二酸和庚二酸受热时同时发生脱水和脱羧生成较为稳定的失羧卤化将羧酸与ago反应得羧酸的银盐然后加等摩尔的溴或碘在无水四氯化碳中回流即可失羧得到溴代或碘代烷hunsdiecker反应
第十二章 羧酸及其衍生物
分子中含有羧基(-COOH,carboxyI group)的化合物叫做羧酸 (carboxyIic acid)。羧基是羧酸的官能团,除甲酸(HCOOH)外,羧酸 可看作是烃分子中的氢原子被羧基取代的产物。
生成酸酐的反应机理是一分子羧酸对另一分子羧酸的亲核加成-消去反应
3.生成酯 羧酸和醇或在强酸(硫酸,对甲苯磺酸等)催化下分子间脱水生成酯, 这个反应叫做酯化反应(esterification)。 酯化反应是可逆反应。为了提高产率,一般采用的方法是增加某 一种反应物的用量,或不断从体系中移去某一种产物。 实验证明,羧酸酯化时生成的水分子中的氧原子一般是来自羧酸 的羟基。例如,用同位素标记的醇与羧酸反应,其结果是同位素标记 的氧原子留在酯分子中。
六、二元羧酸受热的反应 二元羧酸受热易脱水、脱羧,生成产物的结构取决于两个 羧基的相对位置。无水草酸在加热时脱羧生成甲酸。
有机化学:12 羧酸及羧酸衍生物

C
+
O C O
H
(二)羧基上羟基的取代反应
O 酰卤 O 酸酐 O O 酯 O 酰胺 R C X R C O C R R C O R R C NH2(R)
1.成酯反应
O R C OH + H OR' H
+
O R C OR' + H2O
称酯化反应 反应特点:用酸做催化剂,反应可逆,速率慢
1.成酯反应
(1)诱导效应
HCOOH > CH3COOH > CH3CH2COOH
pKa 3.77 4.76 4.88
(一)酸性
如:卤素的位置——越靠近羧基影响越大
CH3CH2CHCOOH Cl
CH3CHCH2COOH CH2CH2CH2COOH Cl Cl
pKa
2.86
4.41
4.70
卤素的数目——越多,酸性越强
RCH2COOH + RCHCOX
X RCHCOOH
X X 该反应称为赫尔-佛尔哈德-泽林斯基(Hell-VolhardZelinsky)反应。 α-位如果还有H,可以进一步发生卤代反应,直至 所有α-H全部反应完。
问:
COOH CH3COOH 1 COOH 2 H2C COOH COOH 3
CH3COOH+SOCl2
pKa
4.20
3.83
4.09
4.10
2.电子效应的影响
邻位取代:
C和 I 都发挥作用,还有空间效应,情况复杂。
除氨基外,-X、-CH3、-OH、NO2酸性都比间 位或对位取代的强。邻位有取代时,羧基与 苯环不共平面,苯环电子云向羧基偏移少。
有机化学第8版第十二章-羧酸衍生物全篇

N-甲基-N-乙基乙酰胺
(N-ethyl -N-methyl acetamide)
O CH3 C-N CH3
N,N-二甲基苯甲酰胺
2、酸酐:按其水解产物命名
OO
OO
CH3C O CCH3
乙酸酐
(acetic anhydride)
O
CH3C O CCH2CH3
乙丙酸酐
(acetic propanoic anhydride)
H2O H+ 或OH
2、氨解反应
O
RC OH + R'OH
COOCH3 + NH3
CONH2 + CH3OH
3、酯缩合反应
酯分子中的α-氢显弱酸性,在碱的作用下与另一分子酯 发生类似于羟醛缩和的反应,生成β-酮酸酯,称为酯缩 和反应或Claisen(克莱森)缩和反应。
O 2CH3C-OC2H5
(1)C2H5ONa (2)H3O+
紫色或紫红色溶液
缩二脲反应
凡分子中含两个或两个以上
O
C NH
肽键
结构的化合物都能进行缩二脲反应
二、胍
NH H2N C NH2
胍
NH H2N C NH
胍基
NH H2N C
脒基
胍的衍生物在临床上是重要的治疗糖尿病的药物。
H2C
COOC2H5
H2N +C
O
COOC2H5 H2N
O
C NH
H2C C O + 2C2H5OH
O-
O
CH3-C=CH-COC2H5
O
O-
CH3-C-CH=COC2H5
乙酸乙酯的性质,具有甲基酮的性质,碘仿反应,2,4-二 硝基苯肼的反应,HCN的反应等;具有烯醇的性质,与金 属钠反应放出氢气,使溴的四氯化碳溶液褪色,与三氯化 铁溶液显色等。
第十二章 羧酸及其衍生物(教学版)

反应注意事项:
应用于一级RX制腈,产率很好。仲、叔卤代烷产率较低,不适用此法! 芳香卤代烷不易制成芳腈。
- -
-Cl
+ NaCN
三、Grignard试剂与CO2作用
R-X
Mg 干醚
R-MgX
CO2
O R-C –OMgX
H2 O H+
R-COOH
(CH3)3CCl + Mg
无水乙醚
(CH3)3C-MgCl
5 6
CH2-COOH CH2-COOH 丁二酸 CH2COOH
3,4-二甲基己酸
γ
3-甲基-2-丁烯酸 COOH COOH 对苯二 甲酸 Cl COOH
CH3CH2-CH-COOH 4 3 2 OH 1 2-羟基丁酸 或α-羟基丁酸
β
α
对氯苯甲酸 α- 萘乙 酸
羧酸分子中除去羧基中的羟基后,余下的部分称为酰基, 可按原来的酸的名称作某酰基:
COOH
以上的反应称为Kolbe-Schmitt(科尔伯—施密特 )反应。
§12-4 羧酸的物理性质和光谱性质
一、物理性质
1. 物态 C1~C3 有酸味的无色液体 C4~C9 有腐败酸臭味的油状液体 C10 以上——蜡状固体,没有气味 芳香族羧酸(Ar-COOH)和脂肪族二元羧酸为结晶的固体 液态脂肪酸以二聚体形式存在。所以羧酸的 2. 沸点 沸点比相对分子质量相当的醇高。
CH2COOH CH2COOH CH2COOH CH2COOH CH2COOH Cl Br I OCH3 F pKa 2.66 2.86 2.90 3.12 4.74
② 芳香酸(共轭效应、诱导效应) 1)酸性:C6H5COOH>CH3COOH 2)芳环上有吸电子基时,ArCOOH酸性增加。例如:
第十二章 羧酸衍生物

C-G的键长一般较那些典型键长有所缩短:
O
O
O
HC NH2 137pm
CH3 NH2 147pm
HC OCH3 133pm
CH3 OH 143pm
HC Cl 178.9pm
CH3 Cl 178.4pm
1、酯(ester)的结构
O R C O-R' 酯键
2、酰卤(acylhalide)的结构
O RC X
相对速率 1 0.47 0.10
0.01
0.102
酸性水解
HCl
CH3COOCH3 + H2O
CH3COOH + CH3OH
一元伯醇、仲醇酯在酸催化下水解,通常也 发生酰氧键断裂。其反应机理为:
O R C OR' + H+
OH
OH
HOH
R C OR'
R C OH2
OR'
OH -R'OH OH
-H+
H3CO
NHCOCH3 KOH H3CO
NO2
回流
NH2 + CH3COOK NO2
CH3O
NH2 + CH3COOK
NO2
HCl CH2CONH2 回流
CH2COOH + NH4Cl
CH2COOH + NH4Cl
• 酸催化机理: • 碱催化机理:
与酯的水解类似
• 羧酸衍生物水解反应的活性顺序是: 酰卤 > 酸酐 > 酯 > 酰胺
O O C CH3 乙酰氧基
O C NH2 氨甲酰基
O C Cl
氯甲酰基
CN
氰基
第二节 羧酸衍生物的性质
第十二章羧酸及其衍生物

电荷分散 羧酸根负离子 稳定性增强
电荷集中 羧酸根负离子 稳定性减弱
羧酸的酸性强弱取决于羧酸根负离子的稳定性!
诱导效应
——由于电负性不同而产生的原子间静电引力的影 响,而使共价键电子云偏移的现象。
吸电子能力比氢强,为吸电子基,
具有负诱导效应(-I效应)
吸电子能力比氢弱,为供电子基,
碳酸pKa=6.5 羧酸可以分解碳酸盐, 可用于区别和分离羧酸:
RCOOH + NaHCO3RCOONa + CO2+H2O RCOONa + HCLRCOOH + NaCL
羧酸呈酸性的原因——
羧酸能离解而生成更为稳定的羧酸根负离 子
P-共轭使其稳定
羧酸的酸性强弱—— 在羧酸中,吸电子取代基可使酸性增强;
二元酸的命名:
体,脂环作取代基
10.2 羧酸的制法
1. 氧化法
– 伯醇、醛的氧化 – 烃氧化 – 芳环侧链氧化
2. 水解法
– 腈水解 – 油脂水解 – 苯三氯甲烷水解
3. 格利雅试剂法(Grignard)
伯醇、醛的氧化
烃氧化
酯化反应的特点: (1)可逆反应 例:
H+ CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O
开始:1mol 平衡:1/3mol
1mol 1/3mol
2/3mol
2/3mol
(2)两种不同的脱水方式: RCO OH+R’O H RCOOR’+H2O 酰氧断裂
RCOO H+R’ OH RCOOR’+H2O 烷氧断裂
10.4.2、羧酸衍生物的生成
羧酸衍生物

理论解释:
活性取决于L离去难易.
酸碱理论
酸性: HCl > RCOOH > ROH > NH3
pKa -2.2 4~5
16~19 34
共轭碱的碱性: Cl < RCOO < RO < NH2
碱性愈弱,愈易离去。
=
=
=
(一)酰基上的亲核取代
1.水解
O (C6H5)2CHCH2CCl
H2O, Na2CO3 0℃
O NH O
0oC + Br2 + NaOH
O N Br + NaBr + H2O
O
= =
N-溴代丁二酰亚胺
碱性水解
RCONH2 + H2O NaOH RCOONa + NH3
酸性水解
RCONH2 + H2O H2SO4
RCOOH + (NH4)2SO4
水解较难,环内酰胺易水解
5. 酯缩合反应-乙酰乙酸乙酯的合成 乙酰乙酸乙酯可用 Claisen 酯缩合反应合成
O
R C O R'
生成酰胺。
OO
RR
CC
++ HHCCll
NNHH22
O
R C NH2
O
+ R' C O H
OO
RR C NNHH22
+ R'CH22OH
4. 酰胺的反应
O
RC
P-π共轭
NH2
= =Hale Waihona Puke = =酰胺的弱酸碱性
显碱性 NH3
O
亚酰胺
NH
O
RNH2
O NH O
pKa 8.3
第十一、十二章 羧酸及其衍生物

酸 + CO2
环酐 + H2O
己、庚二酸
环酮 + H2O+CO2
几种常见的羧酸
甲酸(formic acid) 草酸(dicarboxyl) 乙酸(acetic acid)
苯甲酸(benzoic acid)
O
甲酸的结构 H C OH
醛基
羧基
甲酸
甲酸既具有一般羧酸的通性,还具有还原 性。能和托伦试剂、高锰酸钾等试剂反应 HCOOH+KMnO4+H2SO4
H2C
CH2COOH CH2COOH
O O + H2O O
己二酸和庚二酸受热脱水和二氧化碳
CH2CH2COOH CH2CH2COOH
CH2CH2COOH CH2CH2COOH
O + CO2 + H 2O
H2C
O + CO2 + H 2O
小结:
二元羧酸热解产物与碳链长度有关:
乙、丙二酸
丁、戊二酸
CH2CH2CH2COOH Cl
CH3CH2CHCOOH Cl
CH3CHCH2COOH Cl
pKa
2.86
4.06
4.52
(二) 羧酸衍生物的生成
羧基中的 –OH 被其它原子或基团取代后生成的 化合物称羧酸衍生物(derivatives of carboxylic acid)。
O R C OH
离去基
O C O C O C O C
R
X OCOR OR NH 2
R
O C
R
OH
R R
羧酸衍生物
DHA怎么补?
DHA
DHA,二十二碳六烯酸(docosahexenoic acid ), 俗称脑黄金,是一种对人体非常重要的多不饱和脂肪 酸,属于Omega-3不饱和脂肪酸家族中的重要成员。 DHA是神经系统细胞生长及维持的一种主要元素,是 大脑和视网膜的重要构成成分,在人体大脑皮层中含 量高达20%,在眼睛视网膜中所占比例最大,约占 50%,因此,对胎婴儿智力和视力发育至关重要。
第12章 羧酸衍生物习题解答
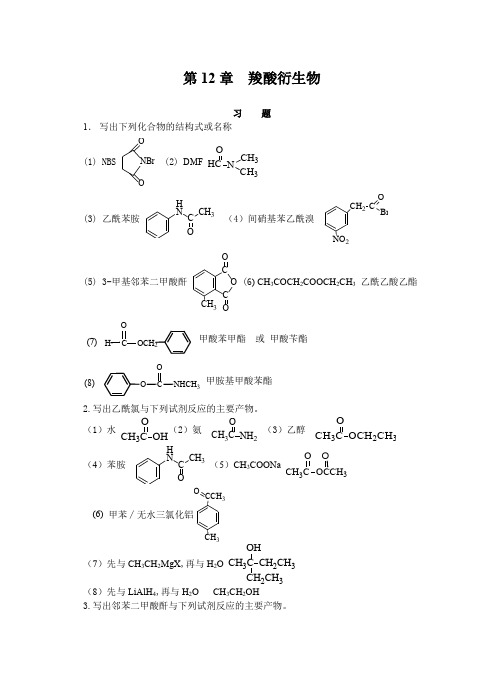
第12章 羧酸衍生物习 题1. 写出下列化合物的结构式或名称(1) NBSOONBr (2) DMF HC N O3CH 3(3) 乙酰苯胺H NC CH 3(4)间硝基苯乙酰溴CH 2NO 2CO Br(5) 3-甲基邻苯二甲酸酐CCH 3C O O (6) CH 3COCH 2COOCH 2CH 3 乙酰乙酸乙酯OCH 2CHO(7) 甲酸苯甲酯 或 甲酸苄酯O CONHCH 3(8)甲胺基甲酸苯酯2.写出乙酰氯与下列试剂反应的主要产物。
(1)水 CH 3C OHO (2)氨 CH 3C NH 2O(3)乙醇 CH 3C OCH 2CH 3O(4)苯胺HN C CH 3(5)CH 3COONa CH 3C 3O O (6) 甲苯∕无水三氯化铝CH 3CCH 3O(7)先与CH 3CH 2MgX ,再与H 2O CH 3C CH 2CH 3CH 2CH 3OH(8)先与LiAlH 4,再与H 2O CH 3CH 2OH3.写出邻苯二甲酸酐与下列试剂反应的主要产物。
(1)水∕△C C O OHOH (2)氨∕△ C C OONH 2ONH 4(3)乙醇∕△ C C O2CH 3OH (6)甲苯∕无水三氯化铝CC O OH CH 3(7)先与CH 3CH 2MgX ,再与H 2OC C OH CH 3OH CH 3 (8)先与LiAlH 4,再与H 2OCH 2OHCH 2OH4.写出乙酸苯酯与下列试剂反应的主要产物。
(1)水∕△CH 3C OCH 2CH 3OOH(2)氨∕△CH 3C NH 2OOH(3)甲酸乙酯∕乙醇钠 HCCH 2CO O(4)钠+乙醇 CH 3CH 2OH + OH(5)先与CH 3CH 2MgX ,再与H 2O CH 3C CH 2CH 3CH 2CH 3OHOH(6)先与LiAlH 4,再与H 2O CH 3CH 2OH +OH5.写出丁酰胺与下列试剂反应的主要产物。
有机化学(第二版)第十二章 羧酸及其衍生物

CH2=CHOCOC2H5
丙二酸二乙酯
醋酸乙烯酯
12.9 羧酸衍生物的化学性质 12.
一、羧酸衍生物的亲核取代反应 • 加成-消除历程:
O 1) R C L O
+
Nu
R C Nu L 亲 亲亲 亲
O 2) R C Nu L:-X,-OCOR,-OR,-NH 2 L R
O C OH HO
O C
O C OH
pKa
4.76
3.75
1.23
2、α-H卤代
• 赫尔-乌尔哈-泽林斯基反应
Br2/P
Br CH2COOH CH2COOH Cl
CH3COOH
Cl2/S
CN
NaCN
CN
H+/H 2 O
RCHCOOH X
① OH
+
-
RCHCOONa OH RCHCOONa RCHCOONa NH 2
②羧酸氯化水解
RCH2COOH Cl2 P RCHCOOH Cl OH .H2O RCHCOOH OH
2、β-羟基酸
• ① 通过次卤酸(p.55)
OH
HOCl
OH Cl
NaCN
OH
R
R
R
CN
1) NaOH
2) H
+
R
COOH
② Reformasky反应
Zn+BrCH2COOC2H5 RCHCH2COOC2H5 OZnBr 无 RCHO ZnBrCH2COOC2H5 .H2O RCHCH2COOH OH
.H2O H
+
三、化学性质
1、酸性
有机化学 第十二章 羧酸衍生物和碳酸衍生物

第一节 第二节 第三节 羧酸衍生物 羧酸衍生物涉及碳负离子的反应及其 在合成中的应用 碳酸衍生物、油脂和原酸酯
第一节
一、结构
羧酸衍生物
O O O O O R C X R C O C R' R C OR' R C NH2
酰卤
酸酐
酯
酰胺
羧基中羟基被置换生成羧酸衍生物,它们经简单 的水解反应可转变为羧酸. 腈 ( RCN ) 水解生成羧酸,故也在本章予以讨论.
NHCOCH3
5-乙酰氨基-7-(2氧代丙基)-2-萘甲酸
2-乙酰氧基苯甲酸
乙酸(3-甲氧基-4氰基苯基)酯
三、物理性质
酰氯酸酐:低级的酰氯和酸酐是有刺鼻气味的液体, 高级的为固体。 酯:低级的酯具有芳香的气味,可作为香料。乙酸 异戊酯(香蕉味);丁酸甲酯(菠萝味); -辛內酯(椰子味)。十四碳酸以下的甲酯和 乙酯均为液体。 酰胺: 由于形成分子间氢键,沸点高。除甲酰胺外均是
4-Chlorocarbonylbezioc acid
普通命名法: -溴丁酰溴 IUPAC 命名法: 2-溴丁酰溴 对氯甲酰基苯甲酸 对甲氧基苯甲酰氯
4-氯甲酰基苯甲酸
2 酸酐的命名
单酐:在羧酸的名称后加酐字; 混酐:将简单的酸放前面,复杂的酸放后面再加酐字 O 环酐:在二元酸的名称后加酐字。
O O CH3COCCH3 Acetic anhydride O O CH3COCCH2CH3 O Aceticpropionic anhydride Succinic anhydride O
快
R'OH +RCO-
2. 酸性下水解
O C2H5CO18C2H5 + H2O
羧酸及其衍生物Carboxylicacidsandderivatives

§12.1 羧酸分类、结构和命名
一、分类: 根据分子中所含羧基的数目: 一元酸 CH3COOH 乙酸 二元酸 HOOCCH2CH2COOH 丁二酸 多元酸 HO-C(CH2COOH)2COOH 柠檬酸 根据R的性质: 芳香羧酸 PhCOOH 脂肪羧酸 HCOOH 脂环羧酸
游离 3550 cm-1,只有在气态才能看见 νC-O:1210-1320 cm-1 O-H: 1400, 920 cm-1
O
NMR:
1HNMR 13CNMR
CH2
C
O
H
§12.3 羧酸的酸性
Cl Cl Cl CH3CH2CHCOOH CH3CHCH2COOH CH2CH2CH2COOH CH3CH2CH2COOH 2.82 4.41 4.70 4.82
取代基诱导效应的强弱顺序有如下规律: A. 与C直接相连的原子,同一族的随原子序数增加 而吸电子诱导效应降低,同一周期的自左向右 诱导效应增加。 -I: F > Cl > Br > I OR > SR F > OR > NR2 > CR3
COOH
饱和羧酸 CH3COOH 不饱和羧酸 CH2=CH2COOH
二、结构
羧酸中,羧基的C是sp2杂化,三个杂化轨道,分别与O, O, R成键,三个轨道在一个平面上,键角大约是1200, 碳上还剩下一个p轨道,与O上的p轨道侧面交盖,形成 键。同时, 键又可以与羟基O的未共用电子对形成p共轭体系。共轭结果是键长部分平均化。
环直接与羧基相连称为环烷酸,编号从羧基所连接 的碳开始。
第十二章羧酸及其衍生物

羧酸:分子中含有羧基(-COOH)的化合物。
O
羧酸的官能团: C O H
酰基 O 羧基 R C OH
第一节 羧酸的结构、分类和命名
一、羧基结构
O
O
RC
RC
OH
OH
二、分类
(一)按羧基所连烃基的碳架
CH3COOH CH3CH CHCOOH
COOH
脂肪族羧酸 脂环族羧酸
COOH
CH3 COOH
80-90%
RX
NaCN
H+ or HORCN H2O
RCOOH
( 1º, 2°)
注意:
CH3 CH3 C Br
CH3
NaCN
CH3
CH3 C CH2
四、羧酸衍生物的水解
O
水解
C
RL
O C R OH
第四节 羧酸衍生物
O
OO
O
O
R C X R C O C R' R C OR' R C NH2
COOH
COOH pka 4.20
NO2
2.21
3.49
-I,—C -I,共轭受阻
COOH
COOH
OH
NO2
3.42
-I,—C
COOH
2.98
-I,+C 分子内氢键
OH
4.08
-I,共轭受阻
OH 4.57
-I,+C
*邻位取代的苯甲酸, 无论取代基是吸电子基或给 电子基, 均使酸性增强。
HCOOH (3.77)
(四)酰胺的生成
RCOOH + NH3
RCOONH4 -H2O
O RC NH2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
42
显然,随着酰胺的氨基上的氢原子被取代,分子间的 氢键缔合作用将逐渐削弱,以致不能发生氢键缔合,其沸 点必然↓。
酰胺 > N - 一取代酰胺 > N - 二取代酰胺
2. 溶解度 酰卤、酸酐和酯不溶于水,但低级酰卤、酸酐遇水则分解。 低级酰胺溶于水,随着M↑,溶解度↓。
43
三、羧酸衍生物的化学性质
3°吸电子基团增多酸性增强。
11
4°吸电子基团的位置距羧基越远,酸性越小。
2、共轭效应 共轭效应具有传递性
吸电子共轭效应:-NO2,-CN,-COOH, -CHO,-COR 供电子共轭效应:-NH2,-NR2,-NHCOR, -OH,-OR,-OCOR
12
对于取代苯甲酸,当取代基处于羧基的邻位时,无论是何 种性质的基团都使得酸性增强,这种影响称为邻位效应。 是综合考虑了位阻效应、电子效应、氢键的影响的一个复 杂过程,至今尚无满意的解释。但对于某些可较好地说明: 例:羟基苯甲酸电子效应相同+C和-I
21
(4).酰胺的生成 在羧酸中通入氨气,可得到羧酸铵盐,铵盐热解失水而 生成酰胺。
二元酸的二铵盐受热则发生分子内脱水兼脱氨,生 成五元或六元环状酰亚胺。
羧酸可以与RNH2、R2NH反应直接生成酰胺。
22
3、脱羧反应
羧酸在一定条件下受热可发生脱羧反应。
饱和一元羧酸在加热下较难脱羧,但低级羧酸的金属盐在 碱存在下加热则可发生脱羧反应。
14
A.(CH3) +I,+C
B.(NO2) -I,-C
15
C.(X) -I> +C
D. (OH) -I< +C
16
2、羧基上的羟基(OH)的取代反应 羧基上的OH可被一系列原子或原子团取代生成羧酸的 衍生物。
羧酸衍生物生成反应的机理是:先亲核加成,再消去。 羰基碳由sp2杂化→sp3杂化→sp2杂化。
离去基团的碱性越强,越不易离去。基团的离去能力顺 序为:
综上所述,羧酸衍生物的反应活性顺序为:
45
(1)、水解
特点: a. 产物均有羧酸生成。 b. 活性:酰卤 〉酸酐 〉酯 〉酰胺
46
(2)、醇解
特点:a. 醇解产物是酯。 b. 反应活性: 酰卤 〉酸酐 〉酯 〉酰胺
47
c. 酰氯和酸酐是活泼的酰基化剂。
34
35
2、羟基酸的制备 (1) 羟基腈水解 A. -羟基腈水解
B. -羟基腈水解
36
(2) 卤代酸水解:只适合制备α-羟基酸
(3) 瑞福尔马茨基反应:只适合制备-羟基酸
反应在惰性溶剂中进行,首先生成有机锌试剂,再和 醛或酮加成、水解得到-羟基酸。
37
3、羟基酸的化学性质 (1) 脱水反应 A. -羟基酸分子间脱水生成交酯
19
(2).酰卤的生成
羧酸与PX3、PX5、SOCl2作用则生成酰卤。
亚磷酸不易挥发,故该法适用于制备低沸点酰氯。
磷酰氯沸点较低(105.3℃),故适用于制备高沸点酰氯。
该法的副产物均为气体,有利于分离,且产率较高。
20
(3).酸酐的生成 羧酸在脱水剂作用下加热,脱水生成酸酐。
因乙酐能较迅速的与水反应,且价格便宜,生成的乙 酸又易除去,因此,常用乙酐作为制备酸酐的脱水剂。 1,4和1,5二元酸不需要任何脱水剂,加热就能脱水生成 环状(五元或六元)酸酐。
一元羧酸的α碳原子上连有-NO2、-C≡N、-CO-、-Cl 等强吸电 子基团时,则易发生脱羧。
羧酸蒸汽在钍、锰或镁的氧化物催化下,发生气相双分子脱羧 生成对称酮。
23
4、α-H的卤代反应 脂肪族羧酸的α- 氢原子也可被卤原子取代,但其反应 活性要比醛、酮低的多,通常要在少量红磷、硫等催化剂 存在下方可进行。
(3) 通过乙酰乙酸乙酯、丙二酸二乙酯合成各种羧酸。
29
五、二元羧酸
1、物理性质
(1) 物态 二元羧酸都是固态晶体,熔点比相近分子量的 一元羧酸高得多。
(2) 溶解度 比相应的一元酸大,易溶于乙醇,难溶于其 它有机溶剂。
30
2、二元羧酸的化学性质 (1) 具有羧酸的通性 对酸性而言 pKa1 < pKa2 (2) 二元羧酸受热反应的规律
控制条件,反应可停留在一取代阶段。
α-卤代酸很活泼,可以进行亲核取代反应和消除反应。如:
24
5、羧酸的还原
羧酸不易被还原。但在强还原剂LiAlH4作用下,羧基可被还 原成羟基,生成相应的1°ROH。
该法不仅产率高,而且不影响C=C和C≡C的存在,可用于 不饱和酸的还原。 羧酸在高温、高压下也可以催化加氢还原成醇。常用的催 化剂为:Cu、Zn或亚铬酸镍。
6
7
二、羧酸的物理性质
羧酸是极性分子,能与水形成氢键,故低级一元酸可 与水互溶,但随M↑,在水中的溶解度↓,正戊酸在水中的 溶解度只有3.7 %,>C10的羧酸不溶于水。 物态:C1~C3 有刺激性酸味的液体,溶于水。 C4~C9 有酸腐臭味的油状液体(丁酸为脚臭味),难溶于水。 > C9 腊状固体,无气味。 b.p:羧酸 > M 相同的醇。 m.p:随M↑呈锯齿形上升。偶数碳原子羧酸的m.p>相邻两 个同系物的m.p。
制备羟基酸或,-不饱和酸
33
制备二元羧酸
二、羟基羧酸 羟基酸分为:醇酸和酚酸; 根据羟基的位置分为:-羟基酸、-羟基酸、 -羟 基酸、-羟基酸等; 羟基酸的酸性比对应的羧酸酸性强; 羟基酸的熔点比对应的羧酸高; 水溶性较好,低级羟基酸可与水混溶; 具有羟基和羧基的化学性质和特性。 1、羟基酸的命名 较多使用俗名
2、Grignard试剂与CO2作用——制备增加一个碳原子的羧酸
1o、2o、3o RX都可使用, 但乙烯式卤代烃难反应。 3、水解法 (1) 腈的水解——制备增加一个碳原子的羧酸
此法仅适用于1o RX(2o、3o RX 与NaCN作用易发生消 除反应)。
28
(2)羧酸衍生物的水解 通过油脂和羧酸衍生物的水解得羧酸,及副产物甘油和醇。
反应过程中,首先由亲核试剂进攻带有部分正电荷的碳基 碳原子,形成加成产物的过渡态。但其不稳定,带有负电荷的 氧原子恢复形成C=O双键。同时羟基离去。 17
(1).酯化反应
1o 酯化反应是可逆反应,一般只有2/3的转化率。
提高酯化率的方法:a 增加反应物的浓度(一般是加过量的醇)。
b 移走低沸点的酯或水。 2o 酯化反应的活性次序: 酸相同时 CH3OH > RCH2OH > R2CHOH > R3COH
2、命名 1o 酰卤和酰胺的命名根据酰基称为某酰某。
40
2o 酸酐的命名是在相应羧酸的名称之后加一“酐”字。
3o 酯的命名是根据形成它的酸和醇称为某酸某酯。
41
二、羧酸衍生物的物理性质
1. 沸点(b.p):酰卤 、酸酐、酯 < M 相近的羧酸,原因:酰卤 、
酸酐、酯 没有分子间的氢键缔合作用。
> 相应的羧酸 酰胺 > 原因:酰胺的氨基上的氢原子可在分子间形成较强的氢键。
4
3、命名 1o 俗名
2o 系统命名法 a. 含羧基的最长碳链。 b. 编号,从羧基C原子开始编号。 c. 如有不饱和键角要标明烯(或炔)键的位次。并主链包括 双键和叁键。 d. 脂环族羧酸。简单的在脂环烃后加羧酸二字,复杂的环可5 作为取代基。
e. 芳香酸可作脂肪酸的芳基取代物命名。 f. 多元羧酸:选择含两个羧基的碳链为主链,按C原子 数目称为某二酸。
R3CCOOH
醇相同时 HCOOH > CH3COOH > RCH2COOH > R2CHCOOH >
18
成酯方式 酯化时,羧酸和醇之间脱水可有两种不同的方式:
究竟按哪种方式脱水,与羧酸和醇的结构及反应条 件有关。经同位素标记醇的办法证实: A. 伯醇和仲醇与羧酸的酯化是按酰氧键断裂进行的。
B. 叔醇与羧酸的酯化是按烷氧键断裂进行的。
Blanck规则(布朗克):在可能形成环状化合物的条件
下,总是比较容易形成五元或六元环状化合物。
A. 乙二酸、丙二酸受热脱羧生成一元酸
31
B. 丁二酸、戊二酸受热脱水(不脱羧)生成环状酸酐
C. 己二酸、庚二酸受热既脱水又脱羧生成环酮
32
第二节 取代羧酸
取代酸是指具有两种或两种以上官能团的有机物,既 具有羧酸的性质,又具有取代基的性质,同时还表现出两 者相互影响所具有的特殊性质。 一、卤代酸 1、性质主要表现为:对羧酸酸性的影响。最重要的是卤代酸。 2、利用羧酸-H卤代反应制备,一般利用卤素单质在红P 催化条件下制得-卤代酸。
邻位羟基不但具有空间位阻效应,而且当羧基上的质 子发生电离后,羧基与羟基形成氢键。
13
当芳环上羧基的邻间位和对位引入吸电子基,使酸性增强, 引入供电子基,使酸性减弱。 当取代基处于对位时,同时通过诱导效应和共轭效应对羧基 产生影响。而且,共轭效应占主导地位。 当取代基处于间位时,对酸性影响不如邻、对位明显,共轭 效应受阻,主要是诱导效应,且隔了3个C。
8
三、羧酸的化学性质
9
1、酸性
羧酸的酸性比水、醇强,甚至比碳酸的酸性还要强。
羧酸离解后生成的RCOO-负离子,由于共轭效应 的存在,氧原子上的负电荷则均匀地分散在两个原子 上,因而稳定容易生成。
10
影响羧酸酸性强度的因素
1、诱导效应 1°吸电子诱导效应使酸性增强。
2°供电子诱导效应使酸性减弱。
2
第一节 羧酸
一、羧酸的结构、分类、命名
1、结构
羧基中羟基氧上的孤电子对与羰基的C=O双键发生了p共轭,使羧基中电子的活动范围增大,从而产生特殊性质。
3
由于形成了一个富电子的大体系,羧基中电子密度趋 于平均化,导致氢原子的电离活性增加。因此其性质显著区 别于醛(酮)和醇。
