第三章单烯烃
第三章单烯烃

5、聚合反应
nCH2=CH A
催化剂
CH2-CH
n
A
含有双键或叁键的化合物以及含有双官能团或多官能团
的化合物在合适的条件下(催化剂、引发剂、温度等)发生
加成或缩合等反应,使两个分子、叁个分子或多个分子结合
成一个分子的反应称为聚合反应。
A= OH (维纶) C6H5(丁苯橡胶) Cl (氯纶)
CH3 (丙纶) CN (晴纶)
(优)CH3 C
H
CH2CH3(优)
CH3
C
C
CH3
(优)CH3CH2
CH(CH3)2(优) C
CH2CH2CH3
(Z)- 3-甲基-2-戊烯 (E)- 3-甲基-4-异丙基-3-庚烯
原子的优先顺序:I,Br,Cl,S,P,O,N,C,D,H
烃基的优先顺序: (CH3)3C-,CH3CH2CH(CH3)-,(CH3)2CHCH2-, CH3(CH2)3-,CH3CH2CH2-,CH3CH2-,CH3-
慢
Br Br
+
+ Br (第一步)
Br
+ Br +
Br
快
Br
Br
反式加成
A、 反应分两步进行 B、第一步是速度控制步骤 C 、反式加成
(第二步)
(ii)碳正离子机理
X X-Y
Y
X
X
Y
+
顺式加成
Y 反式加成
(iii)马氏规则的解释
诱导效应解释:
CH3
dd HC CH2
H-X
第一步
H H3C C CH3
反应机理
OO 引发: C6H5COOCC6H5
第三章单烯烃

C、Markovnikov规则的理论解释 可利用反应过程中生成的活性中间体的稳定性来解释 活性中间体越稳定,相应的过渡态所需要的活化能越 低,则越易生成,加成反应速率和方向取决于活性中间体 生成的难易程度,即活化能高低。
活性中间体与反应的取向
H Cl
(Z)-1-bromo-1,2-dichloroethylene
实例三
H2 C
3
C CH3
2
1
CH2
2-甲基-3-环己基-1-丙烯
3-cyclohexyl-2-methyl-1-propene
双键在环上,以环为母体, 双键在链上,链为母体,环为取代基。
Z、E与顺、反的关系 Z、E是按次序规则排列,与较大基团在同侧或 异侧相对应。 顺、反是与双键碳上各有一个相同的原子或 基团在同侧或异侧相对应。
CH3 CH3 CH3 C Cl CH2 I
C
CH3
CH2
+
I
Cl
一些特殊的反应
F3C-CH=CH2 + HCl F3CH NC-, 2CH2Cl
(CH3)3N+CF3 HC CH2
主要产物
+
H
X
CF3
H C H
CH2 X
如果两边的电荷密度差别不大,则两种产物的量相当 CH3CH2CH2CH2CHBrCH3 + CH3CH2CH2CHBrCH2CH3
CH3-CH=CH2 + Br2 CH2=CH2 + Cl2 CCl4 CH3CHCH2
Br Br
FeCl3 , 40℃ , 0.2MPa
CHAPTER 3-1 单烯烃

H
X
X
H
H2 C
CH CF3
练 习
写出乙烯、丙烯与次卤酸加成的产物:
H C C H H δ + + Br 2.8 H δ OH 3.5 H H C C H H + Br H2C + OHBr CH2 OH
溴钅翁离子
溴乙醇
CH3
δ + CH
δ - δ + δ CH2 + HO Cl 先加
CH3 开环碳正离子
面上,夹角为120º ;
未杂化的 p 轨道垂直于sp2 杂化轨道对
称轴所在的平面上。
C=C : σ键和 键示意
乙烯结构示意图
只有p电子云相互平行时才能重叠, 重叠程度有限,π键不稳定 不能自 由旋转
σ 键
σ键的电子云重叠程度大,键能较大、牢固。 σ键电子云沿键轴 对称分布呈圆柱形,所 以σ键绕键轴旋转不影响电子云的重叠程度。 σ键的电子云较集中,离核较近,在外界条 件影响下不易被极化。
δ + CH
δ CH2 +
HX
H3C
CH
CH3
X
如何解释这一现象? 须从机理上入手: (1) 反应是由亲电试剂(Eδ+)的进攻 引起的,双键电子云密度越高越易 反应,
(2) 反应是分步进行的,有活泼 中间体生成(碳正离子),形成中 间体越稳定,反应越易进行。
因此,可以从两方面来解释:
分子的电子密度分布 生成中间体的稳定性
子中的“ 薄弱环节 ” 。
π键较弱,即易“ 打开 ”
而形成σ键,从而发生一 系列的化学反应。 Csp2 在反应过程中转化为 Csp3杂化状态。
(一)加成反应
Ch.3 单烯烃

第三章单烯烃烯烃——含 C=C 双键的烃类,C=C 是其官能团。
单烯烃——只含一个C=C 双键的烯烃,简称烯烃。
单烯烃的通式——C n H2n第一节烯烃的结构以烯烃同系列中的第一个成员乙烯为例说明之。
乙烯的分子式:C2H4构造式:CH2=CH2实验表明:①键能C=C≠ 2 C-C②分子中6个原子处于同一平面③C=C键长1.34 Å<C-C键长1.54 Å,=C-H键长1.079 Å也<烷烃C-H键长1.094 Å。
乙烯的形成:对于这些事实,杂化轨道理论认为,乙烯的每个C 原子成键时,以另一种杂化方式形成杂化轨道,由一个S 轨道与两个p 轨道杂化:这样就形成三个能量均等的SP2杂化轨道,留下一个P轨道,SP2杂化轨道与SP3杂化轨道极为相似:由于S成份较多,故SP2轨道显得比SP3轨道短。
三个SP2轨道的伸展方向:乙烯分子中σ键的形成:各个C的P轨道通过侧面重迭形成另一个共价键—π键:π键的特点:①不能单独存在②重迭程度小,不如σ键牢固③π电子云离核较远,受核束缚力小,流动性,大,易极化(即易变形)④没有对称轴,不能旋转C=C为什么较短?C=C 间电子云密度较大,使两个核更靠近,另一原因是SP2轨道没有SP3轨道那么伸展。
MO理论对烯烃π键的说明:第二节同分异构现象及命名一、同分异构由于烯烃含有C=C双键,它们的同分异构现象比烷烃复杂,因此同分异构体的数目比相应烷烃的多。
下面以丁烯为例说明了之。
丁烯有4个异构体(丁烷才有2个)。
互为顺反异构体的2个化合物,它们的物理性质必然不同,有时化学性质也有差异,一般来说是反式的较稳定,顺式的比反式的稳定的例子甚少。
二、烯烃的系统命名法1. 选主链选含C=C的最长C链作主链,称为“某烯”,超过10个C要称“××碳烯”。
2.给主链编号从最靠近C=C的一端开始。
3.标示双键的位置双键在链端也应标示。
在不至于引起误会的情况下,双键的位次可省略:烯基的系统命名:几个常见烯基的名称:顺、反异构体的命名:ⅰ.用“顺、反”标明构型顺——指相同或相似基团处于同侧反——指相同或相似基团处于反侧ⅱ.用“Z、E”标明构型Z——同侧之意,二个在次序规则中较前的基团处于同侧。
第三章 烯烃

二、亲电加成 亲电:趋向电子基团的性质。 亲电试剂(E+):凡缺电子物种,如正离子等。 1、与X2的加成(一般Br2和Cl2)
CH2=CH2 Br2/Cl2 CCl4 H2C Br CCl4 CH2 Br CH2CHCH3 Cl Cl
二、马氏规律
1、诱导效应
H3C C H CH2 Cl H3C
Cl C CH3 H
2、碳正离子稳定性:
CH3
CH3CH2 CCHCH2
H3C C CH3 CH3
3°>2°>1°>CH3+
CH3
+ + + +
e
e
957.2 844.4 760.8 714.8
CH3CH2 +
CCHCH2 + e
+ H3C C CH3 + CH3
R R
R R
. . . . . H H H . H . . H H . H . . H H
R R
R
R
. . H
R
H
.
H H H
. . H . . . .H . H H
3、氢化热: 1mol不饱和化合物氢化时放出的热量。 氢化热越大越不稳定 顺式>反式
氢化热的大小反映烯烃的相对稳定性。 双键碳原子上的烷基越多,烯烃越稳定。 R2C=CR2>R2C=CHR>RCH=CHR>RCH=CH2>CH2=CH2。 2-甲基丙烯>反-2-丁烯>顺-2-丁烯>1-丁烯。
也可用OsO4
OsO4
H H OH OH
2)臭氧化
第3章 单烯烃习题答案(第五版)

第三章 单烯烃 (P 79-81)1.写出戊烯的所有开链烯异构体的构造式,用系统命名法命名之,如有顺反异构体则写出构型式,并标以Z 、E 。
2-甲基-2-丁烯2-methylbut-2-ene2.命名下列化合物,如有顺反异构体则写出构型式,并标以Z 、E 。
(1) 2,4-二甲基-2-庚烯; (2) 5,5-二甲基-3-乙基-1-己烯; (3) 3-甲基-2-戊烯 (存在Z,E 两种构型); (4) 4-甲基-2-乙基-1-戊烯; (5) (Z)-3,4-二甲基-3-庚烯; (6) (E)-3,3,4,7-四甲基-4-辛烯. 3.写出下列化合物的构造式(键线式)。
(1) 2,3-dimethyl-1-pentene; (2) cis-3,5-dimethyl-2-heptene(3) (E)-4-ethyl-3-methyl-2-hexene (4) 3,3,4-trichloro-1-pentene4.写出下列化合物的构造式。
(1) (E)-3,4-二甲基-2-戊烯(2) 2,3-二甲基-1-己烯(3) 反-4,4-二甲基-2-戊烯(4) (Z)-3-甲基-4-异丙基-3-庚烯(5) 2,2,4,6-四甲基-5-乙基-3-庚烯5.对下列错误的命名给予更正:(1) 2-甲基-3-丁烯应改为:3-甲基-1-丁烯(2) 2,2-甲基-4-庚烯应改为:6,6-二甲基-3-庚烯(3) 1-溴-1-氯-2-甲基-1-丁烯应改为:2-甲基-1-氯-1-溴-1-丁烯(4) 3-乙烯基-戊烷应改为:3-乙基-1-戊烯6.完成下列反应式。
(1)(2)注意:[CH3-CH=CH-C.-(CH3)2 CH3-CH.-CH=C-(CH3)2]共振极限式关系,所以有两种产物。
(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)7.写出下列各烯烃的臭氧化还原水解产物。
(1)(2)(3)8.裂化汽油中含有少量烯烃,用什么方法能除去烯烃?答:裂化汽油的主要成份是分子量不一的饱和烷烃,除去少量烯烃的方法有:a.用催化加氢方法;b.用KMnO4洗涤的办法;c.用浓H2SO4洗涤。
单烯烃练习题
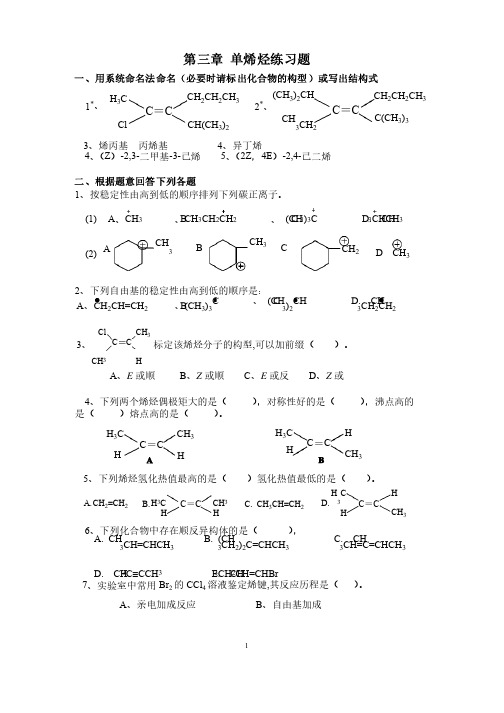
1 第三章单烯烃练习题一、用系统命名法命名(必要时请标出化合物的构型)或写出结构式C =C(CH 3)2CH C(CH 3)3CH3CH 2CH 2CH 2CH 32*、C =CClCH(CH 3)2H 3C CH 2CH 2CH 31*、、3、烯丙基丙烯基4、异丁烯4、(Z )-2,3-二甲基-3-己烯5、(2Z ,4E )-2,4-己二烯二、根据题意回答下列各题1、按稳定性由高到低的顺序排列下列碳正离子。
A 、CH 3 B 、CH 3CH 2CH 2 C 、 (CH3)3C D. CH 3CHCH 3CH 3CH3CH 2CH 3ABCD (1)(2)2、下列自由基的稳定性由高到低的顺序是:A 、CH 2CH=CH 2 B 、(CH 3)3C C 、 (CH 3)2CH D. CH3CH 2CH 23、标定该烯烃分子的构型,可以加前缀()。
ClC CH 3CCH 3HA 、E 或顺B 、Z 或顺C 、E 或反D 、Z 或4、下列两个烯烃偶极矩大的是(),对称性好的是(),沸点高的是()熔点高的是()。
C =CH 3C CH 3C =CH 3C CH 3HHH HAB5、下列烯烃氢化热值最高的是()氢化热值最低的是()。
C =CH 3CCH 3C =C H 3CCH 3HHHHCH 2=CH 2CH 3CH=CH 2A. B. C. D.6、下列化合物中存在顺反异构体的是(),A. CH 3CH=CHCH 3 B. (CH 3CH 2)2C=CHCH 3 C. CH3CH=C=CHCH 3D. CH3C ºCCH 3 E. CH 3CH 2CH=CHBr 7、实验室中常用Br 2的CCl 4溶液鉴定烯键,其反应历程是()。
A 、亲电加成反应B 、自由基加成C 、亲核加成反应、亲核加成反应D 、亲电取代反应、亲电取代反应8、烯烃与卤素在高温或光照下进行反应,卤素进攻的主要位置是(卤素进攻的主要位置是( )。
有机化学课件(李景宁主编)第3章-单烯烃
总目录
第二节 烯烃的同分异构和命名
一、烯烃的同分异构现象
1. 构造异构(constitutional isomerism)
构造异构——分子式相同,原子或基团在分子 中连接次序不同。
碳干异构:
位置异构:(官能团变位)
CH3 CH2 CH CH2
CH3 CH2 CH CH2
CH3 C CH2 CH3
CH3 CH CH CH3
a > b;c > d
a > b,c > d
优先基团同侧-(Z) 优先基团异侧-(E)
总目录
Cl >H,Br >CH3 (E)-
I >CH3,Br >H (Z)-
(E)
(Z)
总目录
(E)-2,2,4-三甲基-3-己烯 (E)-2,2,4-trimethyl-3-hexene
(E)-3,4-二甲基-2-戊烯 顺-3,4-二甲基-2-戊烯 (E)-3,4-dimethyl-2-pentene
因为内能:烯烃 > 烷烃,所以氢化反应放热
总目录
烯烃
氢化热 kJ.mol-1
137.2 125.1 126.8 119.7
115.1
总目录
烯烃
氢化热 kJ.mol-1
126.8
119.2
112.5
111.3
总目录
(1)稳定性:反式 > 顺式 (2)C=C连接的烷基越多越稳定 • 稳定性:
• R2C=CR2 > R2C=CHR > RCH=CHR ≈ R2C=CH2 > RCH=CH2 > CH2=CH2
总目录
注意:
• 顺、反与Z、E是两种不同的表示烯烃几 何构型的方法,在大多数情况下,不存 在对应关系。即顺式不一定是Z构型,而 反式不一定是E构型。例如:
第三章 单烯烃

根据产物推测反应物的结构。
4.催化氧化 ① 银催化氧化
② PdCl2-CuCl2催化氧化
五、聚合反应
六、α -H 的卤代(自由基卤代)
α- H :与官能团直接相连的碳原子上的氢
Cl2/CCl4,< 250℃ Cl2,> 450℃
亲电加成
自由基取代
反应控制在高温、卤素低浓度条件下进行。
光照、高温。自由基取代反应。
过氧化物对HCl, HI加成反应方向没影响.
三、催化氢化
常用的催化剂:铂黑(Pt),钯粉(Pb),Raney Ni 1.原理:烯烃与氢 加成反应需要很高
的活化能,加入催
化剂后,可以降低 反应的活化能,使 反应容易进行。
①催化剂的作用:降低烯烃加氢的活化能。 ②可能机理:烯烃和一分子氢被吸附在催化剂表面,并 释放出能量。能量的释放减弱了烯烃π键和氢分子的 σ键,从而促使两个新的碳氢键形成,烷烃自催化剂 表面解吸附,再吸附新的反应物分子,加氢反应是在 碳碳双键的同侧进行。 2.催化剂的分类 ①异相催化剂:催化剂不溶于有机溶剂,如:Pt黑,Ni粉 ②均相催化剂:催化剂溶于有机溶剂,如:三苯基膦与氯 化铑的络合物
亲电试剂:可以是分子或离子,通常具有空轨道,在反应过程 中接受一对电子形成新的共价键,例如H+,Br+,HBr Br2等,所有Lewis酸都是亲电试剂。
1、与酸的加成
(1)与卤化氢的加成
①HX的活泼次序: HI > HBr >HCl 浓HI,浓HBr能和烯烃起反应,浓盐酸要用AlCl3催 化剂才行。 ②马氏规则(Markovnikov 规则) 凡是不对称的烯烃和酸(HX)加成时,酸的负基X主要加到含氢原子较少的双键碳原子上,H+加到含 氢多的双键碳原子上。
有机化学考研复习资料-单烯烃

第三章单烯烃一、 基本内容1.单烯烃的定义和结构单烯烃指分子中含有一个碳碳双键的不饱和烃,碳碳双键是烯烃的官能团,称为烯键。
烯键是由一个碳碳σ单键和一个碳碳π键组成,具有刚性,不能绕碳碳双键自由旋转。
2.烯烃的同分异构现象烯烃的异构现象包括碳干异构;双键位置不同引起的官能团位置异构;由于双键两侧的基团在空间位置不同引起的顺反异构。
所以相同碳数的烯烃的异构体数目比相应的烷烃较多。
3.烯烃的化学性质碳碳双键是反映烯烃化学性质的官能团。
烯烃的化学性质比烷烃活泼,可以与许多试剂反应。
主要的反应有:亲电加成,催化氢化,氧化反应和聚合反应。
亲电加成包括与酸、卤素和硼烷等的加成;氧化反应包括用KMnO 4或OsO 4等作氧化剂的氧化,臭氧化反应;聚合反应主要是发生加聚反应,生成高分子化合物;催化氢化系烯烃在催化剂存在下,与H 2加成,生成烷烃的反应。
4.烯烃的制备可通过卤代烃脱HX 和醇脱H 2O 等方法制得;也可通过炔烃还原制得。
5.烯烃中氢的分类:可分为烯丙氢和烯氢。
其中,烯丙氢指在C=C 双键邻位碳原子上的氢,也叫α-H ;烯氢指与C=C 双键直接相连的氢原子,它们在发生自由基取代时的活性顺序为: 烯丙氢> 烯氢6.烯烃亲电加成历程和马氏规则。
烯烃亲电加成反应一般分两步进行:第一步,烯烃接受亲电试剂的进攻生成正离子中间体;第二步,正离子与亲核物种结合。
有的反应在第一步生成的正离子为结构特殊的三元环状正离子(鎓离子),如Br 2与烯烃加成生成溴鎓正离子;第二步,Br -从背后进攻,生成反式加成产物。
卤化氢等极性试剂与不对称烯的离子型加成反应,氢原子加在含氢较多的双键碳原子上,卤素、其它亲核性原子或基团加在含氢较少的双键碳原子上。
这种取向称为马尔科夫尼科夫规则,简称马氏规则。
马氏规则是一种经验规则,应在具体的反应中作具体分析。
C C ()二、难点与重点评述本章重点是烯烃的结构,π键的特征,烯烃的化学性质及应用,亲电加成反应的历程,马式规则的应用。
烯烃命名知识

第三章 单 烯 烃学习要求:1.掌握sp 2杂化的特点,形成π键的条件以及π键的特性。
2.握烯烃的命名方法,了解次序规则的要点及Z / E 命名法。
3.掌握烯烃的重要反应(加成反应、氧化反应、α-H 的反应)。
4.掌握烯烃的亲电加成反应历程,马氏规则和过氧化物效应。
分子内含有碳碳双键(C=C )的烃,称为烯烃(有单烯烃,二烯烃,多烯烃),本章讨论单烯烃,通式为 C n H 2n 。
§ 3—1 烯烃的结构最简单的烯烃是乙烯,我们以乙烯为例来讨论烯烃双键的结构。
一、 双键的结构键能 610KJ / molC —C 346KJ / mol由键能看出碳碳双键的键能不是碳碳单键的两倍,说明碳碳双键不是由两个碳碳单键构成的。
事实说明碳碳双键是由一个键和一个键构成的。
双键( C=C) = σ键 + π键现代物理方法证明:乙烯分之的所有原子在同一平面上,其结构如下:二、 sp 2杂化为什么双键碳相连的原子都在同一平面双键又是怎样形成的呢杂化轨道理论认为,碳原子在形成双键时是以另外一种轨道杂化方式进行的,这种杂化称为sp 2杂化。
0.108nm0.133nm117°121.7°sp 2sp sp 2p2s2p杂化2杂化态激发态三、 乙烯分子的形成未杂化的 P 轨道垂直于杂化的轨道,从侧面交盖称为 П 键,轨道上的电子称为π电子,其交盖较 σ — 键小。
所以键能小。
其它烯烃的双键,也都是由一个σ键和一个π键组成的。
π键键能 = 双键键能 — 碳碳单键键能 = 610KJ / mol – 346 = / molπ键的特点:① 不如σ键牢固(因p 轨道是侧面重叠的)。
② 不能自由旋转(π键没有轨道轴的重叠)。
键的旋转会破坏键。
③ 电子云沿键轴上下分布,不集中,易极化,发生反应。
④ 不能独立存在。
四、 其他分子的形成:(丙烯)一个sp2三个 的关系sp 2轨道与轨道的关系p sp2π电子云形状π键的形成乙烯中的 σ键§ 3—2 烯烃的异构和命名一、 烯烃的同分异构现象烯烃的同分异构现象比烷烃的要复杂,除碳干异构外,还有由于双键的位置不同引起的位置异构和双键两侧的基团在空间的位置不同引起的顺反异构(几何异构)。
第三章 单烯烃

4. 氢化热与烯烃的稳定性: 1 mol不饱和烃催化加氢所放出的热量称为氢化热。 不饱和烃的氢化热↑,说明原不饱和烃分子的内能↑, 该不饱和烃的相对稳定性↓。
126.6 -1 kJ.mol E
119.5 -1 kJ.mol
115.3 -1 kJ .mol
126.6 -1 kJ.mol E
119.1 -1 kJ.mol
1. 催化氢化反应
CH3CH CH2 + H2
Ni,C2H5OH 25 C,5MPa
CH3CH2CH3
2. 催化氢化反应历程
1,2-二甲基环己烯
顺-1,2-二甲基环己烷(86%) 反-1,2-二甲基环己烷(14%)
3.催化加氢的反应活性:
CH2=CH2>RCH=CH2>RCH=CHR>R2C=CHR>R2C=CR2
0.123nm
H
以乙烯分子为例:
乙烯分子中的σ键
乙烯分子中的π键
2.π键的特征
(1)π键键能较σ键低,不稳定,易打开;具有较 大的化学活性。
C=C:610kj/mol-1
π键: 264.4kj/mol-1
C-C: 345.6kj/mol-1
(2)碳碳双键不能以σ键为轴自由旋转。 (3)键长比C-C单键短
②立体异构
顺反异构:由于双键上的碳原子不能绕双键自由旋转, 双键碳上所连的两个基团不同时,就出现顺反异构现 象。
H CH3
顺-2-丁烯
C
C
H CH3
CH3 H
C
C
H CH3
反-2-丁烯
条件:当两个双键碳上所带有的两个基团不同时,都 有顺反异构现象,但若一个双键碳上带有的两个基团 相同时,就没有顺反异构现象。
第三章单烯烃

第三章单烯烃第三章单烯烃●教学基本要求1、掌握烯烃的分⼦结构、п键;2、理解烯烃的结构与性质的关系;3、掌握烯烃的命名法、性质及其制法;4、初步掌握烯烃的亲电加成反应历程。
●教学重点烯烃的分⼦结构、п键;烯烃的结构与性质的关系;烯烃的命名法、性质及其制法;烯烃的亲电加成反应历程。
●教学难点烯烃的亲电加成反应历程。
●教学时数:●教学⽅法与⼿段1、讲授与练习相结合;2、讲授与教学模型相结合;3、传统教学⽅法与与现代教学⼿段相结合;4、启发式教学。
●教学内容第⼀节烯烃的结构分⼦中仅含有⼀个碳碳双键C=C的烃称为单烯烃,简称烯烃,通式为C n H2n。
C=C是烯烃的官能团。
1.1⼄烯的结构⼄烯是最简单的烯烃,分⼦式为C2H4,构造式为H2C=CH2。
现代物理⽅法证明,⼄烯分⼦中的所有原⼦都在同⼀平⾯上,每个碳原⼦只和三个原⼦相连。
碳碳双键的键能为610 kJ/mol,键长为0.134nm,价键之间的夹⾓彼此成1200⾓。
根据杂化轨道理论,⼄烯分⼦中的碳原⼦以sp2杂化⽅式成键,两个碳原⼦各以⼀个sp2轨道重叠形成⼀个C─Cσ键,⼜各以两个sp2轨道和四个氢原⼦的1s轨道重叠,形成四个C─Hσ键,五个σ键都在同⼀平⾯上。
每个碳原⼦剩下的⼀个2p y轨道,它的对称轴垂直于sp2轨道所在的平⾯。
它们平⾏地侧⾯重叠,便组成π键。
π键的直剖⾯垂直于σ键所在的平⾯。
推论:C=C是由⼀个σ键和⼀个π键构成。
1、π键的特点⑴π键不如σ键稳定,⽐较容易破裂。
因为π键重叠程度⽐σ键⼩,π键的键能等于264.4kJ/mol [即610(C=C 键能)-345.6(C ─C 键能)],⼩于C ─C 单键的键能为345.6kJ/mol 。
⑵π键具有较⼤的流动性,容易受外界电场的影响,电⼦云⽐较容易极化,容易给出电⼦,发⽣反应。
由于π键的电⼦云不象σ键电⼦云那样集中在两原⼦核连线上,⽽是分散成上下两⽅,故原⼦核对π电⼦的束缚⼒就较⼩。
烯烃

第三章 单烯烃Chapter three Alkenes第一节、烯烃的结构(Structure of Alkene )烯烃----含有一个碳碳双键的开链不饱和烃叫烯烃。
CnH2n 一、碳碳双键的特殊性乙烯是最简单的烯烃,乙烯的分子式为C 2H 4,构造式为CH 2=CH 2。
乙烯有如下反应事实:CH 2CH 2H 2CH 3CH 3 CH 2CH 2B r 2CH 2B rCH 2Br这说明C=C 双键反应时,并不全部打开。
通常只有一根键打开,说明两根键中有一根较弱。
测得E (C=C )=610KJ/mol ,E (C-C )=345.6KJ/mol ,由此可知, C=C 中并非两根σ键,而是一根 π 键,一根σ键。
那么π 键是如何形成的呢? π 键为何易打开?下面谈乙烯的结构。
二、乙烯的结构乙烯碳原子成键时,采取SP 2杂化,杂化轨道成平面三角形:[讨论]:1、分子中六个原子及其所形成的五个σ键都处在同一平面。
2、乙烯的物理常数(1) 键角: ∠H-C-H =116.7 o , ∠H-C-C =121.6 o (2) 键长:简写成CH 2=CH 2L C=C =1.34Å(134pm ) L C-C =1.54Å(154pm ) L C-H =1.076Å(107.6pm ) L C-H =1.102Å(110.2pm ) a 杂化轨道半径SP 3 >SP 2,重叠程度 SP 2 > SP 3; b 由于两个p 轨道肩并肩重叠的影响。
(3)键能:E C=C =610>E C-C =345.6KJ/mol(4)碳氢酸的酸性: 电负性:SP 2 > SP 3 氢的酸性:CH 2CH >CH 3CH 2HHPKa >36.5 42[注]:氢的酸性与共轭碱的碱性有关:稳定性CH 2CH>CH 3CH 2自由基的稳定性与键能有关:CH 2CH >CH 3CH 23、 π键的特性:(1) π键无轴对称所以不能旋转。
有机化学第三章

3.1.3
构造异构 碳链异构
烯烃的同分异构
C5H10的烯烃为例
C C C C C C C C C C C C C C C
位置异构
C C C C C C C C C C
C C C C C
C C C C C
C C C C C
立体异构 顺反异构
H3C C C H C2H5
H
H
H3C C C
C2H5 H
产生顺反异构的条件: 产生顺反异构的条件: 构成双键的任何一个碳原子 上所连接的两个原子或基团 不相同。 不相同。
∆H
C C C C
C C C C ∆H
相同碳原子数的烯 烃的稳定性: 烃的稳定性:
C C C C
反反反反
双键取代基越多越稳定; 双键取代基越多越稳定; 反式比顺式稳定。 反式比顺式稳定。
一些烯烃的氢化热
名 称 乙烯 丙烯 构 造 式 氢 化 热 △H/kJ·mol-1 137 126 127 120
和 Sp3和sp2杂化的比较
sp2 成份
1/3的s成份和2/3的p成份
sp3
1/4的s成份和3/4的p成份
空间伸 展 电负性 比较
互成120o,同一平面
互成109o28‘,立体空间伸展
sp2 > sp3
3.1.2 乙烯(ethylene)的结构 乙烯( 的结构
H C C H H H
碳、碳原子之间(Csp2-Csp2)σ键; 碳原子之间( 氢、碳原子之间(H1s-Csp2)σ键; 碳原子之间( -
Raney Ni H2
催化加氢机理
催化剂
反应历程: 在催化剂表面吸附-脱附过程
催化加氢都是顺式加成: 顺式加成: 顺式加成
3、第三章 烯烃

CH2 CH Br
C H 2B r CH3
CH3
4、加硫酸
烯烃可与浓硫酸反应,生成烷基硫酸。
R CH CH2
H O S O 3H
R
CH
CH3
+
R
CH H
CH2 O S O 3H
H 2 O/
O S O 3H ( 主 )
H 2 O/
R
CH OH
CH2
+
R
CH H
CH2 OH
H( 主 )
用来生产乙醇、异丙醇、叔丁醇
π键的重叠程度比σ键要小得多,键能也小,故π键不如σ 键牢固。 π电子云分散在σ键所在平面上下两方,离碳原子核较远, 故π键容易断裂,因此烯烃具有较大的活泼性。
σ键可以自由旋转,而π键不能自由旋转,故碳碳双键不 能自由旋转。
H H
C
C
H H
C-C 组成 C杂化形式 键长 活泼性 旋转性 一个σ键 sp3杂化 0.154nm 不活泼,很稳定 可自由旋转
第三章 烯烃
• 分子中含有一个碳碳双键的开链
烃称为单烯烃,简称烯烃,如乙
烯、丙烯等。烯烃比相同碳原子
数的烷烃少两个氢原子,属于不
饱和烃,通式为CnH2n。碳碳双键
是烯烃的官能团。
第一节 烯烃的结构
碳碳双键是烯烃的官能团,也是烯烃结构的特征。
一、乙烯的结构
① 乙烯的分子式是C2H4,乙烯分子中的所有原子均在同一 个平面上,每个碳原子只与三个原子相连,各个价键之间的 角度和键长如下:
1 2 3 4 5 6
CH3
C
CH
C
CH
CH3
CH3
C 2H 5
有机化学第三章单烯烃、第四章炔烃和二烯烃课件
合成和反应
单烯烃可以通过饱和化合物的脱 水、脱卤、氢化等反应得到,具 有多样的化学变换和催化反应。
应用领域
单烯烃被广泛用于化学工业、医 药领域和新材料的合成和制备, 如聚合物、溶剂和药物。
炔烃
炔烃是一类含有碳碳三键的有机化合物,具有独特的结构和化学性质。它们被广泛用于合成化学 和有机材料科学领域。
1
定义和特征
二烯烃具有两个独立的双键,形成了特殊的环境和反应位点。
2
合成和应用
二烯烃可以通过饱和化合物的脱水、分子内反应和特定条件下的聚合等方式合成。
3
化学性质和反应
二烯烃具有多样化的化学反应,可进行环化、聚合和环境敏感等特定转化。
有机化学第三章单烯烃、 第四章炔烃和二烯烃课件
介绍有机化学的重要性和基本概念,探索单烯烃、炔烃和二烯烃的关键特征、 结构和应用领域。
单烯烃
单烯烃是一类具有双键的有机化合物,具有独特的化学性质和结构特征。它们在药物合成、材料科学和能源领 域中扮演着重要角色。
定义和特征
单烯烃是一类含有碳碳双键的碳 氢化合物,具有不饱和性和亲电 性。
定义和特征
炔烃是一类含有碳碳三键的碳氢化合物,具有特定的电子结构和化学活性。
合成和应用
炔烃可以通过饱和化合物的去氢和合成反应得到,广泛应用于有机合成和能源产业。
反应性和催化
炔烃具有丰富的化学反应,能发生加成、环化和聚合等多种反应,也可通过金属催化剂进行 特定的转化。
二烯烃
二烯烃是一类具有两个不相连双碳键的有机化合物,拥有丰富的结构和特性,广泛应用于有机合成和材 料科学领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章 单烯烃 Chapter3 alkenes
1. 推测下列化合物的结构.
(1) 三个分子式为C 10H 16的化合物,经臭氧氧化和还原水解后,分别生成下列化合物.
O
CH(CH 3)2
32CHO CH 3H H CH 2COCH 3
CH 3
CH 3CHO H
H
(2) 一化合物的分子式为C 19H 38 ,催化加氢后生成2,6,10,14-四甲基十五烷;臭氧化和还原水解后则得到(CH 3)2=O 和一个十六碳醛.
(3)一个含羟基的化合物C 10H 18O,与KHSO 4一起加热后生成两个新化合物,他们催化加氢后生成同一化合物,其中一个化合物经臭氧化和水解后得到一种产物,环戊酮,
O
(4)化合物A 的分子式为C 6H 18,光氯化时得到3种一氯代烷B,C 和D,B 和C 与叔丁醇钾在叔丁醇溶液中生成同一烯烃E,D 不能起E 2反应,试推测A,B,C,D 和E 的结构. 2. 推测下列反应的机理.
(1) (CH 3)C=CH 2 + Cl 2
CH 2=C-CH 2Cl + HCl
CH 3
(2)
+
H 3C
CH 3
H 3C
CH 3
3
(3)
H 3C
CH=CH 2
+ H 2O
H 2SO 4
H 3C
OH CH 3
(4) C 5H 11CH=CH 2 + (CH 3)3
COCl
CH 3OH,HCl
C 5H 11CHCH 2Cl
3
3. 如何完成下列转变.
(1) CH3CHBrCH3
CH 3CH 2CH 2Br
(2) CH 3CH 2C=CH 2
CH 3
CH 3CH 2C(CH 3)2
(3) CH 3CH 22
CH 3
CH 3CH 2CHCH 2OCH 3
CH 3
(4)
O
(5)
Br
OH
(6) HOCH 2CH 2CH 2CH=CH 2
O
CH 2
4. 用系统命名法命名下列化合物.
(1) CH 3CH 2CH 2CH=CH 2
(2)
C C
H
CH 3CH 2CH 2
H CH 3
(3)
C C
H 3CH 2C H 3CH 2C
Cl
3)2(4)
C C
H 3CH 2C H 3CH 2C CH(CH 3)2
Cl
(5)
C
CH 3
H 3CH 2C
H
2
(6)
C C
H 3CH 2C H
C
CH 3
H 3C H
CH 2CH 3
5. 将下列各组烯烃,按它们起酸催化水合反应的活性次序进行排列,并解释原因.
(1) CH 2=CH 2 CH 3CH=CH 2 CH 3C(CH 3)=CH 2 (2) (CH 3)2C=CH 2 ClCH 2CH=CH 2 环己烯
6. 3-乙基-2-戊烯与下列试剂反应,试写出各反应产物的结构式并命名。
(1)Br 2/CCl 4 (2)Br-H 2O (3)HBr/CHCl 3 (4)HBr ,(PhCOO )2 (5)H2,Pd/C (6)稀冷KMnO4
(7)①B 2H 6,THF ;②H 2O 2,OH - (8)①Hg(OAc)2,CH 3OH;②NaBH 4
(9) ①O 3; ②Zn,H 2O
7. 写出下列反应的主要产物:
(1) (CH 3)2C=CH 2 + HBr
(2) CF 3CH=CHCl + HCl
(3) (CH 3)3CCH=CH 2 + HCl
(4)
C
H 3CH 2CH 2C
CH 3
H
CH 3CH 2ONa
32
(5)
+ Cl 2
CCl 4
(6)
Br
(CH 3)3COK 33
aq. KMnO 4
(7) CH 3CH
2CHClCD 2CH
(8)
+ HCl
AlCl 3
(9)
B 2H 6
H 2O 2,NaOH
(10) (CH 3)CCH=CH Hg(OAc)2,H 2O-THF
NaBH 4
8.用化学方法区别下列各组化合物:
(1)戊烷 2-戊烯 1,2-二甲基环丙烷(2)烯丙基溴 1-己烯(3)环己烯环己烷溴代环己烷
答案
1. (1)
(2) (CH3)2C=CHCH2CH2CH(CH2)3CH(CH2)3CH(CH3)2
CH3CH3
(3)
HO
(4) A: (CH3)3CCH2CH3B: (CH3)33C: (CH3)3CCH2CH2Cl
Cl
D: (CH3)2CCH2CH3
2
Cl
E: (CH3)3CCH=CH2
3. (1) (CH 3)2
2
CH3-C-CH2Cl
+
CH3
CH32Cl
+
-H+CH
2
=C-CH2Cl
CH3
3
3
3
3
H3
C
CH3
3
2
3
CH
3
H
3
C
(2)
(3)H3C CH=CH2
H
-
H3C
CH3
+H
2
O OH2
H3C
+
CH3-H+
H3C OH
CH3
(4) C5H11 2 3)3C5H11CCH2Cl
+HOCH
3 C5H11CH-CH2Cl
HOCH3
+
-H+C
5
H11CH-CH2Cl
OCH3
3. (1) i )NaOEt,NaOH ii )HBr,过氧化物(2)i )Hg(OAc)2,CH3OH ii )NaBH4 (3) i ) HBr,过氧化物 ii )NaOCH3,CH3OH (4) i )O3 ii )Zn+HOAc
(5) i ) NaOEt,EtOH ii )Br2-H2O (6) I2,NaHCO3
4. (1) 1-戊烯(2)(E)-2-己烯(3)(Z)-2,3二甲基-3-己烯
(4)2-甲基-4-乙基-3氯-3-己烯(5)(S)-3-甲基-1-戊烯
(6)(S,Z)-3,4二甲基-2-己烯
5. (1)(CH3)2=CH2 > CH3CH=CH2 > CH2=CH2
(2)(CH3)2=CH2 >环己烯 > ClCH2CH=CH2
6. (1) CH3CH-C(CH2CH3)2
Br
3-乙基-2,3-二溴戊烷
(2) CH 3CHC(CH 2CH 3)2
Br OH
3-乙基-2-溴-3-戊醇
(3) (CH 3CH 2)3CBr
3-乙基-3-溴戊烷
(4) CH 3CHCH(CH 2CH 3)2
Br
3-乙基-2-溴戊烷
(5) (CH 3CH 2)3CH
3-乙基戊烷
(6) CH 3CHC(CH 2CH 3)2
OH
OH 3-乙基-2,3-戊二醇
(7)(CH 3CH 2)2CHCH 2CH 2OH 3-乙基-1-戊醇 (8)(CH 3CH 2)3COCH 3 3-乙基-3-甲氧基戊烷 (9)CH 3CHO + (CH 3CH 2)2=O 乙醛,二乙基酮
7. (1) (CH 3)3CBr (2)CF 3CH 2CHCl 2(3)(4)
(5)(CH 3)3CCH(CH 3)2
C
H 3CH 2CH 2C
3
EtO
C Cl
H Et
3
+
Cl
H
3
(6)
(7)C C
H 3C H
H CD 2CH 3
(8)
(9)
*
3
B
OH
(10) (CH 3)3CCHCH 2HgOAc
(CH 3)3CCHCH 3
OH
9. (1)i )Br 2/CCl 4 ii )KMnO 4(稀冷) (2)AgNO 3,EtOH
(3)i )Br 2/CCl 4 ii ) AgNO 3,EtOH ,∆。
