水稻转基因组织培养步骤的具体事宜
水稻转基因育种的研究进展与应用现状

水稻转基因育种的研究进展与应用现状刘志宏1 田 媛2 陈红娜1 周志豪1 郑 洁2 杨晓怀1(1深圳市农业科技促进中心,广东深圳518000;2暨南大学食品科学与工程系,广东广州510632)摘要:随着生物技术发展的不断深入,我国水稻种业的发展也面临着全新的机遇和挑战。
目前,改善水稻品种质量的主要方法有分子标记技术、基因编辑技术和转基因技术。
其中,转基因水稻是利用生物技术手段将外源基因转入到目标水稻的基因组中,通过外源基因的表达,获得具有抗病、抗虫、抗除草剂等优良性状的水稻品种。
近年来,国内外在采用转基因技术进行水稻育种,提升水稻产量、改善水稻品质方面具有较多的研究进展。
在阐述转基因技术工作原理的基础上,概述国内外利用转基因技术在优质水稻育种方面的研究进展,进一步探究转基因技术在我国水稻育种领域的发展前景。
关键词:转基因育种;水稻;病虫害;除草剂Research Progress and Application Status of Rice Transgenic Breeding LIU Zhihong1,TIAN Yuan2,CHEN Hongna1,ZHOU Zhihao1,ZHENG Jie2,YANG Xiaohuai1(1Shenzhen Agricultural Technology Promotion Center,Shenzhen 518000,Guangdong;2Department of Food Science and Engineering,Jinan University,Guangzhou 510632)水稻(Oryza sativa L.)作为世界上重要的粮食作物之一,为世界超过1/3的人口提供了主粮,全球种植面积约1.4亿hm2[1]。
“十二五”以来,我国水稻产量连续稳定在2亿t以上[2]。
水稻作为我国的主要粮食作物,在我国粮食生产领域占据着十分重要的地位,水稻品种改良仍是保障种业持续发展和国家粮食安全的重点。
转基因操作的基本流程

转基因操作的基本流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!转基因操作的基本流程如下:1. 目的基因的获取:通过化学合成、从生物体中提取或利用 PCR 技术扩增等方法,获得所需的目的基因。
水稻转基因组织培养步骤

水稻转基因组织培养步骤农杆菌介导的转化一.试剂1 6-BA (6-BenzylaminoPurine) Sigma Cat No. B-58982 KT (Kinetin) Sigma Cat No. K-07533 NAA (Napthalene acetic acid) Sigma Cat N-06404 IAA (Indole-3-acetic acid) Sigma Cat No. I-51485 2,4-D (2,4-Dichlorophenoxyacetic acid) Sigma Cat No. D-84076 Kanamycin USB Cat No. 179247 CH (Casein Enzymatic Hydrolysate) Sigma Cat No. C-72908 Hn (hygromycin B) GiBco BRL Cat No. 10687-0109 Cn (Carbenicillin) 国产分装10 Nicotinic acid Sigma Cat No. N-076511 Pyridoxine HCl Sigma Cat No. P-866612 Thiamine HCl Sigma Cat No. T-390213 Inositol Sigma Cat No. I-301114 Phytagel Sigma Cat No. P-816915 Dimethyl Sulfoxide-DMSO Sigma Cat No. D-587916 X-gluc (5-bromo-4-chloro-3-indolyl-D-galactoside) Sigma Cat No. B-378317 AS (Acetosringone) Aldrich chem., CO 01531 EG二.溶液1.MS maxNH4NO316.5gKNO319.0gKH2PO4 1.7gMgSO4?7H2O 3.7gCaCl2?2H2O 4.4g 或CaCl2 3.32g逐一溶解药品后,加dH2O定容到1000ml。
水稻转基因实验技术手册

水稻转基因实验技术手册遗传工程实验室Genetic Engineering Laboratory Discipline of Crop Genetics and BreedingFujian agricultural and Forestry University目录第一章DNA提取与纯化第二章引物设计与PCR第三章感受态细胞制备与转化(E. coli & 农杆菌)第四章电泳技术、琼脂糖凝胶DNA回收第五章质粒回收第六章RT-PCR第七章构建载体互补实验过量表达GFPGUSRNAi第八章水稻组织培养第九章原位杂交第十章石蜡切片技术第十一章扫描电子显微镜附录:第一章SDS-DNA微量提取法1、取新鲜叶片5cm 左右于1.5ml 离心管中,加入液氮研磨(电钻)。
2、加入700μl 预热至65℃的SDS 抽提液,迅速搅匀后置于65℃水浴30min 。
3、加入200μl 5M KAc ,颠倒混匀,-20℃冰浴30min 后,10,000rpm 离心5min ,将上清夜倒入另一新的1.5ml 离心管中。
注:若溶液中仍有植物组织,可进行二次离心。
4、加入等体积的异丙醇(700 μl ),-20℃冰浴30min ,11,000rpm 离心5min 。
5、弃上清,加入70%乙醇清洗液晾干。
6、将风干的DNA 溶于100 μl TE 溶液中,55℃水浴溶解1h ,再室温放置1d 。
实验准备:溶液配制:SDS-抽提液:1M Tris-HCl :100ml 5M NaCl :100ml 0.5M EDTA :100ml 10% SDS :125mlTE (pH8.0):1M Tris-HCl (pH8.0):5ml 0.5M EDTA (pH8.0):1ml第二章 PCR定容至1000ml定容至500mlPrimeSTAR HS DNA Polymerase with GC Buffer & TaKaRa LA Taq with GC BufferPCR体系和程序第四章琼脂糖凝胶DNA回收*第一次使用前请先在15ml漂洗液WB中加入60ml无水乙醇1、在长波紫外下,用干净刀片将所需回收的DNA条带切下,尽力切除不含DNA的凝胶,得到凝胶体积越小越好。
水稻转化方法

水稻转化方法1.愈伤组织的诱导选取成熟良好、饱满、无霉变的籼稻种子,用糙米机或人工方法去掉种子的内外粰,保留胚的完整性。
先用75%酒精消毒1 min,再浸泡于40% NaClO+0.1% Tween 20 溶液,并置于100 rpm的摇床上消毒30 min。
在超净工作台上,消毒后的去粰种子用无菌水洗涤5次以上,洗净后转移至装有无菌吸水纸的培养皿中吸干水分,再将去粰种子接种于诱导培养基中。
培养条件为32℃,持续光照(100 mole m-2 s-1)。
30天后即可得到较好的愈伤组织用于转化。
2.农杆菌的准备农杆菌选用水稻转化中常用的菌株Ag10。
将含有目的基因的表达载体通过电激转化法转入农杆菌Ag10,选取阳性菌株,再将阳性菌株划线于含合适抗生素的YEB固体平板培养基中,于28 ℃暗培养3天。
3天后,用接种针挑取米粒大小的农杆菌震荡悬浮于装有100 mL AA 浸染培养基的150 mL灭菌三角瓶中,以此作为愈伤组织的农杆菌浸染液。
特别值得注意的是,农杆菌应充分分散,而且浓度不能太大(OD600=0.1),否则后续的脱菌效果不好。
3.愈伤组织和农杆菌的共培养挑取诱导30天并且生长良好的愈伤组织(长出的水稻芽与种子去掉)浸泡于装有100 mL 农杆菌浸染液的150 mL灭菌三角瓶中(在加入愈伤前,先加入150ml的AS,使AA液中AS的浓度为30mg/L),摇动5min。
同时,在共培养基平板上预先垫1张无菌滤纸,用1 mL 的AAM浸染培养基打湿,并除去气泡。
然后将浸染5 min后的愈伤组织用无菌滤纸吸干,置于垫了滤纸的共培养基上于25℃黑暗培养3天。
4.农杆菌的洗脱将共培养3天后的愈伤组织置于250 mL锥形瓶中,先用无菌水洗涤4-5次,直至洗液清澈透明为止。
加入过滤灭菌的400 mg/L羧苄青霉素溶液适量,于摇床上100 rpm 震荡洗涤25 min。
然后倒掉洗液,继续用羧苄青霉素溶液洗愈伤3-5次,再加入适量羧苄青霉素溶液,于摇床上100 rpm 震荡洗涤25 min,然后倒掉洗液,继续用羧苄青霉素溶液洗愈伤3-5次,最后用无菌滤纸将愈伤组织吸干。
水稻转基因组织培养步骤

农杆菌介导的转化一.试剂1 6-BA (6-BenzylaminoPurine) Sigma Cat No. B-58982 KT (Kinetin) Sigma Cat No. K-07533 NAA (Napthalene acetic acid) Sigma Cat N-06404 IAA (Indole-3-acetic acid) Sigma Cat No. I-51485 2,4-D (2,4-Dichlorophenoxyacetic acid) Sigma Cat No. D-84076 Kanamycin USB Cat No. 179247 CH (Casein Enzymatic Hydrolysate) Sigma Cat No. C-72908 Hn (hygromycin B) GiBco BRL Cat No. 10687-0109 Cn (Carbenicillin) 国产分装10 Nicotinic acid Sigma Cat No. N-076511 Pyridoxine HCl Sigma Cat No. P-866612 Thiamine HCl Sigma Cat No. T-390213 Inositol Sigma Cat No. I-301114 Phytagel Sigma Cat No. P-816915 Dimethyl Sulfoxide-DMSO Sigma Cat No. D-587916 X-gluc (5-bromo-4-chloro-3-indolyl-D-galactoside) Sigma Cat No. B-378317 AS (Acetosringone) Aldrich chem., CO 01531 EG二.溶液1.MS maxNH4NO316.5gKNO319.0gKH2PO4 1.7gMgSO4∙7H2O 3.7gCaCl2∙2H2O 4.4g 或CaCl2 3.32g逐一溶解药品后,加dH2O定容到1000ml。
水稻转基因策略-第三版

水稻转化体系的构建(第三版,2015年3年10日)N6D 诱导愈伤,前培养2N6-AS 共培养N6DS 筛选MS-NK 再分化MS-HF 生根AB 农杆菌生长MSL 侵染N6D 1LChu N6 Basal Medium w/ Vitamins(PhytoTechnology Laboratories)3.99gMyo-inositol 0.1gProline 2.878gCasamino acid 0.3gSucrose 30g2.4-D 2mg/LGellan gum(Gelrite) 3g/L(分装)PH5.8120℃15min2N6-AS 1LChu N6 Basal Medium w/ Vitamins(PhytoTechnology Laboratories)3.99gMyo-inositol 0.1gCasamino acid 0.3gSucrose 30gGlucose 10g2.4-D 2mg/LGellan gum(Gelrite) 3g/L(分装)PH5.8120℃15min 冷却至50℃加1ml AS(200mg/L)不要吹的太干,该培养基要湿度高一些较好。
N6DS 1LChu N6Basal Medium w/ Vitamins(PhytoTechnology Laboratories)3.99gMyo-inositol 0.1gProline 2.878gCasamino acid 0.3gSucrose 30g2.4-D 2mg/LGellan gum(Gelrite) 3g/L(分装)PH5.8120℃15min 冷却至50℃加1ml cef(100mg/ml) 1ml hyg(50mg/ml)MS-NK 1LMS Basal Medium w/ Vitamins(PhytoTechnology Laboratories)4.43g (包含0.1g Myo-inositol )Casamino acid 2gSucrose 30gSorbitol 30gNAA 0.02mg/LKinetin 2mg/LGellan gum(Gelrite) 3g/L(分装)PH5.8120℃15min 冷却至50℃加1ml cef(100mg/ml) 1ml hyg(50mg/ml)MS-HF 1LMS Basal Medium w/ Vitamins(PhytoTechnology Laboratories)4.43g (包含0.1g Myo-inositol )Sucrose 30gGellan gum(Gelrite) 3g/L(分装)PH5.8120℃15min 冷却至50℃AB 200mlGlucose 1gAgrose 3gAB Buffer(20倍) 10mlAB Salt (20倍) 10mlddH2O 180ml120℃15min 冷却至50℃加相应的抗生素。
转基因技术的主要操作流程

转基因技术的主要操作流程
内容:
转基因技术的主要操作流程通常包括以下几个步骤:
1. 选择目的基因。
根据转基因的目的,从供体中选择想要的目的基因,这通常是编码某种有用蛋白质的基因。
2. 构建载体。
将选定的目的基因插入到载体分子中,例如质粒或病毒载体。
载体可以帮助目的基因进入目标生物的细胞。
3. 将重组载体导入宿主细胞。
使用微注射、电穿孔、基因枪等方法,将含有目的基因的重组载体导入目标生物的细胞中。
4. 筛选转基因细胞。
通过抗性筛选、荧光筛选等方法,从导入重组载体的细胞中筛选出真正导入了目的基因的转基因细胞。
5. 转基因细胞培养。
对转基因细胞进行培养、繁殖,获得足够数量的转基因细胞。
6. 转基因植株再生。
通过组织培养等手段,从转基因细胞中再生出完整的转基因植株。
7. 鉴定转基因植株。
通过、杂交等手段对转基因植株进行鉴定。
8. 转基因植株评价。
对转基因植株的表型进行评价,确定是否达到了转基因的预期目的。
这就是转基因技术的主要操作流程。
不同的转基因目的和对象,具体操作可能会有所调整。
水稻转基因方法及培养基配放个

根癌农杆菌介导的转化方法将水稻成熟种子去壳。
仔细剔除有霉菌点籽粒,取饱满清亮籽粒先用70%乙醇浸泡(表面消毒)1min ,再用含2%活性氯含量的NaClO溶液(加1-3滴Tween20)浸泡30min以上(最长可至1小时左右),并不断摇动,然后用无菌水冲洗4-5次;将灭菌后的成熟种子置于无菌滤纸上吸干多余水分,直接接种于N2D6培养基上,于24-26oC暗培养7-10 天,诱导出初生愈伤组织;将上述从成熟胚诱导的初生愈伤组织直接用于与农杆菌的共培养转化;农杆菌的准备是在含有50mg/mL km的LB 平板上划线,培养含有重组质粒的农杆菌,28oC培养36h。
挑取活化的单个农杆菌菌落,在28oC于3mL 含km 的LB培养基中振荡培养过夜,第2天按1.5/50(V/V)接种量在AB液体培养基中培养,培养程度以稍早于生长对数期为宜(OD600约为0.6-0.8 )。
离心回收新鲜培养的农杆菌,并重悬于约1/2-1/3体积的AAM(含100-400mol·L-1乙酰丁香酮)液体培养基中,至OD600约为0.8-1.0左右为宜;将愈伤组织切下,立即投入含农杆菌的AAM重悬液中,浸泡15-20分钟,并不断摇动。
将感染后的愈伤组织置于无菌滤纸上吸干多余的菌液,转入共培养基N6D2C上培养3天(26oC,暗培养)。
转入筛选培养基N6D2S1上与24-26oC 暗培养条件下筛选2周。
新鲜长出的抗性愈伤组织或不褐化的愈伤组织转入筛选培养基N6D2S2上,继续筛选培养2次,每次2周。
将抗性愈伤组织转入MSPR培养基上进行预分化处理14天,其中先在暗条件下培养7天,然后转入光条件下培养7天;经预分化处理的愈伤组织转入MSR培养基分化再生,在光下培养;再生的小苗在1/2MS0培养基上生根壮苗。
农杆菌介导转化水稻所用培养基-1-1 626蔗糖,2mg·L-1 2,4-D, 2.5g·L-1Phytagel( sigma) ,pH5.8N6D2S1N6D2,25mg·L-1潮霉素B(Roche),500mg·L-1头孢霉素(cefotaxime)N6D2S2N6D2,50mg·L-1潮霉素B,300mg/mL头孢霉素2424442 150mg·L-1KCl, 10mg·L-1CaCl2, 2.5mg·L-1FeSO4·7H2O, 5g·L-1葡萄糖,pH7.0AAM AA(Toriyama和Hinata,1985)盐分和氨基酸,MS(Murashige和Skoog 1962)维生素,0.5g·L-1酪蛋白水解物,36g·L-1葡萄糖,68.5g·L-1蔗糖,100-400µmol·L-1乙酰丁香酮,pH5.2N6D2C N6D2, 10g·L-1葡萄糖,100-400µmol·L-1乙酰丁香酮(用时现加),pH5.2预分化与分化再生MSPR MS(Murashige和Shog,1962)盐分和维生素,0.5g·L-1酪蛋白水解物,50g·L-1蔗糖,2mg·L-16-BA,1mg·L-1NAA, 5mg·L-1ABA ,3.0g·L-1Phytagel, pH 5.8,50mg·L-1潮霉素B,200mg·L-1头孢霉素。
转基因水稻培育实验报告

一、实验目的本实验旨在通过基因工程技术,将具有特定功能的基因导入水稻中,培育出具有抗病、抗虫、抗逆等优良性状的转基因水稻,为我国水稻育种提供新的途径。
二、实验原理转基因技术是指将外源基因导入目标生物体基因组中,使目标生物体获得新的性状或功能。
本实验采用农杆菌介导法将目的基因导入水稻中,通过基因重组,使水稻获得抗病、抗虫、抗逆等优良性状。
三、实验材料1. 水稻品种:Oryza sativa L.(籼稻)2. 抗病基因:Xa213. 抗虫基因:Bt蛋白基因4. 抗逆基因:海藻糖合成酶基因5. 农杆菌:Agrobacterium tumefaciens EHA1056. 实验试剂:限制酶、DNA连接酶、质粒、抗生素等四、实验方法1. 目的基因的克隆与构建(1)从基因库中获取抗病基因Xa21、抗虫基因Bt蛋白基因和抗逆基因海藻糖合成酶基因的DNA序列。
(2)利用PCR技术扩增目的基因。
(3)将扩增的目的基因与载体质粒连接,构建重组质粒。
2. 农杆菌转化(1)将重组质粒转化农杆菌EHA105。
(2)将转化后的农杆菌接种于含有抗生素的培养基中,筛选阳性克隆。
3. 转化水稻(1)将阳性农杆菌接种于含有抗生素的培养基中,培养至对数生长期。
(2)将农杆菌与水稻叶片接触,进行转化。
4. 筛选转基因植株(1)将转化后的水稻苗移栽至田间,进行抗性鉴定。
(2)根据抗性表现,筛选出转基因植株。
5. 分子鉴定(1)提取转基因植株的DNA。
(2)利用PCR技术检测目的基因是否整合到水稻基因组中。
五、实验结果1. 成功构建了含有抗病基因Xa21、抗虫基因Bt蛋白基因和抗逆基因海藻糖合成酶基因的重组质粒。
2. 转化后的农杆菌能够将目的基因导入水稻中。
3. 通过抗性鉴定,筛选出具有抗病、抗虫、抗逆等优良性状的转基因水稻。
4. 分子鉴定结果显示,目的基因已整合到水稻基因组中。
六、实验结论本实验成功培育出具有抗病、抗虫、抗逆等优良性状的转基因水稻,为我国水稻育种提供了新的途径。
水稻遗传转化步骤

实验流程:种子灭菌(ms+, 28天,暗培养,28℃)---愈伤继代( ms,7天,28℃自然光照)--转化共培养(co,暗培养3天,上面放一层滤纸19℃,很重要!)---第一次选择(S500,暗培养15天,28℃)---第二次选择(S500,暗培养15天,28℃)---第三次选择(选抗性愈伤,S250,暗培养7天,28℃)---预分化(m,暗培养8天,28℃)---第一次分化(f,先暗培养2天,28℃,后光照13天)---第二次分化( f,光照15天)---壮苗(1/2,光照,时间不定)种子灭菌:(1)用75%酒精泡5分钟,倒出酒精,加2.5%次氯酸钠摇10分钟以上(2)倒出次氯酸钠,再加2.5%次氯酸钠15-20分钟,猛烈摇动,在超净台上倒去次氯酸钠,用灭菌水洗10次以上,然后放于滤纸上吸干,接种于ms+培养基。
共培养处理:种子愈伤处理28天左右,挑优质愈伤继代培养一次,挑颗粒用农杆菌浸泡15分钟,共培养三天后,挑无褐色愈伤颗粒,用灭菌水洗三次,放入NBL中,摇床摇2小时(200rpm),滤纸吸干后放入筛选培养基S中。
培养基配制;接种培养基(ms+)MS大量,微量,有机,2,4-D(2mg/L)Fe-EDTA,肌醇(0.1g/l),蔗糖30g/l, 脯氨酸2.8g/l, 水解酪蛋白0.3g/l, phytagel3g/l接种继代培养基(ms)MS大量,微量,有机,2,4-D(1mg/L)Fe-EDTA,肌醇(0.1g/l),蔗糖30g/l,Phytagel 3g/l共培养培养基(co,pH5.3)N6大量,B5微量,B5有机,2,4-D(1mg/L)Fe-EDTA,硝酸银1ml/l,肌醇(0.1g/l),蔗糖30g/l,葡萄糖10g/l,phytagel(3g/l),灭菌后加AS20mg/lNBL:就是co加上头孢500mg/l,不加AS选择培养基S500N6大量,B5微量,B5有机,2,4-D(1mg/L)Fe-EDTA,硝酸银1ml/l,肌醇(0.1g/l),蔗糖30g/l, 脯氨酸0.5g/l, 水解酪蛋白0.3g/l, phytagel3g/l灭菌后加头孢500mg/l,潮霉素50mg/l抗性愈伤继代培养基(S250)N6大量,B5微量,B5有机,2,4-D(1mg/L)Fe-EDTA,硝酸银1ml/l,肌醇(0.1g/l),蔗糖30g/l, 脯氨酸0.5g/l, 水解酪蛋白0.3g/l, phytagel3g/l灭菌后加头孢250mg/l,潮霉素50mg/l成熟培养基(m)N6大量,B5微量,B5有机,NAA1mg/l,Fe-EDTA,肌醇(0.1g/l),蔗糖30g/l, 脯氨酸0.5g/l, 水解酪蛋白0.3g/l, phytagel3g/l灭菌后加头孢250mg/l,潮霉素50mg/l,ABA3mg/l,BA2mg/l分化培养基(f)N6大量,B5微量,B5有机,NAA0.5mg/l, Fe-EDTA,肌醇(0.1g/l),蔗糖30g/l,水解酪蛋白0.3g/l, phytagel4.6g/l灭菌后加BA3mg/l壮苗培养基(1/2)MS大量,微量,有机,Fe-EDTA,肌醇(0.1g/l),蔗糖30g/l,Agar5.8g/l 注:2,4-D浓度为2mg/l,溶于0.1NNaOH或酒精硝酸银浓度为0.85mg/ml,避光保存。
水稻组培及农杆菌侵染的具体注意事项
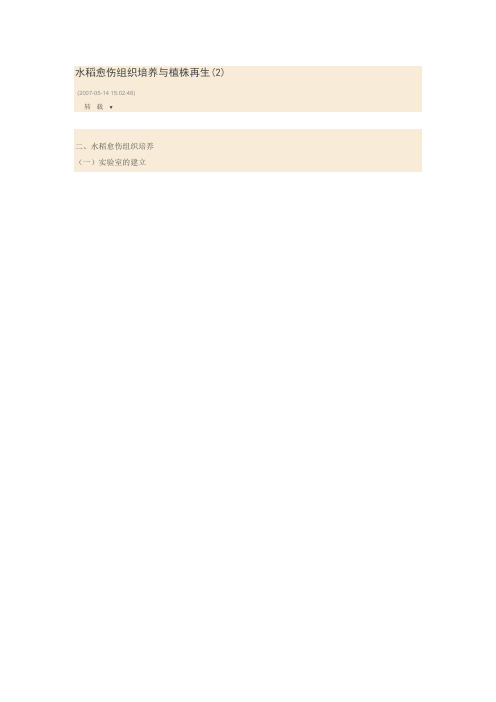
水稻愈伤组织培养与植株再生(2) (2007-05-14 15:02:48)转载▼二、水稻愈伤组织培养(一)实验室的建立组织培养的实验室建立可以按照以下的草图进行规划,图例可以按照表1:图2.植物生物技术实验室平面设计图4.水稻愈伤组织的分化挑选生长良好、结构致密的愈伤组织,先转到分化培养基上,26℃±2℃黑暗条件下培养2周。
然后转至26℃±2℃光照条件下培养,光强为400μmol/m2·s,每日光照16h,培养30~50 d,诱导不定芽,将产生绿芽的组织转至以1/2MS为基本培养基的无激素的壮苗培养基中,26℃±2℃光照条件下培养,使其生根长成完整植株[12]。
三、讨论水稻胚性愈伤的诱导是水稻遗传转化中的重要环节,胚性愈伤的状态直接影响着遗传转化频率,所以提高良好生长状态的胚性愈伤的数量是提高转化频率的关键[13]。
为了提高水稻愈伤的出苗率,有采用干燥处理,辐射处理,添加铜[14-15]、银元素,添加脯氨酸,添加MET(多效唑)和添加活性碳等方法。
[16]理论上愈伤组织是可以无限制继代,但愈伤组织继代次数增加,形态发生能力逐渐丧失。
原因是遗传因素即继代培养中通常出现染色体紊乱。
水稻成熟胚愈伤组织的诱导和再生是组织培养中的两个关键问题,它们涉及到外植体的脱分化过程和愈伤组织的再分化过程[17]。
影响水稻胚性愈伤组织形成和植株再生能力的因素包括基因型、外源激素、渗透压、外植体来源、固化剂、培养基其它成份以及温度、光周期和继代时间等多个方面,其中材料的基因型和外源激素的种类、浓度和配比是最主要的因素[18]。
植物生长调节物质在分化过程中的作用是极为明显的,合适的植物生长物质配比在器官分化中起着重要的作用。
光照是离体培养中比较复杂的调节因子,光照时间,强度以及光质对器官分化均有影响。
因为光照容易引起愈伤组织的老化坏死,所以对后续实验有很大的影响[19]。
认为除选择了合适的培养条件外,也与我们使用的是无菌苗作材料很有关系。
水稻转基因方法 自己

转基因步骤:2-3月完成水稻幼胚愈伤组织的培养1.去壳成熟的水稻种子经70%乙醇消毒5min。
2.倒去乙醇,再用2.5%次氯酸钠(每50mL加一滴吐温20)消毒15min,无菌水洗5次,再用2.5%次氯酸钠消毒15min,再用无菌水浸泡30min。
3.倒去次氯酸钠,将种子倒到无菌滤纸上吸干,再将种子放在N6D (0.6% Gelrite)培养基上29.5度光照培养30-60天(白天12h29.5度,晚上12h29.5度)。
注;培养基每2周换一次。
农杆菌的准备1.选择有活力的愈伤组织(相对干的、淡黄色的。
如图1)转到新的N6D培养基上,29.5度光照培养3天。
注: 褐色的愈伤千万不能选,不然会影响转化效率。
2.挑取含有目的基因的农杆菌单菌落或吸取所保存的农杆菌液100ul 于5ML YEP培养液中(50mg/l Kan+, 50mg/l(利福平) Str+),28度、250rp振荡培养12-36h至OD600饱和。
3.从上述菌液中吸取500ul于50mlYEP培养液中(50mg/l Kan+,50mg/l(利福平) Str+). 28度、250rp振荡培养12-36h至OD600=0.6-0.8。
注;农杆菌培养时要避光。
因为农杆菌对光敏感。
农杆菌本身对利福平有抗性,质粒对Kan+ 有抗性,所以能在YEP培养基中(50mg/l Kan+, 50mg/l(利福平) Str+)生长的菌斑基本上转进去质粒了,只需做下菌落PCR验证下。
农杆菌的侵染1.取15ml培养好的菌液,4度,4000rpm离心10min,去上清。
2. 挑取农杆菌放入30ml AAM感菌液中(10-20mg/l AS),轻轻混匀使OD600=0.05-0.1。
3.将愈伤放入无菌50ml离心管中。
(在准备一个滤膜)4.将步骤2中农杆菌液倒入步骤3中,侵染90s,其中不停要摇晃。
5.弃菌液,将愈伤组织取出置于无菌滤纸上沥干30-45min。
水稻转基因实验方法与步骤

水稻转基因实验操作方法步骤一、水稻愈伤组织的诱导(一)以水稻幼胚为试材诱导愈伤组织1.消毒:取水稻未成熟种子(灌浆期),按以下步骤消毒:1)用自来水冲洗种子,去掉浮起的瘪谷;2)将种子放入250ml无菌烧杯中(种子数量约占1/3体积),用200ml70%酒精消毒2分钟;(在操净工作台上进行无菌操作)3)加入250ml25%次氯酸钠(NaClO)溶液,同时加数滴吐温-20,浸泡90分钟;4)倒去NaClO溶液,用无菌蒸馏水清洗种子4-5遍。
2.诱导与继代培养:(以下步骤需无菌操作)1)用镊子夹住种子,在无菌滤纸上用钢钩挤出幼胚,置入诱导培养基中;2)操作完毕后封好培养皿(一般保鲜膜),在暗处适温下(25-28℃)培养5天;3)继代培养。
用镊子剥下胚性愈伤组织(去掉芽及膜状物),置入继代培养基中(凸起面向上),暗处适温下(25-28℃)培养3天。
(二)以水稻成熟胚为试材诱导愈伤组织1.消毒:取水稻成熟种子,人工或者机械脱壳,挑选饱满光洁无菌斑的种子,按以下步骤消毒:1)将适量种子放入10ml离心管中(100颗左右),倒入75%酒精消毒2分钟;2)倒去酒精,加入一定量的0.1%升汞溶液,浸泡10分钟;3)倒去次氯酸钠溶液,用无菌蒸馏水清洗种子5-6遍,最后一遍浸泡30分钟。
2.诱导与继代培养:(以下步骤需无菌操作)1)种子放在无菌滤纸上吸干,置入成就胚诱导培养基中,每皿12-14颗;2)操作完毕用封口膜(MicroporeTMSurgicalTape)封好培养皿,在28℃光照培养箱,暗培养培养3周;3)在超净工作台上打开培养皿,用镊子挑取自然分裂的胚性愈伤组织(淡黄色,致密呈球状,去除种子和芽),置入继代培养基中,在28℃光照培养箱,继代培养1周(2周愈伤组织更为松散)。
(如不马上用,需转移至暗处,于22℃继续培养1周)二、农杆菌培养挑取农杆菌单克隆或吸取所保藏的农杆菌菌液100国于4mlYEP(含50mg/lKan和50mg/lStr)培养液中,28℃,250rpm振荡培养20-36h至菌液OD600为0.8-1.0(颜色接近橙黄色)。
水稻转基因步骤

在植物转基因过程中,为了有效地识别和筛选转化子,常将目的基因和标记基因构建在同一表达载体中。
这种载体结构导致转基因植物中目的基因和标记基因始终共存,而标记基因(尤其是抗生素抗性基因)的存在可能给转基因植物的生物安全带来隐患。
目前已研发了多种方法剔除转基因植物中的标记基因,其中最常见的是共转化法(Komari 1996,McCormac 等2001)。
共转化系统是采用2个质粒或1个含有两套T—DNA表达盒的表达载体共同转化植物,其中一套表达盒含有抗性选择标记基因,另一套表达盒含有目的基因,它们转化植物时可能整合到植物基因组的不同位置。
转基因植株在减数分裂过程中,标记基因和目的基因发生分离,从而可在转基因后代中筛选到只含目的基因而不含选择标记基因的个体。
共转化从根本上排除了转基因植物中的选择标记,是保证人畜和环境安全的重要措施,因此受到了广泛的重视。
Zhou 等(2003)认为,用分别含一个T-DNA区的两个载体共转化的效率低于双T-DNA区表达载体的共转化效率。
目前关于利用双T-DNA区表达载体,获得无选择标记转基因阳性株系的研究已有不少报道(唐俐等2006,张秀春等2006,于恒秀等2005)。
花药培养与遗传转化技术相结合,可以快速获得纯合转基因植株(斯华敏等,1999,付亚萍等,2001),但是应用花药培养快速获得只含目的基因而无选择标记的转基因研究尚未见报告。
水稻是最主要的粮食作物,转基因水稻的安全显得尤为重要。
本实验室通过农杆菌介导的水稻转化体系,将包含人乳铁蛋白(hLF)、高赖氨酸(SB401)、高甲硫氨酸(RZ10)基因的表达载体p13HSR成功转化脆茎稻,由于该表达载体采用双T-DNA结构,将检测出含选择标记潮霉素磷酸转移酶基因(hpt)和目的基因的转基因阳性T0植株按单株直接进行花药培养。
在189株二倍体花培植株中检出23株有目的基因没有选择标记hpt的转基因纯合植株,得率为9.87%。
组织培养的操作规程(3篇)

第1篇一、准备阶段1. 查阅相关文献,根据已成功培养相近植物资料,结合实际制定切实可行的培养方案。
2. 根据实验方案配制适宜的消毒剂及同培养阶段所需培养基,并经高压灭菌或滤除菌备用。
二、外植体选择与消毒1. 选择合适部位作外植体,如茎尖、叶片、花药等。
2. 对外植体进行预处理,如切割、剥离等。
3. 将外植体用75%乙醇消毒1分钟,再用0.1%升汞消毒5-6分钟,最后用无菌水冲洗3-5次。
三、初代培养1. 将消毒后的外植体接种到初代培养基上。
2. 将接种好的培养基置于培养室或光照培养箱中,温度控制在25-28℃,光照时间12-16小时。
3. 观察外植体生长情况,如脱分化、愈伤组织形成、芽萌发等。
四、继代培养1. 当外植体形成愈伤组织或芽时,将其切割成小块,接种到继代培养基上。
2. 继代培养基的激素配比可根据实际情况进行调整,如增加细胞分裂素或生长素浓度。
3. 继代培养条件同初代培养。
五、根培养1. 当芽长到一定长度时,将其转移到生根培养基上。
2. 生根培养基的激素配比应适当降低细胞分裂素浓度,提高生长素浓度。
3. 生根培养条件同初代培养。
六、炼苗移栽1. 选择健壮的根苗进行室外炼苗。
2. 炼苗期间注意保温、保湿、遮荫,防止病虫害。
3. 待苗适应外部环境后,移栽到疏松透气的基质中。
4. 移栽后加强管理,如浇水、施肥、防治病虫害等。
七、注意事项1. 培养基的配制和灭菌要严格按照操作规程进行。
2. 消毒剂的使用要适量,避免对外植体造成伤害。
3. 培养环境要适宜,温度、光照、湿度等条件要稳定。
4. 观察外植体生长情况,及时调整培养方案。
5. 操作过程中要穿戴无菌手套,避免污染。
通过以上操作规程,您可以根据实验需求进行组织培养。
在实际操作过程中,请根据具体情况调整方案,以确保实验成功。
第2篇一、准备阶段1. 查阅相关文献,了解植物组织培养的基本原理和操作流程。
2. 根据已成功培养相近植物资料,结合实际情况,制定切实可行的培养方案。
水稻的植物组培的Microsoft Word 文档

水稻的植物组培的Microsoft Word 文档水稻的植物组培的microsoftword文档水稻的组织培养姓名:侯小龙班级:生物09104学号4教练:习在星水稻的植物组培实验报告班级:盛科09104学号:4姓名:侯小龙实验目的:1.让学生了解植物组织培养中常用的清洗技术和灭菌方法;掌握常用器具(如玻璃器皿、剪刀、镊子等)的清洗工艺、灭菌方法及注意事项,为后续实验做好准备。
2.学习培养基配制与灭菌方法。
3.学习和掌握植物外植体表面消毒的常规方法。
4.学习诱导植物器官外植体形成愈伤组织的方法5.了解愈伤组织继代培养的基本原理,学习愈伤组织继代培养的方法。
6.了解愈伤组织再分化原理,学习愈伤组织生根培养的方法。
实验原理:离体的植物细胞具有其个体的全套的遗传物质,在一定的条件下可以再次脱分化,再分形成心的植株的能力,这就是植物细胞的全能性。
因此只要给定水稻种子适宜的条件,我们可以诱导其胚状体再次分化,形成愈伤组织,一团无色的包庇细胞。
这种细胞分裂的能力旺盛,再把这写愈伤组织扩大培养,经原代培元,继代培养,生根培养,最后可以形成一个完整实验器材:材料:高压蒸汽灭菌器、超净工作台、电子天平、冰箱、pH试纸、烧杯、量筒、试剂瓶、三角瓶、耳球秤、移液管、洗瓶台秤(灵敏度0.2~0.5g)实验所需的各种玻璃器皿、金属制品和塑料制品,烧杯(300ml,500ml),量筒(500ml,50ml),三角瓶(50ml)移液管玻璃漏斗玻璃棒玻璃笔pH值试纸洗涤耳球线包装纸石棉网洗涤瓶无菌纸一次性手套酒精灯标签纸记号笔超净工作台烧杯镊子剪刀手术刀试剂:MS中大元素母液微量元素母液铁盐母液维生素(有机元素)母液蔗糖琼脂2-4,DnaA甘露醇koh6 Ba酒精漂白剂实验内容:1.MS培养基的制备2.水稻种子的消毒与原代培养3.水稻种子的继代培养4.水稻的生根培养实验步骤:1.MS培养基的制备本次试验每2人一组,每3组一大组,每大组配制1000mlms培养基。
水稻转基因技术

1.报告基因的酶法检测,常用的报告基因有:gus、nos、ocs等。
当然最后转基因植株必须移栽于大田,进行田间鉴定,不仅对改 良性状还要对其它农艺性状进行评价,选育综合性状优良的株系。
11
三、存在的问题
外源基因的稳定遗传、高效表达及目的基因的沉默。 转基因水稻的安全性问题。 水稻育种转入的基因多数为抗病虫基因,这类基因 产生的毒蛋白等物质,随着人们长期食用,是否会有 累积效应?
水稻转基因技术
第二组
1
目录
1 2
水稻装基因技术
外源基因鉴定
存在的问题与展望
3
7
黄金大米:
又名“金色大米”,是一 种 转基因大米,由美国先正达 公司研发。其不同于正常大米 的主要功能为帮助人体增加维 生素A吸收。因为色泽发黄, 该大米品种被称为“黄金大 米”。
左为普通大米,右为黄金大米
3
水 稻 转 基 因 技 术
12
基因枪法
农杆菌介导发
PEC介导转化法
其他方法
花粉管通道发 电击法
4
一、水稻转基因技术
基因枪法:
定义:又称微弹轰击法,是利用基因枪,将载有目的
基因的金属颗粒加速,高速射入受体作物细胞,并随机 整合到受体细胞的基因组上,然后通过细胞和组织培养 技术,再生出新的植株。
原理:是将外源DNA包在微小的金粒或钨粒表面,再 通过高压将微粒高速地射入受体细胞或组织。
7
PEC介导转化法:
原理:是利用化合物聚乙二醇(PEG)及高pH条件诱 导原生质体体外摄取外源DNA。 特点:原生质体作为受体具有群体数大,便于操作,DNA 分子易于进入,获得纯合性的转化子等优点,但原生质体培 养难度大、再生频率低、周期长、不适合水稻转化研究。
水稻转基因实验操作[2]
![水稻转基因实验操作[2]](https://img.taocdn.com/s3/m/ee8ee83143323968011c927c.png)
水稻转基因实验操作(谢越、赵建宁、艾鹏慧、孙淑斌整理)(2006.7)一、水稻(日本晴)愈伤组织的诱导(以水稻成熟胚为试材诱导愈伤组织)1.消毒:取水稻成熟种子,人工或者机械脱壳,挑选饱满光洁无菌斑的种子,按以下步骤消毒:1)将种子放入100ml无菌烧杯中,倒入70%酒精消毒1分钟;2)倒去酒精,加入100ml 30%次氯酸钠(NaClO)溶液(5.2%次氯酸钠),浸泡30分钟;3) 倒去次氯酸钠溶液,用无菌蒸馏水清洗种子4-5遍,最后一遍浸泡30分钟。
2.诱导与继代培养:(以下步骤需无菌操作)1)种子放在无菌滤纸上吸干,置成熟胚于诱导培养基中,每皿12-14颗;2)操作完毕用封口膜(Micropore TM Surgical Tape)封好培养皿,在30℃光照培养箱,培养4周;3)在超净工作台上打开培养皿,用镊子挑取自然散落的胚性愈伤组织(淡黄色,致密呈球状),在30℃光照培养箱,继代培养1-2周。
(没有脱落的可在原培养基上继续培养7天,次数多了效果会减弱)二、农杆菌(工程菌)培养挑取农杆菌单克隆或吸取所保藏的农杆菌(EHA105)菌液100µl于4ml YEP(含50mg/LSpec和50mg/L Str)培养液中,28℃,250rpm振荡培养20-36h至菌液OD600为0.8-1.0。
三、感菌与共培养1)取培养好的工程菌液1ml于1.5ml离心管中,4℃,5000rmp,离心1min,去上清。
用含200µmol/LAs的30ml AAM感菌液制成悬浮液。
2)将长到一定大小的水稻愈伤组织挑出,放入农杆菌悬浮液侵染5分钟(愈伤量没过50ml离心管锥形部位即可)。
3)将愈伤组织取出,置于无菌的滤纸上沥干30-40分钟;4)将愈伤组织置于共培养基上(共培养基上面垫上一层9cm无菌滤纸)。
28℃(组培室)暗培养2.5天。
四、愈伤组织的抗生素筛选将愈伤组织取出,用无菌水清洗6次,其间需不停的振荡(组培室震荡机最大速率)。
水稻组织培养

[3]倪晋山,1985. 植物生理学实验手册(薛应龙主编),上海科 学技术出版社,63-64
水稻组织培养
实验原理
植物组织培养主要利用了植物细胞的全能性,细胞全能性 (toti potency)就是指每个生活的细胞中都包含有产生一个 完整机体的全套基因,在适宜的条件下,细胞具有形成一 个新的个体的潜在能力。
材料
选取水稻种子( 干种子或是湿种子均可)作为植物组织培养 的外植体
仪器
电子天平、酸度计、微量移液器、电炉、培养瓶、培养皿、烧杯、量 筒、移液管、容量瓶、玻璃棒、试剂瓶、超净工作台、剪刀、镊子、 照度计、摇床、灭菌锅
水稻种子做组织培养的优点
操作简单,节省时间
水稻外植体小,进行表面消毒后不易染菌,愈伤组织诱导率较高
水稻种子保存容易且存活时间更长,可以随时取材实验
参考文献
[1]盛玉婷. 2008. 植物组织培养技术及应用进展( 安徽农学通报, 14 (9) :45~47 [2]张志良,翟伟菁. 2003. 植物生理学实验指导( 北京: 高等教育出 版社,326~327
实验结果
根据上述培养基配方所建立起来的水稻植株再生体系,愈伤组织诱导 率)芽分化率及生根率均较高。水稻种子在诱导培养中培养10天左右, 从水稻芽的基部长出淡黄色)呈细小颗粒状的愈伤组织( 图 A)
(水稻种子在诱导培养中所得到的愈伤组织)
将愈伤组织转入分化芽的培养基后约7天,开始出现绿点并逐渐增多 ( 图 B)
(绿色幼苗在分化根的培养基中生出的根)
当水稻组培苗长高至 3~5cm时,即可进行炼苗,将三角瓶 口打开放置室温下,一定避免强光直射,炼苗 3 天左右即 可进行移栽( 图 F)
(炼苗及移栽成活的水稻再生植株)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
农杆菌介导的转化一.试剂1 6-BA (6-BenzylaminoPurine) Sigma Cat No. B-58982 KT (Kinetin) Sigma Cat No. K-07533 NAA (Napthalene acetic acid) Sigma Cat N-06404 IAA (Indole-3-acetic acid) Sigma Cat No. I-51485 2,4-D (2,4-Dichlorophenoxyacetic acid) Sigma Cat No. D-84076 Kanamycin USB Cat No. 179247 CH (Casein Enzymatic Hydrolysate) Sigma Cat No. C-72908 Hn (hygromycin B) GiBco BRL Cat No. 10687-0109 Cn (Carbenicillin) 国产分装10 Nicotinic acid Sigma Cat No. N-076511 Pyridoxine HCl Sigma Cat No. P-866612 Thiamine HCl Sigma Cat No. T-390213 Inositol Sigma Cat No. I-301114 Phytagel Sigma Cat No. P-816915 Dimethyl Sulfoxide-DMSO Sigma Cat No. D-587916 X-gluc (5-bromo-4-chloro-3-indolyl-D-galactoside) Sigma Cat No. B-378317 AS (Acetosringone) Aldrich chem., CO 01531 EG二.溶液1.MS maxNH4NO316.5gKNO319.0gKH2PO4 1.7gMgSO4∙7H2O 3.7gCaCl2∙2H2O 4.4g 或CaCl2 3.32g逐一溶解药品后,加dH2O定容到1000ml。
2.MS min母液(100×)KI 0.083gH3BO30.62gMnSO4∙4H2O 2.23g 或MnSO4∙ H2O 1.69gZnSO4∙7H2O 0.86gNa2MoO4∙ 2H2O 0.025gCuSO4∙ 5H2O 0.0025gCoCl2∙ 6H2O 0.0025g注意:Na2MoO4必须单独溶解后再与其它组分混合。
加dH2O定容到1000ml室温保存。
3.N6max母液(10×)KNO328.3gKH2PO4 4.0g(NH4)2SO4 4.63gMgSO4∙ 7H2O 1.85gCaCl2∙ 2H2O 1.66g 或CaCl2 1.25g逐一溶解药品后,加dH2O定容到1000ml。
4.N6 min母液(100×)KI 0.08gH3BO30.16gMnSO4∙ 4H2O 0.44g 或MnSO4 ∙ H2O 0.3335gZnSO4∙ 7H2O 0.15g加dH2O定容到1000ml室温保存。
5.Fe2+-EDTA(100×)取一个烧杯加300ml dH2O以及FeSO4∙ 7H2O 2.78g;在另一个烧杯中也加300ml dH2O加热到70℃后加入Na2 EDTA ∙ 2H2O 3.73g;待到两种药品都溶解了,混合,70℃保温2hr,然后加dH2O定容到1L,4℃保存。
6.维生素(100×)Nicotinic acid 0.1gPyridoxine HCl (VB6) 0.1gThiamine HCl (VB1) 0.1gGlycine 0.2gInositol 10g加dH2O定容到1000ml 4℃保存。
7.AA max母液(10×)KCl 29.50gNaH2PO4 1.50g 或NaH2PO4 ∙ 2H2O 1.95gMgSO4· 7H2O 2.50gCaCl2∙ 2H2O 1.50g 或CaCl2 1.13g加dH2O定容到1000ml室温保存。
8.AA min母液(1000×)MnSO4∙ H2O 1.0gH3BO30.3gZnSO4∙ 7H2O 0.2gKI 0.075gNaMoO4∙ 2H2O 0.025gCuSO4∙ 5H2O 0.0025gCoCl2∙ 6H2O 0.0025gNa2MoO4必须单独溶解后再与其它组分混合,加dH2O定容到1000ml室温保存。
9.2,4-D母液(1mg/ml)2,4-D 100 mg先加1.0 ml 1N KOH 摇5min,然后加10ml H2O 继续摇直到2,4-D溶解,加水定容到100 ml室温保存。
10.6-BA母液(1mg/ml)6-BA 100mg加1.0 ml 1N KOH摇直到6-BA溶解,加水定容到100 ml室温保存。
11.N AA母液(1mg/ml)NAA 100mg加1.0ml 1N KOH 并搅动直到NAA溶解,加水定容到100 ml室温保存。
12.I AA母液(1mg/ml)IAA 100mg加1.0 ml 1N KOH摇直到IAA溶解,加水定容到100 ml室温保存。
13.100mM AS母液(1mg/ml)AS 0.196gDMSO 10ml分装到1.5 ml离心管4℃保存。
14.1N KOH母液(1mg/ml)KOH 5.6g用100ml H2O溶解后室温保存。
15.羧苄青霉素2钠(CN) (200mg/ml)CN干粉1g用5ml灭菌dH2O溶解后,分装到1.5ml Tub中(无菌操作)。
或者用5ml 75%酒精溶解,分装到1.5ml Tub中(无菌操作)。
16.A stock solution (继代A):硝酸铵16.5g硝酸钾19.0g磷酸二氢钾 1.7g七水硫酸镁 3.5g二水氯化钙4g/无水氯化钙3g加水依次溶解,定容1000ml,室温保存17.B stock solution (继代B):四水硫酸锰 5.0g硼酸 1.5g七水硫酸锌 2.0g碘化钾0.75g (未完)二水钼酸钠0.25g五水硫酸铜0.0389g六水氯化钴0.025g加水依次溶解,定容1000ml,室温保存(二水钼酸钠单独称,单独溶,缓慢加入,边加边搅)三.农杆菌介导的水稻愈伤的遗传转化过程1 愈伤诱导1)成熟种子脱壳后70%酒精灭菌1min,0.15% HgCl2处理15min;2)灭菌单蒸水洗5-7次;3)将种子接种到诱导培养基上,每瓶接6-8粒;4)置黑暗中26±1℃处理约4-7周。
2 愈伤继代挑取浅黄、致密且相对较干的胚性愈伤接种到继代培养基上26±1℃处理2周,不可接太多。
3 预培养挑取致密且相对较干的胚性愈伤接种到预培养基上置黑暗中3至4天。
4 农杆菌准备准备浸染的农杆菌扩大培养。
在相应抗性平皿中涂菌,28度培养箱中培养2-3天5 农杆菌悬浮培养准备将农杆菌转移(粳稻:用接种环刮入半环-1环菌,籼稻:3环-4环菌)到100ml悬浮培养基中28℃摇瓶培养30-60min。
6 农杆菌侵染(共培养)1)经过预培养的愈伤转移到一个灭菌的三角瓶中;2)调整农杆菌悬浮液的OD600值到0.8-1.0之间;3)用农杆菌悬浮液浸泡愈伤20-30min;4)倒去菌液,将三角瓶倒立于含滤纸的灭菌小皿中约15min;5)愈伤放在灭菌的滤纸上晾干后,转移到共培养培养基上去。
培养物19-20℃黑暗处理2天。
7 水洗和筛选1)经过共培养的愈伤转移到一个灭菌的三角瓶中;2)用灭菌单蒸水洗5至7次愈伤;3)用含有400ppm Cn(羧苄青霉素二钠)的灭菌水浸泡愈伤30min(封好口后,可于28度,180至200RPM摇20-30min);4)倒去含抗生素的灭菌水,将三角瓶倒立于含滤纸的灭菌小皿中约15min;5)在灭菌的滤纸上晾干愈伤;6)转移愈伤到相应抗性的筛选培养基筛选2-3个循环(每个循环约2周)8 预分化与分化1)经过筛选得到的抗性愈伤转到带抗性的预分化培养基的培养皿中,黑暗处理5-7天;2)经过预分化的愈伤转移到100ml三角瓶里的分化培养基中,每瓶3粒愈伤,只选亮黄色的抗性愈伤,不必接入太多。
;3)26℃光照处理,约需40-60天。
9 生根1)从分化瓶中挑出要做生根的苗子,同一块愈伤所得的苗子只选一棵;2)剪掉所有原有的根,注意不要剪掉分生组织;3)将苗子转入生根培养基,28℃光照处理7至10天。
10 移栽移去生根管的封口膜,倒入约1cm深的自来水,在光照培养室炼苗3-4天,移栽至准备好的栽种处。
四.培养基注意:所有的培养基必须现配现用。
(一)粳稻的转化1.诱导培养基(用于粳稻)N6max母液(10×) 100mlN6min母液(100×) 10mlFe2-EDTA母液(100×) 10mlVitamin母液(100×) 10ml2,4-D母液 2.5ml脯氨酸0.3g水解酪蛋白0.6g蔗糖30gPhytagel 3g加H2O 600-700ml并用KOH调节pH到5.9,煮沸后加H2O定容到1000ml,分装到50ml三角瓶中(25ml/瓶),封口膜封口灭菌。
2.继代培养基(用于粳稻)N6max母液(10×) 100mlN6min母液(100×) 10mlFe2-EDTA母液(100×) 10mlVitamin母液(100×) 10ml2,4-D母液 2.0ml脯氨酸0.5g水解酪蛋白0.6g蔗糖30gPhytagel 3g加H2O 900ml并用1N KOH调节pH到5.9,煮开后加H2O定容到1000ml,分装到50ml三角瓶中(25ml/瓶),封口膜封口灭菌。
3.预培养培养基(用于粳稻)N6max母液(10×) 12.5mlN6min母液(100×) 1.25mlFe2-EDTA母液(100×) 2.5mlVitamin母液(100×) 2.5ml2,4-D母液0.75ml水解酪蛋白0.15g蔗糖5g琼脂粉 1.75g加H2O 250ml并用1N KOH调节pH到5.6,封口膜封口灭菌。
使用前,煮溶培养基,加入5ml葡萄糖母液(灭菌的50%葡萄糖溶液)和250μl AS 母液,然后分装到培养皿中(25ml/皿)。
4.共培养培养基(用于粳稻)N6max母液(10×) 12.5mlN6min母液(100×) 1.25mlFe2-EDTA母液(100×) 2.5mlVitamin母液(100×) 2.5ml2,4-D母液0.75ml水解酪蛋白0.2g蔗糖5g琼脂粉 1.75g加H2O 250ml并调节pH到5.6,封口膜封口灭菌。
