氨气化学课件
合集下载
高一化学《氨气》(课件)
(2)写出氨气分别与硫酸和硝酸反应的化学方 程式。
湖南长郡卫星远程学校
制作 03
2013年上学期
2、氨气与氯化氢的反应
思考: (1)为什么蘸有浓氨水的玻璃棒 和蘸有浓盐酸的玻璃棒不接触 就能反应,并放出白烟? NH3+HCl=NH4Cl
(2)写出氨气分别与硫酸和硝酸反应的化学方 程式。
2NH3+H2SO4=(NH4)2SO4 NH3+HNO3=NH4NO3
2013年上学期
氨气的喷泉实验注意的问题
(1)氨为什么会形成喷泉?
(2)溶液为什么变为红色? (3)实验成败的关键是什么?
湖南长郡卫星远程学校
制作 03
2013年上学期
氨气的喷泉实验注意的问题
(1)氨为什么会形成喷泉? 氨极易溶于水,使烧瓶内外 形成较大的压差
(2)溶液为什么变为红色?
(3)实验成败的关键是什么?
NH3说:原来 是这样啊!
湖南长郡卫星远程学校
制作 03
2013年上学期
一、氨气的物理性质
1.无色 、 有特殊刺激性气味的气体
NH3说:原来 是这样啊!
2.极易溶于水 常温常压下,1V水约能溶解 700V氨气
3.极易液化,液氨汽化时要吸收大量热
湖南长郡卫星远程学校
制作 03
2013年上学期
一、氨气的物理性质
2013年上学期
演 示 实 验 ——氨气的喷泉实验
步骤: 1.在干燥的烧瓶内充满氨气 2.塞上带有玻璃管和胶头滴管 (预先吸入少量水)的胶塞。 3.打开橡皮管上的止水夹,挤 压胶头滴管,观察现象。
湖南长郡卫星远程学校
制作 03
2013年上学期
演 示 实 验 ——氨气的喷泉实验
湖南长郡卫星远程学校
制作 03
2013年上学期
2、氨气与氯化氢的反应
思考: (1)为什么蘸有浓氨水的玻璃棒 和蘸有浓盐酸的玻璃棒不接触 就能反应,并放出白烟? NH3+HCl=NH4Cl
(2)写出氨气分别与硫酸和硝酸反应的化学方 程式。
2NH3+H2SO4=(NH4)2SO4 NH3+HNO3=NH4NO3
2013年上学期
氨气的喷泉实验注意的问题
(1)氨为什么会形成喷泉?
(2)溶液为什么变为红色? (3)实验成败的关键是什么?
湖南长郡卫星远程学校
制作 03
2013年上学期
氨气的喷泉实验注意的问题
(1)氨为什么会形成喷泉? 氨极易溶于水,使烧瓶内外 形成较大的压差
(2)溶液为什么变为红色?
(3)实验成败的关键是什么?
NH3说:原来 是这样啊!
湖南长郡卫星远程学校
制作 03
2013年上学期
一、氨气的物理性质
1.无色 、 有特殊刺激性气味的气体
NH3说:原来 是这样啊!
2.极易溶于水 常温常压下,1V水约能溶解 700V氨气
3.极易液化,液氨汽化时要吸收大量热
湖南长郡卫星远程学校
制作 03
2013年上学期
一、氨气的物理性质
2013年上学期
演 示 实 验 ——氨气的喷泉实验
步骤: 1.在干燥的烧瓶内充满氨气 2.塞上带有玻璃管和胶头滴管 (预先吸入少量水)的胶塞。 3.打开橡皮管上的止水夹,挤 压胶头滴管,观察现象。
湖南长郡卫星远程学校
制作 03
2013年上学期
演 示 实 验 ——氨气的喷泉实验
高一化学氨气课件

四
通过在我家厨房的窗户可以看到神农药店的后窗总有人起大早排队买口罩,药店每天8.30分出售,6-7点就有人排队,早晨的天气很冷的,排队的人也是无奈呀。看到总有很多人买不到口罩,悻悻地 走了。什么时候可以随意就能买到且价格合理的口罩呢?或者只能等不用带口罩,不然永远事情,湖北省洪湖市一个药店0.60元/只价格进的口罩,以1.00元/只出售。被市场管理局没收违法所得14210元,罚款42630元。该市作为政绩公之于众,天下一片 哗然。虽然定价超出15%的定价标准,但如此执法确有机械执法之嫌。
后来又看到铁东、铁西区有饭店因为私自留客人就餐被巨额罚款或者查扣营业执照。政府三令五申还敢踩红线,真是自找没趣。
我妻子到我家小区门口的超市买菜,录了一个市场管理局检查菜价上涨的视频。视频里有人举报超市卖的大白菜5元一斤,涉嫌哄抬物价,视频里一颗大白菜价签上标明5元/500克,铁证如山。我说 这个超市一定被罚款。果然第二天通报登了出来,被罚款10万元。昨天我出去走走,想到这家超市买点东西,结果正在撤货搬家。没问什么原因,我猜一定是赔了。这个开了不到一年的超市,累死一年 也挣不到10万元。据了解这个超市一共就剩几颗大白菜,老板鬼迷心窍想多挣一点,这是犯傻呀,愚蠢至极。几个大白菜再多挣能多挣多少呢?如按原价出售,小区的居民一定心存感激的。那样客人就 会多一些,收入自然就会多起来。mg免费游戏试玩平台
通过在我家厨房的窗户可以看到神农药店的后窗总有人起大早排队买口罩,药店每天8.30分出售,6-7点就有人排队,早晨的天气很冷的,排队的人也是无奈呀。看到总有很多人买不到口罩,悻悻地 走了。什么时候可以随意就能买到且价格合理的口罩呢?或者只能等不用带口罩,不然永远事情,湖北省洪湖市一个药店0.60元/只价格进的口罩,以1.00元/只出售。被市场管理局没收违法所得14210元,罚款42630元。该市作为政绩公之于众,天下一片 哗然。虽然定价超出15%的定价标准,但如此执法确有机械执法之嫌。
后来又看到铁东、铁西区有饭店因为私自留客人就餐被巨额罚款或者查扣营业执照。政府三令五申还敢踩红线,真是自找没趣。
我妻子到我家小区门口的超市买菜,录了一个市场管理局检查菜价上涨的视频。视频里有人举报超市卖的大白菜5元一斤,涉嫌哄抬物价,视频里一颗大白菜价签上标明5元/500克,铁证如山。我说 这个超市一定被罚款。果然第二天通报登了出来,被罚款10万元。昨天我出去走走,想到这家超市买点东西,结果正在撤货搬家。没问什么原因,我猜一定是赔了。这个开了不到一年的超市,累死一年 也挣不到10万元。据了解这个超市一共就剩几颗大白菜,老板鬼迷心窍想多挣一点,这是犯傻呀,愚蠢至极。几个大白菜再多挣能多挣多少呢?如按原价出售,小区的居民一定心存感激的。那样客人就 会多一些,收入自然就会多起来。mg免费游戏试玩平台
高一化学氨气课件

思考
这个实验的现象为什么会发生?
这个实验说明氨气和氯化氢各具有什么性质?
上实验说明了NH3与HCl相遇会发生剧烈的反应, 生成一种固态的物质——铵盐,形成“发烟”的现象。 因为氯化氢具有酸性,也说明了NH3具有碱性。
三.NH3的化学性质
(1) NH3与水反应 NH3 + H2O NH3· H2 O NH4+ + OH-
氨水中的分子#43; 和 OH所以:氨水是混合物。
液氨是氨气加压或降温后形成的液态物质,液氨所含的 微粒是NH3。 所以:液氨是纯净物。
氨 气 与 盐 酸 反 应
在教学中,将有实物进行演示。
氨 气 与 盐 酸 反 应
在教学中,将有实物进行演示。
二.NH3的物理性质
颜色、状态、气味:无色、有刺激性气味的气体 密 度: 比空气轻
水溶性:极易溶于水
氨 的 喷 泉 实 验
在教学中,将有实物进行演示。
思考
氨溶解于水仅是简单的溶解过程吗? 喷泉实验呈现红色说明了什么?
(1)氨极易溶解于水,当烧瓶内挤入少量的水时就溶解了 大量的氨气,使烧瓶内压强迅速减,大气压将酚酞溶液 压入烧瓶,形成美丽的喷泉。
小结
一.NH3的分子结构 二.NH3的物理性质
颜色、状态、气味:无色、有刺激性气味的气体 三.NH3的化学性质 (1)比空气轻 NH3与水反应 密 度: + + OHNH + H O NH · H O NH (2) NH 与酸反应 3 23 3 2 4 水溶性: (3)极易溶于水 NH3与氧气反应 NH3 + HCl = NH4Cl
2.物质的量相等的下列气体,常温在密闭容器中 混合,完全反应,容器压强降低最大的是( B ) A、NH3和O2 B、NO和O2 C、H2和O2 D、H2和N2
氨教学ppt课件

反应的化学方程式
例如,NH3 + HCl → NH4Cl。
反应条件
常温常压下即可进行,通常在实验室内进行。
氨与氧化剂的反应
氨与氧气反应生成氮气和水
在高温或催化剂的作用下,氨与氧气反应,生成氮气和水。这是 一个重要的工业制氮的方法。
反应的化学方程式
例如,4NH3 + 3O2 → 2N2 + 6H2O。
氨的存在与用途
氨广泛存在于自然界中,是大 气的主要成分之一,约占大气 总量的1%。
氨主要用于制造氮肥、合成纤 维、合成橡胶等,也用于化工 、制药、制冷剂等领域。
在农业生产中,氨是植物生长 所需要的重要元素之一,也是 制造氨基酸的重要原料。
02 氨的生产与合成
氨的生产方法
天然气合成氨
利用天然气作为原料, 通过高温高压下的催化
氨教学ppt课件
• 氨的简介 • 氨的生产与合成 • 氨的化学反应与用途 • 氨的环境影响与安全 • 实验与探究
01 氨的简介
氨的物理性质
氨是一种无色、有刺激性气味的 气体,沸点为-33.5℃,熔点为-
77.7℃。
氨的相对密度小于空气,极易溶 于水,溶解时放出大量的热。
氨气在标准状况下的气体摩尔体 积为22.4L/mol,1mol氨气约
氨对水体的影响
氨进入水体后,会影响水 生生物的生存,导致水体 富营养化。
氨对土壤的影响
过量的氨会影响土壤的酸 碱性和土壤微生物的活性 ,进而影响农作物的生长 。
氨的安全使用与防护
佩戴防护用品
在使用氨的过程中,应佩 戴防毒面具、化学防护眼 镜、化学防护手套等防护 用品。
保持通风
在使用氨的环境中,应保 持良好的通风,以降低空 气中氨的浓度。
例如,NH3 + HCl → NH4Cl。
反应条件
常温常压下即可进行,通常在实验室内进行。
氨与氧化剂的反应
氨与氧气反应生成氮气和水
在高温或催化剂的作用下,氨与氧气反应,生成氮气和水。这是 一个重要的工业制氮的方法。
反应的化学方程式
例如,4NH3 + 3O2 → 2N2 + 6H2O。
氨的存在与用途
氨广泛存在于自然界中,是大 气的主要成分之一,约占大气 总量的1%。
氨主要用于制造氮肥、合成纤 维、合成橡胶等,也用于化工 、制药、制冷剂等领域。
在农业生产中,氨是植物生长 所需要的重要元素之一,也是 制造氨基酸的重要原料。
02 氨的生产与合成
氨的生产方法
天然气合成氨
利用天然气作为原料, 通过高温高压下的催化
氨教学ppt课件
• 氨的简介 • 氨的生产与合成 • 氨的化学反应与用途 • 氨的环境影响与安全 • 实验与探究
01 氨的简介
氨的物理性质
氨是一种无色、有刺激性气味的 气体,沸点为-33.5℃,熔点为-
77.7℃。
氨的相对密度小于空气,极易溶 于水,溶解时放出大量的热。
氨气在标准状况下的气体摩尔体 积为22.4L/mol,1mol氨气约
氨对水体的影响
氨进入水体后,会影响水 生生物的生存,导致水体 富营养化。
氨对土壤的影响
过量的氨会影响土壤的酸 碱性和土壤微生物的活性 ,进而影响农作物的生长 。
氨的安全使用与防护
佩戴防护用品
在使用氨的过程中,应佩 戴防毒面具、化学防护眼 镜、化学防护手套等防护 用品。
保持通风
在使用氨的环境中,应保 持良好的通风,以降低空 气中氨的浓度。
《高一氨气及铵盐》课件

化肥中的应用
铵盐是主要的氮肥成分,被广泛 用于农业。
医药中的应用
铵盐在医药领域中用于制造药品 和药物配方。
食品中的应用
某些铵盐可用作食品添加剂,提 供增加口感和防腐的功能。
氨气及铵盐的安全性
氨气及铵盐的毒性
氨气具有高毒性,铵盐的毒性因类型不同而异。
氨气及铵盐的防护措施
在处理氨气和铵盐时需采取适当的防护措施,如佩 戴防护装备。
《高一氨气及铵盐》PPT 课件
# 高一氨气及铵盐 PPT课件 本PPT课件主要介绍氨气及铵盐的基本概念、性质和作用。
氨气的基本概念
1 化学式
氨气的化学式是NH3。
2 物理性质
氨气是无色气体,有强烈 的刺激性气味。
3 化学性质
氨气是一种碱性物质,可 与酸反应生成盐类。
氨气的应用
合成氨的应用
合成氨被广泛用于制造化肥、 塑料和药品。
总结
1 氨气及铵盐的基本概 2 氨气及铵盐的应用
念
掌握氨气和铵盐在不同领
了解氨气和铵盐的化学式、
域中的应用。物理性质和Fra bibliotek学性质。3 氨气及铵盐的安全性
了解处理氨气和铵盐时应 注意的安全事项。
氨水的应用
氨水常用于清洁剂和药品制造 中。
氨气在生产和科研中 的应用
氨气在金属加工、电子制造和 实验室研究中有重要应用。
铵盐的基本概念
化学式
铵盐是由铵离子(NH4+)和 阴离子组成的化合物。
物理性质
铵盐通常是结晶固体,有各 种各样的颜色和形态。
化学性质
铵盐可以与酸反应生成氨气 和盐类。
铵盐的应用
《高一化学氨气》课件

1
汞法制取
利用氮化汞来吸收氨气,然后再加热分解氮化汞,可以制取高纯度的氨气。
2
卤化铵法制取
卤化铵加热分解可以得到氨气,这是一种常用的制备方法。
3
贵金属催化还原法制取
利用贵金属如镍、铂等作为催化剂还原氮气得到氨气,这是现代工业生产中使用 的主要方法之一。
氨气的应用
化肥生产
氨气是制造含氮化合物的重 要原料,如尿素、硝酸、铵 盐等。
3 存在形式
氨气是一种重要的氮化物, 天然氨主要存在于肥料和 动物废物中。
氨气的性质
毒性
氨气呈刺激性气味,对人体的 呼吸系统、眼睛等具有很强的 刺激作用。
毒性浓度
氨气对人体的毒性与浓度有关, 50-100ppm为危险浓度。
易燃性
氨气是一种不易燃的气体,但 可以与氧或氯气等反应,产生 爆炸危险。
氨气的制取
高一化学氨气
本课件介绍氨气的性质、应用、危害以及制取方法等方面的内容,让大家了 解氨气在我们日常生活和工业生产中的作用和意义。
什么是氨气?
1 定义
氨气是一种无色、有刺激 性气味的气体,它容易溶 解在水中,可以形成强烈 的碱性溶液。
2 发现历史
1774年,英国化学家普里 斯特利从尿液中发现了氨 气。
对健康的危害
长期暴露于高浓度氨气中会对人 体健康产生严重的影响,对呼吸 系统等使用氨气时需要戴口罩、手套等保护用具,随时检查设备的正常运转和安全阀的 状态。
2
储存
氨气的储存温度应该在-33°C以下,同时需要注意防火防爆措施。
3
运输
氨气属于危险品,运输时需要遵守相关法律法规,确保运输安全。
工业制冷
氨气是一种优良的制冷剂, 广泛应用于工业冷却和空调 系统中。
高一化学氨气课件

皇冠欧洲杯代理 整个晚上,我兴高采烈地做着狗狗和自己一道采蘑菇、跳房子、躲猫猫、滚铁环的美梦。 “小三三,起床咯……” 一大早,三娘将我从小花狗的梦境中拉了回来,一边给我穿衣一边拿着我的小手,像往常那样,嘴里一边轻声地哼着儿歌:“点点虫虫飞,虫虫配一对……” “不要,不要虫虫飞,要听三娘给我讲故事”我的脑袋摇晃得像只拨浪鼓似的。此刻,我还沉浸在与小花狗追逐嬉戏的梦境中。 那好,三娘给你讲一个好听的故事:“从前,有一只身穿漂亮花衣裳地小花狗狗……” “那……你知道狗妈咪是怎么样牺牲的呢?”讲完了,当我还饶有兴趣地回味故事场景没有回过神来,三娘亲切地贴近我耳朵问道。 “知道,是好大一场暴风雪夜,为了保护一大群羊宝宝,狗狗妈妈孤身几只大灰狼搏斗,最后因为大灰狼太多,而肚子被咬伤撕开,雪地上流了好多好多的血……”我心疼而又伤心地回答。 “那……你知道这只小狗狗为什么被称为‘勇敢的小花狗’呢?” “小花狗勇敢地带领它的动物小朋友们打败了大ห้องสมุดไป่ตู้狼”,得益于老师的详细讲解,加之自己也反复翻读好几个来回,书中的故事情节早以熟记于心——我肯定地回答。 “那……刚开始的时候,动物小朋友为什么都不理睬小花狗呢?”三娘和蔼而又深情地望着我,细语柔声地问道。
演示文稿氨气-化学课件

➢实验5-1:加热碳酸氢铵的固体,观察现象
现象:固体消失,试管壁上有水珠出现
△ NH4HCO3==NH3↑ + H2O ↑ + CO2 ↑
➢实验5-2:加热氯化铵的固体,观察现象
现象:试管底部固体消失,试管壁上有白色固体出现
△ NH4Cl == NH3↑ + HCl↑
NH3 + HCl == NH4Cl
△ Ca(OH)2+2NH4Cl == CaCl2 + 2NH3↑ + 2H2O
收集:向下排空气法
验满:湿润的红色石蕊试纸 ,伸到试管口检验(变蓝)
氨气的干燥:碱石灰 不用CaCl2
第19页,共21页。
②加热浓氨水
③浓氨水滴加到CaO 或固体NaOH上
△ NH3·H2O == NH3↑+H2O
第20页,共21页。
3NO2 + H2O == 2HNO3 + NO
工业制硝酸的方法
NH3 + HNO3 ==NH4NO3
第10页,共21页。
实验3-2
将铜丝绕成螺旋状,在酒精灯上加热至红热,在 插入盛有氨水的椎形瓶中,反复几次。
现象:铜丝保持红热
2Cu + O2 == 2CuO
2NH3 + 3CuO == N2 + 3Cu + 3H2O
2、氨气的工业制备
高温、高压
N2 + 3H2 催化剂 2NH3 ➢氮的固定:将游离态的氮转化为氮的化合物的过程。
第21页,共21页。
第4页,共21页。
NH3·H2O的不稳定性 --受热易分解
△ NH3·H2O == NH3↑+H2O
思考:用右图的装置,加热氨水至 沸腾,在玻璃管的上端,可以收集 到干燥的氨气。请说明在此能够收 集到干燥氨气的原因 。
现象:固体消失,试管壁上有水珠出现
△ NH4HCO3==NH3↑ + H2O ↑ + CO2 ↑
➢实验5-2:加热氯化铵的固体,观察现象
现象:试管底部固体消失,试管壁上有白色固体出现
△ NH4Cl == NH3↑ + HCl↑
NH3 + HCl == NH4Cl
△ Ca(OH)2+2NH4Cl == CaCl2 + 2NH3↑ + 2H2O
收集:向下排空气法
验满:湿润的红色石蕊试纸 ,伸到试管口检验(变蓝)
氨气的干燥:碱石灰 不用CaCl2
第19页,共21页。
②加热浓氨水
③浓氨水滴加到CaO 或固体NaOH上
△ NH3·H2O == NH3↑+H2O
第20页,共21页。
3NO2 + H2O == 2HNO3 + NO
工业制硝酸的方法
NH3 + HNO3 ==NH4NO3
第10页,共21页。
实验3-2
将铜丝绕成螺旋状,在酒精灯上加热至红热,在 插入盛有氨水的椎形瓶中,反复几次。
现象:铜丝保持红热
2Cu + O2 == 2CuO
2NH3 + 3CuO == N2 + 3Cu + 3H2O
2、氨气的工业制备
高温、高压
N2 + 3H2 催化剂 2NH3 ➢氮的固定:将游离态的氮转化为氮的化合物的过程。
第21页,共21页。
第4页,共21页。
NH3·H2O的不稳定性 --受热易分解
△ NH3·H2O == NH3↑+H2O
思考:用右图的装置,加热氨水至 沸腾,在玻璃管的上端,可以收集 到干燥的氨气。请说明在此能够收 集到干燥氨气的原因 。
氨气的性质 课件

(1)氨气与浓硫酸、浓硝酸能否发生反应? 反应现象与氨气与浓盐酸反应的现象相同吗? 为什么?
思考:浓硫酸是实验室常用的干燥剂,请问可以用来 干燥氨气吗? 你预测氨气还具有哪些化学性质?
-3
NH3
(3)氨气的催化氧化
催化剂
4NH3+5O2 △ 4NO+6H2O
思考:这步化学反应有什么意义?
H2
工业制硝酸 你能写出实现以上转化的每一步化学方程式吗?
氨气的性质
纯净的氨气是一种 无色,有
பைடு நூலகம்
刺气激味性的气体,
密度比空气 。氨 小 溶于水,极常易温下,1体
积水大约可溶解700体积氨。氨易液化,液氨
在汽化时要吸收大量的热,所以常用来作 。
制冷剂
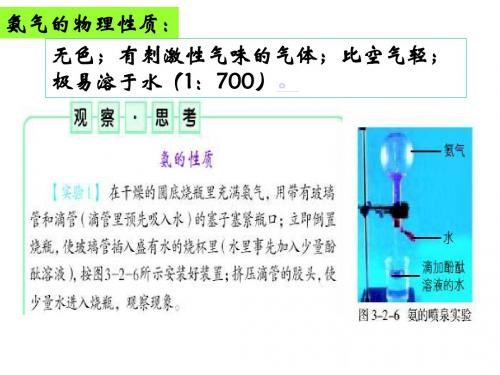
观察 · 思考
如图,在干燥的圆底烧瓶里充满氨气,用 带有玻璃管和滴管(滴管里预先吸入水)的塞 子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水 的烧杯(预先在水里滴入少量酚酞溶液)。打 开止水夹,轻轻挤压滴管,使少量水进入烧瓶。 观察现象。
氨气是中学阶段涉及的唯一一种碱性气体。
(2)氨气与酸的反应
用两根玻璃棒分别在浓氨水和浓盐酸里蘸一 下,然后将这两根玻璃棒接近(不要接触), 观察现象。
实验现象
产生大量白烟
结论(化学方程式)
NH3+HCl = NH4Cl
思考:为什么蘸有浓氨水的玻璃棒和蘸有浓盐酸 的玻璃棒不接触就能反应?
拓展 · 迁移
实验现象
结论
红色的喷泉是怎样形成的? 从这个实验中你能得出什么结论?
(1)氨气与水的反应
NH3+H2O
NH3·H2O
一元弱碱
NH3·H2O NH4++OH¯
思考:浓硫酸是实验室常用的干燥剂,请问可以用来 干燥氨气吗? 你预测氨气还具有哪些化学性质?
-3
NH3
(3)氨气的催化氧化
催化剂
4NH3+5O2 △ 4NO+6H2O
思考:这步化学反应有什么意义?
H2
工业制硝酸 你能写出实现以上转化的每一步化学方程式吗?
氨气的性质
纯净的氨气是一种 无色,有
பைடு நூலகம்
刺气激味性的气体,
密度比空气 。氨 小 溶于水,极常易温下,1体
积水大约可溶解700体积氨。氨易液化,液氨
在汽化时要吸收大量的热,所以常用来作 。
制冷剂
观察 · 思考
如图,在干燥的圆底烧瓶里充满氨气,用 带有玻璃管和滴管(滴管里预先吸入水)的塞 子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水 的烧杯(预先在水里滴入少量酚酞溶液)。打 开止水夹,轻轻挤压滴管,使少量水进入烧瓶。 观察现象。
氨气是中学阶段涉及的唯一一种碱性气体。
(2)氨气与酸的反应
用两根玻璃棒分别在浓氨水和浓盐酸里蘸一 下,然后将这两根玻璃棒接近(不要接触), 观察现象。
实验现象
产生大量白烟
结论(化学方程式)
NH3+HCl = NH4Cl
思考:为什么蘸有浓氨水的玻璃棒和蘸有浓盐酸 的玻璃棒不接触就能反应?
拓展 · 迁移
实验现象
结论
红色的喷泉是怎样形成的? 从这个实验中你能得出什么结论?
(1)氨气与水的反应
NH3+H2O
NH3·H2O
一元弱碱
NH3·H2O NH4++OH¯
高一化学氨气课件

柯美吉见我,说:“家属区,有些人真无聊,见不得人家好!大家种个菜,碍着他们什么了?”申博体育 “院子就这么大,哪几个人,大家还不心知肚明。”快嘴唐阿依,脸色不好,接腔道。 美吉不悦,漂亮的脸蛋,布了一层阴云,美眸,黑白缓动,带些忿忿。“还不就是,那几户不种菜的。不用想,就知道是谁。”她朝我莞尔一笑,阴云忽散,说,“老王,你不能种菜了,遗憾不?” 我也微微一笑,故作大度,掩饰自己内心的焦虑,说:“美吉,不能种菜,这是件好事,我可以落得清闲。若是把菜地改成停车位,或花坛、休闲区什么的,那感情好,他们(城管)为大家做了件 大好事。”说完,不是滋味,心胸也无限的压缩。 “老王,你想得美,听说要用推土机把菜地给犁了,弄成沟壑纵横的乱脏岗。”平日里快言快语的唐老图,接下话茬。 美吉略带调侃,一本正经跟大伙说:“这样还好些,土层深了,种出的冬不老(萝卜),尺多长一个。等他们挖机一走,趁着土质疏松,我们又开工,拿出当年王胡子‘南泥湾’的干劲。” 龙达嫲,目不识丁,年纪大,精神矍铄,听不懂什么王胡子南泥湾,见大家说的欢,也附和道:“你们都想的太美了。我听说,要装一些石
《高一化学氨气》课件

氨气的化学性质包括碱性、还原性和配位性。例如,氨气可以与酸反应 生成铵盐,表现出碱性;在催化氧化条件下,氨气可以被氧化为一氧化
氮,表现出还原性;氨气还可以与金属离子形成配位化合物。
氨气的用途广泛,如制造氮肥、合成纤维、合成橡胶等,还可用作洗涤 剂、中和剂等。
答案部分
氨气的制取方法有多种,如氮气与氢气在高温高压催化剂条件下合成氨气,或在 浓氨水中加入碱石灰等。
成氮气和氯化氢。
氨气可以与某些金属离子反应 ,生成金属氢氧化物沉淀,如 与银离子反应生成氢氧化银沉
淀。
氨气在高温高压下可与氢气反 应生成氮气和氢气,是工业合
成氨的重要反应。
03
氨气的制备方法
实验室制备氨气
实验步骤
将铵盐与碱混合后放入试管中,加热 至沸腾,随着反应进行,试管内产生 大量气泡,收集产生的气体即为氨气 。
《高一化学氨气》ppt课件
目录
• 氨气的物理性质 • 氨气的化学性质 • 氨气的制备方法 • 氨气的应用 • 实验:氨气的性质实验 • 习题与解答
01
氨气的物理性质
氨气的颜色
氨气是无色的气体,这一点在化学实验中十分重要,因为它的无 色可以让实验观察更为准确,例如在制备氨气时,可以清楚地看 到是否已经收集满一瓶氨气。
为了安全地存储和运输氨气,应将其存储在阴凉、干燥、通风良好的地方,远离 火源和热源,避免阳光直射;运输过程中应使用专用的压力容器,确保容器密封 良好,并配备安全阀和压力表等安全设施。
感谢您的观看
清洁能源
氨气可用于燃料电池中,产生电能和热能,具有高效、环 保的优点。
氨气可以与氢气混合制成合成气,用于生产甲醇等清洁能 源。
环境治理
氨气可以用于处理工业废水中的重金 属离子,如铜、铅、汞等,降低废水 对环境的危害。
氮,表现出还原性;氨气还可以与金属离子形成配位化合物。
氨气的用途广泛,如制造氮肥、合成纤维、合成橡胶等,还可用作洗涤 剂、中和剂等。
答案部分
氨气的制取方法有多种,如氮气与氢气在高温高压催化剂条件下合成氨气,或在 浓氨水中加入碱石灰等。
成氮气和氯化氢。
氨气可以与某些金属离子反应 ,生成金属氢氧化物沉淀,如 与银离子反应生成氢氧化银沉
淀。
氨气在高温高压下可与氢气反 应生成氮气和氢气,是工业合
成氨的重要反应。
03
氨气的制备方法
实验室制备氨气
实验步骤
将铵盐与碱混合后放入试管中,加热 至沸腾,随着反应进行,试管内产生 大量气泡,收集产生的气体即为氨气 。
《高一化学氨气》ppt课件
目录
• 氨气的物理性质 • 氨气的化学性质 • 氨气的制备方法 • 氨气的应用 • 实验:氨气的性质实验 • 习题与解答
01
氨气的物理性质
氨气的颜色
氨气是无色的气体,这一点在化学实验中十分重要,因为它的无 色可以让实验观察更为准确,例如在制备氨气时,可以清楚地看 到是否已经收集满一瓶氨气。
为了安全地存储和运输氨气,应将其存储在阴凉、干燥、通风良好的地方,远离 火源和热源,避免阳光直射;运输过程中应使用专用的压力容器,确保容器密封 良好,并配备安全阀和压力表等安全设施。
感谢您的观看
清洁能源
氨气可用于燃料电池中,产生电能和热能,具有高效、环 保的优点。
氨气可以与氢气混合制成合成气,用于生产甲醇等清洁能 源。
环境治理
氨气可以用于处理工业废水中的重金 属离子,如铜、铅、汞等,降低废水 对环境的危害。
5.2.3 氨气的制备课件 高一下学期化学人教版(2019)必修第二册

一、氨气的实验室制法
应用体验
2.(2023·江苏盐城高一联考)下列装置用于实验室中制取干燥氨气的实验,其 中能达到实验目的的是
√A.用装置甲制备氨气
B.用装置乙除去氨气中的少量水 C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
一、氨气的实验室制法
归纳总结
实验室制氨气的几点说明
(1) 铵盐不能用NH4NO3、NH4HCO3、(NH4)2CO3等代替,NH4NO3加热 时爆炸,而NH4HCO3、(NH4)2CO3极易分解产生CO2气体。
随堂检测
1.现有如图所示的四种实验室制备气体的发生装置。
下列叙述正确的是
√A.a装置可用于Na2SO3固体和70%的浓硫酸反应制备SO2
B.b装置可用于Cu和稀硫酸制取SO2 C.c装置可用于加热NH4Cl固体制备NH3 D.d装置可用于MnO2和H2O2反应制备O2,并能控制反应的发生和停止
随堂检测
(2)消石灰不能用NaOH、KOH等强碱代替,因为NaOH、KOH具有吸湿 性,易潮解结块,不利于生成的氨气逸出,而且腐蚀玻璃。
(3)NH3极易溶于水,制取和收集的容器必须干燥。
二、常见气体的制备方法比较
结合以下气体制备原理,试分析试剂状态、反应条件与发 生装置的关系? MnO2 +4HCl (浓)=== MnCl2+2H2O+Cl2↑
第五章第二节化工生产氮中及的其重化要合非物金属元素
第3课时 氨气的制备
1.掌握实验室制取氨气的方法(重点)。 2.掌握实验室制取常见气体的原理、装置、收集、净化方法
及制备方法的比较(难点)。
引入新课
实验室如何制氨气?
高温、高压
N2+3H2 催化剂 2NH3
N2、H2 体积比1:3
氨 课件(17张)
思考:请从化合价角度分析,氨还可能具有 什么性质?
3、氨气与氧气、氯气反应反应 4 NH3+5O2 4NO+6H2O
思考研讨: 如何保存铵态肥料? 施用铵态肥料有哪些注意事项? (2)铵盐的性质: 白色,易溶于水的晶体。
1、受热易分解:
NH4Cl NH4HCO3 NH3 ↑+HCl↑ NH3 ↑ +CO2 ↑ +H2O
简易装置
√
√
2、与碱溶液反应:
NH4++OH-
NH3 ↑+H2O
三、实验室制氨气
反应原理:
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
收集方法: 向下排空气法 干燥: 通过装有碱石灰的干燥管 验满方法 尾气处理:
管口塞一团用水或稀硫酸浸湿的 棉花团 ,可减小NH3与空气对流 的速率。防止污染空气。
氨气的物理性质: 无色;有刺激性气味的气体;比空气轻; 极易溶于水(1:700)。
思考:氨气溶于水仅仅是简单的溶解吗?喷 泉呈现红色说明了什么? 氨气的化学性质:
1ቤተ መጻሕፍቲ ባይዱ氨气与水反应
NH3+H2O NH3.H2O
2、氨气与酸反应实验-氨与氯化氢的反应.flv
NH3+HCl=NH4Cl NH3+HNO3=NH4NO3 2NH3+H2SO4=(NH4)2SO4
