气体摩尔体积一课时PPT课件
合集下载
高一化学必修一-气体摩尔体积ppt课件.ppt

1mol不同的气体在一定温度和压强下体积是
否相同?
❖在同温同压下,相同分子数的气
体,其体积( 相同 );
❖在相同的温度和压强下,相同体积 的任何气体都含有相同数目的分子。
(称“四同定律”或“三同定一同”)
这是阿伏加德罗定律
温度
阿伏加德 罗定律
同温
气体摩尔体积 22.4L/mol
0℃
压强
气体的量
气体的 体积
密度 (g/L) 0.0899
1.429
质量 (g)
体积(L)
2.016 22.42
32.000 22.39
1mol固体和液体物质在200C、1.01×105Pa下的体 积
物质 状态 密度(g/ml) 质量 体积(ml)
Fe 固体 7.86 55.85 7.10
Al 固体 2.7 27.00 10
同压 同分子数 同体积
1atm 1mol 22.4L
则:气体摩尔体积22.4L/mol是阿 伏加德罗定律的特例。
❖在同温同压下,体积相同的气体,其 分子数( 相同 ) ;
❖在同温同压下,气体体积的大小与
分子数目成(正 )比。
克拉珀龙方程:
(理想气体的气态方程)
PV=nRT
*
阿伏加德罗定律的推论
(称“四同定律”或“三同定一同”)
这是阿伏加德罗定律
M2
=D
阿伏加德罗定律的推论
• 依据:PV=nRT
或 PV= m RT M
3. 同温同压下,同体积任何气体的质量比 等于式量之比
T、P、V相同:
M 1 m1 M 2 m2
阿伏加德罗定律的推论
• 依据:PV=nRT
或 PV= m RT M
否相同?
❖在同温同压下,相同分子数的气
体,其体积( 相同 );
❖在相同的温度和压强下,相同体积 的任何气体都含有相同数目的分子。
(称“四同定律”或“三同定一同”)
这是阿伏加德罗定律
温度
阿伏加德 罗定律
同温
气体摩尔体积 22.4L/mol
0℃
压强
气体的量
气体的 体积
密度 (g/L) 0.0899
1.429
质量 (g)
体积(L)
2.016 22.42
32.000 22.39
1mol固体和液体物质在200C、1.01×105Pa下的体 积
物质 状态 密度(g/ml) 质量 体积(ml)
Fe 固体 7.86 55.85 7.10
Al 固体 2.7 27.00 10
同压 同分子数 同体积
1atm 1mol 22.4L
则:气体摩尔体积22.4L/mol是阿 伏加德罗定律的特例。
❖在同温同压下,体积相同的气体,其 分子数( 相同 ) ;
❖在同温同压下,气体体积的大小与
分子数目成(正 )比。
克拉珀龙方程:
(理想气体的气态方程)
PV=nRT
*
阿伏加德罗定律的推论
(称“四同定律”或“三同定一同”)
这是阿伏加德罗定律
M2
=D
阿伏加德罗定律的推论
• 依据:PV=nRT
或 PV= m RT M
3. 同温同压下,同体积任何气体的质量比 等于式量之比
T、P、V相同:
M 1 m1 M 2 m2
阿伏加德罗定律的推论
• 依据:PV=nRT
或 PV= m RT M
气体摩尔体积 ppt课件

气体摩尔体积
知识网络
一、气体摩尔体积
1.决定物质体积大小的因素
大小
距离
2.气体摩尔体积
单位物质的量的气体
Vm
L·mol-1
m3·mol-1
Vm=
温度
压强
3.标准状况下的气体摩尔体积
4.理解气体摩尔体积应注意的几个问题
(1)标准状况下的气体摩尔体积Vm ≈ 22.4 L · mol−1 ,非标准状况时
合气体的平均摩尔质量为__________。
二、阿伏加德罗定律
1.内容:在同温、同压下,相同体积的任何气体都含有________数
相同
目的分子。
2.应用:“三同”定“一同”
温
压
体积
分子数
[即学即练]
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)同温同压下,若两种气体所占体积不同,其主要原因是气体分子间
15×2 g/mol=30 g/mol,根据题意可知,一氧化碳与二氧化碳的总物质的量为1
mol,则混合气体的质量为30 g,设CO的质量为 x g,则CO2 的质量为(30-x)g,
xg
30− g
+
=1 mol,解得x=24.5,B项正确。
28 g/mol
44 gቤተ መጻሕፍቲ ባይዱmol
关键能力
气体摩尔质量或相对分子质量的计算方法
22.4
NH3 273 ℃,202 kPa
22.4
(1)从上表分析得出结论:
22.4 L
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol 不同的气体,在不同的温度和压强下,体积________(填
不一定
知识网络
一、气体摩尔体积
1.决定物质体积大小的因素
大小
距离
2.气体摩尔体积
单位物质的量的气体
Vm
L·mol-1
m3·mol-1
Vm=
温度
压强
3.标准状况下的气体摩尔体积
4.理解气体摩尔体积应注意的几个问题
(1)标准状况下的气体摩尔体积Vm ≈ 22.4 L · mol−1 ,非标准状况时
合气体的平均摩尔质量为__________。
二、阿伏加德罗定律
1.内容:在同温、同压下,相同体积的任何气体都含有________数
相同
目的分子。
2.应用:“三同”定“一同”
温
压
体积
分子数
[即学即练]
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)同温同压下,若两种气体所占体积不同,其主要原因是气体分子间
15×2 g/mol=30 g/mol,根据题意可知,一氧化碳与二氧化碳的总物质的量为1
mol,则混合气体的质量为30 g,设CO的质量为 x g,则CO2 的质量为(30-x)g,
xg
30− g
+
=1 mol,解得x=24.5,B项正确。
28 g/mol
44 gቤተ መጻሕፍቲ ባይዱmol
关键能力
气体摩尔质量或相对分子质量的计算方法
22.4
NH3 273 ℃,202 kPa
22.4
(1)从上表分析得出结论:
22.4 L
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol 不同的气体,在不同的温度和压强下,体积________(填
不一定
气体摩尔体积ppt课件

5.下列说法正确的是( B ) A.硫酸、磷酸的摩尔质量均为98g B.20℃、1.0×105Pa时,同体积的O2与CO2含有相同的分子数 C.标准状况下,16gO2与24g Mg所占的体积相同 D.当1mol气态物质的体积为22.4L时,该气体一定处于标准状况
谢谢观看
SHUAN Q for watching!
可以自由移动
没有固定的形状, 不易被压缩
气态
微粒间的空隙较大
可以自由移动
没有固定的形状, 容易被压缩
1mol任何微粒的集合体所含的微粒数目都相同,但1mol不同物质的的质量往往不 同。那么1mol不同物质的体积是否相同呢?
20°C 1 mol 固体的体积
大鹿化学工作室
20°C 1 mol 液体的体积
专题一 物质的分类及计量
第二单元 物质的化学计量 第二课时 气体摩尔体积
质量 (m)
n=m/M
物质的量 (n)
n=N/NA
微粒数 (N)
物质的体积
(V)?
我们在前面的学习中已经知道了两个计算物质的量的公式:n=N/NA和n=m/M,如果已知某 气体的体积,能否直接应用上面的公式计算出某气体的物质的量呢?显然不能,因为既不 知道气体的分子数,也不知道气体的质量。那么,气体体积与物质的量之间有什么关系呢?
相关公式 (1)气体的物质的量:n=Mm=NNA=VVm; (2)气体的摩尔质量:M=Vm·ρ (ρ 为气体的密度,单位为 g/L); (3)气体的分子数:N=n·NA=VVmNA; (4)气体的质量:m=n·M=VVmM=ρV。
推论
相同条件
同温同压
同温同容
同温同物 质的量 同温同压 同温同压 同体积
粒子数目相同物质的体积关系
气体摩尔体积ppt课件

出四个体积大小不同的气球,下列说法中正确的是( D )
A.气球②中装的是O2 B.气球①和气球③中气体分子数相等 C.气球①和气球④中气体物质的量之比为4∶1 D.气球③和气球④中气体密度之比为2∶1
22.4 22.4 22.4 11.2 11.2 22.4 22.4
气体摩尔体积/L·mol-1
22.4 22.4 22.4 11.2 11.2 22.4 22.4
任务二 气体摩尔体积
重点 理解
结论:
①1 mol任何气体,在标准状况下的体积都约为 22.4 L。 ②1 mol不同的气体,在不同的条件下,体积 不一定(填“一 定”“一定不”或“不一定”)相等。 ③ 不是 只有在标准状况下气体摩尔体积才是22.4L/mol。
1.12L Cl2 体积由大到小的顺序是
①③②④ 。
阿伏伽德罗定律
理想气体方程式:PV=nRT
推论2 同温同压下,任何气体密度之比等于摩尔质量之比,即等于相对原子/
- - 分子质量之比。
ρ1 ρ2
= M1
M2
【例3】在标准状况下,ρ空气的平均相对分子质量为29,相同条件下的下列气体
密度比空气密度大的是 ①③④ 。 ① CO2 ② H2 ③ Cl2 ④ HCl ⑤ N2
任务二 气体摩尔体积
①、标准状况下,1mol氢气体积为( 22.4L )
②、标准状况下,2mol氢气体积为 ( 44.8L )
【练一练】
公式: V=n×Vm 变式: n=VVm
1、标准状况下,0.5molH2,占有的体积约是 11.2L 。
2、标准状况下,4.48L CO2 的物质的量是 0.2mol 。 3、标准状况下,16gO2 的体积约是 11.2L 。 4、标准状况下,11.2LN2 中含有的N2 的分子数约是 3.01×1023 。
A.气球②中装的是O2 B.气球①和气球③中气体分子数相等 C.气球①和气球④中气体物质的量之比为4∶1 D.气球③和气球④中气体密度之比为2∶1
22.4 22.4 22.4 11.2 11.2 22.4 22.4
气体摩尔体积/L·mol-1
22.4 22.4 22.4 11.2 11.2 22.4 22.4
任务二 气体摩尔体积
重点 理解
结论:
①1 mol任何气体,在标准状况下的体积都约为 22.4 L。 ②1 mol不同的气体,在不同的条件下,体积 不一定(填“一 定”“一定不”或“不一定”)相等。 ③ 不是 只有在标准状况下气体摩尔体积才是22.4L/mol。
1.12L Cl2 体积由大到小的顺序是
①③②④ 。
阿伏伽德罗定律
理想气体方程式:PV=nRT
推论2 同温同压下,任何气体密度之比等于摩尔质量之比,即等于相对原子/
- - 分子质量之比。
ρ1 ρ2
= M1
M2
【例3】在标准状况下,ρ空气的平均相对分子质量为29,相同条件下的下列气体
密度比空气密度大的是 ①③④ 。 ① CO2 ② H2 ③ Cl2 ④ HCl ⑤ N2
任务二 气体摩尔体积
①、标准状况下,1mol氢气体积为( 22.4L )
②、标准状况下,2mol氢气体积为 ( 44.8L )
【练一练】
公式: V=n×Vm 变式: n=VVm
1、标准状况下,0.5molH2,占有的体积约是 11.2L 。
2、标准状况下,4.48L CO2 的物质的量是 0.2mol 。 3、标准状况下,16gO2 的体积约是 11.2L 。 4、标准状况下,11.2LN2 中含有的N2 的分子数约是 3.01×1023 。
高中化学必修一 气体摩尔体积课件

气体摩尔体积与其他物理量的关系
质量、摩尔质量和物质的量的关系
在标准状况下,气体的摩尔质量(M)等于其相对分子质量(Mr),而物质的量(n)等于质量(m)除以摩尔 质量(M)。因此,可以使用以下公式表示它们之间的关系:$n = frac{m}{M} = frac{m}{text{Mr}}$。
体积、密度和物质的量的关系
高中化学必修一 气体摩尔体 积课件
contents
目录
• 气体摩尔体积的介绍 • 气体摩尔体积的推导 • 气体摩尔体积的应用 • 气体摩尔体积的实验验证 • 气体摩尔体积的注意事项
01
气体摩尔体积的介绍
气体摩尔体积的定义
气体摩尔体积是指在标准状况 下,1摩尔任何气体的体积都约 为22.4升。
定义中的标准状况是指温度为0 摄氏度,压力为1个大气压。
据具体情况进行计算。
03
气体摩尔体积的应用
计算气体物质的量
计算混合气体的物质的量
通过已知各组分气体的物质的量和体积,可以计算混合气体的总物质的量。
计算标准状况下气体的物质的量
知道气体的体积和标准状况下的摩尔体积,可以计算出该气体的物质的量。
计算气体的质量
计算混合气体的总质量
通过已知各组分气体的物质的量和总物质的量,可以计算出 混合气体的总质量。
气体摩尔体积的适用范围
适用于混合气体
气体摩尔体积适用于任何比例的混合气体,只要这些气体 满足理想气体和标准状况的条件。
适用于单一气体
对于单一气体,无论其分子大小、形状或性质如何,只要 满足理想气体和标准状况的条件,都可以使用气体摩尔体 积。
适用于气体的化学反应
在化学反应中,无论反应前后气体的种类和数量如何变化 ,只要满足理想气体和标准状况的条件,都可以使用气体 摩尔体积。
1.2 课时2 气体摩尔体积((共33张PPT)) 课件 高一化学苏教版(2019)必修第一册

分子个数比:
物质的量比:
扩大NA倍
化学反应方程式中,各物质的化学计量数之比等于其微粒数之比,等于其物质的量之比。
化学计量数比:
2 : 1 : 2
粒子符号
物质的Ar或Mr
每个粒子的质量(g/个)
1mol物质含有的粒子数(个)
坎德拉
cd
物质的量 n
摩尔
mol
物质的量(n)是国际单位制七个基本物理量之一。摩尔(mol)是国际单位制七个基本单位之一。
注意事项:
1.“物质的量(Amount of substance)”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
2.物质的量只能用来描述微观粒子 ,像分子、离子、原子、质子、电子、中子之类,不能用来描述宏观物体。
64 g·mol-1
已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )A.16 g B.32 gC.64 g·mol-1 D.32 g·mol-1
D
物质的量
摩尔质量
不良反应
物质的量判断阿伏伽德罗常数相关计算
③已知一个分子的质量时:M=m(分子)×NA。
bNA g·mol-1
计算方法
摩尔质量(M)与微粒总数(N)有什么计算关系?
g·mol-1
1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
用NA代表阿伏加德罗常数的值,已知a g某气体中含分子数为b,则该气体的摩尔质量为 。
一、气体摩尔体积
物质的体积与什么有关?
1.定义:是用来描述一定数目微观粒子的集合体的物理量。
3.单位:摩尔 ,符号:mol
2.符号:n
Amount of substance
物质的量比:
扩大NA倍
化学反应方程式中,各物质的化学计量数之比等于其微粒数之比,等于其物质的量之比。
化学计量数比:
2 : 1 : 2
粒子符号
物质的Ar或Mr
每个粒子的质量(g/个)
1mol物质含有的粒子数(个)
坎德拉
cd
物质的量 n
摩尔
mol
物质的量(n)是国际单位制七个基本物理量之一。摩尔(mol)是国际单位制七个基本单位之一。
注意事项:
1.“物质的量(Amount of substance)”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
2.物质的量只能用来描述微观粒子 ,像分子、离子、原子、质子、电子、中子之类,不能用来描述宏观物体。
64 g·mol-1
已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )A.16 g B.32 gC.64 g·mol-1 D.32 g·mol-1
D
物质的量
摩尔质量
不良反应
物质的量判断阿伏伽德罗常数相关计算
③已知一个分子的质量时:M=m(分子)×NA。
bNA g·mol-1
计算方法
摩尔质量(M)与微粒总数(N)有什么计算关系?
g·mol-1
1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
用NA代表阿伏加德罗常数的值,已知a g某气体中含分子数为b,则该气体的摩尔质量为 。
一、气体摩尔体积
物质的体积与什么有关?
1.定义:是用来描述一定数目微观粒子的集合体的物理量。
3.单位:摩尔 ,符号:mol
2.符号:n
Amount of substance
气体摩尔体积ppt课件

温度升高,气体分子间的间隔增大,VM增大 压强增大,气体分子间的间隔减小,VM减小
当温度和压强一定时,粒子数相同的任何 气体都具有相同的体积。
标准状况时(0℃,101kPa),1mol任何气体的 体积均约为22.4L。
【思考与讨论】 1mol某气体的体积为22.4L,此时气体一定处于标准状况下吗?
2、瓦斯中甲烷与氧气的质量比为1∶4时极易发生爆炸,此时甲烷与氧 气的体积比为____1_:_2____。
3、同T同P同V时,某气体的密度是氢气密度的22倍,则该气体的相对分
子质量是
44
。
4、同T同P,相同质量的CH4、H2、O2、CO2,其体积从大到小的顺序 是 V(CO2) V(O2) V(CH4) V(H2) 。
气体体积与物质的量之间有什么关系呢?
【思考与讨论】在一定条件下ቤተ መጻሕፍቲ ባይዱ1 mol不同物质的体积如下表所示。观 察并分析表中的数据,你能得出哪些结论?
① 1mol固体所占的体积最小,液体居中,气体最大。 ② 在相同的温度和压强下,1mol固体和液体的体积都不同。 ③ 在相同的温度和压强下,1mol气体的体积都相同。
思考:影响气体粒子间的距离的因素是什么?
气体
气体粒子间隔受温度、压强的影响: 温度越高,气体粒子间距越大;压强越大,气体粒子间距越小。
【归纳】 决定气体的体积
粒子数目
温度
粒子间距
压强
对于粒子数相同的气体来说,如果温度和压强相同,则微粒间的平均距 离基本相同,体积也就相同。
阿伏加德罗定律:
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒
气体摩尔体积
高一化学组
思考: 1、怎样能从试剂瓶中取出约6.02×1023个Zn原子?
气体摩尔体积课件课件

1. 标准状况下,1mol 气体的体积几乎相等
,约为22.4L
2. 标准状况下,1mol 固体、液体的体积
各不相等
3. 标准状况下, 1mol 气体的体积比 1mol 固体、液体的体积大
问题一、决定物质体积的微观因素有哪些?
第9页,此课件共36页哦
分析讨一、论决定物质体积的微观因素
1、 粒子数目的多少 2、 粒子本身的大小
阿伏伽德罗常数
摩尔质量
N
÷NA
微观
n(mol) ÷M
m(g) 宏观
浓度C
第32页,此课件共36页哦
补充:阿伏加德罗定律
1、内容:同温、同压下,相同体积的任何气 体含有相同数目的分子。 2、数学表达式 相同条件下: V1/V2=N1/N2 注意: (1)“三同”定“一同”。
(2)适用于气态物质。既适用于单一气体,
问题二:
1mol物质,粒子
大小 和 间距对
物质体积有何影 响?
3、 粒子之间的平均距离
第10页,此课件共36页哦
为 为为什什什么么么111mmmoloo气l不l不体同同体的的积固气比体体1物m物质ol质或固体液体积体、物相液质同体体?体积积不大同??
V固、液决定于粒子的大小
物 质 的 微 观 结 构 模 型
相同条件下)
2:1
结论:
同温同压下
①H2与O2的物质的 量比等于体积比
②1 mol H2和1 mol
O2的体积相同
第7页,此课件共36页哦
科学探究二
计算1mol下列气体、固
体和液体在
0标0C、准1.01状×10况5Pa下的体积
。 分析所得数据你可以得
出什么结论?
第8页,此课件共36页哦
,约为22.4L
2. 标准状况下,1mol 固体、液体的体积
各不相等
3. 标准状况下, 1mol 气体的体积比 1mol 固体、液体的体积大
问题一、决定物质体积的微观因素有哪些?
第9页,此课件共36页哦
分析讨一、论决定物质体积的微观因素
1、 粒子数目的多少 2、 粒子本身的大小
阿伏伽德罗常数
摩尔质量
N
÷NA
微观
n(mol) ÷M
m(g) 宏观
浓度C
第32页,此课件共36页哦
补充:阿伏加德罗定律
1、内容:同温、同压下,相同体积的任何气 体含有相同数目的分子。 2、数学表达式 相同条件下: V1/V2=N1/N2 注意: (1)“三同”定“一同”。
(2)适用于气态物质。既适用于单一气体,
问题二:
1mol物质,粒子
大小 和 间距对
物质体积有何影 响?
3、 粒子之间的平均距离
第10页,此课件共36页哦
为 为为什什什么么么111mmmoloo气l不l不体同同体的的积固气比体体1物m物质ol质或固体液体积体、物相液质同体体?体积积不大同??
V固、液决定于粒子的大小
物 质 的 微 观 结 构 模 型
相同条件下)
2:1
结论:
同温同压下
①H2与O2的物质的 量比等于体积比
②1 mol H2和1 mol
O2的体积相同
第7页,此课件共36页哦
科学探究二
计算1mol下列气体、固
体和液体在
0标0C、准1.01状×10况5Pa下的体积
。 分析所得数据你可以得
出什么结论?
第8页,此课件共36页哦
气体摩尔体积课件(共28张PPT)高中化学沪科版(2020)必修第一册

= .
.
= .
.
= .
.
= .
.
【结论1】同温同压下,1 mol气体的体积远大于1 mol固体或液体的体积。
【思考】计算1 mol各物质的体积,并寻找规律。
NaCl
Fe
C2H5OH
H2SO4
H2(273 K)
He(273 K)
CH4(273 K)
固
固
液
液
气
气
气
1
1
1
1
1
1
1
58.5
56
46
98
2
4
16
2.17
7.86
0.789
1.84
0.000 088
0.000 176
0.000 716
【结论2】同温同压下,1 mol气体的体积近似相等。
V=
V=
V=
V=
V=V=V=
L。
V(O2) = n(O2) × Vm = 0.8 mol × 22.4 L·mol-1 = 17.92 L
2. 标准状况下,56 L CO2的物质的量为 2.5
n(CO2) =
V(CO2)
56 L
=
= 2.5 mol
Vm
22.4 L·mol−1
mol。
【资料卡片】
分子直径/
(nm)
分子间的平均距离/
(nm)
0.35
0.36
0.33
3.3
3.3
3.3
注:均为常温常压下的测量值
气体物质分子间的平均距离远大于分子本身大小,在分子数
目相同的情况下,气体的体积主要由分子间的距离大小决定。
《气体摩尔体积》PPT课件

× NA ÷ NA
电子
质子 中子
微粒数
N
原子 离子
V (标况)
[讨论]
标准状况下的气体摩尔体积(Vm=22.4L/mol)
请列出标准状况下求算气体体积可能的方法:
1、V=m/ ρ
2、V=n×Vm
m N (V= × Vm 或 V = × Vm) M NA
3、V=nRT/P (理想气体状态方程)
1.下列说法正确的是( D ) (A)在标准状况下,1mol水和1molH2的体积都约是22.4L (B)2gH2和44gCO2的体积相等 (C)1mol某气体的体积为22.4L,则该气体一定处于标准状况 (D)在标准状况下,1gH2和11.2LO2的物质的量相等 2.填写下列空白: (1)标况下,0.5molH2占有的体积是 11.2 L (2)标况下,2molO2占有的体积是 44.8 L (3)标况下,4.48LCO2的物质的量是 0.2 mol (4)标况下, 33.6LH2的物质的量是 1.5 mol (5)标况下,16gO2 的体积为 11.2 L 3.01×1023个 (6)标况下,11.2LN2 中含有N2分子的个数是__________
气体摩尔 体积
理想气体状态方程(克拉珀龙方程)
PV=nRT
R=8.314Pa·m3·mol-1·K-1
若T=273K(0℃) P=1.01×105Pa (即标准状况), n=1mol, R=8.314,
nRT 1 8.314 273 V 22.4 L 5 则 V= P 1.01 10
1.掌握气体摩尔体积的概念,明确影响气体体积的因素有温 度和压强,且气体摩尔体积必须指明一定的温度和压强。 2.了解物质的量、气体体积和气体摩尔体积之间的关系。 3.了解阿伏加德罗定律的内容,学会运用公式PV=nRT进行推 导,得出阿伏加德罗定律的其他推论。
气体摩尔体积优质课课件ppt
气体 物质
H2
1mol 气体 1mol气体 所含分子数 质量(g)
6.02×1023 2.016
密度
标准状况
(g/L)
0.0899
体积
标准状况 (L)
22.4
O2 6.02×1023 CO2 6.02×1023
32.00 44.01
1.429 1.977
22.4 22.3
[结论] 在标准状况下,1mol任何气体 所占的体积 都约是 22.4 L。
“非标准状况下,1mol气体的 体积一定不是22.4L。”这一说 法对吗?为什么?
不对,加压分子距离变小,升温分子距离变大。 所以适当升温并加压后气体体积可能不变。 或适当降温并减压气体体积也可能不变。
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
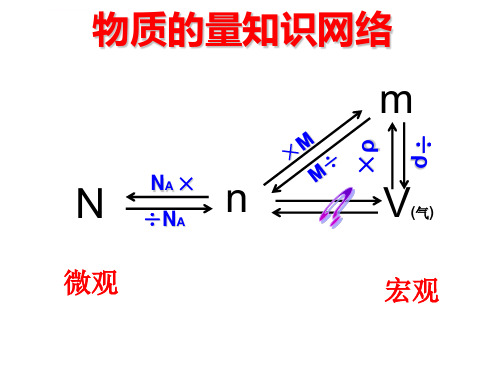
物质的量知识网络
m
×ρ
÷ρ
N n NA × ÷NA
微观
V(气)
宏观
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
相同条件下1摩尔固体、液体物质的体积
物质
1mol物质的 质量
密度
1mol物质的 体积
Fe
56g
7.8g·cm-3 7.2cm3
Al
27g
2.7g·cm-3
10cm3
Pb
207g
11.3g·cm-3 18.3cm3
气体摩尔体积公开课课件

气体摩尔体积公 开课课件
PPT,a click to unlimited possibilities
汇报人:PPT
添加目录标题
气体摩尔体积 的定义与意义
气体摩尔体积 的公式与计算
气体摩尔体积 的实验测定
气体摩尔体积 的应用
气体摩尔体积 的注意事项
气体摩尔体积 的拓展知识
添加章节标题
气体摩尔体积的定义与 意义
气体摩尔体积的 概念和计算方法
气体摩尔体积在 物理变化中的应 用
气体摩尔体积在 化学变化中的应 用
气体摩尔体积在 不同温度和压力 下的变化规律
在工业生产中的应用
计算气体的质量:通过气体摩尔体积可以计算出气体的质量,从而控制生产过程中的原料用量。
确定气体的体积:气体摩尔体积可以用来确定气体的体积,从而控制生产过程中的气体流量。
气体摩尔体积的概念
定义:气体摩尔体积 是指单位物质的量的 气体所占有的体积, 数值是本节课需要重 点掌握的内容。
单位:气体摩尔体 积的单位是升/摩尔, 符号为L/mol。
意义:气体摩尔体积 是气体宏观量与微观 量之间的桥梁,可以 帮助我们更好地理解 气体的性质和行为。
影响因素:温度、压 强是影响气体摩尔体 积的主要因素,不同 条件下,气体摩尔体 积会有所不同。
添加标题
气体摩尔体积的应用:气体摩尔体积在化学、物理、工程等领域都有广泛的应 用。例如,在化学反应中,气体摩尔体积可以用来计算反应物和生成物的比例; 在工程中,气体摩尔体积可以用来计算气体的流量和压力等参数。
气体摩尔体积的理论基础
阿伏伽德罗定律:在同温同压下,相同体积的任何气体都含有相同数目的分子。
气体摩尔体积的注意事项
气体摩尔体积的概念和计算方法 气体摩尔体积与温度、压强的关系 气体摩尔体积的适用范围和限制条件 气体摩尔体积与其他物理量的关系
PPT,a click to unlimited possibilities
汇报人:PPT
添加目录标题
气体摩尔体积 的定义与意义
气体摩尔体积 的公式与计算
气体摩尔体积 的实验测定
气体摩尔体积 的应用
气体摩尔体积 的注意事项
气体摩尔体积 的拓展知识
添加章节标题
气体摩尔体积的定义与 意义
气体摩尔体积的 概念和计算方法
气体摩尔体积在 物理变化中的应 用
气体摩尔体积在 化学变化中的应 用
气体摩尔体积在 不同温度和压力 下的变化规律
在工业生产中的应用
计算气体的质量:通过气体摩尔体积可以计算出气体的质量,从而控制生产过程中的原料用量。
确定气体的体积:气体摩尔体积可以用来确定气体的体积,从而控制生产过程中的气体流量。
气体摩尔体积的概念
定义:气体摩尔体积 是指单位物质的量的 气体所占有的体积, 数值是本节课需要重 点掌握的内容。
单位:气体摩尔体 积的单位是升/摩尔, 符号为L/mol。
意义:气体摩尔体积 是气体宏观量与微观 量之间的桥梁,可以 帮助我们更好地理解 气体的性质和行为。
影响因素:温度、压 强是影响气体摩尔体 积的主要因素,不同 条件下,气体摩尔体 积会有所不同。
添加标题
气体摩尔体积的应用:气体摩尔体积在化学、物理、工程等领域都有广泛的应 用。例如,在化学反应中,气体摩尔体积可以用来计算反应物和生成物的比例; 在工程中,气体摩尔体积可以用来计算气体的流量和压力等参数。
气体摩尔体积的理论基础
阿伏伽德罗定律:在同温同压下,相同体积的任何气体都含有相同数目的分子。
气体摩尔体积的注意事项
气体摩尔体积的概念和计算方法 气体摩尔体积与温度、压强的关系 气体摩尔体积的适用范围和限制条件 气体摩尔体积与其他物理量的关系
气体摩尔体积PPT课件(第一课时).

(1) 5.6L (3) 11.2L (2) 3mol (4) 1.806×1024
对于气体:
n=
N NA
=
m M
=
V Vm
在一定温度和压Байду номын сангаас下,并不一定 是标准状况,1mol任何气体体积是否 相同? 相同,但不一定是22.4L
在同温同压下,相同物质的量(如:1mol)的任 何气体,其体积( 相同 ); 在同温同压下,相同分子数的任何气体,其体积 ( 相同 ); 在同温同压下,相同体积的任何气体,其分子数 ( 相同 ); 在同温同压下,任何气体体积的大小与分子数目 阿伏加德罗定律 成(正 )比。
0.0893g/L
18mL 53.6mL 22.4L 22.4L 22.39L 22.4L
1.429g/L 1.965g/L 1.25g/L
由体积数据结合物质状态你得出什么结论?
结论:
1.在相同条件下,1mol气体所占的体积 比1mol固体或液体所占的体积大得多
2.在相同条件下,1mol固体或液体的体积各不 相同,而1mol气体的体积却几乎完全相同
[讨论]
对于1mol不同的固体和液体物质,为什么它
们的体积各不相同呢?决定物质体积大小的因
素有哪些呢?
[思考]
请判断下列图形,哪边所占的体积更大?
组成物质微粒的数目
微粒数越多,则体积越大
请判断下列图形,哪边所占的 体积更大呢?
粒子本身大小:
粒子本身越大,则体积越大
4个大小相同的球紧密堆积和松散堆积, 哪个所占的体积更大呢?
一、物质体积的大小取决于 ②粒子本身的大小;
概念:单位物质的量的气体所占的体积。 数学表达式: Vm= V n 对象:任何气体(纯净或混合气体(不反应)) 标准状况:温度为0℃,压强为101KPa 在标准状况下,1 mol任何气体的体积都约是22.4L。
气体摩尔体积-完整版PPT课件精选全文

2.气体摩尔体积 (1)定义:单位物质的量的气体所占的体积。 (2)符号:Vm。 (3)单位:L/mol或L·mol-1。 (4)气体摩尔体积概念的要点。 ①物质的聚集状态,必须是气体,不适用于固体、液体。 ②物质的量必须为1_mol。 ③必须指明气体所处的外界条件,即温度、压强。
3.标准状况下的气体摩尔体积
三、气体摩尔体积
1.决定物质体积大小的因素
(1)决定固体、液体物质体积大小的因素主要是粒子数目的多少和粒子 本身的大小。
(2)决定气体体积大小的因素是粒子数目的多少和气体分子间的平均距 离。影响气体间距离的因素是温度和压强,对于一定量的气体,当压强一 定时,温度升高,气体体积要增大,当温度一定时,增大压强,气体体积 会减小。
判断有关概念要注意其指向性——粒子的具体化;恒久性——相对分子 质量,摩尔质量不随微粒的增多而变化;一致性——物理单位与指代物质要
一致。
(2011 年潍坊模拟)设 NA 为阿伏加德罗常数,下列说法中正确的是 ()
A.1 mol Na2SO4 溶于水,所得溶液中 Na+个数为 NA B.H2、O2、N2、CO2 组成的混合气体 1 mol 在标准状况下的体积 约为 22.4 L C.1 L 0.3 mol·L-1 Na2SO4 溶液中含有 Na+和 SO24-总数为 0.6NA D.NA 个氢气分子(H2)的质量为 1 g
【答案】 B
考点2 跨越阿伏加德罗常数判断的“七个陷阱” 陷阱一:忽视气体摩尔体积适用的条件。22.4 L·mol-1指在标准状况 下(0℃,101 kPa)的气体摩尔体积。若题中出现物质的体积,需考虑所给物 质的状态是否为气体,条件是否为标准状况。
陷阱二:忽视物质的聚集状态。气体摩尔体积适用的对象是气体(包 括苯状混况常合下作气为为体气干体)扰。。因一素些迷在惑标考准生状。况另下外是注液意体烃或的固衍体生的物物中质C,H3如Cl、CCHl4C、HSOO等3、在己标烷准、
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
数目 大小
气体体积大小的决定因素是什么?
构1成mo固l气、体液含体有的粒粒子数子目本相身同的,大粒小子之间的距
离远远大于粒子本身的直径。所以气体体积主
要决定于气体粒子间的距离和粒子数目。
气体体积大小的决定因素
分子数目 分子间平均距离
温度 压强
同温同压下,任何气体分子的间距相同。
注意:讨论气体的体积时,必须指明温度和压强。
铅
水
硫酸 氢气 氧气
二氧 化碳
体积 10.0 7.10 18.3 18.0 54.1 22.4 22.4 22.3
cm3 cm3 cm3 cm3 cm3
L LL
示 意 图
从微观角度思考:决定物质体积的 因素有哪些?
构成固态结构微粒间的距离很小 构成液态结构微粒间的距离也小
固体、液体体积大小的决定因素
Please Criticize And Guide The Shortcomings
演讲人:XXXXXX 时 间:XX年XX月XX日
1.等质量的下列物质中,所含分子数最少的是 () A、Cl2 B、 HCl C、NH3 D、H2SO4 2. 1mol下列气体中所含原子数最多的是()
A. H2 B . CH4 C .CO2 D . O2
3. 氢原子数目为9.03×1023的NH3质量为_____
4.下列说法正确的是 A.氧的摩尔质量是32 g•mol-1 B.硫酸的摩尔质量是98g C.CO2的相对分子质量是44g D.CO32—摩尔质量是60 g/mol
7.86 g·cm-3(20℃) 2.70 g·cm-3(20℃) 0.998 g·cm-3(20℃) 1.83 g·cm-3(20℃)
1mol物质 占的体积
22.4 L
22.4 L 7.2 cm3
10 cm3 18.0 cm3 53.6 cm3
1摩尔物质的体积
固态
液态 气态(标准状况)
物质 铝
铁
()
5、1g H2O中含有a个氢原子,则阿伏加德 罗常数为( )
A、(a/9)mol-1
B、 9a mol-1
C、 2a mol-1
D、a mol-1
【知识回顾】
质量 物质的量
体积
2H2 + 4g 2mol
点燃
O2 == 2H2O 32g 36g 1 mol 2mol
?
÷
m
×
n
N
×
÷
?
ρ
V(g)
小
均距离
√ 固体和液
体
√
气体
√
√
温度和压强
结束语
当你尽了自己的最大努力时,失败也是伟大的 ,所以不要放弃,坚持就是正确的。
When You Do Your Best, Failure Is Great, So Don'T Give Up, Stick To The End
感谢聆听
不足之处请大家批评指导
科学探究 教材P13
1 mol物质在特定条件下所具有的体积
物质 1mol物质 的质量
O2 32.00 g
H2 2.016 g
Fe
56 g
Al
27 g
H2O 18 g H2SO4 98 g
密度
1.429 g·L-1(0℃、101.325KPa) 0.0899 g·L-1(0℃、101.325KPa)
结论: 同温同压条件下,粒子数相同的任何气体都具有相 同的体积。 例如,0℃,101KPa,1mol的H2和O2都约为22.4L。 同温同压条件下,相同的体积的任何气体都具有相 同的粒子数
例如,0℃,101KPa,相同体积的 H2和O2都具有 相同的物质的量。
决定物质体积的因素
粒子数目 粒子的大 粒子间平
