《乙酸》ppt课件
合集下载
乙酸课件ppt课件

应用清洁生产技术,如超临界流体技术、膜 分离技术等,提高乙酸生产的环保性能。
对乙酸产品及其生产过程进行生命周期评价, 全面评估其对环境的影响,为绿色化学在乙 酸产业中的推广提供依据。
THANKS FOR WATCHING
感谢您的观看
分析天平
用于精确称量,需注意保 持台面稳定,避免震动。
实验操作步骤详解
1. 实验准备
穿戴好实验服,准备好实验所需 药品和仪器。
2. 药品取用
按照实验要求取用适量药品,注 意节约使用。
3. 实验操作
按照实验步骤进行规范操作,记 录实验现象和数据。
4. 实验结束
清洗实验仪器,整理实验台面, 关闭电源和水源。
材料回收利用
对废弃物中的有价值的材料进行回收,如金属、塑料等,以降低生产 成本和减轻环境压力。
绿色化学在乙酸产业中的推广
绿色合成方法
催化剂优化
开发低能耗、低排放、高效率的乙酸合成方 法,从源头上减少废弃物的产生。
研发高效、环保的催化剂,降低乙酸生产过 程中的能耗和废弃物排放。
清洁生产技术
生命周期评价
结构式
乙酸分子由一个甲基(CH3-)和 一个羧基(-COOH)组成,羧基 中的碳氧双键和羟基使其具有独特 的化学性质。
物理性质与化学性质
物理性质 无色透明液体,有刺激性气味。
能与水、乙醇、乙醚等多数有机溶剂混溶。
物理性质与化学性质
• 熔点16.6℃,沸点117.9℃,相对密度1.05。
物理性质与化学性质
其他有机合成领域应用
乙酸酐
用于合成多种有机化合物,如酯、 醚、酰胺等。
乙酸乙烯酯
作为重要的工业原料,用于合成 聚乙烯醇、聚乙烯胺等高分子化
乙酸的结构及性质ppt课件

【任务 一】乙酸的物理性质 1. 乙酸:俗称醋酸
颜色 状态
气味
溶解性 挥发性 熔点 沸点
无色
液体
有强烈刺激 性气味
易溶于水 和乙醇
易挥发 16.6℃ 118℃
当温度低于16.6℃时,乙酸可凝结成类似冰的 晶体,故纯净的乙酸又称为“冰醋酸”。
【任务 二】乙酸的结构与化学性质 2. 乙酸的结构及其表示方式
2、酯的结构及官能团:
O
‖
酯基:—COOR 或 O
RCOOR′或 RC-O-R′
C OR
3、命名: (根据酸和醇的名称来命名)
羧酸 + 醇
酯+ 水
举例: 乙酸 推广: 某酸
乙醇 某醇
乙酸乙酯 某酸某酯
【任务 三】酯的性质
4、酯的物理性质: 低级酯有香味,密度比水小,不溶于水,易溶有机溶剂,可作溶剂。
【任务 三】酯的性质
【实际应用——生活常识】
酯是有芳香气味的液体,存在于各种水果和花草中。
乙酸异戊酯
乙酸乙酯
戊酸戊酯
【归纳总结】乙酸的结构与化学性质
物理性质 俗称醋酸,无色、有刺激性气味的液体
结构特征 结构简式:CH3COOH,官能团:羧基(—COOH)
乙
化学性质
弱酸性:CH3COOH
CH3COO- + H+
能否与Na2CO3反应 能否与NaHCO3反应
不能 不能
羟基氢的活泼性
O
O
O
H H HO─C─OH CH3 C─OH
水
碳酸
能 逐渐增强 能
乙酸 能
不能
能
能
不能
能(无气体) 能(产生CO2)
乙酸教学PPT课件

02
乙酸制备方法与工艺流程
天然资源提取法
水果、植物等天然资 源中含有丰富的乙酸 或其前体物质。
此方法受限于原料来 源和提取效率,通常 用于小规模生产或实 验室制备。
通过破碎、浸泡、蒸 馏等步骤,可从天然 资源中提取乙酸。
合成法制备乙酸
01
02
03
甲醇羰基化法
甲醇与一氧化碳在催化剂 作用下反应生成乙酸,是 工业上最常用的合成方法 。
分子式
CH3COOH,由甲基(CH3-)和 羧基(-COOH)组成。
物理性质与化学性质
物理性质 无色透明液体,有刺激性气味。
易溶于水、乙醇、乙醚等多数有机溶剂。
物理性质与化学性质
• 熔点16.6℃,沸点117.9℃,密度比水大。
物理性质与化学性质
01
化学性质
02
03
04
具有弱酸性,能与碱反应生成 盐和水。
通过改进催化剂、优化操 作条件等措施提高乙酸产 率和质量。
03
乙酸反应机理及催化作用 探讨
羧酸衍生物生成和转化规律
羧酸衍生物生成
通过羧酸与醇、胺等亲核试剂的反应 ,生成酯、酰胺等羧酸衍生物。
转化规律
羧酸衍生物在特定条件下可发生水解 、醇解、氨解等反应,实现不同官能 团之间的转化。
催化剂类型及其作用原理
绘制乙酸浓度与滴定体积的关系曲线图,观察曲线的变化趋势和特点。
数据记录、结果分析和讨论
讨论
探讨实验中可能出现的误差因素及其对结果的影 响程度。
分析实验结果与理论预期之间的差异及原因,提 出改进实验方法的建议。
06
知识拓展:其他羧酸类物 质简介
甲酸、丙酸等简单羧酸概述
甲酸(HCOOH)
高中化学3.2.2乙酸课件新人教必修2.ppt
乙酸乙酯
酯化反应:酸跟醇作用,生成酯和水的反应.
酯化反应的注意事项
(1)浓H2SO4的作用是脱水剂和催化剂 (2)试管要与桌面成45°角,且试管中的液体不 能超过试管体积的三分之一
(3)导气管兼起冷凝和导气作用
(4)导气管不能伸入碳酸钠液面以下,以防喷出 和倒吸
(5)饱和Na2CO3溶液的作用
①中和乙酸、溶解乙醇杂质;②冷凝酯蒸气; ③由于乙酸乙酯在该溶液中的溶解度较小,有利于乙酸 乙酯析出
【问题与讨论】酯化反应反应时,脱水可能有几种方式? • 同位素原子示踪法判断酯化反应的本质。
提示:如果用乙酸跟含18O的乙醇起反应,可发现生成物中乙酸 乙酯分子中含有18O原子。
18
18
断键方式:酸脱羟基(-OH) 醇脱氢(H) 酯化反应又属于取代反应。
小结:
O
酸性
CH3—C—O—H
酯化反应
某有机物的结构为
Na2CO3 + 2CH3COOH 2CH3COONa + CO2↑+ H2O
阅读P75实验3-4 (2)乙酸的酯化反应
乙酸、乙醇、浓 硫酸的混合物
饱和Na2CO3溶液
现象: 溶液分层,上层有无色透明的油状 液体产生,并有香味
CH3COOH + HOC2H5 浓H2SO4 CH3COOC2H5+H2O
(CH3COO)2Ca + CO2↑+ H2O
CaCO3 + 2CH3COOH2CH3COO- + Ca2+ + CO2↑+ H2O
能,酸性: CH3COOH > H2CO3
P75科学探究
• 2、设计实验。
目的:比较醋酸和碳酸的酸性
原理:强酸制弱酸
酯化反应:酸跟醇作用,生成酯和水的反应.
酯化反应的注意事项
(1)浓H2SO4的作用是脱水剂和催化剂 (2)试管要与桌面成45°角,且试管中的液体不 能超过试管体积的三分之一
(3)导气管兼起冷凝和导气作用
(4)导气管不能伸入碳酸钠液面以下,以防喷出 和倒吸
(5)饱和Na2CO3溶液的作用
①中和乙酸、溶解乙醇杂质;②冷凝酯蒸气; ③由于乙酸乙酯在该溶液中的溶解度较小,有利于乙酸 乙酯析出
【问题与讨论】酯化反应反应时,脱水可能有几种方式? • 同位素原子示踪法判断酯化反应的本质。
提示:如果用乙酸跟含18O的乙醇起反应,可发现生成物中乙酸 乙酯分子中含有18O原子。
18
18
断键方式:酸脱羟基(-OH) 醇脱氢(H) 酯化反应又属于取代反应。
小结:
O
酸性
CH3—C—O—H
酯化反应
某有机物的结构为
Na2CO3 + 2CH3COOH 2CH3COONa + CO2↑+ H2O
阅读P75实验3-4 (2)乙酸的酯化反应
乙酸、乙醇、浓 硫酸的混合物
饱和Na2CO3溶液
现象: 溶液分层,上层有无色透明的油状 液体产生,并有香味
CH3COOH + HOC2H5 浓H2SO4 CH3COOC2H5+H2O
(CH3COO)2Ca + CO2↑+ H2O
CaCO3 + 2CH3COOH2CH3COO- + Ca2+ + CO2↑+ H2O
能,酸性: CH3COOH > H2CO3
P75科学探究
• 2、设计实验。
目的:比较醋酸和碳酸的酸性
原理:强酸制弱酸
化学乙酸ppt课件

储存运输注意事项提醒
• 储存于阴凉、通风的库房。远离火种、热源。库温不超过30℃,相对湿度不 超过80%。保持容器密封。应与氧化剂、碱类分开存放,切忌混储。采用防 爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄 漏应急处理设备和合适的收容材料。
• 运输时运输车辆应配备相应品种和数量的消防器材及泄漏应急处理设备。夏季 最好早晚运输。运输时所用的槽(罐)车应有接地链,槽内可设孔隔板以减少 震荡产生静电。严禁与氧化剂、碱类、食用化学品等混装混运。运输途中应防 曝晒、雨淋,防高温。中途停留时应远离火种、热源、高温区。装运该物品的 车辆排气管必须配备阻火装置,禁止使用易产生火花的机械设备和工具装卸。 公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。铁路运输时要 禁止溜放。严禁用木船、水泥船散装运输。
生产品的制备和应用。
相关领域前沿动态介绍
1 2
乙酸基生物可降解材料
介绍乙酸基生物可降解材料的种类、制备方法、 性能特点以及在包装、农业、医疗等领域的应用 前景。
乙酸燃料电池
介绍乙酸燃料电池的工作原理、性能特点以及在 便携式电子设备、电动汽车等领域的应用前景。
3
乙酸在生物医学中的应用
介绍乙酸在生物医学领域的研究进展,如乙酸在 癌症治疗、神经科学、药物合成等方面的应用。
操作步骤详解和注意事项提醒
操作步骤
包括原料准备、催化剂加入、反应温度控制、产物收集等步 骤。
注意事项
如原料纯度、催化剂活性保持、温度控制精度、安全操作等 。
实验结果分析与讨论
01
产物收率
不同条件下乙酸收
率的比较。
02
产物纯度
通过色谱等方法分 析产物纯度。
04
高中化学《乙酸》课件

处理技术
针对羧酸类化合物的污染问题, 可采用物理、化学或生物方法进 行处理,如吸附、氧化、生物降
解等。
资源回收
通过合适的分离和提纯技术,可 实现羧酸类化合物的回收利用,
降低资源浪费和环境污染。
2024/1/25
30
感谢您的观看
THANKS
2024/1/25
31
乙酸是合成许多有机化 合物的重要原料,如乙 酸乙酯、乙酸纤维等。
8
乙酸可用于治疗某些皮 肤疾病和作为消毒剂使
用。
02
乙酸制备方法与实验
2024/1/25
9
实验室制备乙酸方法及原理
乙醇氧化法
在实验室中,常用乙醇氧化法制备乙 酸。该方法利用乙醇在催化剂作用下 与氧气反应,生成乙酸和水。反应原 理为乙醇中的羟基被氧化为羧基。
2024/1/25
实例分析
以乙酸和乙醇的酯化反应为例,探讨反应条件、催化剂选择 、产物分离提纯等实验细节。
17
酸碱中和反应在乙酸中的应用
01
02
03
中和滴定
利用酸碱中和反应的原理 ,通过滴定方法测定乙酸 的浓度或含量。
2024/1/25
缓冲溶液配制
乙酸与乙酸钠按一定比例 混合可配制缓冲溶液,用 于维持溶液pH值的有机 化合物,具有刺激性气味和酸味 。
分子式
乙酸的分子式为C2H4O2,由两 个碳原子、四个氢原子和两个氧 原子组成。
4
物理性质与化学性质
物理性质
无色透明液体。
具有刺激性气味和酸味。
2024/1/25
5
物理性质与化学性质
易溶于水、乙醇等溶剂。
化学性质
实验注意事项
选择合适的反应条件如温度、时间等;注意催化 剂的选择和用量;对产物进行充分提纯以保证鉴 定结果的准确性。
乙酸(共17张PPT)

浓H2SO4 △
CH3—C—O—C2H5
方式二: O
CH3—C—O—H + H—O—C2H5
+ H2O
O
浓H2SO4 △
CH3—C—O—C2H5
+ H2O
同位素示踪法 ─研究有机反应机理常用的方法 O
CH3C— O—H + H— 18O —C2H5 浓H2SO4 O
CH3C— 18O —C2H5 + H2O
反应条件:加热,加浓硫酸等催化剂。
注意:
浓硫酸的作用:催化剂,吸水剂
饱和碳酸钠溶液 的作用
沸石:防止暴沸
①溶解挥发出来的乙醇
②吸收挥发出来的乙酸
③降低乙酸乙酯在溶液中的溶解度,有 利于分层。
装药品的顺序: ①乙醇 ②浓硫酸,待冷却 ③乙酸
导气管不能插入碳酸钠溶液中: 防止倒吸
三、乙酸的用途 1. 在日常生活中就有广泛的用途,可用于调味品、除水垢等。 2. 乙酸是一种重要的有机化工原料。
当气温低于熔点时,乙酸凝结成类似冰的晶体,所以 纯净的乙酸又称冰醋酸
4. 沸点: 117.9℃ (易挥发) 5. 溶解性: 易溶于水、乙醇等溶剂
CaCO3 + 2CH3COOH = (CH3COO)2Ca + CO2↑+ H2O(除水垢) CaCO3 + 2CH3COOH = 2CH3COO- + Ca2+ + CO2↑+ H2O
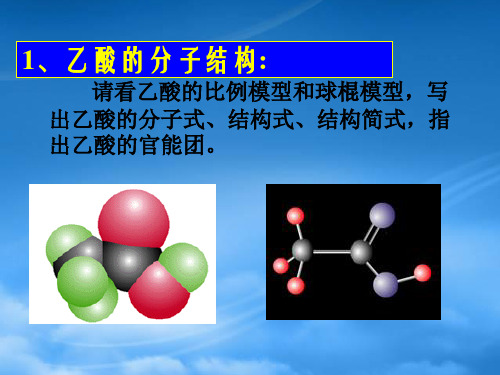
一、乙酸的组成和结构
1. 俗名: 醋酸
2. 分子式: C2H4O2
HO 3. 结构式: H C C O H
H 4. 结构简式: CH3COOH
球棍模型
O
空间填充模型 5. 官能团: 羧基 —C—O—H (或 —COOH)
《乙酸》PPT课件

环境影响
乙酸对水质和土壤有一定影响,需妥善处理废水和废渣,避免对环境造成污染 。同时,乙酸也是大气中光化学烟雾的重要前体物之一,需控制其排放。
02 乙酸制备方法与 技术
原料选择与预处理
原料种类
01
甲醇、一氧化碳、乙醇等
原料纯度要求
02
高纯度原料,减少杂质对反应的影响
预处理方法
03
干燥、蒸馏、净化等
操作顺序
按照实验方案规定的操作顺序进行实验,避免操作失误导致实验 失败或安全事故。
安全防护措施
实验室安全规则
遵守实验室安全规则,禁止单独进行实验,保持实验室整洁有序 。
个人防护装备
实验时需佩戴实验服、护目镜、手套等个人防护装备,确保实验人 员的安全。
应急处理措施
熟悉应急处理措施,如火灾、泄漏等意外情况的应对方法,确保在 紧急情况下能够迅速反应并妥善处理。
设备检查
检查实验器材是否完好无损,特 别是玻璃仪器有无裂痕、破损等
情况,确保实验安全。
清洁与干燥
实验前需对器材进行彻底清洁和 干燥,避免杂质和水分对实验的
影响。
操作步骤详解
原料准备
根据实验方案准备相应的原料,如乙醇、氧化剂等,并确保其纯 度和质量符合要求。
反应条件控制
严格控制反应温度、压力、搅拌速度等条件,以保证反应顺利进 行并避免副反应的发生。
废弃物处理和环境保护要求
废弃物分类处理
对实验产生的废弃物进行分类处理,如有机废液、无机废液、固体 废弃物等,确保废弃物得到妥善处理并不会对环境造成污染。
环境保护意识
提高环境保护意识,减少实验对环境的负面影响,如采用环保型原 料、节能型设备等。
遵守相关法规
乙酸对水质和土壤有一定影响,需妥善处理废水和废渣,避免对环境造成污染 。同时,乙酸也是大气中光化学烟雾的重要前体物之一,需控制其排放。
02 乙酸制备方法与 技术
原料选择与预处理
原料种类
01
甲醇、一氧化碳、乙醇等
原料纯度要求
02
高纯度原料,减少杂质对反应的影响
预处理方法
03
干燥、蒸馏、净化等
操作顺序
按照实验方案规定的操作顺序进行实验,避免操作失误导致实验 失败或安全事故。
安全防护措施
实验室安全规则
遵守实验室安全规则,禁止单独进行实验,保持实验室整洁有序 。
个人防护装备
实验时需佩戴实验服、护目镜、手套等个人防护装备,确保实验人 员的安全。
应急处理措施
熟悉应急处理措施,如火灾、泄漏等意外情况的应对方法,确保在 紧急情况下能够迅速反应并妥善处理。
设备检查
检查实验器材是否完好无损,特 别是玻璃仪器有无裂痕、破损等
情况,确保实验安全。
清洁与干燥
实验前需对器材进行彻底清洁和 干燥,避免杂质和水分对实验的
影响。
操作步骤详解
原料准备
根据实验方案准备相应的原料,如乙醇、氧化剂等,并确保其纯 度和质量符合要求。
反应条件控制
严格控制反应温度、压力、搅拌速度等条件,以保证反应顺利进 行并避免副反应的发生。
废弃物处理和环境保护要求
废弃物分类处理
对实验产生的废弃物进行分类处理,如有机废液、无机废液、固体 废弃物等,确保废弃物得到妥善处理并不会对环境造成污染。
环境保护意识
提高环境保护意识,减少实验对环境的负面影响,如采用环保型原 料、节能型设备等。
遵守相关法规
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8
三、乙酸的化学性质
1. 酸性
试管 现象 I 溶液变红
结论 乙酸显酸性
II
产生无 乙酸酸性比碳酸强
色气体
请用化学方程式或电离方程式表示产生以上现象的原因
I CH3COOH CH3COO- + H+ II 2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑
9
为什么呢?
有机物CH2=CH-COOH可以与下列哪些物质发生反应?
它表现了哪个官能团的性质特征?
❖溴水碳碳双键源自❖乙醇羧基❖ NaOH溶液
羧基
❖ 高锰酸钾溶液
碳碳双键
结论:有什么样的官能团就有什么样的化学性质
17
课堂小结:
一.乙酸的物理性质 (无色、液体、有刺激性气味、易溶于水和乙醇) 二.乙酸的分子结构
结构简式: CH3COOH 官能团: —COOH(羧基) 三.乙酸的化学性质
乙酸乙酯不溶于碳酸钠溶液,且密度比水不小溶。于盐溶液
1、为什么要先加酒精,后加浓硫酸? 乙醇、乙酸
2、乙酸乙酯为什么浮在液面上? ①②3、溶催吸蒸解化水出乙剂剂的醇::加吸乙、快收酸中化生乙和学成酯乙反的中酸应水含、速分有降率,哪低;增些乙大杂酸反质乙应?酯进的行溶的解程性度。
4、饱和碳酸钠溶液的作用是什么?
乙酸
1
1.了解乙酸的分子结构,掌握羧基的结构特征; 2.掌握乙酸的物理性质和化学性质; 3.知道酯化反应的概念。
传说在古代的中兴国,有个叫杜康的人发明 了酒。他儿子黑塔也跟杜康学会了酿酒技术。后 来,黑塔率族移居现江苏省镇江。在那里,他们 酿酒后觉得酒糟扔掉可惜,就存放起来,在缸里 浸泡。到了二十一日的酉时,一开缸,一股从来 没有闻过的香气扑鼻而来。在浓郁的香味诱惑下, 黑塔尝了一口,酸甜兼备,味道很美,便贮藏着 作为“调味浆”。
23
课堂练习
3. 除去乙酸乙酯中混有少量的CH3COOH,
最好的处理方法是( C )
A.蒸馏 B.水洗后分液 C.用过量饱和Na2CO3溶液洗涤后分液 D.用过量NaOH溶液洗涤后分液
24
课堂练习
4. 酯化反应属于( D ).
A.中和反应
B.不可逆反应
C.离子反应
D.取代反应
若乙酸分子中的氧都是18O,乙醇分子中的氧
7
证明乙酸的酸性的可行方案: 方案一 C往H3乙CO酸O溶H液中加石蕊CH3COO- + H+
方案二 2将CH镁3C条OO插H入+ 乙Mg酸溶液(CH3COO)2Mg + H2 方案三 2往CHNa3C2COOO3粉H 未+ N中a加2CO入3乙酸2溶C液H3COONa + H2O +CO2
方案四 C向H滴3C有O酚OH酞+的NNaaOOHH溶液中滴C加H乙3C酸OONa + H2O
1.乙酸的酸性 2.乙酸的酯化反应
O CH3-C-O-H+H-O-CH2-CH3
浓H2SO4
△
O CH3-C-O-CH2-CH3+H2O
概念:酸和醇作用生成酯和水的反应 条件:浓硫酸、加热 规律:酸脱羟基醇脱氢
18
生活小帮手无“醋” 不在
黄豆泡醋可以降血压
19
乙酸是重要的化工原料
乙酸可以生产农药
图中发生装置有何特点?为什么使用长导管?导
管口为什么要在溶液的液面上方?导管的作用:导
注意:不能
气、冷疑
伸到液面下
(防倒吸)
酯化反应:酸和醇作用,生成酯和水的反应
2.酯化反应
11
交流讨论:
物 质 沸点(0C) 密度(g/mL)
水溶性
乙酸
117.9
1.05
易溶
乙醇
78.5
0.7893
易溶
浓硫乙酸酸乙稀酯释放出热7量7 ;若酒精加0.在9后0 ,则会沸微腾溶飞于溅水
5、反应中浓H2SO4的作用是什么?
12
探究:乙 酸和乙 醇可能是以怎样的方式相互结合 形成乙酸乙 酯的?
O CH3-C-O-H
H-O-CH2-CH3
13
探究:乙 酸和乙 醇可能是以怎样的方式相互结合
形成乙酸乙 酯的?
酯化反应实质
14
O
CH3-C-OH + HO-CH2CH3
乙酸
乙醇
浓H2SO4 △
醋 “酉”加“廿一日”——
3
生活中常用的调味品食醋,它就是约含3%~5%的乙酸, 乙酸又称醋酸。它有什么样的结构?它都有那些性质呢?
4
一、乙酸的分子结构
分子式: C2H4O2结构式:
HO
H C C O羧基H H (—COOH)
O
结构简式:CH3COOH 或 CH3-COOH 或 CH3-C-OH
都是16O,二者在浓H2SO4作用 下发生反应,一段时间后,分子中含有18O的物
质有( C)
A.1种 B.2种 C.3 种 D.4种
生成物中水的相对分子质量为 20 。
25
乙酸是重要的化工原料
乙酸可以生产涂料
21
香料 染料 医药
乙酸的用途 有机化工原料
乙酸 农药
喷漆溶剂 醋酸纤维 合成纤维
课堂练习
1. 下列物质中可用来鉴别乙酸、乙醇、苯的是( C )
A.金属钠
B. 溴水
C. 碳酸钠溶液
D. 紫色石蕊试液
2. 分离乙醇和乙酸的方法最好的是( D )
A. 分液漏斗分液 B. 加入碳酸钠饱和溶液,通过分液分离 C. 加热蒸馏 D. 加入氢氧化钠后,蒸出乙醇,再加浓硫酸蒸 出乙酸
O CH3-C-O-CH2CH3 + H2O
乙酸乙酯
O CH3-C-O-CH2CH3
取代反应
15
思考:乙酸的化学性质与它的哪部分结构有关?
O 羧基
CH3—C—OH 官能团 -COOH
结论:乙酸的化学性质与羧基有关。
官能团:反映一类有机物的共同特征的基团。
乙烯 乙醇
碳碳双键 羟基 -OH
C=C
16
知识拓展:
厨师烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香 醇,特别鲜美。
这用化学知识能解释哦!
10
1、在试管中先加入3mL乙醇,再慢慢加入2mL浓硫酸,摇动试管混合均 匀,用手感觉温度变化。
2、再加入2mL冰醋酸,如图连好装置。接上导管到3mL饱和碳酸钠的液 面上(不接触液面)。
3、用酒精灯小心加热,观察现象。
5
二、乙酸的物理性质
颜色 : 气味 : 状态 : 溶解性 : 熔沸点 :
无色 强烈刺激性气味 常温下为液体
与水、酒精以任意比互溶 熔沸点较低,易挥发。熔点:16.6 0C,易 结成冰一样的晶体。(冰醋酸由此得名)
6
根据下列提供的药品,设计实验证明乙酸的酸性。 药品:镁带、NaOH溶液 、 Na2CO3粉末、乙酸溶液、 酚酞、石蕊。
三、乙酸的化学性质
1. 酸性
试管 现象 I 溶液变红
结论 乙酸显酸性
II
产生无 乙酸酸性比碳酸强
色气体
请用化学方程式或电离方程式表示产生以上现象的原因
I CH3COOH CH3COO- + H+ II 2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑
9
为什么呢?
有机物CH2=CH-COOH可以与下列哪些物质发生反应?
它表现了哪个官能团的性质特征?
❖溴水碳碳双键源自❖乙醇羧基❖ NaOH溶液
羧基
❖ 高锰酸钾溶液
碳碳双键
结论:有什么样的官能团就有什么样的化学性质
17
课堂小结:
一.乙酸的物理性质 (无色、液体、有刺激性气味、易溶于水和乙醇) 二.乙酸的分子结构
结构简式: CH3COOH 官能团: —COOH(羧基) 三.乙酸的化学性质
乙酸乙酯不溶于碳酸钠溶液,且密度比水不小溶。于盐溶液
1、为什么要先加酒精,后加浓硫酸? 乙醇、乙酸
2、乙酸乙酯为什么浮在液面上? ①②3、溶催吸蒸解化水出乙剂剂的醇::加吸乙、快收酸中化生乙和学成酯乙反的中酸应水含、速分有降率,哪低;增些乙大杂酸反质乙应?酯进的行溶的解程性度。
4、饱和碳酸钠溶液的作用是什么?
乙酸
1
1.了解乙酸的分子结构,掌握羧基的结构特征; 2.掌握乙酸的物理性质和化学性质; 3.知道酯化反应的概念。
传说在古代的中兴国,有个叫杜康的人发明 了酒。他儿子黑塔也跟杜康学会了酿酒技术。后 来,黑塔率族移居现江苏省镇江。在那里,他们 酿酒后觉得酒糟扔掉可惜,就存放起来,在缸里 浸泡。到了二十一日的酉时,一开缸,一股从来 没有闻过的香气扑鼻而来。在浓郁的香味诱惑下, 黑塔尝了一口,酸甜兼备,味道很美,便贮藏着 作为“调味浆”。
23
课堂练习
3. 除去乙酸乙酯中混有少量的CH3COOH,
最好的处理方法是( C )
A.蒸馏 B.水洗后分液 C.用过量饱和Na2CO3溶液洗涤后分液 D.用过量NaOH溶液洗涤后分液
24
课堂练习
4. 酯化反应属于( D ).
A.中和反应
B.不可逆反应
C.离子反应
D.取代反应
若乙酸分子中的氧都是18O,乙醇分子中的氧
7
证明乙酸的酸性的可行方案: 方案一 C往H3乙CO酸O溶H液中加石蕊CH3COO- + H+
方案二 2将CH镁3C条OO插H入+ 乙Mg酸溶液(CH3COO)2Mg + H2 方案三 2往CHNa3C2COOO3粉H 未+ N中a加2CO入3乙酸2溶C液H3COONa + H2O +CO2
方案四 C向H滴3C有O酚OH酞+的NNaaOOHH溶液中滴C加H乙3C酸OONa + H2O
1.乙酸的酸性 2.乙酸的酯化反应
O CH3-C-O-H+H-O-CH2-CH3
浓H2SO4
△
O CH3-C-O-CH2-CH3+H2O
概念:酸和醇作用生成酯和水的反应 条件:浓硫酸、加热 规律:酸脱羟基醇脱氢
18
生活小帮手无“醋” 不在
黄豆泡醋可以降血压
19
乙酸是重要的化工原料
乙酸可以生产农药
图中发生装置有何特点?为什么使用长导管?导
管口为什么要在溶液的液面上方?导管的作用:导
注意:不能
气、冷疑
伸到液面下
(防倒吸)
酯化反应:酸和醇作用,生成酯和水的反应
2.酯化反应
11
交流讨论:
物 质 沸点(0C) 密度(g/mL)
水溶性
乙酸
117.9
1.05
易溶
乙醇
78.5
0.7893
易溶
浓硫乙酸酸乙稀酯释放出热7量7 ;若酒精加0.在9后0 ,则会沸微腾溶飞于溅水
5、反应中浓H2SO4的作用是什么?
12
探究:乙 酸和乙 醇可能是以怎样的方式相互结合 形成乙酸乙 酯的?
O CH3-C-O-H
H-O-CH2-CH3
13
探究:乙 酸和乙 醇可能是以怎样的方式相互结合
形成乙酸乙 酯的?
酯化反应实质
14
O
CH3-C-OH + HO-CH2CH3
乙酸
乙醇
浓H2SO4 △
醋 “酉”加“廿一日”——
3
生活中常用的调味品食醋,它就是约含3%~5%的乙酸, 乙酸又称醋酸。它有什么样的结构?它都有那些性质呢?
4
一、乙酸的分子结构
分子式: C2H4O2结构式:
HO
H C C O羧基H H (—COOH)
O
结构简式:CH3COOH 或 CH3-COOH 或 CH3-C-OH
都是16O,二者在浓H2SO4作用 下发生反应,一段时间后,分子中含有18O的物
质有( C)
A.1种 B.2种 C.3 种 D.4种
生成物中水的相对分子质量为 20 。
25
乙酸是重要的化工原料
乙酸可以生产涂料
21
香料 染料 医药
乙酸的用途 有机化工原料
乙酸 农药
喷漆溶剂 醋酸纤维 合成纤维
课堂练习
1. 下列物质中可用来鉴别乙酸、乙醇、苯的是( C )
A.金属钠
B. 溴水
C. 碳酸钠溶液
D. 紫色石蕊试液
2. 分离乙醇和乙酸的方法最好的是( D )
A. 分液漏斗分液 B. 加入碳酸钠饱和溶液,通过分液分离 C. 加热蒸馏 D. 加入氢氧化钠后,蒸出乙醇,再加浓硫酸蒸 出乙酸
O CH3-C-O-CH2CH3 + H2O
乙酸乙酯
O CH3-C-O-CH2CH3
取代反应
15
思考:乙酸的化学性质与它的哪部分结构有关?
O 羧基
CH3—C—OH 官能团 -COOH
结论:乙酸的化学性质与羧基有关。
官能团:反映一类有机物的共同特征的基团。
乙烯 乙醇
碳碳双键 羟基 -OH
C=C
16
知识拓展:
厨师烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香 醇,特别鲜美。
这用化学知识能解释哦!
10
1、在试管中先加入3mL乙醇,再慢慢加入2mL浓硫酸,摇动试管混合均 匀,用手感觉温度变化。
2、再加入2mL冰醋酸,如图连好装置。接上导管到3mL饱和碳酸钠的液 面上(不接触液面)。
3、用酒精灯小心加热,观察现象。
5
二、乙酸的物理性质
颜色 : 气味 : 状态 : 溶解性 : 熔沸点 :
无色 强烈刺激性气味 常温下为液体
与水、酒精以任意比互溶 熔沸点较低,易挥发。熔点:16.6 0C,易 结成冰一样的晶体。(冰醋酸由此得名)
6
根据下列提供的药品,设计实验证明乙酸的酸性。 药品:镁带、NaOH溶液 、 Na2CO3粉末、乙酸溶液、 酚酞、石蕊。
