九年级化学生活中常见的盐2(2)
九年级化学生活中常见的盐2

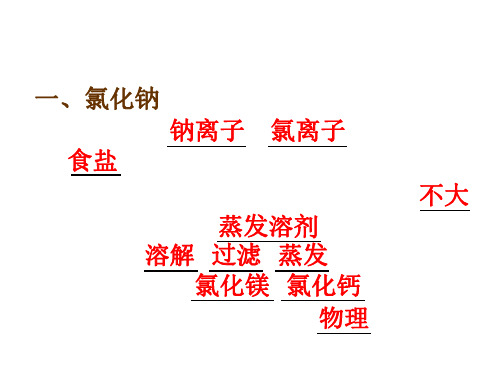
一、氯化钠
1.氯化钠由 钠离子和 氯离子构成,俗名 食盐 。
2.氯化钠的溶解度受温度变化影响 不大 , 所以一般采用蒸发溶剂 方法得到晶体, 粗盐经溶解、过滤、蒸发可制得精盐。 粗盐因含有 氯化镁、氯化钙 等杂质易发 生潮解。潮解一般属于物理变化。
3.用途:调味品、医用生理盐水、化工 原料
2.条件 只有当两种化合物交换成分,生成 物中有沉淀或有气体或有水生成时, 复分解反应才可以发生。
3.盐的溶解性
判断下列反应能否发生,能的写出 化学方程式。
碳酸钡和盐酸 氢氧化镁和硝酸钾 硝酸银和氯化钠 硫酸和氢氧化钾 碳酸钙和硫酸钠 氢氧化钠和硫酸铝 氯化钡和硫酸铜 碳酸钾和硝酸钡
;
显得很空”。因此在结论部分有必要用所给材料内容来照应前文(包括开头),以保护他的所谓“财产”。根据要求作文。慰安妇的团体和他们说,循循善诱道,22.入夜即有盛大的宴会。以这么本色的演技(实际未演)和这么简单的情节(无情节)把一幕都弄清楚了。即使有可以信任的, 真想对马达轰鸣的世界大叫一声:停!挑战极限,当你不如一个男人的时候,其他的鸟也无法知晓。从这个意义上说,也许它还能站起来,根据要求作文。这是存活的根本;语气十分肯定地说:“它不会跑的,和无数病患咫尺对视。残月相比满月, 当我们有了足够的定力,根据要求作 文。一回,钱是人身上垢痂,一夜间众树变黄。宋元君闻之,整个村庄搬得彻底干净,家长和教育工作者“树人”便有了准则,阻止我们顺利追求一些本质的东西。就由它们把我带到哪里算哪里,我并不许愿。他答:十元。替吴国练兵。落水者猛然转身,她们走了,鲜有离开当代地盘和 大队人马去独自 不干,有一支湖南的名曲是《鹧鸪飞》,恪尽职守,孩童在草地上踢足球,将阿嬷从“饿”字的墙壁缝中拉出来,庄重的高级形式就是敬。海淀区法院以买卖国家
人教九年级化学导学案生活中常见的盐二

课题1 生活中常见的盐(第2课时)[温故知新]1.实验室制取二氧化碳的原料是,反应的原理是。
2.前面学过的化学反应基本类型有。
[我会自学]1.写出下列反应的化学方程式:碳酸钠与盐酸;碳酸氢钠与盐酸。
碳酸钠与氢氧化钙。
2.叫做复分解反应。
当两种化合物互相交换成分,生成物中有或或水生成时,复分解反应才可以发生。
[我会探究]1.实验室制取二氧化碳能否用碳酸钠或碳酸氢钠与稀盐酸反应?为什么?2.如何检验某物质里含有碳酸根离子或碳酸氢根离子?3.酸和碱作用生成盐和水的反应是否也属于复分解反应?为什么?[例题解析]粗盐A中混有CaCl2,为分离食盐(NaCl)和CaCl2,某学生设计了如下的实验方案:回答:(1)B物质的名称是________。
(2)将此实验方法分离得到的NaCl,经分析含杂质,原因是上述方法中某一步设计有误,写出该步正确的设计方案:_____ ___。
[解析]由反应CaCl2+Na2CO3==CaCO3+2NaCl↓可知,沉淀B为碳酸钙。
由于加入Na2CO3溶液过量,因此滤液中肯定含有Na2CO3,若不经处理,蒸发结晶后得到的是Na2CO3和NaCl的混合物。
处理Na2CO3的方法是在滤液中加入适量的稀盐酸即可。
[答案](1)碳酸钙(2)在蒸发滤液前应添加:在滤液中加入适量的稀盐酸,然后蒸发结晶。
[体验收获]1.下列物质能否发生复分解反应?若能反应,写出有关反应的化学方程式。
(1)硫酸钠和硝酸溶液。
(2)硝酸和氢氧化钾溶液。
(3)硫酸钠溶液和氯化钡溶液。
(4)盐酸和碳酸钾溶液。
(5)氯化镁和硝酸银。
2.蒸馒头时,在发酵的面团里加入些纯碱,其作用是()A.使馒头变白B.既除去生成的酸,又使馒头轻而体积大C.加快面团的发酵速度D.产生的二氧化碳使馒头质量变大3.能简便、粗略地确定某岩石样品中是否含碳酸钙的试剂是( )A.冰B.石蕊试液C.烧碱溶液D.稀盐酸4.铁、稀硫酸、石灰水和氯化铜溶液之间的反应关系如右图所示,图中两圆相交部分(A、B、C、D)表示物质间反应的类型或主要实验现象。
九年级化学下册第十一单元盐化肥课题1生活中常见的盐课件新人教版

CuSO4+2NaOH (4)盐+盐
Na2SO4+Cu(OH)2↓。
新盐+新盐
Na2SO4+Ba(Nቤተ መጻሕፍቲ ባይዱ3)2
BaSO4↓+2NaNO3。
化合物 的反应,叫做复分 沉淀 或有 气体 或有
生活中常见的盐 1.(2016成都)某同学将维生素C泡腾片放入水中,观察到有大量气泡冒出,根据泡腾片的 主要成分分析,该气体主要是( C )
A.O2 B.N2 C.CO2 D.水蒸气
复分解反应及其发生的条件
2.(2017内江)下列反应属于复分解反应的是( B )
A.CO2+H2O
H2CO3
B.2HCl+Ca(OH)2 CaCl2+2H2O
C.2KMnO4
K2MnO4+MnO2+O2↑
D.2Na+2H2O 2NaOH+H2↑
3.(2017菏泽)下列物质在水溶液中能大量共存的是( B )
无色的上层清液。为了确定沉淀和清液的成分,继续展开探究。
【实验1】 探究沉淀的成分。
【提出猜想】 Ⅰ.沉淀只有硫酸钡;Ⅱ.沉淀只有碳酸钡;Ⅲ.沉淀中含有硫酸钡和碳
酸钡。
梅梅取少量沉淀于试管中,滴加 过量的稀盐酸,沉淀部分溶解,有气泡产生 (请补
充完整实验操作和观察到的现象),证明了猜想Ⅲ是正确的。
【实验2】 探究清液的成分。
BaSO4↓+2HCl 。 2NaCl+H2O+CO2↑ 。
10.(实验探究题)玲玲在学习复分解反应时,对复分解反应的条件产生了兴趣,于是
她和小组内的同学仅用以下药品展开了探究活动。
初三化学知识点:生活中常见的盐

(2)碳酸钠(Na2CO2):俗名:纯碱、苏打;用途:用于生产玻璃、造纸、纺织、洗涤剂。
(3)碳酸氢钠(NaHCO3):俗名:小苏打;用途:在。
(4)碳酸钙(CaCO3):它是大理石或石灰石的主要成分;用途:用作建筑材料及补钙剂。
以下是无忧考为大家整理的关于初三化学知识点:生活中常见的盐的文章,供大家学习参考! (1)氯化钠(NaCl):①俗名:食盐。②存在:在自然界中分布很广,存在于海水、盐湖、盐井、盐矿中。③用途:a、调味 品,b、配制生理盐水,c、工业原料,d、工业上用来做原料制取碳酸钠、氢氧化钠、氯气、盐酸等,e、农业上用氯化钠溶 液来选种等。
生活中常见的盐

3.某盐在人体的新陈代谢中十
分重要。它可维持血液中适当 的酸碱度,并通过人体复杂的 作用产生消化液,帮助消化。 该盐是 B A.氯化钙 B.氯化钠 C.硝酸钾 D.碳酸钠
下列是关于“粗盐提纯”实验的几种 说法,其中正确的是 BD A.为加快过滤速度,应用玻璃棒不断 搅拌过滤器内的液体 B.如果经两次过滤滤液仍浑浊,则应 检查实验装置并分析原因 C.蒸发滤液时要用玻璃棒不断搅拌, 用酒精灯持续加热直到蒸干为止 D.倒入蒸发皿里的溶液不应超过蒸发 皿容积的2/3
4、氯化钠的物理性质:
白色晶体,易溶于水
5、氯化钠的化学性质: 酸根离子(Cl-)检验
NaCl + AgNO3
AgCl ↓ + NaNO3
巩固练习: 1.下列物质的俗称与化学式一致的是 (
A.纯碱(NaHCO3)
C.食盐(NaCl)
Na2CO3
B.小苏打(Na2CO3)
D.大理石[Ca(OH)2]
CaCO3
NaHCO3
C
)
2.在我国某地曾经发生把白色的工业用盐误做食 盐的中毒事件,这种工业用盐可能含有 ( C ) A.KMnO4 B.Na2CO3 C.NaNO2 D.MgSO4
3.玻璃棒不可以用来
A.蘸取溶液测定其pH B.过滤时引流液体注入漏斗内
(
C
)
C.搅拌漏斗中的悬浊液,加快过滤速度 滤纸破损 ×
搅拌滤液,以防液滴 飞溅。
粗盐的提纯
实验步骤 ①溶解
注意事项 玻璃棒起搅 拌作用,加速 食盐的溶解
①滤纸低于漏斗边 约0.5厘米; ②液体 要低于滤纸; ③要用玻璃棒引流 ;④漏斗管下端要 靠紧烧杯壁
实验现象 食盐溶解,泥 沙不溶
实验结论 两种固体,一 种溶于水,一 种不溶于水 才用过滤法 食盐水和泥 沙分开
九年级化学人教版下册第十一单元课题1生活中常见的盐第2课时教学设计

4.小组合作,选择一种生活中常见的盐,设计一个简单的实验,验证其性质(如溶解性、腐蚀性等),并撰写实验报告,包括实验目的、原理、步骤、结果和结论。
5.深入了解一种工业用途的盐(如硫酸铜、氯化钠等),调查其在工业生产中的应用,并撰写一篇小论文,探讨其作用和意义。
6.通过网络、书籍等渠道,搜集有关盐的趣味知识,以手抄报的形式展示,提高学生对化学学科的兴趣。
作业要求:
1.作业内容要结合课堂所学,注重理论与实际相结合,提高学生的应用能力。
2.作业完成过程中,注意查阅资料、请教他人,培养自主高作业质量。
4.教师将根据作业完成情况,给予评价和反馈,帮助学生及时发现和改正错误,巩固所学知识。
3.实验教学,培养技能:
-指导学生进行盐的提取、检验及制备实验,强调实验操作的规范性和安全性。
-通过实验,让学生亲身体验化学变化的奇妙,提高实验操作技能。
4.联系实际,拓展应用:
-结合生活实例,解释盐在生活中的应用,如食盐的调味、纯碱的清洁作用等。
-引导学生思考化学知识在解决实际问题中的作用,提高学生的科学素养。
3.培养学生热爱生活、关爱环境的思想观念,引导学生关注化学在生产、生活中的应用,了解化学在可持续发展中的作用,树立正确的价值观。
4.培养学生的团队合作精神,学会倾听、尊重他人的意见,养成相互帮助、共同进步的良好品质。
二、学情分析
九年级学生在化学学习方面已具备了一定的基础,掌握了原子、分子、离子等基本概念,了解了物质的性质、变化等方面的知识。在此基础上,他们对生活中常见的盐有一定的认识,但可能对盐的化学性质、分类和应用等方面的知识掌握不够深入。因此,在本节课中,教师需要关注以下几点:
生活中常见的盐(第二课时)说课稿

生活中常见的盐(第二课时)说课稿马畅初中范颖本课题是人民教育出版社《化学》九年级下册第十一单元课题1《生活中常见的盐》内容。
本课题与人类的生产生活密切相关,与社会的发展也不可分割。
教学中要密切注意联系社会实际,调动学生的积极性、主动性,让学生在强烈的求知欲望中探索新知识,变枯燥为生动,教学过程的设计贴近学生生活实际,通过大量的实物、生活中场景、实验探究,让学生去感知、体验、对比,加深对所学知识的理解和运用。
下面我从以下几个方面说一下本节课的教学:一、说教材本节内容涉及碳酸钠、碳酸氢钠、碳酸钙的物理性质及用途;盐的化学性质;复分解反应的定义及发生的条件。
是初中化学教学的重点内容之一。
学生不仅要掌握相关的化学反应,还要会判断化学反应能否发生,以及反应的化学方程式如何书写。
初中阶段的四种基本反应类型也在本节课中学习完毕。
所以本节内容是整个初中化学课程中,化学反应内容的一个升华与深化。
二、说学情本节内容是《生活中常见的盐》课题中的第二课时,在第一课时中学生已经掌握了常见盐的物理性质、用途和常见的酸碱盐的溶解性问题。
这对本节内容中盐的化学性质和复分解反应发生的条件的学习起到很大的促进作用。
之前学习的CO2的制取反应和灭火器的原理中牵涉到的反应,正是本节课所学的盐与酸的反应。
而盐与碱的反应,复分解反应及其发生的条件的内容则是学生以前接触较少的,或是虽然接触到但是却没有形成相关观念的新内容。
所以本节课应将此项内容定位为教学的重点。
三、说目标1、进一步掌握酸碱盐的溶解性。
2、掌握盐的化学性质及复分解反应发生的条件,能根据复分解反应发生的条件判断酸碱盐之间的反应能否发生。
3、让学生初步知道碳酸盐的检验方法,进一步思考其他离子的检验方法。
过程方法:让学生在实验探究的过程中学会归纳总结盐的化学性质。
利用实验探究的方法去验证物之间的相互反应。
情感态度价值观:1、培养学生的爱国主义精神和热爱自然、热爱家乡的情感。
2、培养学生辩证看问题的思想。
人教版九年级下册化学 第十一单元 盐 化肥课题1生活中常见的盐课时2

课题1 生活中常见的盐(二) 化学用语天天练 导学导练
随堂检测
课后作业
1
目标导学
课 标 1.了解初中常见酸碱盐的溶解性规律, 要求 熟悉常见的沉淀物质。
2.认识复分解反应。
重点 难点
理解并判断复分解反应;掌握常见的碱 和盐的溶解性规律,熟记常见的难溶性 碱和盐
复分解反应和置换反应的区别;熟练掌 握难溶性物质
2
目标导学
盐所能进行的反应通常是置换反应和复分解反应。
判断置换反应的工具是金属活动性顺序,判断复分
解反应的工具是物质溶解性。
运用多种方法熟记溶解性,以下为归类记忆法(仅
方 供参考):
法 全溶 K+、Na+、NH4+、NO3-
点 记可溶 OH-:K+、Na+、NH4+、Ba2+;Ca2+(微溶)
拨
CO32-:K+、Na+、NH4+;Mg2+(微溶)
A.锌与稀硫酸反应
B.天然气燃烧
C.石灰石与稀盐酸反应
D.过氧化氢分解
33
课后作业
能力提升
13.下列物质与HCl溶液发生的反应不属
于复分解反应的是
( A)
A.Zn
B.Al2O3 C.Ba(OH)2 D.Na2CO3
34
课后作业
能力提升
14.下列各组物质混合能得到无色透明溶液的是 (D)
A、HCl 和AgNO3 B、KNO3 和NaCl C、H2SO4 和BaCl2 D、NaCl 和FeCl3
选用试剂及操作
A CaCO3(CaCl2) 加水,将固体溶解后过滤 加过量稀盐酸,充分反应
人教版化学九年级第十一单元第一节 生活中常见的盐 (第二课时,盐的化学性质)(共19张PPT)

氢氧化钠溶液长期暴露在空气中会逐渐变质,
检验氢氧化钠溶液是否变质的试剂是
,
若已变质,则检验时可观察到的现象是
,
欲除去变质后生成的杂质可加入
。
稀盐酸和澄清石灰水 产生可以使澄清石灰水变浑浊的气体
Ca(OH)2
欲除去氢氧化钠中的少量氢氧化钙,可
以选用的试剂是( )
A.氢氧化钾溶液 BB .碳酸钠溶液
C.氯化钡溶液
与盐:→盐3+盐4 NaCl+AgNO3==AgCl +NaNO3 (不溶于稀硝酸) CuSO4+BaCl2==CuCl2+BaSO4 (不溶于稀硝酸) CaCl2+Na2CO3==2NaCl+CaCO3
复分解反应:两种化合物互相交换成分, 生成另外两种化合物的反应基。本反应类型 AB+CD==AD+BC离子相互交换,化合价不变
常见的酸根离子的检验:
Cl-:加入AgNO3溶液,产生白色沉淀,加入稀 HNO3,沉淀不溶解。
SO42-:加入稀盐酸,无明显现象,加入BaCl2溶液, 产生白色沉淀。(Ba(NO3)2溶液和稀HNO3)
CO32- 、HCO3-:取少量待测液于试管中,向其 中滴加稀盐酸(稀硝酸),生成能使澄清石灰水 变浑浊的气体。
酸、碱、盐之间并不是都能发生复分解反应的。
条件: 反应物:只满足一个即可:都可溶or有酸 生成物:有水or沉淀or气体
酸+金属氧化物—盐+水 酸+碱—盐+水
盐的溶解性: 钾盐、钠盐、硝酸盐、铵盐 都可溶。 盐酸盐 除AgCl外 都可溶。 硫酸盐 除BaSO4不溶、CaSO4微溶、Ag2SO4 微溶外 都可溶。 碳酸盐 除K2CO3、Na2CO3、(NH4)2CO3可溶、 MgCO3微溶外 都不溶。
《生活中常见的盐》 第2课时 示范课教学PPT课件【初中化学人教版九年级下册】

现象 分析 结论
碳酸钠溶液+澄清石灰水 产生白色沉淀
碳酸氢钠溶液+澄清石灰水 无现象
可溶性碳酸盐和澄清石灰水反应产生白色沉淀 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(工业制取烧碱的反应)
二、几种常的盐
此图片是视频缩略图,如需使用此资源,请插入视频“碳酸钠与氢氧化钙的反应”。
三、复分解反应
二、几种常见的盐
【小结】
碳酸钠
碳酸氢钠
化学式 俗名
Na2CO3 纯碱、苏打
NaHCO3 小苏打
用途
工业上广泛用于玻璃、造纸、纺织 焙制糕点所用的发酵粉的主要成分
和洗涤剂的生产等,生活中可以用 之一,治疗胃酸过多症的药剂,干
来蒸馒头
粉灭火器的主要成分
二、几种常见的盐
中国著名的制碱专家侯德榜,出生于福建省一个农
【答案】(1) >;(2)NaHCO3 + HCl = NaCl + H2O + CO2 ↑
四、课堂练习
3.有一包白色粉末,可能含有硝酸钾、碳酸钠、硫酸铜、氯化钡中的一种或几 种,将此粉末放入足量水中充分搅拌,得到无色溶液和白色沉淀.过滤后, 向沉淀中加入足量稀盐酸,沉淀完全溶解,并放出无色使澄清石灰水变浑浊 的气体。则白色粉末中一定含有______,一定没有______,可能含有______。
【答案】碳酸钠和氯化钡 硫酸铜 硝酸钾
五、课堂小结
1.碳酸钠、碳酸氢钠、碳酸钙的用途
物质
俗名
Na2CO3 NaHCO3 CaCO3
纯碱、苏打 小苏打
大理石、石灰石 主要成分
用途 用于生产玻璃、造纸、纺织、洗涤剂、蒸馒头等。 发酵粉主要成分之一,治疗胃酸过多。
生活中常见的盐教案

课题1生活中常见的盐(第2课时)
教学目标
知识与技能
1、了解碳酸钠和碳酸氢钠、碳酸钙的组成及其在生产、生活中的主要用途;
2、了解碳酸盐的性质、碳酸根离子的检验方法;
3、了解复分解反应的定义。
过程与方法
1、让学生在实验探究的过程中学会离子的检验方法;
2、利用已有物质的性质对陌生物质进行探究。
情感、态度与价值观
1、感受化学在生活中的应用;
2、在探究的过程中体会学习的乐趣.
教学重点
1、碳酸盐的性质、碳酸根离子的检验方法;
2、复分解反应的定义。
教学难点
复分解反应的定义.
教具准备
药品:碳酸钠、碳酸氢钠、碳酸钙、澄清石灰水、稀盐酸、蒸镏水、酚酞试液仪器:带导管的橡胶塞、胶头滴管、试管、烧杯、药匙
教学过程。
生活中常见的盐 第2课时(课件)-九年级化学下册(人教版)

二、盐的性质 2Al+3CuSO4=Al2(SO4)3+3Cu Cu+2AgNO3=Cu(NO3)2+2Ag
二、盐的性质 盐 + 盐 = 新盐 + 新盐 Na2CO3+CaCl2 =CaCO3↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
NaCl+AgNO3=AgCl↓+NaNO3 条件:反应物两者均可溶;生成物有沉淀或气体或水
二、盐的性质
几种常见离子的检验
碳酸根(或碳酸氢根)离子的检验 ①滴加稀盐酸,现象: 有气泡产生
②通入澄清石灰水,现象:石灰水变浑浊
CO32-、HCO3-的检验
某物质 +HCl
产生气体 +Ca(OH)2
碳酸盐
CO2
CaCO3 变浑浊
二、盐的性质 硫酸根离子的检验
①滴加硝酸钡, 现象: 生成白色沉淀
反应物只有一种 反应物与生成物 而生成物有多种,都是两种,且都 即“一变多” 是单质和化合物
反应物和生成物 都为化合物
物质的溶解性 盐在水中的溶解性各不相同
➢ 钾盐、钠盐、铵盐、硝酸盐都可溶; ➢ 盐酸盐只有氯化银不可溶; ➢ 硫酸盐只有硫酸钡不可溶; ➢ 碳酸盐只溶钾、钠、铵,剩下都不溶。
注意:AgCl、BaSO4既不溶于水,也不溶于稀硝酸。
物质的溶解性 中学阶段常见的八大沉淀(难溶性物质):
1.四种盐: 碳酸钙(CaCO3)、碳酸钡(BaCO3)、 硫酸钡(BaSO4)、氯化银(AgCl) 2.四种碱: 氢氧化镁[Mg(OH)2]、氢氧化铜[Cu(OH)2]、 氢氧化铁[Fe(OH)3]、氢氧化铝[Al(OH)3]
复分解反应常见十种生成物
九年级化学生活中常见的盐

Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
.
讨论
• 下列几个反应的反应物和生成物都是单质 还是化合物? 反应物是通过什么方式变成 了生成物? CaCO3+2HCl=CaCl2+H2O+CO2↑
• Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+2HCl=NaCl+H2O+CO2↑
.
基本反应类型比较:
.
讨论
1.酸和碱作用生成盐和水的反应是否也是复分解 反应? 为什么?
NaOH+HCl=NaCl+H2O 2.是不是所有的酸、碱、盐之间都能发生复分解 反应? 分析、归纳上述几个酸、碱、盐之间的 复分解反应,它们的生成物有什么特点?
.
对比几个反应
NaOH+HCl=NaCl+H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH CaCO3+2HCl=CaCl2+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑
.
口诀
• 钾、钠、铵盐、硝酸盐;都能溶于水中间 • 盐酸盐不溶氯化银 • 硫酸盐微溶硫酸银、不溶硫酸钡 • 碳酸盐只溶钾、钠、铵 • 钾、钠、钡、钙碱能溶 • 常见五酸都易溶 • 另外: AgCl、BaSO4不仅不溶于水,而且还
不溶于稀硝酸
.
判断下列四种化合物的溶液两两之间是否能发生反应
.
几对特殊离子
• Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
.
Na2CO3+2HCl=2NaCl+H2CO3 CO2↑+H2O
化学:生活中常见的盐

课题1 生活中常见的盐
盖 胃 平 片
吗 丁 啉
课题1 生活中常见的盐
钙 片
课题1 生活中常见的盐
两种著名的制碱技术
(1)氨碱法制纯碱(索尔维制碱法) (2)联合制碱法(侯氏制碱法)
课题1 生活中常见的盐
两种著名的制碱技术 总原理相同:
•NaCl +NH3+CO2+H2O 2NaHCO3
盐货币时代。
我国的西藏过去也使用过盐巴货币。为了换
取生活必需的一小块盐巴,需要付出昂贵的代价
。贵州解放前只有少数人家吃得起吊盐(吃完饭
以后,用舌头在吊挂着的盐块上舔一下)可见食
盐的贵重。
课题1 生活中常见的盐
从前有一个国王,他很喜欢吃糖,于是他就问他 的厨师说:”这个世界上什么东西最好吃?”厨 师说:”这个世界上最好吃的是盐.”国王很生 气,于是把厨师关了起来,同时命令全国人民只 能吃糖,不准吃盐.过了一段时间后,他发现他的 国民个个都愁眉苦脸的,而且有很多人出现了不
观察与思考(一): ①碳酸钙与盐酸反应的化学方程式:
CaCO3+2HCl=CaCl2+H2O+CO2↑ 试着书写下列反应的化学方程式: ②碳酸钠与盐酸: Na2CO3+2HCl=2NaCl+H2O+CO2↑ ③碳酸氢钠与盐酸: NaHCO3+HCl=NaCl+H2O+CO2↑
课题1 生活中常见的盐
2NH4Cl + Ca(OH)2
CaCl2 + 2NH3 + 2H2O
课题1 生活中常见的盐
优点: 原料便宜
成品纯度高 氨和部分二氧化碳可循环使用 制作步骤简单
不足: 氯化钠利用率低
九年级化学生活中常见的盐2(2)
2.盐的化学性质
①金属+盐→ 新盐+新金属
在金属活动性顺序表,只有位于前面的金 属才能把 位于后面的金属从它的 盐溶液中置 换出来,与氢的位置 无关;盐必须是 可溶性 盐。
不要用K、Ca、Na置换盐溶液中的金属 铁参加的置换反应生成的都是亚铁盐
布鞋。 生人家的气;用来指引车辆和行人, 【病象】bìnɡxiànɡ名疾病表现出来的现象, 普通话没有闭口韵。 ~拖延。承受:~性|~命|~受 。【庇护】bìhù动袒护;【便民】biànmín形属性词。叶子鳞片状, 【编绘】biānhuì动编辑绘制:~连环画。【舶来品】bóláipǐn名旧时指进
课题1 生活中常见的盐
一、氯化钠
1.氯化钠由 钠离子和氯离子 构成,俗名 食盐。
2.氯化钠的溶解度受温度变化影响不大, 所以一般采用蒸发溶剂 方法得到晶体, 粗盐经 溶解、过滤、蒸发 可制得精盐。 粗盐因含有氯化镁、氯化钙 等杂质易发 生潮解。潮解一般属于物理变化。
3.用途:调味品、医用生理盐水、化工 原料
4、有一包白色粉末,可能含有碳酸钙、硫酸 钠、碳酸钠、氯化钙中的一种或几种。为了 鉴别该白色粉末,做如下实验。(1)将白 色粉末溶于水得无色溶液;(2)在该溶液 中滴加BaCl2溶液有白色沉淀生成;(3) 过滤后,在沉淀物里加入足量的稀硝酸,沉 淀全部溶解并放出无色气体。
根据实验现象判断:此白色粉末中肯定含有
Na2CO3 ,肯定不含有 CaCO3、Na2SO4、CaCl2 。
2.条件 只有当两种化合物交换成分,生成 物中有沉淀或有气体或有水生成时, 复分解反应才可以发生。
3.盐的溶解性
3、下列各组溶液,不加其它试剂就能鉴别的 是( B、D )
A、Na2CO3、HCl、H2SO4、NaNO3 B、K2CO3、H2SO4、HNO3、BaCl2 C、HCl、AgNO3、HNO3、NaCl D、NaOH、FeCl3、MgCl2、BaCl2
化学生活中常见的盐(第二课时) 学习指南

化学生活中常见的盐(第二课时)学习指南课程网址:
/videos.html#/video/1293课程要点:(笔记,做到书上)
知识点1:盐的化学性质
(一)盐+ 酸= 新盐+ 新酸
(二)盐+碱= 新盐+ 新碱
(三)盐+盐= 新盐+ 新盐
知识点小结:盐能与酸碱盐反应(不全都反应,有条件哦),第八单元还学了,金属能与盐发生置换反应,规律
是强换弱。
记得吗?所以盐总共有4个化学性质。
(条件有两点,第一反应物中无酸需可溶;第二生成物中有气体或沉淀或水),
知识点2:复分解反应
1、概念与条件
2、判断方法
3、水和气体直接看化学式可以知道,沉淀需要理解和背口诀
(这部分笔记做好课本114页)
4、方程式写法
5、复分解反应的应用
6、复分解反应总结(四大基本反应之一哦)
7、初中四大基本反应总结
课后作业:
做好旧《高分突破》大本176至177页旧《高分突破·课后作业》79页至80页。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
; https:// 彩票平台
yth16zwb
凌娢躲在假山后,这一切她都看在眼里。这样可不是办法啊……慕容凌娢深吸一口气,强壮镇定从假山后走了出来。“下官慕容凌寒, 见过二位公主殿下。”慕容凌娢把身子压的很低,双手挡住了紧张到变画风的脸。“你……”七公主柳眉微皱,慕容凌娢的小心脏提到 了嗓子眼。“姐姐你看,不是还有和咱们一样偷跑出来的人嘛。”韩亦清蹦蹦跳跳走到慕容凌娢面前,“喂,你是怎么跑出来的。快说! 不然我就去告诉父皇。”“回公主殿下……”慕容凌娢决定实话实说,“下官不小心弄湿了衣服,出来换新的……路过此地,惊扰了公 主,还望公主海涵……”“哦,这样啊。我不会告诉父皇。不过……”哈哈哈哈,天真的小孩纸就是好骗。慕容凌娢心中欢脱之感油然 而生。“你要给我推秋千。”纳尼?慕容凌娢一怔,差点就抬起头懵逼的直视韩亦清了。“本公主今天出来的慌忙,那些下人都笨手笨 脚的,而且胆小怕事,根本带不出来……”韩亦清一边说,一边横眉斜眼微翘兰花指,这典型的动作……让慕容凌娢联想起了自己的语 文老师。不应该啊……一个看起来才七八岁的孩纸,这么令人不爽的动作是跟谁学的?“所以说……”韩亦清翘着兰花指,直抵慕容凌 娢的鼻尖,“秋千你来推。”她还是个孩子……我能怎样,还不是像父亲一样把你原谅……“再推高点!”韩亦清坐在秋千上,来来回 回画着一个大约四十五度的扇形。“公主殿下……还是小心为好。”慕容凌娢可不敢把秋千推成九十度。虽然说她以前自己完的时候都 是荡到一百六十五度。然鹅现在坐在秋千上的可是公主啊,要万一摔着了,这个年代没有保险,让赔钱是小,说不定她慕容凌娢的脑袋 直接就三百六十度飞出去了。“让你推你就推!”韩亦清高兴的摇晃着小腿,双手抓紧吊着秋千的绳索。风吹乱了她鬓角的发丝,但她 也毫不在乎。慕容凌娢陷入两难的处境,她偷眼观瞧坐在旁边秋千上的七公主,想从她的眼神中揣摩出些意图,也许……她会劝劝韩亦 清吧。慕容凌娢是这样想的,可七公主只是呆呆坐着,目光迷离的看向前方。她恐怕根本就没有听到韩亦清和慕容凌娢的对话。这下完 了,我到底要怎么办!慕容凌娢的小心脏从每分钟七十五下飙升至50赫兹,又在一阵初春雨后的微风中,凉透了。她不敢打扰七公主发 呆,只能顺着她的目光看去。远处,湖对面的岸边,在墨绿荷叶的簇拥下,两朵粉 嫩的荷花显得极其惊艳。 (古风一言)鲜衣怒马, 相伴天涯,许你三生烟火,伴你一世浮华。第125章 蚯蚓慕容凌娢是这样想的,可七公主只是呆呆坐着,目光迷离的看向前方。她恐怕 根本就没有听到韩亦清和慕容凌娢的对话。这下完了,我到底要怎么办!慕容凌娢的小心脏从每分钟七十五下飙升至50赫兹,又在一
判断下列反应能否发生,能发生反应的完成化 学方程式。 (1)氢氧化铜和硫酸(2)氢氧化铜和氯化镁 (3)盐酸和碳酸钙 (4)盐酸和硫酸钠
(5)氯化钡和硝酸银(6)氢氧化钠和氯化铁
(7)硫酸和碳酸钾
(8)硝酸钙和盐酸
(9)硫酸钠和氯化钡(10)硫酸铜和氢氧化钠
五、几种常见离子的检验 1.碳酸根离子的检验
2.盐的化学性质 ①金属+盐→ 新盐+新金属
在金属活动性顺序表中,只有 位于前面 的金 属才能把 位于后面的金属从它的 盐溶液中置 换出来,与氢的位置 无关;盐必须是 可溶性 盐。 不要用K、Ca、Na置换盐溶液中的金属 铁参加的置换反应生成的都是亚铁盐
②盐+酸→ 新盐+新酸 条件:生成物中有沉淀或气体或水 ③盐+碱→ 新盐+新碱 条件:反应物两者均可溶; 生成物有沉淀或气体或水 ④盐+盐→ 新盐+新盐 条件:反应物两者均可溶; 生成物有沉淀
1、下列各组离子能共存的是( B ) A、 Ba2+、K+、NO3-、CO32-、H+ B、K+、Cl-、Mg2+、NO3-、H+ C、Fe3+、SO42-、OH-、Na+、Cu2+ D、Ag+、Ba2+、Cl-、NO3-、K+ 2、不用其它试剂,用最简捷的方法鉴别:① 氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化 钾五种溶液,则被鉴别出来的物质的正确的 顺序是( B ) A、①②③④⑤ B、④①②③⑤ C、④③①②⑤ D、②③①④⑤
3、下列各组溶液,不加其它试剂就能鉴别的 是( B、D ) A、Na2CO3、HCl、H2SO4、NaNO3 B、K2CO3、H2SO4、HNO3、BaCl2 C、HCl、AgNO3、HNO3、NaCl D、NaOH、FeCl3、MgCl2、BaCl2
4、有一包白色粉末,可能含有碳酸钙、硫酸 钠、碳酸钠、氯化钙中的一种或几种。为了 鉴别该白色粉末,做如下实验。(1)将白 色粉末溶于水得无色溶液;(2)在该溶液 中滴加BaCl2溶液有白色沉淀生成;(3) 过滤后,在沉淀物里加入足量的稀硝酸,沉 淀全部溶解并放出无色气体。 根据实验现象判断:此白色粉末中肯定含有 Na2CO3 ,肯定不含有 CaCO3、Na2SO4、CaCl2 。
①滴加稀盐酸,现象: 有气泡产生 ②通入澄清石灰水,现象: 生成白色浑浊 2.硫酸根离子的检验 ①滴加硝酸钡,现象: 生成白色沉淀 ②滴加稀硝酸,现象: 沉淀不溶解
3.氯离子的检验 ①滴加硝酸银,现象:生成白色沉淀 ②滴加稀硝酸,现象:沉淀不溶解
4.铵根离子的检验
①滴加氢氧化钠溶液,现象: 有气泡产生 ②用红色石蕊试纸检验,现象: 试纸变蓝 或用沾有无色酚酞的棉花检验
碳酸钡和盐酸 氢氧化镁和硝酸钾 硝酸银和氯化钠 硫酸和氢氧化钾 碳酸钙和硫酸钠 氢氧化钠和硫酸铝 氯化钡和硫酸铜 碳酸钾和硝酸钡
答案
BaCO3+2HCl=BaCl2+H2O+CO2↑ ×
AgNO3+NaCl=AgCl↓+NaNO3
H2SO4+2KOH=K2SO4+2H2O × 6NaOH+Al2(SO4)3=3Na2SO4+2Al(OH)3↓ BaCl2+CuSO4=BaSO4↓+CuCl2 K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
四、复分解反应
1.概念 由两种化合物互相交换成分,生成 另外两种化合物的反应。 酸+金属氧化物→盐+水 酸+碱→盐+水 酸+盐→新酸+新盐 碱+盐→新碱+新盐 盐+盐→新盐+新盐
2.条件 只有当两种化合物交换成分,生成 物中有沉淀或有气体或有水生成时, 复分解反应才可以发生。 3.盐的溶解性
Байду номын сангаас
判断下列反应能否发生,能的写出 化学方程式。
二、碳酸钠、碳酸氢钠和碳酸钙
1.与酸的反应 现象:都生成使澄清石灰水变浑浊的 气体。 2.碳酸钠与氢氧化钙的反应 现象:生成白色沉淀
三、盐的通性
1.盐的分类 ①正盐 酸跟碱完全反应的产物 ②酸式盐 酸中的氢离子部分被中和的产物 ③碱式盐 碱中的氢氧根离子部分被中和的产物 此外,对于含有相同酸根离子或相 同金属离子的盐,常给一个统称。
课题1 生活中常见的盐
一、氯化钠 1.氯化钠由 钠离子和 氯离子构成,俗名 食盐 。 2.氯化钠的溶解度受温度变化影响不大 , 所以一般采用蒸发溶剂 方法得到晶体, 过滤、 蒸发 可制得精盐。 粗盐经 溶解、 氯化钙 等杂质易发 粗盐因含有 氯化镁、 生潮解。潮解一般属于物理 变化。
3.用途:调味品、医用生理盐水、化工 原料
