6-1 炔烃
炔烃

(S)-7-甲基环辛烯-3-炔 (S)-7-methylcycloocten-3-yne
4,8-壬二烯-1-炔
4,8-nonadien-1-yne
6.2
炔烃的结构
炔烃的结构特征是分子中含有“ C≡C ”,它与 “ C=C ”一样是由键和键构成,下面以乙炔为 例说明叁键的形成及结构,乙炔为一直线型分子, 全部四个原子在同一直线上,在乙炔分子中 0.1061nm
R
X2
R
C
CH
Cl2
X2
R
CHCl2
C X
CH X CHCl2
HC
CH
黑暗
CHCl
CHCl
黑暗
这一反应如在光照的情况下,反应剧烈并爆炸。 所以盛乙炔气、氯气的钢瓶要分开存放,以确保 安全。炔烃和溴也可以发生类似反应,反应现象 为Br2的红棕色褪去,故可用于炔烃的鉴别。
炔烃 26
有机化学
加 X2
HC
C2H5NH2
蓝色溶液
*2 反应体系不能有水,因为钠与水会发生反应。
*3 与制NaNH2的区别 Na + NH3 (液)
Fe3+
NaNH2
炔烃的加氢和还原
H2/Ni, or Pd, or Pt H2/ Pd-CaCO3 or Pd-BaSO4 orNiB
RCH2CH2R’
R H R H
C C
C C
R' (>90%) H R' H
R-CC-R’
硼氢化
RCOOH ~0oC
R H R H
C C
H R' H R'
(90%)
Na, NH3
(82%)
Chapter 6-1 芳烃

间二硝基苯88%
CH3 NO2 CH3
混酸 60℃
CH3 NO2 混酸 NO2
CH3 NO2
混酸 30℃
CH3
混酸
60℃
NO2 NO2
110℃
NO2
2,4,6-三硝基甲苯 (TNT)
氯 苯 硝 化 比 苯 难
主 要 得 邻、对 位 产 物
硝 化 反 应 历 程
先 加 成
后 消 除
硝化反应的应用
H H H H H H
凯 库 勒 结 构 式: 1. 满足碳原子 四价 2.合理地解释了 一取代苯环只 有一个化合物
不能解释:
H H H H H H
1、三个双键不易 加 成和不易氧化
2、单双键相间 但键长完全相等 3、邻位取代产物 只有一种
价键法及分子轨道法对苯结构的研究
近代红外光谱和X-衍射研究证明
如何鉴别苯和环己烷?
硝化反应小结
卤化反应由NO2+进攻苯环而引起, 先加成,后消除,是亲电取代反应!
混酸通常指浓硝酸和硫酸以1:2比例 混合得到的,硫酸的作用是脱水产生 NO2+
1.请查一下苯酚的硝化 反应; 2. 思考一下为什么未列 出苯胺
(3)磺 化 反 应 (E+ = SO3 )
? 怎样利用这一亲电取代反应构建碳碳键
使用C+ (Cδ+)的E+ 已经学习 碳正离子
思考:到目前为止我们学习哪些反应是经过 碳正离子历程的? 碳正离子重要性质是什么? 产生碳正离子有哪些的反应?
使用C+ (Cδ+)的E+
扩展出
醛
?
酮
使用C+ (Cδ+)的E+
炔烃的生成

炔烃的生成
炔烃可以通过以下三种方法生成:
1.烷基酰基分解法:用酸或者烷基过氧化物等作为催化剂,将酰基基团从4(或者6)碳的酰下双键烷上脱离,从而得到炔烃。
例如,正丁烷在存在溴酸,硫酸或双(过氧化丁)酸钾的情况下,可以生成丁炔。
2.卤代烃脱去α-氢原子法:用碱金属或其化合物(如金属钠)作为催化剂,将卤代烃中的α-氢原子去除,生成炔烃。
例如,将溴乙烷在钠的存在下加热,可以得到丙炔。
3.酸催化裂解法:用浓酸(如浓硫酸)将分子量较大的有机化合物分解成较小分子量的化合物,其中包括炔烃。
例如,苯乙烯在浓硫酸的作用下可以裂解成乙炔和苯。
第六章炔烃

114第六章 炔烃分子中含有碳碳叁键的烃叫做炔烃。
碳碳叁键可位于碳链中的任意位置。
开链炔烃的分子通式为C n H 2n-2 。
碳碳叁键位于碳链一端的炔烃称之为单取代或末端炔烃。
6.1 炔烃的结构与烯烃的碳碳双键相比,炔烃的碳碳叁键经历了不同的杂化。
在此杂化过程中,碳的2s 轨道和三个2p 轨道中的一个进行杂化。
每个杂化轨道含有1/2 s 轨道和1/2 p 轨道的成分。
这些杂化轨道称之为sp 轨道。
由于sp 轨道的s 成分增加,乙炔中碳氢键的极性比乙烷和乙烯中的大很多。
乙烯的pK a 值大约在44,而乙炔的pK a 值大约在25,所以末端炔烃在一些特定的情况下,可以当成弱酸,尽管酸性甚至比水还弱很多。
碳碳叁键是两个sp 杂化的碳原子相互之间形成的。
碳原子中的两个sp 杂化轨道沿一轴线呈180 o 伸展 ,该轴线与非杂化的2p x 和2p y 轨道垂直。
当两个sp 杂化碳原子相互靠近时,sp-sp σ 键形成,于是每个碳原子其它两个p 轨道之间就以肩并肩方式重叠,形成两个相互垂直的π键,如图6.1所示。
因此,乙炔C 2H 2是一个线形分子,四个原子都排布在同一条直线上。
由于此线形特性,环状炔烃至少含有十个碳原子才能消除过多的张力。
此外,围绕炔烃叁键部分的电子云密度要比乙烷、乙烯大得多。
与烯烃类似,炔烃容易与亲电试剂相互作用。
(a)(b)图6.1 乙炔的模型(a )乙炔 sp 杂化示意图(b)乙炔的电子云结构模型乙炔碳碳叁键的长度为120pm,键能大约是836 kJ/mol,所以碳碳叁键是已知的键能最大,键长最短的碳碳键。
表格6.1 乙烷,乙烯,乙炔的共价键参数乙烷乙烯乙炔C-C 键键能(KJ) 368 607 836C-C 键长度(pm) 154 134 120C-H 键键能(KJ) 410 444 506C-H键长度(pm) 110 108 106 很明显可以看出(836-368) 并不是(607-368)的两倍,而且实验结果表明,要打开乙炔中的π键需要大约318 KJ/mol的能量,而对于乙烯需要268KJ/mol,所以我们可以得到结论,炔烃与亲电试剂的反应比烯烃与亲电试剂的反应要迟钝。
炔烃和二烯烃习题及解答

第三章炔烃和二烯烃习题及解答3. CH3CH2CH=C _C三C CH3C H 2CH3CH 3 CH 34. CH3C_C 三C_C H CH 35. CH2=CHCH=CH _C三CH6. CH 3CH=CH -C三C_ C 三CHC H 3辛烯-6-炔9. (Z,Z)-2,4- 庚二烯;10. 3,5- 二甲基-4-己烯-1-炔二、写出下列化合物的结构1.丙烯基乙炔;2.环戊基乙炔;3.(E)-2- 庚烯-4-炔;4. 3- 乙基-4-己烯-1-炔5. (Z)-3-甲基-4-乙基-1,3-己二烯-1-炔;6 . 1-己烯-5-炔;7 . (Z ,E)-6- 甲基-2,5-辛二烯;& 3-甲基-3-戊烯-1-炔;9 .甲基异丙基乙炔;10 . 3-戊烯-1-炔答案:、完成下列反应式、命名下列化合物1. CH2=CHCH 2C三CH Cl21.2. CH2=CHCH 2-C三CHH、. C=C』C1C1C2H57. (CH3)2CH C—C ' H 8.CH3CH 2CHCH2CH2^ = CCH3CH=CH 29 C H二bClC_C”C2H5CH 3 H严C_ 5 H10. CH 3 C=C,H CH 3 C CH-C=CHCH3答案:1.(Z ,E)-2,4- 己二烯;2. 1- 戊烯-4-炔;3. 4-乙基-4-庚烯-2-炔;4. 2,2,,5- 三甲基-3- 己炔;5. 1,3-己二烯-5-炔,6. 5- 庚烯-1,3-二炔;7. (E)-2- 甲基-3-辛烯-5-炔;8. 3- 乙基-1-1. CH3CH=CHC 三CH2. 三CH3. CH3 HC=CH" C三CCH2CH34CH3CH=CHCH _C三CHICH 2CH 3CH3 CH2CH 35. CH2=CK C=C C三CH6. CH2=CHCH 2CH2C三CHH CH2C H2CH3 7. CH/=C「H H C=C58 CH3CH=C —C三CH ICH 3 9. CH3C 三CCHCH 310. CH 3CH=CH —C三CHCH 32. CH3CH2C 三CH HgSO q/H z SOH2O *(3. CH3CH=CH _CH=CH 2 +4.6.7.8.Br2,CCI 4 CH3CH二CHCH 2—C三CCH 3—们0| •5;CH2Br HC CNa (卜(5.CH3CH2C三CH站6严啤(CH3CH2C三CH NaNH;(CH2=C_CH=CH HBr ( 2 ■(H33 NaNH 2/(_CH=CH 2答案:Br Br1. CH2_CHCH 2C三CH2.5. CH2C三CH)HgSO /H2SO4H 2OCH3I H2)Lindlar cat.'(B2H6 H2O2/OH -CH 3 CH2CH38.10. C三CHCH 3OOCH 3CH2CCHO3CH3C=CHCH 2Br(主)6.Br4. CH3CHCHCH 2—C三CCH3CH 3CH 2CH 2CHOCH3CH3CCH=CH 2Br (次)Br7. CH3CH2C三CNa CH3C H 2^= CCH 39 C6H5CH=CHCHCH 3I ClCH2CHO四、用化学方法鉴别下列化合物1 . (A)己烷(B) 1- 己炔(C) 2- 己炔答:加入溴水不褪色的为(A),余下两者加入Ag(NH)2+溶液有白色沉淀生成的为(B),另者为(C)。
第六章 炔烃

114第六章 炔烃分子中含有碳碳叁键的烃叫做炔烃。
碳碳叁键可位于碳链中的任意位置。
开链炔烃的分子通式为C n H 2n-2 。
碳碳叁键位于碳链一端的炔烃称之为单取代或末端炔烃。
6.1 炔烃的结构与烯烃的碳碳双键相比,炔烃的碳碳叁键经历了不同的杂化。
在此杂化过程中,碳的2s 轨道和三个2p 轨道中的一个进行杂化。
每个杂化轨道含有1/2 s 轨道和1/2 p 轨道的成分。
这些杂化轨道称之为sp 轨道。
由于sp 轨道的s 成分增加,乙炔中碳氢键的极性比乙烷和乙烯中的大很多。
乙烯的pK a 值大约在44,而乙炔的pK a 值大约在25,所以末端炔烃在一些特定的情况下,可以当成弱酸,尽管酸性甚至比水还弱很多。
碳碳叁键是两个sp 杂化的碳原子相互之间形成的。
碳原子中的两个sp 杂化轨道沿一轴线呈180 o 伸展 ,该轴线与非杂化的2p x 和2p y 轨道垂直。
当两个sp 杂化碳原子相互靠近时,sp-sp σ 键形成,于是每个碳原子其它两个p 轨道之间就以肩并肩方式重叠,形成两个相互垂直的π键,如图6.1所示。
因此,乙炔C 2H 2是一个线形分子,四个原子都排布在同一条直线上。
由于此线形特性,环状炔烃至少含有十个碳原子才能消除过多的张力。
此外,围绕炔烃叁键部分的电子云密度要比乙烷、乙烯大得多。
与烯烃类似,炔烃容易与亲电试剂相互作用。
(a)(b)图6.1 乙炔的模型(a )乙炔 sp 杂化示意图(b)乙炔的电子云结构模型乙炔碳碳叁键的长度为120pm,键能大约是836 kJ/mol,所以碳碳叁键是已知的键能最大,键长最短的碳碳键。
表格6.1 乙烷,乙烯,乙炔的共价键参数乙烷乙烯乙炔C-C 键键能(KJ)C-C 键长度(pm) 154 134 120C-H 键键能(KJ) 410 444 506C-H键长度(pm) 110 108 106 很明显可以看出(836-368) 并不是(607-368)的两倍,而且实验结果表明,要打开乙炔中的π键需要大约318 KJ/mol的能量,而对于乙烯需要268KJ/mol,所以我们可以得到结论,炔烃与亲电试剂的反应比烯烃与亲电试剂的反应要迟钝。
炔烃学案

乙炔炔烃复习讲义2004.1.31[高考热点]1.乙炔的结构;2.乙炔的实验室制法3.掌握乙炔的化学性质和炔烃的通式、通性[高考考点扫描]一、乙炔1.分子组成和结构分子式:电子式:结构式和结构简式:空间构型:2.乙炔的物理性质:3.乙炔的化学性质(1)氧化反应a.燃烧的反应方程式:b.酸性高锰酸钾溶液(2)加成反应(H2、HX、H2O、X2等)4.乙炔的用途5.实验室制法:药品:电石、水(通常用 )原理:装置:收集:注意事项:6、工业制法:二、炔烃1.定义:2.通式:3.物理性质:4.结构特点:5.化学通性(以丙炔为例)⑴氧化反应:⑵加成反应:[高考热点精讲]例1下列描述CH3-CH==CH-C C-CH3分子结构的叙述中,正确的是[]。
A.6个碳原子有可能都在一条直线上B.6个碳原子不可能都在一条直线上C.6个碳原子有可能都在同一平面上D.6个碳原子不可能都在同一平面上例2下列物质中,哪些可以与酸性KMnO4A.C6H6B.C6H5-CH2CH3C.C6H5-CH=CH2D. CH3例3用乙炔原料制取CH2Br—CHBrCl,可行的反应途径是()A 先加Cl2,再加Br2B 先加Cl2,再加HBrC 先加HCl,再加HBrD 先加HCl,再加Br2例4按相等物质的量混合的下列气体,碳元素的质量分数最大的是()A 甲烷和乙烯B 乙炔和丙烯C 乙烷和乙烯D 丙炔和乙烯例5实验室利用电石和饱和食盐水反应生成气体,并测量该气体的体积,从而测定电石中CaC2的含量。
(1)若实验产生的气体是难闻的气味,则结果测定的(填偏大、偏小、不影响)____,产生难闻气味是因为________。
(2)若实验时称取电石1.6g,测量排出水的体积后折算成标况下乙炔的体积为448mL,此电石中CaC2的质量分数是____。
[高考考点精练]1.按相等物质的量混合的下列气体,碳元素的质量分数最大的是()A 甲烷和乙烯B 乙炔和丙烯C 乙烷和乙烯D 丙炔和乙烯2.一种气态烷烃与一种气态炔烃等体积混合,测得混合气体在标准状况下的密度为1.25g/L,则构成这种混合气体的烷烃和炔烃可能是()A 甲烷,丙炔B 甲烷,丁炔C 乙烷,乙炔D 乙烷,丙炔3.1mol某气态烃完全燃烧需要氧气5.5moL,则此气态分子中,C、H原子个数之和为 A 7 B 8C 10D 114.在120℃时,将1LC2H4、2LC2H6和2LC2H2与20LO2混合,点燃完全燃烧后,恢复到原温度,所得气体的体积是()A 10 LB 15 LC 20 LD 25 L5.现有CH4、C3H4、C2H4、C2H6、C3H6五种有机物,同质量的以上物质中,在系统状况下体积最大的是;同质量的以上物质完全燃烧时耗去O2最多的是;同状况、同体积的以上五种物质完全燃烧时耗去O2的量最多的是;同质量的以上五种物质完全燃烧时,生成二氧化碳最多的是,生成水最多的是。
炔烃的结构structure

4、炔化物的生成 1>、 RC ≡ CH 有弱酸性,其酸性比醇、水 弱;比烷、氨强。 2>、 RC≡ CH与Tollen's reagent 作用时有 白色沉淀生成。与氯化亚铜氨溶液作用时 有棕色沉淀生成。若炔烃中无≡ CH结构, 则不能。这两种试剂常用来区别有≡CH结 构和无≡ CH结构的炔烃。
RC ≡ CH
RC= CH
X
X2
X X
X X
RC —CH
RC ≡ C—CH2—CH=CH2
X2
X RC≡ C—CH2—CH—CH2 X
2>、与HX的加成: 比烯键与HX的加成难
X
RC ≡ CH
RC=CH2
X
R—C—CH3
X
符合马氏规则,加HBr时,有过氧化物效应 (自由基加成)
2、水化 water addition М.Г.КУЧероВ库切洛夫反应:
MgO—Fe2O3
CH3CH=CHCH3
600~6500C
CH2=CH—CH=CH2
2、异戊二烯 是无色稍有刺激性的液体,难溶于水, 易溶于有机溶剂。是IUPAC唯一保留的多烯 烃俗名。 四、共扼二烯的反应 1、1,4-加成
CH2=CH—CH=CH2+HX X–
+ … … CH2 — CH—CH — CH3
CH3CH=CHCH2CHCH2CH2CH3 C≡ CCH3 5-丙基-2-辛烯-6-炔 CH3CH=CHC ≡ CH 3-戊烯-1-炔
CH3C ≡ CCHCH2CH=CHCH3 CH=CH2 5-乙烯基-2-辛烯-6-炔
三、炔烃的物理性质 physical properties of alkynes 1、沸点比相应的烯烃高10~20℃; 2、比重比相应的烯烃稍大; 3、水中的溶解度比相应的烷、烯稍大。 四、炔烃的化学性质chemical properties of alkynes 1、亲电加成 electrophilic additional reaction 1>、与卤素的加成: X2 X
第5章炔烃、共轭二烯烃和紫外光谱ppt课件

40
2021/6/23
共轭体系能量降低可从氢化热的数值得到证明: CH2=CH——CH2——CH=CH2
H-C≡C-H + 2Cu(NH3)2+ CuC≡CCu↓(砖红) + 2NH3 + 2 NH4+
R-C≡C-H + Cu(NH3)2+ R-C≡CCu↓(砖红) + NH3 + NH4+
该反应极为灵敏,常用来鉴别具有—C≡CH 结构的端炔烃,并可用于从混合物中把这种炔烃 分离出来。
18
2021/6/23
链,位次的编号常使双键的位次最小,命名为某烯
炔。
CH2=CH-CH = CH-C ≡CH
1,3-己二烯-5-炔 如果两种编号中其中一种的数字和较大时,则
采用数字和小的一种。 CH3-CH=CH-C ≡CH 3-戊烯-1-炔
2-戊烯-4-炔
5
2021/6/23
CH3-C≡C-C≡C-C≡C-CH3 H-C ≡ C-CH2-CH=CH-CH3 H2C= CH-CH2-C ≡ C-CH3
36
2021/6/23
取代基的电负性次序如下: -F > -Cl > -Br > -I > OCH3 > -NH-COCH3 > -C6H5 > -CH=CH2> -H > CH3 > - C2H5 > -CH(CH3)2 >- C(CH3)3 在 H 前面的为吸电子基,在 H 后面的为斥电子基。
重排 CH3-CHO
CH3-C≡CH + H-OH HgSO4/H2SO4 CH3 — C —CH3
O
14
3.亲核加成
有机化学-第六章不饱和烃

KMnO4 H2SO4
R-COOH HCOOH
羧酸
CO2 + H2O
R′
KMnO4
C CHR''
R
H2SO4
R′ CO
R
酮
R''-COOH
羧酸
烯烃高锰酸钾氧化产物与烯烃结构的关系为:
烯烃结构
高锰酸钾氧化产物
CH2=
CO2 + H2O
R CH=
R COOH
RR1C=
R COR1
2、臭氧化反应(用含有臭氧6~8%的氧气作氧化剂)
常用催化剂:Pt、Pd、Ni等。 其反应历程可表示如下:
HH
HH
C3H C3H HH
CH 3C3H
HH
CH 3C3H
HH
吸附
活泼氢原子
烯烃与被吸附 的氢原子接触
双键同时加氢
完成加氢
脱离催化剂表面
1 mol不饱和烃催化加氢所放出的热量称为氢化热 不饱和烃的氢化热↑,说明原不饱和烃分子的内能 ↑,该不饱和烃的相对稳定性↓。
C2H -C2H BrBr
Br
Br
溴 褪 色 ( 黄 无 ) 实 验 室 里 , 常 用 此
反 应 来 检 验 烯 烃
卤素的反应活性次序: F2 > Cl2 > Br2 > I2 。
氟与不饱和烃的加成异常猛烈,而碘与不饱和烃的加 成较为困难。因此,加卤素通常指的是加氯和加溴。
②与酸的加成
C=C
H-Nu
H
H
C=C
CH 3
C6H5
C=C
HH
顺,顺_1_苯基_1,3_戊二烯 (1Z,3Z)_1_苯基_1,3_戊二烯
烯烃和炔烃的命名

CH3—CH = C—CH2—CH3 CH =C—CH—CH—CH3
⑶
CH3—CH—CH2—C =CH2 CH3 CH3 2,4—二甲基—1—戊烯
⑷ CH3—CH2—CH—CH—CH2—CH3
CH3 C CH 4–甲基–3 –乙基–1–己炔
拓 展 练 习
CH3 ︱ (5) CH2=C—CH=CH2
CH2CH3
1,3-二甲基-5-乙基苯
④当苯环上连有不饱和基团或虽为饱和基团
但体积较大时,可将苯作为取代基。
名称:_________
思考
④中的两种物质 属于苯的同系物 吗?为什么?
名称:_________
芳烃连下列官能团时,苯作取代基,其母体顺序如下:
—COOH、—SO3H、—CHO、—OH、 —R、连有不饱和基团
CH2OH
苯甲醇
二、烯烃和炔烃的命名:
命名方法:与烷烃相似,即一长、一近、一简、一多、 一小的命名原则。但不同点是主链必须含有双键或叁 键。 命名步骤: 1、选主链,含双键(叁键); 2、定编号,近双键(叁键); 3、写名称,标双键(叁键)。
用“二”“三”等表示双键或三键的个数。 CH2=CH—CH=CH2 1,3—丁二烯 其它要求与烷烃相同!!!
5 4 6 3 1 CH3 2CH3 3 CH3 1 CH 3 间二甲苯
C2 H5
乙苯
邻二甲苯 1,2-二甲基苯 CH3 1 2 3 4 CH3
1,3-二甲基苯
对二甲苯 1,4-二甲基苯
练习:命名下列苯的同系物
CH3
1-甲基-2-乙基苯 CH3
1-甲基-3-乙基苯
H3C
2—甲基—1,3—丁二烯
(6)
CH3 H3C-C=CH-CH=CH-CH3
有机化学课件(李景宁主编)第4章_炔烃和二烯烃

CH3 C CH
Br2
CH3 C CH Br Br
Br2
CH3
Br Br C CH Br Br
现象:溴的红棕色消失,用于检验烯烃、炔烃及其他含有碳碳 重键的化合物。
C
C
CH3 + Br2
C
Br +
C
CH3
Br-
C Br
C
Br CH3
反式加成
CH2 CH CH2 C CH + Br2
-20 C CCl4
其过程为自由基加成得反马式加成产物与水的加成烯醇式不稳定酮式稳定互变异构两种构造异构体处于相互转化的平衡中在转化tomerizm
作业
P98 2(1)(2)(3); 8; 14(6); 19. 11;
第四章 炔烃和二烯烃
alkyne and diene
AgNO3
6、聚合
TiCl4 Al(C2H5)3 聚乙炔类导电聚合物由日本化学家白川英树研 n HC CH CH CH 制成功,2000年获诺贝尔化学奖。顺式和反式 n
炔烃

chapter 6
6.9 炔烃的分类和结构 6.10 炔烃的化学性质 6.11 二烯烃的分类及结构 6.12 共轭体系及共轭效应 6.13 共轭二烯烃的化学性质 6.14 环戊二烯的反应
chapter 6
6.9 炔烃的分类和结构
6.9.1 炔烃的分类 6.9.2 炔烃的结构
chapter 6
RCH C CH
chapter 6
RC C CH 2
RC C CH2 H RC CCH 3
6.11 二烯烃的分类及结构
6.11.1 二烯烃的分类 6.11.2 共轭二烯烃的结构
chapter 6
6.11.1 二烯烃的分类
1. 累积二烯烃
两个双键与同一个碳原子相连接,即分子中含
环辛四烯
端炔环三聚:
R C CH "Ni#43;
R
R
R
chapter 6 两种取代苯的比例取决于催化剂的种类。
2. 乙炔的高聚反应 在齐格勒-纳塔催化剂作用下,乙炔能聚合成
高聚物——聚乙炔。
nHC CH Ti/AI
( CH CH )n
H
HH
H
CC
CC
CC
CC
H
HH
H
顺-聚乙炔
H
H
CC
H
CC
CC
H
CH3CH2 H H2C CH H H2N H HC C H CH3O H HO H
pKa ~50 ~40 ~35 26
16 15.7
炔氢的酸性比碳-碳双键上的氢酸性大得多。相 应的负离子的稳定性为:HC C-> H2C CH-> CH3CH2chapter 6
炔烃的化学性质

CH (CH ) CH=CH O H 3 2 5 2 +2 2
二氯甲烷 CH (CH )CH
3 25
CH 2
80%
O 1,2-环氧辛烷
3.5.4 烯烃的氧化反应 (2) 高锰酸钾氧化
用稀KMnO4的中性或碱性溶液,在较低温度下氧化烯烃,产物 是邻二醇:
3-溴-1-辛烯 1-溴-2-辛烯 (烯丙位重排产物 -溴代产物) (
3.5.6 烯烃α-H的反应
(2) α-C上的氧化反应
CH =CH-CH 2 3 +2O
钼酸铋等 370 C
=CH-CHO O + H 。 CH 2 2
3 CH =CH-CH + NH + 2 3 3 2
磷钼酸铋 2O
CH =CH-CN + OH 2 2 470 C 丙烯腈 氨氧化法 (人造羊毛单体) (ABS、丁腈橡胶单体 。
(C H ) Al-TiCl 2 5 3 4 -CH n CH =CH [CH ] 2 2 n 2 2 (低压聚乙烯)
>100
。
[CH 2
(C H ) Al-TiCl 2 5 3 4 n CH =CH [CH -CH ] n (聚丙烯) 2 2 。 50 C,1MPa CH CH 3 3
-
C H ] 2 n
C=C +
KMnO 4
OH,H O 2
-
OHOH C C +
顺式氧化 MnO 2
此反应可在实验室制备邻二醇,但产率很低。 如果用浓度较大的KMnO4的酸性溶液,结果是得到双健断裂产物:
R-CH=CH 2
KMnO 4
RCOOH
四川大学华西药学院《有机化学(II)-1,2》教学大纲

《有机化学(II)-1,2》(药物化学专业)教学大纲一、课程基本信息课程名称( 中、英文): 有机化学Ⅱ-1[Organic Chemistry Ⅱ-1]有机化学Ⅱ-2[Organic Chemistry Ⅱ-2]课程号( 代码) :,课程类别: 类级平台课程,必修课学时:64+48学分:4+3先修课程:《无机化学》、《分析化学》基本面向:药物化学专业二、教学目的及要求有机化学与药学渊源深厚。
该课程要求药物化学专业的学生系统地、扎实地掌握有机化学的基本理论和基本规律,为后续课程的学习以及继续深造,为将来利用有机化学,服务药学奠定坚实的基础。
通过有机化学的教学,把有机化学与药学紧密结合起来,进一步加强对学生解决问题、分析问题和提出问题的能力培养。
在学习该课程时学生要着重掌握各类有机化合物的结构、命名、物理性质、光谱性质、常用制备方法和用途。
紧紧抓住结构与性能的关系,深入理解各类有机化合物的典型反应的规律,机理,立体化学。
三、教学内容1 前言(4学时)基本要求:一、了解有机化学的发展史、主要任务和学习方法;二、了解有机化合物的基本特点、分类和反应类型;三、了解共价健的本质,掌握共价健的属性,熟悉利用键能数据推算反应的焓变;四、掌握下述名词术语:有机化学;同分异构现象;分子间作用力;Van der walls 力;官能团1-1 有机化学的由来和发展1-2 有机化合物的特点:分子结构和组成(同分异构现象,结构的表示方法);理化性质1-3 共价键的键参数:键能、键长、键角;键的极性与诱导效应;键的可极化性1-4 共价键的断裂方式与有机反应的类型1-5 有机化合物的分类1-6 学习有机化学的目的和学习方法2 烷烃和环烷烃(6学时)基本要求:一、了解烷烃的物理性质,掌握烷烃的命名规则。
二、掌握构象的表示方法和典型的构象ap, sp, sc, ac 的稳定性分析;三、了解饱和碳原子的sp 3 杂化轨道与烷基自由基的sp 2 杂化轨道的形成与构型;四、着重掌握烷烃的自由基取代反应(卤代反应)的基本规律(区域选择性)和反应机理(自由基反应),五、弄清下列概念:同系列与同分异构;构造异构与链异构;T.S 与活泼中间体;扭转张力与Van der Walls 张力;Newman 投影式与透视式;活性与选择性;Baeyer 张力;船式与椅式构象2-1 烷烃的同系列与同分异构现象(键异构)2-2 烷烃和命名:习惯命名;系统命名(采用1980 年中国化学会有机化学命名原则)衍生物命名与俗名2-3 烷烃的结构:CH 4 的正四面体结构与sp 3 杂化轨道;烷烃的构象2-4 烷烃的物理性质2-5 烷烃的反应:烷烃的卤代反应(CH 4 的氯代反应及自由基反应历程);卤代反应中卤素的活性与选择性;氧化反应(燃烧与部分氧化);热裂反应2-6 烷烃自由基的立体化学(sp 2 杂化)2-7 环烷烃的分类、异构与命名2-8 环烷烃的物理性质2-9 环烷烃的化学反应2-10 拜尔张力学说与近代观点2-11 环烷烃的构象(环丙烷、环己烷及其衍生物、十氢萘)3 立体化学- 对映异构(6学时)基本要求:一、掌握对称因素与手性的关系;二、掌握Fischer 投影式的书写规则,并能熟练地掌握R/S 的命名法,正确地判断手性中心的构型;三、弄清下列概念:对映异构体和非对映异构体;手性和旋光性;旋光度与比旋光度;内消旋体和外消旋体;手性与对称因素,手性中心与手性分子;赤式与苏式;外消旋化与内消旋化3-1 手性现象3-2 平面偏振光与物质的光活性:平面偏振光;物质的光活性;旋光度与比旋光度3-3 手性与对称因素(对称面、心、轴,更迭对称轴)3-4 手性分子构型表示方法与命名结构表示法(透视式与投影式)命名(R 、S ,赤式与苏式,次序规则)3-5 含两个手性碳原子的化合物3-6 含三个手性碳原子的化合物3-7 其它手性分子4 卤代烃(8学时)基本要求:一、重点掌握卤代烃的三类反应:亲核取代、消去反应与活泼金属的反应以及前两类反应的极端历程的描述和特征(动力学特征、立体化学特征等);二、掌握影响S N 1 ,S N 2 ,E1 ,E2 历程的影响因素及其规律(判断反应的历程);三、熟练掌握消去反应的规律——Saytzev 烯和Hofman 烯;四、熟练掌握Grignard 试剂的制备和应用,了解RLi ,R 2 CuLi ,RNa 等的形成与应用;五、掌握下述概念:亲核剂;溶剂解;氢解;Walden 转化;两可离子;邻基参与与邻位促进4-1 卤代烃的分类、异构与命名4-2 卤代烃的化学反应一.亲核取代反应:碳亲核剂的反应;氧亲核剂的反应;氯亲核剂的反应硫亲核剂的反应;卤亲核剂的反应二.卤代烷SN 反应的历程和立体化学(S N 1 、S N 2 )三.影响SN 反应的因素:R 的结构;L 离去基团;Nu 的亲核性;溶剂四.芳卤的SN 反应(Meisenheimer 络合物,苯炔历程)五.卤代烃的消去反应:β- 消去的历程(E1 ,E2 ,E1cb )影响因素;定向规律六.卤代烷与金属的反应:格氏试剂及其反应;类格氏试剂及其反应七.卤代烃的还原八.多卤代烃与α- 消去反应九.分子内的SN 反应与邻基参与5 烯烃(10学时)基本要求:一、掌握烯烃和环烷烃的顺反异构现象和E/Z 命名法;二、掌握烯烃的各类反应,重点掌握其反应规律及离子型亲电加成反应的历程;三、了解环烷烃的性质和构象,掌握环丙烷和环已烷的构象及其理论解释;四、掌握下述概念:Markovnikov 规则与过氧化物效应;立体选择性反应与立体与一性反应;亲电剂;亲电反应;氢化热与燃烧热;5-1 烯的结构5-2 烯烃的异构与命名:烯烃的异构(位置、顺反异构);命名(Z 、E 命名法)5-3 烯烃的物理性质5-4 烯烃的化学反应;烯烃与卤素的加成反应与亲电加成反应的历程[ 立体选择性] 与立体专一性;烯烃与无机酸的亲电加成反应(Markovnikov 规则);烯烃与H 2 O 的反应;烯烃与HOX 的反应;烯烃的聚合反应;硼氢化一氧化反应;溶剂汞化一去汞化反应;烯烃的还原与氧化反应;烯烃的自由基加成反应;烯烃的α-H 反应5-5 烯烃的制备;醇脱水(Saytzev 规律)和卤代烃脱HX (Hofmann 规律)6 炔烃与二烯烃(6学时)基本要求:一、掌握炔烃的亲电加成反应、氧化还原和炔氢的反应,了解亲核加成、聚合反应等;二、掌握共轭二烯的亲电加成反应规律和共轭二烯的Diels-Alder 反应;三、掌握下述概念:共轭效应与诱导效应;双烯组分与亲双烯组分;乙烯基化反应与乙炔基化反应;速度控制与平衡控制;1 ,2- 加成与共轭加成6-1 炔烃的结构、异构和命名6-2 炔烃的化学反应:加成反应(亲电加成);炔烃与含活泼氢化物反应(亲核加成、乙烯基化);氧化与还原反应(Lindlar 催化剂);炔氢的反应(酸性、亲核取代、乙炔基化反应);乙炔的聚合反应6-3 炔烃的制备6-4 二烯烃的分类与多烯烃的命名6-5 共轭二烯烃的结构与π、π共轭效应6-6 其它类型的共轭效应(P- π、P-P 、σ- π、σ-P )6-7 共轭二烯烃的反应:与H 2 和HX 的反应(动力学和热力学控制反应)加H 2 ;游离基加成反应;Diels-Alder 反应;聚合反应6-8 共轭二烯烃的制备7 芳烃(8学时)基本要求:一、掌握苯系芳烃的亲电取代反应类型(卤代;硝化;磺化;付一克烷化与酰化)、历程和定位规则,能充分利用电子效应和共振论来解释其规律;二、掌握侧链上的氧化与卤代反应规律,了解芳环被催化氢化,催化氧化,Birch 还原的规律;三、掌握萘及一取代萘的亲电取代反应和蒽、菲的特性;四、掌握Huckel 规律与芳香性判断;五、掌握下述概念和人名反应:共振论和Kekule 结构;活化基与钝化基;邻对位定位基与间位定位基;同位素效应;空间效应;Friedel-Crafts 烷化和酰化;Clemensen 还原;Haworth 合成法7-1 芳烃的分类和命名7-2 苯的结构:苯的特性与Kekule 结构;苯结构的描述(MO 和共振论)7-3 苯系芳烃的亲电取代反应的反应历程:卤代;硝化;磺化;付一克烷化与酰化7-4 芳环上的亲电取代反应的定位规则及其应用:定位规律及理论解释;苯二元取代物再取代的定位规律;定位规律的应用7-5 氧化(苯环上氧化,侧链氧化)7-6 游离基反应(环的加成,侧链卤代)7-7 萘的结构与衍生物的命名7-8 萘的化学反应;亲电取代(定位规则);氧化与还原7-9 蒽、菲的特性7-10 致癌烃7-11 非苯芳烃:芳香性的条件(Huckel 规则);几个典型碳环非苯芳香族化合物(环丙烯正离子,环戊二烯负离子,环庚三烯正离子,篮烃,杯烯、轮烯)8 醇、醚(6学时)基本要求:一、了解醇、醚的结构的共性、命名与物理性质及一些主要合成法;二、掌握醇的亲核取代反应和消去反应的规律,了解醇氧化和掌握邻二醇的特性;三、掌握不对称醚的醚键断裂规律和酸碱作用下的环醚开环规律;四、弄清下述试剂与反应的体质:Lucas 试剂;Sarett 试剂;Oppenmer 氧化法;Williamenson 醚合成;Pinacol 重排;Wagner-meerwein 重排;Fries 重排8-1 醇的分类和命名8-2 醇的结构与物理性质8-3 醇的化学性质:酸性、碱性、亲核性(与R-X 反应,与ROH 反应,与RCOOH 反应,与TsCl 和无机酰卤反应,与CS 2 反应)与无机酸反应;消去反应;醇的氧化8-4 邻二醇的特性(氧化与重排)8-5 醇的制备8-7 醚(分类,命名,反应,制备)8-8 硫醇和硫醚:命名;物理性质;化学性质9 醛、酮(8学时)基本要求:一、重点掌握羧基上的各种亲核加成反应的规律及历程,注意Cram 规则的立体化学问题;二、掌握醛、酮的α-H 的反应历程;三、了解插烯原理,掌握α、β- 不饱和醛酮的共轭加成规律及意义;四、搞清下列名称反应:Aldol 反应;Claisen-Schmidt 缩合;Mamich 反应;Wittig 反应;Baeyer-Villiger 反应;Wolff-Kisher- 黄鸣龙反应;Michael 反应;Robinson 反应;Cannizzaro 反应9-1 醛酮的分类与命名9-2 醛酮羰基上的亲核加成反应——加HCN 、NaHSO 3 ,有机金属化合物,H 2 O ,LiAlH 4 ,NaBH 4 ,PCl 5 等和立体化学;与氨及氨衍生物的反应(肟、腙、缩氨脲),与醇的加成缩合反应——半缩醛(酮)、缩醛(酮)的生成,醛(酮)的Wittig 反应、Mannich 反应、安息香缩合;9-3 醛酮α-H 的反应:酮- 烯醇互变,卤代与卤仿反应,aldol 反应;9-4 醛酮的氧化与还原:醛酮的一般氧化,Baeyer-Villiger 氧化和Riley 氧化;Cannizzaro反应;还原成醇(催化氢化和金属氢化物和金属还原);还原成烃基(Clemensen 还原,Wolff-Kisher- 黄鸣龙还原)9-5 醛、酮、的制备9-6 不饱和醛、酮(插烯原理与共轭加成)10 酚、醌(4学时)基本要求:一、掌握酚的结构、反应和制备方法;二、掌握醌的结构特征和对体醌的基本反应;三、弄清Reimer-Tiemann 反应;Kolbe 反应;10-1 酚的结构和命名10-2 酚的化学反应(酸性,氧上的烷化与酰化,显色反应,芳环上的反氧化与还原,10-3 酚的制备(磺化法、氯苯水解法、异丙苯法等)10-4 醌的分类与命名10-5 对苯醌的反应10-6 醌的制备11 羧酸及取代羧酸(6学时)基本要求:一、重点掌握羧酸羰基碳上的亲核取代反应,熟悉取代羧酸的特性;二、了解羧酸的结构对酸性的影响,羧酸的脱酸与还原反应,羧酸的α-H 的反应;三、适当的掌握卤代酸、酚酸、醇酸的特有反应。
6 炔烃、二烯烃
当反应物中同时含有碳碳三键和双键时,三键比双键难加成(竞争反应):
CH2=CH-CH2-C ≡ CH Br2/CCl4
CH2-CH-CH2-C ≡ CH Br Br
原因: 1. 炔碳原子是sp杂化的,杂化轨道中S的成分大,S的成 分大,键长就越短, 键的离解能就越大。 2. 两个轨道分布于键的四周,重叠程度比乙烯中的要大,比双键难于极化。
H2/Lindlar cat.
8、炔烃的制备
HX
RC H
C R' X
2 NaNH2
R C C R'
R' X R-C≡ C-Na
( Li )
R-C≡ C-R'
反应中所用到的为一级卤代烃
Na X Li X
第三节 二烯烃
二烯烃:分子中含两个碳碳双键的烃,与炔烃为官能团异构体。 通式为 CnH2n-2
一、 二烯烃的分类
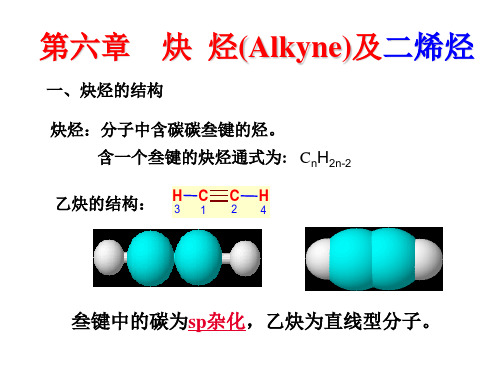
第六章 炔 烃(Alkyne)及二烯烃
一、炔烃的结构
炔烃:分子中含碳碳叁键的烃。 含一个叁键的炔烃通式为: CnH2n-2
乙炔的结构:
H
3
C
1
C
2
H
4
叁键中的碳为sp杂化,乙炔为直线型分子。
sp杂化
能
量
2P
2S
杂化
2P
SP
sp杂化轨道的形成
碳原子的两个sp杂化轨道的空间形象
乙炔分子 轨道图
乙炔分子 结构图
H C≡ C H
HgCl2/C
HCl
120~180℃
CH2=CH-Cl
氯乙烯
③炔烃与HBr的过氧化反应(反马氏加成)
HBr R C C H ROOR
HBr RCCH
写出含有六个碳原子的烯烃和炔烃的构造异构体的构造式汇总

写出含有六个碳原子的烯烃和炔烃的构造异构体的构造式汇总含有六个碳原子的烯烃和炔烃的构造异构体有很多种,下面将列举一些常见的构造式。
对于烯烃,含有六个碳原子的分子式为C6H10。
以下是一些常见的烯烃的构造异构体:1.己烯:它是最简单的六碳烯烃,分子式为CH2=CHCH2CH2CH32.2-己烯:在己烯的基础上,双键在分子中的第二个碳原子上。
它的分子式为CH3CH=CHCH2CH33.3-己烯:在己烯的基础上,双键在分子中的第三个碳原子上。
它的分子式为CH3CH2CH=CHCH34.1,3-己二烯:它是一种二烯烃,分子式为CH2=CHCH2CH=CH25.1,4-己二烯:它是一种二烯烃,分子式为CH2=CHCH2CH2CH=CH26.2,4-己二烯:它是一种二烯烃,分子式为CH3CH=CHCH2CH=CH2对于炔烃,含有六个碳原子的分子式为C6H6、以下是一些常见的炔烃的构造异构体:1.苯:它是最简单的六碳炔烃,分子式为C6H62.1,3-苯丙二炔:它是一种二炔烃,分子式为C6H4(C≡C)23.1,4-苯丙二炔:它是一种二炔烃,分子式为C6H4(C≡C)24.1,2,3-苯丙三炔:它是一种三炔烃,分子式为C6H3(C≡C)35.1,2,4-苯丙三炔:它是一种三炔烃,分子式为C6H3(C≡C)36.1,2,3,4-苯丙四炔:它是一种四炔烃,分子式为C6H2(C≡C)4除了上述列举的烯烃和炔烃的构造异构体外,还可以通过改变双键或三键的位置来获得更多的构造异构体。
需要注意的是,以上只是列举了一些常见的构造异构体,实际上还存在更多可能的异构体。
此外,还有其他碳原子数不同的烯烃和炔烃的构造异构体。
由于构造异构体数量庞大,无法一一列举,以上只是提供了一些典型的例子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3CH2CH2CH2CCH3 甲基酮 O
(4)加醋酸反应
O H2SO4 CH3COOH + HC CH 75~80℃ H3C C OCH CH2
生成的醋酸乙烯是聚乙烯醇的单体。 chapter 6
3. 亲核加成反应 (1)炔烃可以与醇、酸等亲核试剂进行亲核 加成反应。
HC CH + CH3OH
H
RCH C CH 2
RCH C CH
RC C CH 2
RC C CH 2
H
chapter 6
RC CCH 3
6.11
二烯烃的分类及结构
6.11.1 二烯烃的分类
6.11.2 共轭二烯烃的结构
chapter 6
6.11.1 二烯烃的分类
1. 累积二烯烃 两个双键与同一个碳原子相连接,即分子中含 有
C4 H9C CC4 H9 Na-液NH3
-33℃
C4 H9 H
H C C C4 H9
烯烃没有此反应,炔烃还原停留在生成烯烃
这一步,这是制备反式烯烃的一种方法。 chapter 6
6.10.3ຫໍສະໝຸດ 聚合反应1. 炔烃的齐聚反应 (1) 线性齐聚
CuCI2-NH4CI HC CH + HC CH HCI
H2C CH C CH
B
(
C2 H5 H
C2 H5 C C
)3
C2 H5 H
B
25℃
+ (CH3COO)3B
a.在实验室中,可用这个反应制备少量的烯烃。
b.在有机合成中,可作为引进顺式双键的方法。 chapter 6
② 三烯基硼在碱性水溶液中用过氧化氢处理得到 酮和醛:
(
C 2H 5 H
C 2H 5 C C
H 2O 2-NaOH pH= 8 B 3
2-溴丙烯(12%) 1-溴丙烯(88%)
chapter 6
(2)加卤素反应 炔烃与溴加成也是反式加成:
-20℃ 乙醚
CH3C CCH3 + Br2
H3C C C Br
Br CH3
(控制 加成)
反-2,3-二溴-2-丁烯
CH3C CCH3+ 2Br2
20℃ CCI4
CH3CBr2 CBr2CH3
2,2,3,3-四溴丁烷
有两个用途: a.制备顺式烯烃。 b.净化聚乙烯单体中微量乙炔。 chapter 6
(2) 硼氢化反应 ① 与烯烃相似,三键能与硼烷进行硼氢化反 应,若将烯基硼用乙酸处理,得到顺式烯烃:
C2 H5C CC2 H5
BH3 醚 0℃
CH3COOH
(
C2 H5 H
C C
C C
C2 H5 H
C2 H5
)3
20%KOH溶液 60℃ Zn(O2CCH3)2/C
H2C CH OCH3
甲基乙烯基醚
HC CH + CH3COOH
H2C CH O CCH3 醋酸乙烯酯 O
常称为乙烯基化反应,乙炔称为乙烯基化试剂。
chapter 6
(2)亲核加成反应的机理: 以乙炔与甲醇在氢氧化钾催化下反应为例 说明:
CH3OH + OH
C C
0.134
C C
0.120
键能/kJ.mol-1 347.3 chapter 6
610.9
836.8
三键由一个σ 键和两个π 键组成,两个π 键互 相垂直,C≡C上电子云的密度高,在C-C间形成筒状
分布,
,
碳核对电子吸引较不牢,π电子易流动,受分子结 构影响,往往电荷不是均匀分布,π电子较易极化。
C C H H C C H C C H H
反-聚乙炔
顺-聚乙炔
聚乙炔分子具有较好的导电性,故称为“合 成金属”,是有机导体。参杂金属原子后,导电 性更强。 chapter 6
6.10.4
炔氢的反应
炔氢:与三键碳直接相连的氢称为炔氢。 由于三键的影响炔氢有一定的酸性。 1. 炔氢的酸性 Csp-H键是一个极性σ键,电子偏向Csp端,炔 氢有酸性,与其他原子连接的氢比较如下:
15℃
CH3CH2CH2CH2CBr CH2
内炔烃加卤化氢是反式加成,例如:
CH3CH2C CCH2CH3 + HCI
(CH3)4N+CI-
C2 H5 H
CI C C C2 H5
CH3COOH,25℃
炔烃与HBr加成也能按自由基机理进行,得 到反马氏规则产物:
CH3C CH + HBr CH3CH CH + CH3C CH2 Br Br
C C C
结构的烃为累积二烯烃。如丙二烯,
H2C C CH2
1,2-戊二烯。 2.孤立二烯烃
H2C C CHCH2CH3
两个双键间隔多于一个亚甲基结构的烃为孤立 二烯烃。如1,5-己二烯,1,4-环己二烯等。 chapter 6
chapter 6
6.10
炔烃的化学性质
加成反应
氧化和还原反应
6.10.1
6.10.2
6.10.3 聚合反应
6.10.4 炔氢的反应 6.10.5 异构反应
chapter 6
亲电加成 加成
亲核加成
R
C
C
H
炔氢酸性 氧化
chapter 6
6.10.1
加成反应
1. 炔烃与烯烃加成反应的异同点 炔烃与烯烃一样可以进行加成反应,两者有相 同处和不同处。 相同处: (1) 能与卤素、卤化氢等亲电试剂进行亲电加成反 应,遵守马氏加成规则。
H3 C C C CH3 HCI CI HCI H3 C C C H CH3 CI CH3 CH2C CH3 CI
乙炔加HCl需要有催化剂才能顺利反应,是 合成氯乙烯的工业方法:
HC CH + HCI
HgCI2/C
chapter 6
H2C CHCI
溴化氢也能与炔烃加成:
CH3CH2CH2CH2C CH + HBr 无水 Fe
乙烯基乙炔
H2C CH C CH + HC CH
CuCI2-NH4CI
H2C CHC
CCH CH2
1,5-己二烯-3-炔
乙烯基乙炔与HCl反应合成氯代丁二烯,后 者是氯丁橡胶单体。 chapter 6
(2) 环齐聚 环三聚:
3 HC CH
WCI6
该反应曾对证明苯的结构很有意义 环四聚:
4 HC CH
+
干燥的炔化银、炔化铜易爆炸。 chapter 6
演示实验
chapter 6
6.10.5
异构反应
RC 在强碱作用下, C 可异构成RC C C或 C C 位置变化。
OH RCH 2C CH R CH 2 C C
RCH C CH
RCH C CH
HC CH + NaNH2
氨基钠
HC CNa + NH3
乙炔钠
HC CNa + NaNH2
NaC CNa + NH3
乙炔二钠
碱金属炔化物是强碱,亲核试剂,可以与伯卤 烷反应合成炔烃。例:
HC CNa +X R NaC CNa +2X R R'C CH +NaNH HC C R 端炔烃 R C C R 内炔烃 X R'C CNa R R'C C R
chapter 6
6.10.2
氧化和还原反应
1. 氧化反应 炔烃经KMnO4或臭氧氧化后再水解,在三键 处断裂,生成相应的酸:
CH 3CH 2CH 2CH 2C
CH
① O3 ② H 2O
CH 3CH 2CH 2CH 2COOH CH 3(CH 2) 7C C(CH 2) 7CH 3
+ HCOOH
/OH-
)
C 2H 5 H
C 2H 5
C C OH
O
H
C 2H 5CH 2CC 2H 5
若端炔烃为反应物得到醛:
(
C 2H 5 H
H
C C
)3
H 2O 2-NaOH B pH= 8
C 2H 5CH 2C O
这是实验室中制醛的方便方法。
chapter 6
(3) 碱金属-液氨还原成反式烯烃 炔在液氨中用碱金属如钠、锂等还原得到反 式烯烃:
(2) 与溴化氢加成时也有过氧化物效应。 chapter 6
不同处:
(1) 炔烃亲电加成比烯烃难,需要催化剂才能
顺利进行。
(2) 三键可以加成两分子试剂,加成是分步进
行的,可以控制停留在加一分子试剂的阶段。
(3) 三键可以进行亲核加成,亲核加成烯烃比
炔烃难。 chapter 6
2. 亲电加成反应 (1)加卤化氢反应 加一分子氯化氢得卤代烯烃,加入两分子 氯化氢得到同碳二卤代烷:
第6章 烯烃
炔烃
chapter 6
6.9
炔烃的分类和结构
6.10 炔烃的化学性质 6.11 二烯烃的分类及结构
6.12 共轭体系及共轭效应
6.13 共轭二烯烃的化学性质 6.14 环戊二烯的反应
chapter 6
6.9
炔烃的分类和结构
6.9.1 6.9.2
炔烃的分类 炔烃的结构
chapter 6
HC CH2 + CH3O -
CH3O + H2O
慢 快
CH3OCH CH + HOCH3
-
CH CHOCH3
-
CH3OCH CH2+ CH3O
chapter 6
4. 加氢氰酸反应
