植物愈伤组织的继代培养
愈伤组织的诱导和培养
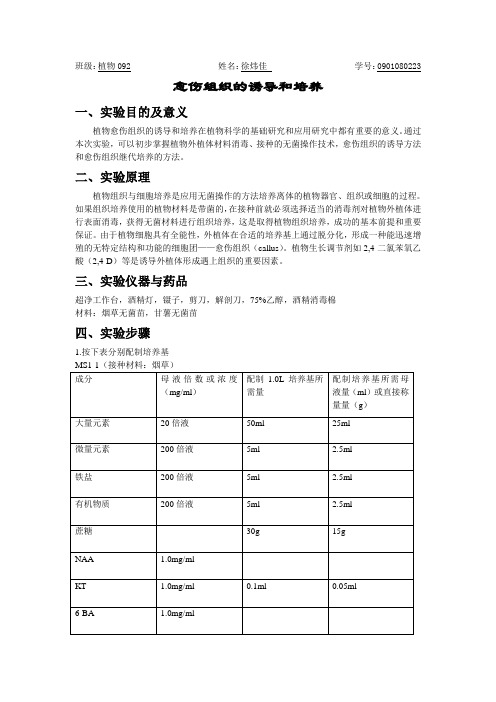
班级:植物092 姓名:徐炜佳学号:0901080223愈伤组织的诱导和培养一、实验目的及意义植物愈伤组织的诱导和培养在植物科学的基础研究和应用研究中都有重要的意义。
通过本次实验,可以初步掌握植物外植体材料消毒、接种的无菌操作技术,愈伤组织的诱导方法和愈伤组织继代培养的方法。
二、实验原理植物组织与细胞培养是应用无菌操作的方法培养离体的植物器官、组织或细胞的过程。
如果组织培养使用的植物材料是带菌的,在接种前就必须选择适当的消毒剂对植物外植体进行表面消毒,获得无菌材料进行组织培养,这是取得植物组织培养,成功的基本前提和重要保证。
由于植物细胞具有全能性,外植体在合适的培养基上通过脱分化,形成一种能迅速增殖的无特定结构和功能的细胞团——愈伤组织(callus)。
植物生长调节剂如2,4-二氯苯氧乙酸(2,4-D)等是诱导外植体形成遇上组织的重要因素。
三、实验仪器与药品超净工作台,酒精灯,镊子,剪刀,解剖刀,75%乙醇,酒精消毒棉材料:烟草无菌苗,甘薯无菌苗四、实验步骤1.按下表分别配制培养基将配置的四种培养基分别分装入20个培养瓶,高温灭菌后水平放置凝固2.接种前,将实验所需器具放入超净工作台,打开紫外灯灭菌20~30min,关闭紫外灯,开启通风开关。
洗手后用酒精喷洒消毒手、手臂、实验材料及培养基外部等进入超净工作台的部分。
进入超净工作台,用酒精棉擦拭台面(手勿伸出工作台),台面完全风干后点燃酒精灯。
3.接种开始时,将镊子及手术刀在酒精中浸泡,并在酒精灯外焰上烧炽片刻,充分冷却。
取幼嫩的烟草(甘薯)叶片,用手术刀切割成小片,再用镊子将其接种至相应的培养基上,每瓶接种3~5片,封口后取出超净工作台,标注姓名、日期、培养基和接种材料。
4.将上述培养材料常温暗培养,每隔7天观察一次,并记录培养情况五、实验结果组织长芽,而当生长素含量大于细胞分裂素含量时,二者共同作用在室温下可诱导外植体生成不定根,也可形成愈伤组织,细胞色素沉淀情况严重;NAA为植物生长素,6-BA为细胞分裂素,促进扦插生根,而当细胞分裂素含量大于生长素含量时,二者共同作用在室温下可诱导外植体生成不定芽,此次实验由于温度非形成愈伤组织的最适温度,所以未形成完整的愈伤组织细胞团。
组织培养第三章 愈伤组织培养资料

2、操作程序
获取外植体材料-消毒处理-修整除去 坏死组织-切成5mm的圆柱形或方形小块- 直放或倒放到培养基上-每9cm培养基接种5 -6块外植体-培养。 选用较大组织做材料时,可用打孔器 从块茎和块根中钻取一批圆柱型组织,切 成相同厚度的小圆片进行培养。
采用圆形的原因:
能得到外形简单结构相同的材料
第一节 愈伤组织的培养
愈伤组织培养是指将母体植株上的各个 部分切下,形成外植体,接种到无菌的培养 基上,进行愈伤组织诱导、生长和发育的一 门技术。 一般情况下,植物组织均能诱发形成愈 伤组织,由外植体形成愈伤组织,标志着植 物离体培养的开始。
一、愈伤组织的诱导 (一)诱导原理 1、细胞全能性 植物每一细胞具有全套遗传信息,在 特定环境下能进行表达,而产生一个独立 完整的个体。
(二)在园艺植物育种中的应用: 1、加快园艺植物新品种和良种繁育速度, 迅速高效低成本 2、培养无病毒苗木 3、获得倍性不同植株,易染色体核内加 倍育种有利用价值 4、克服远缘杂交困难 5、利于种质资源长期保存 6、提供育种中间材料 7、诱发和离体筛选突变体 8、制造人工种子
植物离体培养中的器官发生类型: 不定芽型—诱导顶端分生组织产生不定 芽,再生成植株的方式。顶芽、腋芽培养。 多数植物培养采用。
圆形的表面积大
圆柱形的外植体有利于组织块与外界进 行物质和气体交换;也使外植体表面促进愈 伤组织形成的分泌物较多,诱导率增高。
培养基
MS培养基 激素 IAA、NAA、2,4-D、BA 椰子汁、番茄汁、酵母提取物。
二、愈伤组织细胞的分化
单个细胞或一块外植体形成典型的愈伤 组织,大致经历三个时期,这三个时期中细 胞代谢、细胞数目、细胞形态均有明显差别。
细胞分化——持续细胞分裂增殖——原胚期— —球形胚——心形胚——鱼雷形胚——子叶期
橡胶树花药愈伤组织继代培养与胚状体发生能力研究

一一 1
橡 胶 树 花 药 愈伤 组 织继 代培 养 与胚 状 体 发 生 能 力研 究
梁 国平 , 凤 翔 , 黄 管 艳, 李 玲, 肖三元
( 南省 热 带作 物 科 学研 究所 , 南 景 洪 6 6 0 ) 云 云 6 1 0
An h rCa l lu e a d S m a i t e lusCu t r n o tc Emb y g n ssAb lte n H e e r sle s s r o e e i iii si P ab a ii n i
LI AN G Guo-pi ,H UA NG ng Fen g-x an i g,GUA N n,LILi ,XI Ya ng AO Sha n—y uan
他 继 代 次 数 之 间 差 异 不 显 著 。在 继 代 8 后 , 种 培 养基 的 诱 导 率 逐 渐 升 高 , 别 达 到 4 .%和 代 两 分 4 6
3 3% 。 5.
关 键 词 : 胶 树 ; 药 培 养 ; 伤 组 织 ; 代 培 养 ; 状 体 橡 花 愈 继 胚
中 图分 类 号 : 7 415 文献 标 识 码 : 文 章 编 号 : 6 2 4 0 2 1 ) 1 0 0 — 3 59 . 0 A 17 — 5 ×( 0 1 0 — 0 1 0
摘要 : 用橡 胶 树 花 药愈 伤组 织进 行 继代 培 养 与胚 状 体 诱 导 , 果表 明 , 利 结 在诱 导愈 伤 组 织 、 继代 培 养
和 分 化 胚 状 体 中 MS 养 基 稍 优 于 改 良 MS 养 基 ; 继 代 1 的 愈 伤 组 织 胚 状 体 的 诱 导 率 最 高 , 培 培 以 代 分 别 达到 7. 08%和 6 . : 继 代 0 、 75% 在 代 2代 和 3代 之 间 差 异 达 到 极 显 著 , 继 代 4 时 差 异 达 到 显 著 , 在 代 其
实验愈伤组织的继代与分化培养

实验四、愈伤组织的继代与分化培养一、实验目的学习愈伤组织的继代培养方法;巩固无菌操作技术;观察愈伤或培养物的再生情况及其形态特点。
二、实验原理愈伤在生长一段时间后,由于营养、水分减少和代谢物等积累,使其生长减缓甚至变褐衰亡,须转接到新鲜培养基上进行继代培养或分化培养。
通常,生长素/细胞分裂素比值低利于芽的分化,高则利于根的分化。
将外植体或愈伤接种到激素配比适宜的培养基上培养,可以通过器官发生或体胚发生途径获得再生植株。
三、实验用品器皿与设备同前;用实验三培养的甜瓜/烟草愈伤或子叶外植体,分化培养基(老师准备,同实验三)。
四、实验内容及操作方法注意:四人一组,每组2-3瓶培养基;挑选培养物量大或者培养基少的优先转接。
1)超净工作台等准备工作:同前。
2)将三角瓶用75%酒精喷雾后放入超净工作台中,在酒精灯火焰前取下封口膜,用镊子将培养物夹取、转接到装有新鲜培养基的三角瓶中。
如果愈伤或子叶较大,或分化出根,则用镊子或剪刀将根切除,并将愈伤切割成0.5 cm见方的小块(在培养皿中进行),然后再进行转接。
3)封好瓶口,标好姓名和接种日期。
4)将接种后的三角瓶置于25℃、每天16 h光照和8 h黑暗条件下培养。
五、观察记载内容与实验报告1、观察记载内容每人接种数,4人小组接种总数;外植体/培养物的变化及其形态特征,再生情况;污染情况等。
每隔3天观察一次。
2、实验报告1)实验目的 2)实验原理 3)实验方法:可用流程图表示 4)实验结果与分析A. 描述培养物的变化及其形态特征;B. 统计再生率与污染率,并对结果进行分析。
再生率=分化绿芽(不定根/小植株/胚状体)的愈伤或外植体数/接种总数×100%。
说明:实验报告每人一份,实验结果与分析如有抄袭,涉者均按不及格论处。
愈伤组织的继代培养

实验
实验七七愈伤组织的继代培养
【目的要求】:1、掌握愈伤组织的继代培养方法
2、学习接种操作技术规范。
【实验内容】:1、70%乙醇喷洒净化工作台并擦洗干净,将接种所用的工具等放入工作台。
打开紫外灯,15分钟后关闭紫外灯开始方可操作。
打开风机吹风15分钟,
备用。
2、挑选生长旺盛的苜蓿愈伤组织(此类愈伤组织多呈白色或淡黄色,有光泽),
将其分割成直径约为0.5cm的小块。
3、将分割好的愈伤组织小块接种到新鲜的原培养基上,摆放均匀
4、培养:将培养瓶用封口纸包好,用记号笔写上姓名和接种日期,放在培养
室内25±2℃条件下暗培养。
【实验结果】:观察愈伤组织在继代培养基上的生长情况。
思考题:1.为什么要进行继代培养?
2.在进行愈伤组织继代培养中应注意的问题是什么?。
继代培养增殖类型及特点

继代培养增殖类型及特点研究了这么久继代培养增殖类型及特点,总算发现了一些门道。
首先呢,继代培养增殖有好几种类型。
有一种是侧芽增殖,就像是树会长侧枝一样。
植物的茎尖或者侧芽呀,在适宜的培养条件下,就像被唤醒了生长的潜力,不停地萌发出新的侧芽来。
举个例子,就像我们家里养的那种富贵竹,你要是给它一定的营养条件和环境,它会不断地从茎的旁边冒出新的小芽。
这种侧芽增殖的特点就是它能够比较好地保持植物母株的优良性状。
因为这些侧芽就像是母株的小分身,它们继承了母株的绝大多数特性。
还有一种叫不定芽增殖。
这个有点神奇了呢,它不是从原有的芽上面长出来的,而是从植物的一些其他的组织,像根、叶这些部位长出来新的芽。
这就好比你本来觉得苹果只能从苹果树枝条上长花芽结果,但突然发现苹果根旁边也能莫名其妙地长出小芽来。
这种增殖类型的特点就是繁殖速度可能会比较快。
因为理论上植物身上好多地方都有可能长出不定芽,不再局限于几个特定的部位。
不过呢,有时候它可能不太稳定,可能受到培养条件影响比较大。
另外还有通过愈伤组织增殖的类型。
这感觉就像是把植物组织弄伤了,但这个伤口却能变成新生命的发源地。
这个愈伤组织就像一个多能的小工厂,既能分化出新的芽,又能长出新的根。
但我一直搞不太明白的是,这个过程中怎么去精准控制它的分化方向呢?有时候感觉是个碰运气的事儿。
比如说,我们在培养某种花卉的时候,当形成愈伤组织后,我们想要它多长芽,可它有时候却更多地长出根来。
这就很让人头疼。
这些呀,就是我对继代培养增殖类型及它们特点的一些观察和发现啦。
还有一个关于继代培养增殖的点,这些不同的增殖类型的条件要求都不太一样。
侧芽增殖呢,可能对激素浓度要求比较微妙,就好比做蛋糕的时候,糖放多放少都会影响口感。
激素浓度多一分少一分都可能影响侧芽萌发的数量和速度。
不定芽增殖可能在光照或者温度上某些植物会比较特别。
比如说,有的植物在温度稍微低一点的时候就更容易形成不定芽,可有的就不是。
名词解释

一、名词解释愈伤组织(callus):原指植物体的局部受到创伤刺激后,在伤口表面新生的组织。
在组织培养中则指人工培养基上由外植体长出来的一团无序生长的薄壁细胞。
继代培养:对来自于外植体所增殖的培养物(包括细胞、组织或其切段)通过更换新鲜培养基及不断切割或分离,进行连续多代的培养,就称为继代培养玻璃化苗:指试管苗因生理失调而引起的嫩茎、叶片出现半透明状和水渍状的现象。
其苗称为玻璃化苗。
花粉胚:用花粉经过人工的组织培养而形成的幼胚,发育成的植株就只有正常胚一半的染色体组,所以由花粉胚发育成的植株不会产生种子。
生理隔离:植物传粉后或动物交配后,由于生理上的不协调而不能完成受精作用的现象。
种植保存:指利用天然或人工创造的适宜环境保存种植资源,使个体中所包含的遗传物质保持其遗传完整性和活力,并能通过繁殖将其遗传特性传递下去。
脱分化:已分化的细胞在一定因素作用下恢复细胞分裂能力,失去原有分化状态的过程叫做脱分化。
全能性:是指干细胞具有的分化成机体所有类型细胞和形成完全胚胎的能力。
人工种子:指通过组织培养技术,将植物的体细胞诱导在形态上和生理上均与合子胚相似的体细胞胚,然后将它包埋于有一定营养成分和保护功能的介质中,组成便于播种的类似种子的单位。
炼苗:是在保护地育苗的情况下,采取放风、降温、适当控水等措施对幼苗强行锻炼的过程,使其定植后能够迅速适应陆地的不良环境条件,缩短缓苗时间,增强对低温、大风等的抵抗能力。
再分化:已经脱分化的愈伤组织在一定条件下,再分化出胚状体,形成完整植株,这一过程叫作再分化。
褐变:指在组培过程中,培养材料向培养基中释放褐色物质,致使培养基逐渐变成褐色,培养材料也随之慢慢变褐而死亡的现象。
脱毒培养:利用组织培养技术,脱除植物细胞中的病毒,生产健康的无毒繁殖材料的过程。
胚状体:亦称体细胞胚。
指在组培过程中,由植物体细胞所形成的类似于合子胚的结构。
细胞培养:是指从体内组织取出细胞模拟体内出现环境,在无菌,适当温度及酸碱度和一定营养条件下,使其生长繁殖,并维持其结构和功能的一种培养技术。
第三章-愈伤组织诱导

第三章愈伤组织的诱导与培养第一节愈伤组织的诱导与继代培养愈伤组织(callus): 在培养基上,由外植体经脱分化和细胞分裂形成的一团无序生长的薄壁细胞。
大部分外植体细胞须经脱分化形成愈伤,才能再分化成完整植株,只有茎尖等少数细胞只恢复为分生状态但不分裂,直接再分化。
愈伤组织的诱导与分化是植物组培的基本环节。
一、愈伤组织的诱导及其形态特征1、愈伤组织的诱导1)起动期/诱导期(initiation/induction stage, Induction of growth)外植体细胞在外源激素作用下,经脱分化而恢复分裂状态,开始形成愈伤。
细胞外观无明显变化,代谢旺盛,合成加强,为分裂做准备。
持续十几小时~几天。
2)分裂期(divition stage/phase):外植体切口边缘膨大,外层细胞迅速分裂,体积变小,具分生细胞的特征,细胞数速增。
3)形成期(formation stage/Differentiation phase):外植体表层细胞分裂减缓,内部细胞开始分裂,大量细胞形成瘤状/泡状或片状结构。
若不及时继代,将分化出拟分生组织瘤状物和维管组织,又称分化期。
2. 愈伤组织的形态特征质地:松脆易碎的颗粒状;紧密坚实的结块状;水渍或浆糊状。
颜色:白色或淡黄色;淡绿色或绿色;黄色至褐色。
一般,淡黄或淡绿/绿色松脆(近圆形)或致密的颗粒状愈伤再生能力较强,白色/灰白色或黄褐色、浆糊状或紧实(香蕉形)的愈伤再生能力差。
3. 影响愈伤诱导的关键因素愈伤的形成是外植体、培养基和培养条件诸因素互作的结果。
迄今,几乎从各种外植体诱导形成愈伤。
其关键主要不在于外植体,而是培养基,尤其是激素的种类和浓度。
生长素为愈伤诱导和增殖所必需,细胞分裂素视外植体来源而异。
二、愈伤组织的继代培养继代培养(subculture):将原有培养物转移到新鲜培养基上继续培养的过程称为~。
愈伤组织在培养基上生长一段时间后,由于营养枯竭,水分散失,代谢物积累,致使其生长缓慢甚至停止,须进行继代培养。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
五、实验步骤
芦荟 1、将愈伤组织在无菌条件下,从试管中取出 2、用镊子和解剖刀剔除附着在愈伤块上的培养 基,并用无茵水反复清洗数次,直至愈伤块上无 残留培养基为止。 3、用解剖刀将愈伤块切成数个小块,再接种到 装有愈伤组织诱导培养基的三角瓶中 4、培养基与愈伤组织诱导培养基相同 5、培养条件:与诱导愈伤组织相同。
植物愈伤组织的继代培养
一、实验名称
植物愈伤组织的握植物愈伤组织继代培养的基 本操作步骤
三、实验材料
1、芦荟愈伤组织 2、月季愈伤组织
四、主要实验器材
1、剪刀 2、解剖刀 3、长角镊子 4、超净工作台 5、9cm培养皿 6、封口膜 7、烧杯 8、吸管 9、废液缸 10、橡皮筋
月季
与芦荟类似
