胰岛素定量标记免疫分析试剂盒行业标准的建立和验证
人胰岛素定量检测试剂盒(酶联免疫法)说明书V9.0

终止溶液
1瓶
7mL
准备好使用
0.5M 硫酸
酶结合物 1×溶液的制备
按下表,用酶结合物缓冲液稀释酶结合物 11×(1+10),来制备所需体积的酶结合物 1×溶 液。当为整个平板制备酶结合物 1×溶液时,将所有酶结合物缓冲液倒入酶结合物 11×瓶中, 轻柔混合。
条数量 12 条 8条 4条
酶结合物 11× 1瓶 700 μL 350 μL
5 mL
准备好使用
酶结合物 11×
1瓶
过氧化物酶结合的鼠抗 apoB 单克隆抗体
酶结合物缓冲液
1瓶
蓝色
1.2mL 12mL
制备,见下文 准备好使用
洗涤缓冲液 21×
1瓶
稀释后储存:2-8℃,8 周
底物 TMB
1瓶
无色溶液
注意!光敏!
50 mL 22mL
制备 1×的洗涤缓冲 液需加入 1000mL 重 蒸水稀释 准备好使用
按下表,用酶结合物缓冲液稀释酶结合物 11×(1+10),来制备所需体积的酶结合物 1×溶 液。轻柔混合,1 天内使用。
板数量
酶结合物 11×
酶结合物缓冲液
10 个平板 5 个平板 3 个平板 2 个平板 1 个平板
1瓶 5.0 mL 3.0 mL 2.0 mL 1.0 mL
1瓶 50 mL 30 mL 20 mL 10 mL
酶结合物缓冲液
1瓶
蓝色
12mL 120mL
制备,见下文 准备好使用
洗涤缓冲液 21×
2瓶
200 mL
制备 1×的洗涤缓冲 液需加入 1000mL 重
稀释后储存:2-8℃,8 周
蒸水稀释
底物 TMB
游离β-HCG定量标记免疫分析试剂盒行业标准的建立和验证

m u n o a s s a y k i t w a s r e a s o n a b l e nd a o er p bl a e , w h i c h w o u l d h e l p c o n t r i b u t e t o h t e u n i y t f r e e 3 1 - H C G q u nt a i t a i t v e l be a l i n g i m m u n o a s s a y it k ’
2 0 1 3年 第 2 6卷第 4期 J o f R a d i o i m mu n o l o g y 2 0 1 3 , 2 6 ( 4
..—
—
44 3 - - — —
[ D OI ] 1 0 . 3 9 6 9 / j . i s s n . 1 0 0 8 - 9 8 1 0 . 2 0 1 3 . 0 4 . 0 3 4
k i t .Me t h o d s S e v e n k i t s o f d i fe r e n t me ho t d s we r e u s d. e I h e a p p e a r nc a e ,l i mi t o f b l a n k ,l i n e a  ̄ i t y ,a c c u r a c y,p r e c i s i o n,s p e c i ic f i t y nd a s t a b i l i t y e t a 1 .we r e v e r fe i d i n a c c o r d nc a e w i h t i n d u s t r y s t nd a a r d . Re s u l t s Be s i d e s i n d i v i d u a l k i t s c o u l d n ’ t me e t s o me d e ma n d, he t
胰岛素样生长因子结合蛋白3 定量测定试剂盒(酶联免疫法)使用说明书

人类血清干粉包含IGFBP-3。每瓶1 mL,每盒2瓶。 7.HCL – 终止液 ( REF AC-STOP):
0.5M盐酸,每瓶14 mL。 8.TMB – TMB底物 ( REF AC-TMB):
15-16
47
2155
1569 -3000
17-18
54
2116
1110 -2857
19-20
49
2161
1513 -3578
21-30
45
2681
1627-5619
31-40
44
3001
1700 -5205
41-50
75
2481
1284 -4330
51-60
173
2335
1448 -3567
61-70
微量板被羊抗IGFBP-3单克隆抗体连接到聚苯乙烯微量孔的内部表面,8X12板条孔带干燥剂。 4.AB BIOTIN – 抗体生物素 ( REF AC-1903):
磷酸盐缓冲液包含连接生素素的兔抗IGFBP-3多克隆抗体,蛋白,酶稳定剂和0.05%防腐剂。每瓶12 mL。 5.ENZYMCONJ – 酶结合物 ( REF AC-1904):
IDS IGFBP-3 ELISA 试剂盒是一个纯化的单克隆绵抗-IGFBP-3 抗体包被在聚苯乙烯微量孔的内表面(固相或抗 体捕获)。标准,稀释质控和稀释病人样本然后与生物素多克隆兔抗-IGFBP-3 在抗体包被的微量孔中孵育并震荡, 在室温下放置两个小时。清洗微量孔和加入酶标生物素的复合物(辣根过氧化物酶)。进一步清洗后,加入单一的成 份的显色底物(四甲基联苯胺)形成颜色。终止混合物的反应,吸光度在微量板读数仪上读取,颜色的强度与样本 中 IGFBP-3 的数量成正比关系。 【主要组成成份】 1.CAL┃0– 标准 O/样本稀释 ( REF AC-1901A):
胰岛素测定试剂盒(胶乳免疫比浊法)产品技术要求lepu

胰岛素测定试剂盒(胶乳免疫比浊法) 适用范围:用于体外定量测定人血清中胰岛素的含量。
1.1规格试剂1: 1×50mL,试剂2: 1×50mL;试剂1: 1×50mL,试剂2: 1×25mL;试剂1: 1×45mL,,试剂2: 1×15mL;试剂1: 1×48mL,试剂2: 1×12mL;试剂1: 1×50mL,试剂2: 1×10mL;试剂1: 1×60mL,试剂2: 1×20mL;试剂1: 1×60mL,试剂2: 1×10mL;试剂1: 2×20mL,试剂2: 2×10mL;试剂1: 1×20mL,试剂2: 1×10mL。
1.2主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1应为无色或黄色澄清液体,试剂2应为乳白色液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白在600nm处测定试剂空白吸光度,应≤1.8;2.4 分析灵敏度测试10μIU/mL的被测物时,吸光度变化(ΔA)应不低于0.0006。
2.5 准确度在样品中加入一定体积的纯品,计算回收率,应介于90%-110%之间。
2.6 重复性批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在[1,100]μIU/mL区间内,线性相关系数r应不低于0.990;2.7.2 [1,12)μIU/mL区间内绝对偏差不超过±1.44μIU/mL;[12,100]uIU/mL 区间内相对偏差超过±12%。
2.8 批间差对同一份样品进行重复测定,相对极差≤12%。
2.9 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。
胰岛素测定试剂盒(化学发光免疫分析法)产品技术要求frrk
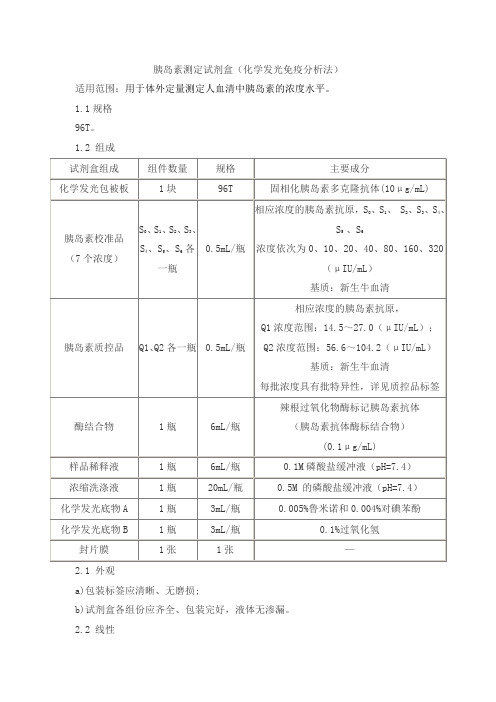
胰岛素测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中胰岛素的浓度水平。
1.1规格96T。
1.2 组成2.1 外观a)包装标签应清晰、无磨损;b)试剂盒各组份应齐全、包装完好,液体无渗漏。
2.2 线性本试剂盒线性范围为:[1,320]μIU/mL。
线性相关系数r≥0.9900。
2.3空白限不大于1 μIU/mL。
2.4准确度用参考物质作为样本进行检测,其测量结果的相对偏差应在±10%范围内。
2.5重复性重复检测质控品Q1和 Q2各10次,其批内变异系数(CV)应不大于10%。
2.6批间差用三个批号的试剂盒检测质控品Q1和 Q2,三批号试剂盒之间的批间变异系数(CV)应不大于15%。
2.7质控品赋值有效性质控品测量值应在质控范围内。
2.8特异性2.8.1与人胰岛素原的交叉反应检测浓度为320μIU/mL的人胰岛素原, 交叉反应率应小于1%。
2.8.2与白蛋白的交叉反应检测浓度为320μIU/mL的白蛋白, 交叉反应率应小于1%。
2.8.3与C-肽的交叉反应检测浓度为320μIU/mL的C-肽, 交叉反应率应小于1%。
2.9稳定性规定产品2℃~8℃储存,有效期6个月。
取到效期后的样品检测准确度、空白限、线性、重复性,应符合2.2~2.5的要求。
2.10溯源性根据《GB/T 21415—2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源,赋值过程以及不确定度等内容,校准品溯源至中国食品药品检定研究院标准品(150519)。
运用行业标准对sdLDL-C试剂盒进行性能评价

WANG Youli,WANG Yishan,NIEZhenlin,MEIYanping
(DepartmentofMedicalLaboratory,NanjingFirstHospital,NanjingMedicalUniversity,Nanjing210006,China)
1398
LabeledImmunoassays& ClinMed,Aug.2019,Vol.26,No.8
运用行业标准对 sdLDLC试剂盒进行性能评价
王有礼,王一杉,聂珍琳,梅燕萍
[南京医科大学附属南京医院(南京市第一医院)医学检验科,江苏 南京 210006]
摘要:目的 对 BeckmanAU5800生化分析仪上检测小而密低密度脂蛋白胆固醇(sdLDLC)所用试剂盒进行性能评价。 方法 参考卫健委发布的 WS/T4922016、WS/T4082012及 WS/T4022012行业标准,选用异常和正常两个水平的质控 品验证 sdLDLC试剂盒的测量精密度,选取尽量接近临床高值的样本配制成一定浓度的样本验证 sdLDLC试剂盒的线 性范围,选取本院正常体检人群进行参考区间验证。结果 2个水平质控品的实验室内变异系数(CV)分别为 4.84%和 4.79%,符合试剂盒宣称的不精密度。对线性范围实验未发现离群点,一次多项式 Y=0.491X-0.383为最适多项式。生 物参考区间验证无离群点,实验结果显示所有数据均落在厂家提供的生物参考区间范围内。结论 该 sdLDLC试剂盒检 测的精密度符合厂商宣称值,sdLDLC浓度在 0.103~2.038mmol/L范围内为线性范围,厂家提供的生物参考区间可被本 实验室直接引用。 关键词:行业标准; 小而密低密度脂蛋白胆固醇; 性能验证
人胰岛素(INS)定量检测试剂盒(ELISA)

仅供科研使用,不得用于临床检验。
人胰岛素(INS)定量检测试剂盒(ELISA)说明书【产品名称】通用名称:人胰岛素(INS)定量检测试剂盒(ELISA)英文名称:Human Insulin (INS) ELISA KIT【包装规格】48人份/盒,96人份/盒【预期用途】仅供科研使用,定量检测血清、血浆、细胞培养上清液中人胰岛素(INS)的浓度。
【检验原理】本试剂盒采用双抗体夹心酶联免疫吸附试验(ELISA)。
在预包被抗人胰岛素(INS)抗体(固相抗体)的微孔酶标板中,加入人胰岛素(INS)校准品和待测样本,再加入另一株HRP标记的抗人人胰岛素(INS)抗体(酶标抗体),经过温育与充分洗涤,去除未结合的组分,在微孔板固相表面形成固相抗体-抗原-酶标抗体的夹心复合物。
加底物A和B,底物在HRP催化下,产生蓝色产物,在终止液(2M 硫酸)作用下,最终转化为黄色,在酶标仪上测定吸光度(OD值),吸光度(OD值)与待测样品中人人胰岛素(INS)的浓度正相关。
拟合校准品曲线,可以计算出样本中人人胰岛素(INS)的浓度。
主要成分mU/mL明HBs抗原阴性,HIV1、HIV2和HCV抗体阴性,由于不存在一种试验方法能够完全保证没有这些物质,本品必须按照具有潜在的感染性进行处理,处理过程应当遵循通用的安全措施。
需要但未提供的材料及耗材1、酶标仪2、精密移液器及一次性吸头3、蒸馏水4、洗瓶或者自动洗板机5、37℃水浴锅或恒温箱6、500ml量筒7、无粉一次性乳胶手套8、质控品(可从蓝图生物科技产品研发系统中选择)【储存条件及有效期】1、2-8℃保存,切勿冷冻,有效期6个月。
2、开封使用后,包被微孔板放入带有干燥剂的自封袋中,密闭自封袋,并将全部试剂放回2-8℃冰箱。
3、开封后,按照建议的条件保存,校准品、包被微孔板和HRP标记抗体,有效期为14天,其他成分在标签标明的有效期内是稳定的。
【适用仪器】半自动的酶标仪,如Thermo MK3,或者国产酶标仪。
胰岛素测定试剂盒(免疫比浊法)产品技术要求baiding

胰岛素测定试剂盒(免疫比浊法)适用范围:
用于体外定量测定人血清或人血浆中胰岛素的含量。
1.1规格
1.2主要组成成分
2.1 外观
2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为白色胶乳液体。
2.1.3 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量应不少于标示值。
2.3 试剂空白吸光度
A≤2.0(波长600nm,光径1cm)
2.4 分析灵敏度
测定30μU/mL的胰岛素样本,吸光度变化在0.010~0.300区间内。
2.5 线性
2.5.1 [1.5,100.0]μU/mL(37℃)。
在规定的线性区间内,测定值与样本浓度值的相关系数(r)应不低于0.9900。
2.5.2 [1.5,20.0]μU/mL区间内,线性偏差应不超过±2.0μU/mL;(20.0,100.0]μU/mL区间内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 批内精密度
用高、中、低3个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于5%。
2.6.2 批间差
用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于6%。
2.7 准确度
相对偏差在±10%范围内(测定国家标准物质150519)。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后两个月内测定结果应应符合2.3、2.4、2.5、2.6.1、2.7要求。
胰岛素测定试剂盒(胶乳免疫比浊法)产品技术要求wantaiderui

胰岛素测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中胰岛素(INS)的含量。
1.1包装规格1) 试剂1:50mL×1、试剂2:50mL×1;2) 试剂1:50mL×2、试剂2:50mL×2;3) 试剂1:50mL×1、试剂2:25mL×1;4) 试剂1:50mL×2、试剂2:25mL×2;5) 试剂1:45mL×1、试剂2:15mL×1;6) 试剂1:45mL×3、试剂2:15mL×3;7) 试剂1:48mL×1、试剂2:12mL×1;8) 试剂1:48mL×3、试剂2:12mL×3;9) 试剂1:50mL×1、试剂2:10mL×1;10)试剂1:50mL×3、试剂2:10mL×3;11)试剂1:60mL×1、试剂2:20mL×1;12)试剂1:96mL×1、试剂2:24mL×1;13)试剂1:100mL×1、试剂2:20mL×1;14)试剂1:30mL×1、试剂2:15mL×1;15)试剂1:30mL×2、试剂2:15mL×2;16)试剂1:30mL×4、试剂2:15mL×4。
1.2组成成分试剂1:Tris-HCl缓冲液(pH7.5)20mmol/L 氯化钠100mmol/L乙二胺四乙酸二钠盐50mmol/L试剂2:抗人胰岛素抗体结合胶乳适量 Tris-HCl缓冲液(pH7.5)20mmol/L氯化钠100mmol/L 2.1试剂装量应不低于试剂瓶签标示装量。
2.2外观试剂1:无色或黄色澄清液体;试剂2:乳白色液体。
2.3试剂空白吸光度在37℃、600 nm波长、1cm光径条件下,试剂空白吸光度应不大于1.8。
胰岛素测定试剂盒(胶乳免疫比浊法)产品技术要求haomai

胰岛素测定试剂盒(胶乳免疫比浊法)适用范围:本试剂用于体外定量测定人血清中胰岛素[INS]的浓度。
1.1包装规格1.2主要组成成分本试剂由试剂1(R1)和试剂2(R2)组成试剂1(R1):Tris缓冲液 100mmol/L 聚乙二醇6000 5g/L NaCL106mmol/LProclin300防腐剂 0.10%试剂2(R2):甘氨酸 50 mmol/L包被胶乳颗粒的单克隆鼠抗-人胰岛素抗体 0.1%BSA2g/LProclin300防腐剂 0.10% 2.1 外观试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰;R1试剂应为无色澄清液体,R2试剂应为无色或乳白色液体。
液体试剂不得有沉淀和絮状物。
2.2 净含量用通用量具测量,液体试剂的净含量应不少于标示值。
2.3 试剂空白在604nm处测定试剂空白吸光度,应≤1.8A。
2.4 分析灵敏度测试50uIU/ml的被测物时,吸光度变化(ΔA)应不低于0.008A。
2.5 准确性参照EP9-A2的方法,用比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990;每个浓度点在[1.5,10)uIU/ml范围内绝对偏差不超过±1.0uIU/ml;[10,100]uIU/ml范围内相对偏差不超过±10%。
2.6 重复性用两个水平的样本检测,检测结果批内变异系数(CV)应不超过8%。
2.7 线性2.7.1在[1.5,100]uIU/ml范围内,线性相关系数r应不低于0.990;2.7.2 在[1.5,10)uIU/ml范围内绝对偏差不超过±1.0uIU/ml;[10,100]uIU/ml 范围内相对偏差不超过±10%。
2.8 批间差对同一份样品进行重复测定,相对极差≤10%。
2.9 稳定性该产品在2℃~8℃条件下贮存有效期为12个月,取到效期后的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。
胰岛素(INS)测定试剂盒(化学发光法)产品技术要求科美

胰岛素(INS)测定试剂盒(化学发光法)适用范围:本试剂盒用于定量测定人血清中胰岛素(INS)的含量。
1.1包装规格2.1外观和物理检查组分齐全、完整;标签清晰,无磨损;液体试剂无渗漏,无混浊、沉淀或絮状物;包被板包装袋无破损、漏气现象;校准品呈疏松体,加入蒸馏水或去离子水后应在10 min 内溶解,无沉淀或絮状物。
2.2 准确性试剂盒内校准品与相应浓度的胰岛素国家标准品(150519)同时进行分析测定,用双对数数学模型拟合,要求两条剂量-反应曲线不显著偏离平行;以胰岛素国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900-1.100之间。
2.3线性在5~160μIU/mL范围内,剂量-反应曲线的线性相关系数(r)应不小于0.9900。
2.4最低检测限应不大于2.0μIU/mL。
2.5分析内精密度用低、高两个浓度水平的质控样本进行重复检测,其变异系数(CV)应满足:仪器自动操作法应不大于8.0%,手工操作法应不大于15.0%。
2.6批间精密度用三个批号试剂盒分别检测低、高2个浓度水平的样本,三个批号试剂盒之间的批间变异系数(CV)应不大于20.0%。
2.7质控品测定值用INS试剂盒测定质控品血清,其测定结果应在试剂盒规定的范围内。
2.8特异性2.8.1与人血清C-肽(C-P)的交叉反应检测浓度为20 ng/mL的C-P,测定值应不大于3.0 μIU/mL。
2.8.2 与胰岛素原的交叉反应检测浓度为10ng/mL的胰岛素原,测定值应不大于3.0μIU/mL。
2.9稳定性INS试剂盒在2~8℃避光保存,有效期12个月。
试剂盒在2~8℃保存至有效期末,分别检测2.1、2.2、2.3、2.4、2.5、2.7项,结果应符合各项目的要求。
2.10校准品性能指标2.10.1瓶间差瓶间差(CV)应不大于5%。
2.10.2复溶稳定性复溶后的校准品在4℃条件下保存7天后检测2.1、2.2、2.3、2.4、2.5、2.7项,结果应满足各项目要求。
北京联众泰克胰岛素(Insulin)测定试剂盒(电化学发光免疫分析法)产品技术要求

胰岛素(Insulin)测定试剂盒(电化学发光免疫分析法)结构组成:试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(Insulin-Cal)(选配)组成。
组成及含量见下表:预期用途:本试剂盒用于体外定量测定人体血清样本中胰岛素(Insulin)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.20μU/mL。
2.3 准确度用Insulin国家标准品或国家标准品标化的企业参考品进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性在[1.0,1000.0]μU/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 批内精密度在试剂盒的线性范围内,浓度为(5.0±1.0μU/mL)和(100.0±20.0μU/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(5.0±1.0μU/mL)和(100.0±20.0μU/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 特异性2.6.1 与胰岛素原(Pro-insulin)浓度不低于10ng/mL的胰岛素原(Pro-insulin)样本,在本试剂盒测定结果应不大于3.0μU/mL;2.6.2 与C-肽(C-Peptide)浓度不低于20ng/mL的C-肽(C-Peptide)样本,在本试剂盒测定结果应不大于3.0μU/mL;2.7 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
总Ig E定量标记免疫分析试剂盒行业标准的验证

疫分析方法的试剂盒 , 进 行 验 证 。结 果 外 观 、 空 白限 、 线性、 准确度 、 精 密度 、 稳 定性等指标符 合要 求, 特 异 性 项 目 中有 个 别 试 剂 盒对 I g M、 I g G 的 测 定 结 果 高 于行 业 标 准要 求 。 结论 总 I g E定 量 标 记 免 疫 分 析 试 剂 盒 行 业标 准制 定合 理 , 有 助 于 规 范 此 类 试 剂
孙 楠 , 于 婷 , 刘 艳 , 王玉梅 , 高尚先△
( 中 国食 品 药品检 定研 究院卫 生部 生物技 术产 品检 定方 法及其 标 准化 重点 实验 室 , 北京 1 0 0 0 5 0 )
摘 要 : 目 的 对 总 I g E定 量 标 记 免 疫 分析 试 剂 盒行 业 标 准 可 行 性 进 行 验 证 。方 法 按 照 拟 定 行 业标 准 的要 求 , 选 择 不 同免
Su n N an , Yu Ti ng , Li u Yah, W an g Yu me i, Gao Sha ngl ' i an
( Na t i o n a l I n s t i t u t e s f o r Fo o d a n d Dr u g Co n t r o l , n l e Ke y La b o r a t o r y o f Bi o t e c h n 0 l o g Pr o du c t t e s t Me t h o d a n d I t s S t a n d a r d i z a t i o n o J t h e Mi n i s t r y o f He a l t h, Be i j i n g 1 0 0 0 5 0, Ch i n a )
Th e e s t a bl i s hi ng o f t he i ndu s t r y s t a nd a r d f or t ot a l I gE q ua n t i t a t i v e l a b e l l i n g i mm u no a s s a y k i t was r e a s o na bl e, whi c h c o ul d he l p t o s t a nd a r d i z e d t he e x pe r i me n t a l me t ho ds a nd t e c hni c a l r e q ui r e me n t s a nd pr omot e d t he i m pr ov e me n t of q ua l i t y, a n d of f e r t he b a s i s f o r t he a dm i s t r a t i o n.
胰岛素样生长因子结合蛋白 3 定量测定试剂盒(酶联免疫法)说明书

胰岛素样生长因子结合蛋白3定量测定试剂盒(酶联免疫法)使用说明书【产品名称】通用名称:胰岛素样生长因子结合蛋白3定量测定试剂盒(酶联免疫法)【包装规格】96人份/盒【预期用途】本产品仅供体外诊断。
IDS IGFBP-3 ELISA试剂盒是双位点酶联免疫吸附试验分析法检测人类血清胰岛素样生长因子结合蛋白3。
IGFBP-3只作为帮助评估生长紊乱的检测项目。
【简介概述】胰岛素样生长因子(IGF-I、IGF-II)是与细胞生长和新陈代谢有关的肽。
在循环中,>95%的IGF-I和IGF-II结合到6种特异性的IGF-结合蛋白(IGFBP-1到6)。
IGFBPs 通过阻止IGF结合到细胞表面的受体以调节IGFS的活性。
另外,一些IGFBPs 可能有不受IGF制约的活性。
在这些IGFBPs中含量最丰富的是IGFBP-3,在正常血清中的IGF-结合蛋白含量>75%。
IGFBP-3有264个氨基酸的酸糖基化蛋白(nonglycosylated MW 29kDA) ,包括IGF和不耐酸蛋白亚单位在循环中是最主要的高MW三重混合物。
IGFBP-3在循环中的浓度是根据生长激素(GH)蛋白酶和年龄的变化、青春期和性变。
除此之外,蛋白酶的活性能调节IGFBP-3。
分解蛋白活性在怀孕妇女的血清是显著的高。
IGFBP-3的水平在GH不足时是低的和在GH分泌过多时异常。
测量血清的IGFBP-3是对评估和GH相关的紊乱的治疗监测是公认的。
【检验原理】IDS IGFBP-3 ELISA 试剂盒是一个纯化的单克隆绵抗-IGFBP-3抗体包被在聚苯乙烯微量孔的内表面(固相或抗体捕获)。
标准,稀释质控和稀释病人样本然后与生物素多克隆兔抗-IGFBP-3在抗体包被的微量孔中孵育并震荡,在室温下放置两个小时。
清洗微量孔和加入酶标生物素的复合物(辣根过氧化物酶)。
进一步清洗后,加入单一的成份的显色底物(四甲基联苯胺)形成颜色。
终止混合物的反应,吸光度在微量板读数仪上读取,颜色的强度与样本中IGFBP-3的数量成正比关系。
胰岛素定量标记免疫分析试剂盒行业标准的建立和验证

胰岛素定量标记免疫分析试剂盒行业标准的建立和验证于婷;沈舒;张春涛;黄颖【期刊名称】《放射免疫学杂志》【年(卷),期】2012(025)004【摘要】目的:建立胰岛素定量标记免疫分析试剂盒的行业标准,并进行试验验证.方法:选择不同方法的8种胰岛素定量标记免疫分析试剂盒,按照拟定行业标准规定,对外观、线性、最低检出限、准确性、精密度和稳定性等项目进行验证.结果:除某些试剂盒的个别指标不能满足要求外,大部分试剂盒均能满足拟定行标中的所有要求.结论:胰岛素定量标记免疫分析试剂盒行业标准制定合理、可操作性强.该标准的制定有助于统一胰岛素定量标记免疫分析试剂盒的质量标准,为其生产、检验、流通及临床应用及其他领域的监管提供依据.%Objective To establish and verify the industry standard for insulin quantitative labelling immunoassay kit. MethodsrnEight kits of different methods were used. The appearance, linearity, detection limit, accuracy, precision and stability et al. werernverified in accordance with industry standard. Results Besides individual kit not matchable for some demand, the others kits couldrnmeet all requirements. Conclusion The establishing of the industry standard for insulin quantitative labelling immunoassay kit wasrnreasonable and operable, which would help contribute to the unity insulin quantitative labelling immunoassay kit's quality, and offer the basis for the administration of its production, examination, circulation,clinical application and other areas.【总页数】4页(P426-429)【作者】于婷;沈舒;张春涛;黄颖【作者单位】中国食品药品检定研究院,100050;中国食品药品检定研究院,100050;中国食品药品检定研究院,100050;中国食品药品检定研究院,100050【正文语种】中文【相关文献】1.促甲状腺素定量标记免疫分析试剂盒行业标准的建立和验证 [J], 黄颖;于婷;李丽莉;高尚先2.人胰岛素定量测定试剂盒化学发光免疫分析法的建立及方法学评价 [J], 陈超;彭波;李基3.总Ig E定量标记免疫分析试剂盒行业标准的验证 [J], 孙楠;于婷;刘艳;王玉梅;高尚先4.生长激素定量标记免疫分析试剂盒行业标准的验证 [J], 于婷;曲守方;黄杰5.游离β-HCG定量标记免疫分析试剂盒行业标准的建立和验证 [J], 于婷;孙楠;刘艳;王玉梅;黄杰;曲守方;黄颖因版权原因,仅展示原文概要,查看原文内容请购买。
胰岛素测定试剂注册技术审查指导原则征求意见稿

胰岛素测定试剂注册技术审查指导原则本指导原则旨在指导注册申请人对胰岛素测定试剂注册申报资料的准备和撰写,同时为技术审评部门审评注册申报资料提供参考。
本指导原则是对胰岛素测定试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需详细阐述理由及相应的科学依据,并根据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审评人员使用的指导性文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系以及当前认知水平下制订的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围胰岛素测定试剂是指利用抗原抗体反应的免疫学方法对人血清、血浆或其他体液中的胰岛素(Insulin,以下简称INS)进行体外定量检测的试剂。
本指导原则适用于以酶标记、(电)化学发光标记、(时间分辨)荧光标记等标记方法为捕获抗体,以微孔板、管、磁颗粒、微珠和塑料珠等为载体包被抗体,定量检测人INS的免疫分析试剂,不适用于以胶体金或其他方法标记的定性或半定量测定的INS试剂、用放射性同位素标记的各类INS放射免疫或免疫放射测定试剂。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),INS测定试剂是用于激素检测的试剂,管理类别为Ⅱ类。
本指导原则适用于进行首次注册申报和相关许可事项变更的产品。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、产品描述、有关生物安全性方面的说明、研究结果的总结评价以及同类产品在国内外上市情况介绍等内容,其中同类产品上市情况介绍部分应着重从方法学、临床应用情况、申报注册产品与目前市场上已获批准的同类产品之间的异同方面进行介绍。
人胰岛素定量测定试剂盒化学发光免疫分析法的建立及方法学评价

人胰岛素定量测定试剂盒化学发光免疫分析法的建立及方法学评价陈超;彭波;李基【期刊名称】《分子诊断与治疗杂志》【年(卷),期】2015(007)005【摘要】目的建立了一种定量测定人血清中胰岛素的化学发光免疫方法,并对其试剂盒性能进行方法学评价. 方法试剂盒采用双抗体夹心法,以磁微粒交联的单抗作为捕获抗体,碱性磷酸酶标记的单抗作为检测抗体,分别对本试剂盒的溯源性、参考范围、最低检测限、线性、准确度、精密性、分析特异性、抗干扰性、药物影响及样本比对方面进行评价. 结果用胰岛素NIBSC国际标准品(66/304)进行溯源,相关性方程为y=1.0335x +0.3349,相关系数r=0.999;建立了健康人群空腹血清胰岛素参考范围,覆盖2.5%~97.5%百分位数人群的参考值范围为1.59 μIU/mL~14.64 μIU/mL;对此方法建立的试剂进行了方法学评价,最低检测限可达0.08μIU/mL;线性在0μIU/mL~300 μIU/mL内,相关系数r=0.9999;精密性CV<8%;准确度在±10%之内;当样本中的胰岛素浓度为200 000 μIU/mL时,未发现钩状效应;与Roche电化学发光系统测定结果显著相关,相关方程为y=0.9541x+0.177,相关系数r=0.9917,两种方法学的测定结果具有较高的一致性. 结论本研究建立的人胰岛素化学发光免疫分析定量检测试剂盒的各项性能指标均达到了临床检测要求,可用于临床血清胰岛素的检测.【总页数】5页(P313-317)【作者】陈超;彭波;李基【作者单位】上海科华生物工程股份有限公司,上海200233;上海科华生物工程股份有限公司,上海200233;上海科华生物工程股份有限公司,上海200233【正文语种】中文【相关文献】1.游离β人绒毛膜促性腺激素定量测定化学发光免疫分析法的建立与性能评价 [J], 伍华颖;王小艳;李志雄;董志宁;吴英松;徐伟文2.促黄体生成素定量测定试剂盒(化学发光免疫分析法)的临床性能评价 [J], 周颖;方婉仙;吴英松3.硫酸去氢表雄酮定量测定试剂盒(化学发光免疫分析法)的研制及性能评价 [J], 苏立;贾晨路4.总前列腺特异性抗原定量测定试剂盒(化学发光免疫分析法)的性能验证 [J], 方婉仙;李志雄;董志宁;李明;吴英松5.癌胚抗原定量测定试剂盒(化学发光免疫分析法)的临床性能评价 [J], 梁丽萍;李志雄;董志宁;李明;吴英松因版权原因,仅展示原文概要,查看原文内容请购买。
胰岛素(INS)测定试剂盒(化学发光法)产品技术要求科美

胰岛素(INS)测定试剂盒(化学发光法)适用范围:本试剂盒用于定量测定人血清中胰岛素(INS)的含量。
1.1包装规格2.1外观和物理检查组分齐全、完整;标签清晰,无磨损;液体试剂无渗漏,无混浊、沉淀或絮状物;包被板包装袋无破损、漏气现象;校准品呈疏松体,加入蒸馏水或去离子水后应在10 min 内溶解,无沉淀或絮状物。
2.2 准确性试剂盒内校准品与相应浓度的胰岛素国家标准品(150519)同时进行分析测定,用双对数数学模型拟合,要求两条剂量-反应曲线不显著偏离平行;以胰岛素国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900-1.100之间。
2.3线性在5~160μIU/mL范围内,剂量-反应曲线的线性相关系数(r)应不小于0.9900。
2.4最低检测限应不大于2.0μIU/mL。
2.5分析内精密度用低、高两个浓度水平的质控样本进行重复检测,其变异系数(CV)应满足:仪器自动操作法应不大于8.0%,手工操作法应不大于15.0%。
2.6批间精密度用三个批号试剂盒分别检测低、高2个浓度水平的样本,三个批号试剂盒之间的批间变异系数(CV)应不大于20.0%。
2.7质控品测定值用INS试剂盒测定质控品血清,其测定结果应在试剂盒规定的范围内。
2.8特异性2.8.1与人血清C-肽(C-P)的交叉反应检测浓度为20 ng/mL的C-P,测定值应不大于3.0 μIU/mL。
2.8.2 与胰岛素原的交叉反应检测浓度为10ng/mL的胰岛素原,测定值应不大于3.0μIU/mL。
2.9稳定性INS试剂盒在2~8℃避光保存,有效期12个月。
试剂盒在2~8℃保存至有效期末,分别检测2.1、2.2、2.3、2.4、2.5、2.7项,结果应符合各项目的要求。
2.10校准品性能指标2.10.1瓶间差瓶间差(CV)应不大于5%。
2.10.2复溶稳定性复溶后的校准品在4℃条件下保存7天后检测2.1、2.2、2.3、2.4、2.5、2.7项,结果应满足各项目要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
综 上所 述 , r s一 Y敷贴治疗疤痕疙瘩效 率高 , 且治疗 简 便易行 , 副作用小 , 济安全 , 经 无创 伤和痛苦 , 易复发 等特 不 点, 是治疗皮肤瘢痕疙 瘩 的较有效 方法 之一 , 具有 较高 的临 床应用价值 。
贴器 内的 S 在 衰变 过程 中释 放 出 B射线 , r 其最 大 能量 为
・
论
著 ・
胰 岛素定 量 标 记 免 疫分 析 试 剂 盒 行 业标 准 的建 立 和 验证
中国食 品药 品检定 研究 院 (000 于 105 )
摘要
婷
沈
舒
张春 涛
黄
颖
目的 : 建立胰 岛素定量标记免疫分析试剂盒 的行业标准 , 并进行试 验验证 。方法 : 选择不 同方法 的
8种胰岛素定量标记免疫分析试剂 盒 , 按照拟定行业标 准规定 , 对外观 、 线性 、 最低 检 出限、 准确性 、 精密 度和稳 定性 等项 目进行验证 。结果 : 除某些试剂盒 的个别指标不能满足要求外 , 大部分试剂 盒均 能满 足拟定行 标 中的
05 6 V, .4 Me 衰变产物为 Y, Y同样放出 f 3 射线 , 最大能量为 22 M V, .7 e 起治疗 作用的核素主要 为 Y。放射性核素放 出的 B射线作用于瘢痕组织 中产生胶 原 的成纤 维细胞 , 成纤 维细
参考 文献
[ ] 张奇亮 , 1 主编. 核医学敷贴治疗技术 [ . M] 1版 . 山东 : 潍坊市新
3 讨论
瘢痕疙瘩是皮肤损伤 后结 缔组织 大量增 生形成 的软 组 织 良性肿瘤 , 性多于男 性 , 女 多见于青 年 , 治疗 方法很 多 , 如 皮损 内注射糖皮 质激素 、 冷冻 、 压迫 、 超短 波和单 纯手术等 , 都易复发 , 复发率 高效果 均不理 想 , 而放射 治疗是 较有效 的 方法 。 卜 Y敷贴 治疗是 放射 治疗一 种。其原 理是 利用 敷 s
・
-Leabharlann ——4 26 -— - —
‘
鱼瘿学杂 2 1 0 2年第 2 5卷第 4期 J ,R d i Il ,g 0 2 2 ( ) } a in ]t I y 1 , 4 t ' o It t 2 5 llo
愈者 2 例 (4 1 , 效 2 6 4 . %) 显 0例 ( 9 2 , 效 4 例 3 . %) 有
10 。这 是 因为 手 术 后 伤 口 内成 纤 维 母 细 胞 占 大 多 数 , 0% 且
对 射线 较敏感 的特性 , B射线 可抑制 成纤 维母 细胞 生 长 ,
减 少术 后 复发 的机 会 ; 外 , 后 皮 损 变 薄 , 面 与 创 面 接 触 另 术 源
[
良好 , 照射区域 的剂量 分布较 为均 匀 , B射 线可 发挥 治疗 作
一
瘢 痕疙瘩较 大 , 疤痕组织较厚 , 面积较大者 , 且 应先 行手
术 切除 , 口愈合 后 即行 敷贴治 疗 , 伤 同样达 到 良好 疗效 。本
文 中 9例患者瘢痕疙瘩较大经手术切 除后 , 口愈合后 再进 伤 行敷贴 治 疗 , 一 个 疗 程 治 愈 率 为 8 . % , 有 效 率 为 第 89 总
( .% ) 无效 1例( .% ) 总有效率 为 9 %。显效 、 78 , 20 , 8 有效 、 无效经第 ( 2~4 个 疗 程 治 愈 者 2 ) 4例 ( 6 ) 有 效 1例 9% , ( %) 总有 效率 为 10 。9例瘢 痕 疙 瘩 经手 术 后再 用 4 , 0% S一 Y敷贴治疗 , r 第一 疗程 治愈 者 8例 ( 8 9 ) 显 效 1例 8.% , ( 1 1 , 有 效 率 为 10 1. %) 总 0 %。与 王 身 坚 等 人 报 道 稍 高
[] 于建华 , 晖. 术后敷 贴治疗 瘢痕疙 瘩 8 4 赵 手 3例 疗 效 分 析 [ ] J.
本文资料显示 ,0例瘢 痕疙瘩 用 s Y敷 贴治疗 总有效 率 6 卜
高达 9 %。最佳治疗 时机 是疾病形成 初期 , 8 皮损 小而表 浅 ;
对 于静止期 的陈旧性 瘢痕疙瘩 , 吸收剂量要 大 , ( 给 需 2~3 )
闻 出 版 局 ,0 15 -5 2 0 :45 .
胞受到 电离辐射作用后 , 出现成纤维 细胞变性 、 坏死 , 抑制了
胶原 的合成与沉积 , 原有 瘢痕组 织被破 坏 , 代之 以正常皮 肤 组织机化而达到治疗 目的 J 同时 B射线 可抑制 切 口处 毛 。
细 血 管 增 生 , 少 炎 症 介 质 的含 量 , 效 防止 疤 痕 的再 形 成 。 减 有
个 疗 程 以上 才 能 达 到 理 想 的疗 效 。
临床皮肤科杂志 ,97,6 3 :6 . 19 2 ( ) 13
( 0 20 — 2 1 -31 6收稿)
[ OI 1 .9 9ji n 10 -8 0 2 1 .40 8 D ]0 36 /. s.0 89 1 .0 20 .3 s
[ ] 王身坚 , 2 颜卫文 , 吴龙妙 .O锶-0钇敷 贴治疗 瘢痕疙 瘩 6 9 9 8例 临床分 析[ ] 海南医学院学报 ,06,2 1 :16 . J. 20 1 ( ) 6 -3 [ ] 王晓燕 , 3 朱丽萍. s. r Y敷贴 治疗瘢痕疙 瘩 的疗 效观察 [ ] J. 放射免疫学杂志 ,00,3 2 :4 — 5 2 1 2 ( ) 141 . 4
用 。选择术后拆线 时敷贴 , 是考虑到 B射线 产生 的电离 辐射
对 正常组织增长 、 修复 也有抑 制和 破坏 作用 , 过早 放射 治疗 有 可能 引起创 口愈合不 良。如照 射皮 肤 出现 轻度 色素 沉着
脱 屑及 局部 发 红 , 为 一 过 性 , 需 特 殊 处 理 而 自行 消 失 。 均 无
所有要求。结论 : 胰岛素定量标记 免疫 分析试剂盒行业标准制定合理 、 可操 作性 强。该标 准的制定有助 于统一
