新鲁科版2020版高考化学大一轮复习第5章原子结构与元素周期律3第2节元素周期律和元素周期表课件(2
高考化学一轮复习 第5单元 原子结构与元素周期律课件 鲁科版

以元素周期律(表)为纲,充分利用类比、归纳、分析、推理的
方法按由先到后,由浅入深的顺序,形成知识网络,总结知识
规律,达到能灵活运用知识的目的。
第四页,共186页。
返回 (fǎnhuí)目
使用(shǐyòng)建 议
1.通过类比,辨明概念,判断正误。运用类比、比较的方法, 既有利于巩固新知识(zhī shi),又能深入理解新概念的内涵与外 延,加强新旧知识(zhī shi)的联系,培养独立思考和辨别正误的 能力,可用列表比较的方法,区分以下几组概念:元素、核素、 同位素;元素周期律、元素周期表;周期、族;同周期元素的性 质和同主族元素的性质;化合价与化学键;离子键与共价键。
第16讲 原子结构
•考 向 互
2.原子核外电子排布规律(guīlǜ)
能量
(1)核外电子一般总是尽先排布在_____(_n_é_n的gl电iàn子g)层里。
动
(2)每个电子层最多容纳的电子数为___较__低___个。
探 究
不超过(3_)_最_个外)层。最多容纳电子数不超过____个,(K层2n为2 最外层时
返回 (fǎnhuí)目
高考(ɡāo kǎo)纵 览
2010年
2011年
2012年
元素 推断
浙江8(选择);福建 23(解答);天津 7(解答);安徽 25(解答);四川 26(解答);江苏 13(选择);全国 Ⅱ12(选择)
课 课 广 江 22569标 标 东((解 解(选2全 全答 答2择国 国(选 ));)11;择13四((安选选);川徽择择浙));;课 择 答 答 答标))));;;全天重全国津庆国17223(67(解选((解解
“化学键”等内容,概念多,内容杂,难度中等。本单元的重
2024年高考化学一轮复习第5章物质结构与性质、元素周期律第3讲化学键

(2)键参数对分子结构和性质的影响
微点拨一般情况下,构成共价键的原子半径越小,键长越短,共价键的键能
越大,分子越稳定。
易错辨析 判断正误:正确的画“√”,错误的画“×”。
(1)s轨道只能形成σ键,p轨道可形成σ键或π键。(
√
)
(2)两个原子的轨道重叠形成共价键时,可以只形成σ键或π键。(
物质的构成微粒、微粒间相互作用与物质性质的关系。
键特征,了解配位化合物的存
在与应用。
4.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。
5.知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型;知道共价键可
分为极性共价键和非极性共价键。
三
键
原子间有
3对
共用电子
深化拓展大π键及其判断
(1)概念
在一个具有平面结构的多原子分子中,如果彼此相邻的3个或多个原子中
有垂直于分子平面的、对称性一致的、未参与杂化的原子轨道,那么这些
轨道可以相互重叠,形成多中心π键。这种不局限在两个原子之间的π键称
为离域π键,或共轭大π键,简称大π键。
(2)形成条件
(4)PH3 的电子式为
··
·
H ·P··H,Mg(OH)2 的电子式为
··
H
··
·
Mg2+[·O·
H]
· 2 。(
··
×
×
)
)
)
二、共价键和键参数
1.共价键的本质和特征
(1)共价键的本质是原子之间形成
共用电子对
(即原子轨道重叠后,高
概率地出现在两个原子核之间的电子与两个原子核之间的电性作用)。
(2)共价键的一般特征是具有
高考化学(鲁科版)一轮总复习(课件):第5章_物质结构_元素周期律_第2节_元素周期律和元素周期表

2.(1)16号元素属于________周期________族。 (2)属于第4周期ⅡA族的元素符号为________,原子序数为________。 [提示] (1)第3 ⅥA (2)Ca 20 (3)第6 ⅦA
[考点多维探究] 角度1 元素周期表结构的分析判断 1.下列各表分别是元素周期表的一部分(表中为原子序数),其中符合实际情 况的是( )
“0族”法确定元素位置 (1)熟记0族元素的相应周期数和原子序数
元素符号 He Ne Ar Kr Xe Rn 原子序数 2 10 18 36 54 86 周期数 1 2 3 4 5 6
(2)确定主族元素在周期表中位置的方法:原子序数-最邻近的稀有气体元素 的原子序数=ΔZ。
若ΔZ<0,则与稀有气体元素同周期,族序数为8-|ΔZ| 若ΔZ>0,则在稀有气体元素下一周期,族序数为ΔZ
角度2 元素在周期表中位置的确定 4.根据中学化学教材中所附元素周期表判断,下列叙述不正确的是( )
【导学号:99682167】 A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数 相等 D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子 数相等
高考化学(鲁科版)一轮复习教学案:第五章 原子结构与元素周期律第二节元素周期律和元素周期表
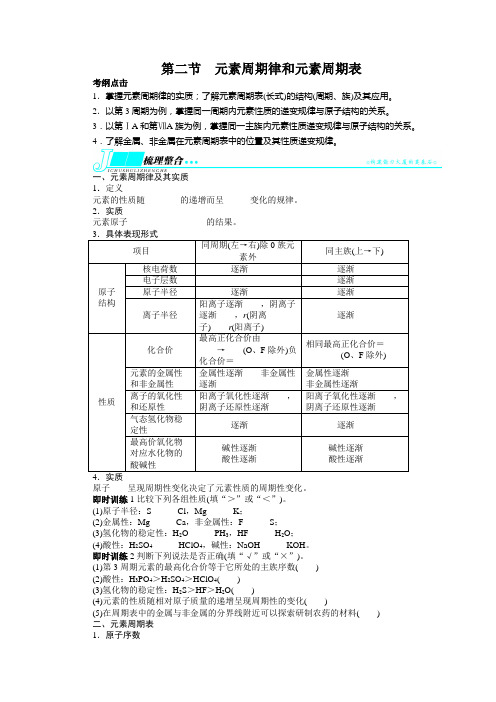
第二节元素周期律和元素周期表考纲点击1.掌握元素周期律的实质;了解元素周期表(长式)的结构(周期、族)及其应用。
2.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
3.以第ⅠA和第ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
4.了解金属、非金属在元素周期表中的位置及其性质递变规律。
一、元素周期律及其实质1.定义元素的性质随________的递增而呈______变化的规律。
2.实质元素原子__________________的结果。
原子____呈现周期性变化决定了元素性质的周期性变化。
即时训练1比较下列各组性质(填“>”或“<”)。
(1)原子半径:S______Cl,Mg______K;(2)金属性:Mg______Ca,非金属性:F______S;(3)氢化物的稳定性:H2O______PH3,HF______H2O;(4)酸性:H2SO4______HClO4,碱性:NaOH______KOH。
即时训练2判断下列说法是否正确(填“√”或“×”)。
(1)第3周期元素的最高化合价等于它所处的主族序数()(2)酸性:H3PO4>H2SO4>HClO4()(3)氢化物的稳定性:H2S>HF>H2O()(4)元素的性质随相对原子质量的递增呈现周期性的变化()(5)在周期表中的金属与非金属的分界线附近可以探索研制农药的材料()二、元素周期表1.原子序数对于一个原子:原子序数=________=______=__________=______-______。
2.元素周期表(1)编排原则①按________递增顺序从左到右排列;②将________相同的元素排成一横行,共有____个横行;③把____________相同的元素按________递增的顺序从上到下排成一纵列,共____列。
(2)周期7个横行,7个周期短周期长周期序号 1 2 3 4 5 6 7元素种数不完全周期,最多容纳32种元素,目前排了26种元素0族元素原子序数86主族列序号 1 2 13 14 15 16 17 族序号副族列序号 3 4 5 6 7 11 12 族序号第Ⅷ族第________共3列0族第____列①分界线:沿着元素周期表中____________与______________的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。
2020版高考化学鲁科版大一轮温习讲义第5章第17讲元素周期律和元素周期表

第17讲元素周期律和元素周期表考纲要求 1.把握元素周期律的实质;了解元素周期表(长式)的结构(周期、族)及其应用。
2.以第3周期为例,把握同一周期内元素性质的递变规律与原子结构的关系。
3.以ⅠA和ⅦA族为例,把握同一主族内元素性质递变规律与原子结构的关系。
4.了解金属、非金属元素在周期表中的位置及其性质递变规律。
考点一元素周期表的结构1.原子序数依照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。
2.编排原那么(1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
(2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。
3.元素周期表的结构总结(1)元素周期表中位于金属与非金属分界限周围的元素属于过渡元素(×)(2)第ⅠA族全数是金属元素(×)(3)元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素(×)(4)两短周期元素原子序数相差8,那么周期数必然相差1(√)请在下表中画出元素周期表的轮廓,并在表中按要求完成以下问题:(1)标出族序数。
(2)画出金属与非金属的分界限,写出分界限处金属的元素符号,并用阴影表示出过渡元素的位置。
(3)标出镧系、锕系的位置。
(4)写出各周期元素的种类。
(5)写出稀有气体元素的原子序数。
(6)标出113号~118号元素的位置。
答案题组一元素周期表的结构应用1.在元素周期表中,铂元素如下图,以下有关说法正确的选项是()A.铂是非金属元素,在常温下呈固态Pt和198 78Pt的核外电子数相同,互为同位素C.“”是铂的质量数D.由78能够推出Pt为第5周期元素答案BPt和198 78Pt的质子数相同,中子数不同,是两种不同的核解析铂为金属元素,A项错误;20878素,二者互为同位素,B项正确;“”是铂元素的相对原子质量,C项错误;由78推出Pt 为第6周期元素,D项错误。
2020版高考化学第5章原子结构与元素周期律3第2节元素周期律和元素周期表课件鲁科版

增大 逐渐_____
项目
同周期(左→右, 除 0 族元 素外)
同主族(上→下)
最 高 正 化 合 价 由 最高正化合价相同, 化合价 性质 元素的金 属性和非 金属性
+1 →____(O +7 、F 除外), 即 ____ 最高正价-8 ____________ 减弱 , 金属性逐渐_____ 增强 非金属性逐渐_____
A.原子半径:W>Y>Z>M>X B.X2Z、YM3、WM4 分子中各原子最外层均为 8 电子稳定结构 C.沸点:X2Z>YX3;热稳定性:XM>X2Z D.N 的一种氧化物可用作油漆和涂料
解析:选 B。根据题意并结合题图,可推知 X 为 H,Y 为 N,Z 为 O , M 为 F , W 为 Si , N 为 Fe 。 原 子 半 径 : r(Si)>r(N)>r(O)>r(F)>r(H),A 项正确。H2O 分子中 H 的最外层 为 2 电子稳定结构,B 项错误。常温下 H2O 为液态,NH3 为气 态, 故沸点: H2O>NH3; 非金属性: F>O, 故热稳定性: HF>H2O, C 项正确。Fe2O3 为红棕色粉末,俗称铁红,常用作红色油漆和 涂料,D 项正确。
周期表结构巧记口诀 横行叫周期,现有一至七,四长三个短,第七尚不满。纵列称 为族,共有十六族,一八依次现①,一零再一遍②。一纵一个族, Ⅷ族搞特殊,三纵算一族,占去八、九、十。镧系与锕系,蜗 居不如意,十五挤着住,都属ⅢB 族。
[说明] ①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ;
②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
(1)周期表结构“七横十八纵”,包括 7 个周期 16 个族。 (2)描述元素位置时, Ⅷ不要写成ⅧB, ⅤA 不要写成“5 主族”。 (3)含元素种类最多的族是ⅢB 族,共 32 种元素。 (4)过渡元素包括 7 个副族和第Ⅷ族,全部为金属元素,最外层 电子数不超过 2 个。 (5)周期序数=电子层数,主族序数=最外层电子数。 (6)最外层电子数为 3~7 个的原子一定属于主族元素, 且最外层 电子数即为主族的族序数。 (7)同一周期ⅡA 族与ⅢA 族的原子序数可能相差 1(2、3 周期) 或 11(4、5 周期)或 25(6、7 周期)。
