HIPEC在胃癌腹膜转移防治中的应用探索
2021年胃肠道癌腹膜转移的化疗策略(全文)

2021年胃肠道癌腹膜转移的化疗策略(全文)摘要腹膜转移是严重影响胃肠道癌患者预后的独立不良因素,"种子-土壤"学说被认为是解释腹膜转移的主要理论。
由于腹膜转移结节初发时体积小,早期诊断尤为困难,因此,腹膜转移的风险评估就显得尤为重要。
目前诊断方法已由临床病理因素逐渐向细胞学、乃至分子层面纵深发展,而包括影像组学在内的多组学整合评估,也进一步丰富了腹膜转移的精准诊断。
腹膜转移可导致癌性腹水、肠梗阻及恶液质等相关并发症,是胃肠道癌治疗的难点。
以系统化疗为基础、手术和腹腔热灌注化疗(HIPEC)等多种方法相结合,是胃肠道癌腹膜转移的有效治疗手段。
如何富集潜在获益的腹膜转移患者,如何判定转化手术的时机,如何进一步优化现有治疗方案,特别是转化手术后的患者如何制定治疗方案等,仍需通过完善研究设计和开展前瞻性随机对照研究来解决。
切实延长胃肠道癌腹膜转移患者的生存期,是持续努力的目标。
由于目前我国尚未形成完善的胃肠肿瘤筛查体系,故其早期诊断率有待提高,多数患者在确诊时即处于进展期、甚至伴有远处转移[1]。
日本Yonemura等[2]报道,接近20%的胃癌患者在术前或术中被诊断为腹膜转移,而超过50%的胃癌患者,即便接受了根治性切除,日后还会发生腹膜转移,因此,无论是可切除还是不可切除的胃癌患者,腹膜转移均是其首位死因[3]。
结直肠癌亦然,7%~15%在术前或术中被确诊为腹膜转移,而接受根治性手术后也有4%~19%会发生腹膜转移。
在所有转移性结直肠癌中,腹膜转移占25%~30%,相较于肝、肺转移,腹膜转移者预后更差[4,5,6,7]。
基于此,有效提高胃肠道癌腹膜转移(gastrointestinal cancer peritoneal metastasis,GICPM)疗效,有助于改善胃肠道癌患者预后。
本文拟围绕GICPM发生机制、风险因素、精准评估及防治,尤其是化学治疗的合理布局与策略做一简述。
胃癌腹膜转移的影像诊断和研究进展(2024)

胃癌腹膜转移的影像诊断和研究进展(2024)摘要目前,胃癌是我国最常见和最致命的肿瘤之一,腹膜转移是进展期胃癌患者常见转移或复发方式,预后极差。
近年来影像技术不断进步,CT、US、MRI、PET-CT等影像学检查均用千评估腹膜转移,但对腹膜转移的准确检测,特别是对隐匿性腹膜转移的诊断仍具有挑战性。
随着精准医学概念的提出,影像组学和人工智能技术进入了高速发展阶段,并在早期预测胃癌腹膜转移方面具有较大潜能,为胃癌腹膜转移患者的诊治提供了新的手段。
胃癌是全球最常见和致命的恶性肿瘤之一。
根据G LOBOCAN2020的数据,胃癌是世界第5常见的癌症,其死亡率位居第4(1];在我国,胃癌的发病率和死亡率均排在所有恶性肿瘤的第3位[2]。
在进展期胃癌中,腹膜转移是常见的转移和复发方式,文献[3]报道显示胃癌患者首次检查时腹膜转移发生率为14%。
伴发腹膜转移的患者预后极差,中位生存时间仅为8~ 13个月[4],约占胃癌相关死亡的60%[5]。
因此,腹膜转移的早期诊断对患者治疗方案选择及预后至关重要。
目前,腹腔镜检查是术前诊断进展期胃癌患者腹膜转移的可靠手段[6],欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)指南[7]也建议进展期胃癌患者需要进行腹腔镜检查,以明确是否发生腹膜转移,从而指导临床决策。
然而,也有研究指出,近80%进行腹腔镜检查的患者最终结果为阴性[8],其成本效益及运用千胃癌患者的适用范围仍具有争议[9]。
随着影像技术的发展,计算机断层扫描(computed tomography, CT入超声(ultrasound,US入磁共振成像(m agnetic resonance imaging, MRI入正电子发射断层扫描/X射线计算机断层扫描(positron emission tomography/X-ray computed tomography, PET-CT)等无创检查逐渐用千临床评估腹膜转移,但传统影像方法在检测腹膜转移尤其是隐匿性腹膜转移(occult peritoneal metastasis,OPM) 方面仍面临挑战。
精准腹腔热灌注化疗技术的研究与临床应用-中华医学会
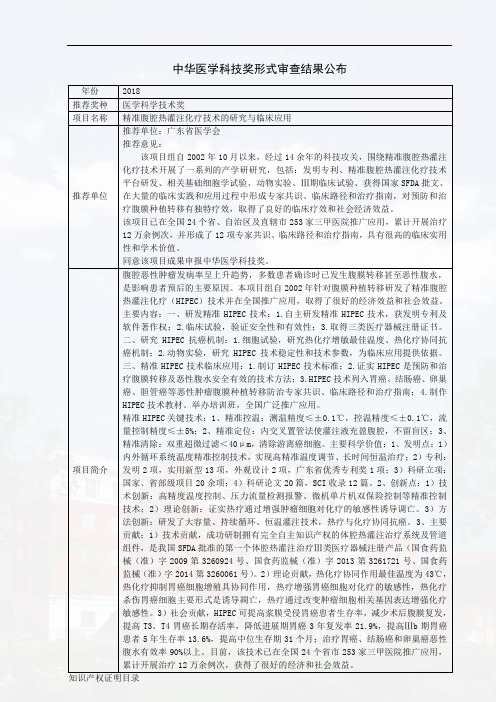
中华医学科技奖形式审查结果公布年份2018推荐奖种医学科学技术奖项目名称精准腹腔热灌注化疗技术的研究与临床应用推荐单位推荐单位:广东省医学会推荐意见:该项目组自2002年10月以来,经过14余年的科技攻关,围绕精准腹腔热灌注化疗技术开展了一系列的产学研研究,包括:发明专利、精准腹腔热灌注化疗技术平台研发、相关基础细胞学试验、动物实验、Ⅲ期临床试验、获得国家SFDA批文、在大量的临床实践和应用过程中形成专家共识、临床路径和治疗指南,对预防和治疗腹膜种植转移有独特疗效,取得了良好的临床疗效和社会经济效益。
该项目已在全国24个省、自治区及直辖市253家三甲医院推广应用,累计开展治疗12万余例次,并形成了12项专家共识、临床路径和治疗指南,具有很高的临床实用性和学术价值。
同意该项目成果申报中华医学科技奖。
项目简介腹腔恶性肿瘤发病率呈上升趋势,多数患者确诊时已发生腹膜转移甚至恶性腹水,是影响患者预后的主要原因。
本项目组自2002年针对腹膜种植转移研发了精准腹腔热灌注化疗(HIPEC)技术并在全国推广应用,取得了很好的经济效益和社会效益。
主要内容:一、研发精准HIPEC技术:1.自主研发精准HIPEC技术,获发明专利及软件著作权;2.临床试验,验证安全性和有效性;3.取得三类医疗器械注册证书。
二、研究HIPEC抗癌机制:1.细胞试验,研究热化疗增敏最佳温度、热化疗协同抗癌机制;2.动物实验,研究HIPEC技术稳定性和技术参数,为临床应用提供依据。
三、精准HIPEC技术临床应用:1.制订HIPEC技术标准;2.证实HIPEC是预防和治疗腹膜转移及恶性腹水安全有效的技术方法;3.HIPEC技术列入胃癌、结肠癌、卵巢癌、胆管癌等恶性肿瘤腹膜种植转移防治专家共识、临床路径和治疗指南;4.制作HIPEC技术教材、举办培训班,全国广泛推广应用。
精准HIPEC关键技术:1、精准控温:测温精度≤±0.1℃,控温精度≤±0.1℃,流量控制精度≤±5%;2、精准定位:内交叉置管法使灌注液充盈腹腔,不留盲区;3、精准清除:双重超微过滤<40μm,清除游离癌细胞。
《胃癌腹膜转移防治中国专家共识》要点

《胃癌腹膜转移防治中国专家共识》要点胃癌是严重威胁人类健康的一种恶性疾病,全球胃癌每年新增95万例,死亡,72万例,其中,70%来自亚洲,而中国患者就占了将近一半。
腹膜转移复发是晚期胃癌患者死亡的首要原因之一;所谓腹膜转移,是指胃癌原发灶癌细胞经血行尧淋巴或腹膜直接种植生长所致的癌症转移形式。
将近20%的胃癌患者在术前或术中诊断有腹膜转移,超过50%的T3、T4期患者在根治性切除术后发生腹膜转移,腹膜转移程度越高,生存期越短。
目前,我国胃癌腹膜转移诊疗现状严峻,发病率高、早期诊断困难、患者预后差。
本共识适用于具有腹膜转移风险因素或确诊腹膜转移的胃癌患者。
一、胃癌腹膜转移的发生机制胃癌腹膜转移的发生机制尚不完全明确,“种子土壤”学说是目前认可度较高的发生机制理论。
二、胃癌腹膜转移的诊断与分期(一)诊断1. 影像诊断:影像学诊断胃癌腹膜转移难度较大,通过典型征象确诊者多已属晚期,即便通过正电子发射型计算机断层显像(PET-CT)也难以在腹膜转移的早期阶段确诊,因而导致较高的假阴性率。
推荐X线计算机断层摄影(CT)作为胃癌腹膜转移的主要影像学检查手段。
2. 血清标志物检测:癌胚抗原(CEA)、癌抗原125(CA125)、癌抗原/19-9(CA19-9)、癌抗原724(CA724)是胃癌常用的肿瘤标志物。
尽管这些血清学指标的升高与腹膜转移成正相关,但用于胃癌腹膜转移的诊断时,其敏感性及阳性预测值均较差。
3. 诊断性腹腔镜检查:诊断性腹腔镜检查是有创检查,可以对腹腔内的转移情况进行评估,了解腹膜转移的分布和大小,并获得明确的组织学及细胞学证据,用于指导制定临床治疗策略,进而评估治疗疗效及监测疾病进展。
目前,腹腔镜检查主要适用于进展期胃癌(cT2-4及任何N和M)的治疗前诊断、术前治疗后的疗效评价。
4. 腹腔游离癌细胞检查:腹水或腹腔灌洗液细胞学检查是目前诊断腹腔内游离癌细胞的金标准。
虽然其敏感性较低,但有助于发现肉眼无法识别的微转移。
腹腔热灌注化疗技术

腹腔热灌注化疗技术背景胃癌腹膜转移是局部进展期胃癌治疗失败最常见的原因之一。
既往研究数据表明,当胃癌原发病灶侵犯浆膜层,其潜在腹膜播种或隐匿型腹膜转移的概率高达60%。
此时,即使接受了胃癌根治性手术治疗,大约60%的患者将会面临继发腹膜转移的风险。
然而,放疗和化疗对这种情况的治疗效果相对有限,在临床实践中,系统性联合局部治疗的方案应运而生。
概念腹腔热灌注化疗是近年来应用的新兴腹腔恶性肿瘤辅助治疗手段,是指将含有化疗药物的灌注液精准恒温,循环灌注,充盈腹腔并维持一段时间,预防和治疗腹膜的种植转移。
随着现在生物技术的发展和大量HIPEC临床应用带来的技术要求,HIPEC在理论和技术上要求精准化和规范化,包含了三大精准新理念:精准定位、精准控温、精准清除。
目的是彻底清除游离癌细胞和临床病灶,实现HIPEC技术应用效果的最大化。
腹腔温热灌注化疗是由三个单独的抗肿瘤的效应联合起作用:1、温热效应:把癌细胞烫死研究报道,癌细胞在40-41℃的环境持续30-60分钟就开始出现严重的内环境紊乱,导致细胞死亡;正常细胞则可以耐热到45-46℃。
2、灌注效应:将癌细胞洗走建立循环灌洗后癌细胞可以被过滤掉,而每个灌洗周期呈现腹腔内游离癌细胞的叠减效应。
3、化疗效应:把癌细胞直接灭掉因为存在腹膜-血液屏障,灌进腹腔的化疗药不易返回到外周血液,导致腹腔内化疗药的浓度较高,杀伤肿瘤细胞的效率更高,而恰好因为吸收入外周血的化疗药物浓度极低,化疗相关的全身反应极少甚无。
一个小时的灌洗期间,腹腔内化疗药物浓度高,增高腹膜对化疗药物的暴露和接触。
4、温热效应+灌注效应+化疗效应:实现1+1+1>3的加强效果热的灌注液进入腹腔内,“热”不仅仅可以直接对抗肿瘤细胞,它也可以让化疗药的效率增加,进入肿瘤细胞的深度和通透性增加。
化疗药在腹腔内的浓度较高,循环的时间较长且回流外周血液里的浓度反而低,起到高效率低副反应的效应。
HIPEC适应症1、胃癌、结直肠癌、胆管癌、胰腺癌、卵巢癌、子宫内膜癌等恶性肿瘤腹膜转移2、腹膜假性黏液瘤3、腹膜恶性间皮瘤4、癌性腹水5、已侵及浆膜的进展期胃癌、结直肠癌、胆管癌根治手术后预防腹膜种植转移HIPEC禁忌症1、各种原因所致腹腔内广泛粘连2、吻合口存在水肿、缺血、张力等愈合不良因素3、完全肠梗阻4、明显肝肾功能不全5、合并骨髓抑制,外周血白细胞、血小板低下6、严重心血管系统病变7、感染性疾病,尤其是严重腹腔感染8、出血倾向或者凝血功能障碍9、生命体征不稳定10、恶病质HIPEC的治疗技术参数:灌注管连接精准腹腔热灌注治疗系统,恒温、恒速、恒量地注入和排出腹腔。
贝伐珠单抗联合腹腔热灌注化疗治疗晚期胃癌腹腔转移的临床研究

贝伐珠单抗联合腹腔热灌注化疗治疗晚期胃癌腹腔转移的临床研究龙孝斌;刘晓飞;郭仪【摘要】目的探究贝伐珠单抗联合腹腔热灌注化疗(HIPEC)对腹腔转移晚期胃癌患者的治疗价值.方法收集腹腔转移晚期胃癌患者64例,采取随机数表法分为试验组(n=32)与对照组(n=32).两组患者均采用FOLFOX方案化疗,试验组在此基础上给予HIPEC,并于腹腔内注入贝伐珠单抗.治疗4个疗程后,比较两组患者的血清CEA、CA199、CA125等肿瘤标志物水平、KPS评分、治疗有效率、疾病控制率与治疗期间死亡率,同时分析贝伐珠单抗联合HIPEC对不同病理类型晚期胃癌的治疗效果.结果与对照组相比,试验组患者的血清CEA、CA199与CA125等肿瘤标志物水平降低,KPS评分与治疗有效率、疾病控制率皆提高(P<0.05),而治疗期间死亡率的差异无统计学意义(P>0.05).此外,贝伐珠单抗联合HIPEC在乳头状腺癌与黏液腺癌中的疗效显著(P<0.05),而对管状腺癌的效果不明显(P>0.05).结论在FOLFOX 全身化疗的基础上,给予贝伐珠单抗联合HIPEC对腹腔转移晚期胃癌患者(乳头状腺癌与黏液腺癌)的疗效显著,具有一定的临床推广价值.【期刊名称】《实用癌症杂志》【年(卷),期】2019(034)006【总页数】4页(P978-981)【关键词】晚期胃癌;腹腔转移;腹腔热灌注化疗;贝伐珠单抗【作者】龙孝斌;刘晓飞;郭仪【作者单位】423000 湖南省郴州市第一人民医院;423000 湖南省郴州市第一人民医院;423000 湖南省郴州市第一人民医院【正文语种】中文【中图分类】R735.2胃癌是全球高发肿瘤之一,其发病率占消化道肿瘤首位。
FOLFOX是晚期胃癌常用的化疗方案[1],但由于晚期患者常已发生腹腔转移,治疗效果不尽如人意,五年生存率几乎为0[2]。
腹腔热灌注化疗(hyperthermic intraperitoneal peroperative chemotherapy,HIPEC)是将化疗与热疗结合的1种新型治疗方式,已被证实可用于多种恶性肿瘤的辅助治疗[3]。
胃癌腹膜转移治疗的研究进展

胃癌腹膜转移治疗的研究进展作者:韩博涵吕慧芳陈小兵来源:《中国医药导报》2020年第04期[摘要] 胃癌腹膜转移发病率高,生存期短,是晚期胃癌死亡的主要原因之一。
尽管胃癌腹膜转移的诊疗措施在不断进步,但胃癌腹膜转移患者的预后仍较差。
有效预防胃癌腹膜转移的发生与胃癌腹膜转移的治疗同等重要。
腹膜转移高危人群给予预防性腹腔热灌注化疗、术中腹腔灌注化疗、术后早期腹腔化疗及术后辅助化疗,可改善患者的预后。
胃癌腹膜转移的治疗以全身化疗为主,可联合多种治疗手段,包括腹腔灌注化疗、靶向治疗及免疫治疗等,特别是转化治疗可明显改善胃癌腹膜转移患者的预后,但转化治疗人群的选择、方案的选择及转化的时机仍是目前的重点和难点。
本文将对近年来胃癌腹膜转移治疗的研究现状进行概述,从而为临床实践提供一定的参考。
[关键词] 胃癌;腹膜转移;预防;治疗[中图分类号] R735.2; ; ; ; ; [文献标识码] A; ; ; ; ; [文章编号] 1673-7210(2020)02(a)-0028-05[Abstract] Peritoneal metastasis of gastric cancer has high incidence and short survival time,which is one of the main causes of death in advanced gastric cancer. In spite of several advances have been made in diagnosis and treatment, the prognosis of patients with peritoneal metastasis is still lower. Effective preventive measures are as important as treatment of peritoneal metastasis. Hyperthemic intraperitoneal perfusion chemotherapy, extensive intraoperative peritoneal lavage,early postoperative intraperitoneal chemotherapy and postoperative adjuvant chemotherapy can improve the prognosis of patients with peritoneal metastasis in high-risk groups. The systemic chemotherapy is the main treatment for peritoneal metastasis of gastric cancer, which can be combined with a variety of treatment methods, including intraperitoneal chemotherapy, targeted therapy and immunotherapy. In particular, the conversion therapy can significantly improve the prognosis of gastric cancer patients with peritoneal metastasis. However, the selection of the groups, the regimens and the timing of the conversion therapy are still the current focus and difficulty. This article summarizes the research status of treatment for peritoneal metastasis of gastric cancer in recent years, thus providing some references for the clinical practice.[Key words] Gastric cancer; Peritoneal metastasis; Prevention; Treatment胃癌是全球第五大惡性肿瘤,也是全球第三大癌症相关死亡原因,对人类的健康造成了严重的威胁。
进展期胃癌术后腹腔热灌注化疗有效性和安全性的系统评价

内容摘要
方法: 我们根据已发表的关于进展期胃癌腹腔热灌注化疗的随机对照试验(RCT)和 半随机对照试验进行Meta分析。通过在Medline、Embase、Cochrane Library等 数据库中搜索相关研究,收集符合条件的试验数据,采用RevMan 5.3软件进行统 计分析。
内容摘要
结果: 共纳入5项RCT和2项半随机对照试验,合计476例患者。Meta分析结果显示, 与单纯手术相比,腹腔热灌注化疗联合手术可显著提高患者的1年生存率(OR = 2.37, 95% CI: 1.59-3.53, P < 0.001)和无病生存率(DFS) (HR = 0.51, 95% CI: 0.36-0.73, P = 0.001)。此外,腹腔热灌注化疗并未增加术后并发 症的发生率(OR = 1.17, 95% CI: 0.78-1.76, P = 0.43)。
谢谢观看
图3 HIPEC组与对照组的无病生 存期比较
图3 HIPEC组与对照组的无病生存期比较
(A) HIPEC组;(B)对照组;(C)合并效应;(D)森林图
图4 HIPEC组与对照组的不良反 应发生率比较
图4 HIPEC组与对照组的不良反应发生率比较
(A) HIPEC组;(B)对照组;(C)合并效应;(D)森林图
摘要
urvival of patients with advanced gastric cancer and the adverse reactions are controllable, but there is still a certain risk.
摘要
Keywords: advanced gastric cancer, Hyperthermic intraperitoneal chemotherapy, effectiveness, safety, systematic review
腹腔热灌注化疗技术临床应用专家共识版

腹腔热灌注化疗技术临床应用专家共识版Coca-cola standardization office【ZZ5AB-ZZSYT-ZZ2C-ZZ682T-ZZT18】腹腔热灌注化疗技术临床应用专家共识(2016版)2016年2月中华胃肠外科杂志,第19卷第2期第121页-第125页近年来新兴的腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)是一种腹腔恶性肿瘤辅助治疗手段。
HIPEC在预防与治疗胃癌、结直肠癌、卵巢癌、腹膜假性黏液瘤、腹膜恶性间皮瘤、肝癌、胆管癌和胰腺癌等腹腔恶性肿瘤的腹膜种植转移及其并发的恶性腹水方面具有独特的疗效[,,,,,]。
自1980年Spratt 等[]首次报道HIPEC以来,国内外学者对其技术方法进行了不断的探索,从简单的灌注液加热后直接灌入法,逐渐演变为目前精准的腹腔热灌注治疗技术方法,其设备得到了不断创新和改进,HIPEC已经成为成熟的临床应用技术[,,]。
传统的HIPEC由于控温不精准,存在治疗安全隐患;由于不能充盈腹腔而存在治疗盲区,达不到安全有效的最大化;由于没有统一的治疗标准,临床研究上不能科学地评价安全性和有效性。
精准化和规范化是实现HIPEC安全有效最大化的技术要求。
近年来,随着腹腔镜外科的发展,HIPEC被引入到了微创外科领域。
在腹腔镜腹腔恶性肿瘤切除或腹腔探查的基础上,进行腹腔镜辅助HIPEC,可充分应用微创外科的优势,避免不必要的手术切口带来的创伤,有着很好的临床应用前景[,]。
腹膜癌(peritoneal cancer,PC)是指在腹膜上发生和(或)发展的一类恶性肿瘤,包括原发性和继发性两种,前者的典型代表是原发性腹膜癌和腹膜恶性间皮瘤,后者的典型代表是各种肿瘤所形成的腹膜转移癌[]。
PC的发生源于自然因素或手术创伤因素所导致的癌肿脱落、转移淋巴结破裂、淋巴管癌栓破裂和癌栓破裂出血等形成腹腔游离癌细胞(free cancer cell ,FCC),FCC着床腹膜,形成微小癌灶、癌结节和广泛性PC[,]。
腹腔热灌注化疗在腹膜转移胃癌的应用现状

腹腔热灌注化疗在腹膜转移胃癌的应用现状李阳;张义胜【摘要】腹膜转移癌(peritoneal carcinomatosis,PC)被认为是癌症发展终末期,相关治疗效果不好且预后差.在全身化疗不是很有效情况下,为了尽可能提高患者生存率及生活质量,区域疗法包括肿瘤细胞减灭术(cytoreductive surgery,CRS)和腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)被广泛研究及应用,并取得相对较好的效果.现HIPEC已作为胃肠道肿瘤术后的辅助治疗,尤其在腹膜转移癌的预防和胃癌引起顽固性腹水治疗上效果较好.本文就腹膜转移胃癌(gastric cancer peritoneal carcinomatosis,GCPC)运用HIPEC治疗的研究进展进行综述.【期刊名称】《沈阳医学院学报》【年(卷),期】2017(019)004【总页数】4页(P364-367)【关键词】胃癌;腹膜转移癌;肿瘤细胞减灭术;腹腔热灌注化疗【作者】李阳;张义胜【作者单位】皖南医学院弋矶山医院胃肠外科,安徽芜湖 241001;皖南医学院弋矶山医院胃肠外科,安徽芜湖 241001【正文语种】中文【中图分类】R735.2胃癌的发病率在所有肿瘤发病率中位居第五位,但其死亡率位居第三位,占所有肿瘤死亡人数的8.8%[1]。
腹膜转移癌(peritoneal carcinomatosis,PC)最常发生于胃肠道肿瘤,T3、T4期胃癌患者大约有60%在根治术后会出现腹膜转移,10%~20%的患者在根治性切除时已有腹膜转移,8%~15%结直肠癌患者诊断时已发生了腹膜转移[2]。
胃癌术后复发也占到相当一部分,虽然在D2淋巴结清扫术的胃癌患者中只有10%~25%出现局部复发,但其远处转移发生率却高达25%[3]。
胃癌术后约有10%~46%患者出现腹膜转移,在所有复发中占36%~45%[4]。
腹腔热灌注化疗技术临床应用专家共识 版

腹腔热灌注化疗技术临床应用专家共识(2016版)2016年2月中华胃肠外科杂志,第19卷第2期第121页-第125页近年来新兴的腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)是一种腹腔恶性肿瘤辅助治疗手段。
HIPEC在预防与治疗胃癌、结直肠癌、卵巢癌、腹膜假性黏液瘤、腹膜恶性间皮瘤、肝癌、胆管癌和胰腺癌等腹腔恶性肿瘤的腹膜种植转移及其并发的恶性腹水方面具有独特的疗效[,,,,,]。
自1980年Spratt等[]首次报道HIPEC以来,国内外学者对其技术方法进行了不断的探索,从简单的灌注液加热后直接灌入法,逐渐演变为目前精准的腹腔热灌注治疗技术方法,其设备得到了不断创新和改进,HIPEC已经成为成熟的临床应用技术[,,]。
传统的HIPEC由于控温不精准,存在治疗安全隐患;由于不能充盈腹腔而存在治疗盲区,达不到安全有效的最大化;由于没有统一的治疗标准,临床研究上不能科学地评价安全性和有效性。
精准化和规范化是实现HIPEC安全有效最大化的技术要求。
近年来,随着腹腔镜外科的发展,HIPEC被引入到了微创外科领域。
在腹腔镜腹腔恶性肿瘤切除或腹腔探查的基础上,进行腹腔镜辅助HIPEC,可充分应用微创外科的优势,避免不必要的手术切口带来的创伤,有着很好的临床应用前景[,]。
腹膜癌(peritoneal cancer,PC)是指在腹膜上发生和(或)发展的一类恶性肿瘤,包括原发性和继发性两种,前者的典型代表是原发性腹膜癌和腹膜恶性间皮瘤,后者的典型代表是各种肿瘤所形成的腹膜转移癌[]。
PC的发生源于自然因素或手术创伤因素所导致的癌肿脱落、转移淋巴结破裂、淋巴管癌栓破裂和癌栓破裂出血等形成腹腔游离癌细胞(free cancer cell ,FCC),FCC着床腹膜,形成微小癌灶、癌结节和广泛性PC[,]。
既往的主流看法认为,PC为癌症晚期或终末期表现,通行的做法是保守治疗,即使是外科干预,也仅是姑息性减瘤手术治疗。
腹腔热灌注化疗防治胃癌腹腔转移研究进展

腹腔热灌注化疗防治胃癌腹腔转移研究进展胃癌是我国最常见的恶性肿瘤之一,进展期胃癌总的复发率达到50%~70%,以腹膜转移为主,达34.9%,是影响其生存率的主要原因。
近30年来,随着技术的发展及设备的改良,腹腔热灌注化疗(HIPEC)获得较好的疗效,且安全性不断提高。
应用HIPEC可提高胃癌5年生存率,降低术后复发率,改善患者生存质量,提升胃癌的总体疗效。
本文对近年来我国应用HIPEC防治胃癌腹腔转移的临床开展情况做一综述。
标签:胃癌;腹腔热灌注化疗;腹腔转移胃癌发病率在世界排名第四位[1],是最常见的恶性肿瘤之一,我国临床收治的胃癌病例绝大多数为进展期,预后较差,2012年中国肿瘤登记年报显示我国胃癌发病率居恶性肿瘤第二位,病死率第三位,严重影响人民群众的生命健康。
近年来由于胃癌的早期诊断率提高,手术方式的规范化,综合治疗的进展,胃癌的预后有一定改善,但进展期胃癌总的复发率达到50%~70%,以腹膜转移为主,达34.9%[2]。
标准D2根治术的推广使胃癌的治愈率有所提高,局部淋巴结转移已非胃癌转移的主要原因,相反腹膜转移是胃癌最常见的转移形式之一。
腹腔热灌注化疗(HIPEC)作为近年兴起的腹腔恶性肿瘤辅助治疗的一种手段,在防治恶性肿瘤的腹膜种植转移及其所致的恶性腹水方面疗效显著,下面就HIPEC防治胃癌腹腔转移的研究进展做一综述。
1 胃癌腹腔转移的诊断腹腔冲洗液细胞学检查找到癌细胞是诊断胃癌腹腔转移的金标准,但常规细胞学检查检出率低,张贤坤等[3]对50例胃癌患者术中行腹腔冲洗液细胞学检查,阳性率仅为20%,难以为临床诊治提供满意的依据。
CT可发现直径5 mm以上的小结节,但对于腹膜转移判断的灵敏度非常低,PET-CT可显示肿瘤组织中高糖代谢状态,做出功能性诊断,但无法精确定位,且费用昂贵,限制了其临床应用。
随着免疫学及分子生物学技术的发展,胃癌腹腔脱落癌细胞检测的方法多种多样,敏感性和特异性也大大提高,使得胃癌腹腔微转移检测成为可能,当前常用检测指标有CEA、CK20、CK19、VEGF、TFF、E-钙粘素、B1整合素、MMPs 等。
最新:中国肿瘤整合诊治指南:腹膜肿瘤(胃肠肿瘤部分)

最新:申国肿瘤整合诊治指南:腹腹肿瘤(胃肠肿瘤部份)摘要腹膜肿瘤发病率高、预后差,源于胃癌、结直肠癌平日阑尾黠液瘤等的继发性腹膜肿瘤临床常见,患者数量多、治疗难、疗效差。
传统观点认为,腹膜肿瘤属于晚期肿瘤,患者生存期短,仅能维持3~6个月,通常f是供姑息性对症治疗。
近年来,以细胞减灭术(CRS)联合腹腔热灌注化疗(HIPEC)为主的整合治疗策略对防治腹膜肿瘤疗效独特,可显著提高患者的生存率和生活质量。
《中国肿瘤整合诊治指南:腹膜肿瘤》在中国抗癌协会的指导下,由腹膜肿瘤专业委员会主E织国内相关领域权威专家共同完成。
指南聚焦我国腹膜肿瘤流行病学特征、遗传背景及国内研究成果,以整合医学理念为引领,强调多学科整合诊治(MDT t o HIM),注重”防-筛-诊-治-康”全程管理。
本指南主要针对胃肠来源的腹膜肿瘤,旨在规范临床诊疗流程、提高整合诊治水平,共同促进我国胃肠腹膜肿瘤的防治工作。
腹膜肿瘤发病率高、预后差,随着诊疗技术的不断完善和病理诊断水平的不断提高,确诊人数每年呈上升趋势(1-4]。
腹膜肿瘤主要分为原发性和继发性,原发性是一类来源于腹膜的肿瘤,常见高原发性腹膜癌和腹膜恶性间皮瘤(malignant peritoneal mesothelioma , MPM);继发性通常是指原发病灶癌细胞直接脱落种植生长,或血行腹膜转移所致,以胃癌、结直肠癌平日阑尾黠液瘤等肿瘤腹膜转移较为常见[5]。
胃癌初诊时约20%的患者已高腹膜转移,约50%的患者行根治术后出现腹膜车制多[6]。
结直肠癌初诊时有7%~15%的患者已高腹膜转移,4%~19%的患者根治术后出现腹膜转移,冥中T4期患者术后腹膜转移率高达20.0%~36.7%[7]。
腹膜假军占液瘤(pseudomyxoma peritonei , PMP)是由于分泌蒙古蛋白的肿瘤破裂致腹腔内大量黠蛋白性腹水积聚及再分布引起,约90%来源于阑尾,属低度恶性肿瘤[8]。
2024《胃癌临床实践指南》更新解读(全文)

2024《胃癌临床实践指南》更新解读(全文)摘要2024年3月7日美国国家综合癌症网络(NCCN)更新了2024年第一版《胃癌临床实践指南》,对于早期胃癌的内镜治疗、二代测序、胃癌腹膜转移的诊疗、系统治疗方案和术后营养缺乏监测等方面作出了更新。
特别是针对近年来晚期胃癌腹膜转移采用腹腔内化疗或腹腔热灌注化疗的热点问题,该指南较为详细地阐述了治疗适应证、综合治疗模式、疗效评估等内容。
在知识和信息迭代更新的时代,NCCN指南也不断地作出更新以适应新的挑战。
新的分子检测手段在胃癌精准诊疗中越来越占据重要的地位,而内镜治疗、腹腔镜手术、机器人手术在内的微创治疗手段也随着更多的循证医学证据和临床实践经验被纳入指南中,充分体现了外科医师对于病人长期生存和生存质量的无限追求。
同样,以免疫检查点抑制剂、靶向治疗药物、抗体药物偶联物为代表的新型抗肿瘤药物在胃癌系统治疗中的地位日益上升,也为病人提供了更多的治疗选择。
未来,秉承“以病人为中心”的治疗理念,积极推动多学科协作和全程化管理,才能真正追求实现所有治疗指南的终极目标。
美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)每年都会根据新出现的临床试验结果和循证医学证据对恶性肿瘤的临床实践指南适时进行更新,并发布不同版本,其更新速度之及时、收录证据之全面,提供信息之完整,远超其他各国的治疗指南和专家共识。
同时,不断进行纠错和调整也充分体现了其尊重客观试验结果、不盲从权威、不做主观臆断的科学精神。
2024年3月7日,2024年第一版《胃癌临床实践指南》(以下简称NCCN指南)发布,其中对于早期胃癌的内镜治疗、二代测序、胃癌腹膜转移的诊疗、系统治疗方案和术后营养缺乏监测等方面作出了更新。
本文将对该版指南中的主要更新内容变化和相关临床试验结果并加以解读和分析,以期把握胃癌诊疗的现状和最新进展。
1 首次增加了早期胃腺癌内镜治疗的流程随着早期胃癌(early gastric cancer,EGC)检出率的逐年升高,原在东亚地区较为普遍接受的内镜治疗理念和技术也逐渐为欧美学者所适应和接受,各版日本《胃癌治疗指南》的更新也为此发挥了积极推动作用,而美国和欧洲胃肠内镜协会也在近年相继发布了内镜黏膜下切除(endoscopic submucosal dissection,ESD)的治疗指南[1-2],因此,NCCN指南也与时俱进地首次增加了早期胃腺癌的内镜治疗路径,指出首先需对EGC进行内镜的评估和活检,基于组织学类型进行分层,如分化较差或弥漫型,则属于非适宜内镜治疗的EGC而建议接受胃切除手术,反之则建议内镜治疗(优选ESD),术后由胃肠病理专业的病理科医师进行治愈性切除评估,其中治愈性切除是指黏膜下层浸润<500 μm、非低分化或未分化类型、无淋巴及脉管浸润。
胃癌腹膜转移防治进展

㊃综述㊃基金项目:延安市科技攻关项目胃癌诊疗关键技术研究(2017K S -11-01)通信作者:赵红,E m a i l :y d f yz h a o h o n @163.c o m 胃癌腹膜转移防治进展朱思颖,赵 红(延安大学附属医院肿瘤科,陕西延安716000) 摘 要:腹膜转移作为进展期胃癌首要的转移和死亡原因,其自然病程小于5个月,且缺乏有针对性的药物治疗,已成为胃癌防治的重难点㊂目前主要采用全身化疗㊁手术㊁局部腹腔灌注及热灌注化疗㊁靶向治疗和免疫治疗等综合治疗方案来处理原发及转移灶,延长患者生存期和改善患者生活质量㊂本文就胃癌腹膜转移的防治进展作一综述㊂关键词:胃肿瘤;腹膜转移;治疗中图分类号:R 732.2 文献标志码:A 文章编号:1004-583X (2020)12-1142-06d o i :10.3969/j.i s s n .1004-583X.2020.12.016 2018年胃癌在全球范围内的发病率与死亡率在全身肿瘤中分别位列第5和第3位,全球每年超过约10万例新发病例,和78万例死亡病例[1]㊂2015年中国胃癌的发病率㊁病死率在全部恶性肿瘤中居第2位和第3位[2]㊂腹膜转移属胃癌临床病理分期Ⅳ期,是进展期胃癌转移和死亡的首要原因,我国发生转移的胃癌患者中53%~60%发生腹膜转移,而发生腹膜转移患者的5年生存率仅为2%,中位生存期只有3~6个月[3]㊂胃癌腹膜转移发生的步骤可概括为:①增殖的癌细胞在相关因子的作用下由原发灶突破浆膜而游离㊁脱落至淋巴系统㊁血液循环㊁腹腔等处,即亚临床转移阶段;②腹膜内游离癌细胞(i n t r a pe r i t o n e a lf r e e c a n c e r c e l l s ,I F C C s )黏附于腹膜组织;③癌细胞与腹膜周围细胞(例如肿瘤相关成纤维细胞和肿瘤相关巨噬细胞等)相互作用㊁调控,从而发生着床㊁侵袭腹膜㊁上皮-间质转化(e p i t h e l i a l -m e s e n c h ym a l t r a n s i t i o n ,E MT )等系列过程;④在各种转移相关因子营造出的促肿瘤生长微环境中,新生毛细血管形成并且新生肿瘤细胞沿血管周围开始增殖[4]㊂宏观上则表现为由腹腔游离细胞阳性发展到肉眼可见的腹膜转移灶㊂针对目前胃癌腹膜转移发生率和死亡率高㊁预防措施效果有限㊁治疗尚缺乏特效药物的现况,临床基本采用系统化疗㊁手术㊁腹腔灌注化疗㊁靶向和免疫治疗与姑息对症相联合的个体化综合治疗方案,且在不断探索中也取得了一些进展㊂本文就现阶段胃癌腹膜转移的预防及治疗情况作一综述㊂1 胃癌腹膜转移的预防1.1 术中预防 除外科手术时要注意无瘤概念技术,避免医源性扩散外,针对局部治疗手段主要包括术中广泛腹腔灌洗(e x t e n s i v e i n t r a o pe r a t i v e p e r i t o n e a l l a v a ge ,E I P L )㊁术中预防性应用腹腔热灌注化疗(h y p e r t h e r m i c i n t r a p e r i t o n e a l c h e m o t h e r a p y,H I P E C )及常温术中腹腔内化疗(n o r m a l t e m p e r a t u r ei n t r a o p e r a t i v ei n t r a p e r i t o n e a l c h e m o t h e r a p y,N I I C )㊂S e s h a d r i 等[5]汇总了近30年多种腹膜内局部化疗手段联合手术治疗胃癌腹膜转移的多项临床研究表明,自1988年开始提出至今,这些局部治疗手段在高危胃癌患者(浆液浸润或淋巴结转移)中预防腹膜复发的作用和安全性已获得多项研究肯定,且其中多数支持联合治疗对比单纯手术更有生存获益㊂M a s u d a 等[6]对行胃癌根治术的晚期胃癌患者用生理盐水多次行E I P L 结果发现如此不但可以降低胃癌的腹膜复发且能延长生存期㊂1.2 术后辅助化疗 术后全身系统辅助化疗杀灭手术无法清除的微小病灶是降低术后复发转移的有效手段㊂目前,临床常用口服氟尿嘧啶类药物如替吉奥(S -1)㊁卡培他滨单药或联合奥沙利铂作为术后辅助化疗方案[7]㊂而在术后局部化疗方面,术后早期腹腔化疗(e a r l yp o s t o p e r a t i v e i n t r a p e r i t o n e a l c h e m o t h e r a p y,E P I C )是于术后第1~5天通过手术时置入的引流管注射化疗药物㊂虽可能引发感染和术后并发症,但其被认为能预防复发和提高生存率[8-9]㊂D r a go n I I 是首个旨在探究新辅助腹腔镜H I P E C (n e o a d ju v a n t l a p a r o s c o pi c h y p e r t h e r m i c i n t r a pe r i t o n e a l c h e m o t h e r a p y,N L H I P E C )与新辅助化疗㊃2411㊃‘临床荟萃“ 2020年12月20日第35卷第12期 C l i n i c a l F o c u s ,D e c e m b e r 20,2020,V o l 35,N o .12Copyright ©博看网. All Rights Reserved.(n e o a d j u v a n t c h e m o t h e r a p y,N A C)联合手术及术后化疗的综合方案,能否预防胃癌患者腹膜复发转移并延长其生存期的多中心Ⅲ期随机对照试验㊂目前其结果尚未公布[10]㊂2胃癌腹膜转移的治疗2.1胃癌腹膜转移的化疗综合目前各方指南对于失去根治性手术机会的终末期转移性胃癌一线系统化疗方案推荐为曲妥珠单抗联合氟嘧啶类药物与顺铂(H E R2阳性的转移性腺癌)㊁顺铂或奥沙利铂联合氟嘧啶类药物(H E R2阴性的转移性腺癌)㊂除此之外紫衫类药物联合铂类或氟嘧啶类也有被提及,对于体能状况良好的患者可尝试3药联合,而对于体能状况较差的患者则考虑单药方案(如紫衫烷类/氟嘧啶类的疗法)[11-13]㊂2017年胃癌腹膜转移防治中国专家共识推荐S-1联合顺铂或奥沙利铂方案用作胃癌腹膜转移患者的一线治疗方案㊂同时还提出腹水较多患者为避免水化优选奥沙利铂;一般条件较差的患者也支持S-1单药或5-F U持续静滴的治疗方案[7]㊂但有研究表明仅全身化疗对胃癌腹膜转移治疗的中位O S短于3.1~10.6个月,故仅行全身化疗的效果有限[14]㊂H I P E C通过其热效应㊁热疗与化疗药物的协同抗肿瘤作用及机械冲刷作用,很好的清除了腹腔内微小亚临床转移灶㊂常用的灌注化疗药物包括紫杉醇㊁奥沙利铂㊁顺铂㊁丝裂霉素和表柔比星等[8]㊂从1980年首次将H I P E C用于临床以来,学者们一直致力于将H I P E C联合全身化疗㊁手术等综合治疗用于胃癌腹膜转移治疗并已取得相当进展[15]㊂Y o n e m u r a等[16]相继证明了不管是H I P E C单独使用还是联合化疗,其都能显著提高腹膜局部缓解率(表现为腹膜癌指数降低㊁游离肿瘤细胞转阴等)㊂并且联合彻底的减瘤术后患者的中位O S延长约13个月,是传统化疗方案中位O S的2倍[17]㊂近年提出的I P化疗新方法中,加压腹膜内气雾化学疗法(p r e s s u r i z e d i n t r a p e r i t o n e a l a e r o s o l c h e m o t h e r a p y,P I P A C)通过加压促进肿瘤药物的吸收,同时喷雾化学疗法增加药物覆盖腹膜表面的面积,从而提高治疗效率㊂虽然缺乏前瞻性研究,但其在小样本腹膜癌中被证明有高达近50%的肿瘤缓解率并且安全性较高[18-19]㊂需注意的是为避免增加局部毒性,P I P A C不与肿瘤细胞减灭术(c y t o r e d u c t i v e s u r g e r y,C R S)联用㊂此外有研究基于胃癌腹膜转移小鼠模型证明了共轭亚油酸耦合洛铂F-127(p l u-C L A)热响应水凝胶作为多西他赛控释内给药系统和白蛋白结合型紫杉醇(N a b-P T X)作为纳米颗粒级药物对胃癌腹膜转移的治疗都有相当潜力[20-21]㊂2.2联合手术的综合治疗虽然目前指南仍不建议胃癌腹膜转移患者在除了梗阻㊁严重出血等特殊情况外行手术治疗[11-13],但仅全身化疗作用有限的前提下,近30年药物㊁技术手段飞速发展使不少学者转变了治疗观念,不断探索联合手术的综合方案布局,试图寻找能从中获益的腹膜转移患者,并取得了一定的进展㊂2.2.1仅腹腔游离癌细胞阳性的胃癌患者(P0C y1)这部分患者的自然病程生存率和肉眼可见转移者几乎一样差,5年生存率低于5%[22]㊂对于其治疗方案,有研究报道胃癌根治术后联合S1单药辅助化疗可使仅C y1胃癌患者的中位O S达到22.3个月[23]㊂若术前接受腹腔㊁全身双途径化疗方案5个周期后脱落细胞学转阴再手术,中位O S可以从12.1个月延长到26.4个月[24]㊂但是,对于这些患者相关的临床研究较少,最合适治疗方案尚无普遍共识㊂2.2.2有肉眼可见腹膜转移的胃癌患者(P1C y0/1)据报道有30%单一腹膜转移的患者无需前期化疗即可完成肿瘤细胞减灭手术[25]㊂而对于不可直接切除的腹膜转移患者,自1990年日本转化治疗概念的兴起,开始将胃癌腹膜转移患者经一定标准筛选后,行全身和(或)局部化疗之后采取更积极的包括胃切除术㊁淋巴结切除术和腹膜切除术的最大程度C R S㊂转化治疗被认为能为这部分患者带来生存获益,而筛选标准尚未统一[14]㊂首先,全身化疗可作为减灭术前转化治疗策略其效果值得肯定㊂F u k u c h i等[26]分析表明一线或二线化疗后接受手术患者的生存时间远长于单独化疗的患者,且无论一线或二线化疗后,只要后续接受手术其生存期无明显差异㊂多数研究设计的转化治疗方案多有不同(氟嘧啶㊁铂类或紫衫类的联合),影响因素也较多,但是大都肯定了转化治疗后行手术治疗对比单纯化疗的生存优势[14]㊂并且,腹腔局部化疗手段联合手术的治疗方案经过30多年的探索已被认为是唯一可能根治胃癌腹膜转移患者策略[15]㊂J i等[17]筛选总结了近30年发表的有关C R S+H I P E C用于胃癌腹膜转移的29个临床试验,不管在回顾还是前瞻性分析中C R S+ H I P E C对比仅C R S都可将中位O S延长近半年, C R S+H I P E C后的1年,2年和5年中位生存率分㊃3411㊃‘临床荟萃“2020年12月20日第35卷第12期 C l i n i c a l F o c u s,D e c e m b e r20,2020,V o l35,N o.12Copyright©博看网. All Rights Reserved.别为50.0%,35.8%和13.0%且无显著不良反应,安全性值得肯定㊂再者,Y o n e m u r a等[16]相继开发的新辅助腹膜内和全身化疗(n e o a d j u v a n t i n t r a p e r i t o n e a l/s y s t e m i c c h e m o t h e r a p y,N I P S)和双向腹膜内和全身诱导化疗(b i d i r e c t i o n a l c h e m o t h e r a p y,B I S I C),即通过腹腔内(I P)和静脉(I V)给予多西紫杉醇和顺铂联合口服S-1的转化治疗方案,以及近年改进的腹腔镜热灌注(l a p a r o s c o p i c h y p e r t h e r m i c i n t r a p e r i t o n e a l c h e m o t h e r a p y,L S-H I P E C)都大大降低了腹膜癌指数(p e r i t o n e a l c a n c e r i n d e x,P C I)㊁消灭了游离的肿瘤细胞从而增加了患者行挽救性手术的机会,并且在联合C R S后可转化为生存获益[27]㊂H I P E C(顺铂和丝裂霉素C)联合全身化疗的N I P S方案也被证明有良好的疗效和耐受性[28]㊂借鉴结直肠癌转化治疗的成功经验及多年的积极成果,国际腹膜表面肿瘤学小组(P S O G I)认可了由腹腔镜评估㊁C R S和围手术期化学治疗(p e r i o p e r a t i v e c h e m o t h e r a p y,P O C)组成的综合治疗方案在胃癌中的疗效[29]㊂其中P O C包括L S-H I P E C㊁N I P S㊁H I P E C㊁E I P L㊁E P I C和术后晚期全身化疗[30]㊂目前评估腹腔肿瘤的方法主要是用于定量描述各种胃肠道肿瘤或原发性腹膜表面恶性肿瘤的腹膜转移灶大小和面积的表述方式 P C I和用于评估接受C R S后细胞减少的完整性的C C评分[30-31]㊂2.2.3综合治疗中关注的问题①必须强调转化治疗的生存获益主要来自最大程度的肿瘤切除,R a u 等[32]证明了接受H I P E C治疗的未切除原发肿瘤患者的总体生存率与仅接受全身化疗患者的总体生存率无显著差异,其原因参考药理学研究动物模型中H I P E C治疗的药物渗透浓度仅1.5mm,反映其减瘤作用非常有限,须联合C R S才可有生存获益㊂并且肿瘤细胞切除的完整性,大大影响了生存率[5,33]㊂②关于胃癌腹膜转移患者的转化治疗中也不乏有其他声音,专针对腹膜转移患者的Ⅲ期临床试验P h o e n i x-G C研究对比了腹膜转移患者的S-1联合H I P E C和静脉内紫杉醇的方案与标准S P方案(静脉输注顺铂联合口服S-1),联合组在腹水量适中的亚组中观察到生存获益㊂但整个研究人群的中位O S的延长差异无统计学意义[24]㊂Ⅲ期前瞻性随机对照试验R E G A T T A中不但未能显示出胃切除术对晚期转移性胃癌患者的生存益处,反而反映出不良反应发生率升高[34]㊂已发生腹膜转移的胃癌治疗中,能否联合手术一直是备受争议的话题,为了最大程度的减少C R S+H I P E C治疗的不良事件,业界学者认为除需详细做好基线评估工作(体能情况㊁影像学评估㊁血清水平等)㊁重视腹腔镜检查的作用,筛选出获益的患者的策略至关重要㊂日本学者认为P C I 临界水平高于12的患者应排除在C R S之外[15,25]㊂S e s h a d r i等[5]综合了目前研究所认为的生存预后预测因素包括:C R S联合H I P E C时肿瘤细胞减少的完整性㊁接受N I P S后P C Iɤ6㊁治疗机构的经验㊁对N I P S药物疗效㊁术前腹水的存在等㊂从而提出对于发生了腹膜转移的胃癌患者中适合C R S和H I P E C 治疗的理想候选人需具备:一般状况较好㊁年龄<60岁㊁P C I评分<10㊁原发肿瘤可切除㊁无腹水或主动脉旁淋巴结病及无肝脏等除腹膜外的远处转移,还有对新辅助治疗有良好反应,并可最大程度的行完整的细胞减灭术㊂但目前尚缺乏一套系统的筛查方法㊂③关于转化治疗用药及技术目前尚缺乏相关的规范㊂用药方面,全身给药途径包括3药方案如D C S㊁D C X和D O X,亦有两药联合靶向治疗方案如S P㊁X P或D C S方案联合曲妥珠单抗㊂而腹腔途径的药物的选择主要是基于其浸润深度及其细胞毒性作用而言,传统的丝裂霉素C和顺铂或多西紫杉醇的方案都是可以接受的,H I P E C的持续时间,流速,温度,药物选择和技术尚缺乏对照研究验证和共识指南[8]㊂封闭式L S-H I P E C和开放式H I P E C,在当前临床实践中都是可以接受的㊂Y o n e m u r a等[15-16]证明了N L H I P E C比传统H I P E C能减少小肠P C I㊂此外关于新辅助化疗方案的使用周期及手术时机也存在争议,目前的研究多集中在行2~6个周期的术前转化治疗,且同样需要重视的是手术后务必继续辅助化疗[25,32]㊂④采取这种更为积极的联合手段,不良事件发生率和死亡率也相应有一定升高㊂C R S +H I P E C相关的临床研究中最常见的不良事件包括胸腔积液㊁肠梗阻㊁败血症㊁伤口感染㊁阻塞㊁低白蛋白血症和吻合口漏[17]㊂对于转化失败或疾病进展的病例,应进行多学科诊疗(m u l t i d i s c i p l i n a r y t e a m, M D T),尽量延长生存期改善生活质量㊂目前欧洲和日本㊁亚洲腹膜表面恶性肿瘤治疗学院已经开设,期待广泛的国际多中心协作R C T试验产生级别更高的证据㊂2.3靶向治疗抗人表皮生长因子2(h u m a ne p i d e r m a l g r o w t hf a c t o r,H E R-2)的曲妥珠单克隆抗体已作为H E R-2阳性胃癌患者的一㊁二线推荐,其㊃4411㊃‘临床荟萃“2020年12月20日第35卷第12期 C l i n i c a l F o c u s,D e c e m b e r20,2020,V o l35,N o.12Copyright©博看网. All Rights Reserved.被认为可显著延长患者生存期[11-13]㊂但针对曲妥珠单抗对于腹膜转移灶的特异性治疗作用少见报道㊂1例日本的曲妥珠单抗联合T P方案化疗转化治疗成功的案例,不仅完成了转化治疗后的根治性手术(病理诊断为y p T3N1P0C y0,ⅡB期),且患者术后24个月仍无复发迹象[35]㊂基于胃癌腹膜转移的小鼠模型的实验研究,用同位素(211A t)标记的曲妥珠单抗灌注小鼠腹腔对比静脉曲妥珠单抗给药,证明前者对腹膜转移灶治疗效果略优于后者且可延长H E R-2阳性小鼠生存期[36]㊂虽然目前尚未看到相关的大规模临床试验数据公布,B e r r e t t a等[37]报道的1例60岁H E R2过表达的胃癌腹膜转移后患者,接受了6个周期的每周150m g曲妥珠单抗腹膜内给药的局部治疗后,未发生并发症且腹膜疾病控制稳定的结果来看,曲妥珠单抗腹腔局部用药可能在治疗H E R2过表达的胃癌腹膜转移患者中具有一定的潜力㊂此外,近年基于近红外光免疫疗法(n e a r i n f r a r e d p h o t o i mm u n o t h e r a p y,N I R-P I T)控制腹膜转移的发展,曲妥珠单抗-光吸收剂偶联物(A P C)在H E R2阳性胃癌细胞系的体外和体内疗效的基础试验也取得了一定的进展[38]㊂血管内皮生长因子(v a s c u l a r e n d o t h e l i a l g r o w t h f a c t o r,V E G F)被认为参与构成促进胃癌腹膜转移的微环境,美国食品药品监督管理局已经批准雷莫卢单抗(人类I g G1单克隆抗体和V E G F R-2拮抗剂)用于复发或转移性胃或食管连接部腺癌患者的二线治疗,虽然两项大型Ⅲ期研究R E G A R D(二线雷莫卢单抗对比安慰剂)㊁R A I N B OW(二线雷莫卢单抗联合P T X对比雷莫卢单抗)中的腹膜转移亚组分析都没有发现获益[7]㊂对腹腔灌洗液细胞学检查阳性的患者使用H I P E C 联合阿帕替尼和S1的单组观察性研究N C T03428425正在招募中㊂C e t u m a x o m a b是一种非人源化单克隆抗体,它主要以大多胃癌腹膜转移患者都会高水平表达的一种I型跨膜糖蛋白 上皮细胞黏附分子(E p C AM)为靶点㊂虽然在入组35例胃癌腹膜转移者的前瞻性Ⅱ期随机对照研究中其联合F L O T化疗对比单纯化疗获益不明显[39]㊂但其也被认为有希望纳入综合治疗策略研究中,它在胃癌中应用的Ⅰ㊁Ⅱ期临床试验N C T04222114正在进行患者的招募㊂2.4免疫治疗免疫治疗蓬勃发展的大背景下, N i v o l u m a b和P e m b r o l i z u m a b在A T T R A C T I O N-2和K E Y N O T E-059两项研究中用于后线治疗晚期胃癌的突出表现使P D-L1单抗获批治疗末线晚期胃癌,并且认为P e m b r o l i z u m a b可能在体能状况较好㊁P D-L1阳性(C P Sȡ1%)或者微卫星不稳定的患者中疗效更好[40-41]㊂但其针对腹膜转移的疗效尚不清楚,且预测免疫治疗疗效的检测指标如P D-L1表达㊁微卫星的表达状态等的预测效果也尚有争议,有待大型R C T临床研究的验证㊂2.5放射治疗及其他治疗放射治疗在I V期G C 中的作用仍存在争议,Z h a o等[33]中国的一项回顾性分析证明姑息放疗在多变量分析中未改善转移性G C患者的生存率,但也有研究肯定了放疗在姑息性缓解症状和联合手术延长生存率方面的潜力[42]㊂此外,营养支持㊁中医药等辅助姑息治疗手段在胃癌腹膜转移患者治疗中地位同样举足轻重㊂综上所述,腹膜转移作为胃癌防治的难点及热点之一,目前其预防和治疗主要是以系统化疗为基础,手术㊁H I P E C等局部腹腔化疗㊁靶向免疫治疗和姑息支持等相结合的综合治疗方案,还推荐M D T讨论制定合理的个体化方案使患者最大程度获益㊂其中最有前景的H I P E C联合手术的转化治疗及靶向㊁免疫治疗等探索中的治疗手段与药物研究都值得期待㊂参考文献:[1] B r a y F,F e r l a y J,S o e r j o m a t a r a m I,e ta l.G l o b a lc a n c e rs t a t i s t i c s2018:G L O B O C A N e s t i m a t e s o f i n c i d e n c e a n dm o r t a l i t y w o r l d w i d e f o r36c a n c e r s i n185c o u n t r i e s[J].C AC a n c e r JC l i n,2018,68(6):394-424.[2] C h e n W,Z h e n g R,B a a d e P D,e ta l.C a n c e rs t a t i s t i c si nC h i n a,2015[J].C AC a n c e r JC l i n,2016,66(2):115-132.[3] T h o m a s s e nI,v a n G e s t e l Y R,v a n R a m s h o r s t B,e t a l.P e r i t o n e a l c a r c i n o m a t o s i s o f g a s t r i c o r i g i n:A p o p u l a t i o n-b a s e ds t u d y o n i n c i d e n c e,s u r v i v a l a n d r i s k f a c t o r s[J].I n t JC a n c e r,2014,134(3):622-628.[4] M i k uła-P i e t r a s i k J,U r u s k i P,T y k a r s k i A,e t a l.T h ep e r i t o n e a l s o i l f o rac a n c e r o u s s e e d :A c o m p r e h e n s i v er e v i e wo f t h e p a t h o g e n e s i s o f i n t r a p e r i t o n e a l c a n c e rm e t a s t a s e s[J].C e l lM o l L i f eS c i,2018,75(3):509-525.[5]S e s h a d r i R A,G l e h e n O.C y t o r e d u c t i v e s u r g e r y a n dh y p e r t h e r m i ci n t r a p e r i t o n e a lc h e m o t h e r a p y i n g a s t r i cc a n c e r[J].W o r l d JG a s t r o e n t e r o l,2016,22(3):1114-1130.[6] M a s u d aT,K u r a m o t o M,S h i m a d aS,e ta l.T h ee f f e c to fe x t e n s i v e i n t r a o p e r a t i v e p e r i t o n e a l l a v a g et h e r a p y(E I P L)o ns t a g eⅢB+C a n d c y t o l o g y-p o s i t i v e g a s t r i c c a n c e r p a t i e n t s[J].I n t JC l i nO n c o l,2016,21(2):289-294.[7]季加孚,沈琳,徐惠绵,等.胃癌腹膜转移防治中国专家共识[J].中华普通外科学文献(电子版),2017,11(5):289-297.[8] L e m o i n eL,S u g a r b a k e r P,V a n d e r S p e e t e nK.D r u g s,d o s e s,㊃5411㊃‘临床荟萃“2020年12月20日第35卷第12期 C l i n i c a l F o c u s,D e c e m b e r20,2020,V o l35,N o.12Copyright©博看网. All Rights Reserved.a n dd u r a t i o n so f i n t r a p e r i t o n e a lc h e m o t h e r a p y:s t a n d a r d i s i n gH I P E Ca n dE P I Cf o r c o l o r e c t a l,a p p e n d i c e a l,g a s t r i c,o v a r i a np e r i t o n e a ls u r f a c e m a l i g n a n c i e sa n d p e r i t o n e a l m e s o t h e l i o m a[J].I n t JH y p e r t h e r m i a,2017,33(5):582-592.[9]I l h a nE,A l e m d a r A,U r e y e n O,e ta l.T h ei m p o r t a n c eo fe x t e n s i v e i n t r a o p e r a t i v e p e r i t o n e a l l a v a g e a s a p r o m i s i n gm e t h o d i n p a t i e n t s w i t h g a s t r i c c a n c e r s h o w i n g p o s i t i v ep e r i t o n e a lc y t o l o g y w i t h o u to v e r t p e r i t o n e a l m e t a s t a s i sa n do t h e r t h e r a p e u t i c a p p r o a c h e s[J].J I n v e s t S u r g,2017,30(5): 318-324.[10] B e e h a r r y MK,N iZ T,Y a n g Z Y,e ta l.S t u d yp r o t o c o lo fam u l t i c e n t e r p h a s eⅢr a n d o m i z e dc o n t r o l l e dt r i a l i n v e s t i g a t i n g t h e e f f i c i e n c y o f t h e c o m b i n a t i o no f n e o a d j u v a n t c h e m o t h e r a p y(N A C)a n d n e o a d j u v a n t l a p a r o s c o p i c i n t r a p e r i t o n e a lh y p e r t h e r m i c c h e m o t h e r a p y(N L H I P E C)f o l l o w e d b y R0g a s t r e c t o m y w i t hi n t r a o p e r a t i v e H I P E Cf o ra d v a n c e d g a s t r i cc a n c e r(A G C):d r a g o nⅡt r i a l[J].B M C C a n ce r,2020,20(1):224.[11]J a p a n e s eG a s t r i cC a n c e rA s s o c i a t i o n.J a p a n e s e g a s t r i cc a n c e rt r e a t m e n t g u i d e l i n e s2014(v e r.4)[J].G a s t r i cC a n c e r,2017, 20(1):1-19.[12] A j a n i J A,D'A m i c oT A,A l m h a n n aK,e t a l.G a s t r i c c a n c e r,v e r s i o n3.2016,N C C Nc l i n i c a l p r a c t i c e g u i d e l i n e s i no n c o l o g y[J].JN a t l C o m p rC a n cN e t w,2016,14(10):1286-1312.[13] W a n g F H,S h e nL,L i J,e t a l.T h e C h i n e s e S o c i e t y o f C l i n i c a lO n c o l o g y(C S C O):c l i n i c a l g u i d e l i n e sf o rt h ed i a g n o s i sa n d t r e a t m e n to f g a s t r i cc a n c e r[J].C a n c e r C o mm u n(L o n d), 2019,39(1):10.[14] W a n g Z,C h e n J Q,L i u J L,e t a l.I s s u e s o n p e r i t o n e a lm e t a s t a s i so f g a s t r i cc a n c e r:a n u p d a t e[J].W o r l dJ S u r gO n c o l,2019,17(1):215.[15] Y o n e m u r aY,S a k oS,W a k a m a S,e t a l.H i s t o r y o f p e r i t o n e a ls u r f a c e m a l i g n a n c y t r e a t m e n ti n J a p a n[J].I n d i a n J S u r gO n c o l,2019,10(S u p p l1):3-11.[16] Y o n e m u r a Y,I s h i b a s h i H,H i r a n o M,e t a l.E f f e c t s o fn e o a d j u v a n t l a p a r o s c o p i c h y p e r t h e r m i c i n t r a p e r i t o n e a lc h e m o t h e r a p y a nd ne o a d j u v a n t i n t r a p e r i t o n e a l/s y s t e m i cc h e m o t h e r a p y o n p e r i t o n e a l m e t a s t a s e sf r o m g a s t r i cc a n c e r[J].A n nS u r g O n c o l,2017,24(2):478-485. [17]J i Z H,P e n g KW,Y u Y,e ta l.C u r r e n ts t a t u sa n df u t u r ep r o s p e c t s o f c l i n i c a l t r i a l so nC R S+H I P E Cf o r g a s t r i cc a n c e r p e r i t o n e a lm e t a s t a s e s[J].I n t JH y p e r t h e r m i a,2017,33(5): 562-570.[18] N a d i r a d z e G,G i g e r-P a b s t U,Z i e r e n J,e ta l.P r e s s u r i z e dI n t r a p e r i t o n e a lA e r o s o l C h e m o t h e r a p y(P I P A C)w i t h l o w-d o s ec i s p l a t i na n dd o x o r u b i c i n i n g a s t r i c pe r i t o n e a lm e t a s t a s i s[J].JG a s t r o i n t e s t S u r g,2016,20(2):367-373.[19] E l l e bækS B,G r a v e r s e n M,D e t l e f s e n S,e ta l.P r e s s u r i z e di n t r a p e r i t o n e a l a e r o s o lc h e m o t h e r a p y(P I P A C)o f p e r i t o n e a lm e t a s t a s i s f r o m g a s t r i c c a n c e r:a d e s c r i p t i v e c o h o r t s t u d y[J].C l i nE x p M e t a s t a s i s,2020,37(2):325-332.[20] B a e WK,P a r k M S,L e e J H,e t a l.D o c e t a x e l-l o a d e dt h e r m o r e s p o n s i v e c o n j u g a t e d l i n o l e i c a c i d-i n c o r p o r a t e dp o l o x a m e r h y d r o g e l f o r t h e s u p p r e s s i o n o f p e r i t o n e a lm e t a s t a s i s o f g a s t r i cc a n c e r[J].B i o m a t e r i a l s,2013,34(4): 1433-1441.[21] V a nd eS a n d eL,C o s y n s S,W i l l a e r tW,e t a l.A l b u m i n-b a s e dc a n c e r t h e r a p e u t i c s f o r i n t r a p e r i t o n e a ld r u g de l i v e r y:Ar e v i e w[J].D r u g D e l i v,2020,27(1):40-53.[22] C o h e nN A,K i n g h a m T P.M i n i m a l l y i n v a s i v e s t a g i n g s u r g e r yf o r c a n c e r[J].S u rg O n c o l C l i nN A m,2019,28(1):61-77.[23] K a n oK,A o y a m a T,M a e z a w a Y,e ta l.T h es u r v i v a la n dp r o g n o s t i c a t o r so f p e r i t o n e a lc y t o l o g y-p o s i t i v e g a s t r i cc a n c e r p a t i e n t sw h o r e c e i v e du p f r o n t g a s t r e c t o m y a n d s u b s e q u e n tS-1c h e m o t h e r a p y[J].I n t JC l i nO n c o l,2017,22(5):887-896.[24]I s h i g a m iH,F u j i w a r aY,F u k u s h i m aR,e t a l.P h a s eⅢt r i a lc o m p a r i n g i n t r a p e r i t o n e a l a n di n t r a v e n o u s p a c l i t a x e l p l u sS-1v e r s u s c i s p l a t i n p l u sS-1i n p a t i e n t s w i t h g a s t r i cc a n c e rw i t hp e r i t o n e a lm e t a s t a s i s:P HO E N I X-G Ct r i a l[J].JC l i n O n c o l, 2018,36(19):1922-1929.[25] Y o s h i d aK,Y a m a g u c h iK,O k u m u r aN,e ta l.I sc o n v e r s i o nt h e r a p yp o s s i b l ei ns t a g eI V g a s t r i cc a n c e r:t h e p r o p o s a lo f n e wb i o l o g i c a l c a t e g o r i e so f c l a s s i f i c a t i o n[J].G a s t r i cC a n c e r, 2016,19(2):329-338.[26] F u k u c h i M,M o c h i k i E,I s h i g u r o T,e t a l.P r o g n o s t i cs i g n i f i c a n c eo fc o n v e r s i o ns u r g e r y f o l l o w i n g f i r s t-o rs e c o n d-l i n e c h e m o t h e r a p y f o r u n r e s e c t a b l e g a s t r i c c a n c e r[J].A n t i c a n c e rR e s,2018,38(11):6473-6478.[27] C a n b a y E,M i z u m o t oA,I c h i n o s e M,e t a l.O u t c o m ed a t ao fp a t i e n t s w i t h p e r i t o n e a lc a r c i n o m a t o s i sf r o m g a s t r i c o r i g i n t r e a t e db y as t r a t e g y o fb i d i r e c t i o n a lc h e m o t h e r a p yp r i o rt oc y t o r ed u c t i ve s u r g e r y a n d h y p e r t h e r m i c i n t r a p e r i t o n e a lc h e m o t h e r a p y i nas i n g l es p e c i a l i z e dc e n t e r i nJ a p a n[J].A n nS u r g O n c o l,2014,21(4):1147-1152.[28] B a d g w e l lB,B l u m M,D a s P,e t a l.P h a s eⅡt r i a l o fl a p a r o s c o p i ch y p e r t h e r m i ci n t r a p e r i t o n e a lc h e m o p e r f u s i o nf o r p e r i t o n e a lc a r c i n o m a t o s i s o r p o s i t i v e p e r i t o n e a lc y t o l o g y i np a t i e n t sw i t h g a s t r i ca d e n o c a r c i n o m a[J].A n n S u r g O n c o l, 2017,24(11):3338-3344.[29] O'D w y e r S,V e r w a a lV J,S u g a r b a k e rP H,e t a l.E v o l u t i o no ft r e a t m e n t sf o r p e r i t o n e a l m e t a s t a s e sf r o m c o l o r e c t a lc a n c e r[J].JC l i nO n c o l,2015,33(18):2122-2123. [30] Y o n e m u r a Y,C a n b a y E,L i Y,e ta l.A c o m p r e h e n s i v et r e a t m e n t f o r p e r i t o n e a lm e t a s t a s e sf r o m g a s t r i cc a n c e rw i t hc u r a t i v e i n t e n t[J].E u rJS u r g O n c o l,2016,42(8):1123-1131.[31]J a c q u e t P,S u g a r b a k e rP H.C l i n i c a l r e s e a r c hm e t h o d o l o g i e s i nd i a g n o s i s a n d s t a g i n g o f p a t ie n t sw i t h p e r i t o n e a l c a r c i n o m a t o s i s[J].C a n c e rT r e a tR e s,1996,82:359-374.[32] R a uB,B r a n d lA,T h u s s-P a t i e n c eP,e ta l.T h ee f f i c a c y o ft r e a t m e n t o p t i o n s f o r p a t i e n t s w i t h g a s t r i c c a n c e r a n dp e r i t o n e a lm e t a s t a s i s[J].G a s t r i cC a n c e r,2019,22(6):1226-㊃6411㊃‘临床荟萃“2020年12月20日第35卷第12期 C l i n i c a l F o c u s,D e c e m b e r20,2020,V o l35,N o.12Copyright©博看网. All Rights Reserved.1237.[33] Z h a oL,L iJ,B a iC,e ta l.M u l t i-m o d a l i t y t r e a t m e n tf o rp a t i e n t sw i t hm e t a s t a t i c g a s t r i c c a n c e r:Ar e a l-w o r l ds t u d y i nC h i n a[J].F r o n tO n c o l,2019,9:1155.[34] F u j i t a n iK,Y a n g H K,M i z u s a w aJ,e ta l.G a s t r e c t o m yp l u sc h e m o t h e r a p y v e r s u s c h e m o t h e r a p y a l o n e f o r ad v a n ce d g a s t r i cc a n c e rw i t ha s i n g l e n o n-c u r a b l e f a c t o r(R E G A T T A):a p h a s e3,r a n d o m i s e dc o n t r o l l e dt r i a l[J].L a n c e t O n c o l,2016,17(3):309-318.[35] M a t s u d aY,S u z u k iS,M a e h a r a R,e ta l.A c a s eo f g a s t r i cc a r c i n o m aw i t h p e r i t o n e a ld i s se m i n a t i o nt r e a t e d w i t hc u r a t i v er e s e c t i o n f o l l o w i n g t r a s t u z u m a b p l u s c a p e c i t a b i n e p l u s c i s p l a t i nc o m b i n ed t he r a p y[J].G a nT oK a g a k uR y o h o,2018,45(4):709-711.[36] L iH K,M o r o k o s h i Y,N a g a t s uK,e t a l.L o c o r e g i o n a l t h e r a p yw i t hα-e m i t t i n g t r a s t u z u m a ba g a i n s t p e r i t o n e a l m e t a s t a s i so fh u m a n e p i d e r m a l g r o w t h f a c t o r r e c e p t o r2-p o s i t i v e g a s t r i cc a n c e r i nm i c e[J].C a n c e r S c i,2017,108(8):1648-1656.[37] B e r r e t t a M,F i s i c h e l l a R,B o r s a t t iE,e ta l.F e a s i b i l i t y o fi n t r a p e r i t o n e a l T r a s t u z u m a b t r e a t m e n t i n a p a t i e n t w i t hp e r i t o n e a l c a r c i n o m a t o s i sf r o m g a s t r i cc a n c e r[J].E u r R e vM e dP h a r m a c o l S c i,2014,18(5):689-692.[38] N a g a y a T,O k u y a m a S,O g a t a F,e t a l.N e a ri n f r a r e dp h o t o i mm u n o t h e r a p y u s i n g af i b e ro p t i cd i f f u s e rf o rt r e a t i n gp e r i t o n e a l g a s t r i cc a n c e rd i s s e m i n a t i o n[J].G a s t r i c C a n c e r, 2019,22(3):463-472.[39] K nöd l e rM,Kör f e r J,K u n z m a n nV,e t a l.R a n d o m i s e d p h a s eⅡt r i a l t o i n v e s t i g a t e c a t u m a x o m a b(a n t i-E p C AMˑa n t i-C D3)f o rt r e a t m e n to f p e r i t o n e a lc a r c i n o m a t o s i si n p a t i e n t s w i t hg a s t r i c c a n c e r[J].B r JC a n c e r,2018,119(3):296-302.[40] B a n g Y J,K a n g Y K,C a t e n a c c iD V,e ta l.P e m b r o l i z u m a ba l o n e o r i n c o mb i n a t i o nw i t hc h e m o t h e r a p y a s f i r s t-l i n e t h e r a p yf o r p a t i e n t sw i t ha d v a n c e dg a s t r i c o r g a s t r o e s o ph a g e a l j u n c ti o na d e n o c a r c i n o m a:r e s u l t sf r o m t h e p h a s eⅡn o n r a n d o m i z e dK E Y N O T E-059s t u d y[J].G a s t r i cC a n c e r,2019,22(4):828-837.[41] K a n g Y K,B o k u N,S a t o h T,e ta l.N i v o l u m a bi n p a t i e n t sw i t h a d v a n c e d g a s t r i c o r g a s t r o e s o p h a g e a l j u n c t i o n c a n c e r r e f r a c t o r y t o,o r i n t o l e r a n t o f,a t l e a s t t w o p r e v i o u sc h e m o t h e r a p y r e g i m e n s(O N O-4538-12,A T T R A C T I O N-2):a r a n d o m i s e d,d o ub l e-b l i n d,p l ac e b o-c o n t r o l l e d,p h a s e3t r i a l[J].L a n c e t,2017,390(10111):2461-2471.[42] Y e S,W a n g L,Z u oZ,e t a l.T h e r o l e o f s u r g e r y a n d r a d i a t i o ni n a d v a n c e d g a s t r i c c a n c e r:A p o p u l a t i o n-b a s e d s t u d y o fS u r v e i l l a n c e,E p i d e m i o l o g y,a n d E n d R e s u l t sd a t a b a s e[J].P L o SO n e,2019,14(3):e0213596.收稿日期:2020-06-26编辑:王秋红㊃7411㊃‘临床荟萃“2020年12月20日第35卷第12期 C l i n i c a l F o c u s,D e c e m b e r20,2020,V o l35,N o.12Copyright©博看网. All Rights Reserved.。
序贯腹腔热灌注间隔腹腔注射化疗对胃癌腹膜转移的效果观察

浙江医学2018年第40卷第5期胃癌是世界范围内第四大常见肿瘤,位居癌症相关死亡原因的第2位[1]。
进展期胃癌侵及浆膜层,易出现腹膜转移,15%~50%的患者初诊时即存在腹膜转移,35%~50%患者术后复发的主要形式为腹膜转移[2]。
胃癌腹膜转移常采取姑息治疗,预后差,患者中位生存时间约6个月[3]。
如何提高胃癌继发腹膜转移患者的疗效一直是临床关注的重点及难点。
近年来临床兴起的腹腔热灌注化疗(HIPEC )是指将含化疗药物的灌注液精准恒温、循环灌注、充盈腹腔并维持一定时间,预防和治疗腹膜的种植转移。
HIPEC 利用肿瘤细胞耐热性差、热效应与抗肿瘤药物的协同作用,以及充分灌注、持续冲刷、洗脱、过滤肿瘤细胞的原理,在胃癌继发腹膜转移的治疗中取得了良好效果[4-6]。
腹腔内-全身新辅助化疗方案(NIPS )是指同时联用紫杉醇和替吉奥,将腹腔注射化疗(IPC )与口服或静脉全身性化疗相结合,对胃癌伴腹膜转移患者进行术前化疗。
然而,HIPEC 需不断腹腔置管,存在持续给药困难,化疗连贯性不够理想;而IPS 对化疗药物在腹腔内弥散充分性尚还欠缺。
基于以上考虑,笔者团队采用序贯HIPEC 间隔IPC 的方法治疗胃癌腹膜转移,现将结果报道如下。
1临床资料1.1一般资料回顾2016年8至12月本院胃肠外科收治的胃癌伴腹膜转移患者17例,其中男12例,女5例;年龄43~74岁,平均56.8岁。
本组患者均为胃癌初治,KPS 体力评分≥70分,均有不同程度上腹部疼痛、不适症状,胃镜及活检病理确诊胃癌,B 超及CT 等影像学检查均发现胃癌伴中-大量腹水,排除肝、肺等远处转移情况,常规口服稀钡造影排除系膜挛缩。
1.2化疗方法1.2.1HIPEC患者全身麻醉后,脐下作纵行1cm 切口,气腹针穿刺充入二氧化碳气体,形成12~14cmH 2O 压力的气腹。
直视下分别于左、右腹直肌外侧缘及脐上、下5cm 穿刺置入4个trocar ,左上为直径1cm 的trocar ,其余均为直径0.5cm 的trocar ;常规留取200ml 腹水送脱落细胞学检查,并切取2~3处腹膜结节送病理学检查;分别于肝脏膈面、脾窝及右盆腔各留置1条有多个侧孔的硅胶导管,于右下腹、左下腹、右上腹和左上腹壁引出固定,体外循环管路连接温热化疗灌注机(广州保瑞医疗技术有限公司,BR-TRG-Ⅱ型),予0.9%氯化钠注射液3000~5000ml 中加入紫杉醇(澳大利亚Hospira Aus -tralia Pty Ltd 公司,规格:5ml ∶30mg ,批准文号H20150350)20mg/m 2,43℃,400ml/min 进水速度,循环热灌注化疗60min ;结束后允许腹腔存留灌注液,但不超过1500ml ,关闭循环管路,术后48h 内进行第2次HIPEC ,共2次。
