2018高考化学-精品课件-专题17 水的电离和溶液的酸碱性
合集下载
最新-2018届高考化学一轮复习 第十章 第一节 电离平衡 水的电离和溶液的酸碱性课件 精品

②水解方面 据水解规律:有弱才水解,越弱越水解判断。如25
℃时,CH3COONa溶液的pH>7。
③稀释方面 a.pH相等的HCl溶液与醋酸溶液稀释相同的倍数,
pH变化小的为CH3COOH。 b.pH相等的HCl溶液与醋酸溶液稀释后pH仍相同,
则加水多的为CH3COOH。
在选择强酸作为参照物来证明某酸是弱酸时,不仅 要注意外界条件(温度、浓度)相同,还要注意酸的 元数也相同才可以。
(2)电离平衡的特点 ①动——动态平衡:v(离子化)=v(分子化)≠0。 ②定——平衡时各组成成分一定,即平衡时溶液中离
子浓度和分子浓度 保持不变 。
③变——条件改变,平衡被破坏。
(3)影响电离平衡的因素 ①内因:电解质本身的性质决定了其 电离程度 的
大小。
②外因:a.温度:升高温度,电离平衡向 电离 方 向移动,因为电离过程中需要破坏化学键,为 吸热 过程。
③强弱电解质与溶液导电性的关系
溶液导电能力的强弱,取决于离子浓度的大小及所 带电荷与电解质的强弱无关,例如:0.2 mol/L的盐 酸导电能力强于0.1 mol/L的盐酸,0.1 mol/L的 CuSO4溶液导电能力强于0.1 mol/L的NaCl溶液,稀 HCl的导电能力弱于浓CH3COOH的导电能力等。
(1)pH适用于c(H+)≤1 mol·L-1的溶液,为了使用时 更方便,当溶液中c(H+)≥1 mol·L-1或c(OH-)≥1 mol·L-1时,一般不用pH表示溶液的酸碱性,而用 物质的量浓度表示溶液的酸碱性。
(2)常温时溶液无限稀释时,溶液的酸碱性主要决定 于水电离的离子浓度,故pH趋近于7。但酸性溶液 无限稀释后,pH不可能≥7,碱性溶液无限稀释后, pH不可能≤7。
CH3COOH NH3·H2O
℃时,CH3COONa溶液的pH>7。
③稀释方面 a.pH相等的HCl溶液与醋酸溶液稀释相同的倍数,
pH变化小的为CH3COOH。 b.pH相等的HCl溶液与醋酸溶液稀释后pH仍相同,
则加水多的为CH3COOH。
在选择强酸作为参照物来证明某酸是弱酸时,不仅 要注意外界条件(温度、浓度)相同,还要注意酸的 元数也相同才可以。
(2)电离平衡的特点 ①动——动态平衡:v(离子化)=v(分子化)≠0。 ②定——平衡时各组成成分一定,即平衡时溶液中离
子浓度和分子浓度 保持不变 。
③变——条件改变,平衡被破坏。
(3)影响电离平衡的因素 ①内因:电解质本身的性质决定了其 电离程度 的
大小。
②外因:a.温度:升高温度,电离平衡向 电离 方 向移动,因为电离过程中需要破坏化学键,为 吸热 过程。
③强弱电解质与溶液导电性的关系
溶液导电能力的强弱,取决于离子浓度的大小及所 带电荷与电解质的强弱无关,例如:0.2 mol/L的盐 酸导电能力强于0.1 mol/L的盐酸,0.1 mol/L的 CuSO4溶液导电能力强于0.1 mol/L的NaCl溶液,稀 HCl的导电能力弱于浓CH3COOH的导电能力等。
(1)pH适用于c(H+)≤1 mol·L-1的溶液,为了使用时 更方便,当溶液中c(H+)≥1 mol·L-1或c(OH-)≥1 mol·L-1时,一般不用pH表示溶液的酸碱性,而用 物质的量浓度表示溶液的酸碱性。
(2)常温时溶液无限稀释时,溶液的酸碱性主要决定 于水电离的离子浓度,故pH趋近于7。但酸性溶液 无限稀释后,pH不可能≥7,碱性溶液无限稀释后, pH不可能≤7。
CH3COOH NH3·H2O
化学:2018高考一轮复习《水的电离和溶液的pH》课件大纲版

知识点2
溶液的酸碱性和pH
问题2:溶液酸碱性的实质?pH的表示方法?溶液的pH简
单计算和测定方法?
考点1 影响水电离平衡的因素
1.温度:由于水的电离过程吸热,故升温使水的电离平衡右移, 即加热能促进水的电离,c(H+)、c(OH-)同时增大,KW增大,
pH变小,但c(H+)与c(OH-)仍相等,故体系仍显中性。
的电离、水的离子积、溶液pH等概念。
知识点1
水的电离
问题1:水的电离性质?水的离子积大小?影响水的电离平衡的 因素?
【思维延伸】 1.水的电离
水是一种极弱的电解质,只能微弱地电离,并存在着电离平
衡。水的电离方程式:H2O+H2O 为H2O H++OH-。 2.水的离子积常数 25℃时,由纯水的导电性实验测得,1 L纯水中只有 1×10-7 mol H2O电离。所以在常温时:KW=c(H+)· c(OH-) =1×10-7×1×10-7=1×10-14。KW只与温度有关,KW 是常数。 H3O++OH-,简写
b.强碱溶液,如B(OH)n,设浓度为c mol· L-1,
c(H+)= mol· L-1,pH=-1gc(H+)=14+lg(nc)。 ②酸、碱混合pH计算
a.两强酸混合
c混 (H+ ) = c1 (H+ ) V1 + c2 (H + ) V2 V1 + V2
b.两强碱混合
c混 (OH- ) = c1 (H+ ) V1 + c2 (H+ ) V2 V1 + V2
【例1】 25℃时,水的电离达到平衡:H2O ΔH>0,下列叙述正确的是
H++OH-, ( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B.向水中加入少量固体硫酸氢钠,c(H+)增大,K+不变
人教版高考化学复习水的电离,溶液的酸碱性ppt

酸碱中和滴定
• (3)“考”指示剂的选择 • ①强酸强碱相互滴定,可选用甲基橙或酚酞; • ②若反应生成强酸弱碱盐溶液呈酸性,则选用酸性变色范围的指示剂(甲基橙),若反应生成
强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞); • ③石蕊溶液因颜色变化不明显,且变色范围过宽,一般不作指示剂。 • (4)“考”误差分析
人教版高考化学复习水的电离,溶液 的酸碱 性ppt
19
人教版高考化学复习水的电离,溶液 的酸碱 性ppt
题组集训
• 解析 A项,25 ℃时,Kw=c(H+)·c(OH-)=1.0×10-14,25 ℃时,c(H+)=10-7 mol·L-1,
pH=7,水呈中性,正确;
• B项,100 ℃时,Kw=c(H+)·c(OH-)=2.5×10-13,c(H+)>10-7 mol·L-1,pH<7,水呈中性,
)
• ⑧酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)(
)
人教版高考化学复习水的电离,溶液 的酸碱 性ppt
15
人教版高考化学复习水的电离,溶液 的酸碱 性ppt
酸碱中和滴定
• 如:用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”“偏低”或 “无影响”填空。
• ①酸式滴定管未用标准溶液润洗( 偏高 ) • ②锥形瓶用待测溶液润洗( 偏高 ) • ③锥形瓶洗净后还留有蒸馏水( 无影响 ) • ④放出碱液的滴定管开始有气泡,放出液体后气泡消失( 偏低 ) • ⑤酸式滴定管滴定前有气泡,滴定终点时气泡消失( 偏高 ) • ⑥部分酸液滴出锥形瓶外( 偏高 ) • ⑦酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯)( 偏低 ) • ⑧酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)( 偏高 )
高中化学第二节 水的电离和溶液的酸碱性优秀课件
例:25C时,100mL 0.05mol / LNaOH溶液 的PH为 _________。
c( H
)
KW c(OH
)
11014 0.05mol / L
2 1013mol / L
pH lg c(H )
lg 2 10(OH )
2V
2
解法二:c(OH ) 106 V 104 V mol / L 104 mol / L
2V
2
c( H
)
11014 104
mol
/
L
2 1010mol
/
L
2 思路:OH-的物质的量守恒,先求出混合后 溶液的c(OH-),再求pH 。
c(OH )混
c(OH
)1
V1 V1
c(OH V2
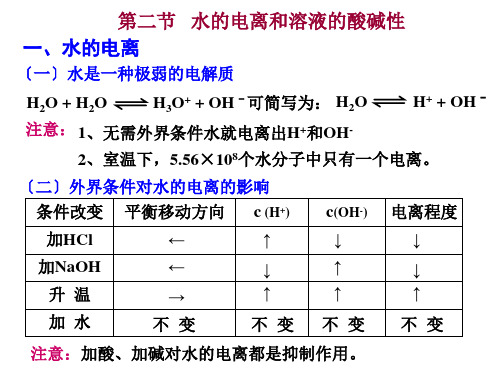
第二节 水的电离和溶液的酸碱性 一、水的电离
〔一〕水是一种极弱的电解质
H2O + H2O
H3O+ + OH - 可简写为: H2O
注意: 1、无需外界条件水就电离出H+和OH-
H+ + OH -
2、室温下,5.56×108个水分子中只有一个电离。
〔二〕外界条件对水的电离的影响 条件改变 平衡移动方向 c (H+)
例:pH = 2和pH = 4的强酸等体积混合,求混合溶液的pH 。
思路:H+的物质的量守恒, 先求混合后溶液的c(H+),再求pH。
c(H
)混
c(H )1
V1 c(H )2 V1 V2
V2
解:c(H )混
10 2
V 10 4 2V
V
mol
/
L
10 2
高三化学复习水的电离和溶液的酸碱性PPT课件

1、温度 2、酸 3、碱 4、盐
强酸弱碱盐 强碱弱酸盐
强酸强碱盐
NH4Cl CH3COONa NaCl
二、影响水的电离平衡的因素
知识
整合
H2O
H+ + OH- △H﹥0
1、升温
c(H+)总
Kw 变化
平衡 移动 方向
c(H+)水 c(OH—)水 c(H+)总 c(OH—)总 pH
与 c(OH—)总
酸 碱 性
与 c(OH—)总
酸 碱 性
关系
不变 左 减小 减小 增大 减小 减小 >
酸
⑴怎样判断水的电离平衡移动方向? ⑵H+、OH-的来源?c(H+)总 ?c(H+)水 c(OH-)总 ?c(OH-)水 ⑶KW如何表示?
二、影响水的电离平衡的因素
知识
整合
H2O
H+ + OH- △H﹥0
3、碱
c(H+)总
Kw 变化
高三化学复习研讨 课
课前 小测
25℃时, 1、pH=2的溶液中,水电离的c(H+)=
2、水电离的c(H+)=1×10-12mol·L-1,则溶液的pH=
知识
一、水的电离
梳理
1、定性分析
(1)水电离的原因是什么?
(2)水的电离有什么特点?
提示:可从水电离的程度、过程、热效应等方面分析。
一、水的电离
⑶KW如何表示?
二、影响水的电离平衡的因素
知识
整合
H2O
H+ + OH- △H﹥0
4、强碱弱酸盐
c(H+)总
Kw 变化
2018年高考化学二轮专题复习课件:《水的电离和溶液的酸碱性》(共71张PPT)

c HCl×V HCl VNaOH c(NaOH)=________________ 计算。
考点串讲深度剖析
影响水电离平衡的因素 以及水电离出的c(H+) 或c(OH-)的计算
1.外界条件对水电离的影响
2.水电离出的c(H+)或c(OH-)的计 算(25 ℃时) (1)中性溶液:c(H+)=c(OH-)= 1.0×10-7 mol/L。
因
玻璃活塞无法打开
为
Байду номын сангаас
____________________________
(2) 实 验 操 作 ( 以 标 准 盐 酸 滴 定 待 测 NaOH溶液为例) ①滴定前的准备 润洗 a . 滴 定 查漏 管 : _____→ 洗 涤 →______→装液→调液面→记录。 b .锥形瓶:注碱液→记读数→加指 示剂。
(4)水解呈酸性或碱性的盐溶液
H+和OH-均由水电离产生。
如pH=2的NH4Cl溶液中由水电离出 的c(H+)=10-2 mol/L; pH=12的Na2CO3溶液中由水电离出 的c(OH-)=10-2 mol/L。
特别提醒 溶质为酸或碱的溶液中: (1)当酸电离出的H+远大于水电离出 的H+时,水电离出的H+可忽略不计. (2)当碱电离出的OH-远大于水电离 出的OH-时,水电离出的OH-可忽 略不计。
1.电离方程式
水是一种极弱的电解质,其电离方程式 ++OH- H O H 2 为:______________________。 2.室温下纯水的有关数据
(1)c(H+)=c(OH-)=1.0×10-7 mol· L-
1.
(2)KW
c(H+)· c(OH-)
= =
1.0×10-14 ________________________
考点串讲深度剖析
影响水电离平衡的因素 以及水电离出的c(H+) 或c(OH-)的计算
1.外界条件对水电离的影响
2.水电离出的c(H+)或c(OH-)的计 算(25 ℃时) (1)中性溶液:c(H+)=c(OH-)= 1.0×10-7 mol/L。
因
玻璃活塞无法打开
为
Байду номын сангаас
____________________________
(2) 实 验 操 作 ( 以 标 准 盐 酸 滴 定 待 测 NaOH溶液为例) ①滴定前的准备 润洗 a . 滴 定 查漏 管 : _____→ 洗 涤 →______→装液→调液面→记录。 b .锥形瓶:注碱液→记读数→加指 示剂。
(4)水解呈酸性或碱性的盐溶液
H+和OH-均由水电离产生。
如pH=2的NH4Cl溶液中由水电离出 的c(H+)=10-2 mol/L; pH=12的Na2CO3溶液中由水电离出 的c(OH-)=10-2 mol/L。
特别提醒 溶质为酸或碱的溶液中: (1)当酸电离出的H+远大于水电离出 的H+时,水电离出的H+可忽略不计. (2)当碱电离出的OH-远大于水电离 出的OH-时,水电离出的OH-可忽 略不计。
1.电离方程式
水是一种极弱的电解质,其电离方程式 ++OH- H O H 2 为:______________________。 2.室温下纯水的有关数据
(1)c(H+)=c(OH-)=1.0×10-7 mol· L-
1.
(2)KW
c(H+)· c(OH-)
= =
1.0×10-14 ________________________
高三化学复习课水的电离和溶液的酸碱性ppt课件.ppt

与 c(OH—)总
酸碱性
关系
pH=4 NH4Cl
10-14 10-4
10-4
10-4 10-10
4
>
酸
pH=10 CH3COONa
10-14
10-4
10-4
10-10 10-4 10
<
碱
NaCl 10-14 10-7
10-7
10-7
10-7
7
=
中
影响水电离平衡因素的定量分析 病原体侵入机体,消弱机体防御机能,破坏机体内环境的相对稳定性,且在一定部位生长繁殖,引起不同程度的病理生理过程
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
能力 提升
☆(07天津)25 ℃时,水的电离达到平衡:
H2O
H++OH-;H>0,
下列叙述正确的是( B )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 D.将水加热,KW增大,pH不变
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
课前 小测
25℃时, 1、pH=2的溶液中,水电离的c(H+)=
2、水电离的c(H+)=1×10-12mol·L-1,则溶液的pH=
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
《高中化学》水的电离和溶液的酸碱性 ppt课件

c(H+)与pH、溶液酸碱性的关系: 常温下
c(H+) 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14 pH 1
2 3 4
5
6
7
8
9
10
11
12
13
14
c(H+)增大,pH减小 酸性增强
c(OH-)减小
ppt课件
16
2、强酸与强酸混合:
强酸Ⅰ: cⅠ 强酸Ⅱ: cⅡ
电离
电离
c (H+)Ⅰ
c (H+)Ⅱ
c (H+)混合
-lg
pH
练习:pH=2的盐酸溶液和0.0 0005 mol/L的硫酸溶液等 体积混合,试计算混合溶液的pH值 解:∵c (H+)Ⅰ=0.01 mol/L c (H+)Ⅱ=0.00005×2=0.0001 mol/L 0.01 V 0.0001 V + 0.005mol / L c (H )混合= 2V pH=- lg 0.005 = 2+lg2 = 2.3 两种强酸等体积混合,混合液 pH = pH 小+ lg2 ppt课件 = pH小+0.3
弱酸、弱碱的稀释
弱碱稀释 11 例:pH=12的NaOH溶液稀释10倍后pH=? > 11 pH=12的氨水稀释10倍后pH= ? 结论:稀释10倍pH变化(减小)<1.
稀释相同倍数时
pH: 氨水>NaOH
pH 12 11 NaOH 氨水
稀释到相同pH时
稀释的倍数:
V水
10倍
氨水>NaOH
24
ppt课件
化学课件《水的电离和溶液的酸碱性》优秀ppt30 人教课标版

任何水溶液中,都存在水的电离平衡,都有H+和OH-。
二、溶液的酸碱性与pH
1. 溶液的酸碱性与c(H+)、c(OH-)的关系(常温) 中性溶液:c(H+) = c(OH-) = 1.0×10-7mol/L 酸性溶液:c(H+) > c(OH-)
c(H+) > 1.0×10-7mol/L
c(OH-) < 1.0×10-7mol/L
§3.2水的电离和溶液的酸碱性
(第2课时)
溶液pH的计算
【学习目标】
1.了解各类混合溶液 pH的计算。
2.了解溶液稀释时pH的变化规律。
【重点难点】
了解各类混合溶液 pH的计算。
复习回顾
+ - lg c (H ) 。 1.pH的定义:pH= -)· +) c (OH c (H 2.水的离子积: Kw= ;
-14 10 = 5×10-3
= 2×10-12 mol/L
pH=-lgc(H+) = - lg(2×10-12) = 11.7
溶液pH的计算
3.强碱与强碱溶液混合后的pH的计算 方法: 先求c(OH-),通过c(H+)= KW ,再求pH。 c(OH )
c(OH-)混=
交流· 研讨 试求算pH=4的盐酸与pH=12的氢氧化钠等体积混合 后的pH。 解:据题意可知碱过量,计算过量的氢氧根离子浓度:
溶液pH的计算
5.酸、碱溶液稀释后的pH的计算
碱按碱,酸按酸, 同强混合在之间, 异强混合看过量, 无限稀释7为限。
强酸 弱酸 强碱 弱碱 (pH=a) (pH=a) (pH=b) (pH=b)
稀释10n倍 后的pH
a+n
pH≈7 但小于7 a+0.3
化学课件《水的电离和溶液的酸碱性》优秀ppt25 人教课标版

10-4 mol/L×1 L = x mol/L×10 L
解得 x = 10-5 mol/L.即pH = 5 那么稀释102倍后,10-4 mol/L×1 L = x mol/L×100 L. 解得 x= 10-6 mol/L.pH = 6
那么稀释104倍后,10-4 mol/L×1 L = x mol/L×10000 L. 解得 x= 10-8 mol/L.pH = 8.但酸不可能稀释为碱。因此稀释 10000倍以后pH = 7.
c稀释前(OH-)=
Kw c(H+)
=
10-14 10-10
= 10-4 mol/L
10-4 mol/L×1 L = x mol/L×10 L 解得 x = 10-5 mol/L.
则c稀释后(H+)=
Kw c(OH-)
=
10-14 10-5
= 10-9 mol/L
即pH = 9
同理稀释102倍后,pH = 8
因此如果溶液中水电离出的C(H+)=10-13 mol/L,则此 溶液既可能是酸性溶液,也可能是碱性溶液。
2、pH值 计算:pH = -lg[H+] 范围:0 - 1 mol/L 例:25℃时 中性溶液:[H+]= 1×10-7 mol/L pH = 7 酸性溶液:[H+]= 1×10-5 mol/L pH = 5 碱性溶液:[H+]= 1×10-9 mol/L pH = 9
即 8 < pH < 9
稀释10000倍以后,按计算pH = 5.但碱仍然不能稀 释成酸。因此pH = 7.
ØpH值计算2,3—— 酸或者碱的稀释 酸碱稀释规律: 1、以7为中心,向7靠拢。
2、强酸稀释10n倍后,pH = pH稀释前 + n 强碱稀释10n倍后,pH = pH稀释前 - n
解得 x = 10-5 mol/L.即pH = 5 那么稀释102倍后,10-4 mol/L×1 L = x mol/L×100 L. 解得 x= 10-6 mol/L.pH = 6
那么稀释104倍后,10-4 mol/L×1 L = x mol/L×10000 L. 解得 x= 10-8 mol/L.pH = 8.但酸不可能稀释为碱。因此稀释 10000倍以后pH = 7.
c稀释前(OH-)=
Kw c(H+)
=
10-14 10-10
= 10-4 mol/L
10-4 mol/L×1 L = x mol/L×10 L 解得 x = 10-5 mol/L.
则c稀释后(H+)=
Kw c(OH-)
=
10-14 10-5
= 10-9 mol/L
即pH = 9
同理稀释102倍后,pH = 8
因此如果溶液中水电离出的C(H+)=10-13 mol/L,则此 溶液既可能是酸性溶液,也可能是碱性溶液。
2、pH值 计算:pH = -lg[H+] 范围:0 - 1 mol/L 例:25℃时 中性溶液:[H+]= 1×10-7 mol/L pH = 7 酸性溶液:[H+]= 1×10-5 mol/L pH = 5 碱性溶液:[H+]= 1×10-9 mol/L pH = 9
即 8 < pH < 9
稀释10000倍以后,按计算pH = 5.但碱仍然不能稀 释成酸。因此pH = 7.
ØpH值计算2,3—— 酸或者碱的稀释 酸碱稀释规律: 1、以7为中心,向7靠拢。
2、强酸稀释10n倍后,pH = pH稀释前 + n 强碱稀释10n倍后,pH = pH稀释前 - n
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
命题趋势
2.趋势分析 预计pH调控、中和滴定等在生产 、生活、物质的提纯等方面的应用在高考中出
知识体系构建
现的可能性较大,考生应予以重视。
高考帮·化学
考情精解读 5
专题十七
水的电离和溶液的酸碱性
考纲解读
命题规律
命题趋势
知识体系构建
返回目录
知识全通关
高考帮·化学
知识全通关 1
专题十七有机化学基础(选修五) 水的电离和溶液的酸碱性 考点1 水的电离
全国Ⅰ,13 全国Ⅱ,26
2015天津,5,6分 全国Ⅱ,11 2015江苏,11,4分 2015浙江,12,6分 2014上海,21,4分
知识体系构建
(4)
高考帮·化学
考情精解读 3
专题十七
水的电离和溶液的酸碱性
考纲解读
考查内容
2016全国
2015全国
2014全国
自主命题区域
2016天津,6,6分 2015广东,12,4分 2015江苏,7,2分
继续学习
高考帮·化学
知识全通关 5
专题十七有机化学基础(选修五) 水的电离和溶液的酸碱性
注意
当c(H+)>1 mol· L-1时,一般不用pH表示溶液的酸碱性,用c(H+)或c(OH-)直接
表示溶液的酸碱性更方便。 (1)未指明温度时,pH=7不代表溶液呈中性,如100 ℃时,pH=6为中性溶液。 (2)溶液的酸碱性也可以用pOH表示:pOH=-lg c(OH-)。因为常温下,c(OH)· c(H+)=10-14,若两边均取负对数得: pH+pOH=14。
都增大,故Kw增大,但溶液仍呈中性;对于Kw,若未注明温度,一般认为是在常温下
返回目录
(25 ℃)。
高考帮·化学
知识全通关 3
专题十七有机化学基础(选修五) 水的电离和溶液的酸碱性 考点2 溶液的酸碱性与pH
1.溶液的酸碱性
2.溶液的pH (1)定义:pH=-lg c(H+)。 (2)pH 与溶液中c(H+)的关系
目 录 Contents
考情精解读 A.知识全通关 B.题型全突破 C.能力大提升
考点1 考点3
考点2
考法1 考法3
考法2 考法4
方法1
考情精解读
高考帮·化学
考情精解读 1
专题十七
水的电离和溶液的酸碱性
考纲解读
专题十七 水的电离和溶液的酸碱性
命题规律
01
1.了解水的电离、离子积常数。
2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。
继续学习
Байду номын сангаас
高考帮·化学
知识全通关 7
专题十七有机化学基础(选修五) 水的电离和溶液的酸碱性
(3)常用酸碱指示剂及其变色范围
指示剂 甲基橙
石蕊 酚酞
pH及变色范围 pH减小 3.1~4.4 pH增大 红色 橙色 黄色
pH减小 5~8 pH增大 pH减小 8.2~10 pH增大 红色 无色 紫色 浅红色 蓝色 红色
命题趋势
知识体系构建
高考帮·化学
考情精解读 2
专题十七
水的电离和溶液的酸碱性
考纲解读
考查内容
水的电离平
2016全国
2015全国
2014全国
自主命题区域
2015广东,11,4分 2015天津,5,6分 2015江苏,6,2分
命题规律
衡和离子积 常数
2014山东,13,5分
命题趋势
溶液的酸碱 性与pH
(1)pH试纸不能伸入待测液中。 (2)pH试纸不能事先润湿(润湿相当于将溶液稀释)。用pH试纸测定的是一个粗略结果。 (3)用广泛pH试纸测出溶液的pH是整数,而不会是3.1、5.2等小数。
1.水的电离平衡 水是一种极弱的电解质,能发生微弱的电离:H2O+H2O H2O H++OH-。 2.水的离子积常数 (1)概念:在一定温度下,c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离 子积。 (2)表达式:水的离子积用Kw表示。 实验测得,25 ℃时,1 L水中只有 1.0×10-7 mol H2O电离。 所以该温度时的纯水中c(H+)=c(OH-)=1.0×10-7 mol· L-1,Kw=c(H+)· c(OH-)=1.0×10-14, 室温下Kw一般也取这个值。 (3)影响因素:Kw只与温度有关。温度升高,Kw增大。 H3O+ + OH-,可简写为
命题规律
酸碱中和滴定
全国Ⅰ,12
全国Ⅱ,28(2)
2014北京,27(2)
命题趋势
知识体系构建
高考帮·化学
考情精解读 4
专题十七
水的电离和溶液的酸碱性
考纲解读
1.热点预测 高考对本专题内容的考查仍将以
命题规律
外界条件对水的电离平衡的影响、溶液pH的 计算及中和滴定原理在物质含量测定中的应用 为主,题型多为选择题,分值约为3~6分。
继续学习
高考帮·化学
知识全通关 6
专题十七有机化学基础(选修五) 水的电离和溶液的酸碱性
3.pH的测定方法 (1)pH试纸法 pH试纸的使用方法:取一片pH试纸,放在洁净的表面皿或玻璃片上,用洁净干燥的玻 璃棒蘸取待测液点于试纸中央,然后与标准比色卡对照读出数值。 pH试纸的种类:常用的pH试纸有广泛pH试纸(pH范围为1~14或0~10,可识别的pH 差值约为1)和精密pH试纸(pH范围较窄,可识别的pH差值为0.2或 0.3)。 (2)pH计法 常用pH计来精确测量溶液的pH,读数时应保留两位小数。
继续学习
高考帮·化学
知识全通关 2
专题十七有机化学基础(选修五) 水的电离和溶液的酸碱性
注意
外界条件改变,水的电离平衡发生移动,但任何时候水电离出的c(H+)和c(OH-)总是 相等的。 (1)水的离子积不仅适用于纯水,也适用于稀的电解质水溶液,不适用于含水很少的 物质(如浓硫酸)。 (2)在室温时,任何物质的水溶液的Kw=10-14。Kw与溶液的酸碱性无关,只与温度 有关。 (3)水的电离是吸热过程,升高温度,水的电离平衡向电离方向移动,c(H+)和c(OH-)
①25 ℃时,纯水的pH=7,溶液呈中性;pH<7的溶液呈酸性;pH>7的溶液呈碱性。
②pH表示溶液的酸碱性及其强弱:25 ℃时,pH(<7)越小,溶液的酸性越强; pH(>7)越大,溶液的碱 性越强。
继续学习
高考帮·化学
知识全通关 4
专题十七有机化学基础(选修五) 水的电离和溶液的酸碱性
(3)pH的适用范围 常温下,当溶液的酸碱性用pH表示时,一般情 况下,1×10-14 mol· L-1<c(H+)<1 mol· L-1,即 14>pH>0。pH=0的溶液中并非无H+,而是 c(H+)=1 mol· L-1;pH=14的溶液中并非无OH-, 而是c(OH-)=1 mol· L-1。
