自身免疫肝病抗体谱检测试剂盒(条带免疫印迹法)产品技术要求siderun
可提取性核抗原(ENA)自身抗体谱检测试剂盒(免疫印迹法) 产品技术要求万孚

1.性能指标
1.1外观
a)试剂盒应完整、牢固,标志应清晰;
b)膜条应洁净、无杂物;
c)试剂盒中各组份应配置齐备,且含有标准图谱、说明书;
d)各试剂应清亮无悬浮物、沉淀和颗粒(显色液 A 允许有颗粒状物悬浮)。
1.2试剂盒质控线的判断
阴性参考品、阳性参考品与膜条反应后,在膜条上距零线下约 2mm 处应出现一条棕色线。
在以下特异性、分析灵敏度、稳定性、精密度试验中,阴性、阳性膜条上均应出现。
试剂质控线是判断试剂有没有失效的标准。
1.3标准图谱精密性
棕色的线条,应与膜条零线平行,能与标准谱中相应区带对应,其偏差应不超过±1mm,边缘应清晰,肉眼应能辨认。
1.4分析特异性
a)与七种阳性参考品反应的膜条应出现标准谱中对应的阳性区带,无假阴性;
b)与十份阴性参考品反应的膜条不应出现阳性区带,无假阳性。
1.5分析灵敏度
阳性参考品 1:100 稀释后,按操作说明书标准程序操作,阳性区带应出现。
1.6精密度
1.6.1批内精密度
同批试剂盒中取足量的成品检测抗 Sm、抗 U 1RNP、抗 rRNP、抗 SSA、抗SSB、抗 Scl-70 及抗Jo-1 阳性参考品和 10 份阴性参考品,检测结果应一致。
1.6.2批间精密度
取连续三个批次的试剂盒检测抗 Sm、抗U 1RNP、抗rRNP、抗SSA、抗SSB、
抗 Scl-70 及抗 Jo-1 阳性参考品和 10 份阴性参考品,检测结果应一致。
1.7装量最大允许负偏差
各试剂的装量最大允许负偏差应≤5%。
抗核抗体检测试剂盒(磁条码免疫荧光法)产品技术要求丽珠

1性能指标
1.1外观
试剂盒各组份应齐全、完整,标签清晰,易识别;液体无渗漏。
1.2准确度
对准确度参考品进行检测,双链DNA(dsDNA)IgG抗体的相对偏差应在±20%范围内。
1.3最低检测限
对检测限参考品进行检测,dsDNA IgG抗体的检测限应不高于10 IU/mL;其它定性指标对应的各指标的L1应为阳性、L2应为阳性或阴性、L3应为阴性。
1.4线性
dsDNA IgG抗体在10~ 600 IU/mL范围内,其线性相关系数(r)r2应不小于0.950。
1.5阴性参考品符合率
对10份阴性参考品进行检测,对应指标的阴性参考品符合率应为100%。
1.6阳性参考品符合率
对12份阳性参考品进行检测,对应指标的阳性参考品符合率应为100%。
1.7重复性
对重复性参考品检测10次,同一指标的变异系数(CV)应不大于15%。
1.8批间差
用三个批号试剂盒检测同一份重复性参考品,批间差应不大于20%。
1.9dsDNA 校准品均匀性
1.9.1瓶内均匀性
校准品的瓶内均匀性(变异系数,CV)应不大于15%。
1.9.2瓶间均匀性
校准品的瓶间均匀性(变异系数,CV)应不大于15%。
自身免疫肝病抗体谱检测试剂盒(条带免疫印迹法)产品技术要求siderun

自身免疫肝病抗体谱检测试剂盒(条带免疫印迹法)产品技术要求siderun自身免疫肝病抗体谱检测试剂盒(条带免疫印迹法)适用范围:用于体外定性检测人血清中抗AMA M2、LKM1、LC1、SLA、F-Actin、gp210、sp100、SSB、SSA/52kd和CENP B的IgG 抗体。
1.1. 包装规格20人份/盒1.2. 型号型号为ALD-10-A;ALD-9-A;ALD-8B-A;ALD-8F-A;ALD-8C-A;ALD-7-A;ALD-6-A;ALD-4-A其中,各型号检测项目如下:表1 各型号检测项目1.3 主要组成成分:表2 主要组成成分抗原膜条包被抗原型号说明见表3(不同产品型号包被不同抗原组合)表3抗原膜条包被抗原型号说明2.1.外观2.1.1.试剂盒外部包装盒应整洁,各组分应齐全完整,文字符号标识清晰,所有试剂瓶密闭,无漏液。
2.1.2.样本缓冲液为无色或淡黄色澄清液体;浓缩洗液(10×)为无色澄清液体;酶结合物(10×)为无色或淡黄色澄清液体;底物液为淡黄色澄清液体。
2.2.净含量液体试剂装量不小于标示值。
2.3.膜条宽度膜条宽度不低于1.8mm。
2.4.临界值及重复性自身免疫肝病抗体谱企业参考品各检测项目临界值浓度均为15U/ml。
阳性参考品各检测项目抗体浓度均为20U/ml,检测10次,结果的阳性率为100%,反应结果一致;阴性参考品各检测项目抗体浓度均为10U/ml,检测10次,结果的阴性率为100%,反应结果一致。
2.5.批间差抽取三个批次的试剂盒,每个批次按临界值及重复性的检验方法检测,各浓度反应结果应一致,应符合临界值及重复性的要求。
2.6.稳定性2℃~8℃保存,有效期18个月,取到效期1个月内试剂盒进行检测,应符合2.4的要求。
自身免疫性肝病自身抗体谱的检测及临床应用

自身免疫性肝病自身抗体谱的检测及临床应用发表时间:2014-07-02T10:28:41.077Z 来源:《中外健康文摘》2014年第14期供稿作者:林波刘莹刘志宇[导读] 自身免疫性肝病发病机制与免疫功能异常密切相关,自身抗体在发病机制中起重要作用。
林波刘莹刘志宇(黑龙江省牡丹江市康安医院检验科 157011)【摘要】目的探讨联合检测多种自身抗体在原发性胆汁性肝硬化(PBC)及自身免疫性肝炎(AIH)诊断中的价值及临床意义。
方法用免疫印迹法分别检测2012~2014年本院提供的35例PBC患者、13例AIH患者和5例健康体检者血清中的抗线粒体(AMA)-M2亚型抗体、抗3E(BPO)抗体、抗Sp100抗体、抗早幼粒细胞性白血病(PML)抗体、抗gp210抗体、抗肝肾微粒体-1(LKM-1) 抗体、抗肝特异性胞质1型(LC-1)抗体、可溶性肝抗原/肝胰抗原抗体(抗SLA/LP抗体)、抗Ro-52抗体。
结果35例PBC中抗AMA-M2抗体、抗3E(BPO)抗体、抗Sp100抗体、抗PML抗体、抗gp210抗体、抗LC-1抗体、抗SLA/LP抗体、抗Ro-52抗体阳性率分别为82.15%、77.21%、15.63%、56.25%、6.88%、9.38%、6.25%、56.25%,而以上8种自身抗体在13例AIH患者中的阳性率分别为18.52%、18.52%、14.81%、14.81%、7.41%、3.70%、7.41%、66.67%。
抗LKM-1抗体在PBC中未检测出,而在AIH的阳性率为11.11%。
结论抗AMA-M2抗体、抗3E抗体、抗PML抗体、抗gp210抗体的联合检测对PBC的诊断有着较高的应用价值,而对AIH的诊断意义不大,而LKM-1对PBC的诊断没有价值,而对AIH具有较高的诊断价值。
自身免疫性肝病自身抗体谱检测对PBC、AIH诊断、鉴别诊断、治疗及预后判断均有重要意义。
【关键词】肝硬化肝炎自身免疫性自身抗体【中图分类号】R446.61 【文献标识码】A 【文章编号】1672-5085(2014)14-0150-02 自身免疫性肝病是患者自身免疫系统攻击肝脏引起的炎症和肝细胞坏死,其特征是慢性和进展性的,其主要包括自身免疫性肝炎(AIH)、原发性胆汁性肝硬化(PBC)、原发性硬化性胆管炎(PSC)。
抗核抗体谱检测试剂盒(条带免疫印迹法)产品技术要求斯德润

抗核抗体谱检测试剂盒(条带免疫印迹法)适用范围:用于体外定性检测人血清中的抗Mi-2、Ku、nRNP/Sm、Sm、SSA/60kd、SSA/52kd、SSB、 Scl-70、PM/Scl、Jo-1、CENP B、PCNA、dsDNA、核小体、组蛋白、P0和AMA M2的IgG抗体。
1.1. 包装规格20人份/盒(型号为ANA-17-A;ANA-15M-A;ANA-15K-A;ANA-13-A;ANA-12-A;ANA-9N-A;ANA-9D-A;ANA-8N-A;ANA-8D-A;ANA-7-A;ANA-5-A)其中,各型号检测项目如下:抗原膜条包被抗原型号说明见表2(不同产品型号包被不同抗原组合)表2抗原膜条包被抗原型号说明2.1. 外观2.1.1. 试剂盒外部包装盒应整洁,各组分应齐全完整,文字符号标识清晰,所有试剂瓶密闭,无漏液。
2.1.2. 样本缓冲液为无色或淡黄色澄清液体;浓缩洗液(10×)为无色澄清液体;酶结合物(10×)为无色或淡黄色澄清液体;底物液为淡黄色澄清液体。
2.2. 净含量液体试剂装量不小于标示值。
2.3. 膜条宽度膜条宽度不低于1.8mm。
2.4. 临界值及重复性抗核抗体谱企业参考品各检测项目临界值浓度均为15U/ml(dsDNA为75IU/ml)。
阳性参考品各检测项目抗体浓度均为20U/ml(dsDNA为100IU/ml),检测10次,结果的阳性率为100%,反应结果一致;阴性参考品各检测项目抗体浓度均为10U/ml(dsDNA为50IU/ml),检测10次,结果的阴性率为100%,反应结果一致。
2.5. 批间差抽取三个批次的试剂盒,每个批次按临界值及重复性的检验方法检测,各浓度反应结果应一致,应符合临界值及重复性的要求。
2.6. 稳定性效期稳定性:试剂盒有效期为2~8℃保存18月,取有效期满1个月内试剂盒,检测应符合2.4的要求。
致密细斑点型抗核抗体在系统性自身免疫性风湿性疾病诊断中的意义

致密细斑点型抗核抗体在系统性自身免疫性风湿性疾病 诊断中的意义
杨可可, 吴俊渊, 曹兴建
(南通市第一人民医院检验科,南通 江苏 226001)
摘要:目的 探讨致密细斑点型抗核抗体在系统性自身免疫性风湿性疾病(SARD)诊断中的价值。方 法 选取1 683例疑似或确诊为SARD的患者,分别用间接免疫荧光法(IIF)检测抗核抗体,免疫印迹法检测 自身抗体。对IIF阳性、免疫印迹法阴性和2种方法均阳性的样本进行抗核抗体核型分析。采用秩相关分析评 价致密细斑点型抗核抗体滴度与SARD的相关性。结果 IIF检测抗核抗体的阳性率与免疫印迹法检测自身抗 体的阳性率比较,差异无统计学意义(P=0.155)。在72例IIF阳性、免疫印迹法阴性样本中,核颗粒型、致 密细斑点型、均质型和核仁型所占比例分别为44.44%、40.28%、12.50%、2.78%。致密细斑点型所占比例与 核颗粒型比较、差异无统计学意义(P=0.701);与均质型、核仁型比较,差异均有统计学意义(P=0.001、 P<0.001)。致密细斑点型抗核抗体的荧光滴度与SARD无相关性(r=-0.300,P=0.667)。644例2种方法均阳 性的样本中,无致密细斑点型抗核抗体阳性。结论 致密细斑点型抗核抗体阳性或可用于排除SARD。
关键词:致密细斑点型抗核抗体;自身抗体;系统性自身免疫性风湿性疾病
Role of anti-nuclear antibody-dense fine speckled pattern for diagnosing systemic autoimmune rheumatic disease YANG Keke,WU Junyuan,CAO Xingjian.(Department of Clinical Laboratory,the First People's Hospital of Nantong,Nantong 226001,Jiangsu,China)
自身免疫性肝病相关抗体测定试剂盒(磁微粒化学发光法)产品技术要求华晟源
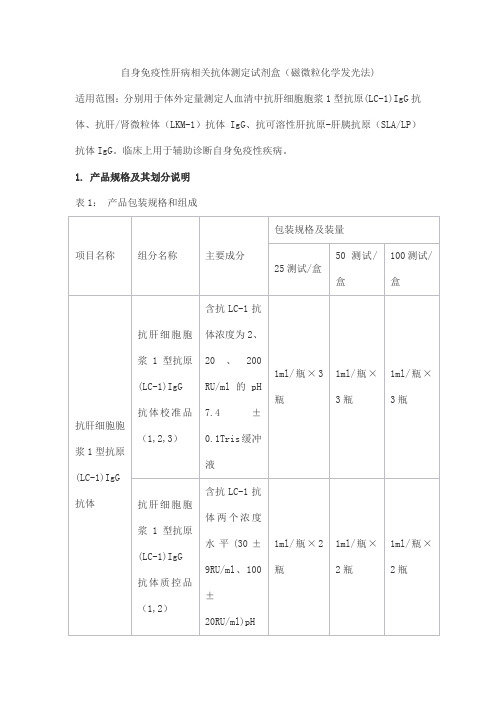
自身免疫性肝病相关抗体测定试剂盒(磁微粒化学发光法)
适用范围:分别用于体外定量测定人血清中抗肝细胞胞浆1型抗原(LC-1)IgG抗体、抗肝/肾微粒体(LKM-1)抗体IgG、抗可溶性肝抗原-肝胰抗原(SLA/LP)抗体IgG。
临床上用于辅助诊断自身免疫性疾病。
1. 产品规格及其划分说明
表1:产品包装规格和组成
2. 性能指标2.1外观
试剂盒各组分应齐全、完整、液体无渗漏;磁分离试剂摇匀后为均匀悬浊液,无明显凝集;液体组分应澄清,无沉淀或絮状物;包装标签应清晰,易识别。
2.2准确度
回收率均应在85%~115%范围内。
2.3线性
2.4空白限
2.5重复性
变异系数(CV)均应不大于10.0%。
2.6质控品赋值有效性
各个项目的质控品测定值,每次测定结果均应在质控品测定值允许范围内。
(质控品测定值允许范围为都是 30±9RU/ml、100±20RU/ml)。
2.7批间差
批间变异系数(CV)均应不大于15.0%。
2.8稳定性
产品在2℃~8℃条件下保存超过有效期,取失效期产品进行检测,检测结果应满足2.2~2.6项要求。
2.9校准品溯源性
根据GB/T21415-2008及有关规定,自身免疫性肝病相关抗体检测试剂盒各个项目校准品溯源到相应的企业工作校准品。
自身免疫性肝病抗体谱检测试剂盒(免疫印迹法)产品技术要求亚辉龙

2 性能指标
2.1外观
2.1.1包装外观
a)试剂盒应无任何破损;
b)试剂盒内的试剂组分包装无破损,无内容物溢出;
c)标签外观完整,无脱落,标签标识内容清晰;
d)检测膜条黏附整齐,干燥无杂色;编号及起始线清晰;
e)判读卡上参考带、功能质控带、临界质控带及所有可测定抗体显色区带文字和标志清晰、准确。
2.1.2试剂外观
试剂应澄清、无混浊和絮状沉淀。
2.2阳性符合率
用试剂盒检测阳性质控物(含待测的 6 种抗体)3 次,不出现假阴性。
2.3阴性符合率
用试剂盒检测阴性质控物 3 次,不出现假阳性。
2.4重复性
阳性质控物10 次检测结果应一致。
1。
抗核抗体谱检测试剂盒(条带免疫印迹法)产品技术要求siderun

抗核抗体谱检测试剂盒(条带免疫印迹法)适用范围:用于体外定性检测人血清中抗Mi-2、Ku、nRNP/Sm、Sm、SSA/60kd、SSA/52kd、SSB、 Scl-70、PM/Scl、Jo-1、CENP B、PCNA、dsDNA、核小体、组蛋白、P0和AMA M2的IgG抗体。
1.1. 包装规格20人份/盒1.2 型号型号为ANA-17-A;ANA-15M-A;ANA-15K-A;ANA-13-A;ANA-12-A;ANA-9N-A;ANA-9D-A;ANA-8N-A;ANA-8D-A;ANA-7-A;ANA-5-A其中,各型号检测项目如下:表1 各型号检测项目1.3. 主要组成成分表2 主要组成成分抗原膜条包被抗原型号说明见表3(不同产品型号包被不同抗原组合)表3抗原膜条包被抗原型号说明2.1.外观2.1.1.试剂盒外部包装盒应整洁,各组分应齐全完整,文字符号标识清晰,所有试剂瓶密闭,无漏液。
2.1.2.样本缓冲液为无色或淡黄色澄清液体;浓缩洗液(10×)为无色澄清液体;酶结合物(10×)为无色或淡黄色澄清液体;底物液为淡黄色澄清液体。
2.2.净含量液体试剂装量不小于标示值。
2.3.膜条宽度膜条宽度不低于1.8mm。
2.4.临界值及重复性抗核抗体谱企业参考品各检测项目临界值浓度均为15U/ml(dsDNA为75IU/ml)。
阳性参考品各检测项目抗体浓度均为20U/ml(dsDNA为100IU/ml),检测10次,结果的阳性率为100%,反应结果一致;阴性参考品各检测项目抗体浓度均为10U/ml(dsDNA为50IU/ml),检测10次,结果的阴性率为100%,反应结果一致。
2.5.批间差抽取三个批次的试剂盒,每个批次按临界值及重复性的检验方法检测,各浓度反应结果应一致,应符合临界值及重复性的要求。
2.6.稳定性2℃~8℃保存,有效期18个月,取到效期1个月内试剂盒进行检测,应符合2.4的要求。
免疫印迹法检测肝自身抗体谱及其临床应用

【 b t c 】 O j t e T a h o at n bde se r tm u ei r i a d o S S t lb i , c r y A s a t be i o er r u at o i c u i a o m n v s s a S Sh r i i yac a , r cv S c f o i sp t m n u i led e e n ta e eea l t u c
21 0 0年 4月 上 第 2卷 第 7期
Ap i r l 2 0 01
V0 . 1 2 No 7 .
中 国 中 医 药 咨 讯
Ju a f iaTrdt n 1 ie eMe iieIfr to o m l n a io a n s den o main o Ch i Ch n ・9 ・ 9
抗核抗体谱检测(免疫印迹法)

抗核抗体谱检测(免疫印迹法)1 目的熟悉自身免疫性疾病抗核抗体谱检测标准操作规程,以便于更加规范化的操作,提高免疫检验质量,保证结果的准确性。
2 适用范围适用于免疫室内自身免疫性疾病抗核抗体谱检测3 职责检验科主任负责组织人员制定自身免疫性疾病抗核抗体谱检测标准操作程序,免疫室组长负责组织人员具体实施。
4 该SOP变动程序本标准程序的变动,可由任一使用本SOP的工作人员提出,,并报经下述人员批准签字:专业组长、科主任。
5原理该欧蒙印迹法试剂盒用于体外定性检测血清或血浆中的人抗nRNP、Sm、SS-A(天然SS-A 和Ro-52)、SS-B、Scl-70、PM-Scl、Jo-1、CENP B、PCNA、dsDNA、核小体、组蛋白、核糖体P蛋白和AMA M2等14种不同抗原IgG类抗体。
实验膜条上平行包被了这些高度纯化的抗原。
在第一次温育时,已稀释的血清与实验膜条反应。
如果标本阳性,特异性的IgG(也包括IgA和IgM)与相应抗原结合。
为检测已结合的抗体,加入酶标抗人IgG(酶结合物)进行第二次温育,然后加入酶底物,以产生可观察的颜色反应。
6标本采集及实验标本要求采取静脉血2-3ml,待分离血清后,离心(1500-3000转/分)15分钟,待测。
随机静脉血2ml,分离血清备用。
也可使用EDTA、肝素或柠檬酸盐抗凝血浆。
稳定性:标本宜新鲜,无污染,避免溶血,避免反复冻融,不可用NaN3防腐。
7标本存放:待检患者标本于2-8 C可稳定14天,稀释后的标本应在同一个工作日内检测。
8标本运输:2-8℃密闭运输。
9标本拒收条件:蛋白变性标本,标本中含有颗粒物质,细菌污染,严重溶血或脂血标本不能做测定。
10试剂附:nRNP/Sm:小牛和兔胸腺提取物,经亲和层析纯化的天然U1-nRNP。
Sm:牛脾脏和胸腺提取物,经亲和层析纯化的天然Sm。
SS-A:牛脾脏和胸腺提取物,经亲和层析纯化的天然SS-A。
Ro-52:重组的Ro-52(52kDa),相应的人cDNA用杆状病毒系统在昆虫细胞中表达。
自身免疫性肝炎检测蛋白芯片及其试剂盒[发明专利]
![自身免疫性肝炎检测蛋白芯片及其试剂盒[发明专利]](https://img.taocdn.com/s3/m/60bb525cfd0a79563d1e7265.png)
专利名称:自身免疫性肝炎检测蛋白芯片及其试剂盒专利类型:发明专利
发明人:穆海东,汪宁梅,穆宇豪,刘纲
申请号:CN200810204040.2
申请日:20081204
公开号:CN101750492A
公开日:
20100623
专利内容由知识产权出版社提供
摘要:本发明公开了一种用于自身免疫性肝炎检测的蛋白芯片及其试剂盒,可以同时检测
ANA(dsDNA、RNP、Sm、SS-A/Ro、SS-B/La、Scl-70、Jo-1)、SMA、LKM-1、SLA/LP、F-actin和AMA共12个免疫蛋白标志物。
克服了现有产品检测指标单一,检测指标不全面的缺陷,提供一种检测结果更全面、过程更简洁的检测方法。
申请人:上海裕隆生物科技有限公司
地址:200233 上海市钦州北路1089号50号楼4层
国籍:CN
更多信息请下载全文后查看。
抗核抗体谱检测试剂盒(磁微粒化学发光法)产品技术要求华晟源
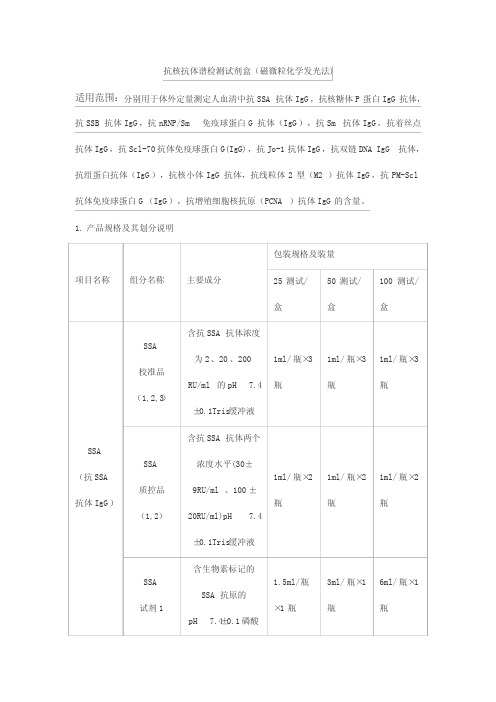
抗核抗体谱检测试剂盒(磁微粒化学发光法)适用范围:分别用于体外定量测定人血清中抗SSA抗体IgG,抗核糖体P蛋白IgG抗体,抗SSB抗体IgG,抗nRNP/Sm免疫球蛋白G抗体(IgG),抗Sm抗体IgG,抗着丝点抗体IgG,抗Scl-70抗体免疫球蛋白G(IgG),抗Jo-1抗体IgG,抗双链DNA IgG抗体,抗组蛋白抗体(IgG),抗核小体IgG抗体,抗线粒体2型(M2)抗体IgG ,抗PM-Scl 抗体免疫球蛋白G(IgG),抗增殖细胞核抗原(PCNA)抗体IgG的含量。
1. 产品规格及其划分说明项目名称 组分名称 主要成分 包装规格及装量25测试/盒50测试/盒100测试/盒SSA (抗SSA抗体IgG)SSA校准品(1,2,3)含抗SSA抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶SSA质控品(1,2)含抗SSA抗体两个浓度水平(30±9RU/ml、100±20RU/ml)pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶SSA试剂1含生物素标记的SSA抗原的pH 7.4±0.1磷酸1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶盐缓冲液SSA 试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶SSA 试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶P0(抗核糖体P蛋白IgG抗体)) P0校准品(1,2,3)含抗核糖体P蛋白抗体浓度为g 、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶P0质控品(1,2)含抗核糖体P蛋白抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶P0试剂1生物素标记的P0抗原的pH 7.4±0.11.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶磷酸盐缓冲液P0试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶P0试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶SSB(抗SSB抗体IgG) SSB校准品(1,2,3)含抗SSB抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶SSB质控品(1,2)含抗SSB抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶SSB试剂1生物素标记的SSB抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶SSB试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶SSB试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶nRNP/Sm (抗nRNP/Sm免疫球蛋白G抗体(IgG)) nRNP/Sm校准品(1,2,3)含抗nRNP/Sm抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶nRNP/Sm质控品(1,2)含抗nRNP/Sm抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶nRNP/Sm试剂1生物素标记的nRNP/Sm抗原的pH 7.4±0.1磷酸1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶盐缓冲液nRNP/Sm 试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶nRNP/Sm 试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Sm(抗Sm 抗体IgG)Sm校准品(1,2,3)含抗Sm抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶Sm质控品(1,2)含抗Sm抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶Sm试剂1生物素标记的Sm抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Sm试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶Sm试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶着丝点(CENP-B)(抗着丝点抗体IgG)着丝点(CENP-B校准品(1,2,3)含抗着丝点(CENP-B)抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶着丝点(CENP-B质控品(1,2)含抗着丝点(CENP-B)抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶着丝点(CENP-B生物素标记的着丝点(CENP-B)抗原的1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶试剂1 pH 7.4±0.1磷酸盐缓冲液着丝点(CENP-B 试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶着丝点(CENP-B 试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Scl-70(抗Scl-70抗体免疫球蛋白G(IgG)) Scl-70校准品(1,2,3)含抗Scl-70抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶Scl-70质控品(1,2)含抗Scl-70抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶Scl-70试剂1生物素标记的Scl-70抗原的1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶pH 7.4±0.1磷酸盐缓冲液Scl-70试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶Scl-70试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Jo-1(抗Jo-1抗体IgG)Jo-1校准品(1,2,3)含抗Jo-1抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶Jo-1质控品(1,2)含抗Jo-1抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶Jo-1试剂1生物素标记的Jo-1抗原的pH 7.4±1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶0.1磷酸盐缓冲液Jo-1试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶Jo-1试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶dsDNA (抗双链DNA IgG 抗体 dsDNA校准品(1,2,3)含抗dsDNA抗体浓度为10、100、800 IU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶dsDNA质控品(1,2)含抗dsDNA抗体两个浓度水平(300±30IU/ml、600±60IU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶dsDNA试剂1生物素标记的dsDNA抗原的1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶pH 7.4±0.1磷酸盐缓冲液dsDNA试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶dsDNA试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶组蛋白(His)(抗组蛋白抗体(IgG)组蛋白(His)校准品(1,2,3)含抗组蛋白(His)抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶组蛋白(His)质控品(1,2)含抗组蛋白(His)抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶 组蛋白生物素标记的组蛋 1.5ml/瓶3ml/瓶×16ml/瓶×1(His)试剂1白(His)抗原的pH 7.4±0.1磷酸盐缓冲液×1瓶 瓶 瓶组蛋白(His)试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶组蛋白(His)试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶核小体(Nuc)(抗核小体IgG抗体)核小体(Nuc)校准品(1,2,3)含抗核小体(Nuc)抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶核小体(Nuc)质控品(1,2)含抗核小体(Nuc)dsDNA抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶缓冲液核小体(Nuc)试剂1 生物素标记的核小体(Nuc)抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶核小体(Nuc)试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶核小体(Nuc)试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶线粒体2型(M2)(抗线粒体2型(M2)抗体IgG) 线粒体2型(M2)校准品(1,2,3)含抗线粒体2型(M2)抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶线粒体2型(M2)质控品(1,2)含抗线粒体2型(M2)抗体两个浓度水平(30±9RU/ml、100±1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶pH 7.4±0.1Tris缓冲液线粒体2型(M2)试剂1 生物素标记的线粒体2型(M2)抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶线粒体2型(M2)试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶线粒体2型(M2)试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PM-Scl(抗PM-Scl抗体免疫球蛋白G (IgG)) PM-Scl校准品(1,2,3)含抗PM-Scl抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶PM-Scl质控品(1,2)含抗PM-Scl抗体两个浓度水平(30±9RU/ml、100±1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶pH 7.4±0.1Tris缓冲液PM-Scl试剂1生物素标记的PM-Scl抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PM-Scl试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶PM-Scl试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PCNA(抗增殖细胞核抗原(PCNA)抗体IgG)PCNA校准品(1,2,3)含抗PCNA抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶PCNA质控品(1,2)含抗PCNA抗体两个浓度水平(30±9RU/ml、100±1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶pH 7.4±0.1Tris缓冲液PCNA试剂1生物素标记的PCNA抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PCNA试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶PCNA试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶2. 性能指标2.1外观试剂盒各组分应齐全、完整、液体无渗漏;磁分离试剂摇匀后为均匀悬浊液,无明显凝集;液体组分应澄清,无沉淀或絮状物;包装标签应清晰,易识别。
自身抗体全自动免疫分析仪参数要求

自身抗体全自动免疫分析仪参数要求
2、检测速度:Z1.OOO测试/小时,仪器可实现模块化连接,对同一个标本单次定量检测(一次检测)可以得到多种指标的检测结果。
3、试剂位:,60个项目,在工作中能连续加载样本、试剂和消耗品;试剂系统具备试剂冷藏装置(2—8。
C),试剂可在机冷藏存储,试剂不足报警且可在线添加。
4、样本位:,120个,原始管上机并随时加载。
5、急诊功能:具备急诊功能,急诊样本随时插入,优先处理。
6、操作系统:具备中文操作系统。
7、通讯功能:与1.IS、H1.S系统双向通讯。
8、设备要求:24小时待机,设备对仪器状态、测试状态、试剂耗材可进行实时监测;具有实时故障报警反馈日志记录报警日志功能。
9、检测结果要求:可溯源,并能提供相关资料。
10、售后服务要求:由厂商及代理商提供双重售后服务及技术支授,每月定期保养仪器一次,仪器故障在24小时内处理。
11、设备终身质保。
自身免疫性肝病—相关抗体谱

抗肝细胞胞浆抗原1型抗体 (抗LC1抗体)
检测方法:IIF、免疫印迹法等 临床意义:为Ⅱ型AIH的血清特异性抗体(56-72%), 常与抗LKM-1抗体同时存在(73%),与疾病活动性 具有相关性。
原发性胆汁性肝硬化(PBC)
临床前期
• 6年发展 为PBC
亚临床期
• 无症状,但又 肝功能异常。 患者5年内5% 出现症状,20 年内95%出现 症状。中位生 存期15年。来自ALD临床诊断存在的困难
ALD患者发病隐匿 重叠综合征大量存在 “金标准”组织病理的局限性 缺乏诊断特异性自身抗体 对疾病的认识有限
原发性硬化性胆管炎(PSC)
PSC病因不明的慢性综合 征
特征:是肝外和/或肝内胆 管弥漫性炎症、纤维化所 引起的慢性胆汁淤积症。
诊 断
壹贰叁
影
ANA
像 学 诊
pANCA 80%
谢 谢 大 家
C
抗SP100抗体
B
抗GP210抗体
D
抗板层素抗体
抗线粒体抗体(AMA)阳性
线粒体(AMA)是PBC最常用的抗体,敏感性>90%,与PBC相关的亚型有M2、M4、 M8、M9。ANA滴度与PBC疾病分期无关。但经研究发现AMA并不特异, SS,SLE,HCV10-20%M2阳性。PBC中的AMA不同于HCV和急性肝损伤。
抗Sp100抗体
PBC特异性抗体,阳性率为10-30%。 对AMA阴性的PBC患者的诊断具有重要意义。
抗gp210抗体
PBC特异性88%,敏感性为25% 约1/4与AMA同时出现,也存在于20-47%AMA阴性PBC中 可作为PBC患者预后指标,抗体阳性提示预后不良
建 议:
检测方法:筛选——IIF 确认——ELISA、免疫印迹法
自身免疫性肝病(AILD)相关抗体谱质控品产品技术要求博粹医学

自身免疫性肝病(AILD)相关抗体谱质控品2.性能指标2.1外观产品各型号组成应齐全;产品外包装应完整,无破损;质控品为澄清黄色或淡黄色,无颗粒沉淀或絮状不溶性杂质;说明书和质量检查报告字迹清晰完整;标签等打码印字应正确、清晰、牢固。
2.2装量1)规格100μL /支的产品,装量要求不低于110μL /支;2)规格500μL /支的产品,装量要求不低于530μL /支。
2.3溯源赋值程序2.3.1溯源赋值依据1)抗线粒体M2 抗体质控品((Q C151-1L,Q C151-5L,QC151-1M,QC151-5M):选用德国A ES K U 公司的A ES KΜL IS A®线粒体IgG抗体检测试剂盒(酶联免疫法)(注册证号:国械注进20152401558)中的标准品作为浓度判断依据。
2)抗线粒体抗体质控品(QC152-1L,QC152-5L):中国医师协会室间质评抗线粒体抗体质控品的荧光模式作为判定依据。
3)抗平滑肌抗体质控品(QC153-1L,QC153-5L):选用通过WH O认证的“抗平滑肌抗体W1062”国际标准品作为溯源赋值依据。
2.3.2溯源赋值方法提供溯源赋值的程序性文件和至少一个批次溯源赋值过程的记录。
(详见附录A)2.3.3赋值准确度2.3.3.1QC15-A 赋值准确度2.3.3.2QC15-B 赋值准确度12.3.3.3QC15-C 赋值准确度2.3.3.4单支包装规格赋值准确度单支包装规格赋值准确度见“2.3.3.1 QC15-A 赋值准确度”。
2.4均一性2.4.1瓶间均一性同批号质控品进行瓶间均一性检测,瓶间均一性CV%≤10%。
2.4.2瓶内均一性同批号质控品进行瓶内均一性检测,瓶内均一性CV%≤10%。
2.5生物安全性产品的HBsAg、HIV(1+2)抗体、HCV 抗体、TP 抗体检测结果应为阴性。
2。
间接免疫荧光法检测抗核抗体与免疫印迹法检测抗核抗体谱结果不一致的临床意义分析

间接免疫荧光法检测抗核抗体与免疫印迹法检测抗核抗体谱结果不一致的临床意义分析莫伟平;张泳仪【摘要】目的:探讨间接免疫荧光法(IIF)检测抗核抗体(ANA)与线性免疫迹法(LIA)检测抗核抗体谱(ANAs)结果不一致的临床意义分析。
方法对6121例标本同时用IIF法检测ANA,LIA法检测ANAs,比较其二者的不符合率。
结果IIF-ANA-/LIA-ANAs+的有1107例,不一致率为22.5%。
IIF-ANA+/LIA-ANAs-的有124例,不一致率为10.3%,在1107份IIF-ANA-/LIA-ANAs+标本中,阳性率最高的前5种自身抗体是SSA/Ro60kd、SSA/Ro52kd、抗SmD1、抗SSB 抗体、抗histones,阳性率为分别为29.62%、18.32%、10.20%、9.58%、8.61%。
结论在自身免疫性疾病(AID)临床诊断中,应联合进行IIF筛查ANA和LIA检测特异性ANAs,避免单一方法检测导致AID患者的漏诊。
【期刊名称】《中国医药指南》【年(卷),期】2016(014)019【总页数】2页(P39-39,40)【关键词】间接免疫荧光法;抗核抗体;线性免疫迹法;抗核抗体谱;自身免疫性疾病【作者】莫伟平;张泳仪【作者单位】广东东莞市人民医院检验科,广东东莞523000;广东东莞市人民医院检验科,广东东莞523000【正文语种】中文【中图分类】R446.6ANA和ANAs的检测目前已广泛用于自身免疫性疾病(AID)的诊断与疗效观察。
IIF用于总的ANA筛查试验,它不仅可以检测出血清中是否存在ANA,还可获知自身抗体所呈现的荧光模型。
但要进一步明确自身抗体的靶抗原就必须做ANAs检测,LIA可能是目前对ANAs检测最可靠的实验室研究方法[1]。
但在实际工作中,我们发现IIF检测ANA与LIA检测ANAs结果不一致。
笔者对2014年6121例临床就诊患者血清标本同时采用IIF检测ANA,用LIA检测17种特异性自身抗体,比较2种检测方法结果不一致的情况,并探讨ANA与ANAs检测结果之间的相关性及临床意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
自身免疫肝病抗体谱检测试剂盒(条带免疫印迹法)
适用范围:用于体外定性检测人血清中抗AMA M2、LKM1、LC1、SLA、F-Actin、gp210、sp100、SSB、SSA/52kd和CENP B的IgG抗体。
1.1. 包装规格
20人份/盒
1.2. 型号
型号为ALD-10-A;ALD-9-A;ALD-8B-A;ALD-8F-A;ALD-8C-A;ALD-7-A;ALD-6-A;ALD-4-A
其中,各型号检测项目如下:
表1 各型号检测项目
1.3 主要组成成分:
表2 主要组成成分
抗原膜条包被抗原型号说明见表3(不同产品型号包被不同抗原组合)
表3抗原膜条包被抗原型号说明
2.1.外观
2.1.1.试剂盒外部包装盒应整洁,各组分应齐全完整,文字符号标识清晰,所有试剂瓶密闭,无漏液。
2.1.2.样本缓冲液为无色或淡黄色澄清液体;浓缩洗液(10×)为无色澄清液体;酶结合物(10×)为无色或淡黄色澄清液体;底物液为淡黄色澄清液体。
2.2.净含量
液体试剂装量不小于标示值。
2.3.膜条宽度
膜条宽度不低于1.8mm。
2.4.临界值及重复性
自身免疫肝病抗体谱企业参考品各检测项目临界值浓度均为15U/ml。
阳性参考品各检测项目抗体浓度均为20U/ml,检测10次,结果的阳性率为100%,反应结果一致;阴性参考品各检测项目抗体浓度均为10U/ml,检测10次,结果的阴性率为100%,反应结果一致。
2.5.批间差
抽取三个批次的试剂盒,每个批次按临界值及重复性的检验方法检测,各浓度反应结果应一致,应符合临界值及重复性的要求。
2.6.稳定性
2℃~8℃保存,有效期18个月,取到效期1个月内试剂盒进行检测,应符合2.4的要求。
